Conferencias clínico-patológicas: la importancia del diagnóstico multidisciplinar
Más datosUn paciente de 66 años y natural de España, no presentaba alergias medicamentosas ni hábitos tóxicos. Entre sus antecedentes patológicos refería hipertensión arterial, insuficiencia renal crónica secundaria a una nefrectomía derecha por neoplasia renal, trastorno depresivo mayor y glaucoma. Diagnosticado de síndrome mielodisplásico con exceso de blastos tipo 2 y mala respuesta a la quimioterapia, se le practicó un alotrasplante de progenitores hematopoyéticos (alo-TPH) selección CD34+, 6 meses antes del episodio que nos ocupa, con escasa reconstitución inmune, habiendo desarrollado tras el trasplante múltiples infecciones oportunistas en forma de replicación de citomegalovirus (CMV) y toxoplasma sin afectación orgánica, y candidiasis oral. Recientemente había presentado infección respiratoria por Rhinovirus y Parainfluenza en que se objetivó un episodio de bradipsiquia y lateralización de la marcha, estudiados mediante análisis del líquido cefalorraquídeo y una resonancia magnética, ambos sin alteraciones, y que se autolimitó en el tiempo.
Su medicación habitual consistía en prednisona 5 mg/24 h, valganciclovir 1 g/12 h, cotrimoxazol 160 mg/800 mg los días lunes, miércoles y viernes, ranitidina 150 mg/12 h, tiamina 100 mg/24 h y alprazolam 0,5 mg a demanda.
La enfermedad actual se había iniciado unas horas antes en forma de febrícula 37,8 °C y malestar general, sin otra sintomatología asociada. Constaba con una replicación del virus Ebstein-Barr (VEB) y virus herpes humano 6 (VHH-6) en la analítica sanguínea realizada 4 días antes del inicio de la clínica.
En la exploración física, el paciente presentaba un estado general conservado con una temperatura axilar de 37,7 °C e ictericia. Se encontraba consciente y orientado, pero bradipsíquico y con dificultad para la coordinación de los movimientos finos. Hemodinámicamente estable y eupneico con saturaciones del 96% en aire ambiente. La auscultación cardíaca y pulmonar fue normal, sin edemas en extremidades inferiores. No se palpaban adenopatías ni organomegalias.
Durante las 24 h siguientes el paciente presentó una rápida evolución a insuficiencia respiratoria, por lo que ingresó en la Unidad de Cuidados Intensivos (UCI); sin aparente afectación radiológica.
En la analítica sanguínea destacaba pancitopenia con hemoglobina 7,7 g/dl (VCM 102,9 fl HCM 36,7 pg, reticulocitos 33,8 x109/L), leucocitos 0,26 x10E9/L (neutrófilos 0,0 x10E9/L, linfocitos 0,1 x10E9/L, monocitos 0,0 x10E9/L, eosinófilos 0,0 x10E9/L, basófilos 0,0 x10E9/L) y plaquetas 19 x10E9/L, coagulopatía con tiempo de protrombina 66%, TTPAr 1,10 y fibrinógeno 5,8 g/L, hiperbilirrubinemia 1,57 mg/dl (esterificada 0,49 mg/dl) con elevación de enzimas hepáticas AST 28 UI/L, ALT 104 UI/L, FA 152 UI/L y GGT 192 UI/L, alteración de la función renal con creatinina 1,07 mg/dl y urea 86 mg/dl similar a su basal y elevación de PCR 14,57 mg/dl, sin alteraciones iónicas.
Las antigenurias en la orina para Streptococcus pneumoniae y de Legionella pneumophila resultaron negativas.
Los cultivos en el lavado broncoalveolar fueron positivos para escasas colonias de flora polimicrobiana aerobia, Enterococcus faecium y Candida lusitaniae y negativos para Nocardia spp, Pneumocystis jirovecii,(Pseudechiniscus jirovecii) tuberculosis u hongos filamentosos. La determinación de galactomanano y la detección molecular mediante la polymerase chain reaction (PCR) de CMV, virus herpes simple 1 y 2 (VHS-1 y 2) y P. jirovecii fueron negativas. Resultaron positivas las PCR para Rhinovirus y virus Parainfluenza. La citología del lavado broncoalveolar fue compatible con un proceso inflamatorio de predominio linfocitario (macrófagos 71%, linfocitos 20%, PMN 9% y eosinófilos 0%) y negativo para células malignas.
Los hemocultivos, 6 en total, fueron todos negativos. La PCR en la sangre para adenovirus, VEB, toxoplasma, virus BK, VHS-1 y 2 y VHH-6 fueron negativas. Presentó replicación de CMV a los 10 días de inicio de la clínica, con una carga vírica máxima de 3.454 UI/ml. La determinación de galactomanano en la sangre fue también negativa (0,021).
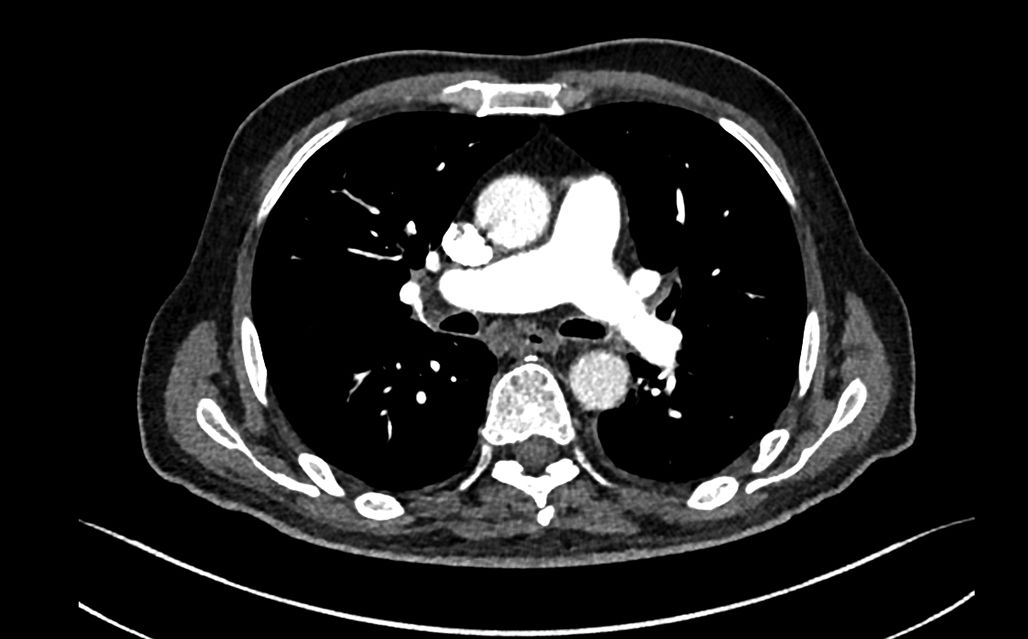
Una angio-TC torácica al ingreso mostraba signos de sobreinfección respiratoria con opacidades nodulillares en el vidrio deslustrado de predominio bibasal pero con afectación de todos los lóbulos y zonas de consolidación bibasales, sin signos de embolismo pulmonar (fig. 1).
La ecografía abdominal mostraba una esplenomegalia homogénea de 13 cm, esteatosis y barro biliar sin signos de colecistitis, con aparición de gas portal intrahepático en segmentos II y IV a, aunque la tomografía computarizada abdominal no mostraba evidencia de claros focos sépticos a nivel intraabdominal.
El ingreso en UCI se caracterizó por insuficiencia respiratoria grave que requirió intubación orotraqueal y alteración hepática en forma de colestasis. A los 15 días de evolución del cuadro presentó un nuevo episodio febril de 38,9 °C seguido de inestabilidad hemodinámica con requerimientos crecientes de noradrenalina hasta dosis de 1,4 μg/kg/min en los siguientes días, con fracaso renal agudo y fallo hepático, con exploración clínica sugestiva de afectación del SNC por trazado plano en sistema de monitorización basado en el índice biespectral (BIS) y pupilas arreactivas, que no se pudo corroborar mediante las técnicas de imagen por la imposibilidad de trasladar al paciente dada la situación clínica. Tras ello, presentó una rápida progresión del fracaso multiorgánico (FMO), siendo el paciente finalmente éxitus a los 18 días de su ingreso en la UCI.
Diagnóstico diferencialSe trata de un varón de 66 años inmunodeprimido por un alo-TPH hace 6 meses por síndome mielodisplásico, con reconstitución inmune baja que presenta fiebre en el contexto de una neutropenia, con afectación inicialmente respiratoria y hepática, a la que se sobreañade posteriormente una inestabilidad hemodinámica con FMO y probable afectación de SNC.
El diagnóstico diferencial se orienta principalmente a las causas infecciosas, muy frecuentes en este tipo de pacientes debido a la inmunodepresión que presentan, y en aquellas enfermedades directamente relacionadas con el trasplante alogénico y medidas por mecanismos celulares como son la enfermedad de injerto contra el huésped (EICH) aguda y crónica1.
En relación a la infección bacteriana, en el periodo de postrasplante tardío (> 100 días del trasplante) los patógenos más frecuentes son las bacterias encapsuladas, como S. pneumoniae y Haemophilus influenzae, ambos causantes de neumonía1. En este caso, los cultivos repetidamente negativos y la ausencia de respuesta al tratamiento antibiótico hacen poco probable esta etiología.
En cuanto a las infecciones víricas, las más frecuentes en este periodo son la infección por CMV y virus varicela zóster (VVZ), aunque también se puede encontrar replicación de VEB, VHS-1 y 2, adenovirus y VVH-6, entre otros. La infección por CMV se da hasta en un 70-80% de los receptores de alo-TPH1 y el riesgo de enfermedad por CMV, que es aquella infección que condiciona la afectación orgánica, es mayor en aquellos pacientes seropositivos con donante seronegativo, pues generalmente se trata de reactivaciones de un virus latente. En el alo-TPH también son factores de alto riesgo la depleción de células T de la fuente de progenitores, los trasplantes de donante no emparentado, los de antígeno de histocompatibilidad2 no idéntico y aquellos con selección CD34+3; el tipo de inmunodepresión, el EICH y el uso o no de profilaxis farmacológica son otros factores que pueden favorecer la replicación de CMV, que a su vez favorece la sobreinfección por otros microorganismos1.
La repercusión clínica de una primoinfección o una reactivación de una infección latente pueden ir desde una infección asintomática hasta una afectación multiorgánica grave; así, la clínica más frecuente de la enfermedad por CMV es la afectación gastrointestinal y respiratoria en forma de neumonitis intersticial, pero también puede cursar en forma de síndrome mononucleósico y menos frecuentemente puede dar afectación en forma de retinitis, encefalitis, hepatitis o miocarditis4. En el presente caso, el paciente presentó replicación de CMV en la sangre de forma tardía, y la PCR en el lavado broncoalveolar fue negativa de forma repetida, criterio imprescindible para considerar que la clínica respiratoria se justificase en el contexto de una neumonitis por CMV.
La infección por VVZ, que se da habitualmente en el contexto de reactivación, afecta al 40% de los pacientes que han recibido alo-TPH si no se administra profilaxis, siendo el EICH el factor de riesgo más importante y presenta una alta mortalidad si no se realiza el tratamiento cuando hay afectación orgánica. Clínicamente la manifestación más frecuente es la cutánea, pese a que en los pacientes trasplantados puede producir afectación visceral sin presentar afectación cutánea; en el caso que haya afectación sistémica puede producir una afectación respiratoria en forma de neumonía hemorrágica, hepatitis, encefalitis y necrosis retiniana2. En este caso no se llegó a realizar la PCR en la sangre de VVZ, pero se realizaron múltiples FBS que no eran compatibles con una neumonía hemorrágica. La replicación de VEB también se da frecuentemente tras el alo-TPH, pero suele cursar de forma subclínica o manifestarse en forma de una enfermedad proliferativa postrasplante con febrícula y adenopatías1. En el caso de una primoinfección se asocia al síndrome mononucleósico, pero en nuestro caso sabemos que el paciente era seropositivo previo al trasplante, por lo que difícilmente podría ser el agente etiológico del cuadro actual, además de que la PCR en la sangre fue negativa en todo momento. Lo que sí que cabe destacar es que la replicación de VEB es la causa más frecuente de síndrome hemofagocítico (SHF) o linfohistiocitosis hemofagocítica, que cursa clínicamente con fiebre, citopenias y hepatoesplenomegalia, pudiendo producir también alteración en la función hepática, coagulopatía e inestabilidad hemodinámica, o incluso un fracaso multiorgánico. El diagnóstico del SHF se realiza por criterios clínicos cumpliendo 5 de los 8 descritos (tabla 1) y puede estar producido por múltiples causas, de entre ellas más frecuentemente por enfermedades infecciosas y, de éstas, las causadas por virus5 son mayoritarias, aunque va en aumento el número de casos causados por infecciones más infrecuentes como la toxoplasmosis6.
Criterios diagnósticos para síndrome hemofagocítico
|
|
La infección por adenovirus se produce en aproximadamente un 10% de los pacientes que reciben un alo-TPH y presenta una elevada mortalidad. La clínica más típica es en forma de cistitis hemorrágica, pero el 20% de estos pacientes presenta una enfermedad diseminada que puede cursar en forma de neumonitis, hepatitis, enteritis y afectación renal2. En nuestro caso la PCR en la sangre fue negativa. La reinfección por VHS-1 y 2 es también muy frecuente en los pacientes que reciben un TPH, dándose generalmente en las fases más tempranas del post-TPH y sobretodo en ausencia de una profilaxis, aunque pueden aparecer más tarde en los períodos de inmunodepresión intensa. Clínicamente cursan típicamente en forma de gingivoestomatitis y esofagitis, y en raras ocasiones pueden dar neumonitis y encefalitis4. En nuestro caso la PCR para VHS-1 y 2 fue negativa tanto en la sangre como en lavado broncoalveolar.
El VHH-6 es otro de los herpesvirus que puede producir una enfermedad en los pacientes que han recibido alo-TPH; tiene un elevado neurotropismo, habiéndose llegado a considerar que pueda ser la causa más frecuente de meningoencefalitis en el alo-TPH. Puede manifestarse también con exantema, neumonitis o complicaciones en forma de retraso o supresión del injerto medular, entre otros, aunque la forma más frecuente es la reactivación asintomática, que puede darse hasta en un 40% de los pacientes trasplantados, típicamente durante el primer mes1. Por último, las infecciones por virus respiratorios como el VRS, el parainfluenza e influenza son frecuentes en el postrasplante y se asocian a neumonías con una elevada mortalidad, pero no producen afectación de otros órganos1. En el presente caso, pese a que la PCR fue positiva en la muestra respiratoria, dado que el paciente ya había padecido un proceso respiratorio que se resolvió hacía 3 semanas y que fue atribuido a una infección por estos virus, su hallazgo en el momento actual evidenciaba más que se tratase de una PCR residual positiva tras un proceso ya resuelto que nuevamente la causa de una infección aguda.
Las infecciones fúngicas se han evidenciado hasta en el 25% de los estudios con la autopsia de los pacientes a los que se les ha practicado alo-TPH1, y son causadas más frecuentes por Aspergillus spp., Candida spp. y P. jiroveci.
La infección por Aspergillus spp. presenta una elevada mortalidad en su forma invasiva, con una afectación típicamente a nivel pulmonar, pudiendo diseminar a SNC u otros órganos. La clínica inicial suele ser fiebre que no responde a antibióticos, con tos y ocasionalmente expectoración hemoptoica, e imagen radiológica típica por TC es el «signo del halo» o el «signo de la semiluna» en las formas más avanzadas. El diagnóstico definitivo se realiza mediante una biopsia, pero la determinación positiva de galactomanano en la sangre con cultivos de muestras respiratorias positivos en los pacientes con elevada probabilidad clínica es altamente sugestiva de una enfermedad invasiva4. En nuestro caso tanto las determinaciones de galactomanano en la sangre como en BAL fueron negativas, así como los cultivos micológicos. Además, ni la imagen radiológica ni la visualización directa de la mucosa bronquial durante las FBS fue sugestiva de una infección fúngica.
La infección por P. jirovecii produce típicamente una afectación a nivel pulmonar en forma de neumonía bilateral, pero es infrecuente en estos pacientes debido al uso de una profilaxis sistemática4. La infección por Candida spp. puede manifestarse en forma de candidiasis hepatoesplénica, con clínica de fiebre y nódulos en el hígado y el bazo, y en forma de candidiasis aguda diseminada, en la que se pueden observar microabscesos en múltiples órganos (hepáticos, cerebrales, renales, esplénicos y pulmonares) secundarios a una siembra hematológica y que es típica de los pacientes graves con ingresos prolongados y nutrición parenteral; en este segundo escenario la clínica puede variar desde fiebre al fracaso multiorgánico7. En nuestro caso las pruebas de imagen realizadas descartaron la presencia de abscesos y los hemocultivos fueron negativos.
En cuanto a las infecciones por parásitos, cabe destacar la leishmaniasis visceral y la toxoplasmosis. La toxoplasmosis es endémica en gran parte de Europa; es poco frecuente como agente patológico en el postrasplante (0,1-6%) y generalmente en el contexto de reactivación, pero en casos de infección se asocia a una elevada mortalidad de hasta el 60-90%6. La manifestación inicial suele ser fiebre alta, y la afectación orgánica más frecuente es la encefalitis, aunque también puede producir de forma habitual una neumonitis rápidamente progresiva8, además de una hepatitis, miocarditis y retinocoroiditis, así como manifestaciones típicas del síndrome mononucleósico9. Se trata, pese a todo, de una enfermedad altamente infradiagnosticada, pues alrededor de la mitad de los casos referenciados en la bibliografía médica se diagnostican en la autopsia10. En este caso el paciente se encontraba en tratamiento profiláctico con cotrimoxazol y la PCR en la sangre fue negativa en 3 ocasiones.
La leishmaniasis visceral o kala-azar es una entidad poco frecuente en nuestro medio que cursa con fiebre vespertina, gran hepatoesplenomegalia, adenopatías, citopenias e hipergammaglobulinemia, sin presentar típicamente afectación de otros órganos11.
Aunque menos sugestivas del cuadro que nos ocupa, otros procesos a descartar son las producidas por la respuesta celular contra el huésped, conocida como enfermedad de injerto contra huésped. Existen 2 formas: la aguda, que a su vez aumenta la inmunodepresión y por lo tanto la probabilidad de infecciones, siendo uno de los factores de riesgo más importantes para desarrollar cualquiera de las infecciones previamente revisadas; y la crónica. La forma aguda se manifiesta típicamente con la tríada de exantema, diarrea e hiperbilirrubinemia, pero suele darse dentro de los primeros 100 días tras el trasplante. La forma crónica es una enfermedad multisistémica que puede repercutir en cualquier órgano. Los órganos más frecuentemente afectados son la piel y la mucosa oral, aunque también puede afectar al hígado, los ojos, el intestino y el pulmón, la mayoría de ocasiones en forma de bronquiolitis obliterante12.
Diagnóstico del Dr. Marcos Pérez CarrascoAsí pues, teniendo en consideración todo lo anteriormente revisado, por las manifestaciones clínicas y la epidemiología del paciente con el antecedente de trasplante de progenitores hematopoyéticos y ante los resultados de las diferentes exploraciones complementarias, la sospecha es que el paciente se encuentre afecto de una infección vírica oportunista, pese a que no se disponga de los resultados confirmatorios. La inestabilidad hemodinámica y el FMO desarrollados tras 2 semanas de ingreso en la UCI podrían no ser causa directa del mismo agente etiológico responsable de la clínica que motivó el ingreso, sino secundaria a un shock séptico por un proceso infeccioso sobreañadido en el contexto de un ingreso prolongado. También podría deberse, como ya hemos nombrado anteriormente, a un SHF desencadenado por la infección inicial; con los datos disponibles no se cumplirían suficientes criterios diagnósticos (se cumplen 4 de 8: fiebre, esplenomegalia, citopenias e hipertrigliceridemia), pero también es cierto que dado que no se planteó como diagnóstico diferencial no se solicitaron ciertas pruebas o determinaciones que sí que podrían haber ayudado a esclarecer el diagnóstico.
Discusión anatomopatológica. Dra. Irene SansanoAl realizar la autopsia, se observaron múltiples nódulos calcificados en la tiroides, derrame pleural izquierdo, pulmones hiperémicos y aumentados de consistencia (D: 1.028 g; N: 360-570 g; I: 985 g; N: 325-480 g), cardiomegalia (370,5 g; N: 250-295 g) a expensas de una hipertrofia del ventrículo izquierdo (2 cm; N < 1,5 cm), una ateroesclerosis importante con calcificaciones de predominio en la aorta descendente, ascitis serosa, hepatomegalia (1.800 g; N: 1.300-1.700 g), cicatrices y quistes renales.
En el sistema nervioso central, se observó un encéfalo edematoso (1.615 g), con circunvoluciones ensanchadas y aplanadas. Las leptomeninges eran lisas y opacas en las regiones frontales y occipitales, con ocasionales lesiones blanquecinas puntiformes. En los cortes coronales seriados, la delimitación cortico-subcortical estaba preservada, con disminución de la consistencia en las áreas mal delimitadas.
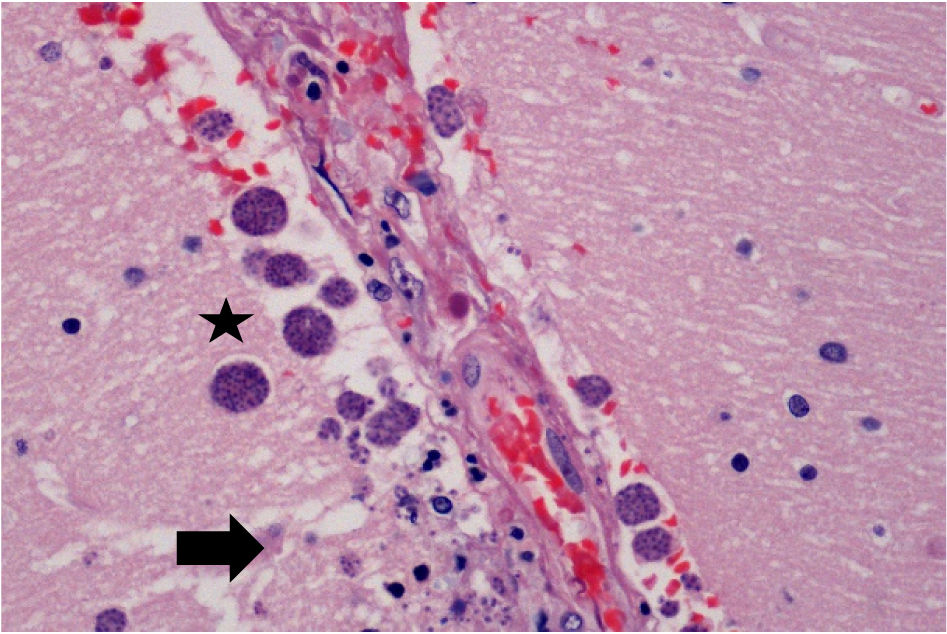
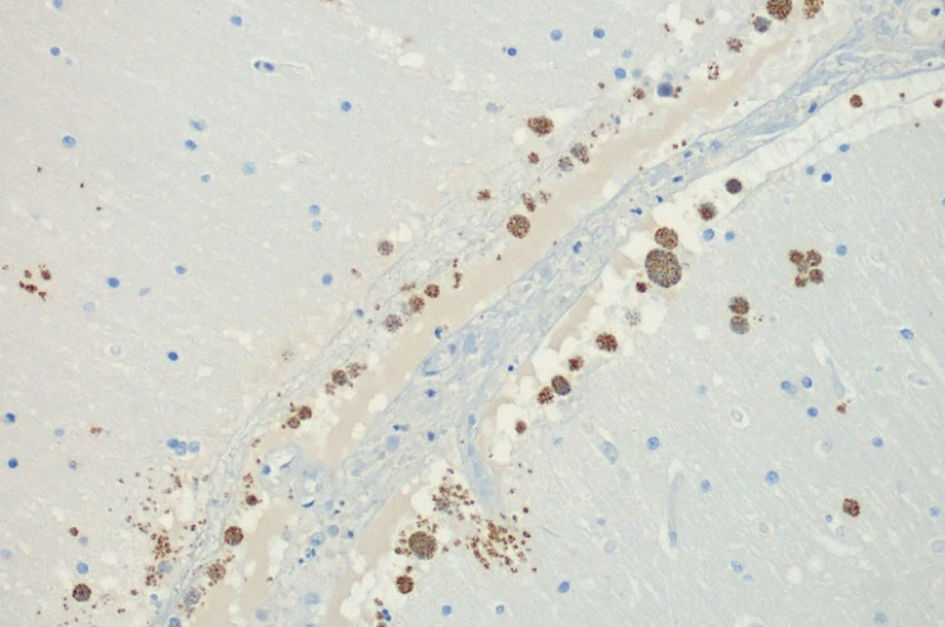
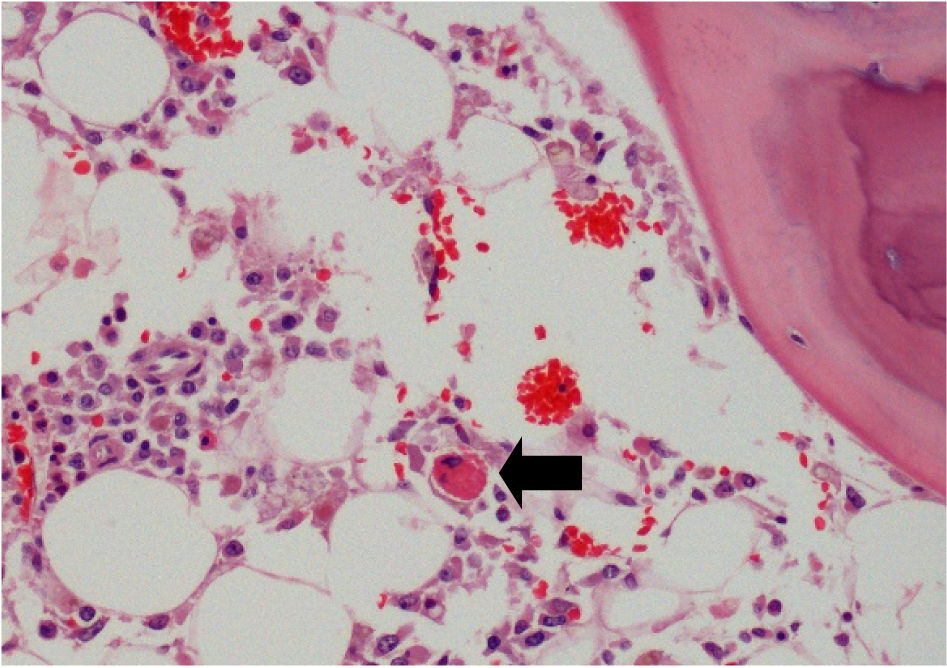
Estudio histológicoEn el examen microscópico se evidenció una congestión vascular generalizada siendo los órganos más alterados los pulmones, que mostraban además neumonía necrosante bilateral (fig. 2). En éstos y también en los riñones, el hígado y la tiroides se identificaron muy ocasionales quistes ovalados con abundantes estructuras basófilas redondeadas o semilunares en su interior, que también se identificaron de forma libre, asociados o no a focos de necrosis (fig. 3). Estas estructuras eran muy numerosas en el sistema nervioso central (fig. 4) y mostraban positividad para PAS, plata, Giemsa y un anticuerpo frente a protozoos (anticuerpo policlonal que se obtuvo mediante la inmunización de conejos a partir de un antígeno de Leishmania infantum, zimodeme MON-1), cuya especificidad es baja y puede mostrar una expresión positiva en otros protozoos intracelulares como el toxoplasma (fig. 5). Con estos hallazgos el diagnóstico de sospecha fue toxoplasmosis diseminada que se confirmó mediante la PCR. Además, se identificaron imágenes de hemofagocitosis en la médula ósea y un hemangioma esplénico infracentimétrico.
La toxoplasmosis puede tener una presentación morfológica variable describiéndose focos de necrosis como el hallazgo histopatológico más consistente en todos los órganos13,14. El diagnóstico se basa en la identificación del toxoplasma como estructuras basófilas alargadas o semilunares, más pequeñas que un hematíe y que pueden encontrarse en forma de taquizoitos sueltos o de quistes intracelulares rellenos de bradizoitos15. Cuando se encuentran en un bajo número su identificación puede ser muy difícil por lo que una tinción inmunohistoquímica puede resultar de ayuda13. Acostumbran a ser más numerosos en el cerebro ya que es el sitio más común de enquistamiento del parásito15. El diagnóstico diferencial morfológico cabe hacerlo con otros microrganismos intracelulares como histoplasma, las inclusiones intracitoplasmáticas del citomegalovirus y amastigotes de Leishmania o tripanosoma. La plata metanamina es positiva en los 2 primeros y permite apreciar la gemación del histoplasma, el citomegalovirus mostraría además inclusiones intranucleares. Los amastigotes, por su parte tienen un kinetoplasto, aunque éste es difícil de ver en los cortes histológicos por lo que la sospecha morfológica debería confirmarse mediante un anticuerpo IHC específico16 u otra técnica como la PCR.
Diagnóstico finalSíndrome hemofagocítico por toxoplasmosis.
Responsabilidades éticasSe obtuvo el consentimiento informado del paciente para la publicación del artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.