El proyecto ATLANTIS es un estudio observacional, longitudinal y ambispectivo que intenta responder los interrogantes de la historia natural del síndrome de apneas-hipopneas durante el sueño (SAHS) a través de su evolución en una población clínica infantil. Para ello se incluyó en el estudio a los niños entre 0 y 14 años remitidos a la Unidad Multidisciplinar de Sueño de Burgos por sospecha clínica de SAHS (presencia de ronquido o pausas respiratorias) desde el año 2000 al 2010. El estudio se realiza en 2fases: fase i: se analiza a todos los niños remitidos por sospecha clínica de SAHS a los que se realizó historia clínica y de sueño, exploración física y otorrinolaringológica y estudio de sueño (polisomnografía o poligrafía), identificándose 2grupos: SAHS y no SAHS, que a su vez se diferencian en 2subgrupos: tratamiento quirúrgico y no quirúrgico; en la fase ii: se realizarán prospectivamente la historia clínica y de sueño, la exploración física y otorrinolaringológica y el estudio de sueño a una muestra aleatoria de cada uno de los grupos obtenidos de la fase i. Los objetivos del estudio son: 1) describir y comparar las características clínicas y polisomnográficas de la población infantil con y sin SAHS e identificar las variables predictivas de SAHS infantil; 2) frecuencia del SAHS residual y sus factores predictores; 3) incidencia de SAHS en la población infantil y sus factores de riesgo; 4) frecuencia de remisión de SAHS y sus factores pronósticos, y 5) frecuencia de recidiva de SAHS y sus factores de riesgo.
The ATLANTIS project is an observational, longitudinal and ambispective study that seeks to answer questions about the natural history of obstructive sleep apnoea syndrome (OSAS) over its course in a clinical child population. To this end, children between 0 and 14 referred to Burgoś Multidisciplinary Sleep Unit due to clinical suspicion of OSAS (presence of snoring and / or respiratory pauses) from 2000 to 2010 were included in the study. The study is carried out in 2phases, Phase I: All children referred with clinical suspicion of OSAS who underwent a clinical and sleep history, physical and otorhinolaryngological examination and sleep study (polysomnography or Respiratory Polygraphy) were analysed, identifying 2groups: OSAS and NO OSAS in turn<these are differentiated into 2subgroups: Surgical and Non-surgical treatment. In PHASE II: Prospective clinical and sleep history, physical and otorhinolaryngological examination and sleep study will be conducted prospectively to a random sample of each of the groups obtained from phase I. The objectives of the study are: 1) To describe and compare the clinical and polysomnographic characteristics of the child population with and without OSAS and identify the predictive variables of childhood OSAS; 2) Frequency of residual OSAS and its predictive factors; 3) Incidence of OSAS in children and their risk factors; 4) Frequency of remission of OSAS and its prognostic factors; 5) Frequency of recurrence of OSAS and its risk factors.
Los trastornos respiratorios del sueño (TRS) en los niños abarcan un amplio grupo de procesos que van desde el ronquido hasta síndrome de resistencia aumentada de la vía aérea superior, síndrome de hipoventilación y síndrome de apneas-hipopneas durante el sueño (SAHS), todas ellas caracterizadas por la presencia de alteraciones de la respiración durante el sueño1.
Se define el SAHS en los niños como un trastorno de la respiración durante el sueño caracterizado por una obstrucción parcial prolongada de la vía aérea superior o una obstrucción completa intermitente (apnea obstructiva) que altera la ventilación normal durante el sueño y los patrones de sueño normales. Se asocia con síntomas que incluyen ronquido habitual nocturno, dificultades con el sueño o problemas de comportamiento y escolares2,3.
La prevalencia del SAHS en los niños de 4-5 años se estima entre el 0,2 y el 4,1%, con un pico de incidencia máxima entre los 2 y 6 años4, siendo su causa más frecuente la hipertrofia adenoamigdalar. Es una enfermedad infradiagnosticada5 y numerosos estudios han demostrado que el SAHS en los niños se asocia a importante morbilidad, y sin diagnosticar, y, por tanto, sin tratamiento oportuno, supone un aumento de costes económicos directos e indirectos. Por otro lado, los estudios demuestran que el tratamiento adecuado del SAHS infantil revierte al menos en parte las consecuencias negativas del SAHS6.
El tratamiento de elección del SAHS infantil es la adenoamigdalectomía; sin embargo, las tasas de éxito varían en los diferentes estudios publicados7,8, quedando un porcentaje no despreciable de SAHS residual9. Edad inferior a 3 años y obesidad son algunos de los factores predictores de SAHS residual1-3.
La polisomnografía (PSG) nocturna realizada en el laboratorio de sueño sigue siendo la técnica de elección1,10 para el diagnóstico de SAHS en los niños. En el 2007, la American Academy of Sleep Medicine11 publica las reglas para codificación de las variables neurofisiológicas y cardiorrespiratorias de la PSG, tanto en adultos como en niños, siendo actualizadas posteriormente12. La poligrafía respiratoria (PR) ha sido validada en niños13,14, siendo aceptada como técnica diagnóstica del SAHS en niños, siempre que se utilice en Unidades de Sueño y con polígrafos validados en esta población1,3.
En el momento actual, aún no conocemos la historia natural de los TRS en los niños. El primer trabajo que aborda la historia natural de síntomas de TRS en niños es un estudio de cohortes que incluyó a 12.447 niños15. Sin embargo, en este estudio se realizó únicamente cuestionarios y no estudios de sueño. En un estudio más reducido en 41 niños, se encuentra gran variabilidad en la persistencia de SAHS 4 años después de tratamiento16 y no existen datos de la evolución de la enfermedad sin tratamiento ni del SAHS residual a largo plazo.
Con el objetivo de conocer la historia natural del SAHS a través de su evolución en una población clínica infantil, nos proponemos realizar un estudio observacional, longitudinal y ambispectivo. En el presente trabajo, se realiza una descripción detallada del protocolo del estudio.
Logística del proyectoPara dar respuesta a los interrogantes de la historia natural del SAHS desde la infancia a la edad adulta, nos planteamos la realización de este proyecto.
Se establecieron a priori las siguientes acciones: a) inclusión en el estudio: niños de ambos sexos, entre 0 y 14 años remitidos a la Unidad Multidisciplinar de Sueño de Burgos por sospecha clínica de SAHS (presencia de ronquido o pausas respiratorias) desde el año 2000 hasta el 2010; b) carta informativa del estudio a todos los sujetos potencialmente incluibles e invitación a participar en la segunda fase del estudio, y c) llamada telefónica para confirmar participación en el estudio y cita presencial.
Objetivos del estudioLos objetivos del estudio se muestran en la tabla 1.
Objetivos del estudio
| Objetivo principal |
| Realizar una aproximación a la historia natural del SAHS a través de su evolución en población clínica infantil |
| Objetivos secundarios |
| Describir y comparar las características clínicas y polisomnográficas de la población infantil con y sin SAHS e identificar las variables predictivas de SAHS infantil |
| Conocer la frecuencia del SAHS residual y sus factores predictores |
| Conocer la incidencia de SAHS en la población infantil y sus factores de riesgo |
| Conocer la frecuencia de remisión de SAHS en la población infantil y sus factores pronósticos |
| Conocer la frecuencia de recidiva de SAHS en la población infantil y sus factores de riesgo |
SAHS: síndrome de apneas hipopneas durante el sueño.
Se incluyó en el estudio a niños de ambos sexos, entre 0 y 14 años, remitidos a la Unidad Multidisciplinar de Sueño de Burgos por sospecha clínica de SAHS (presencia de ronquido o pausas respiratorias nocturnas) desde el año 2000 hasta el 2010, una vez comprobado que cumplían los criterios de inclusión y la ausencia de criterios de exclusión. Fueron excluidos los niños que no tuvieran estudio de sueño diagnóstico, niños con síndromes cráneo-faciales o genéticos, enfermedades de depósito o síndromes malformativos, así como los niños con enfermedades crónicas (respiratorias, cardiacas, neurológicas, etc.) o la no obtención del consentimiento informado. El estudio fue aprobado por el Comité de Ética de Burgos y Soria, y se obtuvo el consentimiento informado por escrito de todos los sujetos incluidos en el estudio.
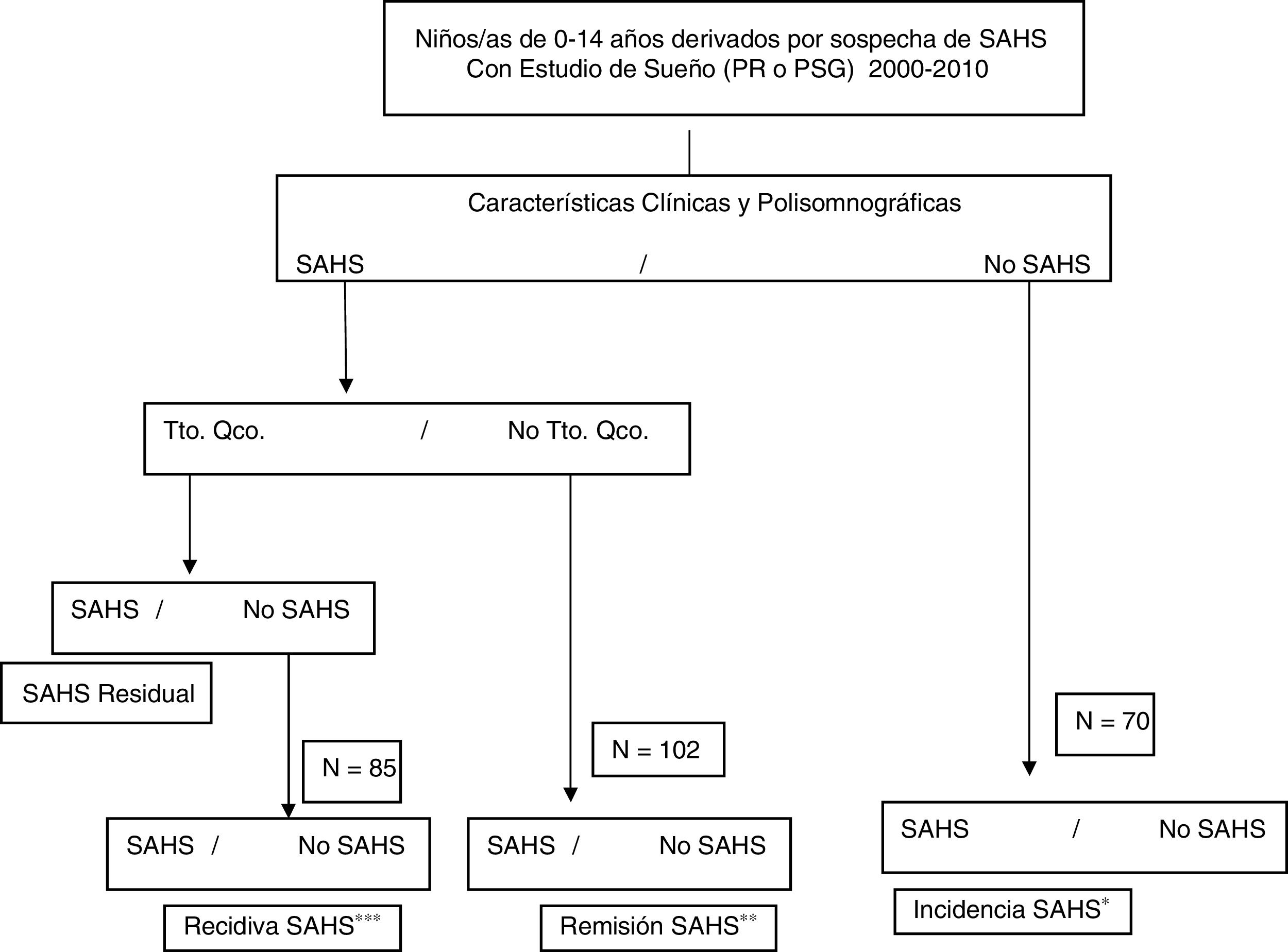
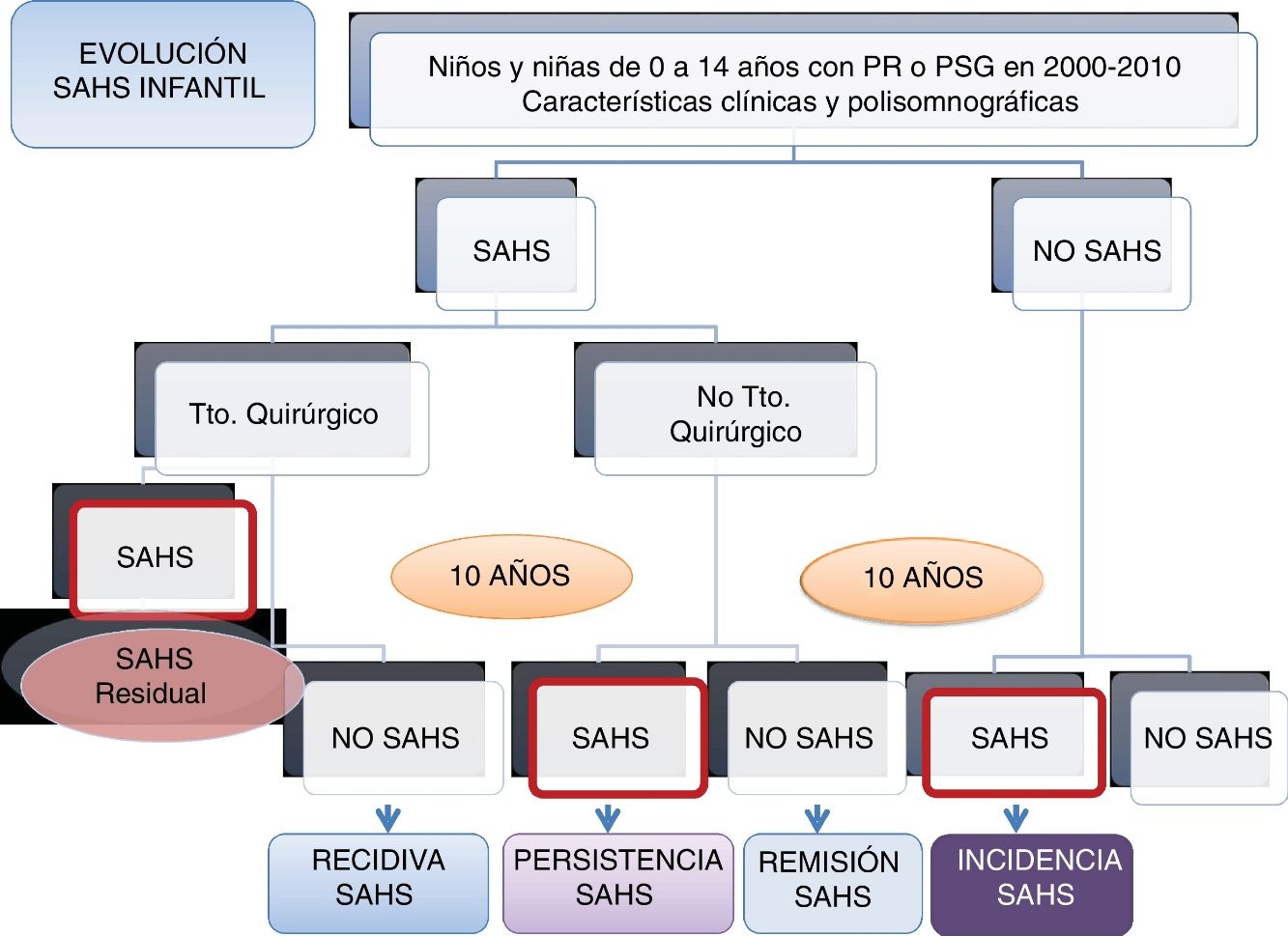
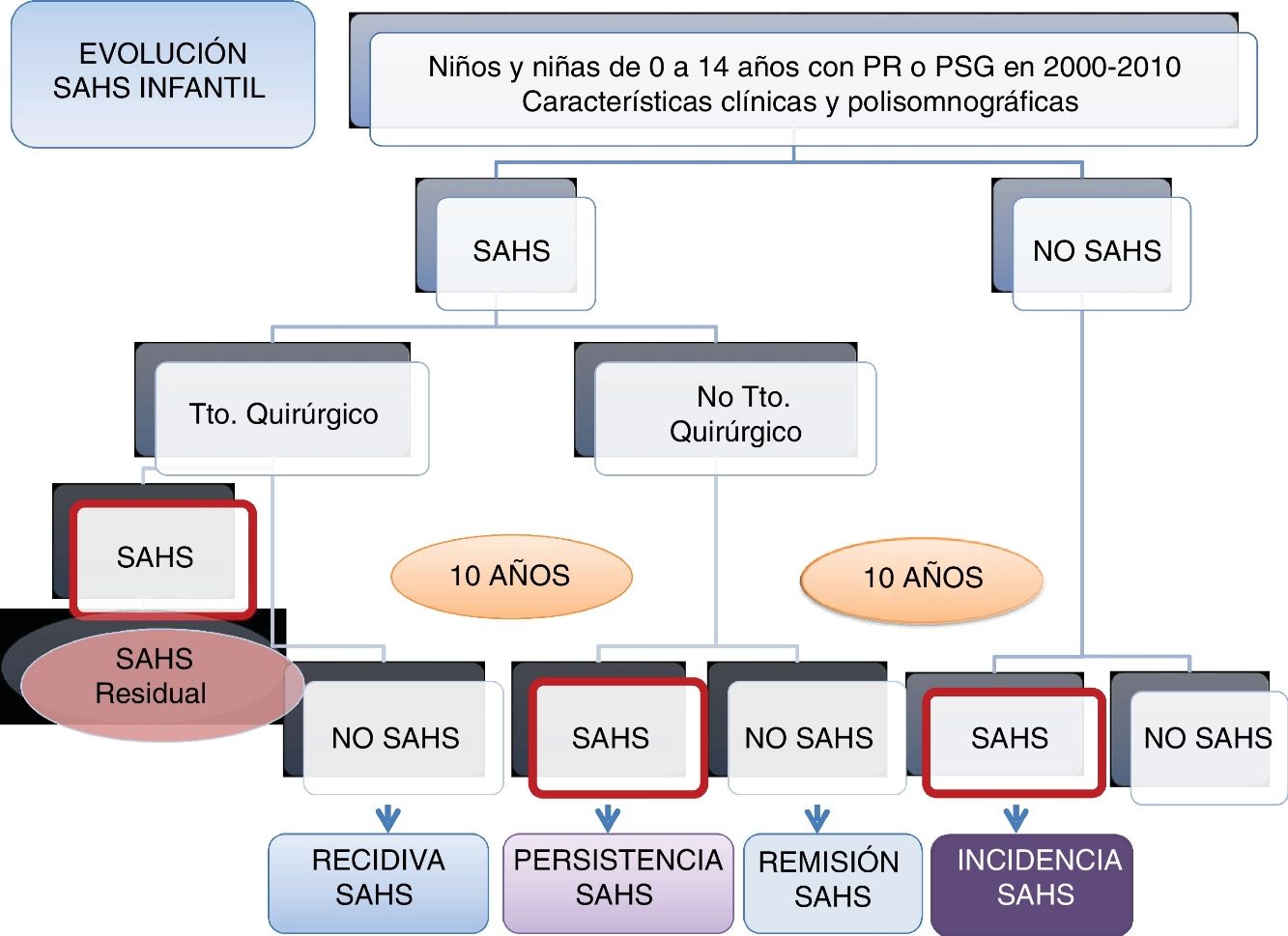
DiseñoATLANTIS es un estudio observacional, longitudinal, ambispectivo (retrospectivo y prospectivo), con seguimiento al menos a un año (a los niños menores de 7 años) o a 3 años (a los niños de 8 a 18 años) después de su estudio de sueño inicial, para el análisis de incidencia del SAHS y al menos 3 años después del diagnóstico de SAHS y no tratamiento quirúrgico o del diagnóstico de no SAHS tras el tratamiento quirúrgico para el análisis de la remisión o la recidiva del SAHS, respectivamente (fig. 1).
Diagrama de flujo del protocolo de estudio.
PR: poligrafía cardiorrespiratoria nocturna; PSG: polisomnografía nocturna; Qco: quirúrgico; SAHS: síndrome de apneas-hipopneas durante el sueño; Tto: tratamiento.
a Edad al diagnóstico: 0-7 años, al menos un año de seguimiento; 8-14 años al diagnóstico, al menos 3 años de seguimiento.
b Al menos 3 años desde el diagnóstico de SAHS y no tratamiento quirúrgico.
c Al menos 3 años desde la confirmación de no SAHS después del tratamiento quirúrgico.
El estudio se realiza en 2fases:
Fase ISe incluyó a todos los niños y niñas que cumplían los criterios de inclusión y no presentaban criterios de exclusión. A todos los sujetos inicialmente seleccionados se les recogieron los datos protocolizados de historia clínica y de sueño (tabla 2), incluida la versión española validada del Pediatric Sleep Questionnaire17, exploración física y otorrinolaringológica (tabla 3), parámetros del estudio de sueño diagnóstico inicial (PSG o PR), diagnóstico (SAHS/no SAHS) y tratamiento realizado.
Historia de sueño (horas de sueño)
| No | Sí | |
|---|---|---|
| Siesta diurna | ||
| Dificultades para conciliar el sueño | ||
| Excusas para no irse a dormir | ||
| Se despierta por la noche | ||
| Ingesta de bebidas estimulantes | ||
| Sudoración nocturna | ||
| Se mueve en la cama y adopta posiciones extrañas | ||
| Movimiento de piernas mientras duerme | ||
| Rechinar de dientes | ||
| Parasomnias | ||
| Cansancio diurno | ||
| Somnolencia diurna | ||
| Hiperactividad diurna | ||
| Déficit de atención | ||
| Alteraciones de la conducta | ||
| Alteraciones del rendimiento escolar |
Exploración física
| Exploración física general | Exploración otorrinolaringológica | Exploración cráneo-facial |
|---|---|---|
| Peso (kg) | Hipertrofia amigdalar(0-IV) | Normal |
| Talla (cm) | Hipertrofia adenoidea (0-100%) | Micrognatia |
| IMC (kg/m2) | Bóveda palatinaNormalElevada | Retrognatia |
| Percentil IMC | Microrretrognatia | |
| Cuello (cm) | Prognatismo | |
| Cintura (cm) | Hipoplasia maxilar | |
| Cadera (cm) | ||
| Presión arterial sistólica (mmHg) | ||
| Presión arterial diastólica (mmHg) |
El diagnóstico de SAHS infantil se establece según el Documento de Consenso del SAHS en niños3, obteniéndose 2grupos para el seguimiento: a) grupo SAHS, y b) grupo no SAHS.
A su vez, en el grupo SAHS (a) se establecerán 2subgrupos: grupo 1 (a1): tratamiento quirúrgico, y grupo 2 (a2): tratamiento no quirúrgico.
Fase IIPara valorar la evolución del SAHS infantil, en la segunda fase prospectiva de seguimiento, en el grupo de niños con SAHS se establecen 2grupos: grupo 1: en todos los niños con tratamiento quirúrgico se valorará la resolución del SAHS tras la intervención (mediante poligrafía o PSG), calculándose la frecuencia de SAHS residual; entre los niños sin SAHS residual (curados), se estudiará una muestra aleatoria (mediante poligrafía o PSG) al menos 3 años después de confirmarse que no tenían SAHS residual para calcular la frecuencia de la recidiva; grupo 2: se estudiará de la misma manera (poligrafía o PSG) una muestra aleatoria de niños con SAHS y sin tratamiento quirúrgico, para conocer la frecuencia de remisión.
En el grupo de niños sin SAHS se estudiará una muestra aleatoria, mediante poligrafía o PSG, al menos un año después del estudio diagnóstico en los menores de 7 años y al menos 3 años después en los mayores de 7 años, para conocer la incidencia de SAHS (fig. 1).
En la fase ii, a todos los sujetos seleccionados se les realizará una visita médica de control con realización de historia clínica y de sueño, exploración física y otorrinolaringológica, y estudio de sueño (PSG nocturna o PR, en función del estudio que se hubiera realizado en la fase i, se realizará el mismo tipo de estudio en la fase ii) (tabla 4).
Realización de estudios de sueño y definición de eventos
| Realización de estudio de sueño | Utilizamos las recomendaciones de la Academia Americana de Sueño para la configuración, los filtros y la señal de muestreoLos estudios de sueño fueron analizados manualmente y para la valoración de los diferentes estadios de sueño y de los eventos respiratorios se siguieron los criterios de Rectschaffen and Kales (Rechtschaffen and Kales [1968]. A manual of standardized terminology, techniques and scoring system for sleep stages of human subjets. Brain information service/Brain Research Institute. University of California [previo al 2007]) y de la Academia Americana de Sueño y el Documento de Consenso Español para niños3,11,12 (a partir del 2007)El cese de flujo oronasal que frecuentemente sigue a los movimientos corporales y los artefactos secundarios a movimientos no se contabilizan ni en la PSG ni en la PR |
| PSG nocturna | Realizada en el laboratorio de sueño, de forma vigilada, con monitorización de electroencefalograma, electrooculograma derecho e izquierdo, electromiograma tibial y submentoniano, electrocardiograma, flujo oronasal mediante termístor, movimientos torácicos y abdominales mediante bandas, posición corporal, saturación de oxígeno mediante pulsioximetría, ronquido y flujo aéreo mediante cánula nasal y registro continúo de CO2 transcutáneo |
| Poligrafía cardiorrespiratoria | Realizada en el laboratorio de sueño o en el domicilio del niño, mediante polígrafo Edentec o eXim-Apnea (validados para niños)13,14, con registro de: flujo oro-nasal mediante termistor nasobucal o cánula nasobucal, movimientos torácicos y abdominales mediante pletismografía de impedancia, sumatorio toraco-abdominal, posición corporal mediante sensor de posición, ronquido mediante micrófono o cánula nasal, frecuencia cardiaca y saturación de oxígeno arterial mediante pulsioximetría |
| Definición de eventos respiratorios | |
| Apnea obstructiva | Duración del evento equivalente a 2ciclos respiratoriosEl evento se asocia a caída de la amplitud de la señal ≥ 90% durante más del 90% del total del eventoPersistencia o aumento del esfuerzo respiratorio durante el periodo de descenso del flujo oronasalDuración: desde el final de la última respiración normal hasta el inicio de la primera respiración que recupera el nivel basal |
| Apnea central | Ausencia de esfuerzo inspiratorio durante todo el evento y uno de los siguientes criterios:1. El evento se asocia a caída de la amplitud de la señal ≥ 90% durante el evento, durante el tiempo equivalente a 2ciclos respiratorios y al menos uno de los siguientes:1) Duración del evento durante al menos 20 s2) Duración del evento al menos el tiempo equivalente a 2 ciclos respiratorios y asociado a arousal, despertar o desaturación ≥ 3%3) El evento se asocia con descenso de FC < 50 lpm durante al menos 5 s o < 60 lpm durante 15 s (niños menores de un año) |
| Apnea mixta | 1. Duración del evento equivalente a 2ciclos respiratorios2. El evento se asocia a caída de la amplitud de la señal ≥ 90%3. Ausencia de esfuerzo inspiratorio en la primera parte del evento seguido de resolución del esfuerzo inspiratorio antes del final del evento |
| Hipopnea | Descenso en la amplitud de la señal de la cánula nasal o de señal alternativa ≥ 30% comparada con la amplitud basalDuración: al menos el tiempo equivalente a 2ciclos respiratoriosLa caída en la amplitud de la cánula nasal debe durar ≥ 90% de todo el evento respiratorio comparado con la amplitud precedente al eventoEl evento está asociado con un arousal, despertar o desaturación ≥ 3% |
| RERA | Secuencia de respiraciones al menos equivalente a 2 respiraciones caracterizado por aumento de esfuerzo respiratorio, flattering en la porción inspiratoria de la cánula, ronquido o elevación de end-tidal o transcutáneo PCO2 que conduce a arousal en sueño y no cumple criterios de apnea ni de hipopnea |
| Índice de apnea (IA) | Número de apneas por hora de sueño (por hora de registro en la PR) |
| Índice de apneas/hipopneas (IAH) | Número de apneas e hipopneas por hora de sueño, incluyendo las apneas centrales (por hora de registro en la PR) |
| Índice de apneas/hipopneas obstructivas | Número de apneas e hipopneas obstructivas por hora de sueño, sin considerar las apneas centrales (por hora de registro en la PR) |
| Índice de RERAS | Número total de episodios RERAS por hora de sueño (por hora de registro en la PR) |
| Hipoventilación obstructiva | Si en la PSG se objetiva obstrucción parcial de la vía aérea con aumento del CO2, CO2 > 50 mmHg durante más del 25% del TST (en ausencia de enfermedad pulmonar) |
| Índice de alteraciones respiratorias (IAR) | Número de apneas (incluyendo las apneas centrales), hipopneas y RERAS por hora de sueño (por hora de registro en la PR) |
| Índice de alteraciones respiratorias obstructivo (IARO) | Número de apneas, hipopneas y RERAS de carácter obstructivo por hora de sueño (por hora de registro en la PR) sin considerar las apneas centrales |
En la segunda fase del estudio, el diagnóstico y el tratamiento, en los casos que fuese necesario, se realizarán según el Documento de Consenso del SAHS para niños3 y normativa SEPAR para adultos18.
Variables de estudioEn la tabla 5 se muestran las variables evaluadas en el estudio. Se consideró ilocalizable si fue imposible su localización después de la carta informativa y 3llamadas telefónicas, y pérdida si, a pesar de su localización, no daban su consentimiento para la realización del estudio o no acudían a la realización del estudio.
Variables recogidas al inicio del estudio y durante el seguimiento
| Antecedentes familiares | Antecedentes familiares de SAHS | |
| Antecedentes familiares de obesidad | ||
| Antecedentes personales | Prematuridad | |
| Somatométricos | ObesidadBajo peso | |
| Patológicos | Hipertensión arterialDislipidemiaDiabetesTDAHHipotiroidismo | |
| Otorrinolaringológicos | RinitisAmigdalitisOtitisCirugía previa | |
| Respiratorios | BronquitisAsma | |
| Hábitos tóxicos | TabacoAlcohol | |
| Historia de sueño | Cuestionario de ronquido | |
| Versión española del PSQ (niños)17 | ||
| Epworth Sleepiness Scale (adultos) (Ferrer M, Vilagut C, Monasterio C, Montserrat JM, Mayos M. Alonso J. Measurement of the perceived impact of sleep problems: The Spanish versión of the functional outcomes sleep questionnaire and the Epworth Sleepiness Scale. Med Clin (Barc). 1999;113(7):250-255 | ||
| Datos antropométricos | SexoEdadTallaPesoIMCPercentil IMCCircunferencia de cuelloPresión arterial sistólicaPresión arterial diastólica | |
| Exploración ORL | Obstrucción de coanas | 0%-100% |
| Hipertrofia amigdalar | 0-IV | |
| Posición mandibular | NormalPrognatismoRetrognatia | |
| Polisomnografía nocturna | Variables neurofisiológicasVariables cardiorrespiratorias | |
| Poligrafía cardiorrespiratoria | Variables cardiorrespiratorias |
IMC: índice de masa corporal; SAHS: síndrome de apneas hipopneas durante el sueño; TDAH: trastorno de déficit de atención e hiperactividad.
Para detectar incidencia, remisión o recidiva del SAHS, se realizó el cálculo del tamaño muestral para la segunda fase del estudio, siendo el tamaño muestral necesario de 257 sujetos19,20.
Para detectar incidencia de SAHS, el tamaño muestral estimado fue de 70 niños sin diagnóstico inicial de SAHS partiendo de los siguientes supuestos: incidencia acumulada esperada: 10%, precisión: ± 8%, nivel de confianza: 95%, porcentaje de pérdidas: 20%.
Para detectar remisión de SAHS, el tamaño muestral estimado fue de 102 niños con diagnóstico inicial de SAHS y sin tratamiento, partiendo de los siguientes supuestos: remisión esperada: 30%; precisión: ± 10%, nivel de confianza: 95%, porcentaje de pérdidas: 20%.
Para detectar recidiva de SAHS, el tamaño muestral estimado fue de 85 niños con SAHS resuelto después de tratamiento (curado inicialmente), partiendo de los siguientes supuestos: recidiva esperada: 13%, precisión: ± 8%, nivel de confianza: 95%, porcentaje de pérdidas: 20%.
Análisis estadísticoAdemás del análisis descriptivo a través de la distribución de frecuencias para las variables cualitativas y media ± desviación estándar para las cuantitativas, se analizará la relación entre variables cualitativas utilizando la prueba de la chi al cuadrado y para la comparación de medias la prueba t de Student o el análisis de la varianza, según corresponda, previa comprobación de las condiciones de aplicación y, en caso de no cumplirse dichas condiciones, se utilizarán las pruebas no paramétricas correspondientes. Se calcularán la incidencia acumulada de SAHS y la tasa de remisión y de recidiva. Se usará un modelo de regresión logística para la identificación de predictores de incidencia, remisión y recidiva. El nivel de significación a utilizar será del 5% y los intervalos de confianza se calcularán con un nivel de confianza del 95%. Los datos serán procesados y analizados con el paquete estadístico SPSS (versión 22; Chicago, IL, Estados Unidos).
Aspectos éticosConsentimiento informado. Se informa al niño/a si era mayor de 12 años de edad y al padre/madre o tutor, de forma oral y por escrito, de la naturaleza y los propósitos del estudio. El proyecto fue valorado y aprobado por el Comité de Ética de Burgos y Soria teniendo en cuenta la declaración de Helsinki.
Situación actualHa concluido la inclusión de sujetos en todos los grupos, por lo que se está llevando a cabo el análisis de comparación entre los diferentes grupos (no SAHS inicial, SAHS inicial no tratado, SAHS inicial tratado/curado) en esta cohorte de niños/as que nos permitirá realizar el cálculo de la tasa de incidencia, de remisión y de recidiva del SAHS infantil.
En total, han sido incluidos 298 sujetos: 102 en el grupo de SAHS no operados, 80 en el grupo de SAHS operados/curados, 70 en el grupo no SAHS/no operado y 46 en el grupo SAHS operado/residual.
DiscusiónEl SAHS infantil puede aparecer en diferentes edades y en relación con diferentes factores etiopatogénicos. La evolución del SAHS infantil y la morbilidad asociada al SAHS, así como su reversibilidad, depende, entre otros factores, de la precocidad del diagnóstico y del tratamiento adecuado del SAHS, pudiendo influir otros factores, como las características cráneo-faciales o antropométricas de los niños. Este estudio nos permitirá realizar una aproximación a la historia natural del SAHS a través de su evolución en una población clínica infantil, así como la identificación de diferentes fenotipos clínicos de SAHS infantil y conocer la frecuencia de SAHS residual y sus factores predictores, la identificación de factores predictores de incidencia, remisión y recidiva del SAHS infantil y predictores de SAHS en adultos jóvenes.
La prevalencia del SAHS infantil se estima en un 1-4%, siendo su causa más frecuente la hipertrofia adenoamigdalar1-4, pero no es la única causa, y así recientemente se ha demostrado el importante papel de la obesidad como causa de SAHS infantil21. Por lo tanto, en la patogenia del SAHS infantil intervienen varios factores, no solo anatómicos1-3. Si se confirmara nuestra hipótesis de trabajo, podríamos identificar diferentes fenotipos de SAHS22,23, en función de su factor patogénico, y ello conllevaría un diagnóstico y tratamiento precoz encaminado a la causa de la enfermedad y, por tanto, a un tratamiento más individualizado. Por otro lado, este estudio permitirá identificar diferentes factores predictores de SAHS residual en los niños8,24,25, lo cual conllevaría una estrategia, de seguimiento y control, específica en esta población. Además, si se confirma nuestra hipótesis, conoceríamos la incidencia de la enfermedad en diferentes fases de la vida (niños, adolescentes, adultos jóvenes), lo que permitirá plantear un abordaje específico en cada una de ellas.
El proyecto presenta varias líneas para la presentación de resultados y publicaciones:
- 1.
Fase 1:
- a.
Diferencias clínicas, antropométricas y polisomnográficas/poligráficas entre los niños con y sin SAHS.
- b.
Factores predictores de SAHS infantil.
- c.
Factores predictores de SAHS residual.
- 2.
Fase 2:
- a.
Factores predictores de incidencia del SAHS infantil.
- b.
Factores predictores de remisión/resolución del SAHS infantil.
- c.
Factores predictores de recidiva del SAHS en las diferentes etapas de la infancia y adolescencia.
Las consecuencias inmediatas de la obstrucción de la vía aérea superior durante el sueño son: cambios en la presión intratorácica, hipoxemia intermitente, fragmentación del sueño e hipoventilación alveolar3, asociándose con importante morbilidad y afectación de diferentes órganos y sistemas. El SAHS en la población pediátrica está asociado a una importante morbilidad, retraso en el crecimiento o estancamiento ponderal, enuresis y morbilidad cardiovascular, neurocognitiva, endocrino-metabólica e inflamatoria26-28. En cuanto a la morbilidad relacionada con el SAHS, es importante considerar que no todos los niños con SAHS desarrollan comorbilidad y la magnitud del daño de los órganos diana estará determinada por la severidad del SAHS, pudiendo influir otros factores, como la susceptibilidad individual29, de ahí la importancia de un diagnóstico precoz y un tratamiento individualizado del SAHS infantil.
Es necesario considerar que hay importantes variaciones fenotípicas en términos de morbilidad específica para cada grado de severidad del SAHS y, en esta línea, las investigaciones recientes se centran en la identificación de biomarcadores30 para la caracterización de fenotipos y predicción del éxito del tratamiento que conducirá a la individualización del tratamiento. Si la hipótesis de nuestro estudio se confirma, nos permitirá la identificación de fenotipos clínicos que conduciría a la realización de una estrategia diagnóstico-terapéutica individualizada.
Análisis de riesgoLas dificultades de este estudio son:
- a.
Carácter retrospectivo de la primera fase del estudio. Sin embargo, los datos fueron recogidos de forma sistemática, debido a la existencia de una base de datos normalizada que permite disponer de datos de alta calidad.
- b.
Necesidad de una muestra amplia.
- c.
Carácter prospectivo de la cohorte y de seguimiento en algunos casos a 10 años, que puede repercutir en aumento de número de ilocalizables, por ejemplo, por cambio de domicilio y ciudad.
- d.
Realización de estudios de sueño a personas presumiblemente sanas, que puede repercutir en aumento del número de rechazos a participar en el estudio.
Instituto Carlos III (Fondo de investigación sanitaria, Ministerio de Sanidad y Consumo) FIS PI 15/01334, Sociedad Española de Neumología y Cirugía Torácica (SEPAR) y Fundación Burgos por la Investigación en la Salud (FBIS).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos expresar nuestro agradecimiento a los niños, los padres y los cuidadores por su participación en el estudio y un especial agradecimiento al Dr. Joaquín Terán Santos, por su profesionalismo, dedicación, estímulo y soporte continuo.