En nombre de la Sociedad Andaluza de Endocrinología y Nutrición (SAEN) se ha elaborado un consenso sobre la atención a la mujer gestante que presenta algún tipo de disfunción tiroidea, basándose en la revisión de la bibliografía actualizada y sobre todo de las guías de buena práctica clínica. Se desarrolla bajo distintos epígrafes o apartados en los que se contempla tanto el diagnóstico como el tratamiento del hipotiroidismo clínico y subclínico, el hipertiroidismo franco y subclínico, la hipotiroxinemia y la tiroiditis posparto, así como la justificación de la realización de cribado universal de la disfunción tiroidea durante la gestación, proporcionando a los profesionales que asisten a estas pacientes un arma de toma de decisiones razonada.
A position statement on the diagnosis and treatment of thyroid dysfunction in pregnancy has been agreed on behalf of The Sociedad Andaluza de Endocrinología y Nutrición (SAEN), based on a review of the literature to date and all good clinical practice guidelines. The document is set out in different sections as regards the diagnosis and treatment of, overt and subclinical hypo- and hyperthyroidism, isolated hypothyroxinaemia and postpartum thyroiditis. It also justifies the implementation of universal screening for thyroid dysfunction in pregnancy, and provides practitioners who care for these patients with tool for rational decision making.
La disfunción tiroidea (DT) en la gestación es un aspecto del conocimiento sujeto a debate: sobre el cribado de hipotiroidismo (selectivo o universal), sobre los valores de referencia de hormonas tiroideas (HT) diferenciados por trimestres, o la extensión de la suplementación yodada, o los potenciales efectos adversos de la hipotiroxinemia aislada. Mientras, los clínicos nos vemos obligados a tomar decisiones terapéuticas con la mejor evidencia posible, bajo criterios de precaución y sin producir iatrogenia.
Este documento es una herramienta de soporte para tomar decisiones respecto a la interpretación de la DT en gestantes dirigido a los profesionales que las atienden en Andalucía. Realizado por endocrinólogos miembros de la Sociedad Andaluza de Endocrinología y Nutrición (SAEN) y responsables de la atención a las endocrinopatías en la gestación en su área de trabajo, se ha considerado como base las guías actuales adaptándolas a nuestro medio1,2. El borrador desarrollado por el grupo de trabajo de la SAEN previo a esta publicación se encuentra disponible en la Web de la SAEN3. Se insertan comentarios que consideramos de utilidad para su interpretación. Cuenta con el apoyo de la Sociedad Andaluza de Ginecología y Obstetricia (SAGO), Sociedad Andaluza de Análisis Clínicos (SANAC), Sociedad Española de Médicos Generales y de Familia, Andalucía (SEMG), Sociedad Española de Médicos de Atención Primaria (SEMERGEN-Andalucía) y Asociación Andaluza de Matronas (AAM). La Sociedad Andaluza de Medicina Familiar y Comunitaria (SAMFYC) lo ratifica con la excepción del screening universal.
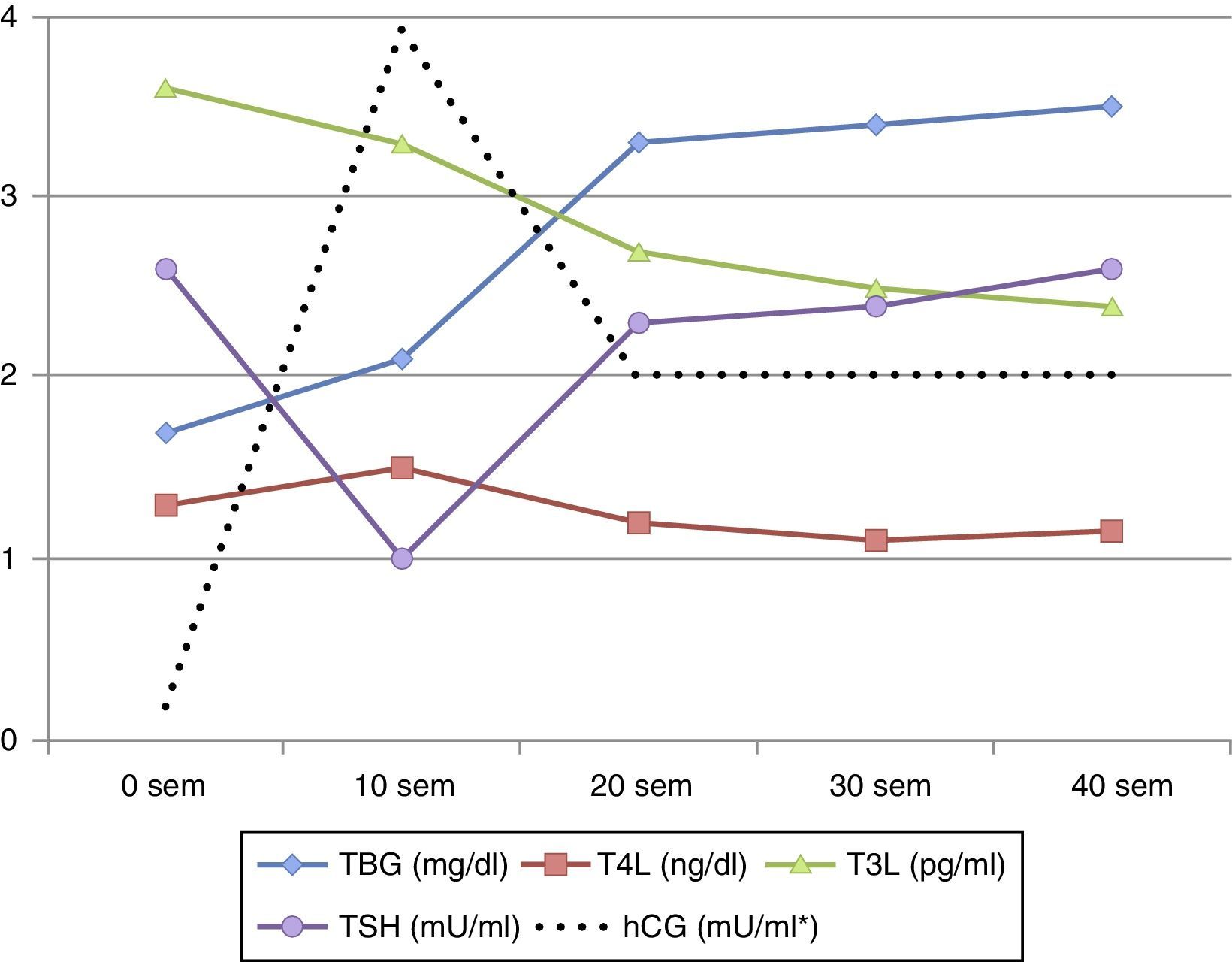
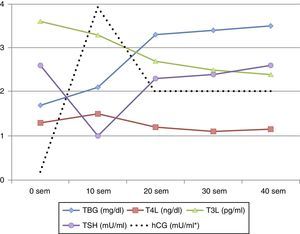
Modificaciones de la función tiroidea durante la gestaciónDurante la gestación se producen cambios fisiológicos que se ven reflejados en los resultados de las pruebas de función tiroidea, de forma que, si no se tienen en cuenta, estas podrían valorarse como alteradas. Estos cambios se exponen en la figura 1, habiendo sido descritos por Glinoer3. Los más importantes se deben a un aumento en las concentraciones de proteína transportadora de HT (TBG) y la estimulación del receptor de tirotropina (TSH) por la gonadotropina coriónica (hCG). La concentración de TBG se duplica (aumenta su producción y disminuye su aclaramiento), incrementándose los niveles de tiroxina y triyodotironina totales (T4T y T3T); como consecuencia, para mantener una adecuada concentración de HT libres (T4L y T3L) el tiroides debe aumentar su producción. Por otra parte la hCG presenta una considerable homología con la TSH, resultando en una actividad estimuladora tiroidea débil y proporcional a los niveles de hCG. Las concentraciones de hCG aumentan pronto tras la fecundación, con un pico máximo a las 10-12 semanas, llevando a un incremento en la producción de HT una reducción paralela de la TSH, de forma que en primer trimestre de gestación (1.°T) la TSH puede ser aparentemente baja hasta en un 10-20% de gestantes sanas, simulando transitoriamente un hipertiroidismo subclínico (hiperSC) que puede ser considerado un hallazgo fisiológico. En el segundo trimestre de gestación (2.°T) la secreción de hCG y la concentración de HT libres disminuyen y la TSH se normaliza.
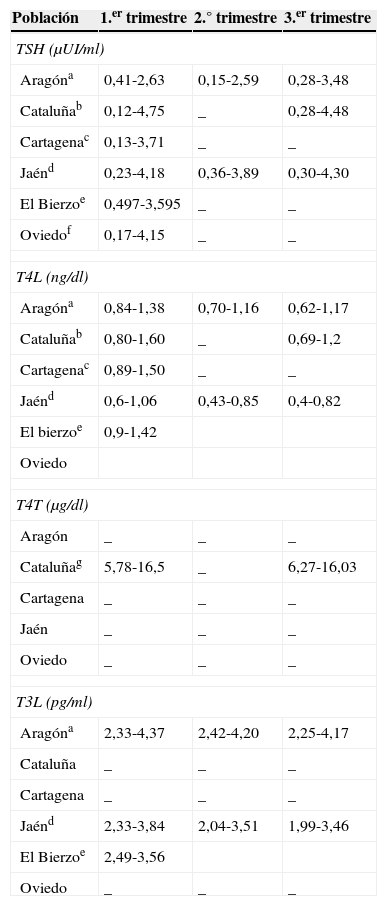
Debido a estos cambios los valores de HT durante la gestación, y dependiendo también del momento de esta, pueden ser diferentes de los valores de referencia (VR) previos, siendo necesario disponer de rangos analíticos específicos de HT por trimestres y en cada población de referencia1,4–9 (tablas 1 y 2).
Ejemplos de valor de referencia de hormonas tiroideas en mujeres gestantes en estudios realizados en España
| Población | 1.er trimestre | 2.° trimestre | 3.er trimestre |
|---|---|---|---|
| TSH (μUI/ml) | |||
| Aragóna | 0,41-2,63 | 0,15-2,59 | 0,28-3,48 |
| Cataluñab | 0,12-4,75 | _ | 0,28-4,48 |
| Cartagenac | 0,13-3,71 | _ | _ |
| Jaénd | 0,23-4,18 | 0,36-3,89 | 0,30-4,30 |
| El Bierzoe | 0,497-3,595 | _ | _ |
| Oviedof | 0,17-4,15 | _ | _ |
| T4L (ng/dl) | |||
| Aragóna | 0,84-1,38 | 0,70-1,16 | 0,62-1,17 |
| Cataluñab | 0,80-1,60 | _ | 0,69-1,2 |
| Cartagenac | 0,89-1,50 | _ | _ |
| Jaénd | 0,6-1,06 | 0,43-0,85 | 0,4-0,82 |
| El bierzoe | 0,9-1,42 | ||
| Oviedo | |||
| T4T (μg/dl) | |||
| Aragón | _ | _ | _ |
| Cataluñag | 5,78-16,5 | _ | 6,27-16,03 |
| Cartagena | _ | _ | _ |
| Jaén | _ | _ | _ |
| Oviedo | _ | _ | _ |
| T3L (pg/ml) | |||
| Aragóna | 2,33-4,37 | 2,42-4,20 | 2,25-4,17 |
| Cataluña | _ | _ | _ |
| Cartagena | _ | _ | _ |
| Jaénd | 2,33-3,84 | 2,04-3,51 | 1,99-3,46 |
| El Bierzoe | 2,49-3,56 | ||
| Oviedo | _ | _ | _ |
Los valores reflejan los percentiles 2.5 y 97.5, respectivamente y se han excluido del análisis estadístico aquellas mujeres que tenían TPO (+).
a Análisis por inmunoanálisis-quimioluminiscencia (Architect i2000 Abbott Diagnostics). Cálculo realizado en población con Ac antitiroideos negativos. No consta la nutrición de yodo de la muestra4.
b Análisis por inmunoanálisis-quimioluminiscencia (Advia Centaur Bayer). Cálculo realizado en población con AC TPO negativos. La mediana de yoduria de la población en el primer trimestre era de 163μg/l. En este estudio se incluye el valor del percentil 10 para la T4L (0,86ng/dl en primer trimestre y 0,80ng/dl en tercer trimestre)5.
c Análisis por inmunoanálisis-quimioluminiscencia (Roche Diagnostics). Cálculo realizado en la población con Ac antitiroideos negativos. No consta la nutrición de yodo de la población6.
g Análisis realizado por RIA (Diagnostic Systems Laboratories, Webster).
d Inmunoanálisis-quimioluminiscencia (Beckman Access. Immuno Assay System). Se excluyen las mujeres con Ac antitiroideos positivos. La mediana de yoduria en primer trimestre era de 109,85μg/l, 179 en el segundo y 181,78 en el tercero7.
e Inmunoan lisis-quimioluminiscencia (ADVIA Centaur XP). Mediana de yoduria de 118μg/l8.
f Inmunoanalisis-quimioluminiscencia (Roche Diagnostic). No se incluye la yoduria en esta publicación, pero en otra complementaria se expone que la mediana de la yoduria es de 197μg/l en el primer trimestre9.
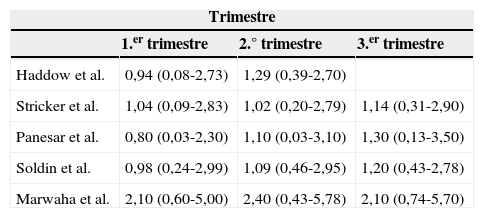
Media y percentiles 2.5 y 97.5 de TSH según trimestre de gestación
| Trimestre | |||
|---|---|---|---|
| 1.er trimestre | 2.° trimestre | 3.er trimestre | |
| Haddow et al. | 0,94 (0,08-2,73) | 1,29 (0,39-2,70) | |
| Stricker et al. | 1,04 (0,09-2,83) | 1,02 (0,20-2,79) | 1,14 (0,31-2,90) |
| Panesar et al. | 0,80 (0,03-2,30) | 1,10 (0,03-3,10) | 1,30 (0,13-3,50) |
| Soldin et al. | 0,98 (0,24-2,99) | 1,09 (0,46-2,95) | 1,20 (0,43-2,78) |
| Marwaha et al. | 2,10 (0,60-5,00) | 2,40 (0,43-5,78) | 2,10 (0,74-5,70) |
Fuente: Stagnaro-Green et al.1.
Proponemos: cribado universal de disfunción tiroidea en gestantes en 1.°T, orientado a la detección de hipotiroidismo clínico.
Justificación: la DT en el embarazo en sus formas clínicamente significativas —hipotiroidismo e hipertiroidismo francos (hipoC e hiperC)— puede complicar la gestación y afectar al feto en diversas formas, por lo que es importante identificarla para iniciar tratamiento apropiado. Hay evidencia más que justificada de que el tratamiento precoz del hipoC consigue beneficios sobre la maduración neurocognitiva del feto y la evolución de la gestación. Es más discutible el efecto del hipotiroidismo subclínico (hipoSC), la positividad de Ac antiperoxidasa (TPO) o la hipotiroxinemia aislada (HA) sobre el curso del embarazo, o la forma en que su tratamiento podría asociarse con alguna mejoría sobre los aspectos citados3,10.
Ninguna sociedad científica duda, por tanto, de la necesidad de cribado para detectar hipoC, pero la mayoría de ellas actualmente se posicionan por un cribado selectivo activo. Para la American Thyroid Association (ATA) y la American Association of Clinical Endocrinologists (AACE)1,2, en sus recomendaciones de 2011 y 2012, no hay suficiente evidencia ni estudios de coste-efectividad prospectivos concluyentes para recomendar el cribado universal. Solo The Endocrine Society (2012) se posiciona en desacuerdo, con un grupo recomendando cribado universal precoz, y otro grupo cribado selectivo activo, pero especificando que en los entornos en que este no se garantice apropiadamente, o en aquellos en que la organización local/entorno lo permitan, se realice de forma universal11,12. En nuestro país, a diferencia de otros, el cribado de diabetes gestacional es universal en 2.°T, entre otras razones porque la edad media de las gestantes es mayor de 30 años; la experiencia con este y otros cribados en la gestación en una organización de sistema sanitario público que da cobertura a la gran mayoría de las gestantes hace posible la implementación del cribado universal, y se evitaría la variabilidad inherente al cribado selectivo, que exige la documentación de muchas variables (incluida la palpación tiroidea) por matronas o médicos en ocasiones poco familiarizados con esta enfermedad en la gestación, y habida cuenta además de que un 30% de gestantes con hipotiroidismo franco no contarán síntomas13. Hay estudios de coste-efectividad que demuestran los beneficios, no solo del cribado universal y selectivo frente a no hacer cribado, sino del cribado universal frente al selectivo14,15.
Es por ello que el grupo de Trastornos por déficit de yodo y disfunción tiroidea de la Sociedad Española de Endocrinología (SEEN) y la Sociedad Española de Ginecología y Obstetricia (SEGO) han establecido unas recomendaciones —basadas en el Scottish Intercolegiate Guidelines Network— en las que proponen cribado universal para diagnosticar hipotiroidismo clínico14,16.
Es de destacar el amplio consenso que ha recibido este documento respecto a la propuesta de cribado universal (como ya se ha citado, SAGO, SANAC, SEMG, SEMERGEN y AAM), con la única excepción de la SAMFYC que se posiciona por el screening selectivo.
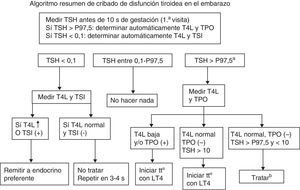
Para la organización del cribado, selectivo o universal, cada laboratorio debe establecer los VR de HT locales, considerándose como subsidiaria de valoración para tratamiento una TSH mayor del percentil 97.5 (P97.5) para esa población. El cribado consistiría en solicitar TSH en la 1.ª visita de la gestación antes de la 9 semana (SG), para tratar antes de la SG 10; si TSH>P97.5 se realizaría automáticamente determinación de T4L y TPO. Respecto a la T4L, en caso de no disponerse de valores propios, se aplicaría —solo para el 1.°T— el límite inferior de normalidad de T4L del laboratorio de referencia. Dado que la T4L desciende en el 2.° y 3.°T, en estos periodos la TSH se considera un marcador más preciso del estado tiroideo que la T4L.
Tanto la SEEN como la Endocrine Society y la ATA recomiendan como VR para TSH, en caso de que no se disponga de datos locales, los siguientes: 1.°T 0,1-2,5μU/ml, 2.°T 0,2-3,0μUI/ml, 3.°T 0,3-3,0μUI/ml. Estos valores se basan en estudios poblacionales previos que describen un P97.5 aproximado o discretamente superior a 2,5μU/ml. Sin embargo, los estudios realizados en distintas áreas de nuestra geografía arrojan resultados para el P97.5 de TSH sustancialmente más elevados (tablas 1 y 3), por lo que aplicar los VR propuestos por la ATA podría llevar a un sobrediagnóstico de hipoSC. En Andalucía se dispone de VR de HT para cribado en 1.°T de gestación en 3 hospitales (tabla 3).
Valores de referencia (P2.5 y P97.5) de hormonas tiroideas en gestación en algunos hospitales de la comunidad autónoma andaluza
| Método | TSH | T4L | |
|---|---|---|---|
| Hospital Regional, Málaga | inmunoanálisis de electroquimioluminiscencia | 0,01-4,4μUI/ml | 10,5-24pmol/l |
| CH Jaén | inmunoanálisis de electroquimioluminiscencia | 0,23-4,18μUI/ml | 0,6-1,6ng/dl |
| Hospital Virgen Macarena, Sevilla | inmunoanálisis de electroquimioluminiscencia | 0,36-4,49μUI/ml | 0,89-1,35ng/dl |
Justificación: el hipoC durante la gestación se asocia a efectos adversos tanto obstétricos como fetales. Entre los obstétricos podemos citar el aborto, el parto pretérmino, la HTA gestacional y mayor riesgo de preeclampsia, sufrimiento fetal intraparto, partos intervencionistas y cesáreas. Para el feto las consecuencias más graves afectan al desarrollo neuromotor y cognitivo17–19. Las complicaciones materno-fetales del hipoSC, sin embargo, difieren entre sí según los estudios9,18–20. Para la HA también existe controversia en cuanto a su implicación en resultados adversos sobre la gestación o la descendencia21,22.
El diagnóstico de hipotiroidismo en gestación se realiza de la siguiente forma1,23,24:
- •
HipoC: TSH>10μU/ml independientemente de los niveles de T4L o TSH>P97.5 de VR locales (para ese trimestre) y T4L por debajo del límite inferior de la normalidad para VR (en ese trimestre); en ausencia de VR propios, TSH>2,5μU/ml.
- •
HipoSC: TSH>P97.5 para VR propios y <10 con T4L normal. HA: T4L<P10 para VR propios y para el mismo trimestre de gestación con TSH normal.
Se recomienda planificar la gestación para mantener una TSH por debajo de 2,5μUI/ml al comienzo de la misma. Al confirmar la gestación se aumentará la dosis de tiroxina en un 25-30% (de media 25mcg/día). Se realizarán controles de HT (TSH, T4L) y ajustes de dosis si procede cada 4-6 semanas durante las 20 primeras SG, y ya ajustada la dosis, coincidentes con las analíticas de 2.°T (24 semanas) y 3.°T (32-36 semanas) para evitar multiextracciones innecesarias. Para el ajuste de tratamiento se tendrán en cuenta los VR de TSH que recomiendan las diferentes sociedades científicas en caso de que no existan VR locales (SEEN, The Endocrine Society, ATA)1,2,14. En caso de TSH elevada se propone incrementar la dosis entre 25-75mcg sobre la dosis previa.
El hierro puede reducir la absorción de la levotiroxina cuando se administran conjuntamente, por lo que se recomienda un intervalo entre ambos de más de 4h.
Proponemos determinar al menos en una analítica, preferiblemente en 2.°T, Ac anti receptor de TSH (TRAb) si la paciente sufre un hipotiroidismo iatrogénico tras tratamiento definitivo de un hipertiroidismo previo.
Hipotiroidismo detectado mediante cribadoLos VR de TSH son los referidos en el apartado anterior. Si TSH>P97.5 para VR locales en 1.°T (o>2,5μUI/ml en su defecto), se realizará precozmente determinación de T4L y TPO siendo informados por el laboratorio de forma simultánea a la TSH.
Proponemos:
- •
HipoC en 1.°T iniciar lo más precozmente posible tratamiento con levotiroxina.
- •
HipoSC y TPO positivos iniciar tratamiento con levotiroxina.
- •
HipoSC y TPO negativos no existe evidencia suficiente respecto a la recomendación de tratamiento. Sugerimos iniciar tratamiento cuando TSH>4μUI/ml. Dado que los VR realizados en gestantes en 1.°T en nuestro medio difieren significativamente de los propuestos por la ATA1, probablemente sea más razonable iniciar tratamiento por encima del P97.5 independientemente del nivel de TPO.
Sugerencia de dosis de inicio con levotiroxina:
- •
TSH>P97.5 y <5μU/ml (o en su defecto 2,5-5): 25-50μg.
- •
TSH 5-8μU/ml: 50-75μg.
- •
TSH>8μU/ml: 75-100μg.
Como alternativa iniciar a dosis media de 1,2μg/kg en hipoSC y 2μg/kg en hipoC. Considerar, en caso de que el tratamiento se vaya a iniciar a dosis altas (≥100μg/día), un inicio progresivo.
Se realizarán controles de función tiroidea (TSH, T4L) y ajustes de dosis igual que en el apartado anterior.
Gestantes con anticuerpos antiperoxidasa positivos conocidos sin disfunción tiroidea previaSe realizará analítica en la primera visita de gestación. Si TSH>P97.5 para VR propios (o en su defecto >2,5μU/ml) en 1.°T se iniciará tratamiento con levotiroxina. La frecuencia de controles analíticos será similar a la descrita previamente.
No recomendamos monitorizar Ac antitiroideos durante la gestación, salvo en antecedentes de hipertiroidismo en que se determinarán TRAb coincidentes con la analítica de 2.°T.
Hipotiroxinemia aisladaSu valor en cuanto a implicaciones obstétricas y fetales está por determinar. Este diagnóstico se reduce cuando cada laboratorio establece sus propios valores de normalidad por trimestres de gestación.
Proponemos: no tratar. Sus médicos/matronas deben ser insistentes en estos casos en la adecuada nutrición yódica.
PospartoRecomendamos disminuir la dosis de levotiroxina hasta la que estuviese tomando previamente a la concepción. Se repetirá analítica a las 6-8 semanas de la reducción de dosis, dado que en pacientes con tiroiditis de Hashimoto se ha descrito que hasta en un 50% de los casos es necesario modificar las dosis respecto a la preconcepcional. La lactancia natural se considera compatible con el tratamiento con levotiroxina.
HipertiroidismoEl hiperC presenta una prevalencia en torno al 0,4-1,7% de las gestaciones25. Generalmente se diagnostica en el 1.°T. Aunque el hipertiroidismo de cualquier causa podría complicar la gestación, son la enfermedad de Graves y el hipertiroidismo mediado por hCG (hipertiroidismo gestacional) las causas más comunes. La enfermedad de Graves puede reactivarse en 1.°T, y suele ser menos severa en las fases más tardías del embarazo, por atenuación de la autoinmunidad. Las consecuencias obstétricas del hiperC son aumento de frecuencia de abortos, parto pretérmino, preclampsia-eclampsia, bajo peso al nacer e hipertiroidismo en el recién nacido26. El hipertiroidismo gestacional (mediado por hCG) puede ocurrir transitoriamente en el 1.°T y es típicamente menos severo que el de Graves (es la causa más común del hiperSC en gestantes). No tiene implicaciones negativas conocidas para la gestación.
El diagnóstico se hace por la clínica y la exploración física: presencia de bocio, oftalmopatía tiroidea, signos de hipertiroidismo y analítica concordante: TSH suprimida con T4L y/o T3L elevadas. La positividad de TRAb confirmará el diagnóstico de enfermedad de Graves1. El diagnóstico diferencial con el hipertiroidismo gestacional se realiza porque, en este, la clínica puede estar ausente o ser leve y además mejora a partir de la 12-14 semana de gestación (coincidiendo con la disminución de los niveles de hCG) y porque, normalmente, no existe bocio ni oftalmopatía tiroidea y los TRAb son negativos. En la mayoría de casos suele presentarse como un hiperSC: TSH suprimida con T4L y T3L normales. El hiperSC gestacional no se asocia habitualmente con efectos adversos durante el embarazo, y no requiere tratamiento25,27, es siempre transitorio y podría ser considerado como un hallazgo fisiológico. A medida que avanza el embarazo las concentraciones de HT libres disminuyen y la TSH aumenta ligeramente o se normaliza.
RecomendacionesHipertiroidismo previamente diagnosticado28Se recomienda evitar gestación hasta la estabilización de la enfermedad, ya sea tras tratamiento definitivo o retirada de la medicación sin recidiva. Tras tratamiento con yodo radiactivo o realización de gammagrafía o rastreo debe demorarse la gestación más de 6 meses. Si la paciente ya estaba previamente dada de alta y controlada en atención primaria (AP) se vigilará estrechamente la función tiroidea en la primera mitad de la gestación (cada 4-6 semanas), y si presenta una recidiva será remitida a endocrinología a la mayor brevedad posible. En mujeres que están con tratamiento antitiroideo (AT) al confirmar gestación, si la T4L previa (reciente) era normal se sugiere suspender dicho tratamiento. Si la T4L estaba francamente elevada previamente o en 1.°T es deseable el cambio a PTU con la menor demora posible, por lo que debe negociarse una revisión preferente por especialista.
Hipertiroidismo detectado durante la gestación por cribadoAnte TSH suprimida se realizan automáticamente por el laboratorio determinación de T4L, T3L y TRAb. En caso de hiperC con TRAb positivos el endocrinólogo indicará tratamiento con AT utilizando en primer trimestre propiltiouracilo (PTU) y en 2.°T y 3.°T derivados imidazólicos para evitar la hepatotoxicidad del PTU25,29–31. Tanto PTU como metimazol y su derivado carbimazol (MM/CBM) se han relacionado con malformaciones fetales (hipospadias), sin embargo se han descrito más frecuentes y específicas con MM/CBM en el primer trimestre (atresia coanal y esofágica, onfalocele, anomalías del ductus onfalomesentérico, aplasia cutis y de cuero cabelludo), por lo que se recomienda la utilización de PTU en el primer trimestre y reintroducir metimazol o carbimazol a partir del segundo trimestre32.
Se recomiendan dosis bajas de AT: PTU 100-150mg/día en dosis fraccionadas, metimazol 5-10mg/día o carbimazol 5-15mg/día (en 2.° y 3.°T). Se hará determinación de HT a las 3-4 semanas de iniciado el tratamiento para ajuste de dosis, con el objetivo de mantener T4L en el límite superior de la normalidad (LSN) de los VR. Se incluirá control de enzimas hepáticas y hemograma para descartar posibles efectos secundarios. Adicionalmente se recomienda la determinación de TRAb entre la 24 y 28SG, ya que su paso transplacentario podría provocar bocio y un hipertiroidismo fetal o neonatal; así como controles ecográficos del feto para monitorizar aparición de bocio, crecimiento fetal, FC fetal y otros signos de hipertiroidismo. En caso de que la mujer presente clínica adrenérgica se pueden utilizar bloqueadores beta, como atenolol de 25 a 50mg/día o propranolol 10-20mg cada 6-8h modificando según la clínica (no más de 6 semanas).
No se recomienda tratar el hipertiroidismo gestacional o el hiperSC.
En caso de hiperC se debe derivar a endocrinología a la paciente a la mayor brevedad posible para valorar la necesidad de tratamiento.
En el posparto se debe realizar control de HT en el caso de la enfermedad de Graves, ya que esta puede reactivarse.
Evaluación fetal y del recién nacidoEl obstetra vigilará con controles ultrasonográficos mensuales la evolución del feto (crecimiento, presencia de bocio y signos de hipertiroidismo), especialmente en 3.°T. Si el título de TRAb excede 3 veces el LSN se estrechará la monitorización fetal. Si hay signos de afectación fetal la madre puede requerir dosis mayores de antitiroideos (o reiniciar, si es preciso, combinados con levotiroxina)1,2,31.
Al recién nacido de madre con enfermedad tiroidea se le realizará el cribado neonatal habitual de metabolopatías en sangre seca de talón extraída al tercer día de vida (40-72h). Solo en hijos de madres con TRAb positivos y/o que hayan recibido tratamiento AT durante el embarazo se realizará una extracción venosa para análisis en suero de TSH, T4L, T3L, TRAb y AcTPO a la semana de vida.
Recidiva del hipertiroidismo autoinmune en postparto/lactanciaEl metimazol a dosis <30mg/día y en 2.° línea y el PTU a dosis <300mg/día se consideran seguros en la lactancia; se recomienda administrarlos en dosis divididas y después de las tomas.
Tiroiditis posparto1,28Recomendación: no se recomienda cribado universal, sí selectivo, en caso de enfermedad autoinmune previa (diabetes tipo 1, enfermedad de Graves en remisión, hepatitis viral crónica, lupus eritematoso sistémico, etc.), antecedentes personales de tiroiditis postparto, TPO positivos pregestación o en 1.°T de gestación, mujeres con historia o clínica de depresión posparto, o sintomatología sugestiva de disfunción tiroidea. Se realizará mediante determinación de TSH y T4L a los 3-6 meses posparto por parte del médico de AP.
Tratamiento y monitorización: la fase hipertiroidea no precisa tratamiento en la gran mayoría de los casos, ya que suele ser autolimitada; no se recomienda el uso de AT ni suspender la lactancia materna. En casos muy sintomáticos se podrían utilizar bloqueadores beta a la mínima dosis que controle la sintomatología. En caso de lactancia materna es de elección el propranolol, por haberse comprobado su seguridad en la lactancia.
Tras la resolución de esta fase se recomienda realizar un control de TSH cada 2-3 meses —o antes si hay clínica— hasta el año del posparto como cribado de posible fase hipotiroidea. Durante la fase de hipotiroidismo puede encontrarse T4L baja con TSH aún frenada o normal, por lo que debe incluirse la determinación de T4L y no solo de la TSH. Se recomienda iniciar tratamiento con levotiroxina si hay cualquiera de las siguientes condiciones: deseo gestacional, lactancia materna, especialmente si la mujer refiere o se sospecha hipogalactia, clínica de hipofunción tiroidea, TSH elevada durante más de 6 meses (o en un plazo menor de forma individualizada, en función del nivel absoluto de TSH) y/o T4L baja.
Recomendamos valorar la retirada de levotiroxina a los 6-12 meses de su inicio (especialmente si no ha sido necesaria dosis altas y/o se han negativizado los TPO). Cuando la dosis utilizada es menor de 50μg/día se puede suspender el tratamiento directamente. En caso de utilizar dosis mayores de 50μg al día se debe reducir la dosis progresivamente haciendo controles de TSH periódicos (al principio cada 6 meses y luego anuales).
En caso de lactancia materna o deseo gestacional a corto plazo se mantendrá el tratamiento con levotiroxina sin intentar la retirada.
Si tras la retirada o la evolución espontánea la mujer se mantiene eutiroidea sin levotiroxina, se recomienda realizar una determinación anual de TSH como cribado de hipotiroidismo, dado que el haber desarrollado una tiroiditis posparto aumenta la probabilidad de presentar hipotiroidismo en el futuro.
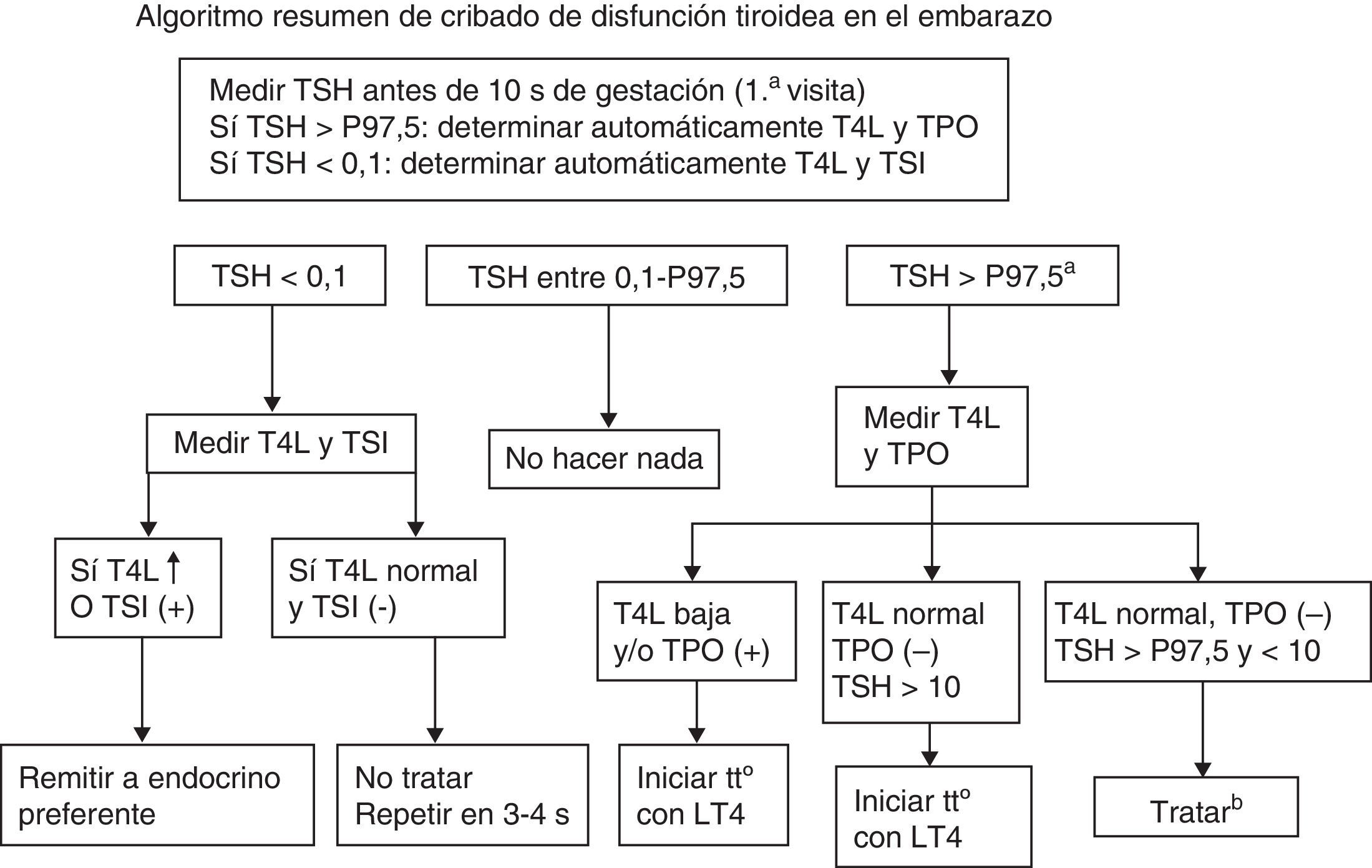
En la figura 2 se resume un algoritmo de diagnóstico y tratamiento en disfunción tiroidea y gestación que esquematiza la esencia del presente documento, y en la tabla 4 se resumen los puntos clave de diagnóstico, seguimiento y actitud en los distintos niveles asistenciales que intervienen en el seguimiento de las pacientes.
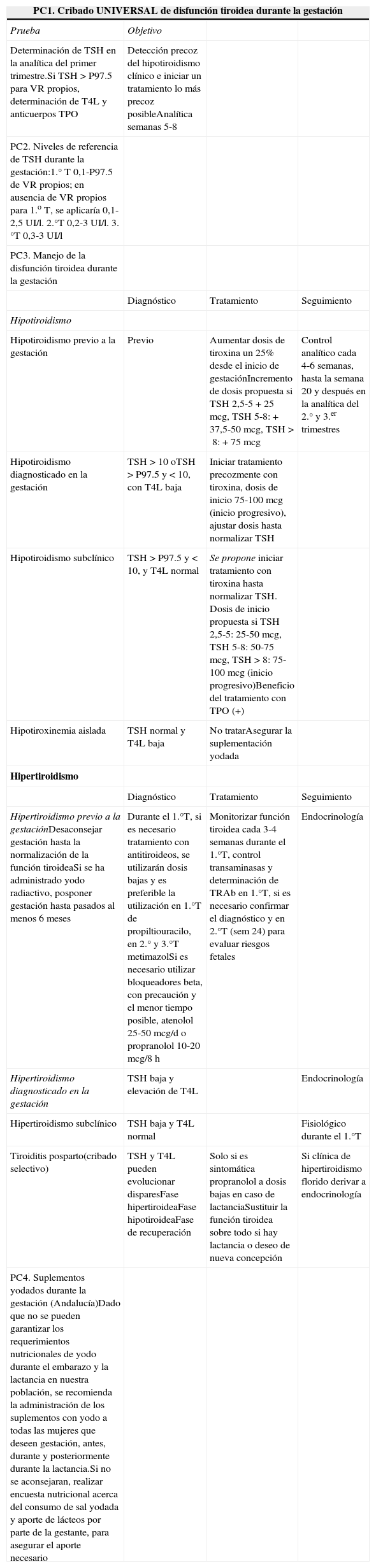
Puntos clave desde el punto de vista de atención primaria en el manejo de la disfunción tiroidea durante la gestación
| PC1. Cribado UNIVERSAL de disfunción tiroidea durante la gestación | |||
|---|---|---|---|
| Prueba | Objetivo | ||
| Determinación de TSH en la analítica del primer trimestre.Si TSH>P97.5 para VR propios, determinación de T4L y anticuerpos TPO | Detección precoz del hipotiroidismo clínico e iniciar un tratamiento lo más precoz posibleAnalítica semanas 5-8 | ||
| PC2. Niveles de referencia de TSH durante la gestación:1.° T 0,1-P97.5 de VR propios; en ausencia de VR propios para 1.o T, se aplicaría 0,1-2,5UI/l. 2.°T 0,2-3 UI/l. 3.°T 0,3-3 UI/l | |||
| PC3. Manejo de la disfunción tiroidea durante la gestación | |||
| Diagnóstico | Tratamiento | Seguimiento | |
| Hipotiroidismo | |||
| Hipotiroidismo previo a la gestación | Previo | Aumentar dosis de tiroxina un 25% desde el inicio de gestaciónIncremento de dosis propuesta si TSH 2,5-5+25mcg, TSH 5-8:+37,5-50mcg, TSH>8: +75mcg | Control analítico cada 4-6 semanas, hasta la semana 20 y después en la analítica del 2.° y 3.er trimestres |
| Hipotiroidismo diagnosticado en la gestación | TSH>10 oTSH>P97.5 y <10, con T4L baja | Iniciar tratamiento precozmente con tiroxina, dosis de inicio 75-100 mcg (inicio progresivo), ajustar dosis hasta normalizar TSH | |
| Hipotiroidismo subclínico | TSH>P97.5 y <10, y T4L normal | Se propone iniciar tratamiento con tiroxina hasta normalizar TSH. Dosis de inicio propuesta si TSH 2,5-5: 25-50mcg, TSH 5-8: 50-75 mcg, TSH>8: 75-100mcg (inicio progresivo)Beneficio del tratamiento con TPO (+) | |
| Hipotiroxinemia aislada | TSH normal y T4L baja | No tratarAsegurar la suplementación yodada | |
| Hipertiroidismo | |||
| Diagnóstico | Tratamiento | Seguimiento | |
| Hipertiroidismo previo a la gestaciónDesaconsejar gestación hasta la normalización de la función tiroideaSi se ha administrado yodo radiactivo, posponer gestación hasta pasados al menos 6 meses | Durante el 1.°T, si es necesario tratamiento con antitiroideos, se utilizarán dosis bajas y es preferible la utilización en 1.°T de propiltiouracilo, en 2.° y 3.°T metimazolSi es necesario utilizar bloqueadores beta, con precaución y el menor tiempo posible, atenolol 25-50mcg/d o propranolol 10-20mcg/8h | Monitorizar función tiroidea cada 3-4 semanas durante el 1.°T, control transaminasas y determinación de TRAb en 1.°T, si es necesario confirmar el diagnóstico y en 2.°T (sem 24) para evaluar riesgos fetales | Endocrinología |
| Hipertiroidismo diagnosticado en la gestación | TSH baja y elevación de T4L | Endocrinología | |
| Hipertiroidismo subclínico | TSH baja y T4L normal | Fisiológico durante el 1.°T | |
| Tiroiditis posparto(cribado selectivo) | TSH y T4L pueden evolucionar disparesFase hipertiroideaFase hipotiroideaFase de recuperación | Solo si es sintomática propranolol a dosis bajas en caso de lactanciaSustituir la función tiroidea sobre todo si hay lactancia o deseo de nueva concepción | Si clínica de hipertiroidismo florido derivar a endocrinología |
| PC4. Suplementos yodados durante la gestación (Andalucía)Dado que no se pueden garantizar los requerimientos nutricionales de yodo durante el embarazo y la lactancia en nuestra población, se recomienda la administración de los suplementos con yodo a todas las mujeres que deseen gestación, antes, durante y posteriormente durante la lactancia.Si no se aconsejaran, realizar encuesta nutricional acerca del consumo de sal yodada y aporte de lácteos por parte de la gestante, para asegurar el aporte necesario | |||
Modificada de M. Paz Pérez Unanua, SEMERGEN.
Los colaboradores en la elaboración de este documento no han recibido financiación de entidades públicas o privadas para llevarlo a cabo.
Los autores firmantes han contado con la colaboración de los miembros del grupo de trabajo de disfunción tiroidea y cáncer de tiroides de la Sociedad Andaluza de Endocrinología: María Victoria Cózar León, Amor García Valero, María Laínez López, María José López Pérez, Jose Luis Robles Rodríguez, Federico Soriguer, Cristina López Tinoco, Guillermo Martínez de Pinillos Gordillo y Federico Soriguer Escofet. Igualmente agradecen a la Dra. M. Paz Pérez Unanua, de SEMERGEN, la elaboración de las recomendaciones de seguimiento y derivación de atención primaria.