Los inhibidores de la bomba de protones (IBP) son el subgrupo farmacológico más prescrito del Sistema Nacional de Salud y su uso se ha relacionado con posibles efectos adversos, potencialmente graves.
ObjetivoRevisar las indicaciones actuales de tratamiento con IBP así como los datos relacionados con su seguridad, con el fin de promover su uso adecuado.
Material y métodosSe ha realizado una revisión de la literatura orientada a los siguientes temas: a) moléculas y mecanismo de acción; b) indicaciones actuales de tratamiento y adherencia; c) efectos adversos relacionados con su uso; d) interacciones farmacológicas; e) alternativas en deprescripción.
ResultadosLas indicaciones actuales no han variado sustancialmente en los últimos años y están bien establecidas; sin embargo, existe un elevado porcentaje de prescripción inadecuada, sobre todo en individuos de bajo o nulo riesgo.
ConclusionesLos IBP son fármacos seguros y en general bien tolerados y sus beneficios superan a los posibles efectos adversos. Adherirse a las recomendaciones basadas en la evidencia representa el único enfoque racional de una terapia efectiva y segura.
Proton pump inhibitors (PPIs) are the most prescribed pharmacological subgroup of the National Health System and their use has been related to possible potentially serious adverse effects.
ObjectiveTo review the current indications for treatment with PPIs as well as the data related to their safety, in order to promote their adecuate use.
Material and methodsA review of the literature focused on the following topics has been carried out: a) molecules and mechanism of action; b) current indications for treatment and adherence to them; c) adverse effects related to its use; d) drug interactions; e) alternatives in deprescription.
ResultsThe current indications have not changed substantially in recent years and are well established, however, there is a high percentage of inappropriate prescription, mainly in individuals with low or no risk.
ConclusionsPPIs are safe drugs and generally well tolerated and their benefits are higher than possible adverse effects. Adhering to evidence-based recommendations represents the only rational approach to safe and effective therapy.
Los IBP son el subgrupo farmacológico, dentro de los antiulcerosos, más prescrito del Sistema Nacional de Salud, con un profundo impacto positivo en pacientes con enfermedad péptica ácida desde su introducción en la práctica clínica a finales de la década de 1990. Alrededor de una de cada 10 personas toma un IBP a diario, una cantidad significativamente superior a la de otros países europeos, no justificable por los datos epidemiológicos disponibles, lo que hace cuestionarse tanto la adecuación como la duración de los tratamientos1,2.
El consumo de antiulcerosos en España ha pasado de 33,3 dosis por cada 1.000 habitantes y día en el año 2000 a 136,8 en 2012, lo que equivale a un incremento del 310,4%, debido en parte a un aumento del consumo de IBP (más del 500%).
Estos últimos son el grupo más utilizado en todo el período, que ha pasado de representar el 65,4% del consumo total de antiulcerosos en el año 2000 al 96,2% en 2012, en gran parte, debido a su buena tolerabilidad, perfil de seguridad y efectividad3. Se consideran fármacos de consumo elevado y en expansión dentro del Sistema Nacional de Salud.
Los IBP están indicados sobre todo en enfermedades relacionadas con la secreción ácida gástrica, en la que han demostrado ser más eficaces que otros antiulcerosos, como los antagonistas de los receptores H2 de la histamina (anti-H2), así como para la prevención de la úlcera gastroduodenal inducida por antiinflamatorios no esteroideos (AINE) en pacientes de riesgo4. Son fármacos seguros en tratamientos a corto plazo (4-8 semanas), no obstante, su consumo puede entrañar algunos riesgos5. Según las fuentes consultadas, entre un 25 y un 70% de su prescripción es inadecuada en cuanto a la indicación, dosificación o duración de los tratamientos6.
En España su prescripción es un 70% superior a la media europea, mayoritariamente relacionada con prescripción inadecuada7 en individuos con bajo o nulo riesgo4,6. Otros factores que han podido influir en su difusión han sido la comercialización de diferentes moléculas con numerosas marcas y equivalentes farmacéuticos, el precio reducido de algunos medicamentos, como omeprazol, y su mayor accesibilidad en las oficinas de farmacia, mediante dispensación sin receta médica durante largo tiempo2. La prescripción inadecuada de IBP es un problema común y afecta a todos los niveles asistenciales. En concreto, la hospitalización se considera como un factor de riesgo, pues alrededor de los 2/3 de las prescripciones inadecuadas se iniciaron en el hospital7 (tabla 1).
Situaciones en las que no es adecuado el tratamiento con IBP
| Esteroides, bifosfonatos o ISRS en monoterapiaa |
| Profilaxis de gastropatía en pacientes en tratamiento crónico con AINE/AAS/ COXIB con edad < 65 años o sin otros factores de riesgoa |
| Tratamiento con anticoagulantes (heparina de bajo peso molecular, warfarina) o antiagregantes (ticlopidina, clopidogrel) en pacientes sin factores de riesgoa |
| Tratamiento con antibióticos o quimioterapiaa |
| Pacientes con hepatopatía crónica e hipertensión portala |
| Pacientes con gastritis atrófica multifocala |
| Pacientes con gastrectomía parcial o totala |
| Pacientes con pirosis de origen funcional (secundaria a transgresiones dietéticas o estilos de vida) |
| Dispepsia en pacientes con síntomas funcionales de síndrome de distrés pospandial (dismotilidad) |
| Pirosis en embarazadasb |
Los estudios disponibles evaluaron la eficacia de antiácidos, sucralfato y acupuntura, pero no de IBP. No hay datos disponibles sobre tasa de malformaciones, probabilidad de inducir parto prematuro, retraso del crecimiento intrauterino ni bajo peso al nacer41.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en octubre de 2019 ordenó la retirada de los medicamentos que contenían ranitidina por vía oral tras detectarse nitrosaminas8, y esto ha supuesto un desplazamiento de la prescripción a otras sustancias, incluidos los IBP.
En los pacientes ancianos hay que prestar especial atención e intentar prevenir reacciones adversas relevantes, pues en ellos suelen confluir la polifarmacia, la prescripción potencialmente inadecuada, la pluripatología y los cambios fisiológicos propios del envejecimiento. A diferencia de lo que sucede en otros órganos y sistemas, la mayoría de los cambios fisiológicos que acontecen en el aparato digestivo asociados al envejecimiento no son graves, aunque sí pueden ser relevantes, especialmente en sujetos en situaciones de estrés y enfermedad9.
ObjetivosLos objetivos de este trabajo son, por un lado, revisar las indicaciones actuales de tratamiento con IBP así como los datos relacionados con su seguridad con el fin de promover un uso adecuado.
Por otro, sensibilizar a los profesionales sanitarios sobre el problema que supone su uso masivo e indiscriminado, ayudarles a determinar cuándo utilizarlos e identificar aquellas situaciones en las que no están indicados y cómo deprescribirlos.
Material y métodosPara el presente trabajo se ha realizado una revisión de la literatura orientada a los siguientes temas: a) moléculas y mecanismo de acción; b) indicaciones actuales de tratamiento y adherencia; c) efectos adversos relacionados con su uso; d) interacciones farmacológicas y e) alternativas en deprescripción.
Para ello se han realizado búsquedas bibliográficas en las bases de datos de MEDLINE (PubMed) y Cochrane Library así como en otros recursos (Clinical Key, Up to Date), guías de práctica clínica, documentos de consenso, revisiones sistemáticas y metaanálisis.
Moléculas disponibles en el mercadoLos antiulcerosos actúan por diversos mecanismos para la reducción de la acidez gástrica6:
- -
Inhibiendo la producción de ácido por competencia reversible de la unión de histamina a los receptores H2 de la membrana basolateral de las células parietales (anti-H2).
- -
Inactivando de forma irreversible la bomba de H+/K+ATPasa gástrica.
- -
Incrementando la defensa de la barrera mucosa gástrica (análogos de la prostaglandina o sucralfato).
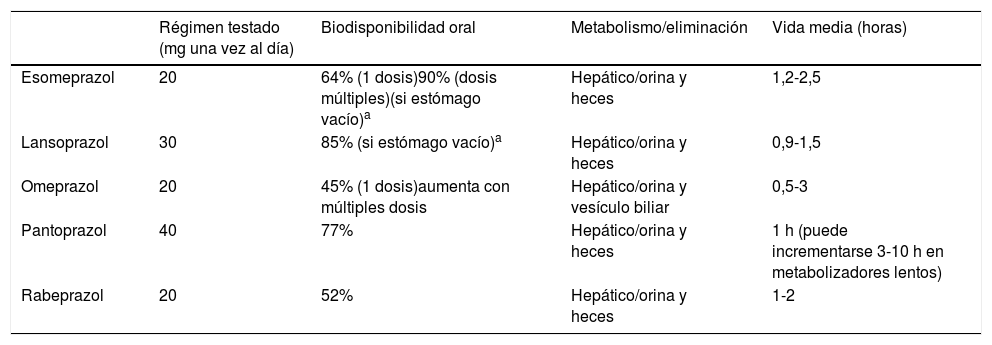
Los IBP son los supresores más potentes de la secreción ácida gástrica, ya que disminuyen un 80-95% la producción diaria de ácido (basal y estimulada) y, aunque su semivida en plasma es corta (1-2h), su efecto es más prolongado debido a que la inhibición que provocan es irreversible y requiere de la síntesis de nuevas bombas de protones para reanudar la secreción ácida. La máxima supresión ácida se alcanza, en promedio, entre el 3.° y el 5.° día de tratamiento10. Aunque son similares en estructura y mecanismo de acción, a nivel celular pueden existir diferencias entre las moléculas (tabla 2) en lo que respecta a la velocidad con la que estos IBP se ligan y disocian de la H+/K ± ATPasa, pero la magnitud de estas diferencias es pequeña y su relevancia clínica no se ha demostrado. No existen diferencias importantes entre los IBP disponibles actualmente para uso clínico (grado de recomendación A)11. Por consiguiente, pueden ser intercambiables en la práctica clínica, siempre que se utilicen en dosis equipotenciales (tabla 3), a excepción de determinadas interacciones medicamentosas12.
Metabolismo IBP
| Régimen testado (mg una vez al día) | Biodisponibilidad oral | Metabolismo/eliminación | Vida media (horas) | |
|---|---|---|---|---|
| Esomeprazol | 20 | 64% (1 dosis)90% (dosis múltiples)(si estómago vacío)a | Hepático/orina y heces | 1,2-2,5 |
| Lansoprazol | 30 | 85% (si estómago vacío)a | Hepático/orina y heces | 0,9-1,5 |
| Omeprazol | 20 | 45% (1 dosis)aumenta con múltiples dosis | Hepático/orina y vesículo biliar | 0,5-3 |
| Pantoprazol | 40 | 77% | Hepático/orina y heces | 1 h (puede incrementarse 3-10 h en metabolizadores lentos) |
| Rabeprazol | 20 | 52% | Hepático/orina y heces | 1-2 |
Fuente: modificada de Wolfe14.
Actualmente en España hay comercializadas 5moléculas: omeprazol, lansoprazol, rabeprazol, pantoprazol y esomeprazol. El omeprazol es el IBP de elección, por ser el de uso más extendido y, además, el de menor coste, por lo que su prescripción se considera la más eficiente6.
El momento de su administración tiene importantes implicaciones clínicas, y ello se debe a que la cantidad de H-K-ATPasa presente en la célula parietal es mayor después de un ayuno prolongado, por lo que deben administrarse antes de la primera comida del día: se aconseja que la toma se realice de 30 a 60 min antes del desayuno para conseguir la máxima inhibición de la bomba de protones10,13,14.
En la mayoría de los individuos, una dosis diaria es suficiente para producir el nivel deseado de inhibición ácida, aunque, si se precisa, se debe administrar una segunda dosis antes de la cena. En este sentido, la administración 2veces al día produce un efecto en el pH gástrico mucho más lineal y mantenido en el tiempo15.
Los IBP están indicados principalmente en los siguientes supuestos7,16,17 (tabla 4):
- -
Úlcera gástrica, duodenal.
- -
Síndrome de Zollinger-Ellison.
- -
Prevención de úlcera gastroduodenal en relación con el tratamiento con AINE/ácido acetilsalicílico (AAS).
- -
Profilaxis de úlceras por estrés.
- -
Erradicación de Helicobacter pylori.
- -
Sangrado gastrointestinal superior.
- -
Enfermedad por reflujo gastroesofágico (de leve a moderada).
- -
Dispepsia funcional no investigada (paciente menor de 55 años sin síntomas de alarma).
- -
Esofagitis eosinofílica.
Indicaciones de tratamiento con IBP
| 1. IBP en enfermedad por reflujo gastroesofágico1.1 En pacientes con síntomas típicos de enfermedad por reflujo gastroesofágico hay que considerar como primera opción el tratamiento con IBP. Son efectivos en tratamiento a corto plazo (4-8 semanas), tanto en esofagitis erosiva como en esofagitis no erosiva (nivel de evidencia: alto; grado de recomendación: fuerte)1.2 Los IBP están también indicados en el tratamiento de mantenimiento de las úlceras endoscópicas en esofagitis erosiva y para el control de síntomas en la enfermedad por reflujo gastroesofágico no erosiva. El tratamiento a largo plazo puede ser de forma continua o a demanda (nivel de evidencia: alto; grado de recomendación: fuerte)1.3 En pacientes con enfermedad por reflujo gastroesofágico y síntomas extraesofágicos, puede intentarse un tratamiento a corto plazo (4-8 semanas) con doble dosis de IBP. Sin embargo, hay que enfatizar que el beneficio en esta indicación es muy controvertido, particularmente en casos de laringitis por reflujo y asma (nivel de evidencia: bajo; grado de recomendación: condicional)1. 4 En pacientes con enfermedad por reflujo gastroesofágico complicada, como estenosis esofágica o esófago de Barrett, deben prescribirse IBP a largo plazo. A pesar de que en enfermedad de Barrett no han demostrado que disminuyan de forma significativa la longitud de la mucosa con cambios metaplásicos, hay algunas evidencias que apoyan que el tratamiento crónico con una dosis diaria permite inducir una menor tasa de transformación de la metaplasia mucosa en displasia (nivel de evidencia: bajo; grado de recomendación: condicional) |
| 2. IBP en esofagitis eosinofílicaEn pacientes con esofagitis eosinofílica se debe intentar un tratamiento con IBP a corto plazo (8-12 semanas), porque aproximadamente un 30-50% de ellos responden con esta terapia. En el grupo que sí responde a la terapia, esta se debe mantener a largo plazo (nivel de evidencia: moderado; grado de recomendación: fuerte) |
| 3. IBP en infección por Helicobacter pylori y úlcera pépticaEn pacientes con infección por H. pylori, los IBP son un componente clave en los regímenes habituales del tratamiento erradicador; debe administrarse 2 veces al día durante 7-14 días (nivel de evidencia: alto; grado de recomendación: fuerte) |
| 4. IBP y AINE4.1 Aquellos pacientes en tratamiento con AINE o AAS tienen mayor riesgo de desarrollar úlceras gástricas en presencia de una serie de condiciones predisponentes. Se ha demostrado que los IBP son la principal terapia a corto plazo (4-8 semanas) en la curación de estas lesiones (nivel de evidencia: alto; grado de recomendación: fuerte)4.2 En aquellos pacientes en tratamiento a largo plazo con AINE, COXIB o incluso una dosis baja de AAS que, además, presenten factores de riesgo que predispongan a la formación de úlceras, está indicado el tratamiento con dosis bajas de IBP como tratamiento preventivo (nivel de evidencia: alto; grado de recomendación: fuerte) |
| 5. IBP y hemorragia digestiva altaEn pacientes con úlceras sangrantes, los procedimientos endoscópicos representan el pilar del tratamiento, pero se ha demostrado que la coadministración de IBP es de gran ayuda para disminuir las secuelas de una hemorragia reciente. Pueden administrarse de forma intravenosa, en bolo o en infusión continua, particularmente después de la endoscopia (nivel de evidencia: moderado; grado de recomendación: fuerte) |
| 6. IBP en profilaxis de úlceras de estrésEn pacientes graves ingresados en la unidad de cuidados intensivos y en riesgo de desarrollar una úlcera de estrés, los IBP pueden prevenir la aparición de dichas lesiones y sus complicaciones, especialmente el sangrado. Las situaciones clínicas de mayor riesgo implican a aquellos pacientes que requieren de ventilación mecánica durante más de 48 h y a aquellos que presentan coagulopatía (nivel de evidencia: moderado; grado de recomendación: fuerte) |
| 7. IBP y síndrome de Zollinger-EllisonEn aquellos pacientes con problemas de hipersecreción ácida, como el síndrome de Zollinger-Ellison, los IBP representan el mejor tratamiento médico para mantener unos niveles adecuados de secreción ácida. Cuando la opción quirúrgica no es posible, la terapia antisecretora debe mantenerse de forma indefinida (nivel de evidencia: alto; grado de recomendación: fuerte) |
| 8. IBP y dispepsia8.1) En pacientes con dispepsia funcional puede indicarse el tratamiento a corto plazo (4-8 semanas), particularmente en aquellos con síndrome de dolor epigástrico (síntomas predominantes de úlcera o reflujo). Sin embargo, es obligatoria una reevaluación del paciente para evitar una prescripción excesiva (nivel de evidencia: bajo; grado de recomendación: condicional)8.2) En pacientes en tratamiento con AINE, COXIB o AAS que presenten dispepsia sin lesiones visibles en mucosa gástrica pueden recibir un ciclo corto de tratamiento (4-8 semanas), aunque el mecanismo que induce tales síntomas no está completamente claro (nivel de evidencia: bajo; grado de recomendación: condicional) |
Actualmente, el consumo de los denominados protectores gástricos es muy elevado y la indicación de protección se ha extendido al alivio de cualquier molestia dispéptica producida por medicamentos.
En general, el término gastroprotección hace referencia al tratamiento con AINE, AAS a dosis bajas y, en algunos casos, a antiagregantes; sin embargo, existen otros fármacos potencialmente gastrolesivos (paracetamol, tramadol, anticoagulantes, corticoides, inhibidores selectivos de la recaptación de serotonina [ISRS]), en los que los IBP podrían ser beneficiosos en la prevención de complicaciones gastrointestinales2,4.
No todos los pacientes tienen el mismo riesgo de desarrollar complicaciones gastrointestinales graves como consecuencia de la ingesta de fármacos gastrolesivos, si bien es un riesgo que se acentúa en determinadas situaciones3,13.
Antiinflamatorios no esteroideosSon analgésicos, antitérmicos y antiinflamatorios que impiden la síntesis de prostaglandinas mediante la inhibición competitiva y reversible de la actividad ciclooxigenasa 1 y 2 (COX-1 y COX-2). Teóricamente la acción antiinflamatoria depende de la inhibición de la COX-2, mientras que los efectos secundarios sobre la mucosa gastrointestinal están relacionados con la inhibición de la COX-11.
Los inhibidores selectivos de la COX-2 (coxib) son más seguros que los AINE no selectivos en el ámbito gastrointestinal, aunque también presentan riesgo de sangrado4. El uso de COXIB disminuye las complicaciones en el tracto gastrointestinal alto y bajo, y son superiores a la combinación de un AINE clásico con un IBP en la prevención de lesiones del tracto gastrointestinal bajo (nivel de evidencia 1, grado de recomendación A)18.
El consumo de AINE incrementa el riesgo de complicaciones digestivas, independientemente de la dosis y del tiempo de tratamiento, y puede afectar a cualquier tramo del aparato digestivo. Los IBP han demostrado que disminuyen el riesgo de úlceras endoscópicas duodenales y gástricas relacionadas con el uso de AINE y ningún IBP ha demostrado ser superior a otro para esta indicación, siempre que se usen en dosis equipotenciales (grado de recomendación A)12.
Existen una serie de factores de riesgo que predisponen para al desarrollo de complicaciones gastrointestinales relacionadas con el uso de AINE19,20:
- •
Antecedente de úlcera péptica.
- •
Edad ≥ 65 años. En función de la fuente consultada, el punto de corte puede situarse en los 60 años18.
- •
AINE a dosis altas.
- •
Uso de 2 o más AINE.
- •
Terapia concomitante con anticoagulantes, ISRS, antiagregantes plaquetarios, corticoides.
- •
Enfermedades comórbidas graves (cardiovasculares y renales).
- •
Infección por H. pylori. En usuarios de AINE, la erradicación de H. pylori previene de la recurrencia de úlcera péptica.
- •
Tipo de AINE y riesgo relativo (RR) de complicaciones gastrointestinales.
- -
RR < 2 (aceclofenaco, ibuprofeno, celecoxib).
- -
RR 2-4 (rofecoxib, meloxicam, nimesulide, sulindaco, diclofenaco, ketoprofeno).
- -
RR 4-5 (tenoxicam, naproxeno, indometacina, diflunisal).
- -
RR > 5 (piroxicam, azapropazona, ketorolaco).
De todos ellos, la edad y el antecedente de úlcera péptica son los que más peso tienen. La edad supone un incremento del riesgo en un 4% cada año21,22. Por todo ello, se debe hacer una evaluación personalizada del perfil de riesgo gastrointestinal basal de cada paciente y de cada AINE18.
De este modo, el riesgo gastrointestinal quedaría clasificado de la siguiente forma:
- •
Riesgo alto: antecedente de úlcera péptica complicada, empleo de anticoagulantes o combinación de más de 2 factores de riesgo restantes.
- •
Riesgo moderado: pacientes no anticoagulados ni con antecedentes de úlcera complicada, pero que presentan algún factor de riesgo aislado.
- •
Riesgo bajo: pacientes sin factores de riesgo, que no toman ácido acetilsalicílico.
Respecto a su acción gastrolesiva, en nuestro medio un 14,5% de las hemorragias digestivas altas son atribuibles a antiagregantes plaquetarios1. El fármaco más utilizado bajo esta indicación es el AAS que, incluso a dosis bajas, aumenta la probabilidad de complicaciones gastrointestinales, por lo que a los pacientes con factores de riesgo (edad > 70 años, antecedentes de úlcera péptica, uso conjunto con AINE o doble antiagregación) se les debe indicar gastroprotección con IBP23,24.
Respecto a clopidogrel, en el año 2010 la AEMPS emitió una nota informativa en la que desaconsejaba su uso junto con omeprazol y esomeprazol, debido a que podría reducir los niveles del metabolito activo de clopidogrel y, por tanto, su efecto antiagregante25. En caso de precisar protección gástrica (doble terapia antiplaquetaria o antecedente de sangrado digestivo), rabeprazol o pantoprazol podrían usarse con menor riesgo26,27.
AnticoagulantesSe considera adecuada la profilaxis con IBP en personas anticoaguladas con antecedentes de hemorragias digestivas altas o úlcera péptica y cuando se asocia a otros fármacos gastrolesivos. Habrá que individualizar la prevención en presencia de otras condiciones clínicas, como la edad, la comorbilidad, la fragilidad, etc.28.
CorticoidesEl riesgo relativo de efectos adversos gastrointestinales asociado a los corticoides por vía sistémica varía entre 1,1 (no significativo) y 1,5 (marginalmente significativo)29. Sin embargo, utilizados conjuntamente con AINE se cuadruplica el riesgo de gastrolesividad respecto a personas que no consumen ninguno de estos 2fármacos, por lo que en esta situación se recomienda gastroprotección.
En la actualidad, no existen unas directrices claras ni estudios que permitan establecer unas recomendaciones precisas; solo existe evidencia en los casos ya descritos, en tratamiento concomitante con AINE o antiagregante o en pacientes de alto riesgo de hemorragia digestiva13.
Por todo ello, se propone valorar individualmente cada caso en función de otros factores como la dosis de corticoide, la duración del tratamiento o la morbilidad asociada.
AntidepresivosLa serotonina se libera de las plaquetas como respuesta a una lesión vascular y promueve la vasoconstricción y la agregación plaquetaria. La serotonina no es sintetizada en las plaquetas. Los ISRS inhiben el transportador de la serotonina, que es el responsable de su captación en las plaquetas1; en consecuencia, incrementan modestamente el riesgo de sangrado gastrointestinal30. Este riesgo aumenta cuando existe infección por H. pylori, en pacientes con historia de úlcera péptica, conforme aumenta la edad del paciente, la duración del tratamiento o cuando se asocian otros fármacos gastrolesivos, especialmente AINE, por lo que se recomienda asociar gastroprotección con IBP en estas situaciones31. Esta recomendación también puede ser aplicable a venlafaxina32. Como alternativa en estos pacientes, se propone utilizar antidepresivos no ISRS (mianserina, mirtazapina, moclobemida o trazodona) para el manejo farmacológico de su trastorno depresivo33.
Analgésicos distintos de los antiinflamatorios no esteroideosSon analgésicos y antipiréticos. No se recomienda gastroprotección en pacientes en tratamiento con paracetamol a dosis inferiores a los 4g/día. En aquellos pacientes que toman paracetamol y AINE o paracetamol e inhibidor de la COX-2, se propone la gastroprotección en caso de AINE o del inhibidor COX-2, independientemente de la dosis de paracetamol1. La coadministración de AAS y paracetamol no parece incrementar el daño mucoso gastroduodenal respecto al uso de AAS solo18.
Metamizol sí parece inducir un ligero incremento del riesgo de hemorragia digestiva alta, aunque este riesgo es inferior al atribuido a tratamiento con AINE y AAS34. Podría recomendarse la utilización de un IBP en pacientes de alto riesgo1.
Efectos secundariosLos IBP ajustados a su indicación y duración apropiadas son generalmente bien tolerados y presentan un buen perfil de seguridad, con una tasa de eventos adversos del 1 al 3% y sin diferencias significativas entre unos y otros17. Sin embargo, a menudo se prescriben de manera inapropiada, sobre todo en ancianos.
En estudios recientes han sido relacionados con efectos adversos, que, aunque poco frecuentes, pueden ser potencialmente graves y de gran impacto, dado su uso extendido, por lo que debe considerarse su valoración beneficio-riesgo35,36.
A pesar de todo lo anterior, los beneficios del tratamiento con IBP, en general, superan a los riesgos potenciales en la mayoría de los pacientes, que tienen una indicación relevante y adecuada16.
Infección por Clostridium difficileSe han publicado estudios que han evaluado el efecto del tratamiento con IBP en la incidencia y recurrencia de esta infección37.
Un metaanalisis publicado en 2017, basado en 50 estudios observacionales, detectó que el uso de IBP se asoció significativamente con un mayor riesgo de infección por C. difficile, incluso en ausencia de toma de antibióticos. Este riesgo parece ser mayor con los IBP en comparación con los anti-H2, lo que indica una relación entre la supresión de ácido gástrico y el desarrollo de esta infección38.
Una revisión de varios estudios observacionales encontró un aumento de hasta el 65% en la incidencia de infección por C. difficile entre los pacientes que recibieron IBP. También se ha asociado a una recurrencia. Sin embargo, los estudios con análisis multivariante establecieron que el uso de IBP no se asociaba a infección por C. difficile grave o complicada, a fracaso en el tratamiento o a recurrencia, por lo que esta asociación pudiera considerarse inconsistente39.
También se ha vinculado el uso de IBP a otras infecciones entéricas, como la salmonelosis y la campilobacteriosis. Sin embargo, el mecanismo fisiopatológico implicado en el aumento del riesgo de infección no está claro40.
Colitis microscópicaEl uso de IBP se ha asociado con colitis microscópica, incluida la colitis linfocítica y colágena, en varios estudios de casos y controles. No está claro si esta asociación varía según el IBP y si existe una relación dosis-respuesta en la dosis o la duración del tratamiento41,42.
NeumoníaDiferentes estudios observacionales han detectado que el uso de los IBP se asocia a un incremento en la frecuencia de neumonías. El aumento del pH gástrico relacionado con la toma de IBP originaría un sobrecrecimiento de la flora bacteriana gastrointestinal que produciría una invasión pulmonar por broncoaspiración40. No obstante, se necesitan más estudios de calidad para confirmar o refutar cualquier relación causal con neumonía adquirida por la comunidad, especialmente en usuarios a largo plazo7,16,17.
CandidiasisSe ha documentado un aumento de las infecciones por cándida (predominantemente Candida albicans) en la boca, el esófago, el estómago y el intestino delgado superior de los usuarios de IBP17,43.
Alteraciones en la absorciónLa aclorhidria que producen los IBP podría alterar la absorción de vitamina B1, hierro y magnesio, especialmente en tratamientos prolongados.
HipomagnesemiaLos IBP pueden causar hipomagnesemia debido a una reducción en su absorción intestinal, aunque la heterogeneidad de los estudios no permite llegar a una conclusión definitiva. El riesgo de hipomagnesemia parece ser mayor en pacientes que han recibido IBP a largo plazo (en general, más de un año), pero se han notificado casos dentro del año siguiente al inicio de la terapia con IBP44.
En 2011, la AEMPS y la Food and Drug Administration emitieron una serie de recomendaciones dirigidas a valorar la determinación de niveles de magnesio (tanto antes como durante el tratamiento) en pacientes con terapias prolongadas con IBP y que además se encontraran en tratamiento con fármacos que puedan inducir hipomagnesemia como digoxina, diuréticos etc.39,45.
HipocalcemiaEl uso a largo plazo de IBP se ha relacionado con una disminución en la absorción enteral de calcio. Sin embargo, su mecanismo no influye en la absorción de sales de calcio solubles en agua o del calcio procedente de alimentos complejos, como la leche o el queso u otros productos lácteos46. En cuanto al calcio insoluble, como el carbonato cálcico, para que se produzca una absorción óptima se requiere de un ambiente ácido y, aunque la hipoclorhidria podría reducir en teoría dicho proceso, este efecto puede superarse mediante la ingesta de una comida ligeramente ácida14. Cuando la suplementación de calcio es necesaria en pacientes que toman IBP, utilizamos suplementos de calcio que no requieren ácido para la absorción, como el citrato de calcio47. No obstante, no hay datos suficientes en este momento para hacer recomendaciones sobre la necesidad de suplementos de calcio en pacientes en tratamiento con IBP46.
Fractura óseaEn marzo de 2012, la AEMPS emitió un informe en el que concluía que los IBP se asocian a un incremento moderado del riesgo de fracturas óseas (vertebrales, de cadera y de muñeca), particularmente cuando se utilizan durante períodos prolongados (más de un año), a dosis elevadas y sobre todo en personas de edad avanzada o con factores de riesgo48. El uso de IBP podría aumentar el riesgo de fractura, pero no está asociado con la pérdida acelerada de densidad mineral ósea49.
Déficit de vitamina B12El uso prolongado de IBP se ha asociado a un posible aumento del diagnóstico de déficit de vitamina B12, de mayor magnitud cuando se utilizan dosis elevadas5,35.
No obstante, con la evidencia disponible no existe justificación para modificar la práctica clínica habitual. En personas de edad avanzada, y especialmente en aquellas con algún factor de riesgo para el déficit de esta vitamina, como la presencia de enfermedad de Crohn, antecedentes de cirugía gástrica y/o intestinal, anemia perniciosa, dietas vegetarianas estrictas o desnutrición, parece razonable evaluar los depósitos de cobalamina a los 2-3 años de tratamiento, con un seguimiento anual/bianual, pautando tratamiento sustitutivo si se detecta la carencia vitamínica7. No se recomienda, por tanto, controlar de forma generalizada los niveles de vitamina B12 en pacientes que reciben tratamiento con IBP a largo plazo39 ni incrementar su ingesta50.
Déficit de hierroEl ácido gástrico desempeña un papel en la absorción de hierro no hemo y el uso de IBP se ha asociado con una disminución de la absorción de hierro. Sin embargo, en la mayoría de los casos, la disminución de la absorción no parece tener importancia clínica. Una excepción puede ser el caso de aquellos pacientes que requieren suplementos de hierro por vía oral. Dichos pacientes pueden necesitar una dosis más alta o una mayor duración de la suplementación51.
Hipersecreción ácida de reboteEn algunos estudios se ha demostrado una hipersecreción ácida de rebote cuando se interrumpe la terapia antisecretora tras un período prolongado de uso, sin embargo, este efecto puede producirse en períodos más cortos de tiempo (8 semanas)52. Se han planteado diferentes estrategias para minimizar este efecto, como una reducción gradual o sustituir el IBP por un anti-H2, aunque ningún enfoque es aceptado universalmente.
NeoplasiasLa hipergastrinemia producida por los IBP induce la hiperplasia de células enterocromafines y aumento del riesgo de tumores carcinoides35. El significado patológico de esta situación no está claro y, aunque el uso prolongado de IBP (superior a 12 meses) se asocia al desarrollo de pólipos glandulares fúndicos53, estos desaparecen al suspender el tratamiento54. Diversos metaanálisis y estudios observacionales muestran una relación incierta para el desarrollo de cáncer gástrico y no significativa para lesiones preneoplásicas. A este respecto, se considera mecanismo biológico plausible el efecto sinérgico de la infección por H. pylori y el tratamiento con IBP, dado que su uso crónico en pacientes infectados se asocia a gastritis atrófica gástrica y metaplasia intestinal12,55.
Por lo que respecta a otras neoplasias gastrointestinales, hasta el momento no se ha comprobado una asociación con el cáncer colorrectal y los estudios epidemiológicos no han demostrado una asociación entre el consumo de los IBP y el cáncer pancreático o esofágico13.
Nefritis intersticial aguda y enfermedad renal crónicaLa nefritis intersticial aguda se ha relacionado principalmente con AINE, analgésicos y antibióticos, pero en los últimos años los centros de farmacovigilancia señalan a los IBP como fármacos implicados en el proceso, independientemente de la dosis utilizada, y como la causa más frecuente de nefritis intersticial aguda35.
El mecanismo para el desarrollo del daño renal puede ser el resultado de una nefritis intersticial aguda subclínica, que si no se trata progresa a lesión de la nefrona. Según algunos estudios, el inicio y el uso acumulativo de IBP se han asociado con el riesgo de enfermedad renal39,56,57.
Existe también un pequeño aumento del riesgo de enfermedad renal crónica en los usuarios de IBP a largo plazo, probablemente como resultado de una nefritis intersticial aguda no diagnosticada o residual inducida por el IBP35,39,57,58. Sin embargo, no se han propuesto recomendaciones para controlar la función renal en pacientes que reciben IBP a largo plazo39.
Cirrosis hepáticaNumerosos estudios han señalado que el uso de IBP en pacientes con cirrosis incrementa el riesgo de peritonitis bacteriana espontánea, pero otros arrojan conclusiones opuestas40. Se precisan más estudios prospectivos, bien diseñados, para clarificar la relación de los diferentes tipos de IBP con el riesgo de infección en pacientes cirróticos, así como el potencial efecto de la dosis y duración de la terapia. Por otro lado, la secreción ácida está reducida en estos pacientes, por lo que no hay suficiente evidencia que indique su uso como profilaxis de complicaciones pépticas en pacientes con gastropatía de la hipertensión portal o varices esofágicas7.
DemenciaUn número limitado de estudios ha abordado esta asociación y, aunque en un modelo de ratón el uso de IBP en dosis muy altas aumentó el nivel de amiloide en el cerebro, los datos que vinculan estos fármacos con el desarrollo de la demencia en humanos son contradictorios17,59. Por otro lado, una serie de estudios recientes han señalado un mayor riesgo de deterioro cognitivo y diagnóstico de demencia entre las personas que consumen IBP, pero, con base en la literatura actual, esta asociación está limitada por problemas metodológicos, por lo que se requieren más estudios longitudinales para determinar cualquier relación causal40,59,60 y para establecer si la reducción del uso de IBP en los ancianos puede prevenir el desarrollo de demencia55.
Síndrome confusionalSe encontró que los IBP eran un factor independiente asociado con el desarrollo del delirio en pacientes geriátricos, probablemente secundario a interacciones medicamentosas derivadas de la polifarmacia17.
Infarto agudo de miocardioNo se ha demostrado relación causal. Los IBP no se relacionan con daño endotelial. Se precisan más estudios de calidad, que deben estar libres de factores de confusión, para confirmar cualquier asociación16,17,61.
Otras reacciones idiosincrásicasLa polimiositis y otras miopatías, incluida la rabdomiólisis, se han descrito con todos los IBP, así como reacciones de hipersensibilidad inmediata y retardada, con reactividad cruzada entre ellos17.
Interacciones farmacológicasLas interacciones farmacológicas derivadas del uso de IBP se deben fundamentalmente a 2mecanismos: en la absorción y por inhibición del citocromo P450. Son más frecuentes en algunas poblaciones de pacientes (por ejemplo, con sida o cáncer) y sus manifestaciones clínicas pueden depender de ciertos factores, como el estado del genotipo de enzimas, la etnia y el régimen farmacológico17 (tabla 5).
Relación de interacciones farmacológicas en tratamiento conjunto con IBP
| AAS | El uso junto con omeprazol, lansoprazol y esomeprazol no afecta a la efectividad del antiagregante. No hay datos sobre otros IBP (nivel de evidencia 1b)66 |
| Clopidogrel | El uso conjunto de IBP con clopidogrel incrementa el riesgo de eventos cardiovasculares mayores, pero su efecto sobre la mortalidad global no ha podido ser demostrado (nivel de evidencia 1a)27,67 |
| Prasugrel | Sus niveles no se ven afectados si se utiliza conjuntamente con omeprazol, lansoprazol, pantoprazol o esomeprazol (nivel de evidencia 2b)66 |
| Anticoagulantes orales | Esomeprazol y omeprazol disminuyen el aclaramiento de warfarina63, pero, respecto a cuáles son las implicaciones clínicas, los datos son insuficientes (nivel de evidencia 1b); sin embargo, no se ve afectada su efectividad si se utiliza junto con pantoprazol (nivel de evidencia 2b)66En general, en el tratamiento con anticoagulantes orales antagonistas de la vitamina K, no se considera necesario sustituir omeprazol por otro IBP, solo ajustar la dosis del anticoagulante según el valor del international normalized ratio pues no parece alterar este valor de forma significativa ni aumentar el riesgo de complicaciones5,13,35Respecto a los nuevos anticoagulantes orales directos, no existe una interacción demostrada entre los IBP y dichos fármacos68-71 |
| Teofilina | No se precisa reajustar el tratamiento en pacientes que estén utilizándola junto con lansoprazol, pantoprazol y omeprazol (nivel de evidencia 1b) y rabeprazol (nivel de evidencia 4)No hay suficientes datos respecto a esomeprazol63,66 |
| Inhibidores de la proteasa | Se desaconseja su uso debido a que se produce una reducción significativa de su biodisponibilidad, ya que la absorción de estos depende del pH ácido intragástrico66Contraindicado uso de nelfinavir y esomeprazol6 |
| Digoxina | Los niveles de digoxina no aumentan si se utiliza conjuntamente con pantoprazol, pero los datos en la literatura son escasosOmeprazol sí incrementa los niveles de digoxina en sangre. No hay suficientes datos respecto a otros IBP (nivel de evidencia 2b)63,66 |
| Diazepam | Los IBP pueden aumentar los niveles séricos de las benzodiacepinas metabolizadas por oxidación (diazepam, flurazepam, triazolam, alprazolam, clonazepam, midazolam), excluyendo el lorazepam y oxazepam que se metabolizan por conjugación6,28El uso de omeprazol y esomeprazol puede aumentar los niveles de diazepam en sangre al disminuir su aclaramiento66A las dosis recomendadas, una interacción farmacocinética entre benzodiazepinas e IBP es menos probable con pantoprazol, lansoprazol y rabeprazol63 que con omeprazol. En consecuencia, esos fármacos IBP podrían considerarse en sujetos polimedicados52 |
| Metotrexato | Sus niveles en sangre se elevan con el uso conjunto con IBP72,73 |
| Anticonceptivos orales | No hay evidencia de interacciones farmacológicas entre pantoprazol y anticonceptivos orales63. No hay datos respecto a otros IBP (nivel de evidencia 2b) |
| Levotiroxina | La interacción de IBP con levotiroxina está descrita; puede afectar esta combinación a la eficacia de levotiroxina28,55,74Se recomienda, por tanto, que la pauta de levotiroxina se tome 1 hora antes o 4 horas después de la administración de los IBP23Pantoprazol no modifica sus niveles en sangre. No hay datos respecto a otros IBP (nivel de evidencia 2b)63,66 |
| Itraconazol oral | Los IBP pueden reducir su eficacia (nivel de evidencia 2b)66 |
En algunos estudios se ha demostrado una eficacia similar en lo que respecta a la supresión ácida, al comparar omeprazol, lansoprazol, rabeprazol y pantoprazol. El esomeprazol tiene un mayor grado de supresión ácida, con un período más prolongado de pH intragástrico > 4. Sin embargo, la interacción dependiente del pH gástrico es específica de la clase y no parece ser notablemente diferente entre los IBP62.
El mayor número de interacciones de los IBP se produce por vía del citocromo P450, ya que omeprazol y esomeprazol se comportan como inhibidores del isoenzima CYP2C196.
Lansoprazol, pantoprazol y rabeprazol presentan una menor incidencia de interacciones farmacológicas respecto a omeprazol y esomeprazol, probablemente por su baja afinidad a complejos enzimáticos que participan en los mecanismos de eliminación de fármacos63.
La supresión ácida reduce la absorción de determinados fármacos como levotiroxina, antifúngicos azólicos (ketoconazol, itraconazol), atazanavir, cefpodoxime, enoxacina y dipiridamol, mientras que aumenta la de furosemida, AAS, nifedipino, digoxina y alendronato5,17. Solo unas pocas interacciones farmacológicas (por ejemplo, con diazepam, warfarina, fenitoína y metotrexato) que involucran a los IBP (principalmente omeprazol y lansoprazol) son de importancia clínica, por tratarse de fármacos con estrecho rango terapéutico17.
Deprescripción de inhibidores de la bomba de protonesLa deprescripción de IBP es un proceso que puede incluir la interrupción del tratamiento, bien por cese definitivo, bien por disminución gradual o bien por la sustitución por otro fármaco antiulceroso (anti-H2)64. Las recomendaciones actuales sobre el uso de IBP van dirigidas a una adecuada valoración del paciente y al ajuste a la indicación y pautas recomendadas.
Serán candidatos a la retirada de IBP35,64:
- •
Pacientes asintomáticos sin indicación clara de tratamiento.
- •
Pacientes en los que, teniendo una indicación adecuada, la duración de los tratamientos exceden las recomendaciones establecidas:
- -
más de 4 semanas en dispepsia.
- -
más de 8 semanas en enfermedad por reflujo gastroesofágico. En estos pacientes asintomáticos, después de 3 meses de tratamiento con IBP, se debería iniciar el proceso de disminución de la dosis pautada.
La deprescripción puede realizarse de 2formas:
- •
En pacientes con tratamientos prolongados con IBP, superiores a 6meses o con tratamientos a dosis altas o moderadas, o en aquellos pacientes que llevan 3 meses asintomáticos, se puede plantear reducir la dosis semanal en un 50%, para evitar así el efecto de hipersecreción de rebote ácido. Una vez establecida la dosis menor, mantener esta durante una semana y luego suspender el tratamiento.
- •
Aumentar el intervalo de la dosis pautada cada 48-72 h.
No hay ningún método específico para la interrupción de IBP. Una reciente revisión sistemática pone de manifiesto que hasta en un 64% de sujetos es posible una interrupción exitosa del tratamiento con IBP sin que haya un deterioro del control sintomático, y que la disminución progresiva puede ser más exitosa que una interrupción brusca. Además se observó que el porcentaje de sujetos que consiguieron una suspensión completa fue mayor en aquellos sin diagnóstico de enfermedad por reflujo gastroesofágico35.
Está disponible una directriz de la Red Canadiense de Deprescripción, no financiada por la industria, con relación a cuándo y cómo reducir de forma segura los IBP65.
ConclusionesEn general, los IBP son fármacos bien tolerados, no obstante, han sido considerados simples «protectores gástricos», prácticamente sin efectos secundarios, lo que ha disparado su uso, a menudo sin una indicación clara o incluso con síntomas no asociados con la hipersecreción ácida.
Se han registrado varios efectos adversos potencialmente graves asociados al uso continuado de IBP a largo plazo, pero la evidencia que respalda tal asociación es difícil de interpretar, de peso insuficiente y en muchas ocasiones sesgada.
Las recomendaciones para prescribir IBP de forma adecuada son:
- 1.
Revisar las indicaciones de uso y su vigencia. El error de indicación más frecuente es la profilaxis innecesaria de lesiones gastroduodenales en pacientes con bajo o nulo riesgo gastrolesivo.
- 2.
Valorar la población candidata al tratamiento. La población anciana es un colectivo que frecuentemente recibe tratamientos inadecuados con IBP.
- 3.
Evitar utilizar dosis elevadas y tratamientos prolongados innecesarios. En situaciones crónicas, como la enfermedad por reflujo gastroesofágico, solo una minoría de los pacientes requiere tratamientos de larga duración y, tras un período de tratamiento adecuado, es posible plantearse una reducción o suspensión.
- 4.
Verificar los tratamientos en las transiciones asistenciales. Se estima que un alto porcentaje de las prescripciones de IBP son inadecuadas, y que la hospitalización es un factor de riesgo para esta inadecuación, dado que, en la mayoría de los casos, son tratamientos que se prolongan de manera injustificada tras el alta.
- 5.
Detectar duplicidades derivadas de la atención en distintos niveles asistenciales. En este sentido, la prescripción por principio activo puede prevenirlas.
- 6.
Explicar al paciente la posibilidad de retirada del fármaco cuando no sea necesario, haciéndole partícipe de las distintas posibilidades terapéuticas.
Por último, para contribuir a la sostenibilidad del sistema sanitario público, se debe tener en cuenta que, aunque todos los IBP son igualmente efectivos, cuando se emplean en dosis equipotentes, omeprazol es el de menor coste. Por ello, a igualdad de eficacia y de seguridad, omeprazol es el fármaco más eficiente y debe ser el de elección, a excepción de para aquellos pacientes en tratamiento con clopidogrel o con interacciones justificadas, en los que esté indicado otro IBP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.