La combinación a dosis fija de fluticasona propionato/formoterol es una nueva combinación de un glucocorticoide inhalado y un agonista β2-adrenérgico de acción larga ampliamente conocidos y utilizados, disponibles por primera vez en un mismo dispositivo. Esta combinación a dosis fija de fluticasona propionato/formoterol ha demostrado su perfil de eficacia y seguridad en distintos ensayos clínicos frente a sus componentes individuales y otras combinaciones a dosis fijas de glucocorticoide inhalado/agonista β2-adrenérgico de acción larga, y está indicada para el tratamiento del asma persistente en adultos y adolescentes. Fluticasona propionato/formoterol está disponible en un amplio rango de dosis, que permite cubrir adecuadamente los escalones terapéuticos recomendados por las guías terapéuticas, y constituye una combinación a dosis fija de glucocorticoide inhalado/agonista β2-adrenérgico de acción larga eficaz, rápida, bien tolerada y con un coste de adquisición razonable. Esta combinación ha sido posicionada por los distintos organismos evaluadores de las comunidades autónomas como alternativa terapéutica adecuada para el asma en el ámbito de la atención primaria.
The fixed-dose combination fluticasone propionate/formoterol (FPF) is a novel combination of a widely known and used inhaled glucocorticoid (IGC) and a long-acting β2-adrenergic agonist (LABA), available for the first time in a single device. This fixed-dose combination of FPF has a demonstrated efficacy and safety profile in clinical trials compared with its individual components and other fixed-dose combinations of IGC/LABA and is indicated for the treatment of persistent asthma in adults and adolescents. FPF is available in a wide range of doses that can adequately cover the therapeutic steps recommended by treatment guidelines, constituting a fixed-dose combination of GCI/LABA that is effective, rapid, well tolerated and with a reasonable acquisition cost. Various assessment agencies of the Spanish Autonomous Communities consider this combination to be an appropriate alternative therapy for asthma in the primary care setting.
El asma es una enfermedad crónica y potencialmente grave, que cursa con síntomas como sibilancias, dificultad respiratoria, opresión torácica y tos, que tienen un curso variable en presencia, frecuencia e intensidad1. La enfermedad supone una carga importante para la sociedad1, se estima que entre el 1 y el 2% del gasto sanitario total se dedica a financiar los costes derivados del asma en países desarrollados2.
La prevalencia de asma en España supera el 5% en adultos y el 10% en población pediátrica, con gran variabilidad geográfica3. En nuestro medio se ha observado que los costes aumentan conforme aumenta la gravedad del asma y empeora el control de la enfermedad4,5, se estima que una tercera parte del coste es atribuible al coste farmacológico4.
De acuerdo a las guías de práctica clínica, el objetivo principal del tratamiento del asma es lograr y mantener el control de la enfermedad lo antes posible, además de prevenir las exacerbaciones y la obstrucción crónica al flujo aéreo y reducir su mortalidad6. Estos objetivos pueden conseguirse en muchos pacientes con un tratamiento adecuado, escalonando las diferentes opciones terapéuticas dependiendo de la gravedad, el grado de control de la sintomatología, la seguridad y la satisfacción del paciente6. En pacientes con síntomas ocasionales, no se aconseja un tratamiento de mantenimiento, mientras que en aquellos con asma persistente leve, ya se recomienda el mantenimiento con un glucocorticoide inhalado (GCI) (beclometasona, budesonida, ciclesonida, fluticasona o mometasona) a dosis bajas; si la enfermedad no se controla, el siguiente escalón sería la combinación de un GCI a dosis baja con un agonista β2-adrenérgico de acción larga (LABA) (salmeterol, formoterol o vilanterol) inhalados, ya que pueden administrarse preferiblemente en un mismo dispositivo; en escalones posteriores se irá aumentado la dosis del GCI6.
Recientemente se ha autorizado en España la asociación a dosis fija de un GCI (fluticasona propionato) y un LABA (formoterol) (FPF), en forma de suspensión para inhalación en envase a presión (MDI), que anteriormente estaban solo disponibles por separado. En este artículo se revisa la farmacología, eficacia, tolerabilidad y seguridad de esta combinación de FPF.
FarmacologíaFluticasona propionato es un GCI trifluorado sintético, con una potente actividad antiinflamatoria cuando se administra por vía inhalatoria y con una mayor eficacia y seguridad que cuando se administran los corticosteroides por vía sistémica7. Formoterol fumarato es un LABA que actúa localmente en el pulmón como broncodilatador con un comienzo de acción rápido7. El comienzo de la broncodilatación con formoterol (1-3 min) es similar al de salbutamol y más rápido que el del LABA salmeterol8,9.
Por su parte, el comienzo de la broncodilatación con FPF es significativamente más rápido que con fluticasona/salmeterol, y esta diferencia se mantiene tras 12 semanas de tratamiento en adultos con asma persistente moderada a grave10. Respecto a las equipotencias de los LABA, una dosis de salmeterol de 50 μg se estima que corresponde a una dosis de formoterol de 9 μg (intervalo de confianza del 95%, 3-19 μg)9.
La utilidad clínica de la combinación de un GCI y un LABA está ampliamente sustentada a lo largo de las últimas 2 décadas11. La combinación ha mostrado efectos sinérgicos del GCI respecto al LABA y viceversa12-15. Además, in vitro se ha demostrado que la acción de ambos fármacos inhibe la proliferación de células de la musculatura lisa del árbol bronquial y que tiene efectos sobre la remodelación de las vías aéreas en el asma13. También debe resaltarse la importancia de la “codeposición” cuando los 2 fármacos se administran en un mismo inhalador, superior a su uso con inhaladores por separado16,17.
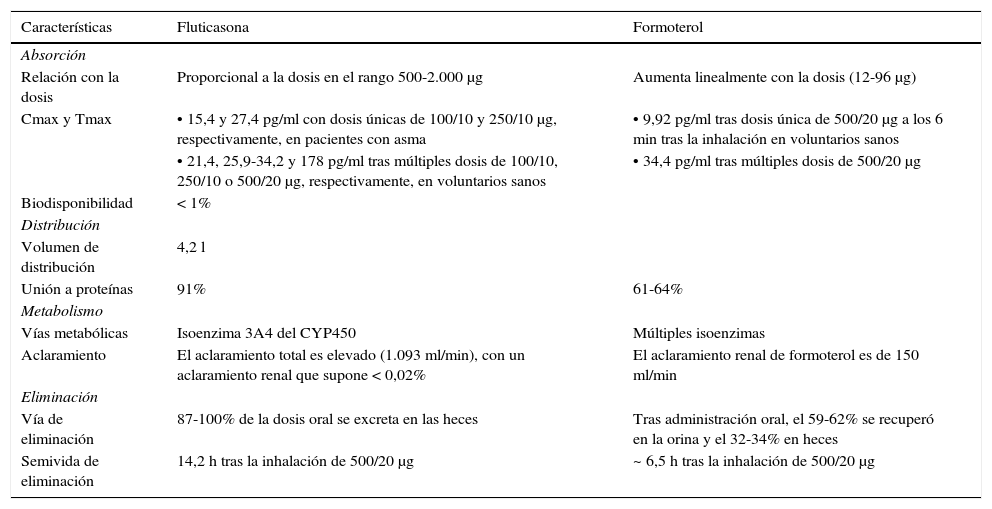
En la tabla 1 se resumen las principales características farmacocinéticas de fluticasona y formoterol. Los datos farmacocinéticos provenientes de estudios que utilizaron la combinación FPF son limitados7.
Principales características farmacocinéticas de fluticasona/formoterol.
| Características | Fluticasona | Formoterol |
|---|---|---|
| Absorción | ||
| Relación con la dosis | Proporcional a la dosis en el rango 500-2.000 μg | Aumenta linealmente con la dosis (12-96 μg) |
| Cmax y Tmax | • 15,4 y 27,4 pg/ml con dosis únicas de 100/10 y 250/10 μg, respectivamente, en pacientes con asma | • 9,92 pg/ml tras dosis única de 500/20 μg a los 6 min tras la inhalación en voluntarios sanos |
| • 21,4, 25,9-34,2 y 178 pg/ml tras múltiples dosis de 100/10, 250/10 o 500/20 μg, respectivamente, en voluntarios sanos | • 34,4 pg/ml tras múltiples dosis de 500/20 μg | |
| Biodisponibilidad | < 1% | |
| Distribución | ||
| Volumen de distribución | 4,2 l | |
| Unión a proteínas | 91% | 61-64% |
| Metabolismo | ||
| Vías metabólicas | Isoenzima 3A4 del CYP450 | Múltiples isoenzimas |
| Aclaramiento | El aclaramiento total es elevado (1.093 ml/min), con un aclaramiento renal que supone < 0,02% | El aclaramiento renal de formoterol es de 150 ml/min |
| Eliminación | ||
| Vía de eliminación | 87-100% de la dosis oral se excreta en las heces | Tras administración oral, el 59-62% se recuperó en la orina y el 32-34% en heces |
| Semivida de eliminación | 14,2 h tras la inhalación de 500/20 μg | ~ 6,5 h tras la inhalación de 500/20 μg |
Cmax: concentración máxima; CYP: citocromo P450; Tmax: tiempo hasta alcanzar la concentración máxima.
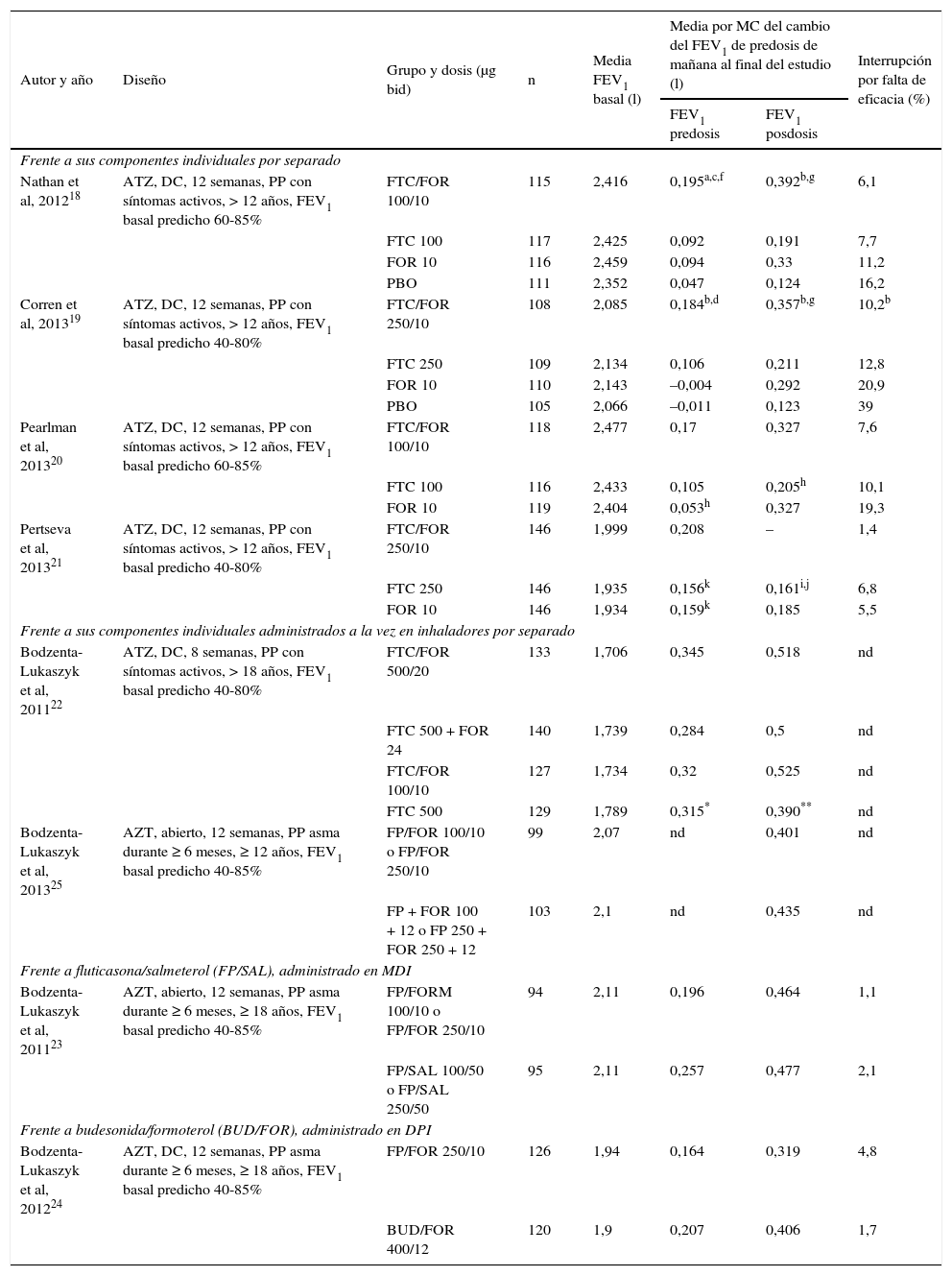
La eficacia de FPF en pacientes con asma persistente se ha evaluado en 8 ensayos clínicos de fase III de 8-12 semanas18-25. Cuatro de estos estudios, realizados en pacientes de al menos 12 años de edad con asma persistente, compararon FPF, a dosis de 100/10 o 250/10 μg 2 veces al día, frente a los componentes individuales en monoterapia utilizando un diseño aleatorizado, doble ciego y paralelo18-21, y en 2 de los ensayos se incluyó un grupo placebo18,19. En 2 ensayos clínicos aleatorizados, paralelos y con hipótesis de no inferioridad se comparó FPF frente a la inhalación de ambos componentes individuales administrados de forma concomitante pero por separado22,25; uno de los estudios fue además a doble ciego y evaluó dosis de 100/10 o 500/20 μg 2 veces al día en adultos de 18 o más años22, mientras que el segundo ensayo evaluó con un diseño no enmascarado dosis de 100/10 o 250/10 μg 2 veces al día en pacientes de al menos 12 años de edad con asma25. Finalmente, en 2 ensayos clínicos aleatorizados, de grupos paralelos y con hipótesis de no inferioridad, se compararon 100/10 o 250/10 μg 2 veces al día de FPF con combinaciones de otros GCI + LABA inhalados: FPF utilizando un diseño no enmascarado en adultos de 18 o más años23 y budenosida/formoterol con un diseño doble ciego en pacientes de 12 o más años24. Además, en un análisis de datos agrupados de 5 estudios se comparó la eficacia de FPF frente a la de fluticasona en monoterapia26, y en un estudio no comparativo de 12 meses de duración se evaluó la eficacia y seguridad de FPF en adultos y adolescentes con asma27. En la tabla 2 se resumen las características y resultados más relevantes de los estudios mencio-nados.
Eficacia de la combinación fluticasona propionato/formoterol: resumen de estudios fase III comparativos (continuación).
| Autor y año | Diseño | Grupo y dosis (μg bid) | n | Media FEV1 basal (l) | Media por MC del cambio del FEV1 de predosis de mañana al final del estudio (l) | Interrupción por falta de eficacia (%) | |
|---|---|---|---|---|---|---|---|
| FEV1 predosis | FEV1 posdosis | ||||||
| Frente a sus componentes individuales por separado | |||||||
| Nathan et al, 201218 | ATZ, DC, 12 semanas, PP con síntomas activos, > 12 años, FEV1 basal predicho 60-85% | FTC/FOR 100/10 | 115 | 2,416 | 0,195a,c,f | 0,392b,g | 6,1 |
| FTC 100 | 117 | 2,425 | 0,092 | 0,191 | 7,7 | ||
| FOR 10 | 116 | 2,459 | 0,094 | 0,33 | 11,2 | ||
| PBO | 111 | 2,352 | 0,047 | 0,124 | 16,2 | ||
| Corren et al, 201319 | ATZ, DC, 12 semanas, PP con síntomas activos, > 12 años, FEV1 basal predicho 40-80% | FTC/FOR 250/10 | 108 | 2,085 | 0,184b,d | 0,357b,g | 10,2b |
| FTC 250 | 109 | 2,134 | 0,106 | 0,211 | 12,8 | ||
| FOR 10 | 110 | 2,143 | –0,004 | 0,292 | 20,9 | ||
| PBO | 105 | 2,066 | –0,011 | 0,123 | 39 | ||
| Pearlman et al, 201320 | ATZ, DC, 12 semanas, PP con síntomas activos, > 12 años, FEV1 basal predicho 60-85% | FTC/FOR 100/10 | 118 | 2,477 | 0,17 | 0,327 | 7,6 |
| FTC 100 | 116 | 2,433 | 0,105 | 0,205h | 10,1 | ||
| FOR 10 | 119 | 2,404 | 0,053h | 0,327 | 19,3 | ||
| Pertseva et al, 201321 | ATZ, DC, 12 semanas, PP con síntomas activos, > 12 años, FEV1 basal predicho 40-80% | FTC/FOR 250/10 | 146 | 1,999 | 0,208 | – | 1,4 |
| FTC 250 | 146 | 1,935 | 0,156k | 0,161i,j | 6,8 | ||
| FOR 10 | 146 | 1,934 | 0,159k | 0,185 | 5,5 | ||
| Frente a sus componentes individuales administrados a la vez en inhaladores por separado | |||||||
| Bodzenta-Lukaszyk et al, 201122 | ATZ, DC, 8 semanas, PP con síntomas activos, > 18 años, FEV1 basal predicho 40-80% | FTC/FOR 500/20 | 133 | 1,706 | 0,345 | 0,518 | nd |
| FTC 500 + FOR 24 | 140 | 1,739 | 0,284 | 0,5 | nd | ||
| FTC/FOR 100/10 | 127 | 1,734 | 0,32 | 0,525 | nd | ||
| FTC 500 | 129 | 1,789 | 0,315* | 0,390** | nd | ||
| Bodzenta-Lukaszyk et al, 201325 | AZT, abierto, 12 semanas, PP asma durante ≥ 6 meses, ≥ 12 años, FEV1 basal predicho 40-85% | FP/FOR 100/10 o FP/FOR 250/10 | 99 | 2,07 | nd | 0,401 | nd |
| FP + FOR 100 + 12 o FP 250 + FOR 250 + 12 | 103 | 2,1 | nd | 0,435 | nd | ||
| Frente a fluticasona/salmeterol (FP/SAL), administrado en MDI | |||||||
| Bodzenta-Lukaszyk et al, 201123 | AZT, abierto, 12 semanas, PP asma durante ≥ 6 meses, ≥ 18 años, FEV1 basal predicho 40-85% | FP/FORM 100/10 o FP/FOR 250/10 | 94 | 2,11 | 0,196 | 0,464 | 1,1 |
| FP/SAL 100/50 o FP/SAL 250/50 | 95 | 2,11 | 0,257 | 0,477 | 2,1 | ||
| Frente a budesonida/formoterol (BUD/FOR), administrado en DPI | |||||||
| Bodzenta-Lukaszyk et al, 201224 | AZT, DC, 12 semanas, PP asma durante ≥ 6 meses, ≥ 18 años, FEV1 basal predicho 40-85% | FP/FOR 250/10 | 126 | 1,94 | 0,164 | 0,319 | 4,8 |
| BUD/FOR 400/12 | 120 | 1,9 | 0,207 | 0,406 | 1,7 | ||
ATZ: aleatorizado; bid: 2 veces al día; BUD: budesonida; DC: doble ciego; DPI: dispositivo de polvo seco; FEV1: flujo espiratorio forzado en 1 s; FTC: fluticasona; FOR: formoterol; MC: mínimos cuadrados; MDI: dispositivo de cartucho; PBO: placebo; PP: período de preinclusión; SAL: salmeterol.
e p < 0,05.
La combinación FPF fue por lo general bien tolerada en los pacientes estudiados, y la mayoría de los efectos adversos asociados al fármaco fueron de intensidad leve a moderada y acordes con el perfil establecido para el tratamiento con GCI y LABA.
La proporción de pacientes que experimentaron al menos un acontecimiento adverso con la combinación a dosis fija de FPF (100/10 μg 2 veces al día) (32,2%) no difirió de la de fluticasona 100 μg (39,5%), formoterol 10 μg (36,7%) o placebo (39%)18. Los acontecimientos adversos más frecuentes en todos los grupos fueron infecciones (de vías aéreas superiores, nasofaringitis y urinarias), que fueron comunicadas en el 16,9, 22,7, 11,7 y 12,7% de los pacientes de cada uno de los grupos de tratamiento, respectivamente18.
Del mismo modo, en estudios a doble ciego en pacientes con asma moderada a grave, los acontecimientos adversos más frecuentes con FPF 100/10, 250/10 o 500/20 μg administrado 2 veces al día fueron las infecciones19,22. Durante 12 semanas de tratamiento, el único acontecimiento adverso grave fue la agudización del asma, comunicado en el 4,4 y el 2,7% de los pacientes que recibieron FPF 100/10 o 250/10 μg, respectivamente, y en el 5,3, 14,4 y 19,3% de los que recibieron fluticasona 250 μg, formoterol 10 μg o placebo, respectivamente, todos ellos administrados 2 veces al día. En un ensayo de 8 semanas en adultos, la proporción de pacientes con al menos un acontecimiento adverso fue similar en los grupos que recibieron FPF 500/20 o 100/10 μg 2 veces al día (19,5 y 18,7%, respectivamente) y los que recibieron 2 veces al día la combinación de 2 inhaladores con fluticasona 500 μg y formoterol 24 μg (19,9%) o fluticasona 500 μg en monoterapia (14,2%)22.
La frecuencia de los acontecimientos adversos más frecuentes con FPF 100/10 o 250/10 μg 2 veces al día fue similar a la de fluticasona/salmeterol 100/50 o 250/50 2 veces al día en pacientes con asma leve a moderada-grave23. El perfil de tolerabilidad de FPF 250/10 μg también fue similar al de budesonida/formoterol 400/12 μg, administrado en ambos casos 2 veces al día24.
Durante el estudio a largo plazo con FPF 100/10 o 250/10 μg 2 veces al día, la incidencia de acontecimientos adversos fue del 29,9 y el 43,4%, respectivamente27. La incidencia de cualquier acontecimiento adverso grave fue del 3,1 y el 4,0%, respectivamente. Los acontecimientos adversos más frecuentes (≥ 2%) con FPF 100/10 o 250/10 μg fueron: nasofaringitis (7,6 y 11,3%, respectivamente), cefaleas (3,1 y 2,4%), faringitis (2,7 y 2,8%), infección de las vías aéreas superiores (2,7 y 2,4%), bronquitis aguda (2,7 y 1,2%), infección de las vías aéreas inferiores (2,2 y 2,8%), disnea (2,2 y 7,7%) y dolor faríngeo (2,2 y 0,4%)27.
Indicaciones y dosisLa combinación FPF está indicada para el tratamiento regular del asma, cuando la administración de una combinación (LABA + GCI) sea apropiada, esto es, para pacientes no controlados adecuadamente con GCI y con agonista β2-adrenérgico de acción corta (SABA) “a demanda” o para pacientes adecuadamente controlados con un GCI y un LABA7.
FPF se administra mediante un MDI que contiene también un indicador de dosis integrado. Cada inhalador suministra al menos 120 inhalaciones (60 dosis)7.
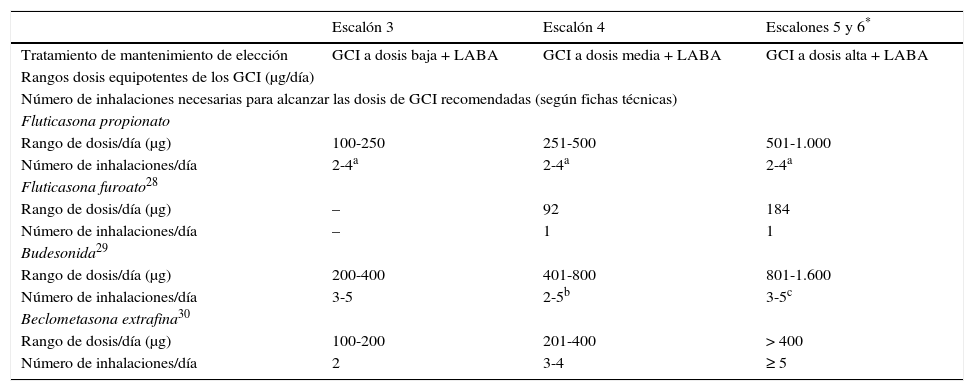
La dosis recomendada para adultos y adolescentes de 12 años o mayores es de FPF 50 μg/5 μg por inhalación, se realizan 2 inhalaciones (pulsaciones) 2 veces al día, normalmente administradas por la mañana y por la noche7. Si en un paciente el asma continúa mal controlada, la dosis total diaria del GCI puede aumentarse a 125 μg/5 μg por inhalación7. De persistir el asma mal controlada, y solo en adultos, la dosis diaria total puede aumentarse de nuevo administrando la dosis mayor: 250 μg/10 μg por inhalación7. Las 3 dosis de GCI disponibles con FPF permiten cubrir adecuadamente los rangos de dosis diarias recomendadas (tabla 3).
Rango de dosis de las distintas combinaciones GCI/LABA disponibles, para cubrir los escalones terapéuticos recomendados por la Guía Española para el Manejo del Asma (GEMA).
| Escalón 3 | Escalón 4 | Escalones 5 y 6* | |
|---|---|---|---|
| Tratamiento de mantenimiento de elección | GCI a dosis baja + LABA | GCI a dosis media + LABA | GCI a dosis alta + LABA |
| Rangos dosis equipotentes de los GCI (μg/día) | |||
| Número de inhalaciones necesarias para alcanzar las dosis de GCI recomendadas (según fichas técnicas) | |||
| Fluticasona propionato | |||
| Rango de dosis/día (μg) | 100-250 | 251-500 | 501-1.000 |
| Número de inhalaciones/día | 2-4a | 2-4a | 2-4a |
| Fluticasona furoato28 | |||
| Rango de dosis/día (μg) | – | 92 | 184 |
| Número de inhalaciones/día | – | 1 | 1 |
| Budesonida29 | |||
| Rango de dosis/día (μg) | 200-400 | 401-800 | 801-1.600 |
| Número de inhalaciones/día | 3-5 | 2-5b | 3-5c |
| Beclometasona extrafina30 | |||
| Rango de dosis/día (μg) | 100-200 | 201-400 | > 400 |
| Número de inhalaciones/día | 2 | 3-4 | ≥ 5 |
GCI: glucocorticoide inhalado; LABA: agonista β2-adrenérgico de acción larga.
FPF no debe utilizarse en niños menores de 12 años. En personas de edad avanzada no es necesario el ajuste de dosis. No hay información sobre la utilización de FPF en pacientes con insuficiencia renal o hepática, por lo que en estos pacientes debe utilizarse la dosis mínima que consiga el control de los síntomas7.
Dispositivo inhalador y tamaño de la partículaEl tamaño de las partículas de los fármacos inhalados es un factor importante en la localización y el grado en el que se depositan en los pulmones las medicaciones inhaladas para alcanzar el efecto terapéutico deseado31,32. La fracción de partículas finas (≤ 5 μm) de la dosis administrada a través de un dispositivo MDI de FPF 250/10 μg fue relativamente alta (el 40% de ambos componentes) en comparación con fluticasona/salmeterol 250/50 μg o budesonida/formoterol 400/12 μg administrados con un inhalador de polvo seco (< 20% en ambos casos). Esta emisión elevada de partículas finas se mantiene casi constante a intensidades de flujo diferentes33, lo que puede ayudar a proporcionar una dosis uniforme en cada administración, dada la elevada variabilidad que hay en las maniobras de inhalación por parte de los pacientes.
Adicionalmente, el dispositivo MDI de FPF ofrece otras novedades frente a las combinaciones GCI/LABA tradicionales: a) la nube emitida es más lenta y templada que la de fluticasona/salmeterol con dispositivo MDI34; b) permite alcanzar un elevado depósito pulmonar, con las maniobras inhalatorias adecuadas (> 40%); c) no requiere refrigeración antes de la primera dispensación por el paciente, y d) tiene un contador de dosis con un código de colores intuitivo.
Agencias evaluadorasA pesar de que los principios activos del fármaco son ampliamente conocidos, la combinación FPF ha sido revisada por distintas entidades evaluadoras a nivel internacional35,36.
En España, con el objetivo de fomentar el uso racional de los medicamentos entre los profesionales sanitarios, distintos organismos autonómicos que realizan evaluaciones sobre nuevos fármacos o sobre nuevas indicaciones autorizadas en el ámbito de la atención primaria de salud, han evaluado la combinación de FPF.
El fármaco ha sido calificado positivamente por distintas agencias evaluadoras como una combinación GCI/LABA que aporta una modesta mejoría terapéutica, por las características de los 2 principios activos incluidos en la combinación y por el precio al que se ha autorizado37-39, por lo que se ha considerado como un fármaco de uso adecuado en atención primaria y comunitaria38.
ConclusionesLa combinación a dosis fija de FPF es una nueva combinación de GCI/LABA indicada para el tratamiento del asma persistente en adultos y adolescentes. Aunque los principios activos son ampliamente conocidos y utilizados, es la primera vez que están disponibles en un mismo dispositivo.
Esta combinación ha demostrado en ensayos clínicos aleatorizados ser superior, en términos de mejoría de la función pulmonar, a los componentes individuales administrados en monoterapia y ser no inferior a la administración concomitante de los componentes individuales. También ha demostrado ser no inferior a las combinaciones a dosis fija de fluticasona/salmeterol y budesonida/formoterol, presentando respecto a la primera la ventaja de una broncodilatación más rápida. El tratamiento con FPF es, por lo general, bien tolerado y tiene un perfil de tolerabilidad similar al de los componentes individuales y otras combinaciones GCI/LABA. FPF está disponible en rango de dosis que permite cubrir adecuadamente los escalones terapéuticos recomendados por las guías de manejo del asma, y cuenta con un dispositivo inhalador MDI de nueva generación.
En conclusión, la combinación de fluticasona/formoterol constituye una alternativa terapéutica eficaz, bien tolerada, de combinaciones a dosis fija de GCI/LABA y a un coste de adquisición razonable y, como tal, ha sido posicionada en la terapéutica del asma por los distintos organismos evaluadores de las comunidades autónomas, siendo adecuada para su uso en el ámbito de la atención primaria.
AgradecimientosLos autores agradecen a Fernando Rico-Villademoros (COCIENTE S.L., Madrid) su ayuda editorial en la preparación de un borrador de este manuscrito; esta ayuda ha sido financiada por Mundipharma Pharmaceuticals, S.L.
Conflicto de interesesJ.A.Q. declara que en los últimos 3 años ha recibido honorarios por impartir conferencias y/o talleres de Almirall, Bayer, Boehringer Ingelheim, Ferrer, GSK, Novartis, Menarini, TEVA y como consultor de Almirall, Boehringer Ingelheim, Ferrer, Menarini, Novartis y Mundipharma. Ha recibido financiación para asistencia a congresos médicos de Almirall, Pfizer, Gebro, TEVA, GSK, Mundipharma y Novartis.
L.G. declara que en los últimos 3 años ha recibido honorarios por ponencias y asistencia a reuniones de Astra-Zeneca, Boehringer Ingelheim, GSK, Mundipharma, Pfizer y Teva; honorarios por consultoría de Chiesi, Mundipharma y Teva, y honorarios por investigación de GSK.
L.M.E. declara que en los últimos 3 años ha recibido honorarios por ponencias y asistencia a reuniones de Alter, Astra-Zeneca, Boehringer Ingelheim, Chiesi, Esteve, Ferrer, Glaxo-Smith-Kline, Menarini, MSD, Mundipharma, Novartis, Orion Pharma, Pfizer Takeda-Nycomed y Teva. Honorarios por consultoría de Chiesi, GSK, Mundipharma, Novartis y Teva. Fondos y becas para investigación de Novartis, Roche, Sanofi y Teva.
J.P.G. declara que en los últimos 3 años ha recibido honorarios por ponencias en congresos nacionales en actividades patrocinadas por Boehringer Ingelheim, Bayer, Daiichi-Sankyo, Pfizer-BMS, Puleva y Menarini. Honorarios como autor de múltiples publicaciones patrocinadas por Boehringer Ingelheim, Bayer y Pfizer-BMS. Honorarios por ser miembro del comité científico de los estudios: Grado de control de la ACO España, Estudio PAULA (becado por Bayer), Estudio ESCONDIDA Pacientes con FA no Anticoagulados (becado por Pfizer-BMS) y SAMOA Estudio calidad del control de la ACO en España (becado por Boehringer Ingelheim).