La diabetes mellitus (DM) es una enfermedad crónica caracterizada por la alteración del metabolismo de la glucosa. Produce una gran variedad de complicaciones sistémicas, incluyendo enfermedades cardiovasculares, nefropatías, retinopatías, dermopatías y neuropatías. Dentro de estas últimas, la alteración puede englobar al cerebro, médula espinal, pares craneales y sistema nervioso autonómico, siendo la clínica más común el dolor y las alteraciones sensitivas. La corea, más frecuentemente observada tras infartos, traumatismos craneoencefálicos y en relación con neoplasias, también se ha descrito como complicación en casos de hiperglucemias no cetósicas1,2. Esta entidad, aunque infrecuente y usualmente unilateral, supone una causa reversible de este tipo de distonías, por lo que siempre debe estar presente en el diagnóstico diferencial en este tipo de patologías.
A propósito de un caso vamos a hacer una breve revisión sobre esta infrecuente presentación de hiperglucemia no cetósica.
Caso clínicoMujer de 74 años que acudió a la consulta de Atención Primaria por cuadro de movimientos involuntarios en extremidades superiores y tronco, con empeoramiento progresivo desde hacía 3 días. Dichas alteraciones cesaban al dormir y eran generalizadas, discontinuas y de poca amplitud en inicio, siendo más amplias y continuas en el momento de la asistencia. Como antecedentes personales destacaba DM tipo 2 e hipertensión arterial. Debido a estas patologías, estaba bajo tratamiento con ramipril 5mg cada 24h, olmesartán 20mg cada 24h, metformina 850mg cada 12h y sitagliptina 25mg cada 24h. Como único antecedente destacaba el cese del tratamiento antidiabético desde el inicio de la sintomatología.
En la exploración física la paciente se encontraba afebril, con una glucemia capilar de 290mg/dL y sin alteraciones a nivel cardiopulmonar o abdominal. A nivel neurológico destacaban movimientos coreiformes en extremidades superiores, tronco y cefálicos continuos en reposo y en movimiento. La marcha era inestable. Dada la situación, la paciente fue derivada a las urgencias hospitalarias de referencia para completar el estudio.
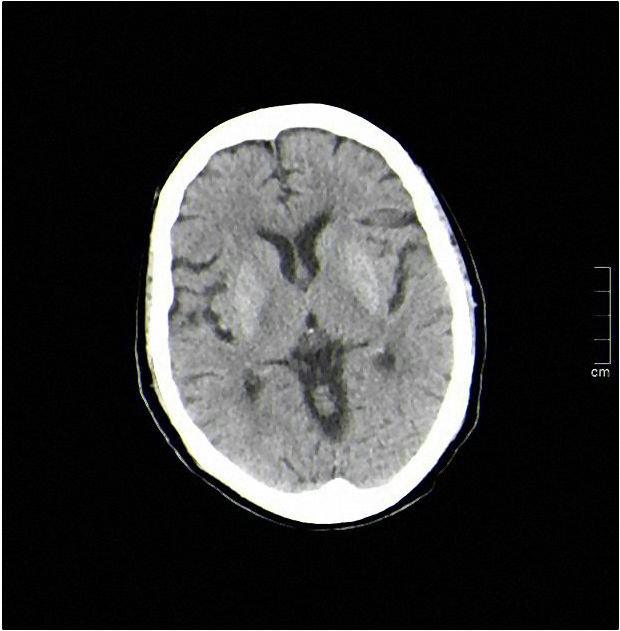
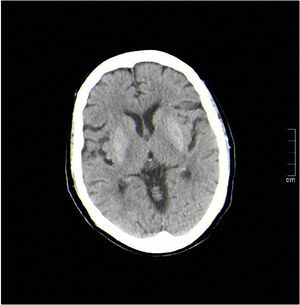
En dicho centro, se realizó una analítica en la cual destacaba una glucemia de 286mg/dL, sin otro tipo de alteraciones, incluyendo gasometría venosa. Para completar el estudio, se realizó una tomografía axial computarizada (TAC) cerebral que informó de aumento simétrico de la densidad putaminal, sin relevancia clínica (fig. 1). Dada la situación se comentó el caso con el servicio de neurología, indicando ingreso para estudio y se inició tratamiento con haloperidol 5mg y midazolam 5mg intravenoso, con control parcial de los síntomas.
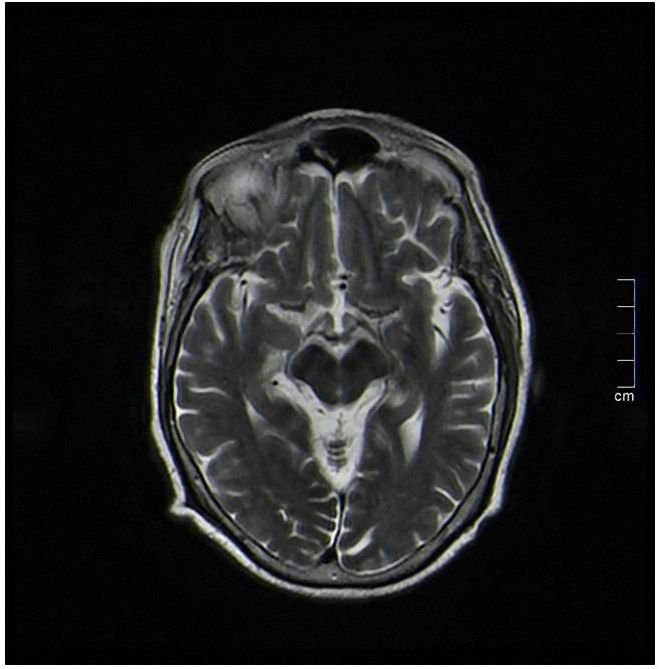
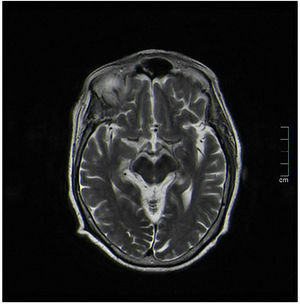
Durante el ingreso, se realizó una analítica general donde se apreciaron niveles de hemoglobina glicada del 13%. Se realizó un estudio autoinmune el cual no presentó alteraciones (incluyendo anticuerpos onconeuronales) y hubo negatividad en la serología Rosa de Bengala, enfermedad de Lyme, sífilis, hepatitis y virus de inmunodeficiencia humana (VIH). Para completar el estudio de corea no hereditaria se realizó una resonancia magnética (RMN) cerebral que informó de la ausencia de lesiones intra- o extraaxiales a nivel del parénquima cerebral, con presencia de una discreta hiposeñal difusa en T2 capsulolenticular bilateral de significado inespecífico (fig. 2). Así mismo, se realizó un ecocardiograma que no presentó hallazgos patológicos.
Ante el diagnóstico de corea generalizada secundaria a hiperglucemia no cetósica, se optimizó el tratamiento antidiabético con insulinoterapia y el sintomático con haloperidol, con respuesta progresiva hasta el cese de la sintomatología.
DiscusiónLa corea inducida por hiperglucemia fue descrita por primera vez por Bedwell en 19603. Esta entidad suele ser más frecuente en mujeres (las series de casos oscilan con relaciones hombre-mujer de 1:1,8-5), de entre 50-80 años de edad (edad promedio: 71 años) y, generalmente, sin historia previa de DM. En relación con la prevalencia, cabe destacar una predisposición de causa desconocida en mujeres de raza asiática4. La clínica se basa principalmente en movimientos coreicos y balísticos de un hemicuerpo (hemicorea) de horas de duración y que disminuyen o remiten a las 24-48h del control glucémico5.
La etiología es diversa, incluyendo tratamientos médicos de hormonoterapia y L-dopa. En los pacientes más jóvenes hay que descartar causas genéticas como la enfermedad de Wilson o la enfermedad de Huntington. Otras causas que han de ser descartadas, según el contexto clínico, son la infección postestreptocócica, la corea de Sydenham, la infección por el VIH, el hipertiroidismo, el síndrome antifosfolípido y la intoxicación por monóxido de carbono6.
La fisiopatología es poco conocida, habiéndose postulado diversas teorías:
- -
Hiperglucemia e hiperviscosidad causada por ella, las cuales producen una disrupción en la barrera hematoencefálica (BHE) causando acidosis intracelular y fracaso metabólico regional5.
- -
En algunos casos se han descrito hemorragias petequiales. Así mismo, se ha relacionado esta enfermedad con infartos del núcleo estriado secundarios a la debilidad de la BHE por la hiperglucemia y estrés oxidativo por procesos similares a la isquemia durante la hiperglucemia, lo que ocasiona la proliferación de astrocitos7.
- -
En mujeres posmenopáusicas, se ha sugerido que un aumento de la sensibilidad de los receptores dopaminérgicos puede desencadenar hipercinesia5.
- -
Disminución del ácido gamma-aminobutírico (GABA) en el tálamo/estriado debido a la no disponibilidad de acetoacetato para la formación de GABA en estados no cetóticos7.
En relación con las pruebas complementarias, los hallazgos radiológicos no son específicos. Se pueden observar en la RMN hiperintensidades ponderadas en T1 a nivel del estriado, putamen y globo pálido con difusión restringida en T2 (como sucede, esto último, en nuestro caso)4. La RMN también descarta infartos o procesos hemorrágicos. La TAC puede ser normal o puede mostrar hiperdensidad en los ganglios basales contralaterales. Los estudios de tomografía computarizada de emisión monofotónica (SPECT) pueden mostrar hipoperfusión en las áreas afectas8. La tomografía por emisión de positrones (PET) puede mostrar niveles reducidos de glucosa cerebral en las áreas afectas en T1, lo que sugiere alteraciones en el metabolismo9. Por último, la RMN por espectroscopia puede mostrar baja proporción de N-acetilaspartato-creatina y cociente elevado de colina-creatinina asociado a un pico elevado en los niveles de lactato10. Cabe destacar que la mayoría de estos hallazgos se resuelven con el tratamiento de la hiperglucemia, aunque se aprecian casos de persistencia pese al óptimo control glucémico sin causa clara, sugiriéndose la posibilidad de daños neuronales secundarios a la isquemia y microhemorragias putaminales. Los casos que no se resuelven han sido tratados de forma diversa, incluyendo agentes bloqueadores de la dopamina, tetrabenazina o topiramato5.
En conclusión, los movimientos involuntarios, particularmente la hemicorea, pueden ser una manifestación rara en la presentación de inicio de la DM y casos de hiperglucemia en pacientes ya conocidos (generalmente no cetósica). Las pruebas complementarias no son específicas, aunque es frecuente apreciar señales hiperintensas en T1. La clínica suele remitir tras el control de los niveles de glucemia. Por último, la patogenia no está clara, por lo que se requieren futuros estudios para conocer mejor esta enfermedad.
Consideraciones EticasLos autores han seguido los protocolos establecidos en su lugar de trabajo para la publicación de datos relativos a los pacientes y se ha contado con el consentimiento del paciente.