En el cribado de cáncer de próstata con antígeno prostático específico (PSA) se recomienda ofrecer información individualizada al paciente sobre el balance riesgos-beneficios y compartir la toma de decisiones.
ObjetivoExplorar la práctica habitual y la percepción de los médicos de familia y los facultativos de laboratorio sobre el cribado del cáncer de próstata mediante PSA.
Material y métodosEstudio transversal basado en un cuestionario y en las solicitudes de PSA como cribado realizadas desde atención primaria (AP) a hombres mayores de 49 años.
ResultadosEn 2015, la AP catalana solicitó PSA como cribado oportunista al 15,2% de los hombres. En el cuestionario participaron 114 médicos de familia y 227 facultativos de laboratorio. El 64% fueron mujeres, con 43 años de edad media y 17 de experiencia profesional. Los médicos de familia consideraron que los pacientes inducían el 61% de las solicitudes de PSA. La incertidumbre al solicitar PSA fue de 5 puntos para los médicos de familia y de 5,7 para los del laboratorio. El interés en disponer de recomendaciones clínicas recibió 7,2 puntos en atención primaria y 8,8 en el laboratorio. El conocimiento sobre las diferentes guías de práctica clínica recibió, en global, menos de 5 puntos.
ConclusionesDesde AP se realizó cribado de casi la sexta parte de los hombres mayores de 49 años sin enfermedad prostática, frecuentemente a petición del paciente e informándole de beneficios y riesgos. Los médicos de AP y del laboratorio estaban interesados en disponer de recomendaciones e información, aunque no solían consultar las guías de práctica clínica.
It is currently recommended to provide individualised information on benefit-risk balance and shared decision-making in prostate cancer screening using prostate-specific antigen (PSA).
AimTo determine the usual practice and the views of general and laboratory practitioners in the screening of prostate cancer using PSA.
Material and methodsA cross-sectional study based on a questionnaire and on PSA screening requests from Primary Health Care (PHC) in men older than 49 years with no prostatic symptoms.
ResultsIn 2015, PHC in Catalonia requested PSA on 15.2% of males. A total of 114 general practitioners and 227 laboratory practitioners participated in the questionnaire. The mean age of those who responded was 43 years with a mean of 17 years’ experience, and included 64% women. According to general practitioners, 61% of PSA was performed at the patient's request. The uncertainty score when requesting PSA was 5 points for general practitioners and 5.7 for laboratory professionals. Interest in having clinical recommendations received 7.2 points in PHC, and 8.8 in the laboratory. Knowledge about the different clinical practice guidelines received was less than 5 points overall.
ConclusionsGeneral practitioners requested PSA screening in almost one-sixth of men over the age of 49 without prostate disease, often at the patient's request, and after informing them of the benefits and risks. PHC and laboratory physicians were interested in having recommendations and information, although they did not usually consult clinical practice guidelines immediately.
El cáncer de próstata (CaP) es, después del de piel, el cáncer más frecuente en hombres. Y además es la tercera causa de muerte por cáncer en hombres, por detrás del de pulmón y del colorrectal. El antígeno prostático específico (PSA) es una prueba diagnóstica muy conocida, usada y polémica debido a las discrepancias sobre su eficacia como cribado1–3. Característicamente, el CaP presenta una evolución clínica muy variable, desde cáncer asintomático, que podría pasar desapercibido sin afectar a la supervivencia global del paciente, hasta muy agresivo, con metástasis y causando disminución en la calidad de vida y en la supervivencia. El debate sobre la pertinencia del cribado del CaP suele centrarse en el balance entre los beneficios, entendidos como disminución de la mortalidad, y los inconvenientes, especialmente sobrediagnóstico y sobretratamiento.
La evidencia científica disponible se basa principalmente en los resultados de 2 grandes ensayos clínicos todavía activos: uno europeo, The European Randomized Study of Screening for Prostate Cancer (ERSPC)4, con disminución de la mortalidad por CaP en el grupo de intervención; y otro estadounidense, The Prostate, Lung, Colorectal and Ovarian Cancer Screening Trial (PLCO), con un nuevo seguimiento publicado en 20175,6. La actitud hacia el cribado cambia conforme se conocen nuevos resultados del seguimiento a largo plazo de estos 2 estudios y también por los avances hacia nuevas estrategias de tratamiento, como la vigilancia activa7. En Estados Unidos, en 2012, la US Preventive Services Task Force (USPSTF) recomendó en contra de la utilización del PSA en el cribado del CaP (grado D). Esta recomendación fue muy polémica y ha influido sobre la práctica clínica8,9, llevando hacia una rápida desaparición del cribado en atención primaria10. En 2017, la nueva recomendación de la USPSTF indica ahora que la decisión de realizar la determinación de PSA es individual y que los clínicos deben informar a los hombres de entre 55 y 69 años de los potenciales beneficios y riesgos de medir el PSA (grado C)7. Por su parte, las guías de práctica clínica también han contribuido a alimentar la polémica, al discrepar en sus recomendaciones, llegando incluso a contradecirse11.
Los constantes avances, con cambios en las recomendaciones para adaptarse a ellos, podrían provocar cierta confusión entre los profesionales sanitarios. En casos como este, cuando la evidencia científica disponible conduce a elaborar recomendaciones débiles, adquiere especial relevancia tomar decisiones compartidas y tener en cuenta las preferencias del paciente12,13. Por otra parte, en todo este proceso también está implicado el laboratorio clínico y sus profesionales, aspecto poco conocido que acostumbra a pasar desapercibido. Nuestra hipótesis es que conocer el porcentaje de pacientes al que finalmente se le determina PSA como cribado desde atención primaria y contrastar estos datos con la percepción de los profesionales implicados –médicos de atención primaria, que realizan la solicitud, y facultativos de laboratorio, responsables de asegurar la validez de los resultados y la calidad de todo el proceso– podría contribuir a detectar áreas de mejora y a clarificar cómo optimizar la utilización del PSA.
El objetivo de este estudio fue analizar la práctica habitual en relación con la utilización de la medición de PSA en la detección del CaP, y las percepciones, opiniones y experiencias de médicos de familia y facultativos de laboratorio.
MetodologíaSe planteó un estudio descriptivo basado en un cuestionario dirigido a médicos de familia y facultativos de laboratorio, y en la revisión de las determinaciones de PSA realizadas en la atención primaria catalana a hombres mayores de 49 años sin enfermedad prostática, desde 2011 hasta 2015, y en los 8 centros de atención primaria de MútuaTerrassa en 2015 y 2016.
Se seleccionó la población de hombres mayores de 50 años o más sin enfermedad prostática por razones prácticas, por tratarse de datos accesibles, que coincidían con el indicador solicitado por el Servei Català de la Salut a todos los centros de atención primaria catalanes, y publicados por la Central de Resultados del Observatorio del Sistema de Salud de Cataluña14. Estos informes se realizan por encargo del Servei Català de la Salut, que, como aseguradora pública, promueve la medición, la evaluación y la difusión de los resultados de los diferentes proveedores del Sistema Sanitario Integral de Utilización Pública de Cataluña. El indicador utilizado fue el porcentaje de hombres con 50 años o más, sin enfermedad prostática, con solicitud de PSA (a/b), donde al numerador «a» fue el número de hombres≥50 años, asignados, atendidos y sin enfermedad prostática con solicitud de PSA durante el año analizado, y el denominador «b» fue el número de hombres≥50 años, asignados y atendidos. También se utilizó este mismo indicador en los 8 centros de salud de MútuaTerrassa, donde al disponer de las bases de datos originales se calculó además este indicador para el subgrupo de hombres de 60 años o más.
Además, se diseñó un cuestionario específico, en 2015, para ser autocumplimentado por médicos de familia y facultativos de laboratorio. Tras revisar la bibliografía, y al no encontrar un cuestionario que se adaptara completamente a los objetivos de este estudio, los autores desarrollaron un cuestionario con 2 versiones. El cuestionario constaba de 4 secciones: datos sociodemográficos, práctica clínica habitual sobre cribado de CaP, guías de práctica clínica y sugerencias. Las 2 versiones diferían en la sección sobre práctica clínica habitual sobre cribado de CaP, para adaptar el cuestionario a las particularidades de la práctica asistencial del grupo profesional estudiado. La versión para médicos de atención primaria contenía 40 variables y la de facultativos de laboratorio clínico, 36 variables. Para las variables se utilizó una escala de 1-10. Se realizó una primera validación técnica (comprensión y pertinencia), consultando con expertos en CaP y en metodología de cuestionarios. Se realizó una prueba piloto con 30 médicos de familia.
Para facilitar el acceso a los profesionales se solicitó personalmente la participación, de enero a marzo de 2016, de los médicos de familia que trabajaban en los centros sanitarios de los autores de este estudio (Mútua Terrassa y el Institut Català de la Salut). En total, participaron médicos de familia de 13 centros de salud: 8 centros de MútuaTerrassa, y 5 centros del Institut Català de la Salut: EAP Abrera, EAP Esparreguera, EAP Martorell, EAP Sant Andreu de la Barca y CAP Artés. Por otra parte, para acceder a los facultativos de laboratorio se utilizaron 2 vías. En primer lugar, el cuestionario se distribuyó personalmente, antes del inicio del curso, entre los asistentes al XIII Curso Teórico Práctico sobre Utilidad Clínica de los Marcadores Tumorales en el Cáncer, celebrado en Barcelona en febrero de 2016, con asistentes de toda España. Y además, se solicitó la participación de los socios de la Sociedad Española de Medicina de Laboratorio (SEQC-ML) por vía electrónica. El cuestionario estuvo disponible en la web de la sociedad del 4 de noviembre al 12 de diciembre de 2016. Durante ese periodo se enviaron 2 recordatorios por correo electrónico a los socios, el 10 y el 25 de noviembre. Se garantizó confidencialidad y anonimato. El estudio disponía de la aprobación del Comité Ético de Investigación Clínica de MútuaTerrassa.
En cuanto al análisis estadístico, se realizó un análisis descriptivo uni y bivariado. Para las variables significativas se establecieron intervalos de confianza del 95%. Para la comparación de variables cualitativas se utilizó la prueba de la χ2 y para la comparación de medias, la prueba de la t de Student o el test de ANOVA. El nivel de significación estadística se estableció en 0,05. Se utilizó el paquete SPSS 17.0 (SPSS Inc., Chicago, Estados Unidos).
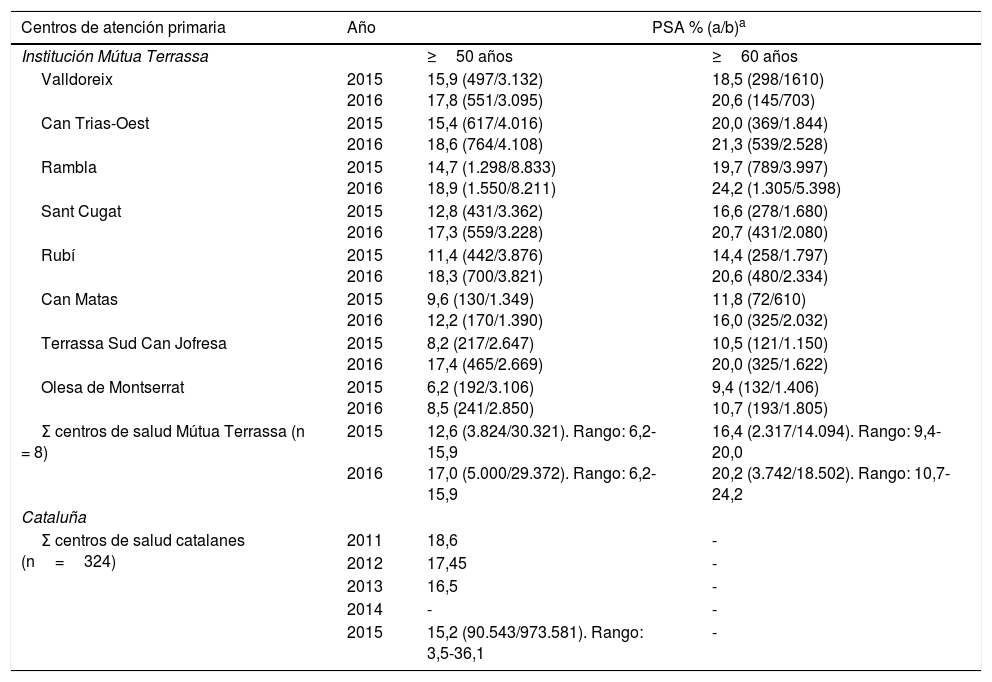
ResultadosLos resultados sobre determinaciones de PSA en hombres catalanes sin enfermedad prostática se muestran en la tabla 1. En Cataluña, en 2015, la atención primaria solicitó PSA a 90.543 hombres mayores de 49 años sin enfermedad prostática (15,2%). Desde MútuaTerrassa se solicitó al 12,6%, incrementándose hasta el 17% en 2016. En el subgrupo de hombres con 60 años o más se solicitó PSA en el 16,4% en 2015 y aumentó hasta el 20% en 2016.
Porcentajes de hombres mayores sin enfermedad prostática y con determinación de antígeno prostático específico en los centros de atención primaria de MútuaTerrassa y en Cataluña
| Centros de atención primaria | Año | PSA % (a/b)a | |
|---|---|---|---|
| Institución Mútua Terrassa | ≥50 años | ≥60 años | |
| Valldoreix | 2015 2016 | 15,9 (497/3.132) 17,8 (551/3.095) | 18,5 (298/1610) 20,6 (145/703) |
| Can Trias-Oest | 2015 2016 | 15,4 (617/4.016) 18,6 (764/4.108) | 20,0 (369/1.844) 21,3 (539/2.528) |
| Rambla | 2015 2016 | 14,7 (1.298/8.833) 18,9 (1.550/8.211) | 19,7 (789/3.997) 24,2 (1.305/5.398) |
| Sant Cugat | 2015 2016 | 12,8 (431/3.362) 17,3 (559/3.228) | 16,6 (278/1.680) 20,7 (431/2.080) |
| Rubí | 2015 2016 | 11,4 (442/3.876) 18,3 (700/3.821) | 14,4 (258/1.797) 20,6 (480/2.334) |
| Can Matas | 2015 2016 | 9,6 (130/1.349) 12,2 (170/1.390) | 11,8 (72/610) 16,0 (325/2.032) |
| Terrassa Sud Can Jofresa | 2015 2016 | 8,2 (217/2.647) 17,4 (465/2.669) | 10,5 (121/1.150) 20,0 (325/1.622) |
| Olesa de Montserrat | 2015 2016 | 6,2 (192/3.106) 8,5 (241/2.850) | 9,4 (132/1.406) 10,7 (193/1.805) |
| Σ centros de salud Mútua Terrassa (n = 8) | 2015 2016 | 12,6 (3.824/30.321). Rango: 6,2-15,9 17,0 (5.000/29.372). Rango: 6,2-15,9 | 16,4 (2.317/14.094). Rango: 9,4-20,0 20,2 (3.742/18.502). Rango: 10,7-24,2 |
| Cataluña | |||
| Σ centros de salud catalanes (n=324) | 2011 | 18,6 | - |
| 2012 | 17,45 | - | |
| 2013 | 16,5 | - | |
| 2014 | - | - | |
| 2015 | 15,2 (90.543/973.581). Rango: 3,5-36,1 | - | |
PSA %: porcentaje de hombres≥50 años sin enfermedad prostática con solicitud de antígeno prostático específico.
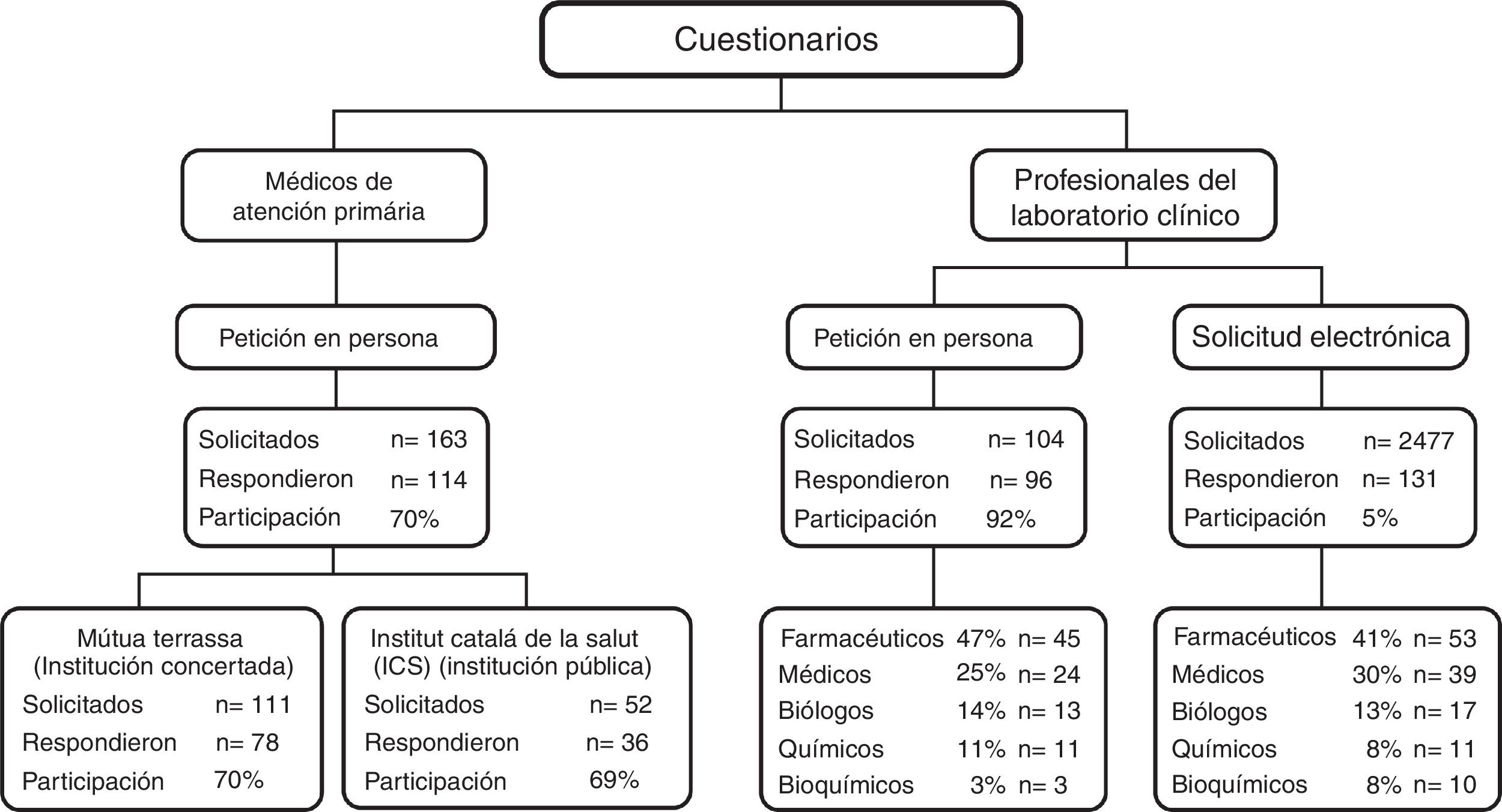
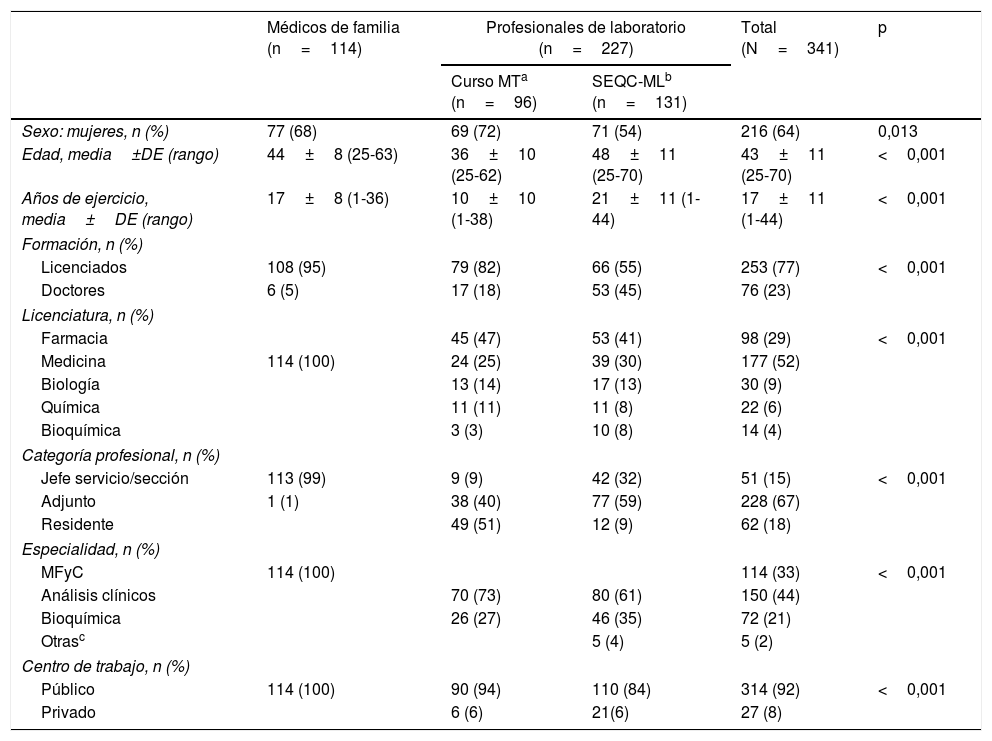
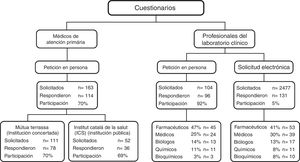
Respecto al cuestionario, la participación se encuentra detallada en la figura 1. Cuando se solicitó personalmente participaron el 70% de los médicos de familia (n=114) y el 92% de los facultativos de laboratorio (n=96). Tras solicitud electrónica a los socios de la SEQC-ML, se obtuvo un 5% de participación (n=131). En total respondieron el cuestionario 227 facultativos de laboratorio. Las características generales de cada grupo se muestran en la tabla 2. No se observaron diferencias en el perfil de los médicos de familia según la institución en que trabajaban. Por el contrario, sí que fueron diferentes los perfiles de los 2 grupos de profesionales de laboratorio. Entre los que accedieron a través de la web de la SEQC-ML hubo un 18% más de hombres, fueron 12 años mayores de media y disponían de 11 años más de experiencia profesional, con respecto a los asistentes al curso de marcadores tumorales. Además, el 45% de los que accedieron al cuestionario electrónico vía SEQC-ML disponían del grado académico de doctor.
Características de los 3 grupos profesionales participantes
| Médicos de familia (n=114) | Profesionales de laboratorio (n=227) | Total (N=341) | p | ||
|---|---|---|---|---|---|
| Curso MTa (n=96) | SEQC-MLb (n=131) | ||||
| Sexo: mujeres, n (%) | 77 (68) | 69 (72) | 71 (54) | 216 (64) | 0,013 |
| Edad, media±DE (rango) | 44±8 (25-63) | 36±10 (25-62) | 48±11 (25-70) | 43±11 (25-70) | <0,001 |
| Años de ejercicio, media±DE (rango) | 17±8 (1-36) | 10±10 (1-38) | 21±11 (1-44) | 17±11 (1-44) | <0,001 |
| Formación, n (%) | |||||
| Licenciados | 108 (95) | 79 (82) | 66 (55) | 253 (77) | <0,001 |
| Doctores | 6 (5) | 17 (18) | 53 (45) | 76 (23) | |
| Licenciatura, n (%) | |||||
| Farmacia | 45 (47) | 53 (41) | 98 (29) | <0,001 | |
| Medicina | 114 (100) | 24 (25) | 39 (30) | 177 (52) | |
| Biología | 13 (14) | 17 (13) | 30 (9) | ||
| Química | 11 (11) | 11 (8) | 22 (6) | ||
| Bioquímica | 3 (3) | 10 (8) | 14 (4) | ||
| Categoría profesional, n (%) | |||||
| Jefe servicio/sección | 113 (99) | 9 (9) | 42 (32) | 51 (15) | <0,001 |
| Adjunto | 1 (1) | 38 (40) | 77 (59) | 228 (67) | |
| Residente | 49 (51) | 12 (9) | 62 (18) | ||
| Especialidad, n (%) | |||||
| MFyC | 114 (100) | 114 (33) | <0,001 | ||
| Análisis clínicos | 70 (73) | 80 (61) | 150 (44) | ||
| Bioquímica | 26 (27) | 46 (35) | 72 (21) | ||
| Otrasc | 5 (4) | 5 (2) | |||
| Centro de trabajo, n (%) | |||||
| Público | 114 (100) | 90 (94) | 110 (84) | 314 (92) | <0,001 |
| Privado | 6 (6) | 21(6) | 27 (8) | ||
DE: desviación estándar; MFyC: Medicina Familiar y Comunitaria; MT: marcadores tumorales; SEQC-ML: Sociedad Española de Medicina de Laboratorio.
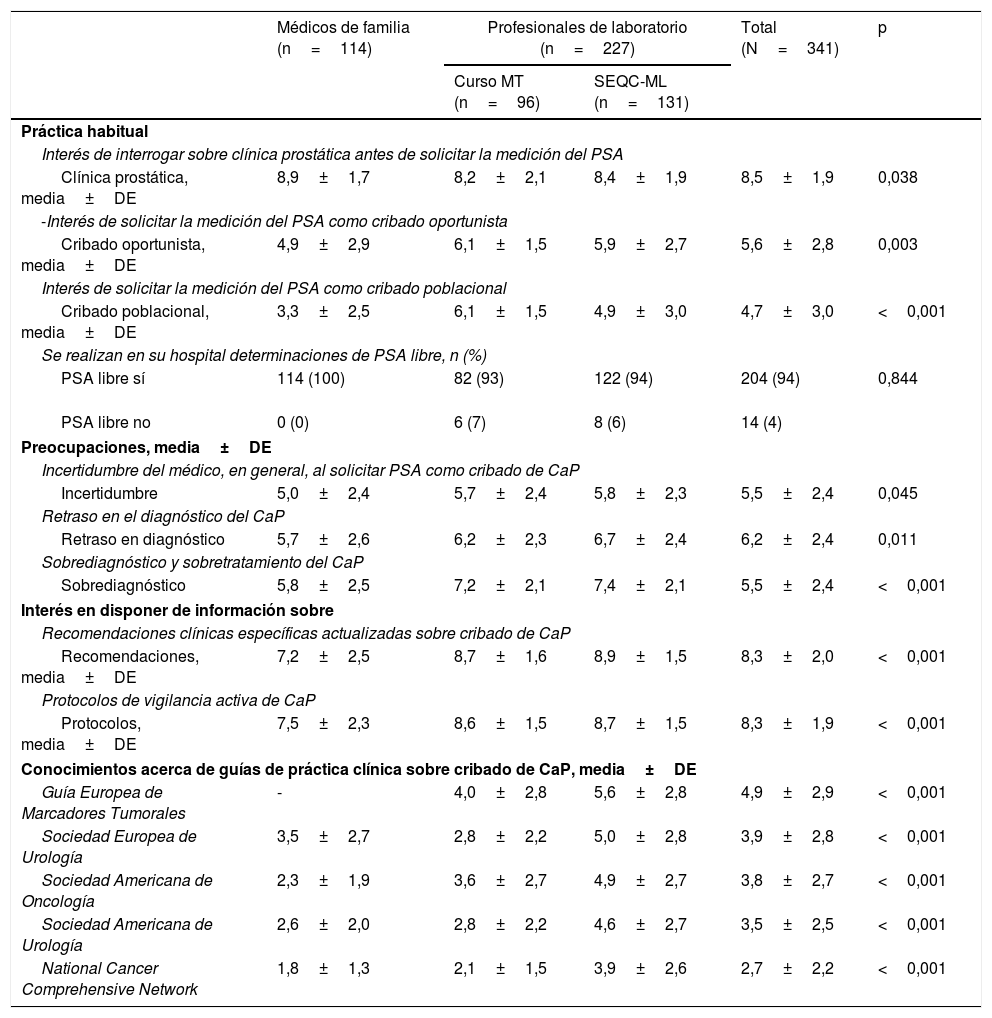
La percepción, las inquietudes y el interés sobre la utilización del PSA en la práctica clínica habitual en relación con el cribado del CaP se detallan en la tabla 3. El aspecto que recibió la mayor puntuación, con 8,5 puntos, fue valorar la clínica prostática antes de solicitar la medición del PSA. Además, tanto el interés por disponer de recomendaciones como de información sobre protocolos de vigilancia activa del CaP recibieron 8,3 puntos. Los médicos de familia puntuaron, de media, con 5 puntos su incertidumbre al solicitar PSA como cribado de CaP. La medición de PSA libre se encontraba disponible en el 94% de los hospitales. En la mayoría de las variables se observaron diferencias estadísticamente significativas entre los grupos profesionales estudiados. También se observaron diferencias estadísticamente significativas en la mayoría de las variables según los años de ejercicio profesional, destacando que el conocimiento sobre las 5 guías de práctica clínica incluidas en el cuestionario recibió mayor puntuación para todas ellas en el grupo de profesionales con 11 años o más de experiencia profesional (n=203) (p < 0,001) respecto a las puntuaciones de los profesionales con menos años de ejercicio (n = 118). Con respecto a los conocimientos de los profesionales sobre las guías de práctica clínica, en global, ninguna de ellas alcanzó los 5 puntos en la escala de 1 a 10. Los profesionales de laboratorio otorgaron la mayor puntuación a la Guía Europea de Marcadores Tumorales, con 4,9 puntos. Los médicos de familia seguían mayoritariamente, con 3,6 puntos, las recomendaciones de su sociedad científica, la Sociedad Española de Medicina de Familia y Comunitaria, y los protocolos de sus centros de trabajo: la guía de la web «3 clics», del Institut Català de la Salut, y en MútuaTerrassa, un protocolo interno basado fundamentalmente en la Guía de Práctica Clínica de la Asociación Europea de Urología.
Práctica habitual, inquietudes e interés sobre el uso del antígeno prostático específico en el cribado del cáncer de próstata
| Médicos de familia (n=114) | Profesionales de laboratorio (n=227) | Total (N=341) | p | ||
|---|---|---|---|---|---|
| Curso MT (n=96) | SEQC-ML (n=131) | ||||
| Práctica habitual | |||||
| Interés de interrogar sobre clínica prostática antes de solicitar la medición del PSA | |||||
| Clínica prostática, media±DE | 8,9±1,7 | 8,2±2,1 | 8,4±1,9 | 8,5±1,9 | 0,038 |
| -Interés de solicitar la medición del PSA como cribado oportunista | |||||
| Cribado oportunista, media±DE | 4,9±2,9 | 6,1±1,5 | 5,9±2,7 | 5,6±2,8 | 0,003 |
| Interés de solicitar la medición del PSA como cribado poblacional | |||||
| Cribado poblacional, media±DE | 3,3±2,5 | 6,1±1,5 | 4,9±3,0 | 4,7±3,0 | <0,001 |
| Se realizan en su hospital determinaciones de PSA libre, n (%) | |||||
| PSA libre sí | 114 (100) | 82 (93) | 122 (94) | 204 (94) | 0,844 |
| PSA libre no | 0 (0) | 6 (7) | 8 (6) | 14 (4) | |
| Preocupaciones, media±DE | |||||
| Incertidumbre del médico, en general, al solicitar PSA como cribado de CaP | |||||
| Incertidumbre | 5,0±2,4 | 5,7±2,4 | 5,8±2,3 | 5,5±2,4 | 0,045 |
| Retraso en el diagnóstico del CaP | |||||
| Retraso en diagnóstico | 5,7±2,6 | 6,2±2,3 | 6,7±2,4 | 6,2±2,4 | 0,011 |
| Sobrediagnóstico y sobretratamiento del CaP | |||||
| Sobrediagnóstico | 5,8±2,5 | 7,2±2,1 | 7,4±2,1 | 5,5±2,4 | <0,001 |
| Interés en disponer de información sobre | |||||
| Recomendaciones clínicas específicas actualizadas sobre cribado de CaP | |||||
| Recomendaciones, media±DE | 7,2±2,5 | 8,7±1,6 | 8,9±1,5 | 8,3±2,0 | <0,001 |
| Protocolos de vigilancia activa de CaP | |||||
| Protocolos, media±DE | 7,5±2,3 | 8,6±1,5 | 8,7±1,5 | 8,3±1,9 | <0,001 |
| Conocimientos acerca de guías de práctica clínica sobre cribado de CaP, media±DE | |||||
| Guía Europea de Marcadores Tumorales | - | 4,0±2,8 | 5,6±2,8 | 4,9±2,9 | <0,001 |
| Sociedad Europea de Urología | 3,5±2,7 | 2,8±2,2 | 5,0±2,8 | 3,9±2,8 | <0,001 |
| Sociedad Americana de Oncología | 2,3±1,9 | 3,6±2,7 | 4,9±2,7 | 3,8±2,7 | <0,001 |
| Sociedad Americana de Urología | 2,6±2,0 | 2,8±2,2 | 4,6±2,7 | 3,5±2,5 | <0,001 |
| National Cancer Comprehensive Network | 1,8±1,3 | 2,1±1,5 | 3,9±2,6 | 2,7±2,2 | <0,001 |
CaP: cáncer de próstata; DE: desviación estándar; MT: marcadores tumorales; PSA: antígeno prostático específico; SEQC-ML: Sociedad Española de Medicina de Laboratorio.
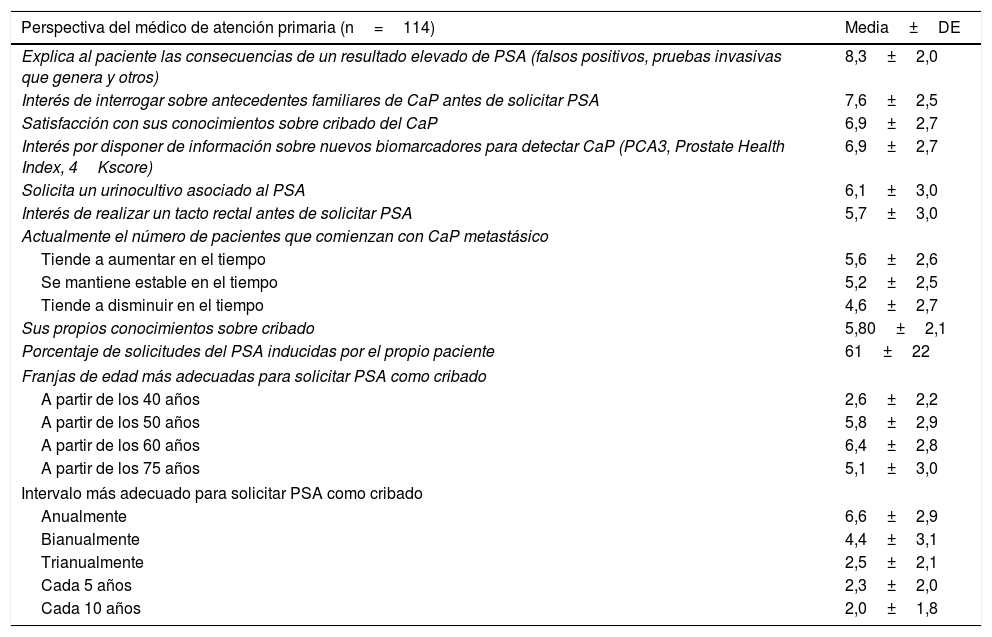
Los resultados sobre las variables relacionadas con aspectos específicos sobre la determinación de PSA como cribado de CaP, propios de cada área profesional, atención primaria y laboratorio, se muestran en la tabla 4. Con respecto a la visión del médico de familia, destacaron, con la puntuación más alta, 8,3 puntos, las explicaciones que ofrecen a los pacientes sobre las consecuencias de un resultado elevado de PSA (falsos positivos, pruebas invasivas que genera y otros aspectos). Consideraron que el 61% de las solicitudes de PSA fueron inducidas por los propios pacientes. La franja de edad más conveniente para solicitar el PSA como cribado fue a partir de los 60 años, con 6,4 puntos. Y el intervalo de tiempo más adecuado para solicitar una nueva determinación de PSA fue anualmente, con 6,6 puntos. Por otra parte, con respecto a los factores del laboratorio que influyen sobre la determinación de PSA, destacó que el 44% utilizaba el calibrador 96/670 de la OMS, el 8% no lo utilizaba y el 48% desconocía qué estándar se utilizaba en el laboratorio donde trabajaba. Entre los equipos más utilizados para realizar la medida del PSA destacaron Cobas (Roche) en el 46% de los laboratorios y Advia Centaur (Siemens) en el 17%.
Aspectos específicos sobre la determinación de antígeno prostático específico como cribado de cáncer de próstata propios del área profesional: atención primaria y laboratorio
| Perspectiva del médico de atención primaria (n=114) | Media±DE |
|---|---|
| Explica al paciente las consecuencias de un resultado elevado de PSA (falsos positivos, pruebas invasivas que genera y otros) | 8,3±2,0 |
| Interés de interrogar sobre antecedentes familiares de CaP antes de solicitar PSA | 7,6±2,5 |
| Satisfacción con sus conocimientos sobre cribado del CaP | 6,9±2,7 |
| Interés por disponer de información sobre nuevos biomarcadores para detectar CaP (PCA3, Prostate Health Index, 4Kscore) | 6,9±2,7 |
| Solicita un urinocultivo asociado al PSA | 6,1±3,0 |
| Interés de realizar un tacto rectal antes de solicitar PSA | 5,7±3,0 |
| Actualmente el número de pacientes que comienzan con CaP metastásico | |
| Tiende a aumentar en el tiempo | 5,6±2,6 |
| Se mantiene estable en el tiempo | 5,2±2,5 |
| Tiende a disminuir en el tiempo | 4,6±2,7 |
| Sus propios conocimientos sobre cribado | 5,80±2,1 |
| Porcentaje de solicitudes del PSA inducidas por el propio paciente | 61±22 |
| Franjas de edad más adecuadas para solicitar PSA como cribado | |
| A partir de los 40 años | 2,6±2,2 |
| A partir de los 50 años | 5,8±2,9 |
| A partir de los 60 años | 6,4±2,8 |
| A partir de los 75 años | 5,1±3,0 |
| Intervalo más adecuado para solicitar PSA como cribado | |
| Anualmente | 6,6±2,9 |
| Bianualmente | 4,4±3,1 |
| Trianualmente | 2,5±2,1 |
| Cada 5 años | 2,3±2,0 |
| Cada 10 años | 2,0±1,8 |
| Perspectiva del facultativo del laboratorio (n=227) | ||||
|---|---|---|---|---|
| Profesionales de laboratorio (n=227) | Total (N=227) | p | ||
| Curso MT (n=96) | SEQC-ML (n=131) | |||
| El ensayo utilizado en su laboratorio está calibrado con el estándar de la OMS 96/670 | ||||
| PSA calibrado OMS | ||||
| Sí | 36 (38) | 63 (48) | 99 (44) | 0,590 |
| No | 9 (9) | 9 (7) | 18 (8) | |
| Lo desconozco | 51 (53) | 59 (45) | 110 (48) | |
| Las concentraciones de PSA medidas varían al utilizar diferentes ensayos | ||||
| Variaciones ensayos | 8,0±2,2 | 7,6±1,8 | 7,8±2,0 | 0,106 |
| Considera que debería ajustar el nivel de discriminación del PSA según el ensayo utilizado para su medición | ||||
| Ajustar cut-off PSA, n (%) | ||||
| Sí | 87 (91) | 110 (84) | 197 (87) | 0,663 |
| No | 5 (5) | 12 (9) | 17 (7) | |
| Lo desconozco | 4 (4) | 9 (7) | 13 (6) | |
| -Inquietud por los falsos positivos del PSA en el cribado del CaP | ||||
| Falsos positivos PSA | 6,7±2,2 | 6,7±2,2 | 6,7±2,2 | 0,960 |
| Utilidad de la medición de PSA libre para detectar el CaP | ||||
| Utilidad PSA libre | 8,1±1,9 | 7,3±1,9 | 7,6±1,9 | 0,010 |
| Dispone de información sobre la utilidad de estos nuevos marcadores tumorales en la detección del CaP | ||||
| PCA3 | 4,3±3,0 | 5,9 ±2,9 | 5,3±3,0 | <0,001 |
| Prostate Health Index | 3,6±2,9 | 5,2 ±2,9 | 4,6±3,0 | <0,001 |
| 4Kscore (panel 4 calicreínas) | 3,1±2,4 | 4,3 ±2,9 | 3,8±2,8 | 0,001 |
| Equipo utilizado en medición de PSA | ||||
| Cobas (Roche) | 44 (49) | 57 (44) | 101 (47) | |
| Centaur (Siemens) | 17 (19) | 22 (17) | 39 (18) | |
| Architect (Abott) | 13 (15) | 19 (14) | 32 (15) | |
| Access 2 O UniCel Dxl (Beckman Coulter) | 7 (8) | 17 (13) | 24 (11) | |
| Immulite 2000 (Siemens) | 4 (4) | 2 (2) | 6 (3) | |
| Vitros 5600 (Ortho) | 2 (2) | 4 (3) | 6 (3) | |
| Dimension Vista (Siemens) | 2 (2) 2 (2) | 4 (3) 7 (5) | 6 (3) 9 (2) | |
| Otrosa | 7 | 3 | 10 | |
CaP: cáncer de próstata; DE: desviación estándar; MT: marcadores tumorales; OMS: Organización Mundial de la Salud; PSA: antígeno prostático específico; SEQC-ML: Sociedad Española de Medicina de Laboratorio.
Finalmente, el 13% de los encuestados ofreció sugerencias sobre aspectos relevantes sobre el cribado del CaP con PSA. Los ejemplos textuales más relevantes se muestran en la tabla 5. En síntesis, los profesionales proponen avanzar en aspectos científicos (conocimiento e incorporación de nuevas tecnologías) y también en organización y comunicación para alcanzar consensos entre todos los profesionales implicados.
Respuestas a la sección sobre sugerencias
| Sugerencias de los médicos de familia, 15% (17/114) |
| «Divergencias importantes entre industria/laboratorios/urólogos/oncólogos y atención primaria en diagnóstico e información. Habría que ponerse de acuerdo. Importante desviación de la información de periódicos (Vanguardia) y TV. ¿Qué hacer?» |
| «Aunque intento seguir las recomendaciones, ante un paciente que a pesar de ser informado de pros y contras sigue empeñado en que se le determine el PSA, se lo solicito, aunque yo no lo vea necesario» |
| «Considero que podría educarse al paciente, ya que un porcentaje muy alto de ellos son muy demandantes en la consulta. Sobre todo pacientes de edades 40-50 años. Mayor interacción entre urólogos y atención primaria. Los urólogos solicitan PSA anual a pacientes con PSA bajos sin riesgo según clínica» |
| «Falta una buena “conexión” entre atención primaria y especializada, porque los médicos de familia no hacemos cribado, explicamos al paciente y el urólogo pide PSA a todos» |
| «Para solicitar PSA valoro la clínica y/o los antecedentes familiares de neoplasia de próstata» |
| «Solo solicito PSA si hay CaP» |
| «Yo utilizaría el International Prostate Symptom Score previo a PSA» |
| Sugerencias de los participantes en curso marcadores tumorales, 12% (12/96) |
| «Debería establecerse un protocolo nacional» |
| «Estoy confusa respecto a este cribado. Por la experiencia tiendo a pensar que se sobreestima, pero tengo casos recientes que me ofrecen mucha confusión» |
| «Los urólogos deberían conocer la problemática en las técnicas del ensayo» |
| «Los urólogos, entre ellos, no opinan todos igual» |
| «Aunque es de los pocos marcadores implantados en programas de screening es evidente que los criterios de utilización no están claros ni siquiera entre los propios clínicos. Su demanda va en aumento, principalmente por la aplicación de una medicina defensiva y/o oportunista y de complacencia hacia el paciente» |
| «Médicos de centros de salud desconocen o confunden sintomatología prostática y protocolos de cribado» |
| «Se debería poner un intervalo de edad (estratificar por edad) para los niveles de PSA» |
| «Utilidad del proPSA» |
| Sugerencias de los socios SEQC-ML, 5% (6/131) |
| «¿El analista tiene que generar PSA libres en vista de las controversias actuales?» |
| «Atención a la preanalítica de las muestras, a la estabilidad de PSA libre frente a tiempo de procesamiento» |
| «Ya es hora de aplicar marcadores genómicos circulantes para cribado de cáncer» |
| «Las sociedades científicas pueden reforzar su acción pedagógica sobre este tema en al menos 2 aspectos: 1) difundir activamente las mejores síntesis de evidencia disponibles (Cochrane, TRIP, etc.); 2) promover o realizar talleres de lectura crítica» |
| «Muy interesante difundir a los socios SEQC-ML las nuevas guías» |
CaP: cáncer de próstata; PSA: antígeno prostático específico; SEQC-ML: Sociedad Española de Medicina de Laboratorio.
La mayor aportación de este estudio es contrastar la práctica actual habitual de cribado oportunista del CaP con PSA desde atención primaria, que se realiza en alrededor del 15% de los hombres mayores de 49 años asintomáticos, con la opinión de los médicos de familia y de los facultativos de laboratorio implicados en el proceso. Los médicos de familia en conjunto y el grupo de facultativos de laboratorio clínico con mayor experiencia profesional no manifestaron incertidumbre hacia el cribado del CaP, en contraste con una cierta incertidumbre entre los facultativos de laboratorio con menor experiencia profesional. La polémica sobre el cribado con PSA es conocida1–3. Los médicos actúan de acuerdo con su propio criterio, basado en sus conocimientos y en su experiencia e influidos principalmente por los protocolos de sus centros de trabajo y por las recomendaciones de las sociedades científicas. Las guías de práctica clínica no acostumbran a ser conocidas en profundidad, probablemente en relación con las barreras conocidas15.
En Cataluña, gracias a los informes públicos de la Central de Resultados del Observatorio del Sistema de Salud de Cataluña14, se sabe que en 2015 se realizó la determinación de PSA, desde atención primaria, a cerca del 15% de los hombres mayores de 49 años asintomáticos. La recomendación del programa Essencial, pública desde 2013, indica: «La determinación del PSA como cribado poblacional de CaP no debería realizarse al no aportar beneficios en términos de reducción de mortalidad»16. La web especifica que se trata de una recomendación para ayudar a tomar decisiones, sin ser de obligado cumplimiento ni sustituir al juicio clínico del personal sanitario. Por su parte, el Servei Català de la Salut, cuando contrata la prestación de servicios sanitarios, marca unos objetivos contractuales. Entre estos objetivos, en 2015 y 2016, el contrato para los equipos de atención primaria catalanes establecía en el 20% el máximo en los hombres mayores de 49 años sin enfermedad prostática y con determinación de PSA, dentro del marco del proyecto Essencial. En 2017 ha variado el objetivo contractual, solicitando como máximo mediciones en el 18% de los hombres.
La evidencia científica se basa principalmente en 2 ensayos clínicos activos iniciados en 1993, en Europa (ERSPC)4 y América (PLCO)5,6, con resultados discrepantes, atribuidos probablemente a las diferencias en el diseño y la ejecución de los estudios. El estudio europeo ERSPC incluyó, en el momento de la aleatorización, a 162.338 hombres entre 55 y 69 años de varios países, entre ellos España, y ha mostrado una disminución de la mortalidad del 21% en el grupo de cribado tras 13 años de seguimiento4. El estudio americano PLCO incluyó de forma aleatoria 76.685 hombres y tras 13 años de seguimiento no ha encontrado diferencias en la mortalidad entre el grupo control y el grupo de intervención5,6. Las limitaciones y los sesgos de los estudios motivan que se deban interpretar con precaución. Se ha debatido mucho sobre la validez de los resultados de estos estudios y sobre los factores que podrían cuestionarlos, como el efecto de contaminación, o cribado oportunista con determinaciones de PSA, en el grupo control17,18. En Estados Unidos, siguiendo la recomendación de la USPSTF, se ha observado una disminución de las mediciones de PSA en atención primaria, desde el 27,3 hasta el 16,7%10. Simultáneamente se ha acompañado de la disminución del tacto rectal, llevando a una rápida desaparición del cribado del CaP de la atención primaria10.
La incidencia del CaP y la mortalidad asociada presentan una amplia variación en su distribución mundial. Hay consenso sobre el peso decisivo del cribado con PSA respecto a la gran variación observada en la incidencia, pero controversia sobre su influencia sobre el descenso de la mortalidad, relacionado sin duda con la mejora de los tratamientos y en menor medida con la detección precoz19. Actualmente el debate sobre el cribado del CaP sigue abierto, cuestionándose una vez más la comunidad científica la posibilidad de introducir modificaciones, a medida que se dispone de nuevos resultados como los de la cohorte europea ERSPC4, los del último seguimiento a 15 años del ensayo PLCO6 y el reciente cambio en la recomendación de la USPSTF5.
Con respecto a los médicos de familia, no manifestaron incertidumbres respecto al cribado del CaP con PSA. Probablemente sobre esta percepción influyó que las sociedades científicas de atención primaria coinciden en sus principales recomendaciones20 y facilitan actualizar la propia formación21,22. Entre los aspectos más comentados por los médicos destacaron interrogar sobre clínica prostática antes de decidir solicitar PSA e informar al paciente sobre las consecuencias de un resultado elevado de PSA, en cuanto a posibles falsos positivos y pruebas invasivas que podría generar. Las sociedades científicas han elaborado sus recomendaciones a favor de compartir la decisión con los pacientes con una esperanza de vida mínima de 10 a 15 años. Actualmente se recomienda tomar la decisión compartida con el paciente, tras informarle del balance riesgos-beneficios y teniendo en cuenta sus características individuales y sus preferencias12. La evidencia apoya que podría ser beneficioso para la salud pública el cribado y la detección precoz del CaP en hombres seleccionados. Además, se añaden los avances conseguidos hacia nuevas estrategias de tratamiento, tipo vigilancia activa23. La vigilancia activa contribuye a mantener los beneficios del cribado y reducir los inconvenientes. Los protocolos de vigilancia activa parecen una solución con ventajas claras24, aunque no exenta de inconvenientes y problemas para su cumplimentación por pacientes y médicos25. Otros temas siguen siendo conflictivos, como la franja de edad más adecuada para solicitar el PSA como cribado y el intervalo de tiempo para realizar una nueva determinación de PSA cuando ya se dispone de una determinación previa normal. En este estudio los médicos de familia se inclinaron por considerar como más adecuados la franja de edad de mayores de 60 años y el intervalo anual para solicitar PSA como cribado. Y efectivamente, se observó que en el subgrupo de hombres de 60 años o más el porcentaje de solicitudes de PSA fue mayor. Hasta ahora, las guías de práctica clínica mayoritariamente recomendaban el cribado anual, aunque nuevas evidencias apuntan a que se obtienen los mismos beneficios con intervalos de 2 años12.
Otra aportación de este estudio es mostrar la poco conocida perspectiva del laboratorio. Se manifiesta claramente la disparidad entre los laboratorios españoles en los equipos, las técnicas de laboratorio y los calibradores para determinar PSA, y sería recomendable que en las publicaciones se indicasen estos aspectos para evitar errores. Esta enorme variabilidad es un aspecto del que son más conscientes los profesionales del laboratorio que otros colectivos en los que esta circunstancia pasa más desapercibida. Sin embargo, estas diferencias pueden tener un impacto clínico significativo, por lo que deberían considerarse para evitar problemas al interpretar los resultados26. Con respecto a los calibradores, actualmente el empleo mayoritario del estándar 96/670 de la OMS ha permitido homogeneizar los resultados, pero pese a todo, cuando existen divergencias sería recomendable adaptar el valor discriminante a cada ensayo. Si este factor no se tiene en cuenta, cambian los falsos positivos y disminuye significativamente el número de CaP detectados, con relevantes implicaciones clínicas19,27. Algunos analizadores permiten elegir entre diferentes calibradores, como la empresa Beckman Coulter, que ofrece la posibilidad de calibrar su ensayo para PSA en el analizador Access tanto con el calibrador de Hybritech como con el de la OMS28. Desconocer estos aspectos puede ocasionar errores en la interpretación clínica.
Entre las limitaciones de este trabajo, destacar que la detección del CaP se basa principalmente en la determinación de PSA sérico y en el tacto rectal. Se tuvo acceso a datos sobre las determinaciones de PSA utilizadas como cribado en la atención primaria catalana y en los centros de salud de MútuaTerrassa, excepto en el 2014, pero se desconocen los datos sobre los tactos rectales efectuados. Por ello, queda la duda de si el tacto rectal también ha ido disminuyendo, a semejanza de lo sucedido en Estados Unidos10. Otra limitación ha sido que los cuestionarios recogen las opiniones y las percepciones de los encuestados, que no necesariamente se corresponden con una realidad objetiva. Por otra parte, por razones de factibilidad, se solicitó la participación de grupos profesionales concretos y por vías diferentes, con participaciones muy dispares según la vía de acceso (petición personal o correo electrónico), y obteniéndose, por tanto, perfiles distintos. Los facultativos de laboratorio que asistieron al curso de marcadores tumorales eran más jóvenes y con menor experiencia profesional que los socios de la SEQC-ML que decidieron participar. Finalmente, dado que en el cribado del PSA se considera clave la decisión compartida con el paciente e individualizada según sus necesidades, hubiera sido interesante poder contrastar los resultados con la opinión de los pacientes.
En resumen, este estudio confirma que los profesionales, pese a las polémicas sobre el cribado del CaP con PSA y pese a las controversias y las discrepancias en las recomendaciones que reciben, se sienten seguros en su práctica habitual. Entre los médicos de familia es una situación habitual que los pacientes soliciten cribado de CaP mediante PSA y que el médico ofrezca información hasta alcanzar una decisión compartida, lo que puede ser complejo13. Por su parte, los facultativos de laboratorio disponen de información específica imprescindible para la correcta interpretación clínica de los resultados del PSA. En general, todos los grupos profesionales estuvieron de acuerdo en manifestar un marcado interés por disponer de mejor información sobre recomendaciones acerca de la utilización del PSA, guías de práctica clínica y protocolos de vigilancia activa del CaP. También reclamaron mejorar la comunicación y el consenso entre todos los profesionales implicados, de atención primaria y especializada, y dirigir los esfuerzos hacia protocolos comunes multidisciplinares que superen el ámbito de aplicación local.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren agradecer a Patricia Vigués la corrección del resumen en inglés, y a Manel Martori por su ayuda con los gráficos. Y al Dr. Hernan Farés y a la Dra. Karina Rodríguez-Capote, de la comisión del Laboratorio Basado en la Evidencia de la International Federation of Clinical Chemistry and Laboratory Medicine (C-EBLM of IFCC), por la invitación a explicar una parte de este trabajo en el simposio «¿Por qué debemos usar medicina de laboratorio basada en la evidencia en la práctica clínica?», en el XXIII Congreso Latinoamericano de Bioquímica Clínica, celebrado en Uruguay en septiembre de 2017. Y finalmente, agradecemos también a todos los profesionales participantes su generosa colaboración.
Componentes del Grupo de Estudio sobre Cribado en Cáncer de Próstata: Juan Antonio Allué, Antonio Arevalo, Josep María Caballero, Mar Delgado, Ferran Ferrer, Xavier Filella, Laura Foj, Montse Gavagnach, Nuria Giménez, Rabee Kazan, Marc Matarrodona, Bernat de Pablo, David Pedrazas, Angels Ruiz, Dolors Ruiz, Marta Serra, María José Torrejón.