Describir el uso cuantitativo de medicación inhalada de rescate en una población asmática atendida en el ámbito de Atención Primaria y, secundariamente, conocer su posible asociación respecto a otras variables relacionadas con el control.
Material y métodosEstudio observacional descriptivo. Muestra no seleccionada de todos los pacientes asmáticos con más de un año de evolución, procedentes de 17 cupos poblacionales de Atención Primaria. Periodo de observación de un año. Se recogieron variables sociodemográficas y características del asma como uso de short-acting beta-agonists (SABA, «beta-agonistas de acción corta») y grado de control conforme a su frecuentación de uso, utilización de medicación inhalada de control (MIC), número de exacerbaciones hospitalarias, tabaquismo y disponibilidad de un plan de acción. Los datos fueron obtenidos de la historia clínica y de los módulos electrónicos de prescripción.
ResultadosFueron incluidos 442 pacientes asmáticos (59,5% mujeres) con una media de 45,4 años. El número total de envases de SABA prescritos en el año por paciente estuvo comprendido entre los 0 y los 25 envases, con un promedio de 4,26 (DT 4,1). Solo un 46,6% mostraba un uso regular de MIC. El número de envases prescritos de SABA a los pacientes que presentaban un uso intermitente de la MIC fue significativamente superior con respecto al de los pacientes con un uso regular de la misma (p=0,001). Existe una asociación entre el número de exacerbaciones y el número de envases prescritos de SABA (coeficiente de correlación de Spearman=0,474, p<0,001), de forma que a mayor número de envases prescritos, mayor número también de exacerbaciones asmáticas hospitalarias.
ConclusionesUn porcentaje considerable de asmáticos de la muestra presenta elevadas prescripciones de envases de SABA en rangos cuantitativos definitorios de al menos asma parcialmente controlada o mal controlada. El sobreuso de SABA presenta una relación positiva con el uso intermitente de MIC, al igual que con las exacerbaciones hospitalarias, el tabaquismo y la ausencia de un plan de acción por escrito.
To describe the quantitative use of inhaled rescue medication in an asthmatic population treated in the Primary Care clinics, and secondly to determine its possible relationship as regards other variables associated with control.
Material and methodsAn observational, descriptive study was conducted on a randomised sample of all the asthmatic patients with more than one year of onset, and coming from 17 Primary Care catchment areas. 1 year observation period. The data collected included sociodemographic variables and characteristics of the asthma, such as the use of short-acting beta-agonists (SABA) and level of control as regards its frequency of use, the use of inhaled control medication (ICM), number of hospital exacerbations, smoking habits, and availability of an action plan. The data were obtained from the clinical history and the computerised prescription modules.
ResultsA total of 442 asthmatic patients were included (59.5% female), with a mean age of 45.4 years. The total number of SABA containers prescribed in one year per patient was between 0 and 25 containers, with a mean of 4.26 (SD=4.1). Only 46.6% showed a regular use of an ICM. The number of SABA containers prescribed to patients with an intermittent use of an ICM was significantly higher than those patients that used it regularly (P=.001). There was an association between the number of exacerbations and the number of SABA containers prescribed (Spearman correlation coefficient=0.474, P<.001), as such that the higher the number of containers prescribed there was also a higher number of hospitalised asthmatic exacerbations.
ConclusionsA considerable number of asthmatics in the sample had elevated prescriptions for SABA inhalers and within the defined quantitative ranges of at least a partially or poor-controlled asthma. There is a positive relationship between the overuse of SABA and the intermittent use of the ICM, the same as with hospital exacerbations, smoking, and the lack of a written action plan..
El asma es una enfermedad respiratoria crónica que padece, con distintos grados de severidad, el 4,7% de la población mayor de 15 años de nuestro país, aunque con notables variaciones de prevalencia según la distribución geográfica1,2.
Con el fin de mejorar la calidad de la atención sanitaria que se proporciona a los pacientes asmáticos y de igual forma disminuir la carga que comporta la enfermedad para la sociedad y el sistema de salud, se han publicado diversas directrices nacionales e internacionales en los últimos años, ampliamente difundidas entre los clínicos3,4.
Uno de los objetivos generales señalado en dichas guías y normativas es el llamado control de la enfermedad, entendiendo este como el grado en el que las manifestaciones del asma están ausentes o se ven reducidas al máximo por las intervenciones terapéuticas y, al mismo tiempo, se cumplen los objetivos del tratamiento5,6. Este concepto de control incluye, por tanto, la evaluación simultánea de 2 componentes o dimensiones: el control actual de la enfermedad y el riesgo futuro5. No obstante, los diferentes estudios epidemiológicos que han descrito el grado de control del paciente asmático muestran que este es subóptimo y se encuentra lejos del estándar que marcan las guías7–9. Además, muchos de estos estudios poblacionales coinciden en describir una amplia variabilidad en los factores vinculados a este deficiente control, inconveniente que dificulta aún más, si cabe, la consecución de los objetivos de idoneidad en el control10.
Tradicionalmente se han utilizado muchos métodos para medir el control del asma11,12. Entre estos podemos mencionar medidas de función respiratoria como el flujo espiratorio máximo y el volumen espiratorio forzado en el primer segundo, la comprobación de la hiperrespuesta bronquial y, más recientemente, marcadores de inflamación como los valores de óxido nítrico en aire exhalado y la cifra de eosinófilos en esputo13,14. Con el fin de facilitar y estandarizar la evaluación del grado de control se han diseñado diversos cuestionarios sencillos y fáciles de cumplimentar por el paciente que combinan las diferentes variables definidas para el control11. De ellos, han sido validados y adaptados culturalmente al castellano para su uso en España el Test de Control del Asma15 y el Cuestionario de Control del Asma16. Los ítems descritos en ambos cuestionarios hacen referencia a los síntomas diurnos y nocturnos, a la repercusión sobre las actividades de la vida diaria y al empleo de medicación inhalada de rescate (MIR), en concreto al uso de short-acting beta-agonists (SABA, «beta-agonistas de acción corta»).
En el caso concreto del uso de medicación de rescate, los estudios poblacionales describen una excesiva utilización de la misma, circunstancia que se podría traducir en una situación de falta de control de la enfermedad y, por consiguiente, un área de mejora en la que incidir, dentro de la atención que se presta al paciente asmático17. En relación con el empleo de este tipo de medicación, las normativas internacionales sobre el manejo del asma proponen que dicho control sea evaluado con preguntas específicas que identifiquen este parámetro, dentro de cuestionarios normalizados. La Global Initiative for Asthma (GINA)12 recomienda para ello, y dentro de un cuestionario estandarizado de control de los síntomas, utilizar el enunciado «Necesidad de uso de medicación sintomática más de 2 veces/semana» referido a las 4 últimas semanas, siendo su confirmación indicativa de falta de control. La misma guía internacional utiliza además este indicador como un factor de riesgo independiente para futuras exacerbaciones asmáticas, empleándose específicamente el enunciado «Uso excesivo de SABA>un cartucho de 200 dosis/mes» como señal de alerta18–20.
En este contexto, obtener una descripción cuantitativa de la utilización de medicación de rescate en la población asmática nos debe proporcionar valiosa información sobre el hipotético grado de control de la enfermedad y, al mismo tiempo, suscita la oportunidad de diseñar medidas correctoras desde la práctica profesional dirigidas a mejorar la asistencia sanitaria de la población con asma. Conforme a ello, el objetivo principal de nuestro estudio fue describir el uso cuantitativo de MIR, circunscrito al empleo de SABA, en una población asmática atendida en el ámbito de Atención Primaria, y secundariamente, conocer su posible asociación respecto a otras variables relacionadas con el control.
Material y métodosDiseño y población del estudioSe diseñó un estudio descriptivo, multicéntrico y transversal sobre datos secundarios obtenidos de registros electrónicos de la historia clínica y de otras bases de datos complementarias (AP Madrid versión 2.46.8, Horus, Visor integrado Atención Especializada y dispensación electrónica de medicamentos). La extracción de datos fue proseguida por un procedimiento seguro de disociación y/o anonimización de la información obtenida.
La población de estudio fueron todos los pacientes mayores de 18 años con registro en la historia clínica informatizada de asma bronquial (CIAP R96 o CIE-9 493.0, 493.9, 493, 493.1) y con más de un año de evolución desde su diagnóstico. Se excluyeron aquellos pacientes con diagnóstico coexistente de enfermedad pulmonar obstructiva crónica o cualquier otra codificación diagnóstica (enfisema pulmonar, bronquiectasias, fibrosis pulmonar, fibrosis quística, neoplasia pulmonar y bronquitis aguda no asmática) que requiriese el empleo de medicación inhalada. Igualmente, se excluyeron los diagnósticos de asma de menos de un año de evolución y aquellos individuos con desplazamiento temporal en la zona.
Se invitó a participar a médicos de Atención Primaria de 5 centros de salud (17 médicos en total), pertenecientes a 2 demarcaciones geográficas urbanas (Alcalá de Henares y Torrejón de Ardoz, en la Comunidad de Madrid) de una misma área de salud, y cuya población universal adscrita asciende a 120.051 personas. La obtención de datos del estudio por parte del médico para cada paciente se realizó en una única visita temporal, tomando retrospectivamente como referencia de análisis un periodo de tiempo de un año previo al momento de su inclusión. La duración de la fase de selección de todos los pacientes fue de 6 meses (de junio a noviembre de 2018).
De acuerdo con el diseño del estudio no se contempló realizar una entrevista directa con los pacientes. Este estudio fue diseñado siguiendo los principios éticos de la Declaración de Helsinki y observando lo establecido por la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales, quedando garantizada la disociación de los datos personales de los sujetos mediante codificación y/o anonimización de la información obtenida. En ningún caso se interfirió en la decisión clínica del investigador sobre el cuidado o tratamiento médico más adecuado para el paciente. No se aplicó a los pacientes ninguna intervención, ya fuera diagnóstica o de seguimiento, que no fuese la habitual de la práctica clínica. El diseño fue evaluado positivamente por el Comité de Ética e Investigación Clínica del Hospital Universitario Príncipe de Asturias de Alcalá de Henares, Madrid (código de protocolo EPA 05/2017), y por la Comisión Central de Investigación de la Gerencia Asistencial de Atención Primaria de la Comunidad de Madrid (código de protocolo 18/17). De igual forma, fue clasificado como EPA-OD por la Agencia Española de Medicamentos y Productos Sanitarios.
Para todos los pacientes asmáticos incluidos en el estudio se recopilaron las siguientes variables: datos sociodemográficos (edad, sexo) y características del asma (tiempo de evolución, medicación del asma empleada en el momento de su inclusión, uso de medicación inhalada de control [MIC] en el último año, número de exacerbaciones hospitalarias definidas como visitas a urgencias hospitalarias y/o ingresos hospitalarios a causa de un empeoramiento agudo de su asma, historia de tabaquismo y disponibilidad de un plan de acción escrito conforme a los contenidos recomendados por la Guía Española para el Manejo del ASMA [GEMA 4.3])11. Igualmente, se recogieron los datos de consumo de fármacos SABA equiparándolos a los datos de consumo de MIR (número de envases totales de salbutamol aerosol presurizado dispensados en el último año por cada paciente, número de envases totales de terbutalina inhalador polvo seco dispensados en el último año por cada paciente, número total de envases de SABA [salbutamol+terbutalina] dispensados en el último año por cada paciente, y adecuación entre el empleo de SABA y grado de control).
Con el fin de definir el patrón temporal del uso de MIC se ajustó el número de envases empleados en un año a la duración hipotética del envase de cada presentación. Este último valor fue calculado según la posología habitual definida en la dosis diaria definida (DDD) para cada una de las posibles presentaciones de la MIC21. La adherencia a MIC fue estimada en función de la tasa de posesión de medicación, calculada de acuerdo con la fórmula días cubiertos con la medicación dispensada/días totales entre dispensación inicial y final en el periodo de estudio×100. El punto de corte para clasificar a un paciente como adherente/uso regular se estableció en el 80%, valor normalmente aceptado como umbral de buena adherencia debido a su capacidad para predecir hospitalizaciones en enfermedades crónicas altamente prevalentes22. De acuerdo con ello se establecieron las siguientes categorías: uso regular (>80% del tiempo total prescrito), uso intermitente (<80% del tiempo total prescrito) y no utilización de MIC.
De igual forma, se evaluó la adecuación entre empleo de SABA (salbutamol inhalado y terbutalina inhalada) y grado de control. En este caso se consideró la adecuación de uso en función del número de envases de SABA empleados por paciente y año. Para este cálculo se estimó la duración del envase de la especialidad farmacéutica comercializada (salbutamol aerosol 100μg/pulsación [200 dosis], terbutalina inhalador polvo seco 500μg [100 dosis]), ajustado igualmente a su DDD (0,8mg o 800μg para salbutamol aerosol, 2mg o 2.000μg para terbutalina inhalador polvo seco)19. Dicha correlación entre frecuentación de uso de SABA y grado de control se sustentó en lo establecido por las guías clínicas de la enfermedad (bien controlada: ninguna o≤2 veces a la semana, parcial o mal controlada: >2 veces a la semana)5,9. Para la variable uso excesivo en umbral de riesgo para exacerbaciones se siguieron las recomendaciones publicadas por GINA 20189, predeterminado como más de un envase de salbutamol aerosol 100μg (200 dosis) por mes. Por analogía se ajustó este indicador proporcionalmente a la presentación comercializada de terbutalina inhalador y a su DDD, siendo en este caso redefinido el uso excesivo como más de un envase de terbutalina inhalador polvo seco 500μg (100 dosis) por mes.
Variables y categoríasDatos demográficos- •
Sexo (hombre/mujer).
- •
Edad (fecha de nacimiento).
- •
Tiempo de evolución del asma desde su diagnóstico (años).
- •
Medicación del asma empleada en el momento de su inclusión en el estudio:
- -
Beta-agonistas inhalados de acción corta (sí/no).
- -
Corticoides inhalados en monoterapia (sí/no).
- -
Corticoides inhalados en combinación con long-acting beta-agonists (LABA, «beta-agonistas de acción prolongada») (sí/no).
- -
Antileucotrienos (sí/no).
- -
Otros (sí/no).
- -
- •
Uso de MIC en el último año (corticoides inhalados o corticoides/LABA inhalados).
La MIC incluye todas las presentaciones de las siguientes especialidades farmacéuticas: budesonida inh. (aerosol 200μg, polv. inh. 100μg; 200μg; 400μg), beclometasona inh. (aerosol 250μg), ciclesonida inh. (aerosol 160μg), fluticasona inh. (aerosol 125μg; 250μg, polv. inh: 100μg; 500μg), mometasona inh. (polv. inh. 200μg; 400μg), budesonida/formoterol inh. (polv. inh. 160/4,5μg; 320/9μg), beclometasona/formoterol inh. (aerosol 100/6μg, polv. inh 100/6μg), furoato de fluticasona/vilanterol inh. (polv. inh. 92/22μg; 184/22μg), fluticasona propionato/formoterol inh. (aerosol 125/5μg; 250/10μg), fluticasona propionato/salmeterol inh. (aerosol 125/25μg; 250/25μg, polv. inh 250/50μg; 500/50μg).
- -
Uso regular (>80% del tiempo total prescrito): sí/no.
- -
Uso intermitente (<80% del tiempo total prescrito): sí/no.
- -
No utiliza MIC.
Un uso>80% del tiempo total prescrito equivale a un uso anual>9 meses al año.
Para el cálculo del número de envases empleados por año se ajustó cada presentación de medicación inhaladora controladora a su DDD y a la tasa de posesión de medicación.
- •
Número de exacerbaciones hospitalarias en el último año. Se considera exacerbación hospitalaria las visitas a urgencias hospitalarias y/o los ingresos hospitalarios a causa de un empeoramiento agudo de su asma.
Para su cálculo se consultó las aplicaciones disponibles de visores de Atención Especializada (Horus).
- •
Historia de tabaquismo en el momento de la inclusión en el estudio (fumador actual/exfumador/nunca ha fumado). Se consideró fumador actual si había cualquier consumo en el último mes y exfumador si no había consumo desde hacía más de un mes.
- •
Dispone el paciente de un plan de acción por escrito para el reconocimiento y tratamiento precoz de una crisis de asma (sí/no).
Este plan debe constar de 2 partes básicas (GEMA 4.0):
- -
El tratamiento habitual para situaciones de estabilidad clínica.
- -
Las acciones a realizar en caso de deterioro del asma, es decir, qué medicamentos se deben incrementar para conseguir prevenir la crisis de asma.
La MIR incluye todas las prescripciones de las siguientes especialidades farmacéuticas: salbutamol aerosol 100μg/puls (200 dosis), terbutalina polv. inh. 500μg (100 dosis).
- •
Número de envases totales de salbutamol aerosol prescritos en el último año por cada paciente. Para el cálculo de esta variable se consultó el registro histórico de prescripciones del último año a través del aplicativo de consulta web.
- •
Número de envases totales de terbutalina polv. inh. prescritos en el último año por cada paciente. Para el cálculo de esta variable se consultó el registro histórico de prescripciones del último año a través del aplicativo de consulta web.
- •
Número total de envases de MIR (salbutamol+terbutalina) prescritos en el último año por cada paciente. Para el cálculo de esta variable se consultó el registro histórico de prescripciones del último año a través del aplicativo de consulta web.
- •
Adecuación entre empleo de MIR y grado de control.Para el caso de consumo de salbutamol inhalado se consideró la adecuación con el control según las siguientes recomendaciones:
- -
Parcialmente o no controlada (uso>2 veces/semana): equivalente>un envase salbutamol inh. 100μg (200 dosis) cada 3 meses (sí/no). En el cálculo de este indicador se ha estimado, en caso de requerirse su empleo, un uso medio diario de 2 inhalaciones de salbutamol cada 6h, empleo equivalente a su DDD. Para el criterio de parcialmente o no controlada (uso>2 veces/semana) supone una duración mínima del envase, ajustado al número de dosis por envase, de 3 meses.
Uso excesivo (>un envase de salbutamol inh. 100μg [200 dosis] por mes) (sí/no). En el cálculo de este indicador se han seguido las recomendaciones publicadas por GINA 2018.
Para el caso de consumo de terbutalina inhalada se consideró la adecuación con el control según las siguientes recomendaciones:
- -
Parcialmente o no controlada (uso>2 veces/semana): equivalente>un envase terbutalina inh. 500μg (100 dosis) cada 3 meses (sí/no). En el cálculo de este indicador se ha estimado, en caso de requerirse su empleo, un uso medio diario de una inhalación de terbutalina cada 6h, empleo equivalente a su DDD. Para el criterio de parcialmente o no controlada (uso>2 veces/semana) supone una duración mínima del envase, ajustado al número de dosis por envase, de 3 meses.
- -
Uso excesivo (>un envase terbutalina inh. 500μg [100 dosis] por mes) (sí/no). En el cálculo de este indicador se han seguido las recomendaciones publicadas por GINA 2018 para MIR con envases de 200 dosis, ajustado a la duración hipotética equivalente empleando envases de 100 dosis.
Para el análisis estadístico descriptivo de la muestra se han empleado los métodos descriptivos básicos de modo que, para las variables cualitativas, se ha obtenido el número de casos presentes en cada categoría y el porcentaje correspondiente; y para las variables cuantitativas, los valores mínimo, máximo, media (desviación típica [DT]) o mediana e intervalo intercuartílico (P25-P75).
La comparación entre los grupos se ha realizado con las pruebas Chi-cuadrado, U de Mann-Whitney o Kruskal-Wallis en función del tipo de variable y el número de grupos. Las correlaciones entre variables cuantitativas (uso cuantitativo de SABA y número de exacerbaciones) se han estudiado mediante el coeficiente de correlación de Spearman.
El análisis estadístico se realizó con el programa SPSS 25.0 para Windows. Las diferencias consideradas estadísticamente significativas fueron aquellas cuya p resultase menor de 0,05.
ResultadosLa muestra final del estudio se ha constituido con 442 pacientes asmáticos, de los cuales un 40,5% (n=179) son hombres y un 59,5% mujeres (n=263), con edades comprendidas entre los 18 y los 91 años, con un promedio de 45,4 años (DT 17,6). El tiempo de evolución desde el diagnóstico de asma osciló entre un mínimo de un año y un máximo de 60 años, con un promedio de 15,98 años (DT 10,35). Cabe señalar que en un 26,7% de los sujetos incluidos no constaba en su registro clínico la duración de este periodo.
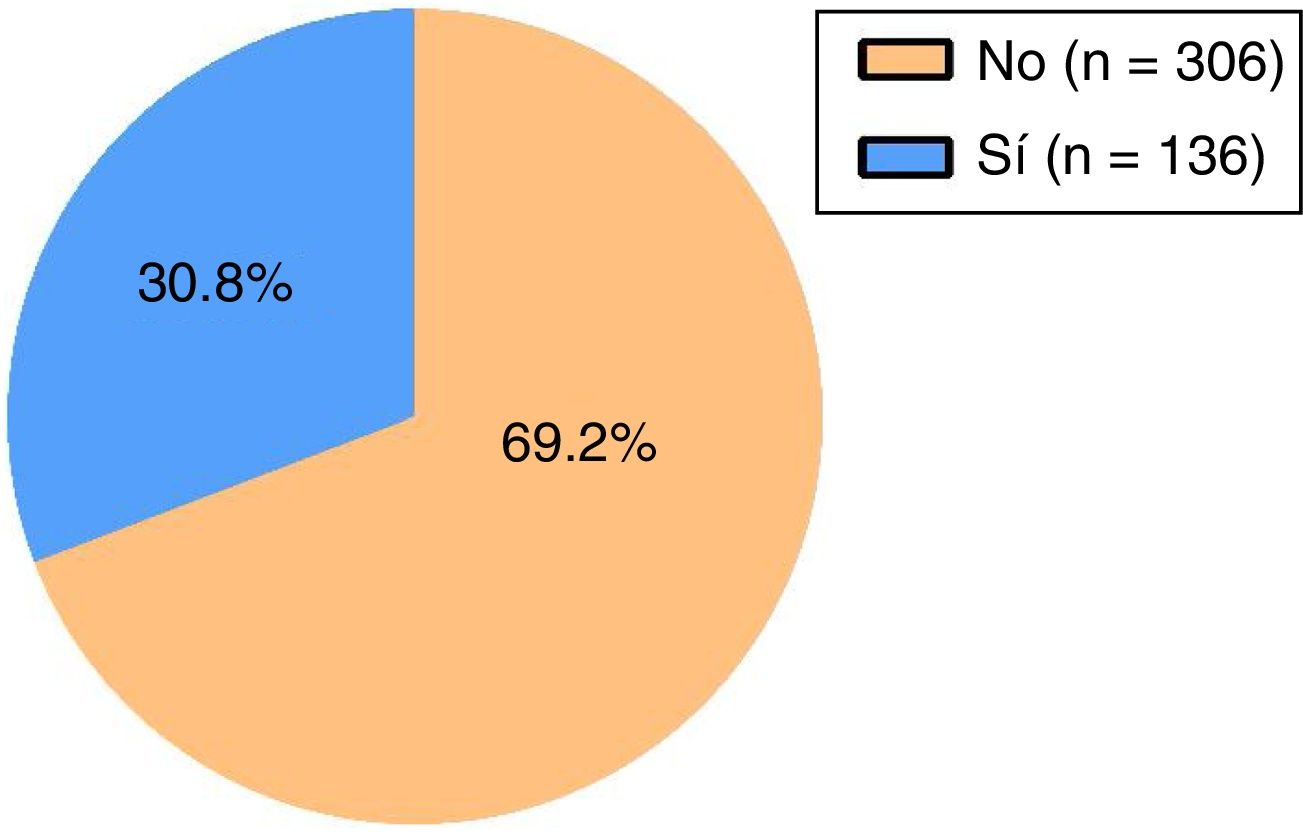
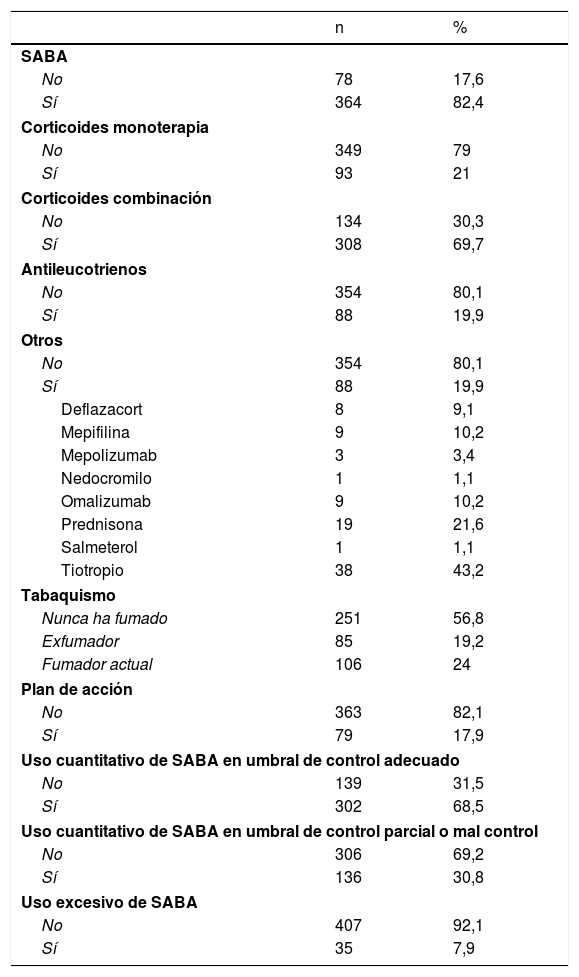
En la tabla 1 se muestra la distribución porcentual y en números absolutos de las variables estudiadas. En el 82,4% de los sujetos se detectaron prescripciones de SABA, en el 21% de corticoides inhalados en monoterapia y en el 69,7% de corticoides en combinación. Respecto a otras variables, el 24% de los individuos eran fumadores y el 17,9% disponía de un plan de acción. Para el uso cuantitativo de SABA, en un 30,8% de los sujetos asmáticos se observaron cifras de utilización en umbrales definitorios de asma parcialmente o mal controlada y en un 7,9% de un uso excesivo.
Variables descriptivas de la población estudiada
| n | % | |
|---|---|---|
| SABA | ||
| No | 78 | 17,6 |
| Sí | 364 | 82,4 |
| Corticoides monoterapia | ||
| No | 349 | 79 |
| Sí | 93 | 21 |
| Corticoides combinación | ||
| No | 134 | 30,3 |
| Sí | 308 | 69,7 |
| Antileucotrienos | ||
| No | 354 | 80,1 |
| Sí | 88 | 19,9 |
| Otros | ||
| No | 354 | 80,1 |
| Sí | 88 | 19,9 |
| Deflazacort | 8 | 9,1 |
| Mepifilina | 9 | 10,2 |
| Mepolizumab | 3 | 3,4 |
| Nedocromilo | 1 | 1,1 |
| Omalizumab | 9 | 10,2 |
| Prednisona | 19 | 21,6 |
| Salmeterol | 1 | 1,1 |
| Tiotropio | 38 | 43,2 |
| Tabaquismo | ||
| Nunca ha fumado | 251 | 56,8 |
| Exfumador | 85 | 19,2 |
| Fumador actual | 106 | 24 |
| Plan de acción | ||
| No | 363 | 82,1 |
| Sí | 79 | 17,9 |
| Uso cuantitativo de SABA en umbral de control adecuado | ||
| No | 139 | 31,5 |
| Sí | 302 | 68,5 |
| Uso cuantitativo de SABA en umbral de control parcial o mal control | ||
| No | 306 | 69,2 |
| Sí | 136 | 30,8 |
| Uso excesivo de SABA | ||
| No | 407 | 92,1 |
| Sí | 35 | 7,9 |
SABA: short-acting beta-agonists («beta-agonistas de acción corta»).
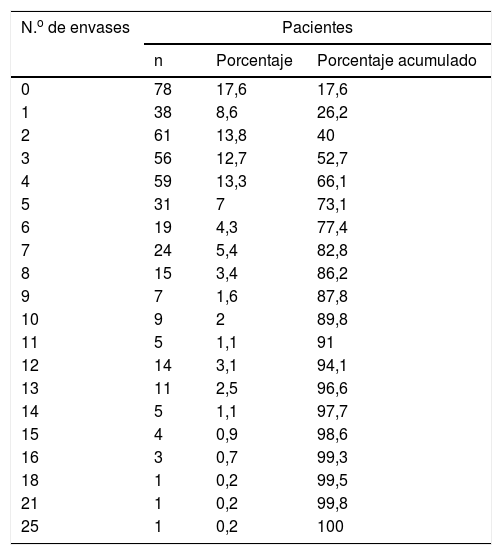
El número total de envases de SABA prescritos en el último año por paciente estuvo comprendido entre los 0 y los 25 envases, con un promedio de 4,26 (DT 4,1). En la tabla 2 se presenta la distribución del número de envases prescritos a los pacientes, siendo la mediana igual a 3 (P25=1 y P75=6).
Distribución del número de envases de SABA prescritos
| N.o de envases | Pacientes | ||
|---|---|---|---|
| n | Porcentaje | Porcentaje acumulado | |
| 0 | 78 | 17,6 | 17,6 |
| 1 | 38 | 8,6 | 26,2 |
| 2 | 61 | 13,8 | 40 |
| 3 | 56 | 12,7 | 52,7 |
| 4 | 59 | 13,3 | 66,1 |
| 5 | 31 | 7 | 73,1 |
| 6 | 19 | 4,3 | 77,4 |
| 7 | 24 | 5,4 | 82,8 |
| 8 | 15 | 3,4 | 86,2 |
| 9 | 7 | 1,6 | 87,8 |
| 10 | 9 | 2 | 89,8 |
| 11 | 5 | 1,1 | 91 |
| 12 | 14 | 3,1 | 94,1 |
| 13 | 11 | 2,5 | 96,6 |
| 14 | 5 | 1,1 | 97,7 |
| 15 | 4 | 0,9 | 98,6 |
| 16 | 3 | 0,7 | 99,3 |
| 18 | 1 | 0,2 | 99,5 |
| 21 | 1 | 0,2 | 99,8 |
| 25 | 1 | 0,2 | 100 |
SABA: short-acting beta-agonists («beta-agonistas de acción corta»).
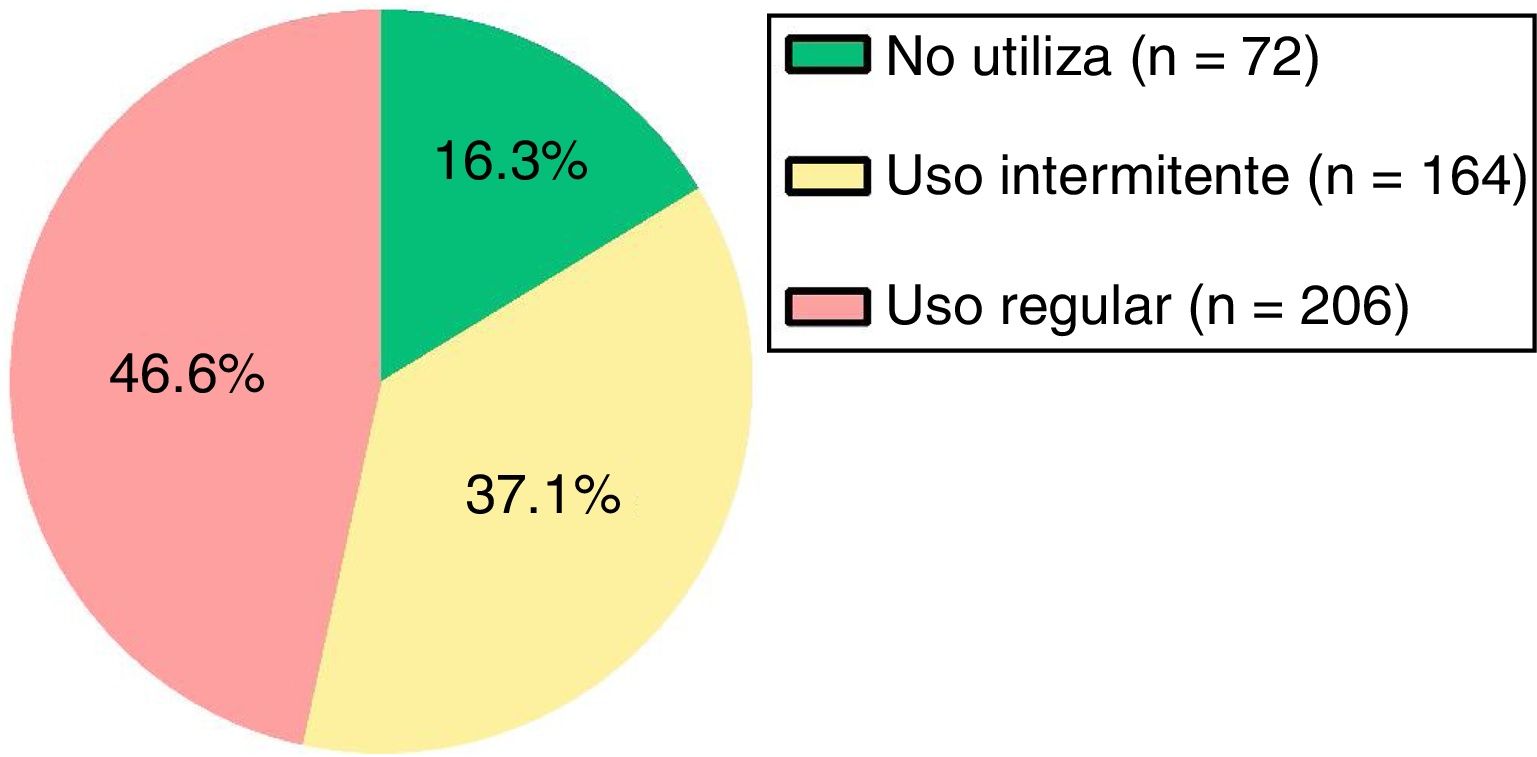
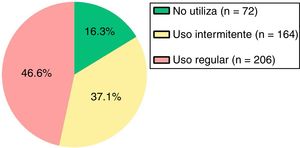
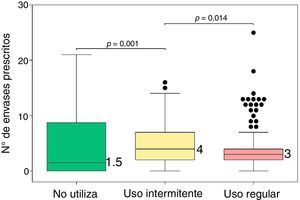
De acuerdo con el cumplimiento en el uso de MIC (fig. 1), en el 46,6% de los pacientes se evidenció un uso regular de la misma.
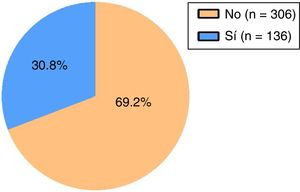
En la figura 2 se muestra la distribución de los pacientes según la frecuencia de uso cuantitativo de SABA para un umbral de asma parcialmente o mal controlada, en la que se observa que el 30,8% de los pacientes presentan un rango de uso de SABA en valores cuantitativos de, al menos, asma parcialmente o mal controlada, mientras que el 69,2% de los pacientes presentan valores de uso de SABA en umbrales de frecuencia correspondientes a un buen control.
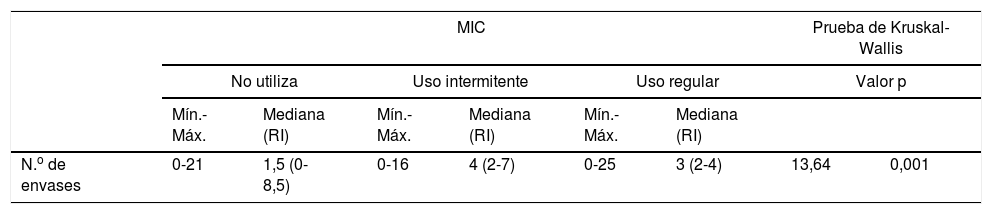
En la tabla 3 se muestra el descriptivo del número de envases SABA prescritos según la cumplimentación en el uso de MIC.
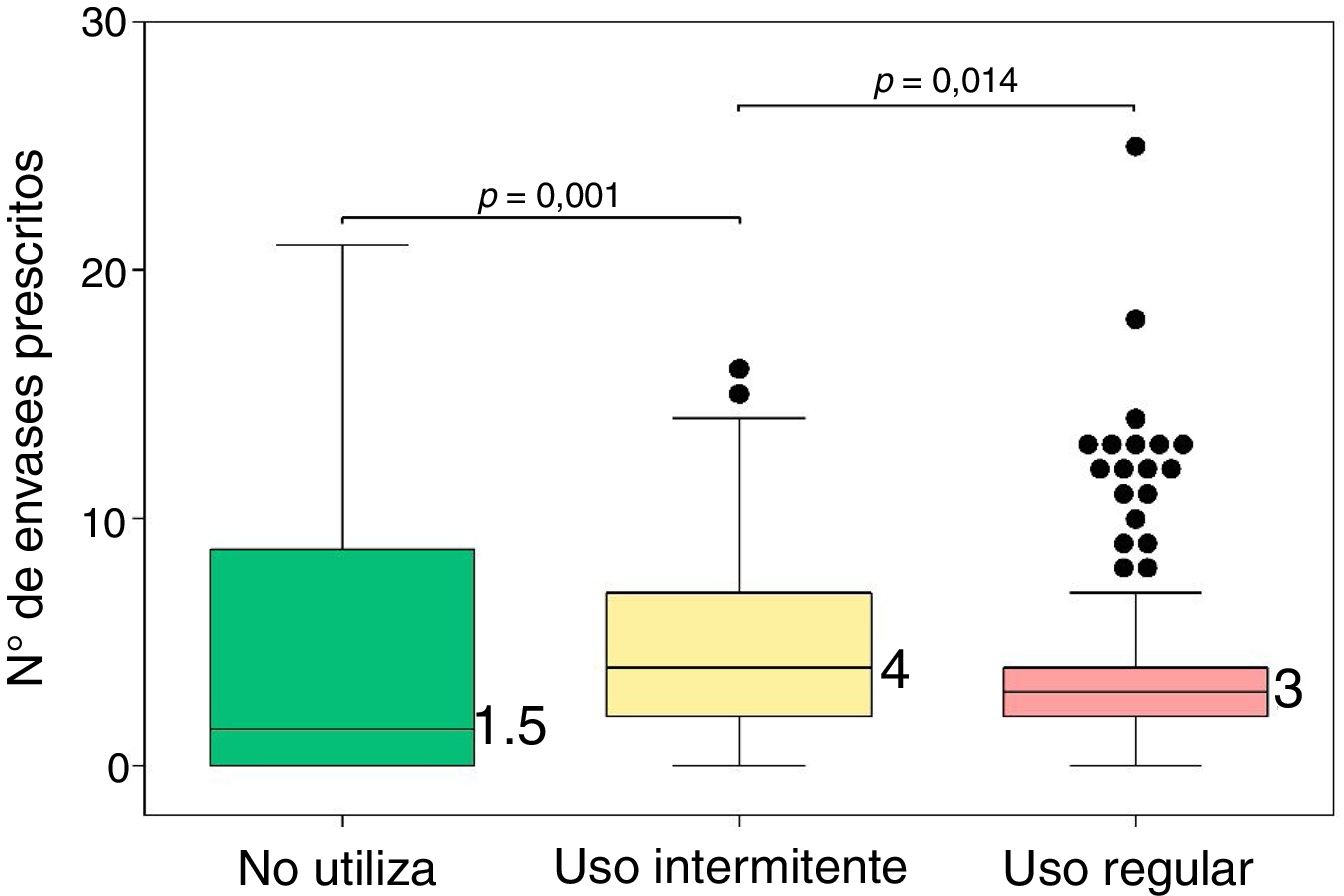
Descriptivo del número de envases según el uso de MIC
| MIC | Prueba de Kruskal-Wallis | |||||||
|---|---|---|---|---|---|---|---|---|
| No utiliza | Uso intermitente | Uso regular | Valor p | |||||
| Mín.-Máx. | Mediana (RI) | Mín.-Máx. | Mediana (RI) | Mín.-Máx. | Mediana (RI) | |||
| N.o de envases | 0-21 | 1,5 (0-8,5) | 0-16 | 4 (2-7) | 0-25 | 3 (2-4) | 13,64 | 0,001 |
Máx.: valor máximo; MIC: medicación inhalada de control; Mín.: valor mínimo; RI: rango intercuartílico (percentil 25-percentil 75).
El número de envases prescritos de SABA en el último año fue significativamente distinto en función del cumplimiento en el uso de MIC (prueba de Kruskal-Wallis: χ2=13,64, p=0,001), de forma que el número de envases prescritos a los pacientes que presentaban un uso intermitente de la MIC fue significativamente superior con respecto al de los pacientes que no utilizaban MIC (p=0,014) y respecto al de los pacientes que presentaban un uso regular de la misma (p=0,001). Entre los pacientes que no utilizaban MIC y los que lo hacían de forma regular no se observó diferencia estadísticamente significativa (p=0,212). En la figura 3 se muestran las diferencias.
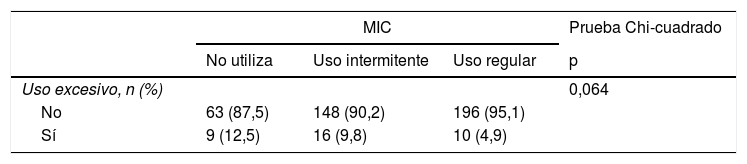
El 12,5% de los pacientes que no utilizan MIC, el 9,8% de los que la usan de forma intermitente y el 4,9% de los que lo hacen de forma regular tienen un uso excesivo de SABA, no siendo la diferencia encontrada estadísticamente significativa, lo que no permite establecer una asociación estadística entre un uso excesivo de SABA y el empleo de MIC. Por otra parte, el número de exacerbaciones hospitalarias de los pacientes con uso regular de MIC fue significativamente inferior con respecto a los pacientes que no lo usan y a los que lo hacen de forma intermitente. Entre los pacientes que no lo utilizan y los que lo hacen de forma intermitente no se observó diferencia estadísticamente significativa en el número de exacerbaciones (tabla 4).
Uso excesivo de SABA y número de exacerbaciones hospitalarias según el empleo de MIC
| MIC | Prueba Chi-cuadrado | |||
|---|---|---|---|---|
| No utiliza | Uso intermitente | Uso regular | p | |
| Uso excesivo, n (%) | 0,064 | |||
| No | 63 (87,5) | 148 (90,2) | 196 (95,1) | |
| Sí | 9 (12,5) | 16 (9,8) | 10 (4,9) | |
ExHOSP: exacerbaciones hospitalarias; MIC: medicación inhalada de control; RI: rango intercuartílico (percentil 25-percentil 75); SABA: short-acting beta-agonists («beta-agonistas de acción corta»).
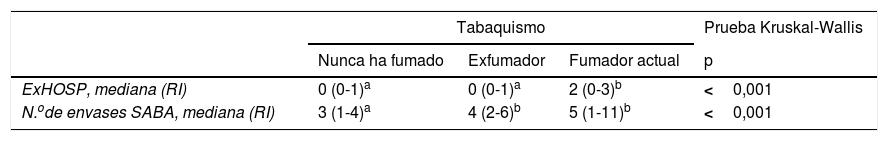
En la tabla 5 se muestra el descriptivo de las variables número de exacerbaciones hospitalarias, envases de SABA, uso cuantitativo de SABA en un umbral definitorio de control adecuado y uso excesivo de SABA según las diferentes categorías de tabaquismo, así como los resultados de las pruebas estadísticas realizadas para comparar las variables según el hábito. El número de exacerbaciones mostró diferencias estadísticamente significativas según el tabaquismo, de forma que los fumadores tienen un número de exacerbaciones significativamente superior con respecto a los no fumadores (p<0,001) y los exfumadores (p<0,001). Entre no fumadores y exfumadores no se observó diferencia significativa (p=0,061). En relación con el número de envases dispensados de SABA, los no fumadores tienen un número de envases significativamente inferior con respecto a los exfumadores (p=0,002) y los fumadores (p<0,001); entre exfumadores y no fumadores no se observó diferencia significativa (p=0,170). El uso de SABA en rango cuantitativo de control adecuado se asoció significativamente con el tabaquismo, de forma que el porcentaje de pacientes que nunca ha fumado y tiene un empleo cuantitativo de control adecuado (79,2%) es significativamente superior con respecto a los exfumadores (60%, p<0,001) y los fumadores (50%, p<0,001), no observándose diferencia entre exfumadores y fumadores.
Número de exacerbaciones hospitalarias, número de envases de SABA, uso de SABA en control adecuado y uso excesivo de SABA según la presencia de tabaquismo
| Tabaquismo | Prueba Kruskal-Wallis | |||
|---|---|---|---|---|
| Nunca ha fumado | Exfumador | Fumador actual | p | |
| ExHOSP, mediana (RI) | 0 (0-1)a | 0 (0-1)a | 2 (0-3)b | <0,001 |
| N.ode envases SABA, mediana (RI) | 3 (1-4)a | 4 (2-6)b | 5 (1-11)b | <0,001 |
| Tabaquismo | Prueba Chi-cuadrado | |||
|---|---|---|---|---|
| Nunca ha fumado | Exfumador | Fumador actual | P | |
| Uso de SABA en control-adecuado, n (%) | <0,001 | |||
| No | 52 (20,8)a’ | 34b (40)b’ | 53 (50)b’ | |
| Sí | 198 (79,2)a’ | 51b (60)b’ | 53 (50)b’ | |
| Uso excesivo de SABA, n (%) | <0,001 | |||
| No | 246 (98)a’ | 80 (94,1)a’ | 81 (76,4)b’ | |
| Sí | 5 (2)a’ | 5 (5,9)a’ | 25 (23,6)b’ | |
ExHOSP: exacerbaciones hospitalarias; RI: rango intercuartílico (percentil 25-percentil 75); SABA: short-acting beta-agonists.
a-b Prueba U de Mann-Whitney: comparaciones 2 a 2.
a’-b’ Comparaciones 2 a 2 Bonferroni.
Por último, el uso excesivo de SABA también se asoció de forma estadísticamente significativa con el tabaquismo. El porcentaje de pacientes fumadores con un uso excesivo (23,6%) es significativamente superior con respecto a los exfumadores (5,9%, p<0,001) y no fumadores (2%, p<0,001), no observándose diferencia entre exfumadores y no fumadores.
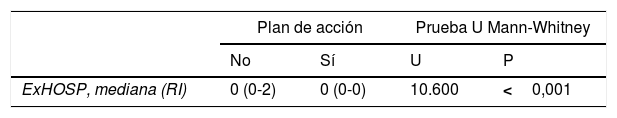
En la tabla 6 se muestra el descriptivo de las variables número de exacerbaciones y uso de SABA con criterios de control adecuado en función de la presencia o no de un plan de acción en asma, así como los resultados de las pruebas estadísticas realizadas para comparar las variables según el plan de acción. El número de exacerbaciones mostró diferencias estadísticamente significativas, de forma que el número de exacerbaciones cuando se tiene un plan de acción es significativamente inferior con respecto a cuando no se tiene un plan. El uso de SABA en umbrales cuantitativos correspondientes a un control adecuado se asoció significativamente con la presencia de un plan de acción, de forma que el porcentaje de pacientes que tiene un plan de acción hacen uso del SABA en un rango de control adecuado en un número significativamente superior (81%) con respecto al porcentaje hallado cuando no se tiene dicho plan (65,7%).
Número de exacerbaciones hospitalarias y uso cuantitativo de SABA en rango de control adecuado según la presencia o no de un plan de acción
| Plan de acción | Prueba U Mann-Whitney | |||
|---|---|---|---|---|
| No | Sí | U | P | |
| ExHOSP, mediana (RI) | 0 (0-2) | 0 (0-0) | 10.600 | <0,001 |
| Plan de acción | Prueba Chi-cuadrado | |||
|---|---|---|---|---|
| No | Sí | χ2 | p | |
| Control adecuado, n (%) | 7,002 | 0,008 | ||
| No | 124 (34,3)a’ | 15 (19)b’ | ||
| Sí | 238 (65,7)a’ | 64 (81)b’ | ||
ExHOSP: exacerbaciones hospitalarias; RI: rango intercuartílico (percentil 25-percentil 75); SABA: short-acting beta-agonists.
a’-b’ Comparaciones 2 a 2 de Bonferroni.,
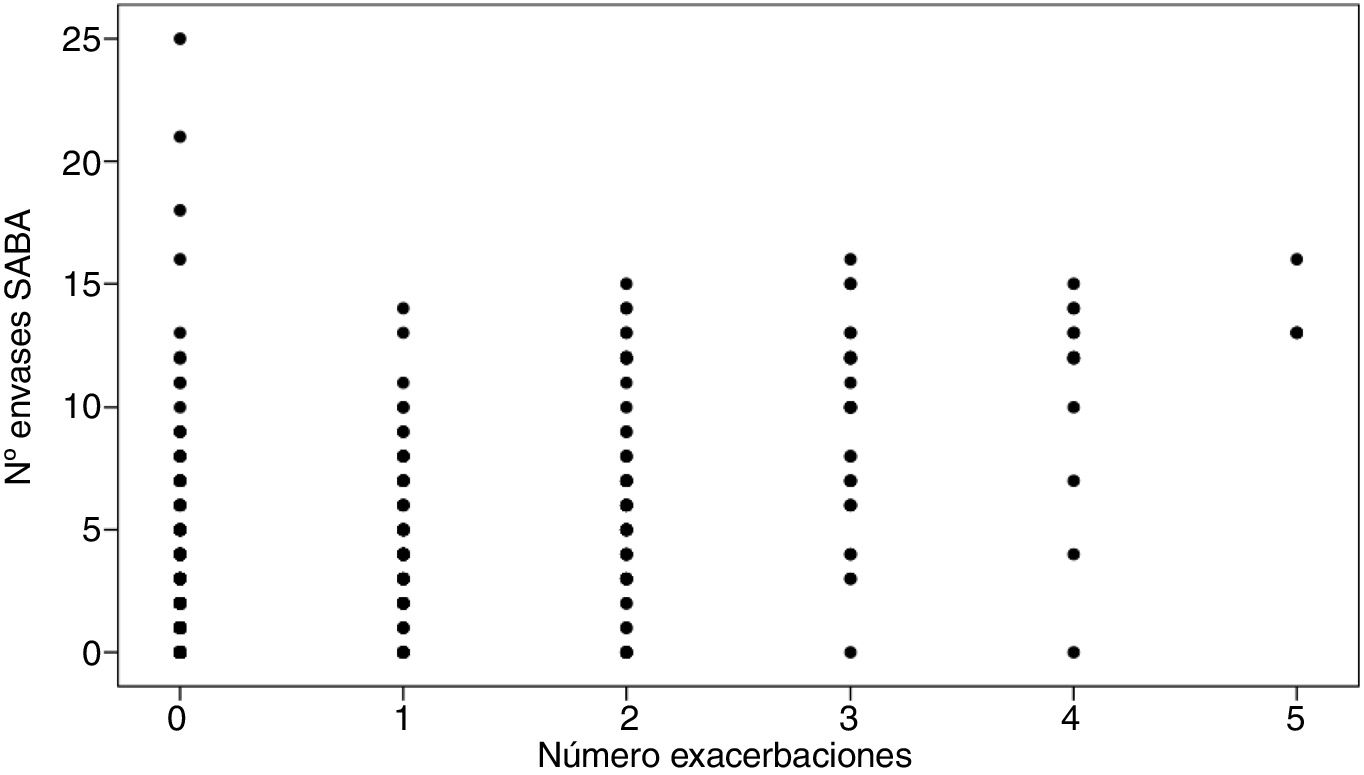
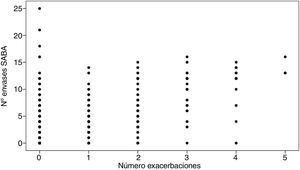
Para determinar la posible asociación entre el número de exacerbaciones y el número de envases prescritos de SABA se calculó el coeficiente de correlación de Spearman, cuyo resultado evidenció que existe una relación positiva y estadísticamente significativa entre ambas variables: 0,474 (p<0,001), de forma que a mayor número de envases prescritos, mayor número también de exacerbaciones asmáticas hospitalarias (fig. 4).
DiscusiónDe acuerdo con los objetivos propuestos del estudio, se evidencia en la población analizada un uso de SABA por encima, en términos cuantitativos, de lo recomendado por las guías y normativas del asma.
El número promedio de envases prescritos de SABA por paciente durante el año de estudio fue de 4,26 (DT 4,1), lo que supone un envase prescrito cada 3 meses. Hasta un 30,8% de los sujetos disponían de prescripciones de SABA en un rango de uso en valores cuantitativos predefinidos de al menos asma parcialmente o mal controlada. Además, del total de individuos estudiados, un 7,9% tuvieron prescripciones de 12 o más envases de SABA en el año, cantidad descrita por la normativa GINA como uso excesivo y, al mismo, tiempo considerada un factor de riesgo para presentar exacerbaciones, aun cuando los síntomas estén bien controlados12. Estas cifras son similares e incluso superiores a las encontradas en otros estudios que describen el uso SABA en población asmática23,24. Igualmente es conocido que un uso excesivo de SABA está también relacionado con la mortalidad por asma, llegando a observarse en estudios epidemiológicos retrospectivos que hasta un 39% de los pacientes fallecidos por asma tienen prescripciones en el año previo en un rango superior a 12 inhaladores de SABA25. Dicha asociación entre uso excesivo de SABA y mortalidad ya ha sido previamente descrita en la literatura científica, incluso para usos inferiores a 12 cartuchos por año26,27. No obstante, el umbral por encima del cual queda definido el uso excesivo de SABA no está claramente identificado por los profesionales. En este sentido, y a pesar de que la Revisión Nacional de Muertes por Asma del Reino Unido identificó la alta prescripción de SABA como un factor clave en más del 40% de las muertes analizadas, cuando se ha entrevistado a expertos en asma para describir el uso de SABA en la práctica clínica habitual se observa una disparidad en la forma en que se define, en términos cuantitativos, el uso aceptable, variando esta frecuencia de 0,5 (100 dosis/año) a 12 inhaladores de SABA (2.400 dosis/año)28. Esta circunstancia contrasta con el hecho de que profesionales y pacientes llegan a identificar precisamente la elevada frecuencia de uso de SABA como una de las variables que mejor predice la percepción de falta de control de la enfermedad29.
Por otro lado, y en oposición al uso excesivo, un 17,6% de los sujetos de nuestro estudio no tuvieron ninguna prescripción de SABA durante el año de estudio, circunstancia de la que podría deducirse una situación de enfermedad controlada, al menos desde el punto de vista de necesidad de medicación de rescate.
En cuanto a las prescripciones de otros tratamientos antiasmáticos, un 90,7% de los pacientes incluidos en el estudio recibía prescripciones de MIC, ya fuesen corticoides inhalados en monoterapia (21%) o en combinación con LABA (69,7%), constituyendo una distribución de MIC muy similar a la encontrada en estudios con poblaciones asmáticas similares30,31. En el caso de combinaciones LABA-corticoides inhalados, no se han identificado aquellas situaciones con un uso de mantenimiento y rescate single inhale maintenance and reliever therapy y que, por consiguiente, supondrían la no utilización de SABA en estos casos.
Un 19,9% había recibido prescripciones en el último año de antileucotrienos, y la misma proporción de pacientes (19,9%) disponía de otros tratamientos prescritos más minoritarios, incluyendo en este grupo fármacos como mepifilina, corticosteroides orales, fármacos biológicos, LABA inhalados, anticolinérgicos de larga duración inhalados y/o antiinflamatorios estabilizadores de mastocitos.
Respecto a la adherencia farmacológica a la MIC, en menos de la mitad de los sujetos (46,6%) se observó un uso regular de dicha medicación a lo largo del año de estudio. Esta falta de adherencia a la medicación controladora está ampliamente descrita en la literatura que ha revisado este tema. Sin embargo, la mayoría de dichos estudios presentan una gran heterogeneidad metodológica, definiciones desiguales de adherencia y métodos diferentes de cálculo, que los hace difícilmente comparables, mostrando resultados con una gran variación que oscila del 30 al 70%32–34. En cualquier caso, dicho hallazgo parece constatarse repetidamente en los estudios observacionales y también se confirma en nuestro estudio35.
Analizadas las diferentes variables estudiadas, observamos una asociación entre el uso de SABA (número de envases prescritos) y la falta de adherencia a la MIC, de modo que el número de envases prescritos a los pacientes que presentaban un uso intermitente de la MIC fue significativamente superior con respecto al de los pacientes que presentaban un uso regular de la misma (p=0,001). Esta concordancia entre elevado uso de SABA y baja adherencia a la medicación controladora ya había sido referida recientemente por Urrutia et al.36. En este sentido, parece lógico pensar que en muchos pacientes esta ausencia de medicación controladora haya podido ser suplida con un aumento en el uso de medicación de rescate.
Paradójicamente, esta asociación no se observa entre los pacientes que no utilizaban MIC y los que lo hacían de forma regular, no hallando diferencia estadísticamente significativa en el número prescrito de envases de SABA de ambos grupos. Entre las explicaciones posibles para esta falta de asociación intuimos que, formando parte del grupo de los pacientes sin MIC, pudiese existir también un elevado número de pacientes con asma leve intermitente que tampoco precisasen, a criterio de sus clínicos, tratamiento con SABA. Esto último no deja de ser una hipótesis interpretativa que, sin embargo, no ha sido posible corroborar con los datos obtenidos.
Paralelamente encontramos un mayor porcentaje de asmáticos con un uso excesivo (>12 envases de SABA/año) entre aquellos que no usan MIC (12,5%) respecto a los que presentan un uso intermitente (9,8%) y un uso regular (4,9%), pero en este caso sin llegar a alcanzar una significación estadística que permita establecer una asociación.
Para otras variables clínicas, el uso de SABA, tanto en número de envases como en el patrón de uso excesivo de SABA, se asoció de forma estadísticamente significativa con el tabaquismo. En este caso, el porcentaje de pacientes fumadores con un uso excesivo de medicación de rescate fue significativamente superior con respecto a los exfumadores y no fumadores, relación que ya ha sido previamente establecida en otros estudios36,37. Tradicionalmente es conocido que el tabaquismo es un potente modulador pronóstico del asma determinando en los fumadores asmáticos más síntomas, mayor número de exacerbaciones y una peor respuesta a los corticoides inhalados, circunstancias que podrían explicar dicha asociación con el sobreuso de medicación de rescate38,39. Por otro lado, cabe señalar que la proporción de fumadores encontrada en nuestra muestra (24%) es muy similar a la hallada en estudios con similares pacientes40 y a la prevalencia de tabaquismo en la población general1.
Otra variable analizada en nuestro estudio fue la presencia de exacerbaciones hospitalarias. Para dicha variable se encontró una asociación positiva con el número de SABA prescritos, de manera que a mayor uso de SABA se observó también un mayor número de exacerbaciones. Diversos estudios que han analizado este aspecto señalan esta misma vinculación, aunque mostrando diferencias en la predefinición de sobreuso y variaciones en la magnitud de la asociación18,34. Igualmente, tanto la presencia de tabaquismo como la ausencia de un plan de acción por escrito se asociaron positivamente con el número de exacerbaciones hospitalarias. En este sentido, resulta llamativo que apenas un 18% de los sujetos estudiados dispusiese de un plan de acción por escrito. La disponibilidad de dicho plan por el paciente se asoció directamente con el uso de SABA en rango cuantitativo de asma bien controlada y de modo inverso con las exacerbaciones hospitalarias.
Nuestro estudio no está exento de algunas limitaciones. En cuanto al diseño, la asociación descrita entre variables clínicas de modo bivariante no permite establecer una dirección en la relación causa-efecto ni inferencia causal, por lo que es posible que la coexistencia de factores confusores no medidos pueda producir sesgos. Por otra parte, toda la información analizada fue obtenida de las historias clínicas y de sus registros informatizados, a modo de audit clínico, sin la necesidad de recurrir a entrevistas clínicas directas con los sujetos. Ello supone que la recogida de información y su relevancia esté en fuerte dependencia con el grado de calidad del registro clínico, pudiendo existir cierta discordancia latente entre el registro analizado y la práctica clínica real. Respecto a la variable principal medida, el número de prescripciones de SABA, fue consultado con los datos disponibles en el sistema informatizado de prescripción de la historia clínica, lo que impediría recoger aquellas prescripciones no vehiculizadas por este procedimiento (recetas de sistemas sanitarios privados, dispensación farmacéutica de SABA sin receta). Igualmente, debe considerarse una sobrestimación del efecto en situaciones de dispensación de SABA sin uso real del mismo. Estos aspectos no deben ser obviados si tenemos en cuenta el elevado volumen de prescripciones existentes de este subgrupo terapéutico. Como ejemplo cabe señalar que la especialidad farmacéutica más dispensada de salbutamol inhalado significó a su vez el séptimo medicamento más vendido en España durante el año 2018, con un volumen de ventas que alcanzó los 7,6 millones de unidades41.
Existen otras limitaciones referentes a la selección de los pacientes. La verificación del diagnóstico de asma no fue analizada por no ser objeto del estudio, lo que podría afectar a la representatividad de la muestra. Tampoco se identificaron los diferentes niveles de gravedad de la enfermedad, circunstancia que intuimos podría modificar la distribución de algunas variables clínicas.
ConclusionesPor último y como resumen debemos concluir que en nuestra muestra hemos hallado un porcentaje considerable de asmáticos que presentan elevadas dispensaciones de envases de SABA, en rangos cuantitativos definitorios de asma parcialmente controlada o mal controlada. Paralelamente se observa una relación directa entre uso cuantitativo de SABA y uso intermitente de MIC, y de igual manera una relación positiva entre el número de envases de SABA prescritos y el número de exacerbaciones hospitalarias. Además, tanto la presencia de tabaquismo como la ausencia de un plan de acción por escrito se asocian positivamente con el número de exacerbaciones hospitalarias y con la posibilidad de un uso cuantitativo de los SABA por encima de los umbrales de control adecuado.
En definitiva, nuestro estudio se alinea con las diversas investigaciones en población asmática que confirman el sobreuso de SABA y su relación directa con la probabilidad de eventos clínicos adversos. En consonancia con ello, parece necesario demandar a los clínicos un mayor esfuerzo profesional en la búsqueda y detección de este sobreuso y, al mismo tiempo, desarrollar intervenciones educativas que faciliten un uso más racional y seguro de la medicación de rescate.
FinanciaciónEste estudio ha recibido financiación no condicionada de la compañía ASTRA ZENECA España. Dicha compañía no ha participado en ninguna fase del desarrollo de la investigación, análisis de resultados, redacción del manuscrito o revisión del contenido final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.