El cáncer de próstata (CP) es la neoplasia primaria más frecuente en varones del mundo desarrollado, y la segunda causa de muerte por cáncer en varones de los Estados Unidos, por detrás del cáncer broncopulmonar. En Europa supone la tercera causa de muerte por cáncer en varones (tras los cánceres broncopulmonar y colorrectal). En la actualidad el papel del screening del CP está cuestionado.
En el siguiente artículo se resumen los aspectos epidemiológicos más relevantes del CP, así como los principales ensayos clínicos sobre cribado de CP, y las recomendaciones de las diferentes asociaciones científicas médicas sobre la realización o no del cribado del CP.
Prostate cancer (PC) is the most common malignancy in men in the developed world and the second leading cause of cancer death in men in the USA, behind lung cancer. In Europe, it is the third leading cause of cancer death in men (after lung and colorectal cancers). The role of PC screening is currently being questioned.
The following article summarises the most relevant epidemiological aspects of PC, as well as major clinical trials of PC screening, and recommendations of the various medical scientific associations on whether or not to screen for PC.
El cáncer de próstata (CP) es el tumor de mayor prevalencia en el hombre. Su detección precoz y tratamiento en fases iniciales aumentan sus perspectivas de curación1.
Con relación a otros cánceres, el CP habitualmente es de crecimiento lento y aparece en edades más tardías, razón por la que la adopción de medidas enfocadas a su prevención podrían ser más útiles que en otros tipos de tumores1.
Para su prevención y detección en fases tempranas debemos considerar la presencia de distintos factores de riesgo, para que así podamos actuar mediante una serie de medidas diagnósticas y terapéuticas con el objetivo de disminuir su incidencia y aumentar la supervivencia de los hombres con CP1.
El CP tiene unas características que nos interesa conocer. Su prevalencia histológica es más elevada que su incidencia clínica. Es un tumor con una elevada tasa de enfermedad subclínica y un bajo riesgo de mortalidad. Algunos estudios nos indican que pacientes con tumores de bajo riesgo y localizados, sin ningún tratamiento, mediante una vigilancia expectante tras 5-10 años de seguimiento, presentan unas bajas tasas de mortalidad, lo que nos indica que no todos los CP requieren un tratamiento activo2.
Epidemiología del cáncer de próstataEl CP es, a nivel mundial, el segundo cáncer más comúnmente diagnosticado (tras el cáncer de pulmón), y representa la quinta causa de muerte por cáncer en varones (6,6% del total de defunciones)3. En Europa la incidencia del CP ha aumentado desde la década de los 90 (7% anual)4, siendo el cáncer más diagnosticado en 2012 (más de 400.000 casos nuevos)3. Algo similar se observa en España donde las tasas estimadas, a partir de los registros de base poblacional, se incrementan (1,3% anual en el periodo 1975-1990 y 7,3% anual en el periodo 1990-2004)5. En 2012, con 27.853 casos nuevos diagnosticados, se convierte en el cáncer más frecuente en hombres3.
Es uno de los tumores que aparecen en edades más avanzadas. La mayoría de los CP se diagnostican a partir de los 65 años de edad: el periodo de 70-75 años de edad es el de mayor tasa de incidencia2. En menores de 50 años su incidencia es del 1%1.
El CP constituye una de las enfermedades oncológicas de mayor prevalencia en Europa, con un amplio impacto en la atención sanitaria6. Causa el 3% de las muertes de los hombres de la Unión Europea (UE) y el 10% de las muertes en varones por tumores malignos1. La tasa de mortalidad en la UE es de 10,5/100.000 hombres1.
España, junto a Grecia, Francia e Italia, es uno de los países europeos con menor tasa de mortalidad por este cáncer. Los países centroeuropeos, nórdicos y Estados Unidos, presentan una tasa de mortalidad más elevada1.
Posiblemente las diferencias entre países pueden ser reflejo de distintos factores de riesgo, como ocurre con el envejecimiento de la población, sobre todo en los países más desarrollados, y con la generalización del empleo del antígeno prostático específico (PSA) como test de cribado7.
En los últimos años la tasa de mortalidad por CP ha descendido ligeramente, aunque no se observa un descenso en la mortalidad global, por lo que una ligera mejora en la supervivencia del CP incrementa la probabilidad de que los varones mueran por otra causa7. Es un tumor con una elevada tasa de enfermedad subclínica en la población general, lo que hace necesario que conozcamos tanto su magnitud como la forma de presentación clínica del CP para poder planificar su diagnóstico y tratamiento adecuadamente6.
Prevención primaria: factores de riesgo del cáncer de próstataLas causas que se relacionan con el CP no están bien definidas1,8. Se le vincula con varios factores. Los 3 que más se han relacionado con el CP son la edad, la raza y los factores genéticos.
- 1.
La edad. Cerca del 80% de los CP aparecen en varones de 64 o más años de edad1. A diferencia de otros tumores, con una edad de máxima incidencia, el CP aumenta paulatinamente con la edad. La probabilidad de desarrollarlo antes de los 40 años es de 1/10.000, de 1/103 entre 40 y 49 años y de 1/8 entre 60 y 79 años. Si viviéramos lo suficiente, todos los hombres acabarían padeciendo un CP histológico.
- 2.
Raza. El CP es más frecuente en hombres afroamericanos (100 casos×100.000) que en hombres blancos (70 casos×100.000). La población asiática (China, Japón) tiene una menor incidencia de CP clínico. Los estudios de migración nos señalan que estos varones tienden a adquirir el riesgo del país que los recibe, lo que nos indicaría la existencia de factores no controlados por los genes (epigenéticos)1.
- 3.
Factores genéticos. En torno a un 9-10% de los casos de CP tienen una base genética. En los varones diagnosticados de CP antes de los 50 años de edad, esta proporción es superior al 40%. El riesgo es 2 veces mayor entre los hijos de varones con CP. Se ha identificado un locus causante en el cromosoma 1q24-25, existiendo asociación con el gen BRCA-1 para el cáncer de mama, sobre todo en familias con tres o más varones afectos de CP1.
En las distintas poblaciones mundiales no existe diferencia en la incidencia de CP latente, aunque sí que existen diferencias significativas de CP clínico entre distintos lugares geográficos1. Se piensa que existen factores ambientales asociados a la exposición a plaguicidas, metales como cinc, cadmio, etc.1,8.
Factores dietéticosLa dieta últimamente se constata como un posible elemento de prevención del riesgo para el CP. Se puede disminuir el riesgo de padecer CP siguiendo una dieta baja en grasas y rica en verduras, frutas y cereales8. Se ha publicado en el año 2014 un estudio en el que se aboga por la dieta mediterránea y la toma de brócoli como medidas preventivas contra el CP9. Estudios anteriores no observaban un gran beneficio1.
- -
Diversos estudios epidemiológicos han mostrado una relación directa entre la obesidad, el síndrome metabólico y el CP1,8,10. El Cancer Prevention Study demostró que los hombres con un índice de masa corporal superior a 32,5 kg/m2 presentaban más probabilidad de morir de CP1.
- -
La ingesta elevada de calcio se relaciona con aumento del riesgo de CP1.
- -
La ingesta de alimentos ricos en selenio y licopeno (tomate) se relacionó durante mucho tiempo con una disminución del riesgo de CP1,8. Sin embargo, estudios recientes no encuentran una gran asociación entre la toma de licopeno y la disminución del riesgo de CP8. Los autores aducen que los estudios anteriores no tenían en consideración el sesgo que generaba la toma de otros productos vegetales y antioxidantes11.
- -
Otros estudios indicaban el papel protector de la vitamina E1. Los recientes datos del estudio Selenium and Vitamin E Cancer Prevention Trial (SELECT), iniciado en el año 2001, sobre un total de 35.000 varones, nos indican todo lo contrario: se ha observado que la toma aislada de vitamina E aumenta el riesgo de CP en un 17%. En este mismo estudio, comparado con el grupo placebo, no se observó un aumento significativo de CP en los pacientes que tomaban selenio o la asociación de vitamina E y selenio12.
- -
La toma de los antioxidantes ya citados y vitamina A teóricamente disminuyen el riesgo de CP, al reducir el estrés oxidativo y sus efectos nocivos. Un metaanálisis de estudios realizados en prevención primaria y secundaria, publicado en la revista JAMA en el año 2007, cuestiona estos beneficios13. El beneficio con los suplementos de antioxidantes aparece en los hombres fumadores y en los que tienen niveles bajos1.
- -
La ingesta de té verde puede ser beneficiosa en la prevención, sobre todo en aquellos pacientes con neoplasia intraepitelial prostática (PIN)1.
Se han relacionado con la presencia de CP1. Con base en esta premisa se han realizado 2 estudios preventivos, uno con finasterida14 y otro con dutasterida15. Ambos fármacos neutralizan la acción de la 5 alfa reductasa de la próstata. Dutasterida disminuyó significativamente el número total de CP, sobre todo de bajo y medio grado, y aumentó muy ligeramente el diagnóstico de CP de alto grado. En pacientes con hiperplasia benigna de próstata, dutasterida podría aportar una disminución en el riesgo de presentar CP.
VirusSe sospecha que distintos virus como el del herpes, citomegalovirus, papiloma e infecciones bacterianas de transmisión sexual puedan ser una causa de CP en varones con susceptibilidad genética1.
AntiinflamatoriosAlgunos estudios relacionan la toma habitual de antiinflamatorios (ibuprofeno, aspirina, etc.) con la disminución del riesgo de presentar CP1,8. Actualmente no se puede aconsejar, y se deben valorar los efectos secundarios en pacientes susceptibles de padecer enfermedad gástrica8.
Actividad sexualSe ha relacionado positivamente en la prevención del CP1. La vasectomía, que algunos autores citaban como un factor de riesgo, no parece que esté relacionada con el CP1.
En conclusión, se sabe poco de los factores etiológicos asociados al desarrollo y progresión del CP. En la actualidad, solo la edad, la raza y los antecedentes familiares se establecen como factores de riesgo. A pesar de la gran cantidad de información existente hasta el momento, los resultados contradictorios hacen imposible dar recomendaciones. Aunque puedan ser relevantes las conclusiones de algunos estudios, se precisan ensayos epidemiológicos bien diseñados y con mayor poder estadístico que midan el efecto de la ingesta dietética o de la actividad física en el riesgo del CP y que aclaren su papel en su etiología16–18.
En la gran mayoría de los estudios de prevención primaria que valoran como objetivo final la supervivencia del CP, la muerte generalmente se debe a causas distintas al CP, sobre todo por otros tumores y enfermedades cardiovasculares1,8. Esto nos indica que, indistintamente de su efecto protector o no con relación al CP, los hábitos de vida saludables nos aportan beneficios más allá, sobre todo en la esfera cardiovascular1,8.
Cribado de cáncer de próstata o diagnóstico precozEl cribado poblacional debe ofrecerse a poblaciones mayoritariamente sanas2,19, y la enfermedad debe cumplir una serie de requisitos para que sea eficaz (tabla 1)2.
Características que deben tener una enfermedad y las pruebas de cribado para que sea beneficiosa su realización
| Enfermedad: |
| - Prevalencia elevada |
| - Periodo presintomático |
| - Tratamiento efectivo |
| Prueba de cribado |
| - Segura |
| - Asequible |
| - Aceptable para la población, mínima morbilidad |
| Recursos para el diagnóstico y tratamiento |
Fuente: Tomado de Brenes2.
El cribado tiene como objetivo identificar las enfermedades en una primera etapa tratable, antes de que los síntomas se hayan desarrollado, para así tener más posibilidades de éxito en su tratamiento19,20. Antes de incluir una actividad de cribado, se han de valorar las consecuencias positivas y las negativas de las diferentes pruebas necesarias para su diagnóstico, y de las distintas alternativas terapéuticas, por lo que se debe realizar un análisis continuo en el tiempo de los beneficios y perjuicios1,2,19.
A los varones que soliciten o sean invitados a participar en programas de prevención secundaria de CP se les debe informar sobre los aspectos positivos y negativos para que libremente decidan si se exponen o no a los posibles efectos secundarios1,2 (tabla 2).
Aspectos negativos y positivos de la detección precoz del CP
| Beneficios |
| • La detección precoz y el tratamiento en una fase potencialmente curable de CP ofrece más posibilidades de supervivencia con enfermedad localizada • Tranquilidad de estar en bajo riesgo para el CP • El PSA se obtiene con una simple analítica de sangre: es muy accesible |
| Limitaciones |
| • Leve aumento de la supervivencia del CP. No afecta a la mortalidad global • Un falso resultado positivo puede conducir a un aumento de la ansiedad, con las posibles complicaciones asociadas con la biopsia (dolor, hematospermia/hematuria, infección) • El CP puede ser de crecimiento lento y no causará enfermedad ni muerte • El tratamiento puede causar tanto a corto como a largo plazo efectos secundarios (dolor, incontinencia urinaria, disfunción eréctil) • Falsa tranquilidad de una prueba normal (falsos negativos), lo que lleva a un retraso en el diagnóstico del CP |
Fuente: Tomado y adaptado de Brenes1.
Se pretende que sea el paciente quien tome la decisión, y no el médico. Al ser el cribado de CP una intervención de resultados algo inciertos, si el médico la toma, puede que esté imponiendo al paciente sus valores y actitudes en la evaluación del riesgo2,21. El consentimiento informado constituye un reto para los profesionales y para las instituciones sanitarias1. La realización de cribado de CP en población asintomática es controvertida. Debe realizarse fundamentalmente en aquellos individuos que presentan factores de riesgo1.
El diagnóstico precoz del CP generalmente se realiza mediante la determinación de los valores de PSA, que puede asociarse o no con la realización de tacto rectal (TR)2. El cribado de CP mediante la determinación generalizada de PSA es motivo de controversia20.
La aparición del PSA en 1970 y la generalización de su uso en la década de los noventa aumentaron el diagnóstico de CP22. Por fin parecía que contábamos con el elemento diagnóstico necesario para la detección precoz de esta enfermedad. La realidad nos muestra la variabilidad de la sensibilidad y especificidad de esta prueba si la realizamos de forma aislada, así como la dificultad para conocer realmente cuántos pacientes con un PSA considerado normal presentan verdaderamente un CP, ya que no sería éticamente aceptable la realización sistemática de biopsia prostática a toda la población masculina asintomática con cifras normales de PSA20.
En varones de 60 o más años de edad se aceptan como valores normales de PSA los comprendidos entre 0 y 4ng/ml. Hasta los 60 años se han considerado cifras de PSA dentro de la normalidad entre 0 y 3ng/ml20.
La probabilidad de presentar CP con valores de PSA entre 4-10ng/ml es del 30% y es superior al 50% para valores superiores a 10ng/ml22.
El TR solo capta un 10% del CP en una fase inicial y su valor predictivo positivo (VPP) es del 40% en manos muy expertas20. Se ha propuesto, para suprimir la realización del TR, bajar las cifras de corte del PSA a 3ng/ml2. Si el PSA es superior al valor asignado en la realización de cribado, deberíamos añadir siempre la realización de ecografía transrectal y biopsia prostática2.
Algunos autores indican que la realización de TR, junto a la determinación del PSA, aumenta el número de diagnósticos de CP. La sensibilidad y especificidad del TR aislado es baja20.
El PSA no es un marcador específico de cáncer, sino de órgano. Puede estar elevado en: hiperplasia benigna de próstata, prostatitis, retención aguda de orina, otras infecciones del aparato urinario y situaciones tales como manipulación con catéter, biopsia prostática, tras relaciones sexuales o tras realización de TR. Puede estar disminuido en varones que toman fármacos inhibidores de la enzima 5 alfa reductasa de la próstata y en varones encamados20.
Para evitar la iatrogenia y la realización de exploraciones no necesarias, durante la década de los noventa se han desarrollado otros parámetros del PSA válidos en valores de hasta 10ng/ml (densidad PSA, velocidad PSA, PSA libre y PSA según edad)22. De estos valores, el más usado es el PSA libre. Se considera como límite de normalidad si el porcentaje es superior al 20%. Si la fracción del PSA libre es inferior al 10%, el VPP es del 56%, y cuando es superior al 25%, el VPP baja al 8%, lo que indica que un PSA libre elevado no descarta la presencia de un CP, aunque desciende mucho la probabilidad de que exista20.
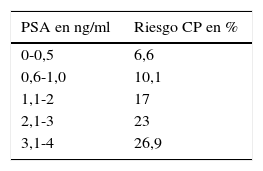
A principios de la primera década del siglo XXI se empezó a cuestionar la eficacia del PSA como un instrumento eficaz en el cribado del CP22. Se observó una incidencia progresiva de CP en varones con PSA<4ng/ml, que oscilaba entre el 6% con cifras de PSA<1ng/ml y cerca del 25% con cifras de PSA entre 3-4ng/ml23 (tabla 3), aunque la mayoría de los CP con estos valores de PSA son de bajo grado23.
Riesgo de CP según valores PSA entre 0-4ng/ml
| PSA en ng/ml | Riesgo CP en % |
|---|---|
| 0-0,5 | 6,6 |
| 0,6-1,0 | 10,1 |
| 1,1-2 | 17 |
| 2,1-3 | 23 |
| 3,1-4 | 26,9 |
Fuente: Tomado de Thomson et al.23.
La determinación sistemática del PSA es un procedimiento poco efectivo, no puede detectar si una persona tiene CP y, además, no nos sirve para distinguir entre el CP que puede provocar la muerte y el que no24, por lo que podríamos estar actuando activamente sobre neoplasias que nunca darían clínica y, por tanto, estar sobrediagnosticando una enfermedad de la que no sabemos si mejoramos20.
En los últimos años se están generando avances para incrementar la especificidad del PSA centrándose en nuevos marcadores detectados en la orina tras masaje prostático, como el gen 3 del cáncer de próstata (PCA3) o la combinación de varios genes o isoformas de PSA determinadas en suero, como el Phindex22. Por último, la resonancia magnética multiparamétrica aporta avances importantes en la localización del CP por imagen, que en un futuro permitirá que se realicen biopsias prostáticas dirigidas, lo cual hará que se cambie el paradigma del cribado de CP22.
¿Qué nos indican los principales estudios clínicos sobre cribado del cáncer de próstata?Se han publicado en la última década varios ensayos clínicos y metaanálisis con resultados variables y no siempre concluyentes2. Dos grandes estudios publicados en el año 200925,26 no han disipado del todo las dudas e incertidumbres que genera la realización o no de cribado de CP en varones asintomáticos20.
En el estudio realizado en Estados Unidos, en la rama prostática del Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Trial25, se aleatorizaron 76.693 hombres entre los años 1993 y 2001 de 55-74 años de edad (edad media 62 años) y sin antecedentes de cáncer. No se han detectado diferencias en la mortalidad entre el grupo de cribado y el de control tras un cribado basado en PSA anual durante 6 años, más TR anual durante 4 años. La mediana de seguimiento fue de 11,7 años. Se detectaron 2.820 CP en el grupo de cribado (7,3%) y 2.322 en el grupo de control (6%). Por CP murieron 50 hombres en el grupo de cribado y 42 en el de control (RR 1,13; IC 95%: 0,75 a 1,70), aunque las diferencias no son significativas. El número de muertes totales fue ligeramente inferior en el grupo de cribado (RR 0,97; IC 95%: 0,93 a 1,01), igualmente sin diferencias significativas. En este estudio, en el grupo control, ha existido un elevado nivel de contaminación, ya que a más del 50% de los varones se les ha realizado alguna determinación de PSA durante el estudio. En posteriores revisiones a los 13 años del estudio27 se ha observado que no variaban estos porcentajes.
El estudio europeo Randomized Study of Screening for Prostate Cancer (ERSPC)26 se ha realizado en 7 países europeos, entre ellos España, sobre un total de 182.160 hombres, de 50-74 años de edad (edad media 60 años), sin antecedentes de CP. La gran mayoría de los hombres incluidos en el estudio (162.243) tenía una edad comprendida entre los 55 y los 69 años de edad. La periocidad del cribado varió de unos países a otros entre 2 y 4 años y la media de seguimiento fue de 9 años. Se ha observado una disminución de muerte por CP en un 20% (RR: 0,8; IC 95%: 0,65 a 0,98). Se considera positivo el PSA>3-4ng/ml, con hasta un 76% de falsos positivos. Se detectaron en el grupo de cribado 5.990 CP (8,2%) y 4.307 en el grupo control (4,8%). La diferencia absoluta entre los 2 grupos es de 0,71‰ muertes, lo que nos indica que 1.410 hombres han de ser estudiados. La diferencia de tumores detectados y tratados fue de 34‰, lo que significa que es necesario tratar a 48 varones con el fin de prevenir una muerte por CP. Se estima un sobrediagnóstico del 50%. Los varones diagnosticados de CP en el grupo cribado presentaban un Gleason habitualmente<7 y menos metástasis. En la rama española del ERSPC se aprecia un curioso desequilibrio entre la incidencia y la mortalidad de la enfermedad, especialmente si se compara con la de otros tumores malignos. De hecho, en nuestro entorno se ha verificado un mayor número de diagnósticos con el cribado y la migración al diagnóstico en estadios más precoces, pero, a pesar de un largo seguimiento (más de 15 años), aún no se ha producido un beneficio en términos de supervivencia global ni cáncer-específica. La mortalidad por CP en el brazo español del ERSPC es sorprendentemente baja, posiblemente por la relativa limitación numérica de la serie (18.612 varones). Este hecho hace que las dudas e incógnitas del cribado tengan en nuestro entorno un interés mayor y provoquen un gran respeto por evitar sobretratamiento28,29.
Con datos revisados a los 13 años de seguimiento del estudio ERSPC, se diagnosticaron 7.408 casos de CP en el grupo de intervención y 6.107 casos en el grupo de control. La tasa de incidencia de CP entre los grupos de intervención y de control fue de 1,91 (IC 95%: 1,83-1,99) después de 9 años (1,64 [1,58-1,69] incluida Francia), 1,66 (1,60-1,73) después de 11 años y 1,57 (1,51-1,62) después de 13 años. La tasa de mortalidad por CP fue de 0,85 (0,70-1,03) después de 9 años, 0,78 (0,66-0,91) después de 11 años y 0,79 (0,69-0,91) a los 13 años. La reducción absoluta del riesgo de muerte por CP a los 13 años fue de 0,11 por cada 1.000 años-persona o de 1,28 por cada 1.000 hombres asignados aleatoriamente, lo que es equivalente a evitar una muerte por CP por cada 781 (IC 95 %: 490-1.929) hombres invitados a realizarse las pruebas de detección o uno por cada 27 (17-66) casos de CP adicionales detectados. Después del ajuste por no participación, la proporción de las tasas de mortalidad por CP en los hombres evaluados fue de 0,73 (IC 95%: 0,61-0,88). En esta actualización, el estudio ERSPC confirma una reducción sustancial en la mortalidad por CP atribuible a las pruebas de PSA, con un aumento sustancial del efecto absoluto a los 13 años en comparación con los hallazgos después de 9 y 11 años. Pese a estos hallazgos, aún se considera un prerrequisito la cuantificación adicional de daños y su reducción para que tenga lugar la introducción de las pruebas de detección a nivel poblacional30.
Los resultados de un estudio realizado en la ciudad sueca de Göteborg sobre 20.000 pacientes varones, la mayor parte incluidos en el estudio ERSPC, mostraron una reducción del 44% en el riesgo de muerte por CP con el cribado en un periodo de seguimiento de 14 años. A largo plazo la mortalidad global es parecida entre el grupo de cribado y el de control, adelantándose en el grupo de cribado entre 5-10 años el diagnóstico de CP31.
Un metaanálisis realizado el año 2010 analiza diversos estudios, entre ellos el ERSPC y el PCLO. Los autores destacan que el cribado se asocia a un aumento del 46% de diagnóstico de CP, fundamentalmente en fases precoces. No tiene impacto en los tumores de riesgo intermedio y avanzado. Genera un sobrediagnóstico del 29-56%. No supone un impacto significativo ni en la mortalidad cáncer-específica ni en la global. El incremento en el diagnóstico no se traslada a un descenso en la mortalidad32.
La Cochrane, en un metaanálisis del año 2013, analizó diversos estudios con 341.342 participantes de 45-80 años de edad tratados mediante cribado durante periodos que oscilan de 7 a 20 años. Los resultados mostraron que el cribado detecta más CP (RR: 1,3; IC 95%: 1,02-1,65), y en estadios más precoces (RR: 1,79; IC 95%: 1,19-2,70); pero no tiene impacto sobre la mortalidad por CP (RR: 1,00; IC 95%: 0,86-1,17). No se observa una mejora en la supervivencia global (RR: 1,00; IC 95%: 0,96-1,03). Consideran que los riesgos asociados al cribado son importantes, si se tiene en cuenta que muchas de las personas en las que se ha detectado una elevación del PSA no hubieran desarrollado ni síntomas ni complicaciones en relación con este cáncer a lo largo de su vida. Entre los riesgos destacan los asociados33:
- -
A la biopsia (hemorragias, infección, dolor, ansiedad y efectos psicológicos de un resultado falsamente positivo).
- -
Al tratamiento quirúrgico y a la radiación (disfunción eréctil, incontinencia urinaria, síntomas urinarios).
Una revisión reciente publicada en JAMA, con relación al cribado con PSA, encuentra, con un nivel de evidencia B, en los hombres entre 55 y 69 años de edad con riesgo moderado que, si tras la información por parte de su médico sobre los aspectos negativos y positivos de la prueba de PSA, estos mantienen su deseo de someterse al cribado, en este caso deberían realizarse la prueba de PSA34.
Consideran que una estrategia que podría disminuir los efectos negativos del cribado sería:
- -
Realización del cribado bienal.
- -
Aumentar el umbral de PSA a valores más altos para realizar la biopsia.
- -
Fomentar el tratamiento conservador para los hombres que han sido diagnosticados de CP.
Los riesgos de la radiación y el tratamiento quirúrgico se podrían mitigar, sobre todo en aquellos casos de CP localizados. El 90% de estos CP se tratan con cirugía o radioterapia.
En España, un estudio reciente ha investigado la utilidad de optimizar el cribado de CP mediante la determinación de PSA basal en varones entre 40 y 49 años en una población de Madrid. Así, un total de 4.304 varones de 40-49 años fueron tratados mediante cribado oportunista a lo largo de 17 años, con al menos una determinación sérica de PSA (6.001 determinaciones) y con seguimiento medio de 57,1±36,8 meses. A 768 se les practicó biopsia de algún órgano y a 104, biopsia prostática. Catorce pacientes (0,33%) fueron diagnosticados de CP. La mediana de PSA basal fue 0,74ng/ml (0,01-58,5) para pacientes sin CP y 4,21ng/ml (0,76- 47,4) con CP. La mediana de tiempo desde la determinación hasta el diagnóstico fue 26,8 meses (1,5-143,8). El punto de corte óptimo para detectar CP fue 1,9ng/ml (sensibilidad 92,86%; especificidad 92,54%; VPP 3,9%; VPN 99,97%) y el área bajo la curva 92,8%. Respecto a las determinaciones repetidas, la evolución del PSA no mostró diferencias estadísticamente significativas entre pacientes sin cáncer (p=0,56) o con cáncer (p=0,64); pero un valor de velocidad de PSA>0,3ng/ml/año revelaba elevada especificidad para detectar cáncer en esta población. Según los autores de este estudio, un PSA basal≥1,9ng/ml en varones españoles de 40-49 años predice el desarrollo de CP, por lo que podría resultar de utilidad para el cribado oportunista en edad temprana. Sin embargo, se necesita definir un seguimiento apropiado adaptado al riesgo en esta población, pero una velocidad de PSA anual≥0,3ng/ml/año parece de utilidad para conseguir un diagnóstico temprano35.
¿Qué opinan las distintas sociedades médicas sobre el cribado de cáncer de próstata?El debate acerca de la idoneidad de llevar a cabo el cribado del CP está aún muy lejos de poder cerrarse. No existe una opinión unánime sobre la idoneidad del cribado de CP entre las distintas sociedades y organizaciones médicas. Sin embargo, todas coinciden en destacar la importancia de la decisión informada34.
-American Cancer Society (ACS)36: En su última revisión del 2014 mantiene parecidas recomendaciones a las del año 2010. Un aspecto importante de estas recomendaciones es que los médicos antes de realizar el cribado deben informar al paciente sobre los posibles beneficios y limitaciones de las pruebas de cribado, siempre que el paciente tenga el suficiente entendimiento para tomar por sí mismo la decisión de participar o no en el cribado.
Aconsejan el cribado mediante la determinación de PSA y, si es necesario, también con TR:
- -
a partir de los 50 años de edad, a todos los hombres que no presentan riesgo de CP (riesgo intermedio), si tienen una esperanza de vida superior a 10 años;
- -
a partir de los 45 años de edad, a todos los hombres con alto riego de presentar CP (afroamericanos, un familiar de primer grado diagnosticado de CP antes de los 65 años de edad);
- -
a partir de los 40 años a todos los hombres con riesgo aún mayor (aquellos con más de un familiar de primer grado con CP a una edad temprana).
Según los valores de PSA, si este es<2,5ng/ml, aconsejan control cada 2 años; si es≥2,5ng/ml, control anual.
-American Urological Association (AUA)37,38: Hace la misma reflexión que la ACS: el paciente debe conocer los efectos del cribado y la decisión de realizarse o no el cribado debe discutirla con su médico. Sus conclusiones principales son las siguientes:
- -
No recomienda el cribado con determinación de PSA en<40 años (grado de recomendación C) (anexo A).
- -
No recomienda el cribado con PSA en varones de 40-54 sin factores de riesgo (grado de recomendación C).
- -
Recomienda una decisión compartida entre el médico y el paciente para varones de 55-69 años (grado de recomendación B). En este grupo de pacientes, para reducir los perjuicios del cribado, recomiendan un cribado rutinario con un intervalo de ≥2 años, el cual es preferible al examen anual en estos varones que han participado en la toma de decisiones compartida sobre el cribado. En comparación con el examen anual, se espera que el cribado a intervalos de 2 años preserve la mayor parte de los beneficios y reduzca el sobrediagnóstico y los falsos positivos (grado de recomendación C).
- -
No recomienda el cribado con PSA en ≥70 años o en aquellos varones con una esperanza de vida<10-15 años (grado de recomendación C).
- American College of Physicians (ACP)39: La guía de 2013 recomienda a los médicos:
- -
Informar a los varones de 50-69 años de edad con riesgo moderado, mediante un análisis de los daños considerables de la detección del CP y las limitaciones de los posibles beneficios.
- -
No realizar el cribado en los pacientes que no expresan una clara preferencia por él.
- -
No solicitar PSA en varones<50 años ni en>69 años.
- -
No realizar el cribado en hombres con una esperanza de vida <10-15 años.
- National Cancer Institute8: En su última actualización de abril del 2015 considera que los hombres deben ser informados acerca de la posibilidad de que puedan aparecer resultados con falsos positivos o falsos negativos en la prueba de PSA para el cribado de CP. Encuentra que la evidencia actual es insuficiente para determinar la idoneidad de realizar cribado de CP mediante TR y PSA.
-US Preventive Services Task Force (USPSTF)40: Está en contra de la realización de PSA en pacientes asintomáticos sin factores de riesgo, al considerar que los efectos nocivos del cribado superan a los beneficios. El cribado con PSA produce una pequeña o nula reducción de la mortalidad y conlleva muchos riesgos innecesarios asociados al diagnóstico y al tratamiento. No existen suficientes datos para evaluar el balance beneficio-riesgo del cribado en las personas menores de 75 años (grado de recomendación D) y se manifiestan en contra del cribado en mayores de 75 años de edad (grado de recomendación D).
-Programa de Actividades Preventivas y de Promoción de la Salud en Atención Primaria (PAPPS)41: No encuentra evidencias suficientes para recomendar el cribado poblacional en varones asintomáticos sin factores de riesgo. Consideran que se debe proporcionar una información rigurosa a las personas que solicitan cribado, centrada en los beneficios y riesgos del cribado y del tratamiento.
- SEMERGEN1: No aconseja la realización del cribado poblacional en varones asintomáticos mayores de 50 años (grado de recomendación D). Si el paciente lo solicita, se aconseja la realización del consentimiento informado (grado de recomendación B). En pacientes con factores de riesgo se debe ofrecer el cribado de CP (grado de recomendación A).
- La Asociación Española de Urología (AEU) asume las recomendaciones de la European Association of Urology (EAU)42. Sus recomendaciones son las siguientes:
- -
Contemplan la posibilidad de individualizar y ofrecer el cribado oportunista valorando los riesgos y beneficios mediante una decisión informada a varones con un buen estado funcional y al menos 10-15 años de esperanza de vida (nivel de evidencia 3; grado de recomendación B).
- -
Se debe ofrecer cribado mediante determinación de PSA a varones con riesgo elevado de CP (nivel de evidencia 2b; grado de recomendación A). Los grupos de riesgo son:
- •
Hombres mayores de 50 años de edad.
- •
Hombres mayores de 45 años de edad y con antecedentes familiares de CP.
- •
Afroamericanos.
- •
Hombres con un nivel de PSA>1ng/ml a los 40 años de edad.
- •
Hombres con un nivel de PSA>2ng/ml a los 60 años de edad.
- •
- -
Podría considerarse una estrategia adaptada al riesgo (según el nivel de PSA inicial), que puede ser cada 2 años para los inicialmente en riesgo, o se pospone hasta 8 años en los varones que no están en situación de riesgo (nivel de evidencia 3; grado de recomendación C).
- -
La edad en que el diagnóstico precoz del CP debe interrumpirse está influida por la esperanza de vida y el estado funcional; hombres con esperanza de vida<15 años es poco probable que se beneficien del cribado (nivel de evidencia 3; grado de recomendación A).
Podemos observar que la mayoría de las instituciones y asociaciones médicas, estén o no a favor del cribado, insisten en la importancia de que sea el paciente quien decida si quiere o no la prueba de detección precoz1,2,8,36–42. En nuestro país no existe ninguna recomendación de las autoridades sanitarias a favor de la realización del cribado poblacional43.
En el CP, antes de recomendar la generalización o no de su cribado, lo más prudente es esperar los resultados de los análisis adicionales de los distintos estudios que nos permitan una mejor cuantificación del balance beneficios/efectos adversos44.
Conclusiones (tabla 4)- -
El cribado de CP tiene limitaciones. Los datos de los estudios indican un beneficio moderado. Con el cribado disminuye ligeramente la mortalidad por CP, sin que se modifique la tasa de mortalidad global.
Tabla 4.¿A quién se le debe ofrecer y aconsejar la realización de diagnóstico precoz de CP?
• A todos los varones de 40-45 o más años que tengan familiares de primer grado con antecedentes de CP, sobre todo si ha aparecido el cáncer en edades inferiores a los 60-65 años • A los varones de raza afroamericana, a partir de los 45 años • A los varones asintomáticos de 55-69 años de edad si el paciente lo solicita, valorando pros y contras mediante la toma de decisión informada • No debe realizarse en pacientes con enfermedades graves o esperanza de vida<10-15 años - -
No parece que exista una evidencia científica clara que justifique el cribado poblacional con PSA en pacientes asintomáticos, debido al riesgo de efectos adversos secundarios (sobrediagnóstico y sobretratamiento).
- -
El sobrediagnóstico y el sobretratamiento suponen curar CP asintomáticos que nunca se habrían manifestado, y deteriorar la calidad de vida.
- -
La mayoría de las asociaciones médicas son reacias a la realización de cribado poblacional.
- -
Podría estar justificado el diagnóstico precoz activo en varones con familiares de primer grado con antecedentes de CP y en varones de raza afroamericana.
- -
Se puede valorar el diagnóstico precoz oportunista si el paciente lo solicita, circunscrito fundamentalmente a varones entre 55 y 69 años de edad y en pacientes con algún síntoma del tracto urinario inferior.
- -
Si el paciente solicita el cribado de CP debemos informarle de los posibles beneficios y de las complicaciones que puede acarrear el cribado y posteriormente el tratamiento, dejando que él tome la decisión que crea más satisfactoria.
- -
No debe ofrecerse el cribado de CP en pacientes cuya expectativa de vida sea<10-15 años.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores hemos tenido en cuenta las instrucciones y las responsabilidades éticas, cumplimos los requisitos de autoría y declaramos la no existencia de conflicto de intereses.
| Nivel de evidencia | Tipo de datos científicos |
|---|---|
| 1a | • Datos científicos procedentes de metaanálisis de ensayos aleatorizados |
| 1b | • Datos científicos procedentes de, al menos, un ensayo aleatorizado |
| 2a | • Datos científicos procedentes de un estudio controlado bien diseñado sin aleatorización |
| 2b | • Datos científicos procedentes de, al menos, un estudio cuasiexperimental bien diseñado de otro tipo |
| 3 | • Datos científicos procedentes de estudios no experimentales bien diseñados, como estudios comparativos, estudios de correlación y casos clínicos |
| 4 | • Datos científicos procedentes de informes u opiniones de comités de expertos o de la experiencia clínica de autoridades en la materia |
| Grado de recomendación | Naturaleza de las recomendaciones |
|---|---|
| A | • Basadas en, al menos, un ensayo aleatorizado o criterio de los expertos con base en evidencia indirecta de calidad |
| B | • Basada en estudios clínicos bien realizados, pero sin ensayos clínicos aleatorizados |
| C | • Emitida a pesar de la ausencia de estudios clínicos de buena calidad directamente aplicables |
Fuente: Adaptado de Oxford45.