El cáncer de próstata es la neoplasia más frecuente y la segunda causa de muerte por cáncer en varones en todo el mundo. El hecho de que sea un tumor con un período de latencia muy prolongado ha llevado a confusión en cuanto a la conveniencia del diagnóstico y tratamiento de pacientes en estadios tempranos. Clásicamente, ninguna de las sociedades europeas ni americanas ha recomendado el cribado, dejando a criterio del clínico el diagnóstico precoz oportunista. En 2012 y tras años de conflicto, la organización americana United States Preventive Task Force emitió un comunicado en contra del cribado y desaconsejaba su uso. El resultado de esta recomendación llevó a un aumento en la incidencia de cáncer de próstata metastásico y, por consiguiente, de su mortalidad. En 2018, y a la vista de estos resultados, la Asociación Europea de Urología emitió nuevas recomendaciones en las que por primera vez aconsejaba el cribado mediante PSA. En 2019, dichas recomendaciones se actualizaron, manteniendo su posicionamiento a favor.
Prostate cancer is the most frequently diagnosed cancer in men and the second cause of death in those worldwide. The fact that is a tumor with a long latency period has led to a confusion in the convenience of its diagnosis and treatment in patients at an early stage. Classically, European and American societies have not recommended prostate cancer screening with PSA, allowing physicians take this decision. In 2012, after many years full of controversy, the American organization United States Preventive Task Force recommended to abandon its use. The results of these statements carried an increase in the incidence of the metastatic prostate cancer and, therefore, a rise in its mortality. In 2018, after these consequences, the European Association of Urology released new recommendations in favor of screening based on PSA for the first time. In 2019, guidelines were updated with no changes in its recommendations.
El cáncer de próstata es un problema de salud pública de gran magnitud a nivel mundial. La prevalencia en Europa es de 1.551.420 casos en los últimos 5 años, lo que equivale al 42% de todos los diagnósticos en el mundo. Esto lo convierte en el tumor más prevalente por encima de los 70 años y representa hasta un 7% en la mortalidad total por cáncer en el sexo masculino1.
Pese a que la edad media de diagnóstico del cáncer de próstata son los 69 años, existe la falsa creencia de que esta enfermedad solo afecta a ancianos y que no supone una amenaza para la vida del paciente. Sin embargo, en Estados Unidos, alrededor del 10% de los nuevos diagnósticos ocurren en varones por debajo de los 55 años2.
Las tasas de incidencia del cáncer de próstata son muy variables entre las distintas regiones y grupos poblacionales. La razón de estas diferencias no está clara. Se cree que estas variaciones podrían deberse a diferencias entre la prevalencia de los factores de riesgo, pero también a la heterogeneidad y falta de consenso en la práctica clínica en cuanto a la realización del cribado con antígeno prostático específico (PSA).
Antes de la implementación del cribado mediante PSA, la mayor parte de los tumores de próstata se diagnosticaban por la aparición de síntomas de enfermedad avanzada (dolor en las caderas, columna vertebral, caja torácica o miembros inferiores, sugestivo de metástasis ósea), o bien por la aparición de sintomatología local (sangre en el semen o hemospermia, sangre en la orina o hematuria, o síntomas del tracto urinario inferior). Algunos tumores también se diagnosticaban por un hallazgo de tumoración palpable en el examen rectal. Los tumores sintomáticos eran normalmente de alto grado y, con frecuencia, letales a su diagnóstico.
A continuación, se describen los principales factores de riesgo constitucionales y no constitucionales recogidos en la última actualización de las guías de práctica clínica de la European Association of Urology3, que se han visto relacionados con un aumento del riesgo de padecer cáncer de próstata.
Factores de riesgo no modificables en el cáncer de próstataAntecedentes familiares y genéticaSe estima que hasta un 20% de los casos de cáncer de próstata tienen antecedentes familiares. En estos casos, el tumor se desarrollará, no solo por el hecho en sí de compartir genes con sus progenitores, sino por un patrón similar de exposición a ciertos carcinógenos ambientales y hábitos de vida comunes. Solo un pequeño porcentaje se trata, realmente, de casos hereditarios, los cuales se asocian con un inicio de enfermedad entre 6 y 7 años antes que los casos no familiares, así como con la afectación de 3 o más familiares, o 2 con un inicio anterior a los 55 años3.
Las mutaciones de la línea germinal en genes como BRCA1 y BRCA2 se han asociado con un riesgo aumentado de padecer cáncer de próstata, por lo que el análisis genómico de estos genes diana podría identificar familias de alto riesgo. Para los portadores de la mutación BRCA2 de la línea germinal, el riesgo relativo de desarrollar cáncer de próstata a los 65 años es de entre 2,5 y 8,6 veces superior a los no portadores3. En estos pacientes la enfermedad aparece antes y presenta un curso más agresivo.
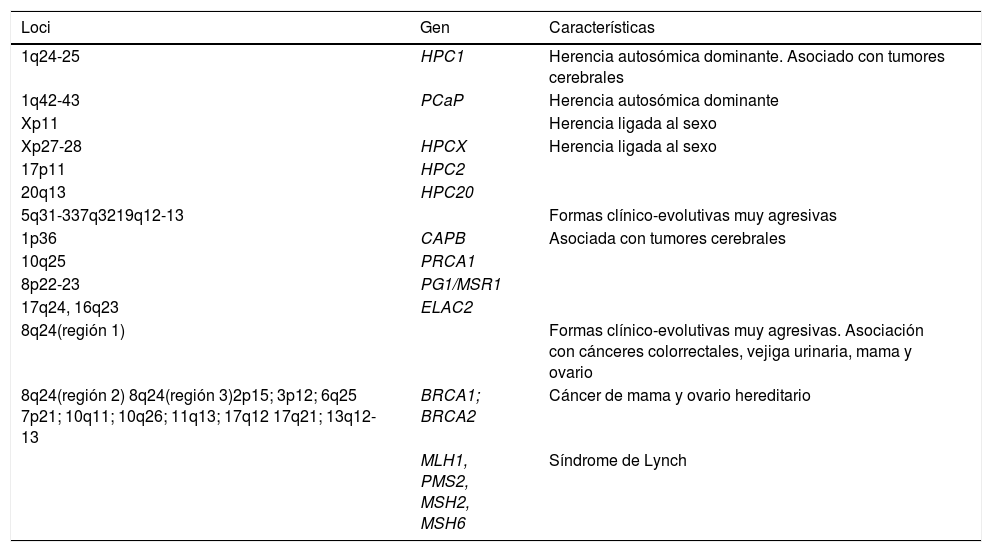
La alta incidencia de casos con cáncer de próstata familiar ha alentado la búsqueda activa de mutaciones de línea germinal que puedan promover la susceptibilidad de padecer este cáncer. En la tabla 1 se describen algunas de las más importantes4.
Genes implicados en las formas hereditarias del cáncer de próstata
| Loci | Gen | Características |
|---|---|---|
| 1q24-25 | HPC1 | Herencia autosómica dominante. Asociado con tumores cerebrales |
| 1q42-43 | PCaP | Herencia autosómica dominante |
| Xp11 | Herencia ligada al sexo | |
| Xp27-28 | HPCX | Herencia ligada al sexo |
| 17p11 | HPC2 | |
| 20q13 | HPC20 | |
| 5q31-337q3219q12-13 | Formas clínico-evolutivas muy agresivas | |
| 1p36 | CAPB | Asociada con tumores cerebrales |
| 10q25 | PRCA1 | |
| 8p22-23 | PG1/MSR1 | |
| 17q24, 16q23 | ELAC2 | |
| 8q24(región 1) | Formas clínico-evolutivas muy agresivas. Asociación con cánceres colorrectales, vejiga urinaria, mama y ovario | |
| 8q24(región 2) 8q24(región 3)2p15; 3p12; 6q25 7p21; 10q11; 10q26; 11q13; 17q12 17q21; 13q12-13 | BRCA1; BRCA2 | Cáncer de mama y ovario hereditario |
| MLH1, PMS2, MSH2, MSH6 | Síndrome de Lynch |
Basada en Ferris-i-Tortajada et al.
El cáncer de próstata es el tumor maligno más diagnosticado en varones de edad avanzada. Existe una relación proporcional directa entre la edad y el riesgo de padecer la enfermedad, en especial, después de los 50 años en varones de raza caucásica sin antecedentes familiares de cáncer de próstata y, a partir de los 40 años, en varones de raza negra o con antecedentes familiares3.
EtniaLa etnia está estrechamente relacionada en la génesis del cáncer de próstata. En los EE. UU., los varones afroamericanos tienen 1,4 veces más riesgo de padecer y de 2 a 3 veces más riesgo de morir de cáncer de próstata que los varones europeos. De la misma manera, existe un riesgo superior de desarrollar un curso evolutivo más agresivo en los varones afroamericanos que los varones caucásicos.
Factores de riesgo modificables del cáncer de próstataTabacoLa asociación entre el consumo de tabaco y el riesgo de desarrollar cáncer de próstata puede tener una base genética u hormonal. Esta se basa en un nivel de hormonas sexuales en suero mayor en los varones fumadores que en los no fumadores, las cuales aumentan el riesgo de cáncer de próstata o contribuyen a su progresión3.
Tratamiento con inhibidores de la 5-αreductasaA principios de los años 90, se sugirió que la inhibición de la 5-αreductasa, la enzima que disminuye los niveles de dihidrotestosterona en el tejido prostático, podía prevenir el cáncer de próstata. La inhibición de la 5-αreductasa era una diana muy atractiva para la prevención del cáncer de próstata, por lo que se desarrollaron 2grandes ensayos clínicos controlados con placebo para evaluar el efecto de los inhibidores de la 5-α reductasa (5-ARI) aprobados por la Food and Drug Administration (finasteride y dutasteride): el Prostate Cancer Prevention Trial5 con finasteride y el Reduction by Dutasteride of Prostate Cancer Events (REDUCE) con el dutastride6.
Ambos estudios demostraron la reducción del riesgo de cáncer de próstata, pero solo los de bajo grado. Sin embargo, demostraron un riesgo potencial aumentado de enfermedad de alto grado con finasteride y dutasteride en la incidencia de cánceres de alto grado (escala de Gleason 8-10).
Síndrome metabólicoLa presencia aislada de factores de riesgo vascular del síndrome metabólico, como la hipertensión o un perímetro de cadera>?102cm, se relacionan con un aumento significativo del riesgo de padecer cáncer de próstata3.
ObesidadEn el estudio REDUCE7, la obesidad fue asociada con un bajo riesgo de cáncer de próstata de bajo grado; sin embargo, fue asociada con un riesgo aumentado de cáncer de próstata de alto grado. Este efecto parecía explicarse más por determinantes ambientales que afectaban al índice de masa corporal y que secundariamente podían traducirse en un aumento de la conversión periférica de tejido adiposo en andrógenos, que por una estatura o un índice corporal alto condicionados por la genética.
AlcoholTanto el abuso de alcohol como la abstención total de su consumo se han relacionado con un riesgo superior de carcinoma de próstata y de mortalidad específica asociada a la enfermedad.
Dieta- -
Lácteos: Se ha descubierto una correlación débil entre el alto consumo de proteínas derivadas de lácteos y un aumento del riesgo de cáncer de próstata.
- -
Carne: no se ha podido demostrar la relación entre el consume de carne roja o carne procesada y el cáncer de próstata.
- -
Tomates (licopenos/carotenos): se ha observado un efecto favorable con respecto a la ingesta de tomate (principalmente cocinado) y los licopenos en la incidencia del cáncer de próstata.
- -
Fitoestrógenos: son compuestos naturales que forman parte de los vegetales. Se ha demostrado una relación significativa del consumo de estos con una disminución del cáncer de próstata.
- -
Vitamina D: se ha observado asociación entre concentraciones tanto altas como bajas de vitamina D con un aumento del riesgo de cáncer de próstata y, más fuertemente, con tumores de alto grado.
Se ha demostrado que la inflamación prostática, traducida histológicamente en prostatitis crónica, puede desempeñar un papel importante en la carcinogénesis del cáncer de próstata a través de varios mecanismos: daño celular, recambio celular aumentado, favorecimiento de microambiente tisular que induce la replicación celular, angiogénesis y reparación tisular.
La prostatitis crónica provocada por infecciones de transmisión sexual se asocia a un mayor riesgo de cáncer de próstata aunque, hasta la fecha, ningún microorganismo se ha relacionado como agente causal.
Diagnóstico del cáncer de próstataEl cáncer de próstata tiene una progresión larvada e indolente, que se manifiesta de forma sintomática cuando la enfermedad se encuentra en estadio avanzado.
Se requiere una elevada sospecha clínica en el diagnóstico, que se basa en la exploración clínica mediante tacto rectal y en niveles analíticos de PSA por encima del limite superior de la normalidad. La confirmación definitiva se obtiene mediante la histopatología procedente de la biopsia prostática.
Tacto rectalEl tacto rectal como técnica exploratoria de cribado se ha visto limitado debido a su baja fiabilidad y sensibilidad y a la incapacidad de palpar la próstata por completo, en especial, en tumores pequeños que no alcanzan la capsula prostática. Algunos datos son3:
- •
Un 18% de los cánceres de próstata son detectados por alteraciones en el tacto rectal, independientemente del valor del PSA.
- •
Un tacto rectal sospechoso en un paciente con un nivel de PSA?≤?2 tiene un valor predictivo positivo de 5 a 30%.
Por el contrario, el PSA como marcador serológico ha revolucionado el diagnóstico del cáncer de próstata: vomo variable independiente, se ha demostrado que es mejor predictor que el tacto rectal o la ecografía transrectal3.
No obstante, desde su propuesta a finales de los años 80 como marcador sérico en el cribado precoz del cáncer de próstata, el PSA ha sufrido un cambio constante en su recomendación por la comunidad médica debido al riesgo de sobretratamiento asociado al cribado: mortalidad operatoria o síntomas del tracto urinario a corto plazo; impotencia, disfunción eréctil o incontinencia urinaria a largo plazo, lo que puede afectar a la calidad de vida de estos pacientes. La vigilancia activa de algunos casos, en lugar de un tratamiento intensivo, puede ser una muy buena alternativa terapéutica que ayude a mitigar los perjuicios derivados del sobretratamiento3.
En este contexto, la falta de consenso entre los diversos profesionales de la medicina, no solo urólogos sino también médicos de atención primaria, médicos internistas u oncólogos, ha hecho todavía más difícil un uso correcto de este marcador.
Estrategia de cribadoEn líneas generales, para que una enfermedad sea susceptible de un programa de cribado, han de darse varias circunstancias8:
- 1.
Que la enfermedad suponga un problema importante de salud, conocido y definido.
- 2.
Que se disponga de tratamientos que, aplicados en la fase precoz de la enfermedad, contribuyan a una disminución en la morbimortalidad.
- 3.
Que la prueba sea sencilla, segura y aceptada por la sociedad.
- 4.
Que la enfermedad tenga un período de latencia lo suficientemente prolongado en el que se pueda aplicar el cribado.
- 5.
Que la prueba sea efectiva (sensibilidad y especificidad elevadas) y eficiente (relación precio/beneficio adecuada).
- 6.
Que los resultados de la prueba realizados in vitro sean reproducibles in vivo y en diferentes poblaciones.
El riesgo de sobretratamiento asociado al cribado hizo que, en 2012, la United States Preventive Task Force (USPSTF) recomendase abandonar el uso del PSA9. Las consecuencias derivadas reflejaron una disminución de la tasa de incidencia global de cáncer de próstata, pero, también, un aumento de la incidencia en fase metastásica y, en consecuencia, de la mortalidad total atribuible a esta enfermedad10. A la vista de estos resultados, en la actualización de 2018, la USPSTF concluyó que, en varones de entre 55 y 69 años, la decisión de someterse a un cribado periódico basado en determinaciones de PSA debería ser individual y tras evaluar los riesgos y beneficios con su médico de atención primaria en función de los factores de riesgo del paciente (recomendación C). En varones mayores de 70 años se recomendaba en contra del cribado (recomendación D). Por último, los médicos no deberían cribar a pacientes que no expresasen claramente su deseo de someterse al screening (recomendación C)11.
Sin embargo, la evidencia científica que ha evaluado el rol del cribado del cáncer de próstata basado en mediciones repetidas de PSA proviene de 2grandes ensayos clínicos aleatorizados: el European Randomised Study of Screening of Prostate Cancer (ERSPC)12 y el Prostate, Lung, Colorrectal and Ovarian Cancer Screening Trial (PLCO)13. Estos ensayos han asentado la base a partir de la cual se han elaborado las recomendaciones del uso del PSA como herramienta de cribado a lo largo del tiempo.
European Randomized Study Screening of Prostate Cancer (ERSPC)En 2009, el ensayo clínico ERSPC12 aleatorizó en 2grupos a 182.000 varones con edades comprendidas entre los 50 y 74 años. En el primer grupo se realizó un cribado con PSA cada 4 años; en el grupo control no se practicó ningún cribado.
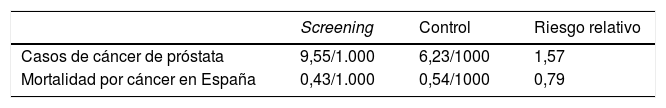
A los 13 años del seguimiento14, se habían diagnosticado 7.408 cánceres de próstata en el grupo de intervención y 6.107 en el grupo control. La razón de tasas de incidencia entre el grupo de intervención y el grupo control fue de 1,91 (IC 95%: 1,83-1,99) después de 9 años; 1,66 (IC 95%: 1,60-1,73) después de 11 años y 1,57 (IC 95%: 0,66-0,91) después de 13 años. La razón de tasas de mortalidad fue de 0,85 (IC 95%: 0,70-1,03) después de 9 años, 0,78 (IC 95%: 0,66-0,91) después de 11 años y 0,79 (IC 95%: 0,69-0,91) después de 13 años (tabla 2). La reducción de riesgo absoluto de muerte por cáncer de próstata fue de 0,11 por cada 1.000 personas/año o 1,28 por cada 1.000 hombres aleatorizados, lo que es equivalente a una muerte prevenible por cada 781 pacientes a los que se les proponía el cribado. Dicho de otra manera, se prevenía una muerte por cada 27 cánceres de próstata diagnosticados.
En esta actualización a 13 años de seguimiento, ERSPC confirmó una disminución del 21% en la mortalidad específica del cáncer de próstata en el subgrupo de 55 a 69 años, atribuible al cribado con PSA, con un efecto absoluto sustancialmente mayor comparado con los hallazgos a los 9 y a los 11 años de seguimiento.
Prostate, Lung, Colorrectal and Ovarian Cancer Screening Trial (PLCO)Ese mismo año, el ensayo clínico PLCO13 aleatorizó a 76.000 hombres en 2grupos: en el primero se practicó un cribado anual con PSA durante 6 años, mientras que en el grupo control se llevo a cabo la práctica habitual.
Tras 13 años de seguimiento15, se contabilizaron un total de 158 muertes en el brazo de cribado y 145 muertes en el brazo control. Las tasas de mortalidad acumuladas por cáncer de próstata fueron de 3,7 y 3,4 por cada 10.000 personas/año en cada grupo. Estas diferencias de resultados entre el brazo de cribado y el brazo control no fueron significativas (RR=1,09; IC?95%: 0,87-1,36).
En la actualización de 201716, tras 15 años de seguimiento, se observaron 255 muertes por cáncer de próstata (47,8 muertes por cada 100.00 personas/año) en el brazo de intervención y 244 muertes por cáncer de próstata (46 muertes por cada 100.000 personas/año) en el brazo control del ensayo. El riesgo relativo fue de 1,04 a favor del brazo control (IC?95%: 0,87-1,24). En esta nueva actualización se llegó a las mismas conclusiones.
Posicionamiento actual y nuevas recomendaciones de la European Association of Urology (EAU)En 2013, la EAU realizó una revisión sistemática de la bibliografía publicada de 1990 hasta ese momento y actualizó sus recomendaciones en las guías de detección precoz de cáncer de próstata al mismo tiempo que el ERSPC publicaba sus resultados a los 13 años de seguimiento14. Estos datos demostraron que la reducción de la mortalidad no había cambiado. Sin embargo, el número necesario que cribar había descendido y, en la actualidad, es menor del que se necesita en los ensayos de cáncer de mama.
La evidencia científica disponible más reciente, proveniente en su gran mayoría de dicho ensayo clínico, en concreto, de la cohorte de Rotterdam17, ha logrado demostrar una reducción significativa de la incidencia del cáncer de próstata en fase metastásica y, por tanto, de mortalidad específica por enfermedad, y posiciona a la EAU a favor del cribado mediante PSA. La instauración de programas de screening bien estructurados basados en la medición repetida de PSA demuestra que una detección más precoz del cáncer de próstata en estadios tempranos aumenta las tasas de curación y disminuye la mortalidad.
Estos resultados han obligado a las sociedades científicas de urología a actualizar y elaborar nuevas recomendaciones. En 2018, la EAU lanzó una nueva edición de las guías de práctica clínica sobre el cribado del cáncer de próstata en la que lo recomendaba por primera vez3. Estas recomendaciones se resumen en la tabla 3.
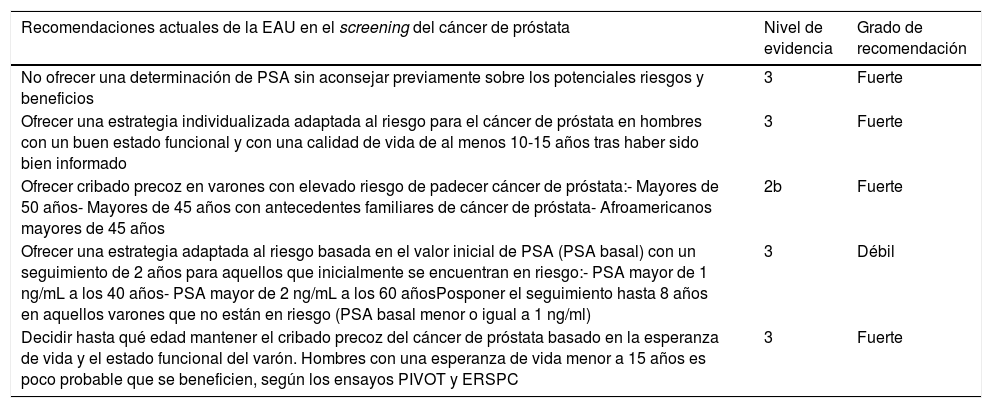
Recomendaciones actuales en el cribado del cáncer de próstata
| Recomendaciones actuales de la EAU en el screening del cáncer de próstata | Nivel de evidencia | Grado de recomendación |
|---|---|---|
| No ofrecer una determinación de PSA sin aconsejar previamente sobre los potenciales riesgos y beneficios | 3 | Fuerte |
| Ofrecer una estrategia individualizada adaptada al riesgo para el cáncer de próstata en hombres con un buen estado funcional y con una calidad de vida de al menos 10-15 años tras haber sido bien informado | 3 | Fuerte |
| Ofrecer cribado precoz en varones con elevado riesgo de padecer cáncer de próstata:- Mayores de 50 años- Mayores de 45 años con antecedentes familiares de cáncer de próstata- Afroamericanos mayores de 45 años | 2b | Fuerte |
| Ofrecer una estrategia adaptada al riesgo basada en el valor inicial de PSA (PSA basal) con un seguimiento de 2 años para aquellos que inicialmente se encuentran en riesgo:- PSA mayor de 1 ng/mL a los 40 años- PSA mayor de 2 ng/mL a los 60 añosPosponer el seguimiento hasta 8 años en aquellos varones que no están en riesgo (PSA basal menor o igual a 1 ng/ml) | 3 | Débil |
| Decidir hasta qué edad mantener el cribado precoz del cáncer de próstata basado en la esperanza de vida y el estado funcional del varón. Hombres con una esperanza de vida menor a 15 años es poco probable que se beneficien, según los ensayos PIVOT y ERSPC | 3 | Fuerte |
Basada en la actualización de la guía EAU sobre el cáncer de próstata de marzo de 2019.
Aún en la actualidad, y a pesar de la innumerable evidencia de la que se dispone a favor del cribado mediante PSA, es necesaria la implementación de medidas que faciliten la consecución de las recomendaciones de las guías clínicas, la elaboración de programas de cribado consistentes y bien estructurados, con identificación de las barreras que impiden sistematizarlos en una consulta de urología, atención primaria, medicina interna u oncología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.