El dolor torácico es uno de los motivos de consulta más frecuentes en cualquier ámbito sanitario, no obstante sigue suponiendo un reto diagnóstico tanto en la consulta del médico de atención primaria como en el ámbito de los médicos que prestan atención en los servicios de urgencias. Describimos un caso de síndrome aórtico agudo que se presentó de forma insidiosa en forma de dolor torácico y síncope de repetición en el que el retraso en el diagnóstico y tratamiento pudo resultar fatal. Hacemos también un breve repaso en la definición, diagnóstico, tratamiento y pronóstico de esta entidad.
Chest pain is one of the most frequent reasons for consulting in any healthcare setting, however its diagnosis remains a challenge for both Primary Care and Emergency Department physicians. We report a case of an Acute Aortic Syndrome which was diagnosed late after an insidious course of chest pain, repetitive syncope, and in which the delay in diagnosis and treatment could be fatal. We also describe the definition, diagnosis, treatment, and outcome of this condition.
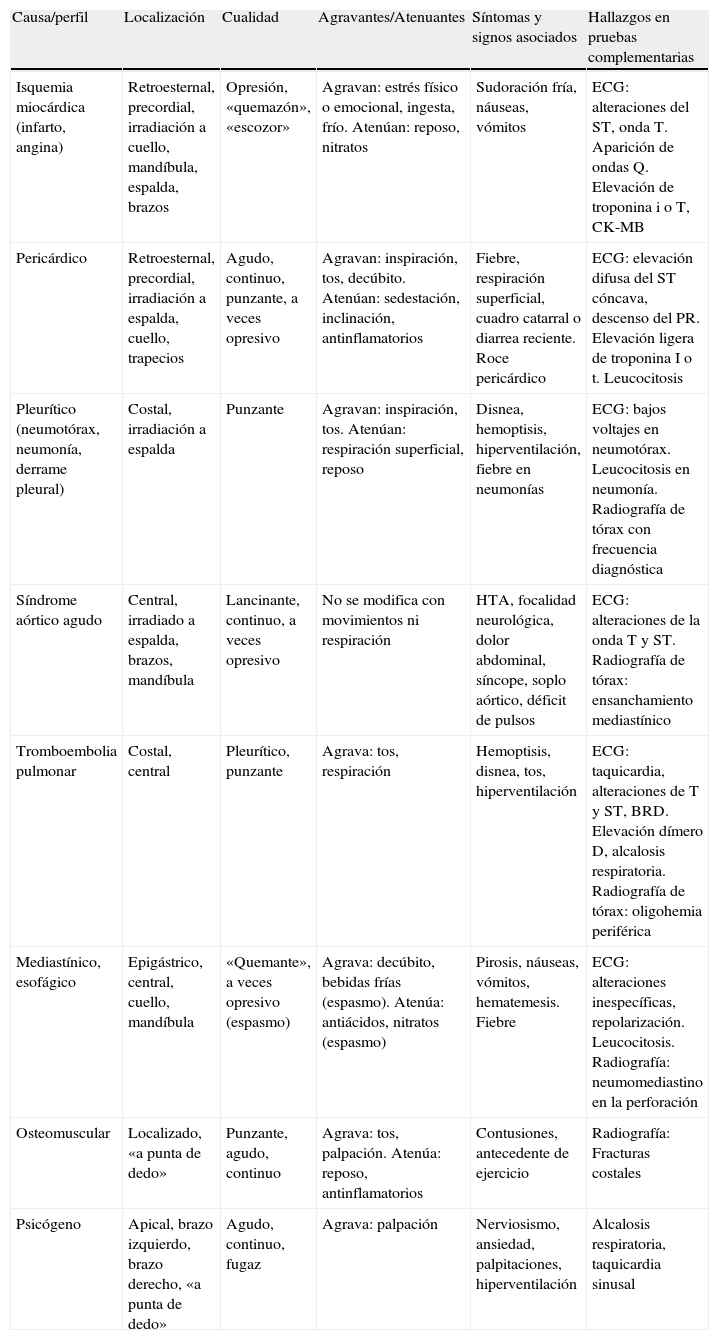
Pese a ser uno de los motivos de consulta más habituales, el dolor torácico (DT) sigue suponiendo un reto diagnóstico tanto para el médico de atención primaria como para médicos que prestan atención en los servicios de urgencias. Supone entre el 5 y el 20% del volumen de urgencias médicas y se estima que un hospital de referencia atiende un DT/1.000 hab. al mes1. En estas situaciones es fundamental intentar diferenciar «lo grave» que requiera una actuación urgente-emergente de «lo no grave» que nos permita más tiempo para un diagnóstico y tratamiento correcto (tabla 1). Las principales entidades que deben descartarse, debido a su gravedad, son 3: por orden de frecuencia, un síndrome coronario agudo (SCA), una tromboembolia pulmonar (TEP) y aunque menos frecuente, debemos también considerar el síndrome aórtico agudo (SAA), ya que esta enfermedad constituye una importante causa de mortalidad que llega a ser la decimotercera en Estados Unidos2. Las 3 pueden mostrar alteraciones similares en el ECG, movimiento analítico de enzimas cardiacas y compartir síntomas diferentes del DT. Con el siguiente caso, intentamos mostrar la importancia de tener en mente un buen diagnóstico diferencial cuando nos enfrentamos a un paciente con DT.
Diagnóstico diferencial del dolor torácico
| Causa/perfil | Localización | Cualidad | Agravantes/Atenuantes | Síntomas y signos asociados | Hallazgos en pruebas complementarias |
| Isquemia miocárdica (infarto, angina) | Retroesternal, precordial, irradiación a cuello, mandíbula, espalda, brazos | Opresión, «quemazón», «escozor» | Agravan: estrés físico o emocional, ingesta, frío. Atenúan: reposo, nitratos | Sudoración fría, náuseas, vómitos | ECG: alteraciones del ST, onda T. Aparición de ondas Q. Elevación de troponina i o T, CK-MB |
| Pericárdico | Retroesternal, precordial, irradiación a espalda, cuello, trapecios | Agudo, continuo, punzante, a veces opresivo | Agravan: inspiración, tos, decúbito. Atenúan: sedestación, inclinación, antinflamatorios | Fiebre, respiración superficial, cuadro catarral o diarrea reciente. Roce pericárdico | ECG: elevación difusa del ST cóncava, descenso del PR. Elevación ligera de troponina I o t. Leucocitosis |
| Pleurítico (neumotórax, neumonía, derrame pleural) | Costal, irradiación a espalda | Punzante | Agravan: inspiración, tos. Atenúan: respiración superficial, reposo | Disnea, hemoptisis, hiperventilación, fiebre en neumonías | ECG: bajos voltajes en neumotórax. Leucocitosis en neumonía. Radiografía de tórax con frecuencia diagnóstica |
| Síndrome aórtico agudo | Central, irradiado a espalda, brazos, mandíbula | Lancinante, continuo, a veces opresivo | No se modifica con movimientos ni respiración | HTA, focalidad neurológica, dolor abdominal, síncope, soplo aórtico, déficit de pulsos | ECG: alteraciones de la onda T y ST. Radiografía de tórax: ensanchamiento mediastínico |
| Tromboembolia pulmonar | Costal, central | Pleurítico, punzante | Agrava: tos, respiración | Hemoptisis, disnea, tos, hiperventilación | ECG: taquicardia, alteraciones de T y ST, BRD. Elevación dímero D, alcalosis respiratoria. Radiografía de tórax: oligohemia periférica |
| Mediastínico, esofágico | Epigástrico, central, cuello, mandíbula | «Quemante», a veces opresivo (espasmo) | Agrava: decúbito, bebidas frías (espasmo). Atenúa: antiácidos, nitratos (espasmo) | Pirosis, náuseas, vómitos, hematemesis. Fiebre | ECG: alteraciones inespecíficas, repolarización. Leucocitosis. Radiografía: neumomediastino en la perforación |
| Osteomuscular | Localizado, «a punta de dedo» | Punzante, agudo, continuo | Agrava: tos, palpación. Atenúa: reposo, antinflamatorios | Contusiones, antecedente de ejercicio | Radiografía: Fracturas costales |
| Psicógeno | Apical, brazo izquierdo, brazo derecho, «a punta de dedo» | Agudo, continuo, fugaz | Agrava: palpación | Nerviosismo, ansiedad, palpitaciones, hiperventilación | Alcalosis respiratoria, taquicardia sinusal |
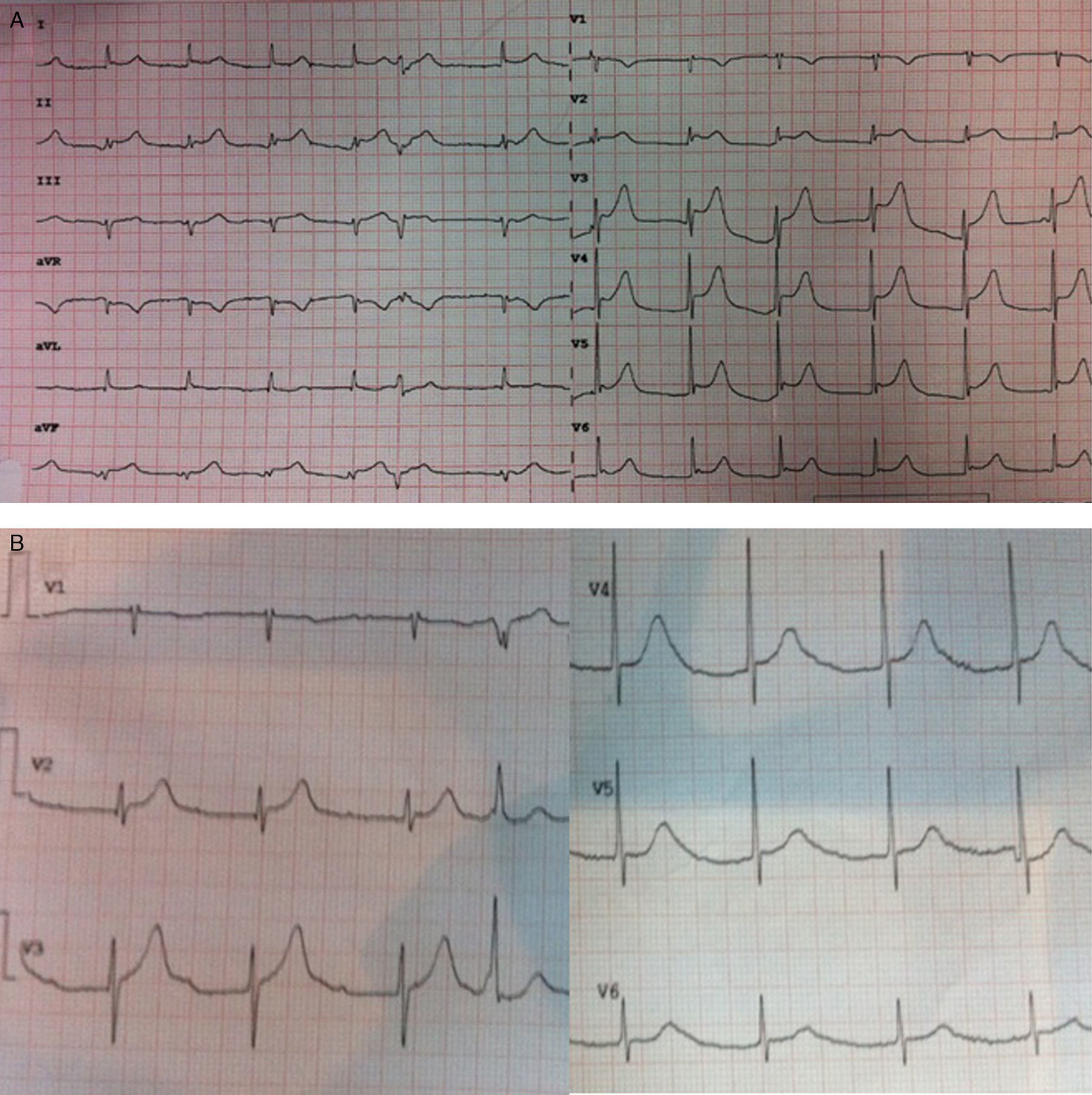
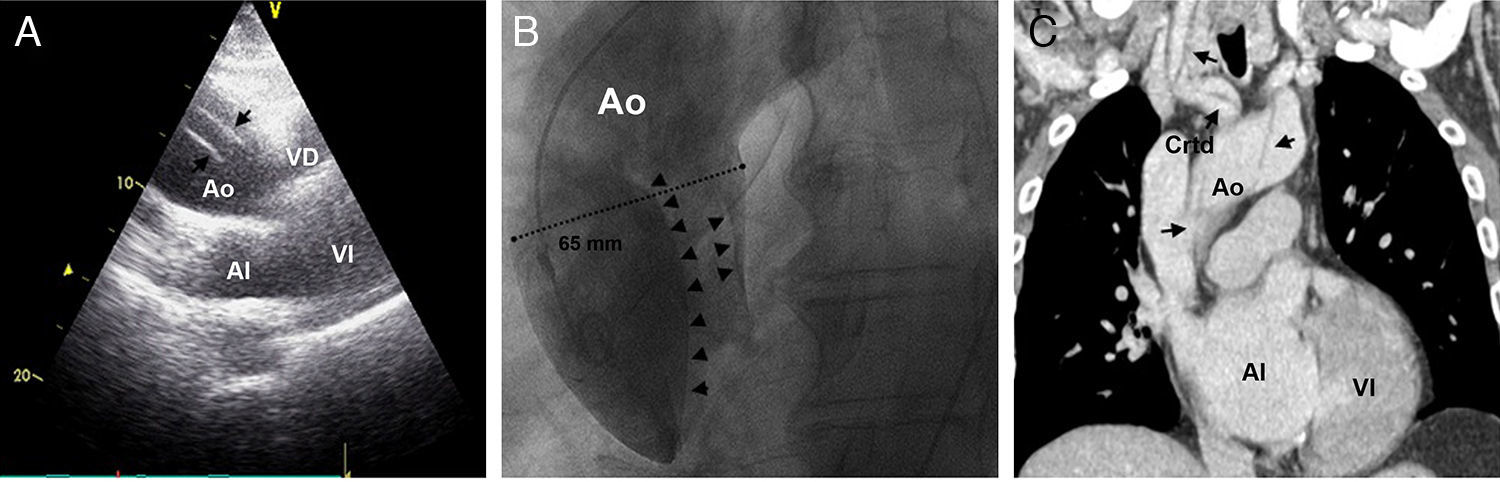
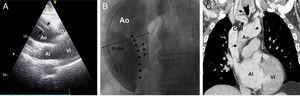
Varón de 74 años atendido en domicilio tras un síncope brusco posprandial. Dos días antes había presentado otro síncope y el día previo había consultado a su médico de familia por dolor opresivo en ambos brazos y por el que se le había realizado un ECG que no mostraba alteraciones. Era ex fumador e hipertenso y había sido intervenido años atrás debido a una HBP. Recibía tratamiento con valsartán, 320mg, y doxazosina, 4mg. El paciente fue trasladado a urgencias y tras la primera valoración se realizó un ECG y se contactó con el cardiólogo de guardia. A su llegada estaba consciente y orientado, con regular estado general y sus constantes eran: PA (brazo derecho) 85/45mmHg; FC: 120 lat./min, SpO2 basal 98% y temperatura 36°C. En la exploración destacaba IY, un soplo diastólico de intensidad leve en foco aórtico y crepitantes en bases pulmonares, además de ausencia de ambos pulsos radiales y del carotídeo derecho. Los pulsos de miembros inferiores estaban presentes. En ese momento refería dolor en hemitórax izquierdo, no claramente opresivo pero irradiado a región interescapular. El ECG mostraba ascenso del segmento ST difuso de hasta 3mm V2-V6 y en i, ii, iii, aVF (fig. 1A) y ante sospecha de SCACEST se activó el código de reperfusión urgente mediante angioplastia primaria establecido por protocolo en nuestro centro. A los 3 min se volvió a repetir el ECG que en esta ocasión mostraba práctica normalización del ascenso del ST (fig. 1B). El paciente se trasladó al laboratorio de cateterismos hipotenso a pesar de haber iniciado administración de noradrenalina y con DT residual. Se realizó un cateterismo transfemoral ante ausencia de pulsos a nivel radial, y el primer hallazgo fue que la PA invasiva era 165/60mmHg, por lo que se suspendió la noradrenalina. Tras varios intentos de canulación de ambas coronarias y dificultad de manipulación de los catéteres por severa dilatación aórtica, se practicó una aortografía (fig. 2B) que evidenció un aneurisma de aorta torácica ascendente con disección espiroidea y un gran flap intimal que ocluía de forma dinámica los ostium coronarios explicando las también dinámicas alteraciones del ST. Un ecocardiograma transtorácico (fig. 2A) confirmó los hallazgos y se contactó con cirugía cardiaca que aconsejó la realización de una TC (fig. 2C) para planear una estrategia quirúrgica. El paciente había sido previamente tratado con carga de doble antiagregación (clopidogrel, 600mg, y aspirina, 250mg) ante el primer diagnóstico de sospecha de SCACEST, lo cual dificultaría una correcta hemostasia durante la cirugía, por lo que aparte de iniciar tratamiento con nitroglicerina intravenosa para adecuado control tensional mediante monitorización invasiva, se transfundieron plaquetas y se cruzó sangre y plasma. La analítica mostraba ligero deterioro de la función renal con Cr 1,98mg/dl y elevación de troponina T de alta sensibilidad de 168 U/l con CK normal y dímero D 3.633 U/l. El paciente se trasladó al quirófano donde se confirmaron los hallazgos y se localizó la puerta de entrada por debajo de la salida de la subclavia izquierda, realizándose exclusión del aneurisma y sustitución de la aorta ascendente por un tubo valvulado (cirugía de Bentall-Bono) con mucha dificultad para hemostasia y duración del procedimiento de 6 h. Finalmente, tras un post-operatorio tórpido pudo ser dado de alta tras un mes de ingreso y actualmente es seguido de forma ambulatoria.
A) ECG del paciente a su llegada a urgencias: obsérvese el ascenso difuso del segmento ST desde V2-V6 y en i, ii, iii, aVL, aVF, que era más compatible con pericarditis que con lesión de múltiples territorios. B) ECG 3 min más tarde que muestra práctica normalización del ST y aparición nueva de un BAV 1.ocon PR muy largo, probablemente por afectación de la coronaria derecha.
Técnicas de imagen para el diagnóstico. A) Ecocardiograma transtorácico: se observan 2 imágenes lineales ecodensas y paralelas en el interior de la luz aórtica (flechas) que además presentaban movimiento independiente de la pared y que eran compatibles con flap de la íntima. B) Aortografía: las flechas señalan las líneas de disección y el flap en una aorta muy dilatada (65mm). Obsérvese que no hay relleno no selectivo de las arterias coronarias que tienen afectada su perfusión por el flap. C) Angio-TC: las flechas señalan las líneas de disección con afectación de aorta ascedente y troncos supraórticos. Ao: Aorta; AI: aurícula izquierda; Crtd: carótida; VD: ventrículo derecho; VI: ventrículo izquierdo.
El SAA se define como la presentación aguda de un DT característico ocasionado por una de las afecciones potencialmente mortales de la aorta torácica: la disección, el hematoma intramural o la úlcera aterosclerótica penetrante3–5. El caso expuesto corresponde a una disección aórtica aguda (DAA), cuya definición es la disrupción de la capa íntima, habitualmente precedida de degeneración o necrosis quística de la media y que ocasiona la creación de una falsa luz en el interior del vaso3–6. La sangre pasa a través de la falsa luz favoreciendo la progresión anterógrada o retrógrada de la disección desde el punto de rotura3–7. Numerosos trastornos adquiridos y genéticos pueden contribuir a una vía final común de debilitación y degeneración de la media que evoluciona habitualmente hacia la dilatación (aneurisma), hematoma intramural por rotura de vasa vasorum, disección o rotura. La perpetuación de factores que contribuyen a un aumento de la tensión parietal ocasiona degeneración y facilitan su rotura, siendo en los bordes de placas de ateroma donde suelen producirse3–7. Los trastornos genéticos más frecuentemente relacionados son aquellos que afectan al tejido conjuntivo con degeneración quística de la media, como el síndrome de Marfan o el Síndrome de Ehlers-Danlos3–5. La DAA tiene una incidencia de 2,6-3,5 casos/100.000 hab./año y afecta más frecuentemente a varones (75-80%) con edad media 65 años. La HTA es el factor de riesgo más frecuente (80%), seguido del tabaquismo (45%). El síndrome de Marfan es responsable del 5% y con menor edad de aparición3–7. Se ha clasificado la DAA como tipo A o B de Stanford según esté afectada o no la aorta ascedente y tipos i (toda la aorta), ii (solo la aorta ascendente) y iii (respeta aorta ascedente y arco) según DeBakey. La tipo A o ii es la presentación más frecuente (70%) y la puerta de entrada suele localizarse 5-6cm encima del seno de Valsalva derecho (65%) tras la salida de la subclavia izquierda (20%)3–7. Clínicamente, suele reconocerse por la aparición brusca de dolor severo de carácter desgarrante y a veces pulsátil o migratorio siguiendo el sentido de la disección y localizado en la parte anterior del tórax (95%) irradiado hacia mandíbula, brazos o espalda y, en ocasiones, hacia el abdomen si progresa distalmente. El paciente puede tener apariencia de shock con PA normal o incluso alta en el 30-60%. La valoración de la PA debe hacerse con precaución, ya que cuando hay afectación de troncos supraórticos, su medición en miembros superiores puede revelar valores falsamente bajos (seudohipotensión)3–5. En ocasiones se asocian síntomas de insuficiencia cardiaca por insuficiencia aórtica aguda o síncope8 (18-25%), este último más frecuente cuando la disección se rompe proximalmente ocasionando taponamiento (15% disecciones de tipo A). Menos frecuente es la aparición concomitante de un ictus por afectación carotídea, o la neuropatía periférica (3-6%). Por supuesto, puede presentarse también como muerte súbita o IAM (2%) por afectación coronaria, habitualmente disección de la coronaria derecha3–7. En la exploración física destacan varios signos guía. El déficit de pulsos (20%-50%) es más frecuente en disecciones de tipo A y miembros superiores, menos frecuente femorales (10%). Un soplo de insuficiencia aórtica aparece en el 60%. Menos frecuentes son la hemoptisis, el hemotórax o la hematemesis por rotura a bronquio, espacio pleural o esófago, respectivamente3–7. Las pruebas complementarias habituales ayudan al diagnóstico, pero son inespecíficas. El ECG es normal en el 40% pero puede mostrar cambios en la repolarización por isquemia, en ocasiones transitorios, hasta en el 13%. La radiografía de tórax es normal en el 20% con ensanchamiento mediastínico en el 50% y contorno aórtico anormal en el 20%. Puede evidenciar a veces derrame pleural (8%) y cardiomegalia por derrame pericárdico (14%). En la analítica puede encontrarse elevación de creatinina por daño renal, anemia por secuestro de sangre o rotura, leucocitosis y frecuentemente elevación de troponina y CK-MB. Es frecuente también encontrar elevación de D-dímero3–7. Las técnicas de imagen proporcionan el diagnóstico definitivo9. Actualmente la angio-TC es la técnica de elección, con sensibilidad y especificidad cercanas al 100% y ampliamente disponible. Además en estos momentos es posible realizar una estrategia de «triple descarte» con ciertos protocolos de administración de contraste y obtención de imágenes que permiten visualizar coronarias, aorta y descartar un TEP en el mismo estudio. Aunque todavía no muy extendida por su coste, es posible que con el paso de los años se utilice cada vez más en la evaluación del DT en urgencias9. El ecocardiograma transtorácico es también fundamental en el diagnóstico, aportando evaluación funcional y anatómica; el diagnóstico se basa en la visualización del flap con movimiento en la luz del vaso. También informa sobre el funcionamiento de la válvula aórtica o la presencia de derrame pericárdico. Si se realiza el estudio con transesofágico, el rendimiento es mucho mayor, con valor predictivo positivo del 95%, permitiendo además visualizar de cerca la aorta, diferenciar ambas luces (verdadera y falsa), la puerta de entrada y la trombosis de la falsa luz; tiene el inconveniente de la necesidad de sedación. La RM aporta información de todo lo anterior, pero su disponibilidad es menor en urgencias. La angiografía tiene una precisión diagnóstica del 98% y permite información sobre el estado coronario y de ramas de la aorta, pero el inconveniente de ser invasiva y menos rápida en el diagnóstico9. El manejo agudo requiere monitorización hemodinámica estricta desde el principio. El paciente debe estar en un lugar tranquilo y debe controlarse el dolor de forma adecuada. Es imprescindible mantener la PA sistólica en 100-120mmHg y la FC en torno a 60 lat./min. Los fármacos idóneos son los vasodilatadores de acción rápida como nitroglicerina o nitroprusiato y en ausencia de contraindicaciones los bloqueadores beta, clásicamente el propranolol (1mg intravenoso cada 5 min hasta lograr la FC deseada), pero pueden utilizarse algunos en infusión continua como esmolol o labetalol3–7,10. Puede ser necesario el tratamiento concomitante de complicaciones añadidas como pericardiocentesis, reposición de volumen o sangre, tratamiento del shock, etc.3–7,10. Hay que considerar la DAA tipo A como una urgencia quirúrgica. El pronóstico es muy adverso incluso con tratamiento quirúrgico. La mortalidad aumenta un 2% por hora de retraso diagnóstico y llega a ser del 50% a las 2 semanas en ausencia de cirugía y hasta el 20% con cirugía.
El caso expuesto corresponde a una DAA tipo A o ii y tiene varias peculiaridades que nos pueden ayudar a reflexionar sobre el buen manejo del DT. El primer punto a destacar está en el primer contacto médico del paciente, 2 días antes de ser diagnosticado. Pese a tener un ECG compatible con la normalidad, presentaba 2 síntomas de alarma, DT y síncope, así como factores de riesgo cardiovascular y, por tanto, debería haber sido derivado para valoración urgente. El segundo punto está en la exploración física en urgencias. La ausencia de pulsos junto a los síntomas debería habernos hecho sospechar el SAA y la seudohipotensión nos hizo iniciar la administración de fármacos vasoconstrictores que favorecen la rotura. Por tanto, es importante en caso de hipotensión en un paciente con DT la comprobación en las 4 extremidades y evitar medidas terapéuticas que pueden ser contraproducentes. Es cierto que en el SCACEST el tiempo apremia y el ECG era compatible, pero su tratamiento puede empeorar mucho la situación clínica de un SAA, máxime si se realiza trombólisis. Esto nos hace comentar el tercer punto: gran parte del éxito de la cirugía depende de una correcta hemostasia y si antiagregamos o anticoagulamos intensamente, podemos agravar la situación, más aún si el paciente está sangrando a pericardio. El cuarto punto hace referencia a un hallazgo inusual como es la alteración dinámica del ST en los ECG por oclusión también dinámica de los ostium coronarios (2% presentación como SCA). Por último, cabe añadir que con una adecuada exploración y teniendo en cuenta lo expuesto, la realización de una TC torácica ante la sospecha de SAA hubiera evitado el cateterismo y ahorrado tiempo en el diagnóstico. Con este caso inhabitual, queremos en resumen ayudar a reflexionar sobre los diagnósticos diferenciales del DT y ayudar también a reconocer signos de alarma que deben hacernos pensar en las enfermedades más graves. Por tanto, ante un paciente con factores de riesgo cardiovascular, que se presenta con DT, hipotensión, síncope y déficit de pulsos, una atención urgente es mandatoria y debemos pensar en una enfermedad potencialmente mortal como la expuesta.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.