Describir las características clínicas y el manejo de pacientes con fibrilación auricular no valvular (FANV) tratados con anticoagulantes orales de acción directa (ACOD) de acuerdo a quién inicia su prescripción: el médico de atención primaria (AP) o el especialista.
Material y métodosSe compararon 2 estudios observacionales, transversales y multicéntricos. El estudio SILVER-AP se realizó en aquellas comunidades autónomas en las que el médico de AP podía prescribir ACOD y el estudio BRONCE-AP en aquellas comunidades autónomas en las que el médico de AP debía derivar al especialista para tal fin. Se incluyeron pacientes diagnosticados de FANV con riesgo de ictus o embolia sistémica que estuviesen en tratamiento crónico con anticoagulantes, que hubiesen modificado su pauta terapéutica y que actualmente estuviesen en tratamiento con un ACOD durante al menos 3meses.
ResultadosSe incluyeron un total de 1.036 pacientes (790 provenientes del estudio SILVER-AP y 246 del BRONCE-AP). En comparación con el estudio BRONCE-AP, los pacientes incluidos en el SILVER-AP eran mayores, tenían más comorbilidades y el riesgo tromboembólico y hemorrágico era más elevado (CHA2DS2-VASc 4,3±1,6 vs. 3,8±1,8; p<0,001; HAS-BLED 2,1±0,8 vs. 1,8±1,0; p<0,001). El cumplimiento terapéutico fue elevado, al igual que la satisfacción con el tratamiento. Las dosis bajas de ACOD se emplearon frecuentemente, en especial con dabigatrán.
ConclusionesLos pacientes en los que el médico de AP puede prescribir ACOD tienen un peor perfil clínico, con un mayor riesgo tromboembólico y de hemorragias que aquellos casos en los que debe derivar al especialista.
To determine the clinical characteristics and management of patients with non-valvular atrial fibrillation (NVAF) treated with direct oral anticoagulants (DOAC) according to who initiates their prescription, the Primary Care (PC) physician or referring the patient to a specialist.
Material and methodsTwo observational, cross-sectional and multicentre studies were compared for this purpose. The SILVER-AP study was performed in those autonomous communities in which the PC physician can prescribe DOAC directly, and the BRONCE-AP study in those autonomous communities in which the PC physician has to refer the patient to the specialist to start treatment with DOAC. Patients on chronic treatment with anticoagulants, in whom therapy was changed, and those that were on current treatment with DOAC for at least 3months, were included.
ResultsA total of 1,036 patients (790 from SILVER-AP study and 246 from BRONCE-AP study) were included. Compared with the BRONCE-AP study, those patients included in SILVER-AP were older and had more comorbidities, as well as a higher thromboembolic and haemorrhagic risk (CHA2DS2-VASc 4.3±1.6 vs. 3.8±1.8; P<.001; HAS-BLED 2.1±0.8 vs. 1.8±1.0; P<.001). Therapeutic adherence and satisfaction with treatment were high. Low doses of DOAC were frequently prescribed, particularly with dabigatran.
ConclusionsThose patients in whom the PC physician can prescribe DOAC directly have a worse clinical profile, as well as a higher thromboembolic and haemorrhagic risk than those patients in whom the PC physician has to refer to the specialist.
La anticoagulación constituye la piedra angular en el tratamiento de los pacientes con fibrilación auricular (FA) para disminuir el riesgo de presentar complicaciones tromboembólicas1. Durante décadas se han empleado los antagonistas de la vitaminaK (AVK) como tratamiento antitrombótico en los sujetos con FA2,3. Sin embargo, a pesar de que la mayoría de los pacientes con FA tienen un elevado riesgo de presentar ictus4, existe una proporción importante de pacientes, que puede llegar hasta el 40% de los casos según las series, que aun teniendo FA e indicación de anticoagulación no la reciben, a pesar de no haber una contraindicación clara para ella2,5. Aunque la infraestimación del riesgo de ictus podría explicar en parte esta situación, el miedo al sangrado asociado a la anticoagulación, y sobre todo las limitaciones relacionadas con el tratamiento con AVK, podrían subyacer como las causas principales2,6. Además, aproximadamente el 40% de los pacientes anticoagulados con AVK tienen habitualmente un mal control de la relación normalizada internacional (internacional normalizad ratio [INR]), lo que aumenta de manera innecesaria tanto el riesgo de ictus como el de sangrados7–11.
Globalmente, en comparación con los AVK, los anticoagulantes orales de acción directa (ACOD) reducen el riesgo de ictus o embolismo sistémico y tienen un menor riesgo de hemorragias, sobre todo intracraneales y mortales12. Además, se pueden administrar a dosis fijas, no necesitan controles periódicos de la anticoagulación y tienen escasas interacciones con otros fármacos y ninguna con los alimentos13,14.
Aunque en la actualidad en España el tratamiento anticoagulante más frecuentemente prescrito siguen siendo los AVK, cada vez son más pacientes los que reciben tratamiento anticoagulante con ACOD15. En el año 2013, la Agencia Española de Medicamentos y Productos Sanitarios publicó un informe de posicionamiento terapéutico (IPT) realizando una serie de recomendaciones sobre el uso de ACOD en el paciente con FA no valvular (FANV)16, indicando, entre otras cosas, en qué pacientes/situaciones se deberían emplear los ACOD de manera preferencial. Sin embargo, cada comunidad autónoma ha realizado sus propias recomendaciones, y no en todas las comunidades autónomas el médico de atención primaria (AP) puede prescribir directamente ACOD, sino que en algunas el médico de AP se ve obligado a derivar al especialista para que sea este el que lo haga. Recientemente se ha publicado una nueva versión del IPT, si bien los cambios no han sido muy sustanciales con respecto a la edición previa17.
Actualmente existe muy poca información en nuestro país acerca de en qué pacientes se están empleando ACOD, cómo se está realizando el manejo de ACOD en la práctica clínica, y si el hecho de que el médico de AP pueda prescribir directamente o no un ACOD tiene algún impacto15,18-20.
El objetivo principal de este estudio fue describir las características sociodemográficas y clínicas de los pacientes diagnosticados de FANV con riesgo de ictus o embolia sistémica en tratamiento anticoagulante que hubiesen modificado su pauta terapéutica hacía al menos 3 meses por cualquier situación clínica, y que actualmente se encontrasen en tratamiento con un ACOD. Como objetivos secundarios se analizaron el cumplimiento terapéutico de los pacientes con FANV con respecto a su tratamiento crónico anticoagulante en el momento de ser reclutados, la satisfacción de los pacientes con el tratamiento anticoagulante, así como los motivos que hubiesen determinado el cambio de tratamiento anticoagulante.
Material y métodosPara contestar a estas cuestiones, el presente trabajo ha analizado la información proveniente de dos estudios: el SILVER-AP y el BRONCE-AP21,22. La metodología de ambos estudios ha sido publicada previamente21,22.
En resumen, SILVER-AP fue un estudio observacional de corte transversal, nacional y multicéntrico, realizado en las 9 comunidades autónomas en las que el médico de AP podía establecer la indicación y la prescripción de un ACOD en el momento del reclutamiento de los pacientes (Galicia, Madrid, País Vasco, Navarra, Aragón, Andalucía, Cataluña, Valencia y Baleares), mientras que el estudio BRONCE-AP fue un estudio observacional, transversal, nacional y multicéntrico realizado en las 8 comunidades autónomas donde el médico de AP no podía prescribir un ACOD directamente y tenía que derivar al paciente al especialista para que este lo hiciese.
Para ello se incluyó a pacientes ≥18 años diagnosticados de FANV con riesgo de ictus o embolia sistémica atendidos en consultas de AP, que estuviesen en tratamiento crónico con anticoagulantes, que hubiesen modificado su pauta terapéutica por cualquier situación clínica y que actualmente estuviesen en tratamiento con un ACOD durante al menos 3meses antes de ser reclutados, cuya indicación del ACOD hubiese sido establecida por el médico de AP (SILVER-AP) o cuya primera prescripción del ACOD tuviese que ser realizada por el especialista (BRONCE-AP) y que hubiesen firmado el consentimiento informado. Se excluyó a los pacientes que hubiesen modificado su tratamiento anticoagulante en un periodo inferior a 3meses antes de la firma del consentimiento informado, que presentasen un deterioro cognitivo que impidiese la comprensión de lo redactado en la hoja de información para el paciente, el consentimiento informado o la realización de cuestionarios autoadministrados o cuyo inicio del tratamiento anticoagulante para FANV fuese un ACOD.
El estudio SILVER-AP fue aprobado por el comité ético de investigación clínica de referencia (IDIAP, Fundación Jordi Gol) y por los comités éticos de investigación clínica locales de los diferentes centros participantes. El reclutamiento se inició en mayo de 2015 y finalizó en diciembre de 2015. El estudio BRONCE-AP fue aprobado por el comité ético de investigación clínica de referencia (Principado de Asturias) y por los comités éticos de investigación clínica locales de los diferentes centros participantes. El reclutamiento se realizó entre septiembre y diciembre de 2015.
En cada uno de los dos estudios todos los datos se obtuvieron en una única entrevista al paciente y a través de dos fuentes de información: la historia clínica del paciente y el cuestionario de satisfacción con el tratamiento anticoagulante Anti-Clot Treatment Scale (ACTS)23. Los datos se recogieron en un cuaderno de recogida de datos electrónico diseñado específicamente para cada uno de los estudios y que disponía de un sistema de validación interna.
Se recogieron variables sociodemográficas (edad, sexo, raza, situación laboral, situación familiar, grado de autonomía, nivel de estudios), datos referentes a la FA (tipo de FA, tiempo desde el diagnóstico), exploración física (peso, talla, presión arterial y frecuencia cardiaca), factores de riesgo cardiovascular (hipertensión arterial, dislipemia, diabetes, hábito tabáquico), enfermedades cardiovasculares asociadas (cardiopatía isquémica, incluyendo antecedentes de infarto de miocardio, insuficiencia cardiaca congestiva y/o disfunción del ventrículo izquierdo, historia de ictus, ataque isquémico transitorio o embolismo sistémico, enfermedad arterial periférica, insuficiencia renal [filtrado glomerular estimado <60ml/min], placa de ateroma), antecedentes de sangrado, anemia o predisposición al sangrado, antecedentes de INR lábil (tiempo en rango terapéutico <60% por el método directo o <65% por el de Rosendaal16), polimedicación (toma ≥5 principios activos de forma habitual en el momento de la visita)21,22, EPOC, depresión y cáncer activo. Se estratificó el riesgo tromboembólico mediante las escalas CHADS2 y CHA2DS2-VASc y el riesgo de sangrado mediante la escala HAS-BLED24,25.
Se analizó el tratamiento anticoagulante previo (tipo, duración y, en caso de AVK, qué médico y dónde se realizaba el control de la anticoagulación, así como los motivos del cambio del tratamiento previo anticoagulante a ACOD según se siguiera el IPT16). Con respecto a los ACOD, se analizó el tipo de ACOD prescrito y su posología. También se analizó el cumplimiento terapéutico referido a los ACOD mediante el test de Haynes-Sackett y el grado de satisfacción con los ACOD a través del cuestionario ACTS23,26. En el test de Haynes-Sackett se define buen cumplimiento cuando el paciente declara haber tomado una cantidad de comprimidos >80% y <110% de los prescritos26. El cuestionario ACTS mide la satisfacción con el tratamiento anticoagulante, teniendo en cuenta su experiencia con el tratamiento en las 4 semanas anteriores. Incluye 13 ítems sobre la carga que supone el tratamiento, mediante una escala de 12 ítems (escala Carga [Burden Scale]) y una pregunta global sobre dicha carga, y 4 ítems sobre los beneficios de dicho tratamiento, incluyendo una escala de 3 ítems sobre los beneficios (escala Beneficios [Benefit Scale]) y una pregunta de carácter general. En ambas escalas, cuanto mayor sea la puntuación, la satisfacción con el tratamiento será mayor. La puntuación de la escala Carga oscila entre 12 y 60 puntos, y la de la escala Beneficio, entre 3 y 15 puntos23.
Análisis estadísticoLas variables categóricas se describieron mediante frecuencias absolutas y relativas. Para la descripción de las variables continuas se emplearon la media y la desviación típica. Los datos de ambos estudios se analizaron de manera conjunta, incluyendo a todos los pacientes valorables de ambos estudios y también cada uno de los 2 estudios de forma independiente, pudiendo así analizar diferencias estadísticamente significativas entre ambos estudios.
Para las comparaciones de subgrupos de pacientes en las variables cuantitativas se utilizaron pruebas paramétricas (t de Student) o no paramétricas (U de Mann-Whitney), según las características propias de las variables en estudio (normalidad de las variables). Para las variables cualitativas se realizó la prueba chi-cuadrado o el test exacto de Fisher. En todas las pruebas estadísticas se aplicó un nivel de significación estadística bilateral <0,05.
El tratamiento estadístico de los datos se realizó con el soporte del paquete estadístico SAS versión 9.4 (SAS Institute Inc., Cary, NC).
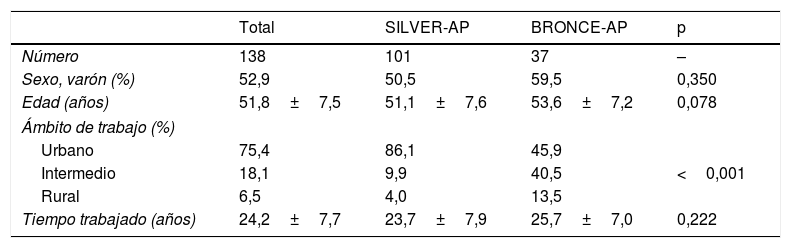
ResultadosEn el conjunto de estudios SILVER-AP y BRONCE AP participaron un total de 138 investigadores de toda España (tabla 1). La edad media de los investigadores fue de 51,8±7,5años, el 52,9% varones, y la mayoría provenían principalmente del ámbito urbano (75,4%), sobre todo en el estudio SILVER-AP. Todos los investigadores tenían una amplia experiencia (tiempo trabajado 24,2±7,7años).
Perfil de los investigadores
| Total | SILVER-AP | BRONCE-AP | p | |
|---|---|---|---|---|
| Número | 138 | 101 | 37 | – |
| Sexo, varón (%) | 52,9 | 50,5 | 59,5 | 0,350 |
| Edad (años) | 51,8±7,5 | 51,1±7,6 | 53,6±7,2 | 0,078 |
| Ámbito de trabajo (%) | ||||
| Urbano | 75,4 | 86,1 | 45,9 | |
| Intermedio | 18,1 | 9,9 | 40,5 | <0,001 |
| Rural | 6,5 | 4,0 | 13,5 | |
| Tiempo trabajado (años) | 24,2±7,7 | 23,7±7,9 | 25,7±7,0 | 0,222 |
Urbano: >10.000 habitantes; Intermedio: >2.000 y ≤10.000 habitantes; Rural: ≤2.000 habitantes.
Para la comparación entre variables cuantitativas se empleó la t de Student y para la comparación entre variables cualitativas, la prueba chi-cuadrado.
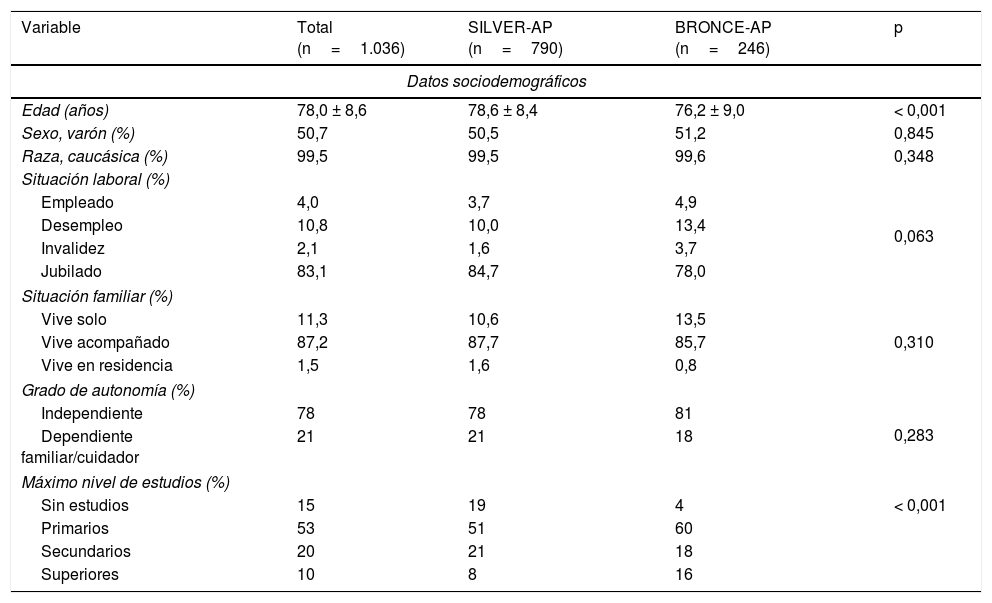
En el SILVER-AP y en el BRONCE-AP, de los 792 y 247 pacientes incluidos, respectivamente, 790 (99,7%) y 246 (99,6%) resultaron valorables para el análisis final del estudio. De esta forma, en el presente estudio se incluyeron un total de 1.036 pacientes (790 provenientes del estudio SILVER-AP y 246 del BRONCE-AP). En la tabla 2 se resumen las principales características clínicas de los pacientes incluidos, divididos según el estudio de origen. Globalmente, los pacientes tenían una edad avanzada (edad media 78,0±8,6años), la mayoría estaban jubilados (83,1%), vivían acompañados (87,2%) y eran independientes (78,9%). La mayoría de los pacientes tenía FA permanente (59,3%), con un tiempo medio de evolución de 5,4±4,4años. El 85,0% de los pacientes eran hipertensos, el 26,9% tenían insuficiencia cardiaca, el 20,3% presentaban antecedentes de ictus, ataque isquémico transitorio o embolismo sistémico, y el 18,1%, insuficiencia renal. Los pacientes del estudio tomaban una media de 7,0±3,1 principios activos de forma habitual, incluyendo el tratamiento anticoagulante (el 82,1% de los pacientes se encontraba polimedicado). En el estudio SILVER-AP, en comparación con el estudio BRONCE-AP, los pacientes eran más ancianos (78,6±8,4 vs. 76,2±9,0; p<0,001), era más frecuente la FA permanente (64,6% vs. 42,3%; p <0,001) y tenían más hipertensión arterial (86,3% vs. 80,9%; p=0,037), diabetes (32,4% vs. 24,0%; p=0,012), insuficiencia cardiaca (29,4% vs. 19,1%; p=0,002) e insuficiencia renal (20,0% vs. 11,8%; p=0,004). La polimedicación también fue más frecuente en el estudio SILVER-AP (83,6% vs. 77,2%; p=0,023).
Características clínicas de la población de estudio
| Variable | Total (n=1.036) | SILVER-AP (n=790) | BRONCE-AP (n=246) | p |
|---|---|---|---|---|
| Datos sociodemográficos | ||||
| Edad (años) | 78,0 ± 8,6 | 78,6 ± 8,4 | 76,2 ± 9,0 | < 0,001 |
| Sexo, varón (%) | 50,7 | 50,5 | 51,2 | 0,845 |
| Raza, caucásica (%) | 99,5 | 99,5 | 99,6 | 0,348 |
| Situación laboral (%) | ||||
| Empleado | 4,0 | 3,7 | 4,9 | 0,063 |
| Desempleo | 10,8 | 10,0 | 13,4 | |
| Invalidez | 2,1 | 1,6 | 3,7 | |
| Jubilado | 83,1 | 84,7 | 78,0 | |
| Situación familiar (%) | ||||
| Vive solo | 11,3 | 10,6 | 13,5 | 0,310 |
| Vive acompañado | 87,2 | 87,7 | 85,7 | |
| Vive en residencia | 1,5 | 1,6 | 0,8 | |
| Grado de autonomía (%) | ||||
| Independiente | 78 | 78 | 81 | 0,283 |
| Dependiente familiar/cuidador | 21 | 21 | 18 | |
| Máximo nivel de estudios (%) | ||||
| Sin estudios | 15 | 19 | 4 | < 0,001 |
| Primarios | 53 | 51 | 60 | |
| Secundarios | 20 | 21 | 18 | |
| Superiores | 10 | 8 | 16 | |
| Características de la FA | ||||
|---|---|---|---|---|
| Tipo de FA (%) | ||||
| Paroxística | 28 | 26 | 34 | < 0,001 |
| Persistente | 12 | 9 | 23 | |
| Permanente | 59 | 64 | 42 | |
| Tiempo desde el diagnóstico de FA (años) | 5,4 ± 4,4 | 5,4 ± 4,2 | 5,3 ± 5,1 | 0,067 |
| Exploración física | ||||
| Índice de masa corporal (kg/m2) | 29,0 ± 4,9 | 29,0 ± 4,8 | 29,0 ± 5,2 | 0,727 |
| Presión arterial sistólica (mmHg) | 131,5 ± 14,3 | 130,9 ± 14,3 | 133,2 ± 14,3 | 0,013 |
| Presión arterial diastólica (mmHg) | 74,9 ± 9,2 | 74,5 ± 9,1 | 75,9 ± 9,4 | 0,019 |
| Frecuencia cardiaca (lpm) | 73,5 ± 12,7 | 73,9 ± 12,8 | 72,2 ± 12,4 | 0,065 |
| Factores de riesgo cardiovascular | ||||
|---|---|---|---|---|
| Hipertensión arterial (% [IC 95%]) | 85,0 [82,9-87,2] | 86,3 [83,9-88,7] | 80,9 [76,0-85,8] | 0,037 |
| Dislipemia (% [IC 95%]) | 61,9 [58,9-64,9] | 63,8 [60,5-67,2] | 55,6 [49,3-61,8] | 0,020 |
| Diabetes mellitus (% [IC 95%]) | 30,4 [27,6-33,3] | 32,4 [29,1-35,7] | 24,0 [18,7-29,3] | 0,012 |
| Tabaquismo (% [IC95%]) | ||||
| Fumador activo | 5,3 [3,9-6,7 | 5,8 [4,2-7,5] | 3,7 [1,3-6,0] | 0,354 |
| Ex fumador (≥ 1 año) | 33,3 [30,4-36,2] | 32,7 [29,4-35,9] | 35,3 [29,4-41,3] | |
| Nunca fumador | 61,4 [58,4-64,4] | 61,5 [58,1-64,9] | 61,0 [54,9-67,1] | |
| Enfermedades cardiovasculares | ||||
|---|---|---|---|---|
| Insuficiencia cardiaca/disfunción sistólicaVI(% [IC 95%]) | 26,9 [24,2-29,6] | 29,4 [26,2-32,5] | 19,1 [14,2-24,0] | 0,002 |
| Antecedentes de ictus, AIT o ES (% [IC 95%]) | 20,3 [17,8-22,7] | 20,8 [17,9-23,6] | 18,7 [13,8-23,6] | 0,483 |
| Insuficiencia renal (% [IC 95%]) | 18,1 [15,7-20,4] | 20,0 [17,2-22,8] | 11,8 [7,8-15,8] | 0,004 |
| Enfermedad arterial periférica (% [IC 95%]) | 10,0 [8,2-11,9] | 9,7 [7,7-11,8] | 11,0 [7,1-14,9] | 0,576 |
| Cardiopatía isquémica (% [IC 95%]) | 13,9 [11,9-16,1] | 15,1 [12,6-17,6] | 10,6 [6,7-14,4] | 0,076 |
| Antecedentes de infarto de miocardio (% [IC 95%]) | 7,1 [5.6-8.7] | 7,8 [6.0-9.7] | 4,9 [2.2-7.6] | 0,114 |
| Placa de ateroma en cualquier territorio (% [IC 95%]) | 5,8 [4,4-7,2] | 6,3 [4,6-8,0] | 4,1 [1,6-6,5] | 0,184 |
| Factores que aumentan el riesgo de sangrado | ||||
|---|---|---|---|---|
| INR lábil conocido (% [IC 95%]) | 57,8 [54,8-60,8] | 63,7 [60,3-67,0] | 39,0 [32,9-45,1] | < 0,001 |
| Historia de sangrado, anemia o predisposición al sangrado (% [IC 95%]) | 10,0 [8,2-11,9] | 10,4 [8,3-12,5] | 8,9 [5,4-12,5] | 0,513 |
| Otras enfermedades/situaciones de interés | ||||
|---|---|---|---|---|
| Polimedicación (% [IC 95%]) | 82,1 [79,8-84,4] | 83,6 [81,0-86,2] | 77,2 [72,0-82,5] | 0,023 |
| Depresión (% [IC 95%]) | 16,3 [14,1-18,7] | 16,2 [13,6-18,8] | 16,7 [12,0-21,3] | 0,863 |
| EPOC (% [IC 95%]) | 17,3 [15,0-19,6] | 19,4 [16,6-22,1] | 10,6 [6,7-14,4] | 0,001 |
| Cáncer activo (% [IC 95%]) | 3,1 [2,0-4,1] | 2,2 [1,1-3,2] | 6,1 [3,5-9,9] | 0,002 |
AIT: ataque isquémico transitorio; EPOC: enfermedad pulmonar obstructiva crónica; ES: embolismo sistémico; IC 95%: intervalo de confianza del 95%; VI: ventrículo izquierdo.
Para la comparación entre variables cuantitativas se empleó la t de Student y para la comparación entre variables cualitativas, la prueba chi-cuadrado.
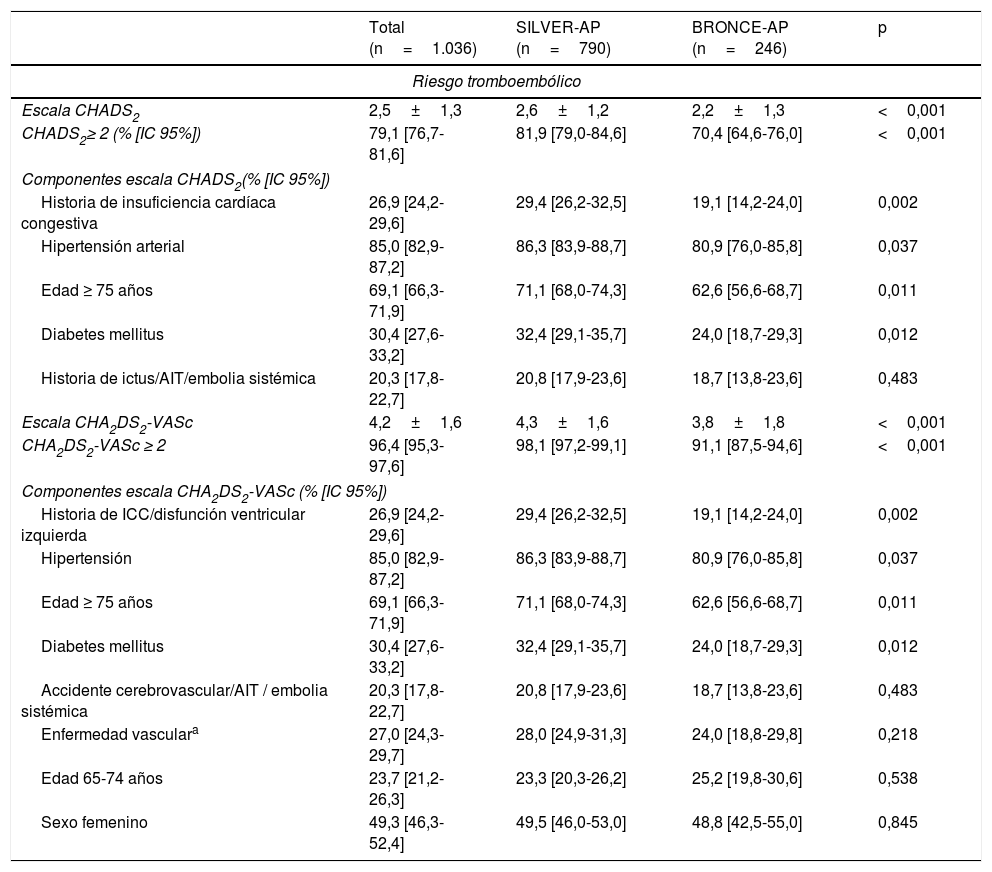
Los pacientes tenían un elevado riesgo tromboembólico (79,1% de los pacientes tenían un CHADS2 ≥2, y el 96,4% un CHA2DS2-VASc ≥2), siendo mayor en el estudio SILVER-AP que en el BRONCE-AP (CHADS2 medio 2,6±1,2 vs. 2,2±1,3; p<0,001; CHA2DS2-VASc medio 4,3±1,6 vs. 3,8±1,8; p<0,001). Por el contrario, solo el 26,1% de los pacientes tenía un elevado riesgo de sangrado, que también fue mayor en el estudio SILVER-AP (HAS-BLED 2,1±0,8 vs. 1,8±1,0; p<0,001) (tabla 3).
Estratificación de riesgo tromboembólico y hemorrágico
| Total (n=1.036) | SILVER-AP (n=790) | BRONCE-AP (n=246) | p | |
|---|---|---|---|---|
| Riesgo tromboembólico | ||||
| Escala CHADS2 | 2,5±1,3 | 2,6±1,2 | 2,2±1,3 | <0,001 |
| CHADS2≥ 2 (% [IC 95%]) | 79,1 [76,7-81,6] | 81,9 [79,0-84,6] | 70,4 [64,6-76,0] | <0,001 |
| Componentes escala CHADS2(% [IC 95%]) | ||||
| Historia de insuficiencia cardíaca congestiva | 26,9 [24,2-29,6] | 29,4 [26,2-32,5] | 19,1 [14,2-24,0] | 0,002 |
| Hipertensión arterial | 85,0 [82,9-87,2] | 86,3 [83,9-88,7] | 80,9 [76,0-85,8] | 0,037 |
| Edad ≥ 75 años | 69,1 [66,3-71,9] | 71,1 [68,0-74,3] | 62,6 [56,6-68,7] | 0,011 |
| Diabetes mellitus | 30,4 [27,6-33,2] | 32,4 [29,1-35,7] | 24,0 [18,7-29,3] | 0,012 |
| Historia de ictus/AIT/embolia sistémica | 20,3 [17,8-22,7] | 20,8 [17,9-23,6] | 18,7 [13,8-23,6] | 0,483 |
| Escala CHA2DS2-VASc | 4,2±1,6 | 4,3±1,6 | 3,8±1,8 | <0,001 |
| CHA2DS2-VASc ≥ 2 | 96,4 [95,3-97,6] | 98,1 [97,2-99,1] | 91,1 [87,5-94,6] | <0,001 |
| Componentes escala CHA2DS2-VASc (% [IC 95%]) | ||||
| Historia de ICC/disfunción ventricular izquierda | 26,9 [24,2-29,6] | 29,4 [26,2-32,5] | 19,1 [14,2-24,0] | 0,002 |
| Hipertensión | 85,0 [82,9-87,2] | 86,3 [83,9-88,7] | 80,9 [76,0-85,8] | 0,037 |
| Edad ≥ 75 años | 69,1 [66,3-71,9] | 71,1 [68,0-74,3] | 62,6 [56,6-68,7] | 0,011 |
| Diabetes mellitus | 30,4 [27,6-33,2] | 32,4 [29,1-35,7] | 24,0 [18,7-29,3] | 0,012 |
| Accidente cerebrovascular/AIT / embolia sistémica | 20,3 [17,8-22,7] | 20,8 [17,9-23,6] | 18,7 [13,8-23,6] | 0,483 |
| Enfermedad vasculara | 27,0 [24,3-29,7] | 28,0 [24,9-31,3] | 24,0 [18,8-29,8] | 0,218 |
| Edad 65-74 años | 23,7 [21,2-26,3] | 23,3 [20,3-26,2] | 25,2 [19,8-30,6] | 0,538 |
| Sexo femenino | 49,3 [46,3-52,4] | 49,5 [46,0-53,0] | 48,8 [42,5-55,0] | 0,845 |
| Riesgo de sangrado | ||||
|---|---|---|---|---|
| Escala HAS-BLED | 2,0±0,9 | 2,1±0,8 | 1,8±1,0 | <0,001 |
| HAS-BLED ≥3 (% [IC95%]) | 26,1 [23,4-28,7] | 27,6 [24,5-30,7] | 21,1 [16,0-26,2] | <0,001 |
| Componentes escala HAS-BLED (% [IC 95%]) | ||||
| Hipertensión no controlada (PAS>160 mmHg) | 3,6 [2,4-4,7] | 3,3 [2,1-4,5] | 4,5 [1,9-7,1] | 0,384 |
| Insuficiencia renalb | 0,5 [0,0-0,9] | 0,6 [0,0-1,2] | 0,0 [0,0-0,0] | 0,211 |
| Insuficiencia hepáticac | 0,6 [0,1-1,0] | 0,8 [0,2-1,4] | 0,0 [0,0-0,0] | 0,170 |
| Historia previa de ictus | 20,3 [17,8-22,7] | 20,8 [17,9-23,6] | 18,7 [13,8-23,6] | 0,843 |
| Historia de sangrado, anemia o predisposición al sangrado | 10,0 [8,2-11,9] | 10,4 [8,3-12,5] | 8,9 [5,4-12,5] | 0,513 |
| Tiempo en rango terapéutico del INR <60% | 57,8 [54,8-60,8] | 63,7 [60,3-67,0] | 39,0 [32,9-45,1] | <0,001 |
| Edad> 65 años | 91,5 [89,9-93,2] | 93,4 [91,7-95,2] | 85,4 [81,0-89,8] | <0,001 |
| Medicamentos que afecten la hemostasiad | 13,3 [11,3-15,4] | 12,8 [10,5-15,1] | 15,0 [10,8-20,1] | 0,363 |
| Ingesta de ≥ 8 bebidas alcohólicas/semana | 4,2 [2,9-5,4] | 4,2 [2,8-5,6] | 4,1 [1,6-6,5] | 0,939 |
AIT: ataque isquémico transitorio; ICC: insuficiencia cardiaca congestiva; IC 95%: intervalo de confianza 95%; PAS: presión arterial sistólica.
Enfermedad vascular incluye infarto de miocardio previo, enfermedad arterial periférica, placa aórtica.
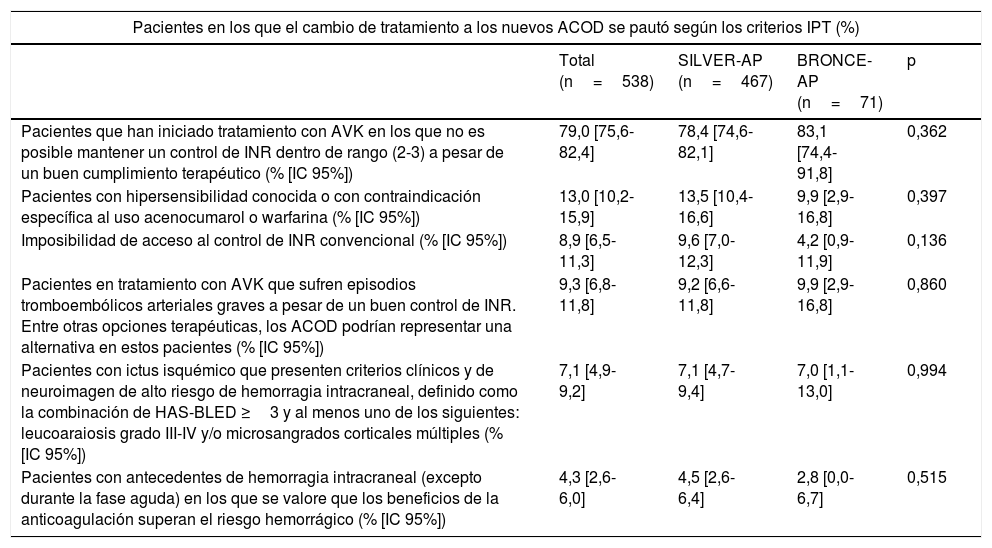
Con respecto al tratamiento anticoagulante previo al cambio a un ACOD, el 94,9% de los pacientes tomaba AVK antes del cambio al ACOD (95,9% en el estudio SILVER-AP vs. 91,5% en el estudio BRONCE-AP; p=0,005), con una duración media de tratamiento de 42,5±41,2meses (43,9±41,1 vs. 37,7±41,1, respectivamente; p=0,007). En el 72,2% de los pacientes el control de la anticoagulación previo al cambio de tratamiento a un ACOD se realizaba solo desde AP (78,1% vs. 53,3%, respectivamente; p<0,001), seguido de hematología (16,0% de los pacientes; 12,2% vs. 28,1%, respectivamente; p<0,001). Los motivos del cambio a ACOD según se siguiesen los criterios del IPT se resumen en la tabla 4. En el 59% de los casos de la muestra total el cambio de tratamiento se hizo siguiendo los criterios indicados en el IPT, siendo el motivo más frecuente del cambio el mal control de INR, independientemente de si se siguiesen los criterios del IPT. Cuando se siguieron los criterios del IPT no hubo diferencias significativas en cuanto al motivo del cambio a ACOD entre ambos estudios. En cambio, cuando no se siguieron los criterios del IPT, mientras que el motivo principal del cambio en el estudio SILVER-AP fue el mal control de INR, en el estudio BRONCE-AP fue la prescripción según la ficha técnica.
Motivos del cambio a ACOD según se siguiesen los criterios del IPT o noa
| Pacientes en los que el cambio de tratamiento a los nuevos ACOD se pautó según los criterios IPT (%) | ||||
|---|---|---|---|---|
| Total (n=538) | SILVER-AP (n=467) | BRONCE-AP (n=71) | p | |
| Pacientes que han iniciado tratamiento con AVK en los que no es posible mantener un control de INR dentro de rango (2-3) a pesar de un buen cumplimiento terapéutico (% [IC 95%]) | 79,0 [75,6-82,4] | 78,4 [74,6-82,1] | 83,1 [74,4-91,8] | 0,362 |
| Pacientes con hipersensibilidad conocida o con contraindicación específica al uso acenocumarol o warfarina (% [IC 95%]) | 13,0 [10,2-15,9] | 13,5 [10,4-16,6] | 9,9 [2,9-16,8] | 0,397 |
| Imposibilidad de acceso al control de INR convencional (% [IC 95%]) | 8,9 [6,5-11,3] | 9,6 [7,0-12,3] | 4,2 [0,9-11,9] | 0,136 |
| Pacientes en tratamiento con AVK que sufren episodios tromboembólicos arteriales graves a pesar de un buen control de INR. Entre otras opciones terapéuticas, los ACOD podrían representar una alternativa en estos pacientes (% [IC 95%]) | 9,3 [6,8-11,8] | 9,2 [6,6-11,8] | 9,9 [2,9-16,8] | 0,860 |
| Pacientes con ictus isquémico que presenten criterios clínicos y de neuroimagen de alto riesgo de hemorragia intracraneal, definido como la combinación de HAS-BLED ≥3 y al menos uno de los siguientes: leucoaraiosis grado III-IV y/o microsangrados corticales múltiples (% [IC 95%]) | 7,1 [4,9-9,2] | 7,1 [4,7-9,4] | 7,0 [1,1-13,0] | 0,994 |
| Pacientes con antecedentes de hemorragia intracraneal (excepto durante la fase aguda) en los que se valore que los beneficios de la anticoagulación superan el riesgo hemorrágico (% [IC 95%]) | 4,3 [2,6-6,0] | 4,5 [2,6-6,4] | 2,8 [0,0-6,7] | 0,515 |
| Pacientes en los que el cambio de tratamiento a los nuevos ACOD no se pautó según los criterios IPT (%) | ||||
|---|---|---|---|---|
| Total (n=374) | SILVER-AP (n=323) | BRONCE-AP (n=51) | P | |
| Paciente con INR no controlado durante el último año (% [IC 95%]) | 63,9 [59,0-68,8] | 71,8 [66,9-76,7] | 13,7 [4,3-23,2] | <0,001 |
| Prescrito según ficha técnica (% [IC 95%]) | 26,7 [22,3-31,2] | 19,8 [15,5-24,2] | 70,6 [58,1-83,1] | <0,001 |
| Paciente con hipersensibilidad conocida o con contraindicación específica al uso de acenocumarol o warfarina (% [IC 95%]) | 3,7 [1,8-5,7] | 3,7 [1,7-5,8] | 3,9 [0,0-9,3] | 0,943 |
| Paciente en tratamiento con AVK que sufre episodios tromboembólicos arteriales graves a pesar de un buen control del INR (% [IC 95%]) | 3,7 [1,8-5,7] | 3,1 [1,2-4,5] | 7,8 [0,5-15,2] | 0,097 |
| Reacciones adversas graves asociadas al tratamiento con AVK o interacción farmacológica relevante de difícil control a pesar del ajuste posológico en función del INR (% [IC 95%]) | 2,1 [0,7-3,6] | 2,5 [0,8-4,2] | 0,0 [0,0-0,0] | 0,256 |
| Paciente en tratamiento con AVK que ha presentado episodios hemorrágicos graves a pesar de un buen control del INR (% [IC 95%]) | 2,1 [0,7-3,6] | 2,2 [0,6-3,8] | 2,0 [0,0-5,8] | 0,925 |
| Paciente con riesgo elevado de hemorragia intracraneal (% [IC 95%]) | 1,6 [0,3-2,9] | 1,5 [0,2-2,9] | 2,0 [0,0-6,8] | 0,827 |
ACOD: anticoagulantes orales de acción directa; AVK: antagonistas de la vitaminaK; IC95%: intervalo de confianza del 95%; INR: internacional normalizad ratio; IPT: informe de posicionamiento terapéutico.
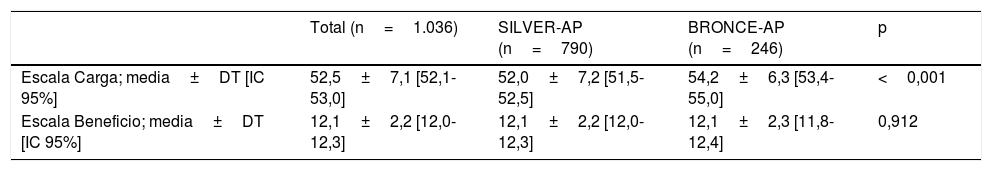
En cuanto al tratamiento con ACOD, la duración media del tratamiento fue de 15,8±12,4meses, sin diferencias significativas entre ambos estudios. El cumplimiento terapéutico fue elevado. El 91,9% de los pacientes afirmaron no tener dificultad para tomar todos los comprimidos, sin que se observaran diferencias estadísticamente significativas en función del estudio. Igualmente, la satisfacción con el tratamiento anticoagulante fue elevada, siendo mayor la satisfacción en el estudio BRONCE-AP que en el estudio SILVER-AP (tabla 5).
Puntuación del cuestionario ACTS
| Total (n=1.036) | SILVER-AP (n=790) | BRONCE-AP (n=246) | p | |
|---|---|---|---|---|
| Escala Carga; media±DT [IC 95%] | 52,5±7,1 [52,1-53,0] | 52,0±7,2 [51,5-52,5] | 54,2±6,3 [53,4-55,0] | <0,001 |
| Escala Beneficio; media±DT [IC 95%] | 12,1±2,2 [12,0-12,3] | 12,1±2,2 [12,0-12,3] | 12,1±2,3 [11,8-12,4] | 0,912 |
IC 95%: intervalo de confianza del 95%.
Para la comparación entre variables cuantitativas se empleó la t de Student.
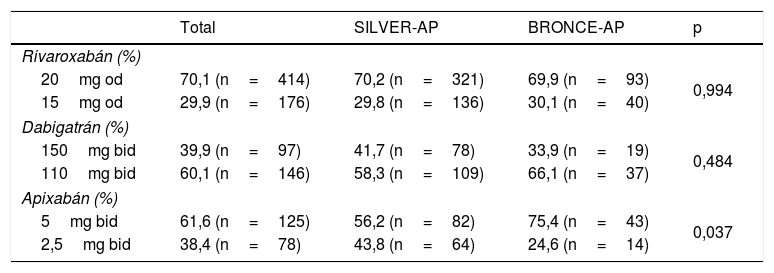
El ACOD más frecuentemente prescrito fue rivaroxabán (56,9%), seguido de dabigatrán (23,5%) y apixabán (19,6%), sin diferencias significativas entre los estudios. En cuanto a la posología, las dosis bajas de ACOD se emplearon en el 29,9% de los pacientes tratados con rivaroxabán, en el 38,4% de los pacientes tratados con apixabán y en el 60,1% de los pacientes tratados con dabigatrán (tabla 6).
Dosis empleadas en el tratamiento con anticoagulantes orales de acción directa (ACOD)
| Total | SILVER-AP | BRONCE-AP | p | |
|---|---|---|---|---|
| Rivaroxabán (%) | ||||
| 20mg od | 70,1 (n=414) | 70,2 (n=321) | 69,9 (n=93) | 0,994 |
| 15mg od | 29,9 (n=176) | 29,8 (n=136) | 30,1 (n=40) | |
| Dabigatrán (%) | ||||
| 150mg bid | 39,9 (n=97) | 41,7 (n=78) | 33,9 (n=19) | 0,484 |
| 110mg bid | 60,1 (n=146) | 58,3 (n=109) | 66,1 (n=37) | |
| Apixabán (%) | ||||
| 5mg bid | 61,6 (n=125) | 56,2 (n=82) | 75,4 (n=43) | 0,037 |
| 2,5mg bid | 38,4 (n=78) | 43,8 (n=64) | 24,6 (n=14) | |
bid: dos veces al día; od: una vez al día.
Los resultados principales de nuestro estudio muestran que los pacientes en los que el médico de AP puede prescribir ACOD tienen un peor perfil clínico, con un mayor riesgo tromboembólico y de hemorragias que aquellos casos en los que debe derivar al especialista. Asimismo, nuestro estudio mostró que el cumplimiento terapéutico con ACOD fue elevado, al igual que la satisfacción con el tratamiento. Finalmente, las dosis bajas de ACOD se emplearon frecuentemente, especialmente con dabigatrán.
A pesar de que en los últimos años se están publicando numerosos trabajos acerca de en qué pacientes se están prescribiendo ACOD y cómo se está realizando el manejo de los mismo en la práctica clínica en otros países27,28, la información disponible en España a este respecto es muy limitada15,18-20,29. En este sentido, la información aportada por nuestro trabajo es relevante. Asimismo, como hecho diferencial con respecto a otros estudios realizados en nuestro país, además del importante número de pacientes incluidos se encuentra el hecho de que se analizaron las diferencias en el perfil clínico y en el manejo en función de si el médico de AP era el que podía prescribir de inicio el ACOD, o debía derivar al paciente al especialista para que fuese este el que iniciase el tratamiento con ACOD. Es importante destacar el gran número de investigadores que participaron en el estudio, así como la gran experiencia clínica que tenían (tiempo trabajado, 24años).
Globalmente, los pacientes incluidos en nuestro estudio tenían una edad avanzada, un gran número de comorbilidades y un elevado riesgo tromboembólico. En el estudio FANTASIIA, que incluyó 296 pacientes en tratamiento con ACOD, la edad media fue de 73años, y también el número de comorbilidades fue elevado. El riesgo tromboembólico fue elevado, aunque algo menor que en nuestro estudio (el 71% tenía un CHA2DS2-VASc ≥2)18. En comparación con estudios realizados en España en pacientes tratados con AVK, el perfil clínico fue bastante similar. Así, en el estudio PAULA la edad media fue de 77años y más del 94% de los pacientes tenían un CHA2DS2-VASc ≥28.
Por otra parte, es importante conocer si existen diferencias en el perfil clínico de los pacientes de acuerdo a si el médico de AP podía prescribir directamente ACOD o tenía que derivar al especialista para que iniciara este tratamiento. Los pacientes en los que el médico de AP podía prescribir ACOD directamente (estudio SILVER-AP) tenían un mayor número de comorbilidades, así como un mayor riesgo tromboembólico y de hemorragias. Además, la polimedicación fue más frecuente en esta población. Es decir, los médicos de AP son capaces de manejar perfectamente los ACOD en pacientes complejos. En consecuencia, la complejidad del paciente no debería constituir una excusa para establecer la necesidad de que el médico de AP deba derivar a los pacientes al especialista para iniciar el tratamiento con ACOD.
La mayoría de los pacientes previamente anticoagulados en los que se inició el tratamiento con ACOD estaban tomando anteriormente AVK. En un reciente estudio que analizó la percepción que tienen los médicos sobre los factores que pueden influir a la hora de escoger entre los AVK y los ACOD en pacientes con FANV se objetivó que tener un riesgo tromboembólico o de sangrado aumentados, así como el fracaso previo en el tratamiento con dicumarínicos, se asociaron a una mayor predisposición al empleo de ACOD29. Todas estas características son fácilmente identificables por el médico de AP. Además, teniendo en cuenta que en España el control de la anticoagulación de los AVK se realiza principalmente en el ámbito de la AP y que el motivo principal del cambio es un pobre control de INR, situación que ocurre hasta en el 40% de los pacientes7-11, el médico de AP es el profesional mejor posicionado para poder identificar a los pacientes que más se van a beneficiar de la anticoagulación con ACOD.
Por otra parte, aproximadamente en el 40% de los casos de la muestra total de pacientes el cambio a ACOD no se realizó siguiendo los criterios indicados en el IPT. En parte esto se debe a que en algunos casos las prescripciones se pueden realizar desde el ámbito de la medicina privada. Sin embargo, parece más relevante para esta importante falta de seguimiento del IPT que las diferentes comunidades autónomas hayan establecido criterios propios a la hora de permitir la prescripción de ACOD, lo que sin duda conduce a que el acceso a estos fármacos sea diferente dependiendo de la comunidad autónoma30.
En nuestro estudio, la duración media del tratamiento con ACOD fue de prácticamente 16meses, lo que implica que la experiencia en el manejo de estos fármacos es ya importante. Según el test de Haynes-Sackett el cumplimiento fue muy elevado, incluso en los pacientes polimedicados. Esta elevada adherencia al tratamiento con ACOD, posiblemente mayor que con los AVK, ya había sido reportada en otros estudios31.
Por otra parte, la satisfacción con el tratamiento con ACOD fue globalmente muy elevada, quizás algo mayor en el estudio BRONCE-AP, probablemente porque eran pacientes con un mejor perfil clínico. En cualquier caso, los resultados de nuestro estudio confirman los reportados por otros autores en los que se objetiva un elevado grado de satisfacción con el tratamiento con ACOD, posiblemente mayor que con los AVK32.
A pesar de las ventajas evidentes que aportan los ACOD, nuestro trabajo refleja un dato preocupante, y es el elevado número de pacientes en los que se prescriben las dosis bajas de ACOD, hecho que ocurrió con los 3 ACOD, pero especialmente con dabigatrán en ambos estudios y con apixabán en el caso del SILVER-AP. Es posible que la mayor complejidad a la hora de ajustar la dosis con dabigatrán y apixabán en comparación con rivaroxabán pueda haber influido en estos resultados. Por otra parte, otros estudios han mostrado que en una proporción relativamente importante de pacientes se están prescribiendo las dosis bajas de ACOD, y que en muchos casos estas dosis no se corresponden con lo que debería por el perfil clínico de los pacientes33, lo que podría tener importantes implicaciones clínicas.
El presente trabajo tiene las limitaciones propias de un diseño transversal, como la falta de un grupo control y de una asignación aleatoria, lo que no permite controlar todos los posibles factores de confusión. Por otra parte, en el presente trabajo se comparan 2 muestras obtenidas de diferentes estudios, con un diferente perfil de investigadores (urbano vs. rural). Aunque es cierto que parte de las diferencias podrían deberse a un diferente método de selección de la muestra en ambos estudios, así como al diferente perfil de investigadores, hay que tener en cuenta que los diseños de ambos estudios fueron muy similares, y el amplio tamaño muestral, el que los pacientes fueron incluidos de manera consecutiva y la meticulosidad con que los datos fueron recogidos de alguna manera reducen estas limitaciones en gran medida. Además, este es el primer trabajo que compara específicamente el perfil clínico y el manejo de los pacientes tratados con ACOD de acuerdo a si el médico de AP podía prescribir directamente un ACOD o debía derivar al especialista para que este lo iniciara, lo que demuestra la relevancia de nuestros resultados. Por otra parte, hay que reconocer que es posible que los investigadores participantes en el presente estudio estuviesen especialmente sensibilizados con el manejo de la anticoagulación en pacientes con FA, y en particular con el uso de ACOD, lo que de alguna manera podría no representar a todos los médicos de AP y, en consecuencia, limitar de alguna manera la validez externa del estudio.
En conclusión, los pacientes tratados con ACOD en España tienen un elevado riesgo tromboembólico. Los pacientes en los que el médico de AP puede prescribir ACOD directamente tienen un peor perfil de riesgo, con un mayor riesgo tromboembólico y de hemorragias que aquellos pacientes en los que el médico de AP debe derivar al especialista para que inicie el tratamiento con ellos. El cumplimiento terapéutico con ACOD es elevado, así como la satisfacción con el tratamiento. Sin embargo, en un número significativo de pacientes se prescriben las dosis bajas de ACOD, lo que podría tener implicaciones clínicas.
Responsabilidades éticasProtección de personas y animales.Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos.Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado.Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesNuria Marín es empleada de Bayer Hispania.
Los demás autores declaran no tener ningún conflicto de intereses.
Content Ed Net (Madrid) proporcionó asistencia editorial en la preparación de este artículo.
| *Listado de investigadores |
| Alfonso Romero Furones (C.S. San Bernardo, Salamanca –Salamanca) |
| Ana Alayeto Sanchez (C.S. Mar Báltico, Madrid –Madrid) |
| Ana Isabel Perez Aragues (CAP Manso, Barcelona –Barcelona) |
| Andrés Martínez Gonzalez (C.S Serantes, Ferrol –La Coruña) |
| Angela Gutierrez Perez (C.S Calero, Las Palmas –Las Palmas) |
| Antonio Arroyo Pérez (C. S. Gregorio Marañón, Alcorcón –Madrid) |
| Antonio Calvo Guerrero (C.S Noia, La Coruña –La Coruña) |
| Antonio de Torres Lopez (C.S Potosi, Madrid –Madrid) |
| Antonio Jimenez Lopez (C.S. Tíjola, Tíjola -Almería) |
| Antonio Regueiro Martinez (C.S Vilanova de Arousa, Vilanova de Arousa –Pontevedra) |
| Arantxa Gonzalez Osuna (CAP Maragall, Barcelona –Barcelona) |
| Beatriz Alvarez Alvarez (C.S Andres Mellado, Madrid –Madrid) |
| Begoña Ruiz Aguirre (Amb.Markonzaga, Sestao –Bizkaia) |
| Carlos Casado Alvaro (C.S. General Ricardos, Madrid –Madrid) |
| Clara Ordas Miguelez (C.S. Benavides, Benavides –León) |
| Cristina Aguado Taberne (C.S. Santa Rosa, Córdoba –Córdoba) |
| Cristina Niño Azcarate (C.S Playa de los Cristianos, Arona -Tenerife) |
| Delia Mestres (CAP el Pla, Sant Feliu Llobregat –Barcelona) |
| Eduardo Hevia Rodriguez (CS Vallobín - Concinos, Oviedo –Asturias) |
| Elena López de la Fuente (C.S Villaamil, Madrid –Madrid) |
| Emilio Aberasturi Ramirez (C.S. Ntra Sra de Estibaliz, Vitoria -Álava) |
| Enrique Martín Riobó (C.S. Fuensanta, Córdoba –Córdoba) |
| Fco. Javier Cecilio Montero (C.S de Porriño, Porriño –Pontevedra) |
| Fernando Gallo Trevol (C.S. Joaquín Elizalde, Logroño -La Rioja) |
| Ferran Marco Cardona (CAP Adriá, Barcelona –Barcelona) |
| Gabriel Lliteras Fleixas (C.S. Lluc Major, Lluc Major - Mallorca –Islas Baleares) |
| Giusseppe Ruffo (CAP Banyoles, Banyoles –Girona) |
| Ignacio Brotons Garcia (C.S Legazpi, Madrid -Madrid) |
| Inmaculada C. Marin Cabrera (C.S. Alvarez de la Riva, Orihuela –Alicante) |
| Isabel Ortega Abarca (CAP Pubilla Cases, Esplugues de Llobregat –Barcelona) |
| Jaime Ruiz Perez (C.S Tanos, Tanos –Cantabria) |
| Javier Cejudo Palmero (C.S. San Fermin, Madrid –Madrid) |
| Javier Velasco (C.S Las Rozas Abajon, Las Rozas –Madrid) |
| Jesús de Juan Prego (C.S Fontela Maristany, Ferrol –La Coruña) |
| Joan Lluis Frigola Marcet (CAP San Pere, Reus –Tarragona) |
| Jorge Abraldes Dopazo (C.S. Landako, Durango –Bizkaia) |
| José Antonio Quindimil (C.S. Kueto, Sestao –Bizkaia) |
| José Manuel Soto Gonzalez (C.S. De Pintor Colmeiro, Vigo –Pontevedra) |
| José María Fernández Villaverde (C.S Ribeira, Ribeira –La Coruña) |
| Jose Porta Quintana (C.S. Muñoz Fernandez Ruiseñores, Zaragoza) |
| Jose Ramón Domínguez Alonso (C.S. San José Norte, Zaragoza –Zaragoza) |
| Juan José Muñoz Gavilán (C.S. Levante Norte, Córdoba –Córdoba) |
| Judith Calpe (CAP Terrassa Oest, Terrassa –Barcelona) |
| Julio Vallina Blanco (C.S Llano Ponte, Avilés –Asturias) |
| Lidia Gonzalez Gil (CAP Rambla, Terrassa –Barcelona) |
| Lucas Mengual Martínez (ABS Badia Vallés, Badia del Vallès –Barcelona) |
| Luis Prieto Albino (C.S Nuevo Cáceres, Cáceres –Cáceres) |
| Luis Segovia Castro (C.S. Casa Do Mar Marin, Marin –Pontevedra) |
| Luis Serrano Mallagray (C.S. Cascante, Cascante –Navarra) |
| Luis Torres Buisan (CS Yunquera de Henares, Yunquera de Henares –Guadalajara) |
| Manuel Barral Castro (C.S Casa del Mar, La Coruña –La Coruña) |
| Manuel Pedro Ayechu Redín (C.S. de Puente la Reina, Puente de la Reina –Navarra) |
| Margarita Beatriz Reboredo Otero (C.S. La Cañiza, La Cañiza – Pontevedra) |
| Margarita Maortua Maortua (Amb. Dr. Areilza, Bilbao –Vizcaya) |
| Maria Antonia Sanchez Calavera (C.S. Canal Imperial, Zaragoza –Zaragoza) |
| Maria del Mar Díez Ponce (C.S. Calle Cuba, Vigo –Pontevedra) |
| Maria Isabel Lopez Abietar (C.S. Casas Ibañez, Casas-Ibáñez –Albacete) |
| Maria Victoria Vilar Linares (C.S. Torre del Mar, Torre del Mar –Málaga) |
| Mariano de la Figuera (CAP Sardenya, Barcelona –Barcelona) |
| Mariano Leal Hernandez (C.S. San Andres, Murcia –Murcia) |
| Marta Guzón Centeno (C.S. Goya, Madrid –Madrid) |
| Marta D’Lacoste Farre (CAP San Ildefons, Cornellà de Llobregat –Barcelona) |
| Martín San Millán Honrado (C.S San Andres del Rabanedo, San Andrés del Rabanedo –León) |
| Mercedes Lasa Garmendia (Amb. Amara Berri, Donostia – Guipúzcoa) |
| Muti Mahmoud-Ibrahim (C.S. La Almunia, La Almunia de Doña Godina –Zaragoza) |
| Olga Garcia Vallejos (CS Comillas, Madrid –Madrid) |
| Pablo Gutiérrez Muñoz (C.S. Montejícar, Montejícar –Granada) |
| Pedro Cañones (C.S. Isla de Oza, Madrid –Madrid) |
| Rafael Luquín Martínez (C.S. Virgen de la Caridad, Cartagena –Murcia) |
| Rodrigo Córdoba García (CAP. Dromda_Delicias Sur, Zaragoza _Zaragoza) |
| Rodrigo Mayo Cabeza (C.S. Fuengirola – Oeste, Fuengirola –Málaga) |
| Roque Lucas Sánchez (CAP Palau de Plegamans, Palau-Solità i Plegamans –Barcelona) |
| Rosario Alustiza Vergara (Ambulatorio de Bergara, Vergara –Guipúzcoa) |
| Sergio Cinza (C S. Porto do Son, Porto do Son –La Coruña) |
| Silvia Medrano Sanz (C.S. Garcia Noblejas, Madrid –Madrid) |
| Susana Daviña Romero (C.S. Chapela, Chapela –Pontevedra) |
| Tomas Hernandez Corral (C.S San Juan, Salamanca –Salamanca) |