El dolor crónico no oncológico y el mal uso de los opioides prescritos son dos realidades muy prevalentes. La prescripción de opioides para el dolor crónico se ha incrementado notablemente en las últimas décadas1. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) publicó en marzo del 2019 un informe sobre la utilización de opioides en España durante el periodo 2010-2017. Según se extrae del mismo, el consumo global se ha incrementado casi el doble en estos siete años, pasando de una dosis diaria definida por cada 1.000 habitantes (DHD) de 9,9 en 2010, a 17,7 en 2017, lo que supone un crecimiento del 78%2.
Sin embargo, las dudas sobre la seguridad a largo plazo de los opioides dificultan la toma de decisiones clínicas3. Existen médicos preocupados por posibles problemas de adicción en sus pacientes y son reacios a prescribir estos fármacos, contribuyendo con ello a un tratamiento insuficiente del dolor crónico4. Esta situación ha hecho que múltiples sociedades científicas elaboren guías sobre el uso racional de opioides5,6.
El término opioide describe una amplia clase de fármacos que están disponibles en diversas formas farmacéuticas y se utilizan para el control del dolor. Los opioides convencionales o típicos (como morfina, codeína, hidromorfona, fentanilo y oxicodona) comparten varias características, entre las cuales está su eficacia como analgésicos, pero están asociados con determinados efectos secundarios bien conocidos y existe la posibilidad de que se usen de forma indebida o se abuse de ellos. En la búsqueda del analgésico ideal se han tratado de encontrar maneras de diseñar fármacos que sean igual de eficaces a la hora de controlar el dolor pero que sean más seguros7.
Los opioides típicos actúan como agonistas en los receptores opioides μ (MOR, Mu Opioid Receptor) y a veces tienen actividad sobre los receptores δ y κ. Los fármacos de acción central más recientes que se han introducido en el mercado o están en desarrollo, junto con otros «viejos conocidos»; activan los MOR, pero exhiben características que no son típicas de los opioides convencionales. Hasta la fecha, se han desarrollado cinco analgésicos de este tipo (en orden alfabético): buprenorfina, cebranopadol, metadona, tapentadol y tramadol. Estos compuestos se basan en mecanismos de acción únicos y sinérgicos8,9. Por tanto, no funcionan como los opioides típicos, aunque a menudo se clasifican sencillamente como «opioides». Por supuesto, esa clasificación es cierta en parte, ya que sí tienen efectos opioides, pero considerarlos opioides típicos puede inducir a error porque poseen muchas propiedades distintas. Por este motivo, estos cinco fármacos a veces se denominan «opioides atípicos», puesto que tienen propiedades características de los opioides, pero también son distintos de los opioides convencionales en aspectos clínicamente importantes7.
La determinación de si un fármaco debiera clasificarse como opioide se basa en su afinidad por los receptores opioides medida in vitro (o ex vivo) y en su producción de efectos similares a los de la morfina determinados in vivo. El tramadol, por ejemplo, tiene una afinidad relativamente baja por los receptores opioides, más de 400 veces menor que la de la morfina por los MOR10. Las propiedades clínicas del tramadol son el resultado combinado de los diversos mecanismos de acción del fármaco11. Por consiguiente, aunque el término «opioide atípico» desde luego es preciso, no es el ideal, ya que es posible que el aspecto «atípico» de tales fármacos pierda importancia y se les considere primordialmente opioides que quizás tengan algunas características inusuales. Sería igual de lógico, por ejemplo, denominar al tramadol y al tapentadol «inhibidores atípicos de la recaptación de las monoaminas», y sería igual de poco útil.
Los cinco fármacos anteriormente mencionados difieren de manera sustancial de los opioides convencionales. Cada uno se ha descrito en la literatura como «único» y como un posible nuevo fármaco «primero de su clase». Cuentan con distintos perfiles de efectos secundarios, distintos mecanismos de acción y propiedades específicas que los distinguen tanto entre sí como respecto a los opioides típicos (tabla 1). La falta de precisión que supone agruparlos con los opioides, por tanto, surge de que las características de clase asociadas con los opioides quizás no sean aplicables, o incluso induzcan a error, a la hora de describir estos fármacos. Hay autores que proponen utilizar el término «multigésico» para describir estos opioides atípicos12. El término «multigésico» hace referencia a sus múltiples mecanismos de acción analgésica, siendo una descripción mucho más acertada de estos fármacos que no tienen propiedades idénticas a los de los opioides típicos.
Mecanismos de acción de los opioides atípicos
| Opioide atípico | Mecanismos de acción |
|---|---|
| Tramadol | Agonista receptores μ: metabolito principal activo: O-desmetiltramadol (M1)Inhibición de recaptación de NAInhibición de recaptación de 5HT |
| Buprenorfina | Agonista parcial receptores μAntagonista receptores κ (KOR)Agonista receptores N/OFQ |
| Metadona | Agonista receptores μAntagonista receptores NMDA |
| Tapentadol | Agonista receptores μInhibición de recaptación de NA |
| Cebranopadol (en desarrollo clínico) | Agonista receptores μ y N/OFQ |
NA: noradrenalina; 5HT: serotonina; N/OFQ: nociceptin/orphanin FQ; NMDA: N-metil-D-aspartato.
Al reducir la cantidad de opioides que se administra al paciente sin sacrificar el beneficio analgésico el paciente consume menos opioides, lo cual podría suponer, al menos en teoría, un número o una intensidad menores de acontecimientos adversos y una posibilidad menor de abuso o adicción7. A fin de reflejar esto con precisión, se propone el término «multigésico» para describir los analgésicos que tienen mecanismos de acción duales o múltiples. Creemos que esto representa una valoración más realista de cómo funcionan, ayuda a distinguirlos de los opioides típicos y también podría generar una mayor atención sobre un camino importante en el desarrollo de mejores fármacos analgésicos.
Por supuesto, la labor de hallar el analgésico ideal continúa. En la actualidad no hay un fármaco analgésico ideal que proporcione un alivio eficaz del dolor con poco riesgo para los pacientes. Los médicos debemos trabajar con nuestros pacientes para encontrar las mejores soluciones individuales para el dolor, lo cual en sí mismo puede ser una dinámica de altibajos debido a la enfermedad subyacente, las experiencias vitales, el estrés, el avance de la edad, las comorbilidades, etcétera. Los posibles efectos secundarios problemáticos y la posibilidad de uso indebido y abuso han atenuado el entusiasmo por el uso de los opioides típicos. Pese a los esfuerzos de desarrollo farmacológico por crear mejores analgésicos, los médicos aún nos enfrentamos con la tarea de conciliar la seguridad y la eficacia en el caso individual de cada paciente. Agrupar los opioides típicos, de mayor trayectoria, junto con productos más nuevos puede llevar a los médicos a pensar que esos fármacos exhiben todas las características de la morfina y los opioides convencionales, lo cual no es el caso. Por otro lado, no se quiere dar una falsa sensación de seguridad de que no poseen propiedades opioides, especialmente en el marco del uso indebido. Con todo, hay importantes distinciones clínicas. Por estos motivos, postulamos que el término «multigésico» describe mejor y con más precisión a los analgésicos que presentan mecanismos de acción opioides y no opioides.
Por otra parte, para un correcto abordaje del dolor, es evidente la necesidad de conocer en detalle su etiopatogenia, más allá de su intensidad. Distintos mecanismos pueden provocar dolores de intensidad semejante, pero se hace imprescindible buscar tratamientos dirigidos a bloquear esos mecanismos precisos. De ahí que el uso de fármacos con múltiples mecanismos de acción, actuando sobre distintas dianas, a distintos niveles (medular, fig. 1, o supraespinal, fig. 2) sea fundamental para tratar eficazmente el dolor crónico, generalmente de tipo mixto, con componentes nociceptivos y neuropáticos, centrales y periféricos13,14.
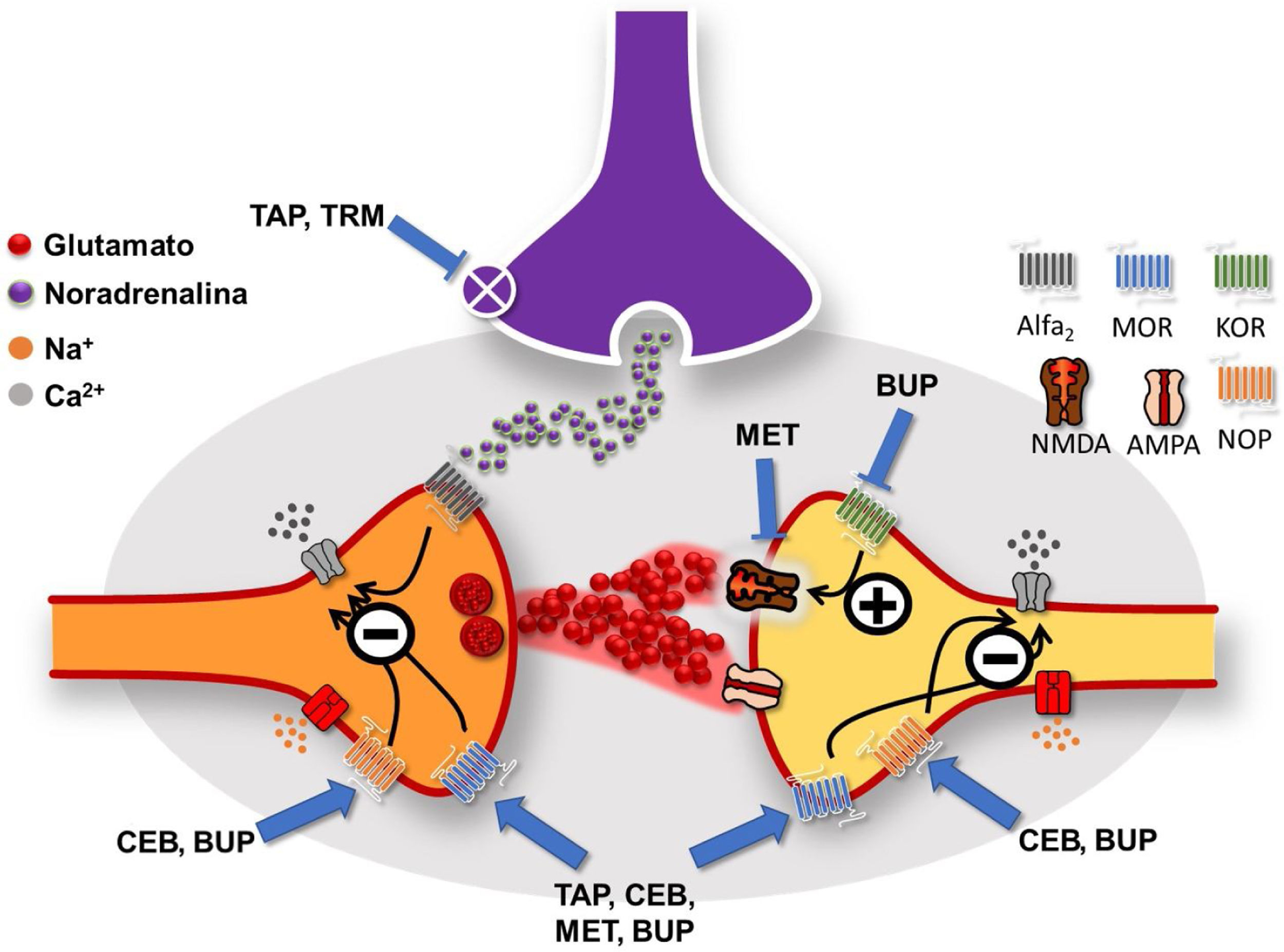
Mecanismos de acción de los opioides atípicos a nivel de la médula espinal (imagen cortesía de Carlos Goicoechea García).La transmisión de la señal que proviene de la periferia se produce por la liberación de glutamato que se une a receptores selectivos AMPA y NMDA. Tapentadol (TAP), Cebranopadol (CEB), Metadona (MET) y Buprenorfina (BUP) actúan como agonistas en receptores opioides MOR pre y postsinápticos. Su acción provoca el bloqueo de los canales de calcio y la hiperpolarización neuronal, disminuyendo la transmisión de la señal nociceptiva. CEB y BUP son igualmente agonistas de receptores NOP (mismo mecanismo inhibidor de canales de calcio). BUP es antagonista del receptor KOR (la activación de KOR estimula el receptor NMDA, implicado en la Sensibilización Central (SC)). MET es antagonista del receptor NMDA por lo que puede contribuir a disminuir la SC. TAP y Tramadol (TRM) actúan inhibiendo el sistema de recaptación de noradrenalina (NA) de la vía inhibidora descendente que se genera en el locus coeruleus (en morado), lo que aumenta la concentración de NA y su acción sobre el receptor inhibidor Alfa2, que también bloquea el canal de calcio. MOR= Mu Opioid Receptor;KOR= Kappa Opioid Receptor;NOP= Nociceptin/orphanin FQ Opioid Peptide Receptor;NMDA=Receptor del ácido N-metil-D-aspartato.
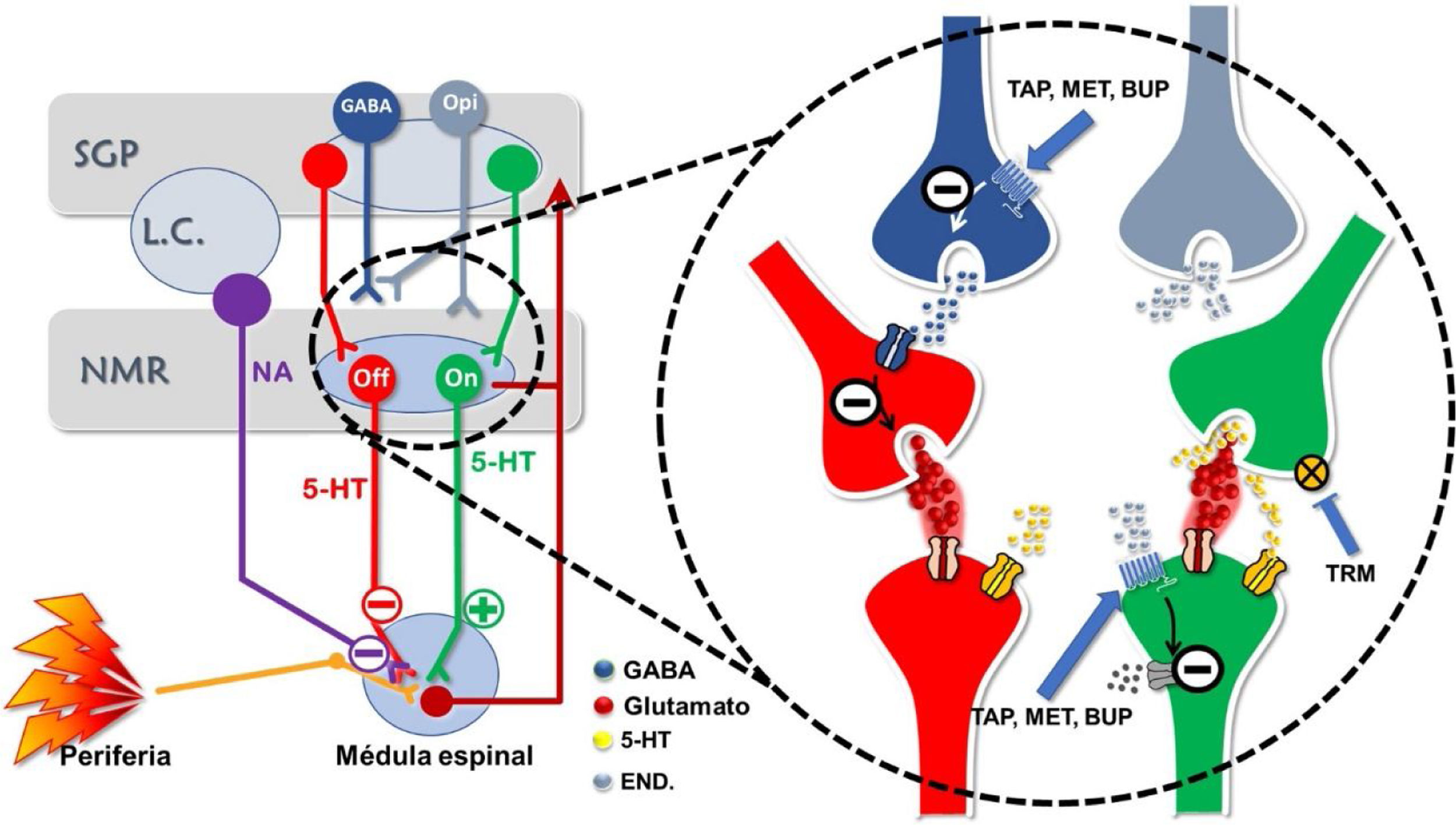
Mecanismos de acción de los opioides atípicos a nivel de las vías moduladoras descendentes (imagen cortesía de Carlos Goicoechea García).
Desde los centros superiores del SNC se ponen en marcha mecanismos descendentes que modulan la trasmisión a nivel de la médula espinal. La vía OFF es una vía inhibidora, la vía ON es activadora. La vía OFF está generalmente inhibida, ya que el GABA impide la liberación de glutamato. Tapentadol (TAP), Metadona (MET) y Buprenorfina (BUP), a través del receptor MOR, impiden la liberación de GABA y, de forma indirecta, potencian la vía OFF. Además, TAP, MET y BUP bloquean directamente la vía ON al estimular el receptor MOR. La serotonina (5-HT) puede estimular tanto la vía OFF como la vía ON, aun cuando inhibir la recaptación de 5-HT, como hace el Tramadol (TRM), tiene un efecto predominante sobre la vía OFF. Opi= Neurona liberadora de opioides endógenos; NA= Noradrenalina; END.= Endorfinas; SGP= Sustancia Gris Periaqueductal; NMR= Núcleo Magno del Rafe; L.C: = Locus Coeruleus.
En conclusión, tanto los opioides típicos como los opioides atípicos son componentes importantes en el arsenal terapéutico contra el dolor. Acuñamos el término «multigésico» para cubrir la necesidad de contar con un término nuevo que describa los analgésicos que no pertenecen completamente en el campo de los opioides típicos y que tienen dos (o más) mecanismos de acción. En este momento solo hay cinco fármacos analgésicos (buprenorfina, cebranopadol, metadona, tapentadol y tramadol) que cumplen claramente estos criterios. Sin embargo, apuntan hacia una forma probada de diseñar analgésicos más seguros que se centra igualmente sobre las vías de los receptores opioides μ endógenos.
Conflicto de interesesHemos tenido en cuenta las instrucciones, las responsabilidades éticas, cumplimos los requisitos de autoría y declaramos la no existencia de conflicto de intereses.