La dislipidemia es uno de los principales factores de riesgo de cardiopatía isquémica, primera causa de mortalidad en el mundo. Realizar una detección temprana y una intervención terapéutica precoz son elementos clave a la hora de establecer una adecuada prevención de una enfermedad cardiovascular. Debemos conocer el arsenal terapéutico de que disponemos para su adecuada utilización en cada una de las situaciones clínicas que puedan presentar nuestros pacientes. En los últimos 3 años, la proliferación de múltiples guías para el manejo clínico del paciente dislipidémico con aparentes mensajes contradictorios en relación con la consecución de los objetivos de control llegan a confundir a los médicos. En esta revisión se pretende ofrecer una visión actualizada de la situación de la dislipidemia, partiendo del posicionamiento de las guías tanto europeas como americanas, pasando por diferentes situaciones de riesgo y finalizando con el concepto de dislipidemia aterogénica, reconocido factor de riesgo cardiovascular.
Dyslipidaemia is one of the major risk factors for ischaemic heart disease, the leading cause of death worldwide. Early detection and therapeutic intervention are key elements in the adequate prevention of cardiovascular disease. It is essential to have knowledge of the therapeutic arsenal available for their appropriate use in each of the clinical situations that might be presented in our patients. In the past 3 years, there has been a proliferation of multiple guidelines for the clinical management of patients with dyslipidaemia, with apparent contradictory messages regarding the achievement of the control objectives, which are confusing clinicians. This review aims to provide an updated overview of the situation as regards dyslipidaemia, based on the positioning of both European and American guidelines, through different risk situations and ending with the concept of atherogenic dyslipidaemia as a recognized cardiovascular risk factor.
La dislipidemia es uno de los principales factores de riesgo para la cardiopatía isquémica, primera causa de mortalidad en el mundo. Realizar una detección temprana y una intervención terapéutica precoz son elementos clave a la hora de realizar una adecuada prevención de una enfermedad cardiovascular (ECV). A pesar de las numerosas evidencias sobre su manejo clínico, la tasa de pacientes que consiguen un buen control de sus niveles de lípidos, sobre todo en los pacientes de alto y muy alto riesgo cardiovascular (RCV), es muy baja. En el momento actual se sigue cuestionando cuál puede ser la razón, y si bien el problema del cumplimiento terapéutico está implicado en muchos de nuestros pacientes, la actitud de los profesionales sanitarios (inercia clínica) es un problema que contribuye al inadecuado control de los factores de RCV. En este sentido, un estudio reciente realizado en el ámbito asistencial de la Comunidad Valenciana con el registro electrónico de las historias clínicas demuestra el elevado grado de inercia terapéutica en el tratamiento de las dislipidemias1. Por otro lado, la proliferación de múltiples guías de manejo clínico del paciente dislipidémico, que, en ocasiones, pueden dar mensajes aparentemente contradictorios en relación con la consecución de objetivos, llegan a confundir a los médicos; y todo ello pese a que en la actualidad disponemos de un arsenal terapéutico para el tratamiento de las alteraciones lipídicas.
En esta revisión se pretende ofrecer una visión actualizada de la situación de la dislipidemia partiendo del posicionamiento de las guías, pasando por diferentes situaciones de riesgo, y finalizando con el concepto de la dislipidemia aterogénica, reconocido factor de RCV y, sin embargo, en la práctica clínica frecuentemente subestimado y, en consecuencia, infratratado e infracontrolado.
1Guías actuales para la prevención cardiovascularDada la implicación multifactorial de todos los factores de riesgo es razonable que las guías de práctica clínica sobre prevención cardiovascular se hayan desarrollado con la colaboración de múltiples sociedades científicas y desde diferentes ámbitos de la medicina, contribuyendo, sin duda, a la orientación pluridisciplinar de estas y a que los consensos finalmente acuerden estrategias unificadas de actuación, capaces de conseguir el mayor y mejor impacto en la población. En las últimas guías europeas para la prevención cardiovascular2, que incorporan el documento sobre el manejo del colesterol consensuado por las sociedades europeas de cardiología y arteriosclerosis3, se acuerdan diferentes niveles de RCV total:
A. Riesgo muy alto. Personas con alguna de las siguientes situaciones:
- -
ECV documentada por pruebas invasivas o no invasivas (coronariografía, resonancia magnética, ecocardiografía de estrés, placa carotídea por ultrasonidos), infarto de miocardio (IM), síndrome coronario agudo, revascularización coronaria –intervención coronaria percutánea o cirugía de revascularización aortocoronaria– u otros procedimientos de revascularización arterial, accidente isquémico, enfermedad arterial periférica.
- -
Pacientes con diabetes mellitus tipo 2 y algún otro factor de RCV, pacientes con diabetes mellitus tipo 1 y lesión de órganos diana (como microalbuminuria).
- -
Pacientes con enfermedad renal crónica (ERC) grave (índice de filtrado glomerular [GFR]<30ml/min/1,73m2).
- -
Un riesgo según la Systematic Coronary Risk Evaluation (SCORE) calculado a 10 años≥10%.
B. Riesgo alto. Personas con alguna de las siguientes situaciones:
- -
Factores individuales de riesgo muy elevados, como dislipidemia familiar e hipertensión arterial grave.
- -
Pacientes con diabetes mellitus tipo 2 sin otro factor de RCV.
- -
Pacientes con ERC moderada (GFR 30-60ml/min/1,73m2).
- -
Un riesgo SCORE≥5% y<10% a los 10 años.
C. Riesgo moderado. Se considera que un sujeto tiene un riesgo moderado cuando su riesgo SCORE es≥1% y<5% a los 10 años.
D. Bajo riesgo. La categoría de bajo riesgo se aplica a individuos con un riesgo SCORE<1%.
Los objetivos de control del c-LDL, según las Guías Europeas 2012, son:
- -
Para los pacientes con RCV muy alto, el objetivo de tratamiento para el c-LDL es<70mg/dl) (<1,8mmol/l) o una reducción≥50% de los títulos basales de c-LDL (Recomendación I, Nivel A).
- -
Para personas con riesgo alto debe considerarse un valor de c-LDL<100mg/dl (<2,5mmol/l) (Recomendación IIa, Nivel A).
- -
Para los pacientes con riesgo moderado se considerará como objetivo de tratamiento un valor<115mg/dl (<3mmol/l) de c-LDL (Recomendación IIa, Nivel C).
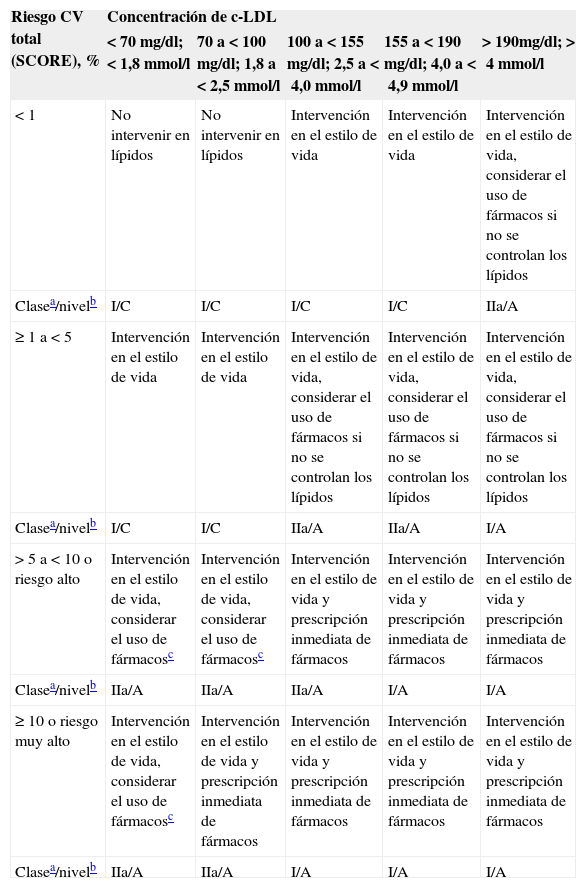
Las estrategias de intervención en función del RCV total y las concentraciones de c-LDL vienen reflejadas en la tabla 1.
Estrategias de intervención en función del riesgo cardiovascular total y las concentraciones de colesterol unido a lipoproteínas de baja densidad
| Riesgo CV total (SCORE), % | Concentración de c-LDL | ||||
|---|---|---|---|---|---|
| <70mg/dl; <1,8mmol/l | 70 a <100mg/dl; 1,8 a <2,5mmol/l | 100 a <155mg/dl; 2,5 a <4,0mmol/l | 155 a <190mg/dl; 4,0 a <4,9mmol/l | >190mg/dl; >4mmol/l | |
| <1 | No intervenir en lípidos | No intervenir en lípidos | Intervención en el estilo de vida | Intervención en el estilo de vida | Intervención en el estilo de vida, considerar el uso de fármacos si no se controlan los lípidos |
| Clasea/nivelb | I/C | I/C | I/C | I/C | IIa/A |
| ≥1 a <5 | Intervención en el estilo de vida | Intervención en el estilo de vida | Intervención en el estilo de vida, considerar el uso de fármacos si no se controlan los lípidos | Intervención en el estilo de vida, considerar el uso de fármacos si no se controlan los lípidos | Intervención en el estilo de vida, considerar el uso de fármacos si no se controlan los lípidos |
| Clasea/nivelb | I/C | I/C | IIa/A | IIa/A | I/A |
| >5 a <10 o riesgo alto | Intervención en el estilo de vida, considerar el uso de fármacosc | Intervención en el estilo de vida, considerar el uso de fármacosc | Intervención en el estilo de vida y prescripción inmediata de fármacos | Intervención en el estilo de vida y prescripción inmediata de fármacos | Intervención en el estilo de vida y prescripción inmediata de fármacos |
| Clasea/nivelb | IIa/A | IIa/A | IIa/A | I/A | I/A |
| ≥10 o riesgo muy alto | Intervención en el estilo de vida, considerar el uso de fármacosc | Intervención en el estilo de vida y prescripción inmediata de fármacos | Intervención en el estilo de vida y prescripción inmediata de fármacos | Intervención en el estilo de vida y prescripción inmediata de fármacos | Intervención en el estilo de vida y prescripción inmediata de fármacos |
| Clasea/nivelb | IIa/A | IIa/A | I/A | I/A | I/A |
c-LDL: colesterol unido a lipoproteínas de baja densidad; CV: cardiovascular.
Modificada de Reiner et al.3
Una cuestión importante que queda por contestar es cuál debe ser el objetivo óptimo de c-LDL para la población de bajo riesgo. Hacen falta estudios de grandes poblacionales para que se pueda dar respuesta a esta cuestión.
La Guía 2013 de ACC/AHA4, aunque no marca un objetivo de control para el c-LDL, establece 4 categorías de RCV que se pueden beneficiar del tratamiento con estatinas:
- -
Pacientes con antecedentes de enfermedad vascular arteriosclerótica.
- -
Pacientes con colesterolemia superior a 189mg/dl.
- -
Diabéticos tipo 1 o tipo 2 con edad entre 40 y 75 años.
- -
Pacientes en prevención primaria de alto RCV.
Esta guía, coincidiendo con la Guía Europea ESC/EAS, recomienda la utilización de estatinas como rosuvastatina 20mg/día o atorvastatina 80mg/día (capaces de lograr una reducción≥50% de los títulos basales de c-LDL) para la prevención cardiovascular de los pacientes de muy alto RCV, si bien la Guía de ACC/AHA propugna que no es preciso realizar controles para conseguir un objetivo específico del c-LDL, más allá de evaluar el adecuado cumplimiento y los posibles efectos secundarios inherentes al tratamiento con estatinas. Así pues, según esta Guía el tratamiento resulta más sencillo ya que requiere menos supervisión de los niveles de lípidos. Este documento representa un cambio importante en el enfoque y la gestión del tratamiento de la hipercolesterolemia, lo que ha suscitado gran controversia. En relación con este aspecto, hay que manifestar que se distancia enormemente de lo propugnado en el ATP III, y lo que se ha denominado como un cambio de paradigma por los autores no coge para nada a contrapié a las guías europeas elaboradas con gran rigor metodológico y basadas en la mejor evidencia.
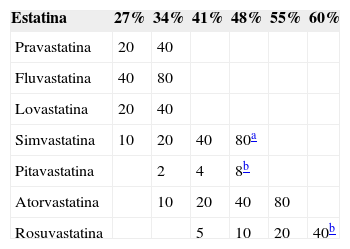
2Pacientes con antecedentes de enfermedad vascular arterioscleróticaLas evidencias que sustentan el beneficio del tratamiento con estatinas para la reducción de la morbimortalidad cardiovascular son múltiples. En el metaanálisis CTT sobre datos individuales de más de 170.000 pacientes participantes en 26 ensayos clínicos aleatorizados5 se comunicó una reducción proporcional del 10% en la mortalidad por cualquier causa, una reducción proporcional del 20% en la mortalidad cardiovascular por cada reducción de 1,0mmol/l (40mg/dl) del c-LDL. El riesgo de episodios coronarios graves se redujo en un 23%, y el riesgo de accidente cerebrovascular en un 17% por cada reducción de 1,0mmol/l (40mg/dl) de c-LDL. Estos resultados indican que el beneficio clínico es independiente del tipo de estatina, pero depende del grado de reducción del c-LDL; por lo tanto, la elección de la estatina debe reflejar el grado de reducción del c-LDL que se requiere para alcanzar la concentración deseada para determinado paciente (tabla 2).
Porcentajes de descenso de lipoproteínas de baja densidad con las diferentes estatinas y dosis
| Estatina | 27% | 34% | 41% | 48% | 55% | 60% |
|---|---|---|---|---|---|---|
| Pravastatina | 20 | 40 | ||||
| Fluvastatina | 40 | 80 | ||||
| Lovastatina | 20 | 40 | ||||
| Simvastatina | 10 | 20 | 40 | 80a | ||
| Pitavastatina | 2 | 4 | 8b | |||
| Atorvastatina | 10 | 20 | 40 | 80 | ||
| Rosuvastatina | 5 | 10 | 20 | 40b |
Una reciente revisión crítica6 de la Guía de ACC/AHA, aunque aplaude el enfoque de utilizar únicamente los datos de ensayos clínicos controlados aleatorizados, aconseja cautela en el estricto seguimiento de las nuevas directrices, y en su lugar insta a los médicos a considerar un «híbrido» de las guías anteriores (con objetivos específicos de c-LDL) y de las nuevas (con énfasis en la evaluación global del RCV y el tratamiento con estatinas de alta intensidad), sin olvidar en la elección del tratamiento «la importancia del juicio clínico, sopesando los beneficios potenciales, los efectos adversos, las interacciones farmacológicas y las preferencias del paciente».
A pesar de que los ensayos clínicos no fueron diseñados para mostrar las diferencias basadas en un nivel objetivo de c-LDL, existe una relación clara entre un menor número de eventos y concentraciones de c-LDL más bajas, tanto para la prevención primaria como para la secundaria de episodios cardiovasculares. Además de los ensayos clínicos con estatinas, otros proporcionan evidencia de que la reducción de c-LDL disminuye el RCV, como ha demostrado el estudio POSCH7 con un método no farmacológico en la reducción de c-LDL (se empleó el baipás ileal), el estudio SHARP8, con la utilización de ezetimiba y simvastatina, y el Coronary Drug Project9, ensayo en el que se empleó niacina.
Otro ensayo clínico, el TNT10, compara 2 estrategias hipolipidemiantes con la utilización de atorvastatina a dosis diferentes (80mg versus 10mg) en pacientes con cardiopatía isquémica estable, y encuentra que el tratamiento con 80mg/día de atorvastatina reduce la incidencia de complicaciones cardiovasculares mayores, concretamente la tasa de IM y de ictus fatal y no fatal, en comparación con la administración de 10mg/día de atorvastatina, que logró una menor reducción de la colesterolemia. En este mismo estudio, aunque no constituía un objetivo del ensayo, con el mismo tratamiento farmacológico, el quintil de mayor reducción del c-LDL presentaba menor número de complicaciones cardiovasculares. Un reciente estudio11 demuestra que el tratamiento intensivo con estatinas para conseguir una mayor reducción de c-LDL, en relación con la terapia estándar, produce una mayor remisión de la ateromatosis aórtica.
Debemos considerar que existe una diferencia interindividual en la respuesta hipolipidemiante a las estatinas, y conviene tener presente el posible incremento de efectos secundarios con la coadministración de las estatinas metabolizadas por el citocromo P450 3A4 (atorvastatina, lovastatina y simvastatina) con otros fármacos que utilizan la misma vía metabólica. Al respecto, la FDA publica recomendaciones en relación con la administración conjunta de fármacos con simvastatina12, y limita su uso a 20mg/día en la coadministración con amlodipino, y a 10mg/día con verapamilo, amiodarona o diltiazem.
El estudio SEARCH comparó la eficacia y seguridad de simvastatina 80mg/día frente a 20mg/día en pacientes con antecedentes de IM, y sus resultados en cuanto a la aparición de miopatía y rabdomiolisis13 han llevado a desaconsejar la utilización de simvastatina a una dosis de 80mg/día.
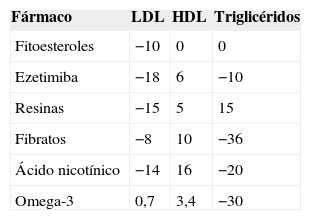
Si con la estatina administrada a las dosis máximas toleradas no se consigue el objetivo propuesto de c-LDL, en las últimas guías europeas se recomienda la administración de una combinación de fármacos2 (tabla 3). Ezetimiba logra una reducción de un 18% aditiva a la conseguida con estatinas. Los secuestradores de ácidos biliares (resinas) suelen tener peor tolerancia, y en el caso de una dislipidemia mixta no están indicados, ya que pueden incrementar la trigliceridemia. Un metaanálisis reciente14 concluye que la combinación de una estatina de menor capacidad hipocolesterolemiante con secuestradores de ácidos biliares o ezetimiba puede ser una alternativa a la monoterapia con estatinas de mayor potencia, entre los pacientes de alto riesgo que presenten intolerancia a las dosis más elevadas o que tengan una respuesta inferior a la prevista en la reducción del c-LDL. Estos regímenes consiguen una disminución del c-LDL en un grado similar o mayor que la monoterapia con estatinas de mayor intensidad (0 a 14% más para ambos). Sin embargo, advierte que los clínicos debemos utilizar estas estrategias con precaución, dada la falta de ensayos que demuestren beneficios de reducción de RCV de la terapia combinada frente a la monoterapia con estatinas. Estudios en curso como el IMPROVE-IT15 (cuyos criterios de inclusión han sido pacientes estables tras un síndrome coronario agudo≤10 días, con un c-LDL≤125mg/dl o un c-LDL≤100mg/dl si recibían tratamiento con estatina) deben evaluar la seguridad y los beneficios cardiovasculares de la combinación estatina/ezetimiba a largo plazo.
3Pacientes con hipercolesterolemia familiarLa hipercolesterolemia familiar es una enfermedad autosómica dominante debida a mutaciones en el gen del receptor de las LDL. Ello significa que el aclaramiento plasmático de estas partículas estará disminuido y, con ello, aparecerán las características típicas de este trastorno: concentraciones elevadas de colesterol en sangre y depósito del mismo en diferentes tejidos. La Guía Europea2 valora al paciente con dislipidemia genética como de alto RCV y se le recomienda recibir tratamiento hipolipidemiante. La Guía 2013 de ACC/AHA4 considera que los pacientes con un c-LDL superior a 189mg/dl deben recibir tratamiento con estatinas de alta intensidad (rosuvastatina 20mg/día, atorvastatina 80mg/día). La detección precoz de la hipercolesterolemia familiar y su tratamiento con estatinas ha contribuido a la reducción de la elevada morbimortalidad cardiovascular de esta población. La utilización de fármacos hipolipidemiantes se ha asociado a una reducción en la mortalidad en pacientes con hipercolesterolemia familiar homocigota16.
Actualmente hay fármacos en fase de investigación y desarrollo que pueden contribuir a ampliar el arsenal terapéutico para el tratamiento de las hiperlipidemias genéticas:
- -
Mipomersen (inhibe la producción de apo B-100) ha demostrado que reduce el c-LDL hasta un 44% en los pacientes con hipercolesterolemia familiar con c-LDL significativamente elevado, a pesar de tomar las dosis máximas de estatinas. Los efectos secundarios adversos encontrados con mipomersen incluyen síntomas gripales, reacciones locales a la inyección e hipertransaminasemia17.
- -
Los inhibidores de la PCSK9 han sido evaluados, y a las 12 semanas el tratamiento con el anticuerpo monoclonal AMG 145 (evolocumab) a una dosis de 350 y de 420mg consigue una reducción del c-LDL de 43 y 55%, respectivamente, en pacientes con hipercolesterolemia familiar heterocigota que ya recibían estatinas con o sin ezetimiba18, y más recientemente, en pacientes con intolerancia a estatinas, se han conseguido reducciones de entre un 53 y un 56% con evolocumab a dosis de 140mg 2 veces por semana, o 420mg una vez al mes, respectivamente19.
- -
Lomitapide ha sido evaluado en 29 pacientes afectos de hipercolesterolemia familiar homocigota, a una dosis media de 40mg/día, y reduce el c-LDL un 50% a la semana 26 de tratamiento. Los síntomas gastrointestinales fueron los efectos secundarios más frecuentes. En 4 pacientes las transaminasas se elevaron 5 veces el límite superior de la normalidad, lo que se resolvió al reducir la dosis o interrumpir temporalmente el tratamiento20.
El abordaje global y la intervención multifactorial intensiva en pacientes diabéticos deben ser incorporados a nuestra práctica clínica habitual para reducir la elevada morbimortalidad cardiovascular que presentan estos pacientes, tal como se puso de manifiesto en el estudio STENO21. En un reciente estudio observacional de seguimiento de una cohorte de diabéticos tipo 2 aparece el control del c-LDL como la variable más importante en la prevención cardiovascular de estos pacientes22.
Las estatinas juegan un papel importante en la prevención cardiovascular del diabético, y la guía europea2 y americana4 abogan por su empleo en el paciente diabético, con la matización, en la americana, que establece para los diabéticos de entre 40 y 75 años 2 categorías de riesgo que definen el empleo de estatinas de alta intensidad en los de mayor riesgo, y de mediana intensidad en el resto; además, no se marca ningún objetivo de control del c-LDL, cosa que sí hace la guía europea.
A principios de 2014 la ADA publica sus recomendaciones para el control de los lípidos en el paciente diabético23, y establece:
- 1.
La terapia con estatinas puede ser añadida a las modificaciones del estilo de vida, independientemente de los niveles de c-LDL, en pacientes:
- -
Con antecedentes de ECV. Evidencia grado A.
- -
Sin antecedentes de ECV, mayores de 40 años, con uno o más factores de RCV. Evidencia grado A.
- -
- 2.
Para pacientes de bajo riesgo (sin ECV, <40 años). Evidencia grado C.
- -
Considerar el tratamiento con estatinas añadido a las modificaciones del estilo de vida si el c-LDL>100mg/dl.
- -
El beneficio del tratamiento con estatinas en el diabético ha sido puesto de manifiesto en el estudio CARDS24. Un metaanálisis de 14 estudios clínicos aleatorizados con estatinas en 18.686 diabéticos25 encuentra que un 1mmol/l (39mg/dl) de reducción de c-LDL disminuye: un 21% los eventos cardiovasculares, un 22% los coronarios, un 21% los cerebrovasculares y un 13% la mortalidad cardiovascular. Los beneficios son independientes del c-LDL inicial.
El empleo de estatinas en diabéticos o en pacientes con síndrome metabólico ha sido motivo de polémica tras los hallazgos del estudio JUPITER, en el que se observó que la aparición de nuevos casos de diabetes se incrementó en el grupo que recibió rosuvastatina a una dosis de 20mg/día. En 2010 se publicó un metaanálisis26 cuyo objetivo fue valorar si la terapia con estatinas estaba asociada a un incremento del riesgo de desarrollar diabetes de nueva aparición. La terapia con estatinas se asoció a un 9% de incremento en el riesgo, aunque se consideró un riesgo bajo en comparación con la disminución del riesgo de episodios cardiovasculares. El riesgo de desarrollar diabetes es todavía mayor con el empleo de dosis altas de estatinas. No obstante, el beneficio en términos de reducción del RCV es de un 16% con el tratamiento intensivo con estatinas27, lo que corrobora su utilidad en la prevención cardiovascular de los diabéticos.
En la misma línea, un análisis de los beneficios cardiovasculares y riesgos de desarrollar diabetes por el tratamiento con estatinas en el estudio JUPITER28 demuestra que aunque el tratamiento se asoció con un aumento del 28% de diabetes (p=0,01), se evitaron en este grupo un total de 134 eventos o muertes de origen vascular por cada 54 nuevos casos de diabetes diagnosticados. Parece, pues, que los beneficios cardiovasculares del tratamiento con estatinas superan con creces el riesgo de diabetes, incluso en los sujetos con alto riesgo de desarrollar esta enfermedad.
En cambio, el reciente estudio japonés J-PREDICT, realizado en individuos con intolerancia a la glucosa29, encuentra un efecto beneficioso de pitavastatina sobre la aparición de nuevos casos de diabetes, experimentando, el grupo que recibió 1-2mg/día de pitavastatina y consejos para la modificación del estilo de vida, una reducción del 18% de la incidencia de diabetes (objetivo primario del estudio) en relación con el grupo control, que solo recibió el asesoramiento para adquirir hábitos saludables. Esto indica que el efecto diabetogénico de las estatinas no parece ser un efecto de clase, y la pitavastatina puede tener un comportamiento diferente.
En relación con el empleo de ezetimiba en diabéticos, un metaanálisis30 muestra que la eficacia hipocolesterolemiante de ezetimiba es mayor entre los diabéticos, con reducciones significativamente mayores en c-LDL, colesterol total y no HDL en comparación con los pacientes no diabéticos.
Según la Guía Europea ESC/EAS3, en el caso de que en el paciente diabético no consiguiéramos el objetivo de c-LDL a las máximas dosis de estatinas toleradas, podríamos valorar la asociación con ezetimiba. La adición de ezetimiba contribuye a mejorar el porcentaje de pacientes que alcanzan el adecuado control del c-LDL31.
5Pacientes en prevención primaria de alto riesgo cardiovascularLa prevención de las ECV debe realizarse actuando sobre los factores de RCV teniendo en cuenta el riesgo global de cada individuo. El RCV estima la probabilidad de sufrir una ECV en un determinado periodo de tiempo, generalmente 10 años, basándose en la presencia, o no, de enfermedad coronaria previa u otras formas clínicas de enfermedad vascular arteriosclerótica, y en la valoración conjunta de determinados factores de riesgo. El cálculo del RCV global permite tomar decisiones individualizadas en función del riesgo que presenta cada paciente. Identifica pacientes de alto riesgo que demandarían una intervención más precoz e intensa que aquellos de bajo riesgo.
El proyecto europeo SCORE ha permitido desarrollar un sistema de estimación del RCV global basado en la práctica clínica europea y considerando las variaciones geográficas de dicho riesgo. Se trata de un método de cálculo de mortalidad cardiovascular a 10 años. En la guías europeas2 se aboga, para España, por la utilización en la práctica clínica de las tablas SCORE adaptadas a los países europeos de bajo riesgo.
La utilización de fármacos hipolipidemiantes en prevención primaria, especialmente estatinas, debe contemplar si el beneficio para la prevención cardiovascular es suficiente para recomendar su utilización. Un artículo reciente se plantea, de forma provocativa, si a partir de los 50 años de edad será necesario añadir estatinas al agua potable32, y señala que en la mayoría de los individuos mayores de 50 años de edad es suficiente la presencia de un factor de RCV adicional para considerar seriamente la terapia con estatinas. Al respecto, se ha publicado un metaanálisis33 que concluye que en individuos con un riesgo inferior al 10%, cada 1mmol/l de reducción en el c-LDL produce una disminución absoluta del 11 por 1.000 de episodios vasculares mayores a 5 años. No obstante, en prevención primaria el beneficio del tratamiento con estatinas es menos claro que en otros grupos de pacientes (prevención secundaria, dislipidemias genéticas, diabetes), y debemos considerar la presencia de otros factores que puedan incrementar el RCV. La eficacia de las estatinas es dependiente del riesgo: mayor beneficio en pacientes con riesgo elevado34.
6Pacientes con enfermedad renal crónicaEn las guías europeas de prevención cardiovascular2 también se considera de muy alto RCV a los pacientes con ERC y un GFR<30ml/min/1,73m2, estableciéndose para ellos el mismo objetivo de control (c-LDL por debajo de 70mg/dl, o al menos una reducción del 50% respecto al basal) que para los pacientes que presentan antecedentes de enfermedad vascular arteriosclerótica (prevención secundaria); y además, se clasifica de alto RCV a aquellos pacientes con ERC y un GFR entre 30 y 60ml/min/1,73m2, asignándoles como objetivo un c-LDL por debajo de 100mg/dl. Para la consecución del adecuado control lipídico, el tratamiento con estatinas es necesario en la mayoría de estos casos.
Un metaánalisis35 demuestra la eficacia de las estatinas para reducir el RCV en pacientes con ERC. Otro reciente metaánalisis36, que incluyó 11 estudios clínicos con un total de 21.295 participantes, concluye que el tratamiento con estatinas reduce la mortalidad total (p<0,0001) y los episodios cardiovasculares y cerebrovasculares (p=0,0001 y p=0,0022, respectivamente) en los pacientes con ERC que no requieren diálisis. En cambio, el uso de estatinas en pacientes con ERC en diálisis resultó en un efecto no significativo sobre la mortalidad total y sobre los episodios cerebrovasculares, pero tuvo el efecto de reducir la muerte por causas cardiacas (p<0,05) y los episodios cardiovasculares (p<0,05).
El control estricto del c-LDL destinado a disminuir el RCV en pacientes con deterioro de la función renal cuenta con el aval de diversos estudios. El estudio SHARP, en pacientes con ERC, demuestra que la asociación de simvastatina con ezetimiba reduce la morbimortalidad cardiovascular8.
En la Guía KDIGO 201337 se recomienda el tratamiento con una estatina o con la combinación de estatina y ezetimiba para individuos a partir de los 50 años con un GFR<60ml/min/1,73m2. En adultos con ERC en diálisis se recomienda que el tratamiento con estatinas o con combinación de estatina y ezetimiba no se inicie, aunque no se recomienda interrumpir este tratamiento en aquellos pacientes que ya lo están recibiendo en el momento de inicio de la diálisis.
En la elección de la estatina debemos valorar su eficacia hipocolesterolemiante y su seguridad. Las que presentan un mayor riesgo de producir reacciones adversas debidas a interacciones farmacológicas son las que se metabolizan por la vía del citocromo P450 3A4 (lovastatina, simvastatina, atorvastatina)38. También la incidencia de miopatía con el tratamiento con estatinas es mayor en sujetos que presentan ERC, por ello es más adecuada la utilización de estatinas dotadas de una menor excreción renal: atorvastatina, fluvastatina y pitavastatina, que son las recomendadas por las guías europeas para el tratamiento de la dislipidemia en la ERC3; también en el documento español de consenso sobre la ERC de 201239 se señala la utilización preferente de estas estatinas.
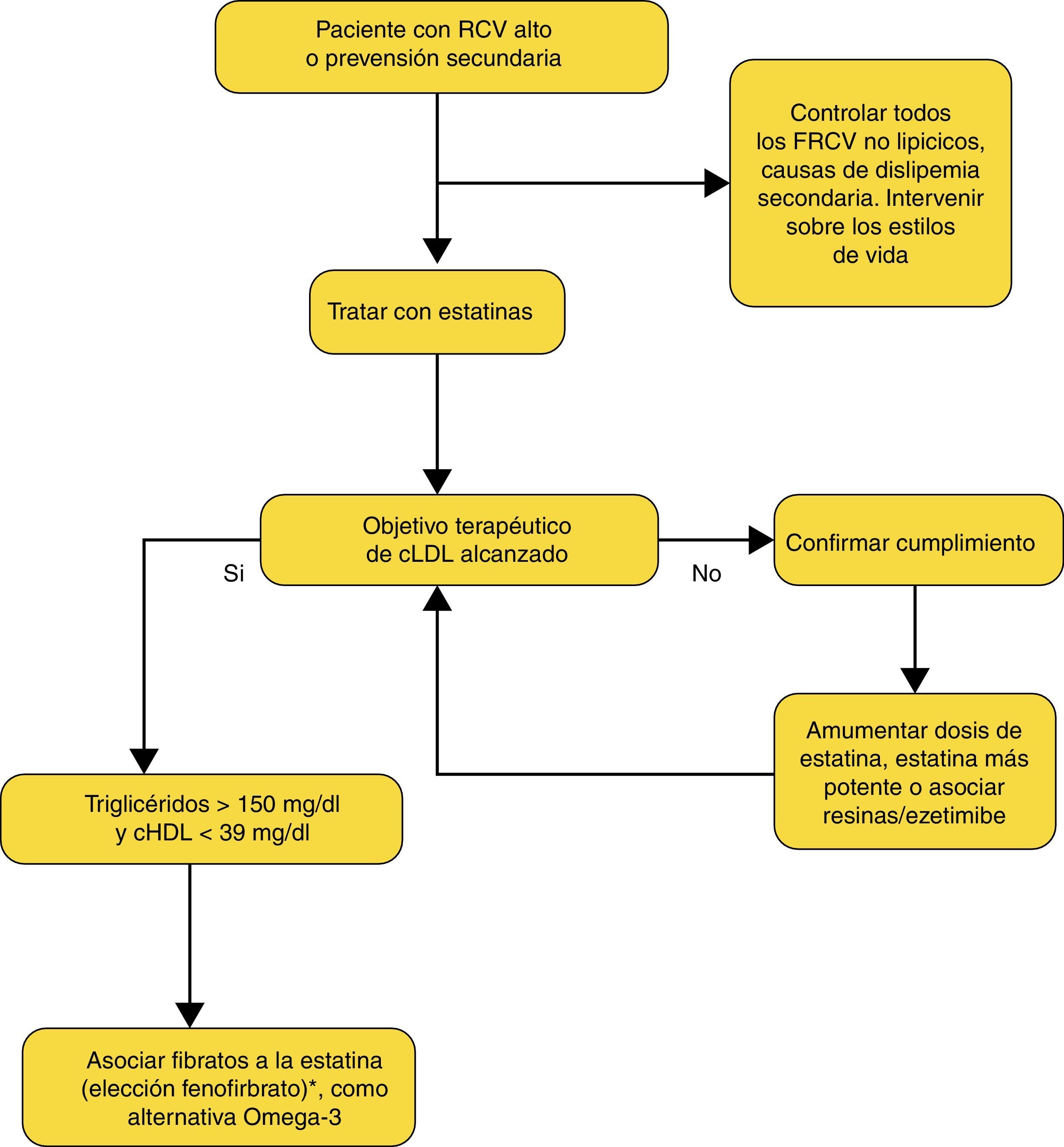
7Pacientes con dislipidemia aterogénicaLas características que definen la dislipidemia aterogénica son la presencia de una concentración aumentada de triglicéridos (≥150mg/dl), abundancia de partículas de LDL pequeñas y densas, y una disminución de la concentración de c-HDL (<39mg/dl).
La Guía 2013 de ACC/AHA4 plantea exclusivamente en este caso el tratamiento con estatinas. La recién publicada Guía Clínica para la detección, diagnóstico y tratamiento de la Dislipemia Aterogénica en Atención Primaria, avalada por las sociedades españolas de Atención Primaria y por la Sociedad Española de Arteriosclerois, aboga por el tratamiento en primera instancia con estatinas, y si no se consigue el control, asociar a las dosis máximas toleradas de estas, resinas o ezetimiba para conseguir el objetivo adecuado de c-LDL. También señala que las otras alteraciones lipídicas (c-HDL bajo, trigliceridemia elevada), que con frecuencia no se corrigen de forma adecuada mediante el tratamiento con estatinas, deben ser consideradas. Así pues, el tratamiento de la dislipidemia aterogénica debe ir encaminado al control del c-LDL como objetivo terapéutico principal, pero sin olvidarse de estrategias que modifiquen las concentraciones de triglicéridos y c-HDL, componentes esenciales de esta dislipidemia y responsables del riesgo residual presente en estos sujetos. Para ello, el control adecuado del metabolismo de la glucosa, así como el consumo de una dieta saludable, como la mediterránea, el ejercicio regular, un adecuado control de la presión arterial y el abandono del hábito tabáquico son fundamentales.
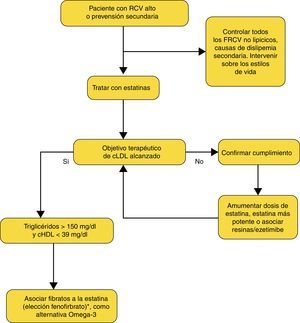
Si las medidas higiénico-dietéticas y el tratamiento con estatinas consiguen el objetivo de c-LDL propuesto, pero a pesar de ello siguen persistiendo las otras alteraciones de la «tríada lipídica» (triglicéridos por encima de 150mg/dl y c-HDL por debajo de 39mg/dl) (fig. 1), una alternativa podría ser añadir un fibrato, por su efecto sobre la trigliceridemia (reducción del 36%) y el c-HDL (incremento del 10%) (tabla 3). Aunque en los estudios FIELD40 y ACCORD41 el fenofibrato no demostró reducir la mortalidad cardiovascular, sí consigue beneficio en el subgrupo de pacientes con dislipidemia aterogénica, tal como ha evidenciado un metaanálisis42.
Abordaje del tratamiento de los pacientes con dislipidemia aterogénica propuesto por SEA, SEMERGEN, semFYC y SEMG.
Tomada de: Guía Clínica para la detección, diagnóstico y tratamiento de la dislipemia aterogénica en Atención Primaria. Documento SEMERGEN 2014. Disponible en: http://www.google.es/url?sa=t&rct=j&q=&esrc=s&frm=1&source=web&cd=2&ved=0CDYQFjAB&url=http%3A%2F%2Fwww.semg.es%2Fimages%2Fstories%2Frecursos%2F2014%2Fdocumentos%2FGuia_Dislipemia.pdf&ei=P39eU__8IoaG0AXLqIHwCQ&usg=AFQjCNHsxbSbJxNjFsZoK_vWjLk4jUeTcg.
La Guía Europea ESC/EAS3 señala que «los fibratos y especialmente el fenofibrato por su bajo potencial miopático están indicados como tratamiento combinado con estatinas para mejorar el control lipídico en pacientes con dislipidemia aterogénica combinada, especialmente en pacientes con síndrome metabólico».
Conviene proceder con cautela ante la posible aparición de efectos musculares adversos43. El riesgo de miopatía es mayor con gemfibrozilo y, por lo tanto, se debe evitar la combinación de este fármaco con las estatinas. Recordemos que las estatinas son un sustrato del transportador OATP1B1 y que gemfibrozilo es un potente inhibidor del mismo. Este mecanismo explica la interacción entre cerivastatina y gemfibrozilo, que produjo casos de rabdomiolisis mortal y ocasionó la retirada de esta estatina44. Mejor será, entonces, combinar la estatina con fenofibrato, lo cual redundará en una mayor reducción del colesterol no HDL y potenciará la acción predominante sobre el colesterol LDL de la estatina. Los fibratos, además de reducir la trigliceridemia, aumentan el tamaño de las partículas LDL, confiriéndoles menor aterogeneidad.
Los omega-3 a dosis superiores a unos 3g/día pueden ser una alternativa para el tratamiento de la dislipidemia mixta, en el caso de que exista intolerancia o contraindicación para la utilización de los fibratos asociados a estatinas. No obstante, en el seguimiento de una cohorte de pacientes con múltiples factores de RCV, el tratamiento diario con ácidos grasos omega-3 no redujo la morbimortalidad cardiovascular45, y un metaanálisis46 que incluyó 20 estudios con 68.680 pacientes no encontró asociación estadísticamente significativa de la administración de suplementos de omega-3 con un menor riesgo de mortalidad total, muerte cardiaca, muerte súbita, IM o accidentes cerebrovasculares.
En relación con el ácido nicotínico, aunque es el fármaco que más incrementa el c-HDL, tras la finalización de la revisión de los resultados disponibles del estudio HPS2-THRIVE47, se ha concluido que actualmente el balance beneficio-riesgo de la combinación ácido nicotínico/laropiprant es desfavorable. En consecuencia se ha decidido suspender la autorización de comercialización de este medicamento, aunque existe la posibilidad de utilizar ácido nicotínico aislado en fórmula magistral.
Otras estrategias dirigidas a incrementar el c-HDL con la inhibición de la CETP no han conseguido reducir la morbimortalidad cardiovascular. Es el caso de torcetrapib en el estudio ILLUMINATE48, que se asoció a un incremento de la presión arterial, un deterioro de la función endotelial y un aumento de la morbimortalidad cardiovascular, a pesar del incremento en la concentración de c-HDL, o dalcetrapib en el estudio OUTCOMES49, que en pacientes con un síndrome coronario agudo reciente aumentó los niveles de c-HDL, pero no redujo el riesgo de episodios cardiovasculares recurrentes. Aunque estos fármacos consiguen notables aumentos del c-HDL se han planteado dudas sobre su funcionalidad, y su desarrollo ha sido suspendido antes de su comercialización; no obstante, de esta familia continúan en fase de investigación evacetrapib y anacetrapib, este último, en un reciente estudio50 en pacientes de alto riesgo, consigue un incremento del c-HDL del 138,1% y una reducción del c-LDL del 39,8%. No obstante, habrá que corroborar con estudios de morbimortalidad cardiovascular si estos buenos resultados sobre el perfil lipídico son extrapolables a la prevención cardiovascular. Así pues, hasta el momento las estrategias dirigidas a incrementar el c-HDL con ácido nicotínico/laropiprant o con la inhibición de la CETP no han conseguido los resultados esperados y en ningún caso resultan recomendables.
ConclusionesLa hipercolesterolemia es uno de los principales factores de riesgo de morbimortalidad cardiovascular y nuestras intervenciones terapéuticas deben dirigirse a tratar el RCV y no exclusivamente el colesterol. Las directrices reseñadas en la Guía 2013 de ACC/AHA abogan por la utilización de estatinas para la prevención cardiovascular, e incrementan el número de personas subsidiarias de recibir tratamiento con estatinas en comparación a las anteriores recomendaciones, especialmente entre diabéticos y en sujetos en prevención primaria51.
Parece, pues, importante la evaluación global del RCV y el tratamiento con estatinas de alta intensidad, pero sin olvidarnos de otros aspectos positivos que nos ofrecen las guías europeas, en las que el establecimiento de objetivos específicos de c-LDL facilita el manejo y el seguimiento de los pacientes que pueden tener un mayor beneficio en la prevención cardiovascular, como son aquellos con alto y muy alto RCV. En la elección final de un fármaco determinado y su dosificación hay que considerar siempre los tratamientos concomitantes y la tolerancia, el estado clínico del paciente y sus preferencias, haciéndolo partícipe de las opciones terapéuticas como mejor forma de mejorar el cumplimiento, intentando evitar la inercia clínica de forma que, en términos de prevención cardiovascular, no lleguemos demasiado tarde.
Las guías de práctica clínica tratan de condensar la mayor evidencia clínica considerando las necesidades de la mayoría de los pacientes en la mayor parte de circunstancias, pero la decisión final de «qué y cómo hacer» en el cuidado de cada paciente en particular debe ser tomada por el médico, de acuerdo con el paciente y a la vista de todas las circunstancias que presente o afecten a este.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.