El herpes zóster es una erupción cutánea dolorosa que resulta de la reactivación del virus varicela zóster latente en los ganglios de las raíces dorsales o pares craneales.
En este artículo se hace una revisión actualizada del tratamiento farmacológico y la prevención del dolor secundario a la infección por el virus. La forma más efectiva para prevenir la neuralgia postherpética y sus consecuencias es la propia prevención del herpes. Desde hace varios años disponemos de una vacuna de virus vivos atenuados (cepa Oka virus varicela zóster) autorizada en adultos de 50 o más años de edad; esta vacuna ha demostrado su eficacia contra el herpes zóster y la neuralgia postherpética; sin embargo su eficacia decrece con la edad y está contraindicada en pacientes con algún tipo de inmunosupresión. Hoy en día existen vacunas recombinantes que son una alternativa y pueden administrarse a personas inmunocomprometidas.
Shingles is a painful rash that results from reactivation of latent varicella-zoster virus in the dorsal root ganglia or cranial nerves.
In this article an update is presented on the prevention and pharmacological treatment of the secondary pain from the virus infection. The most effective way to prevent post-herpetic neuralgia and its consequences is the prevention of herpes itself. A live attenuated vaccine (the Oka strain varicella zoster virus) has been available for several years, and is approved in adults aged 50 years old. Although this vaccine has shown to be effective against herpes zoster and post-herpetic neuralgia, its effectiveness decreases with age and is contraindicated in patients with some form of immunosuppression. Today the recombinant vaccines provide an alternative, and may be administered to immunocompromised persons.
El herpes zóster (HZ) es una erupción cutánea dolorosa, generalmente unilateral, que aparece como consecuencia de la reactivación del virus latente de la varicela zóster, la mayor parte de las veces secundaria a una disminución de la inmunidad celular frente al virus. Constituye una enfermedad de distribución mundial. En los países templados más del 90% de la población se infecta antes de los 15 años1.
La incidencia anual del HZ en la población general es de3,4 casos/1.000 personas2,3, variando según el grupo de edad4; así comprobamos que la incidencia es de 2/1.000 personas/año entre aquellos que tienen menos de 50 años de edad, de 5-7 en el grupo de 50-79 años y de 11 en el de 80 o más años2,5. Entre los pacientes que ya han padecido HZ, el índice de recurrencia es de menos de 0,6%6.
Manifestaciones clínicas del herpes zósterInicialmente existe una fase prodrómica de 1-5 días de duración, donde aparecen síntomas inespecíficos acompañados de sensación de quemazón, picazón o hiperestesia localizados en un dermatoma, es la neuralgia preherpética7,8.
A continuación aparecen las manifestaciones cutáneas limitadas a un único dermatoma. Los más frecuentemente afectados son los de la región torácica (62%), lumbar (14%) y facial, esta última la más dolorosa. En raras ocasiones cruza la línea media2. La apariencia de las lesiones y la distribución dermatómica hacen que el diagnóstico generalmente sea sencillo.
Existen casos de evolución corta y benigna con dolor pero sin ningún tipo de manifestación cutánea (zóster sine herpete) de difícil diagnóstico y que requieren confirmación a través de pruebas de laboratorio como: la reacción de la cadena polimerasa para el ADN del virus varicela zóster en el líquido tomado de las vesículas, el cultivo de virus, que tiene baja sensibilidad, o la inmunofluorescencia directa para antígeno virus varicela zóster que ofrece una alternativa diagnóstica cuando no se dispone de reacción de la cadena polimerasa2,8,9.
La neuralgia herpética aguda es el dolor que acompaña a la erupción, manifestándose como parestesias, disestesias, alodinia o hiperestesia. Puede persistir hasta 30 días después del comienzo del rash cutáneo10. El dolor generalmente remite cuando curan las lesiones, pero en el 9-34% de los pacientes persiste y se hace crónico.
La neuralgia herpética subaguda es el dolor que persiste más allá de la curación del rash pero que se resuelve dentro de los 3 primeros meses desde el inicio del cuadro10. Cuando hacemos una comparación entre estos pacientes y aquellos que sufrirán una neuralgia postherpética (NPH), vemos que los que sufren neuralgia herpética subaguda son significativamente más jóvenes y menos propensos a tener erupciones cutáneas severas11.
La NPH es la complicación más frecuente del HZ. Se define como el dolor que persiste por lo menos 90 días después de la infección aguda7. En los ensayos clínicos, para definirla como tal, se requiere que el dolor presente una intensidad mínima en las últimas 24h de≥40 (en ocasiones≥30) en una escala de Likert graduada de 0 (sin dolor) hasta 100 (peor dolor posible)7,9,12.
Acontece en algo más del 30%10 de los pacientes de más de 80 años, siendo rara en los menores de 508. La NPH se puede resolver espontáneamente8. En los pacientes en los que la NPH ha persistido más de un año, un 50% tendrá dolor significativo, mientras que el otro 50% estará sin dolor o lo tendrá controlado con la medicación a los 2 años de seguimiento. El 2% de las personas con HZ presentan dolor de más de 5 años de duración13.
El cuadro clínico consiste en una radiculalgia unilateral localizada en el dermatoma afectado por la reactivación del virus. Es un síndrome doloroso crónico englobado en el grupo de dolor neuropático (DN). La sensación que produce suele ser descrita como quemante, y otras cualidades incluyen picazón intensa, hormigueo, disestesias, hiperalgesia, descargas paroxísticas y dolor lancinante7,10. La alodinia aparece en más del 90% de los casos7. También pueden experimentar déficits sensoriales como áreas de anestesia10.
Factores de riesgo mayores para la aparición de la NPH son la edad avanzada, el dolor intenso durante la fase de rash y el rash severo8,10,14. Otros factores de riesgo serían: estrés, exposición a inmunotoxinas, traumatismos, afectación de dermatomas adyacentes, historia de dolor durante la fase de pródromos, afectación oftálmica, incremento de anomalías neurológicas en el dermatoma afectado (pérdida de sensibilidad), factores psicosociales, infección por virus de la inmunodeficiencia, enfermedades neoplásicas, trasplante de órganos, uso de fármacos inmunosupresores y otras condiciones que causen decremento de la inmunidad celular; posiblemente el sexo femenino también pueda ser un factor de riesgo para el HZ dado que es más frecuente entre las mujeres que entre los varones8,10,13–17. La frecuencia parece estar aumentada también en las personas con enfermedades crónicas como enfermedades respiratorias y diabetes18.
Los pacientes con NPH presentan una calidad de vida, funcionalidad física y bienestar psicológico disminuidos19.
Herpes zóster en el paciente inmunodeprimidoLa incidencia del HZ en estos pacientes aumenta de forma considerable. Las manifestaciones clínicas pueden llegar a ser muy variadas y atípicas. La diseminación mucocutánea o visceral puede estar aumentada con una tasa de mortalidad de hasta un 28%. En los adultos mayores el cuadro clínico tiende a ser más intenso7,20.
Complicaciones médicas relacionadas con el herpes zósterAunque el HZ afecta fundamentalmente a piel y sistema nervioso, también puede afectar a otros órganos. Las complicaciones pueden ser agudas o crónicas, leves o severas, incluso mortales.
En la tabla 1 se muestran algunas de las posibles complicaciones, siendo la NPH la más frecuente.
Complicaciones médicas relacionadas con el herpes zóster
| Dermatológicas |
| Sobreinfección bacteriana Diseminación cutánea Sepsis |
| Neurológicas |
| Neuralgia postherpética Parálisis de nervios periféricos y craneales Encefalitis-meningitis Síndrome de Guillain-Barré: incluso semanas después de desaparecidas las vesículas |
| Neumológicas |
| Incluyendo neumonía atípica |
| Abdominales |
| Estreñimiento, cuadros seudooclusivos, retención orina |
| Oculares |
| Neuritis óptica, lesiones corneales Conjuntivitis, iridociclitis |
| Cardíacas |
| Miocarditis |
| Endocrinometabólicas |
| Secreción inadecuada de ADH |
Las primeras medidas a aconsejar al paciente están relacionadas con la vestimenta; le indicaremos que emplee ropas holgadas de fibras naturales para que el roce con la piel sea mínimo, lo instruiremos en relación con medidas higiénicas de la piel, el empleo de compresas frías y el tratamiento con antisépticos en caso de necesidad. Simultáneamente debemos de tratar el dolor; se prescribirá tratamiento antiviral cuando esté indicado y la evolución del cuadro sea inferior a las 72h. Recomendaremos que retomen las actividades y vida normal tan pronto como sea posible. Si el dolor impide el movimiento articular, está indicada la fisioterapia y la movilización precoz. Durante el seguimiento reevaluaremos el dolor, los efectos adversos de los fármacos y la satisfacción con el tratamiento.
Tratamiento antiviralEstá recomendado en todos los pacientes inmunocomprometidos y en algunos inmunocompetentes que cumplen determinados criterios (tabla 2).
Indicación para el tratamiento antiviral en pacientes con herpes zóster
| Edad igual o mayor de 50 años Dolor moderado o severo Rash severo Afectación facial o ocular Otras complicaciones del herpes zóster Paciente inmunocomprometido |
Adaptada de Cohen21.
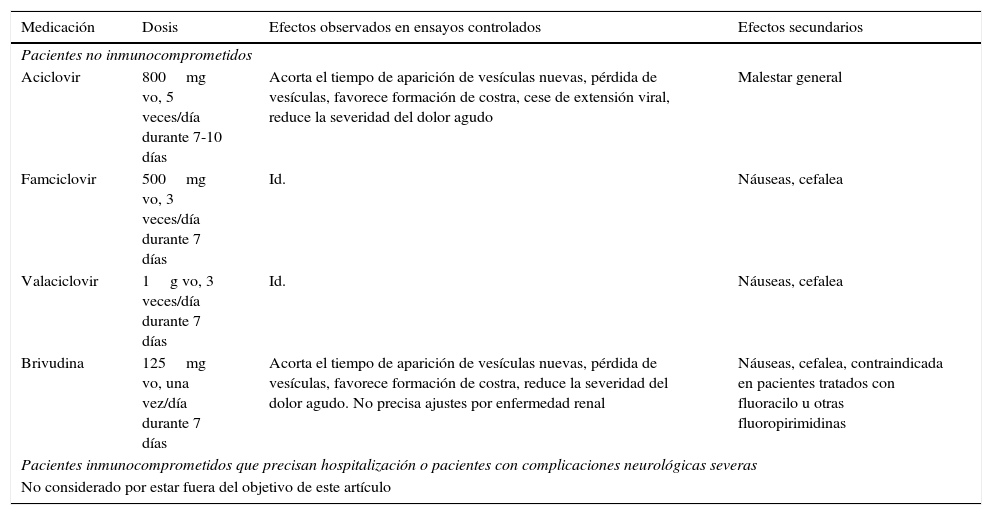
Se comprobó que el empleo de fármacos antivirales (tabla 3) dentro de las primeras 72h del inicio del cuadro disminuye el dolor, la duración, la severidad del cuadro y acelera la curación del HZ agudo8,15,21–23; también está constatado que acortan la duración de la NPH, pero que carecen de efecto sobre la incidencia16,23–25.
Tratamiento antiviral del herpes zóster
| Medicación | Dosis | Efectos observados en ensayos controlados | Efectos secundarios |
|---|---|---|---|
| Pacientes no inmunocomprometidos | |||
| Aciclovir | 800mg vo, 5 veces/día durante 7-10 días | Acorta el tiempo de aparición de vesículas nuevas, pérdida de vesículas, favorece formación de costra, cese de extensión viral, reduce la severidad del dolor agudo | Malestar general |
| Famciclovir | 500mg vo, 3 veces/día durante 7 días | Id. | Náuseas, cefalea |
| Valaciclovir | 1g vo, 3 veces/día durante 7 días | Id. | Náuseas, cefalea |
| Brivudina | 125mg vo, una vez/día durante 7 días | Acorta el tiempo de aparición de vesículas nuevas, pérdida de vesículas, favorece formación de costra, reduce la severidad del dolor agudo. No precisa ajustes por enfermedad renal | Náuseas, cefalea, contraindicada en pacientes tratados con fluoracilo u otras fluoropirimidinas |
| Pacientes inmunocomprometidos que precisan hospitalización o pacientes con complicaciones neurológicas severas | |||
| No considerado por estar fuera del objetivo de este artículo | |||
Adaptado de Cohen21.
Los antivirales deben ser administrados dentro de las 72h posteriores al comienzo del rash, pero si continúan apareciendo nuevas lesiones, se están extendiendo o aparece alguna complicación del HZ el tratamiento pueden ser iniciados incluso transcurridos estos 3 días7,22.
El valaciclovir y el famciclovir son superiores al aciclovir en la reducción del dolor asociado al HZ7,26,27. La comparación directa entre el valaciclovir y el famciclovir no mostró diferencias. La brivudina es superior al aciclovir en la prevención de la NPH, pero no se apreciaron diferencias en la duración una vez instaurada28.
Tratamiento analgésico del herpes zóster agudoEn los casos de dolor ligero-moderado pueden ser útiles el paracetamol, el metamizol o un antiinflamatorio no esteroideo8 valorando el riesgo gastrointestinal y cardiovascular del paciente y la posibilidad de efectos adversos. Pueden administrarse en combinación con el tramadol si fuese necesario4. Los antiinflamatorios no esteroideos tienen una eficacia analgésica superior al paracetamol. Se pueden emplear también los parches de lidocaína aplicados solo sobre piel intacta7.
El dolor moderado-severo requiere opioides potentes (p. ej. tapentadol, oxicodona, morfina)4 (tabla 4). Dado que el dolor intenso durante la fase aguda es un factor de riesgo para el desarrollo posterior de NPH29 cabría esperar que un control óptimo del dolor se asociara con una incidencia menor de esta, pero es preciso confirmar esta hipótesis con estudios adecuados.
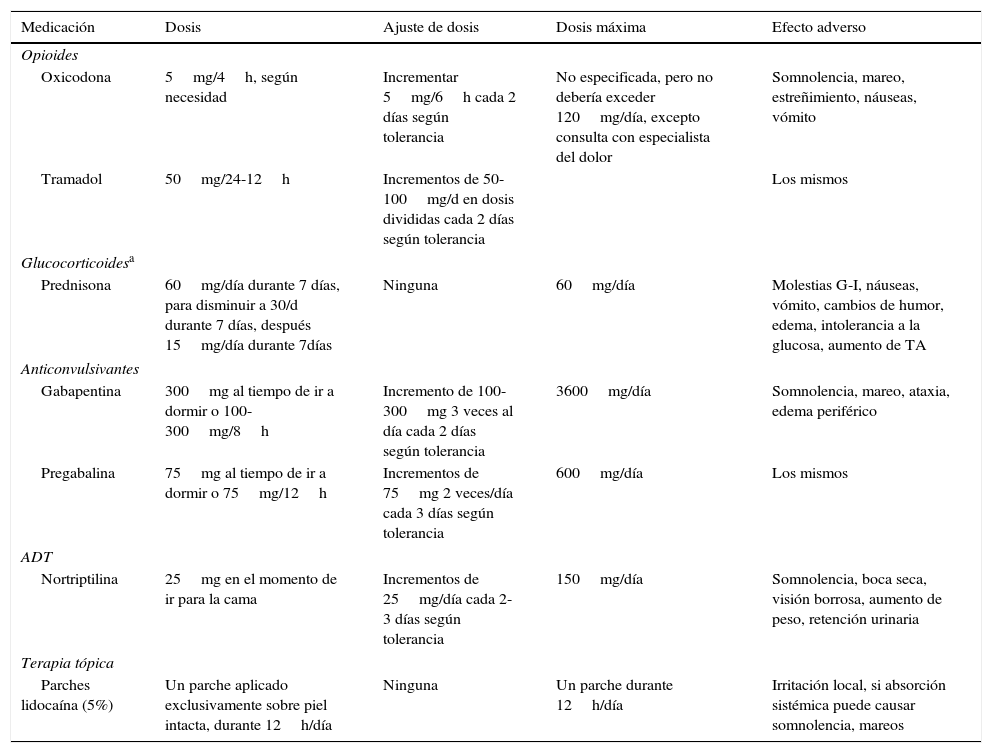
Medicaciones empleadas comúnmente para el tratamiento del dolor agudo por herpes zóster
| Medicación | Dosis | Ajuste de dosis | Dosis máxima | Efecto adverso |
|---|---|---|---|---|
| Opioides | ||||
| Oxicodona | 5mg/4h, según necesidad | Incrementar 5mg/6h cada 2 días según tolerancia | No especificada, pero no debería exceder 120mg/día, excepto consulta con especialista del dolor | Somnolencia, mareo, estreñimiento, náuseas, vómito |
| Tramadol | 50mg/24-12h | Incrementos de 50-100mg/d en dosis divididas cada 2 días según tolerancia | Los mismos | |
| Glucocorticoidesa | ||||
| Prednisona | 60mg/día durante 7 días, para disminuir a 30/d durante 7 días, después 15mg/día durante 7días | Ninguna | 60mg/día | Molestias G-I, náuseas, vómito, cambios de humor, edema, intolerancia a la glucosa, aumento de TA |
| Anticonvulsivantes | ||||
| Gabapentina | 300mg al tiempo de ir a dormir o 100-300mg/8h | Incremento de 100-300mg 3 veces al día cada 2 días según tolerancia | 3600mg/día | Somnolencia, mareo, ataxia, edema periférico |
| Pregabalina | 75mg al tiempo de ir a dormir o 75mg/12h | Incrementos de 75mg 2 veces/día cada 3 días según tolerancia | 600mg/día | Los mismos |
| ADT | ||||
| Nortriptilina | 25mg en el momento de ir para la cama | Incrementos de 25mg/día cada 2-3 días según tolerancia | 150mg/día | Somnolencia, boca seca, visión borrosa, aumento de peso, retención urinaria |
| Terapia tópica | ||||
| Parches lidocaína (5%) | Un parche aplicado exclusivamente sobre piel intacta, durante 12h/día | Ninguna | Un parche durante 12h/día | Irritación local, si absorción sistémica puede causar somnolencia, mareos |
ADT: antidepresivos tricíclicos; G-I: gastrointestinal; TA: tensión arterial.
El empleo de corticoides es controvertido porque están asociados con frecuencia a efectos secundarios en personas mayores.
Adaptada de Cohen21.
Si el dolor no responde, añadiremos con prontitud tratamiento coadyuvante30. Se aconsejan antidepresivos tricíclicos (ADT) y antiepilépticos; el empleo de estos en el episodio agudo reduce el dolor31, no obstante, la necesidad de titulación de estos fármacos inclinaría su uso hacia los casos de persistencia del dolor moderado o severo32.
GlucocorticoidesSu empleo como fármacos añadidos al tratamiento antiviral en el HZ no complicado todavía permanece controvertido. Los pacientes experimentan una resolución de la erupción cutánea y del dolor agudo más temprana pero no se observaron diferencias en el alivio del dolor, en la incidencia, ni en la duración de la NPH29,33–35. No deben de ser administrados sin tratamiento antiviral debido a que podrían causar diseminación del herpes13.
La combinación de fármacos antivirales y corticosteroides debería ser considerada en los pacientes mayores si no presentan contraindicaciones para su uso29 pero con especial precaución por tener un riego aumentado para efectos adversos severos7.
Tratamiento farmacológico de la neuralgia postherpéticaSe basa en el control de los síntomas ya que actualmente no disponemos de tratamiento modificador de la enfermedad.
Ante un dolor ligero o alodinia localizada, una opción terapéutica razonable sería el empleo de medicación tópica en monoterapia, pero ante dolor moderado o intenso, con bastante probabilidad, precisará tratamiento sistémico36, generalmente un ADT, siempre que no exista contraindicación que impida su utilización. Como alternativa se puede emplear la duloxetina, antidepresivo dual, hasta una dosis máxima diaria (DMáx) de 120mg en una toma al día.
Analgésicos tópicosLos tratamientos tópicos tienen la ventaja de poder ser aplicados directamente en el área dolorosa sin efectos sistémicos.
Parches de lidocaínaLa lidocaína actúa bloqueando los canales de Na, decreciendo la actividad de los nociceptores afectados y previniendo el mantenimiento sostenido de la sensibilización central y periférica.
Con relación a su eficacia y al lugar que debe ocupar en el tratamiento de la NPH, existe discrepancia entre los diferentes autores y guías; así, mientras que unos señalan que la lidocaína tópica es más efectiva que el placebo en el tratamiento de la NPH, apoyan su uso en forma de parches al 5% e incluso la sitúan como tratamiento de elección en la NPH con dolor localizado, otros no la recomiendan como tratamiento de primera línea13,37–44. DMáx: 3 parches durante un máximo de 12h.
Capsaicina tópicaBloquea los nociceptores aferentes C por medio de la depleción de sustancia P.
La eficacia de la crema de capsaicina al 0,075% en el tratamiento de la NPH aplicada 4 veces al día, fue vista en 2 estudios45,46. Quemazón o picazón fueron sus efectos secundarios más importantes; ambos disminuyen a la semana del inicio del tratamiento o con la aplicación previa de crema de lidocaína. Estudios más recientes observaron que la capsaicina en crema tendría una eficacia limitada47,48. Otra aproximación es la capsaicina en parches en alta concentración (8%)49; esta presentación solo dispone de dispensación hospitalaria.
Tratamiento sistémicoAntidepresivosLos ADT son uno de los principales fármacos para el tratamiento de la NPH, existiendo evidencia que apoya su efectividad48. El número necesario para tratar para obtener un paciente el alivio del 50% del dolor es de 3; y el número necesario para dañar es de 1650,51.
Los más utilizados son: la amitriptilina, la nortriptilina y la desipramina. La elección está basada en el perfil de efectos secundarios de cada uno; los más frecuentes son boca seca, mareos, estreñimiento y sedación. La amitriptilina y la nortriptilina tienen una eficacia frente al dolor similar, siendo la nortriptilina mejor tolerada. Cuando existen problemas de sueño es frecuente recomendar la amitriptilina pero la nortriptilina produce una sedación similar a la de la amitriptilina con menos efectos anticolinérgicos, por lo que puede ser considerada como una alternativa. Además, la nortriptilina no bloquea el reflejo de los barorreceptores, por lo tanto, conlleva menor probabilidad de producir hipotensión ortostática, lo que la convierte en una buena elección en pacientes de edad avanzada. La desipramina es la que provoca menor número de efectos secundarios entre los ADT de primera generación y no se asocia con sedación por carecer de efecto antihistamínico. Igualmente, también, es efectiva en el tratamiento de la NPH.
La dosis inicial de amitriptilina y nortriptilina es de 12,5 a 25mg/día con incrementos de 12,5 a 25mg cada 3-5 días hasta la DMáx de 150mg. En los pacientes de 65 o años de edad no se recomiendan dosis mayores a 75mg diarios, a causa de su mayor efecto anticolinérgico, efecto sedativo y riesgo potencial de caídas52. En estos pacientes es necesario comenzar con dosis bajas en el momento de ir a acostarse y precisan ser monitorizados en relación con los efectos secundarios e interacciones con otras medicaciones.
Se ha visto un aumento del riesgo de muerte cardíaca súbita en pacientes que toman ADT en dosis superiores a 100mg/día.
Si no hay respuesta o no hay un adecuado control del dolor se añaden los anticonvulsivantes, que son de utilidad sobre todo en la reducción del componente lancinante del DN10.
AntiepilépticosLos antiepilépticos como la gabapentina o la pregabalina pueden reducir la intensidad del dolor de la NPH en un 50%.
La gabapentina es tan efectiva como la nortriptilina en la mejoría del dolor de la NPH. Dosis: 300mg en dosis única, titulando hasta una DMáx de 3.600mg/día, repartida en 3 dosis. Un ensayo de efectividad adecuado de gabapentina puede llevar hasta 2 meses o más7. Los efectos secundarios potencialmente serios son: hipertensión arterial, hipotensión, edema, confusión, infecciones. La pregabalina se comienza por la noche con dosis de 75mg vo al momento de irse a la cama, aumentando 75mg a la semana hasta alcanzar un máximo de 600mg repartidos en 2-3 tomas al día. Si el dolor no está controlado se debe continuar la titulación hasta alcanzar la dosis máxima, excepto que aparezcan efectos secundarios severos como alucinaciones, ataxia o espasmos mioclónicos intensos. Con ambos medicamentos los pacientes pueden experimentar sedación, mareos, visión borrosa, temblor, confusión, vértigo, somnolencia, dificultad de concentración y aumento de peso. Tanto la gabapentina como la pregabalina pueden incrementar el riesgo de pensamientos y conductas suicidas, por lo que es necesario controlar este aspecto.
No permanece claro si la gabapentina en formulación de liberación retardada tiene una relación riesgo-beneficio más baja que la formulación de liberación normal53. DMáx: 3.600mg dividida en 2 dosis.
El número necesario para tratar con la pregabalina y la gabapentina es de 3-8 y el número necesario para dañar es de 7-3250,51. Un ensayo clínico con oxcarbacepina en pacientes con DN, que incluía a un pequeño número de pacientes con NPH, indicó que la respuesta al tratamiento variaba significativamente de acuerdo con el fenotipo de dolor54; la relevancia de este hallazgo para esta y otras terapias en la NPH necesita ser determinada.
OpioidesSi no alcanza una adecuada respuesta clínica con la combinación de estas 3 sustancias procederíamos a la introducción de un opioide, aunque la eficacia a largo plazo de opioides potentes o débiles es controvertida y la seguridad a largo plazo para esta condición tampoco fue establecida. Cuando se decide su uso deben de constituirse metas apropiadas, requiriendo monitorización y supervisión adecuadas55,56.
Existen estudios que indican que son efectivos en el tratamiento del DN y están recomendados en la NPH4,39–41,44,48,50, pero una revisión Cochrane más reciente concluyó que no hay evidencia convincente del beneficio de la oxicodona en el tratamiento de esta enfermedad57. Algunas de las guías recomiendan considerar los opioides después de otras terapias4,39–41,44 debido a su perfil de efectos secundarios, así como a cuestiones sobre su seguridad a largo plazo, riesgo de hiperalgesia y potencial mal uso o abuso.
En los casos de DN agudo intenso, intensas exacerbaciones episódicas de DN o ante la necesidad de alivio inmediato del dolor durante la titulación de una de las medicaciones de primera línea, los opioides pueden convertirse en fármacos de primera línea.
El tramadol es un opioide débil que actúa como agonista opioide e inhibidor de la recaptación de serotonina y noradrenalina. Demostró ser efectivo en el DN, incluida la NPH58,59. DMáx: 400mg repartida en 3 dosis o en 2 si la presentación es de liberación retardada.
Oxicodona: comparada con placebo reduce del dolor persistente, espontáneo, paroxístico y alodinia. Respecto a los ADT se demostró que no había diferencia significativa en la reducción del dolor y que los efectos secundarios eran más severos con los opioides60. DMáx: 120mg.
Metadona: ofrece más alivio que los ADT48. Para su prescripción, dadas sus especiales características farmacológicas, es necesario tener experiencia en su uso.
Tapentadol: actúa a través de un doble mecanismo, por una parte actúa sobre los receptores opioides mu y por otra inhibe la recaptación de noradrenalina. Se mostró efectivo en el tratamiento de dolor de tipo mixto o neuropático61–63. DMáx: 500mg repartidos en 2 dosis.
Otros tratamientosAntagonistas receptores NMDA: empleados en el DN debido al papel de los receptores NMDA en la sensibilización central; a pesar de ello en la NPH, tanto la ketamina, el dextrometorfano como la memantina no mostraron mejoría con relación al placebo39–41,48.
Metilprednisolona intatecal: efectiva para la NPH intratable48.
Lidocaína intravenosa: reduce el área de alodinia.
Llegados a este punto creemos necesario señalar que, a pesar de que ha sido publicado algún estudio donde se mostraba que el tratamiento del DN por parte de médicos de familia no se sujetaba a las guías basadas en la evidencia51,64, otros estudios realizados en el Reino Unido, han demostrado que los médicos de atención primaria sí realizan un tratamiento correcto, afirmando que los resultados fueron generalmente consistentes con las guías del Reino Unido para el tratamiento del DN65,66.
Categorización de las recomendaciones del tratamiento del dolor neuropáticoEn tanto que el tratamiento personalizado del DN deje de ser una aspiración para llegar a convertirse en una realidad, recogemos, a continuación, las recientes recomendaciones generales sobre el tratamiento farmacológico del DN en adultos (incluida la NPH) resultado de un amplio metaanálisis realizado por el Neuropathic Pain Special Interest Group de la Asociación Internacional para el Estudio del Dolor (IASP) que, utilizando la clasificación de las recomendaciones GRADE67, corrigen las dadas por el mismo grupo en el año 200751. En el caso particular de la neuralgia del trigémino, los autores recomiendan dirigirse a guías específicas. También advierten que estas recomendaciones no son aplicables para el dolor agudo ni para las exacerbaciones agudas y que en algún tipo de DN de origen oncológico las recomendaciones con relación al uso de opioides pueden ser diferentes68.
Tratamiento primera línea. Alto grado de recomendaciónAntidepresivos: ADT (calidad de evidencia moderada), ISRSN (particularmente la duloxetina) (calidad de evidencia alta).
Con la precaución recomendada para muchos ADT en altas dosis. Amitriptilina, imipramina, clomipramina no se recomiendan a dosis superiores a 75mg/día en adultos de 65 o más años de edad. Se ha visto un aumento del riesgo de muerte cardíaca súbita en pacientes que toman ADT en dosis superiores a 100mg/día. Los ADT tienen eficacia similar.
Antiepilépticos (calidad de evidencia alta): ligandos α2-δ de los canales de Ca: pregabalina, gabapentina; gabapentina de liberación prolongada o enecarbil.
Tratamiento segunda línea. Débil grado de recomendaciónParches de lidocaína (calidad de evidencia baja) (en las recomendaciones anteriores figuraba como de primera línea). Uso en DN periférico.
Parches de capsaicina al 8% (calidad de evidencia alta). Uso en DN periférico
Tramadol (calidad de evidencia moderada).
Tratamiento tercera línea. Débil grado de recomendaciónOpioides potentes (calidad de evidencia moderada) (antes de segunda línea).
Toxina botulínica A subcutánea (calidad de evidencia moderada). Uso en DN periférico.
Medicamentos con recomendaciones no concluyentesCapsaicina en crema. Carbamacepina. Clonidina tópica. Lacosamida. Lamotrigina. Antagonistas NMDA, oxcarbacepina, antidepresivos inhibidores de la recaptación de serotonina, tapentadol, topiramato, zonisamida. Tratamiento combinado (este aparece como un medio para aumentar la eficacia y reducir los efectos secundarios; en general los estudios dirigidos a valorar tal fin eran de pequeño tamaño; un estudio con amplio número de pacientes que comparaba altas dosis de pregabalina y duloxetina en monoterapia frente a la combinación de estos fármacos a bajas dosis no encontró diferencia significativa en eficacia ni efectos adversos)68. La combinación de pregabalina o gabapentina y duloxetina o ADT puede ser una alternativa al incremento de dosis en monoterapia68.
Recomendación débil contra su usoCanabinoides.
Ácido valproico.
Fuerte recomendación contra su usoLevetiracetam.
Mexiletina.
Nota: las dosis máximas están recogidas en diferentes apartados a lo largo de este artículo.
Prevención del herpes zóster: vacuna frente al herpes zósterLa única evidencia bien documentada para la prevención de la NPH es la prevención del HZ.
Para la prevención del HZ hoy en día disponemos de 2 vacunas:
- 1)
Vacuna con virus vivos atenuados, disponible desde 2006.
- 2)
Vacuna HZ/suvacuna, de la que recientemente fueron publicados los resultados del estudio en fase 369; es una vacuna que contiene una glucoproteína del virus de la varicela zóster en un sistema adyuvante ASO1B. Por su mayor contenido antigénico (más de 18.000ufp) tiene una potencia 14 veces superior a la infantil para la varicela.
La vacuna contra la varicela zóster de virus vivos atenuados, disponible desde 2006, fue aprobada por la Agencia Europea del Medicamento para la prevención primaria del HZ y NPH en adultos de 60 o más años y posteriormente ampliada a los de 50 o más años de edad70,71 que no presenten contraindicaciones (incluso para aquellos con enfermedades crónicas o que ya padecieran HZ con anterioridad)7.
La vacuna frente al HZ es la primera vacuna que no se administra para prevenir la aparición de una infección sino para reducir la probabilidad de reactivación de una infección padecida anteriormente y que se mantuvo latente en el cuerpo humano. En España todos los adultos se pueden beneficiar de esta vacuna, ya que prácticamente el 100% de la población fue infectada por el virus antes de los 40 años de edad72.
Está demostrado que reduce la incidencia del HZ en un 51,3%, que en caso de sufrir HZ el dolor era más breve y menos intenso (61,1% menor) y que reduce la incidencia de la NPH en un 66,5%73. El número necesario para tratar para prevenir un caso en 3 años es 58 para HZ y 364 para a NPH74.
Los pacientes pueden ser vacunados sin realizar test serológicos ni considerar los antecedentes sobre haber padecido varicela o HZ70,73 ni enfermedades crónicas. La vacuna puede administrarse de forma concomitante con la vacuna de la gripe inactivada, pero debe evitar ser aplicada simultáneamente con la vacuna neumocócica 23-valente.
Se desconoce, todavía, el tiempo exacto de protección de esta vacuna, por lo cual tampoco sabemos si va a ser necesario administrar dosis de refuerzo adicionales. La vacuna con virus vivos atenuados reduce significativamente la carga de la enfermedad causada por el HZ durante 10 años tras la vacunación, pero reduce la incidencia del HZ significativamente solo durante 8 años74.
En caso de haber sufrido HZ recientemente, la vacuna se puede retrasar hasta 3 años.
Está contraindicada en las mujeres embarazadas, en pacientes inmunocomprometidos, grupo que es más sensible a la infección por HZ: cáncer hematológico que no está en remisión o recibieron quimioterapia citostática en 3 meses, pacientes con tuberculosis activa no tratada, inmunodeficiencia de células T (por ejemplo, infección por virus de la inmunodeficiencia humana con un recuento de CD4≤200/por mm3 o<15% del total de linfocitos), los que están recibiendo altas dosis de tratamiento inmunosupresor (por ejemplo, >20mg de prednisona diaria durante más de 2 semanas). Los corticoides por vía tópica, nasal o intraarticular no contraindican la vacunación (tabla 5).
Consideraciones especiales sobre la vacunación con virus vivos atenuados contra virus herpes zóster
| Consideración especial | Recomendaciones |
|---|---|
| Previa a la inmunosupresión | Recomendada. Administrarla 2-4 semanas antes de comenzar el tratamiento inmunosupresor |
| Historia de herpes zóster | Recomendada. Administrar tan pronto como el dolor y el rash se resuelvan |
| Edad menor de 60 años | Recomendada |
| Historia de vacuna contra varicela | No etiquetada para esta indicación, sin embargo los adultos de 40 o más años de edad generalmente no recibieron esta vacuna |
| Sida | Contraindicada, incluyendo a pacientes con manifestaciones clínicas de VIH o recuento de células CD4 de 200mm3 (0,20×109/L) o menos |
| Anafilaxia a la gelatina o a la neomicina | Contraindicada. Dermatitis de contacto por neomicina no es una contraindicación |
| Enfermedad hematológica maligna | Contraindicada. Pueden vacunarse los pacientes con leucemia si están en remisión y no recibieron quimioterapia o radioterapia en 3 meses |
| Altas dosis de corticosteroides (>20mg/día durante 2 o más semanas) | Contraindicada. Diferir la vacunación por un mes después de la discontinuación de los esteroides |
| Embarazo | Contraindicada |
Lal et al.69 publicaron en abril de 2015 los prometedores resultados de su estudio de 3 años de seguimiento con la vacuna HZ/suvacuna, llevada a cabo en un conjunto de 15.411 de personas (7.698 vacunados y 7.713 controles) en 18 países a lo largo de todo el mundo. Los participantes tenían todos 50 o más años de edad y no presentaban ningún tipo de inmunocompromiso. El estudio comprobó que esta vacuna ofrece un 97,2% de eficacia en la prevención del HZ. A diferencia de lo que sucede con la vacuna con virus atenuados, la eficacia no disminuye con la edad. La eficacia fue del 96,6% en el grupo de pacientes de 50-59 años, del 97,4% en el de 60-69 y del 97,9% en el de 70 o más años de edad (para la de virus vivos atenuados la eficacia era del 70, 64 y 67% respectivamente para cada grupo de edad). Ya vimos que la vacuna con virus atenuados está contraindicada en las personas con inmunidad celular deficiente; dado que esta vacuna solo contiene proteínas del virus y por lo tanto no se puede replicar, probablemente será segura para pacientes inmunocomprometidos, aunque no está claro si será capaz de producir una respuesta inmune suficiente para protegerlos. Actualmente hay en marcha varios estudios: uno que trata de dilucidar este aspecto75, otro que compara las 2 vacunas entre sí (clinicaltrials.gov number, NCT02114333) y otro que trata de determinar si esta vacuna previene la NPH y otras complicaciones en las personas de 70 o más años de edad (clinicaltrials.gov number, NCT01165229).
La vacuna se administra en 2 dosis. Está por determinar la duración del efecto. La duración de la efectividad determinará la necesidad de dosis de refuerzo. Respecto a los efectos adversos, se vio que son más frecuentes que en el grupo placebo, pero que los efectos adversos serios o el potencial de enfermedad inmunomediada era similar en los 2 grupos.
ConclusionesEl tratamiento del dolor agudo por HZ continúa manteniéndose sin modificaciones desde hace varios años. En el año 2015 el Neuropathic Pain Special Interest Group de la IASP estableció unas nuevas recomendaciones para el tratamiento del DN no agudo en adultos que afectan, por lo tanto, al manejo de la NPH al ser ella misma un tipo de DN crónico. El tratamiento analgésico propuesto se dirige contra las consecuencias de la enfermedad, siendo la vacunación contra el virus la única forma de prevenirla; para ello hoy disponemos de 2 vacunas: la vacuna con virus vivos atenuados y la vacuna HZ/suvacuna.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.