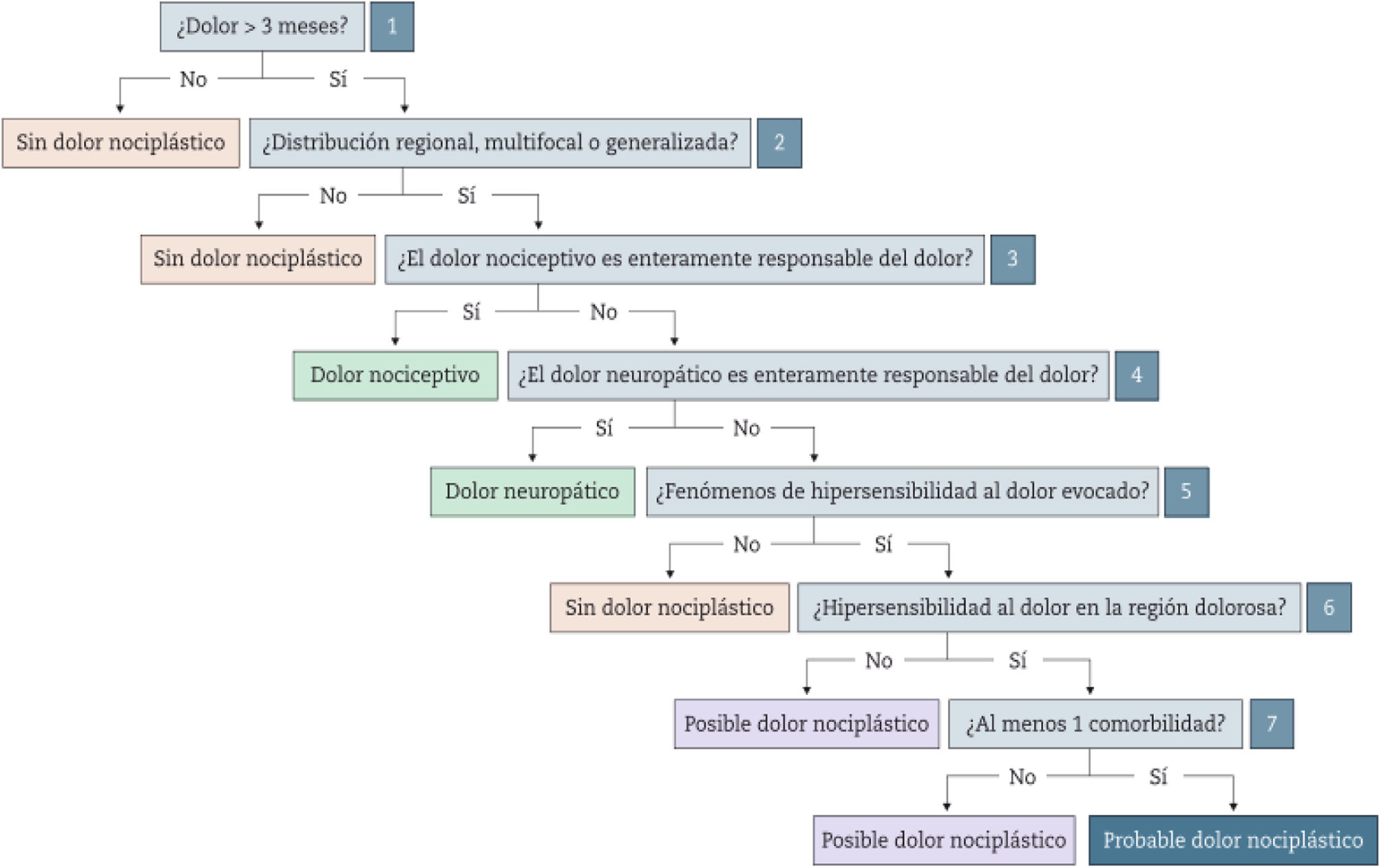
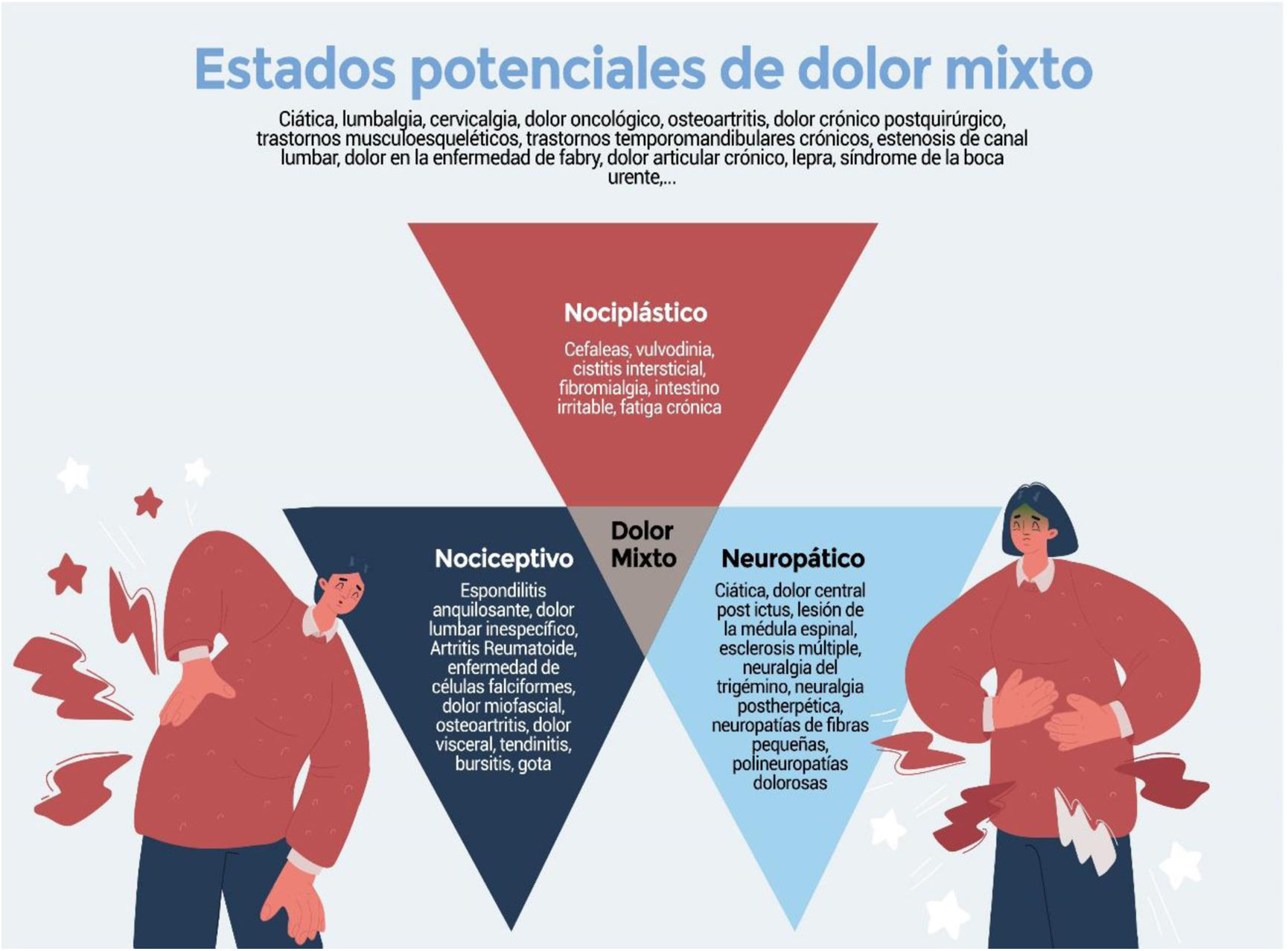
A pesar de haber sido referenciado en la literatura durante más de una década, el término «dolor mixto» apenas ha sido definido formalmente. La estricta clasificación binaria del dolor como puramente neuropático o nociceptivo dejó a una buena proporción de pacientes sin clasificar; incluso la introducción del término «dolor nociplástico» en la terminología de la Asociación Internacional para el estudio del Dolor deja fuera a los pacientes que presentan clínicamente una superposición sustancial de síntomas nociceptivos, neuropáticos y nociplásticos. Para estos pacientes el término «dolor mixto» es cada vez más reconocido y aceptado por la comunidad científica. Esta revisión narrativa resume los aspectos más destacados del dolor mixto y hace hincapié en la importancia de reconocer este tipo de dolor en la práctica clínica.
Despite being referenced in the literature for over a decade, the term “mixed pain” has hardly been formally defined. The strict binary classification of pain as purely neuropathic or nociceptive left a good proportion of patients unclassified; even the introduction of the term “nociplastic pain” in the International Association for the Study of Pain terminology leaves out patients who clinically present with a substantial overlap of nociceptive, neuropathic, and nociplastic symptoms. For these patients the term “mixed pain” is becoming increasingly recognized and accepted by the scientific community. This narrative review summarizes the highlights of mixed pain and emphasizes the importance of recognizing this type of pain in clinical practice.
Artículo
Diríjase al área privada de socios de la web de la SEMERGEN, (https://www.semergen.es/index.php?seccion=biblioteca&subSeccion=revistaSEMERGEN ) y autentifíquese.