Esta revisión sistemática tuvo como objetivo analizar la evidencia científica existente sobre los efectos que el ejercicio físico tiene en la sintomatología, actividad de la enfermedad y condición física de personas con lupus eritematoso sistémico. Siguiendo la lista de verificación «PRISMA», se realizó una búsqueda en las bases de datos PubMed, PEDro y Sportdiscus, empleándose las escalas PEDro y MINORS para determinar la calidad metodológica de las mismas. Se localizaron en total 14 investigaciones, 10 estudios controlados y 4 comparativos. La práctica de ejercicio produjo mejoras significativas en la condición física y la fatiga, no registrándose efectos adversos derivados de su práctica. Ningún estudio reportó efectos positivos en la actividad de la enfermedad. Los resultados obtenidos indican que la práctica de ejercicio físico es segura en personas con lupus eritematoso sistémico, si bien sus beneficiosos se reducen principalmente a mejoras en su forma física y en su nivel de fatiga percibida.
This systematic review was aimed at analysing the existing scientific evidence regarding the effects of physical exercise on the symptomatology, disease activity, and fitness level in a population with systemic lupus erythematosus. Following the PRISMA checklist, a search was carried out on PubMed, PEDro, and Sportdiscus databases. The PEDro and MINORS checklists were used in order to identify the methodological quality of the studies selected. A total of 14 studies were found, of which 10 were randomised controlled trials, and 4 were comparative studies. The performance of physical exercise led to significant improvements in fitness and fatigue. No adverse effects were registered. None of the studies found reported positive effects on the disease activity. The obtained results imply that the performance of physical exercise is safe for people with systemic lupus erythematosus, although its benefits are reduced mainly to improvements in their fitness and perceived level of fatigue.
El ejercicio físico es una de las terapias no farmacológicas que mayores beneficios presenta en personas con padecimientos crónicos1, por lo que el profesional de atención primaria debe incluir su promoción como parte del consejo médico2. Por lo general, la principal fuente de información acerca de la prescripción de ejercicio físico en enfermedades crónicas emana de los estudios de revisión que presentan de manera resumida la evidencia científica existente al respecto, si bien los mismos se centran en su mayoría en enfermedades de gran prevalencia3. Por lo tanto, se hace necesario incrementar el número de estudios de este tipo que se centren en enfermedades crónicas de menor prevalencia pero especialmente relevantes, como es el caso del lupus eritematoso sistémico (LES). En nuestro país, el LES es una de las enfermedades reumáticas más incipientes con una prevalencia estimada que oscila entre 9 por cada 10.000 a nivel nacional4 y uno cada 400 casos a nivel local5. Ante la ausencia de una terapia farmacológica efectiva, el tratamiento del LES está actualmente enfocado a la mejora de la calidad de vida (CdV) del paciente6, que se encuentra mucho más afectada que la de la población en general4. Teniendo en cuenta que la práctica de ejercicio físico tiene un efecto beneficioso sobre diversas manifestaciones clínicas que afectan a la CdV del paciente con LES, como la fatiga, la dislipidemia, la resistencia a la insulina o la arterioesclerosis precoz entre otras, su prescripción cobra especial importancia en esta población. Sin embargo, los estudios de revisión sobre el estado de la cuestión son escasos y no aportan la información suficiente como para poder establecer pautas claras sobre su prescripción, bien por ser de carácter narrativo7,8, bien por centrarse en un síntoma específico y tipo de ejercicio concreto9. Bajo estas circunstancias, esta revisión sistemática tiene como objetivo aportar evidencia científica sobre si la prescripción de ejercicio físico en personas con LES cuyo nivel de afectación permite su práctica puede considerarse como una estrategia de rehabilitación segura que conlleve efectos beneficiosos en la sintomatología, actividad de la enfermedad y condición física de las mismas.
Material y métodosSe diseñó una revisión sistemática siguiendo la lista de verificación Preferred Reporting Items for Systematic review and Meta-Analysis Protocols (PRISMA-P), aconsejada para este tipo de estudios10. El protocolo fue registrado en la base de datos PROSPERO (Ref: 69473).
Estrategia de búsquedaLa estrategia de búsqueda fue diseñada para encontrar el mayor número de investigaciones que tuviesen como objetivo identificar el impacto que la práctica de ejercicio física tiene sobre los síntomas que refieren las personas diagnosticadas con LES, así como en la actividad de la enfermedad y en la condición física de las mismas. Para tal fin, un autor (AD) realizó una búsqueda sin acotación temporal en las bases de datos PubMed, PEDro y Sportdiscus, hasta febrero de 2017, combinando las palabras clave y operadores booleanos de este modo: «Lupus» AND «Exercise» OR «Phyiscal Activity» OR «Training» OR «Rehabilitation». Se repitió la búsqueda en mayo de 2017 con el fin de actualizar los resultados de la misma.
Se excluyeron todas las investigaciones que: a) incluyesen un único grupo de participantes en su diseño; b) no describiesen el programa de entrenamiento físico realizado; c) analizasen los efectos de una sesión aislada de ejercicio físico; d) no estuviesen disponibles a texto completo; e) estuviesen escritos en un idioma diferente al español o inglés; d) fuesen revisiones, metaanálisis, tesis doctorales, estudios de caso o estudios observacionales; y f) hubiesen sido obtenidos en otra base de datos previa (resultados repetidos).
Procedimiento de selecciónDos autores (AD e IM) revisaron de manera independiente la información incluida en el título y/o el resumen de cada uno de los registrados propiciados por la estrategia de búsqueda, clasificando los estudios como «válidos (a priori)» o «no válidos» en función de los criterios de selección anteriormente citados. Los estudios cuyo título o abstract no aportaban la suficiente información como para decidir su inclusión/exclusión fueron considerados en un primer momento como «válidos (a priori)». Una vez finalizada esta primera fase de selección, ambos autores contrastaron sus respectivas clasificaciones al objeto de llegar a un consenso. En el caso de que no hubiese acuerdo a la hora de considerar un estudio como «válido (a priori)» o no «válido», se solicitó la opinión de un tercer revisor (CA) y se procedió a la lectura del texto completo de los estudios finalmente clasificados como «válidos (a priori)». Tras leer ambos revisores de manera independiente dichos estudios, se procedió del mismo modo al objeto de descartar aquellos que no cumpliesen los criterios de selección, obteniéndose una selección de estudios considerados finalmente como «válidos».
Extracción de datosLa información extraída de los estudios «válidos» se realizó mediante la lectura de los mismos por 2 autores (AD e IM), que identificaron y organizaron los datos de relevancia en tablas de evidencia de manera independiente. Para cada estudio se consideró el tipo de diseño (controlado aleatorizado, controlado no aleatorizado, comparativo, etc.), las características de la muestra (número, edad, sexo, etc.), el tipo de intervención realizada y sus características (modalidad de ejercicio, duración, intensidad, frecuencia, etc.), las variables de estudio, las respectivas herramientas de valoración y los resultados más relevantes descritos en la investigación. Posteriormente, se realizó una retrobúsqueda mediante la revisión de las referencias bibliográficas de cada uno de los estudios, al objeto de identificar posibles investigaciones que pudiesen cumplir los criterios de selección y que no hubiesen sido localizadas tras la realización de la búsqueda inicial. Las posibles discrepancias que pudiesen aparecer entre ambos autores tras la extracción de la información fueron resueltas por un tercer autor (AC). En el hipotético caso de que la información incluida en el estudio se considerase como insuficiente, se planteó el contactar al autor del estudio en cuestión si existiese tal posibilidad. El procedimiento de extracción de datos no fue ciego, conociéndose el nombre de los autores de los estudios seleccionados y el título de las revistas en las que fueron publicados.
Valoración de la calidad metodológicaLa calidad metodológica de los estudios considerados como ensayos clínicos aleatorizados y controlados, fue determinada mediante el empleo de la escala PEDro11. La puntuación total obtenida en la misma sirvió para diferenciar la calidad de las investigaciones entre alta (6 o más puntos) o baja (5 o menos puntos)12. Para el resto de investigaciones finalmente seleccionadas se aplicó el índice de valoración metodológica para estudios no aleatorizados «MINORS»13. Ambas escalas fueron inicialmente administradas de manera independiente por 2 autores (AD e IM), quienes contrastaron posteriormente las puntuaciones otorgadas a cada uno de los estudios analizados. En caso de desacuerdo, se recurrió al criterio de un tercer autor (CA), al objeto de lograr un consenso al respecto.
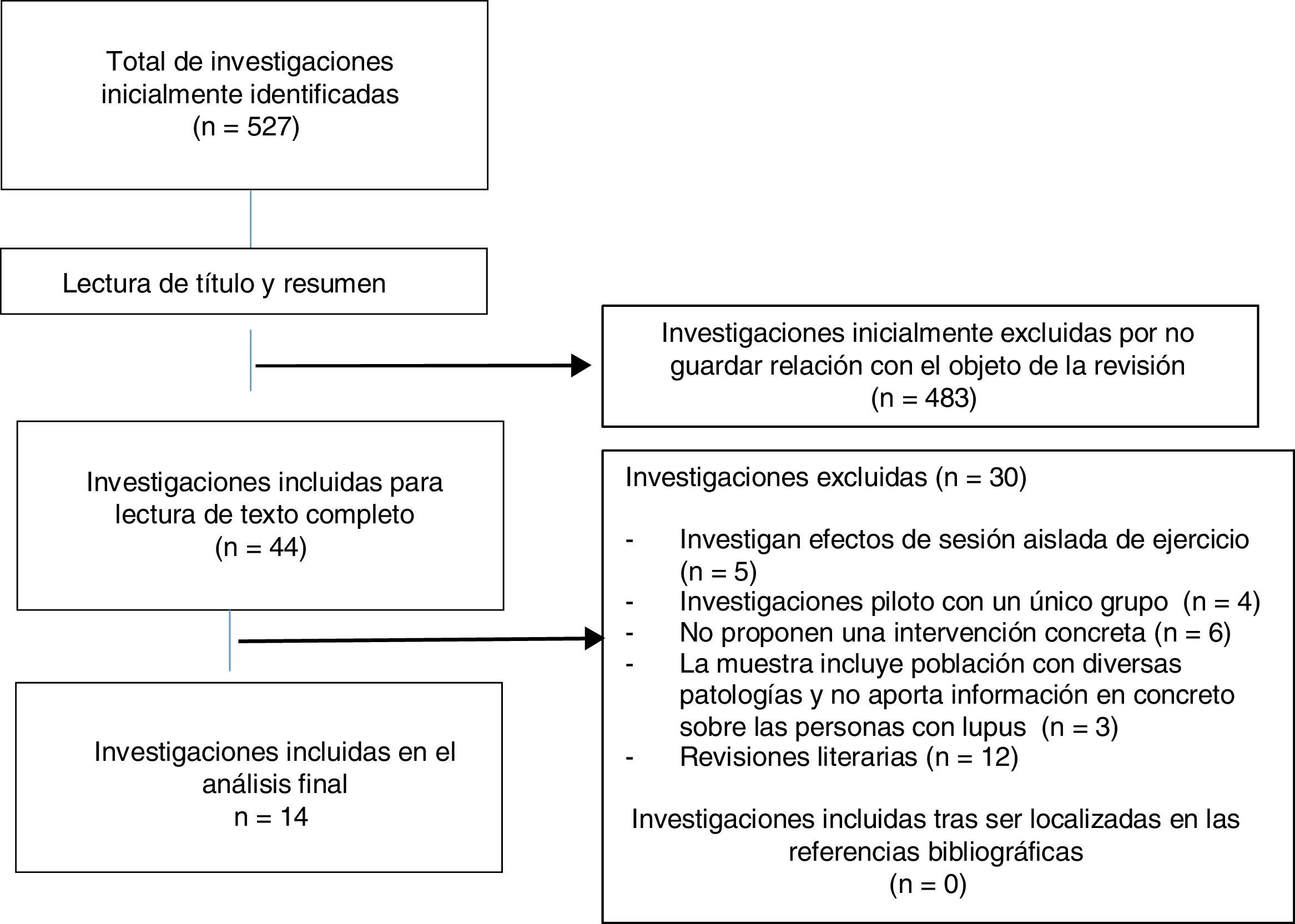
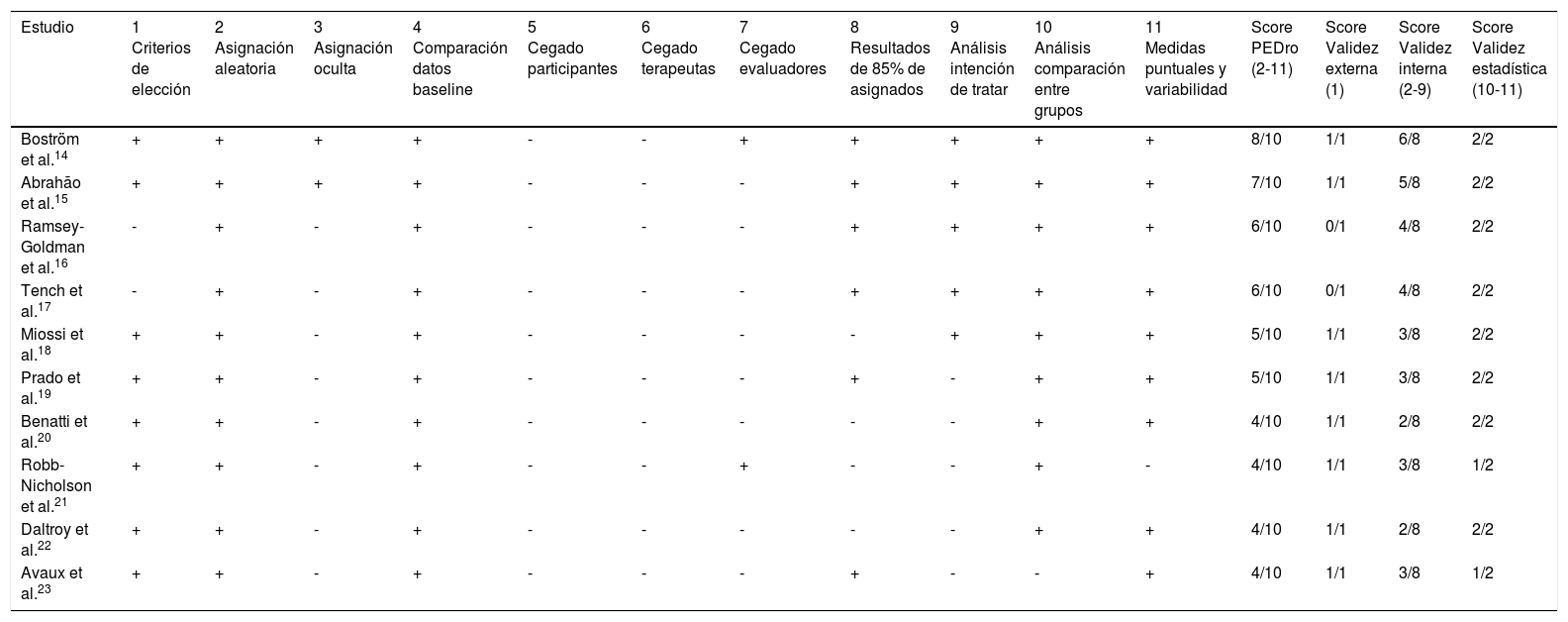
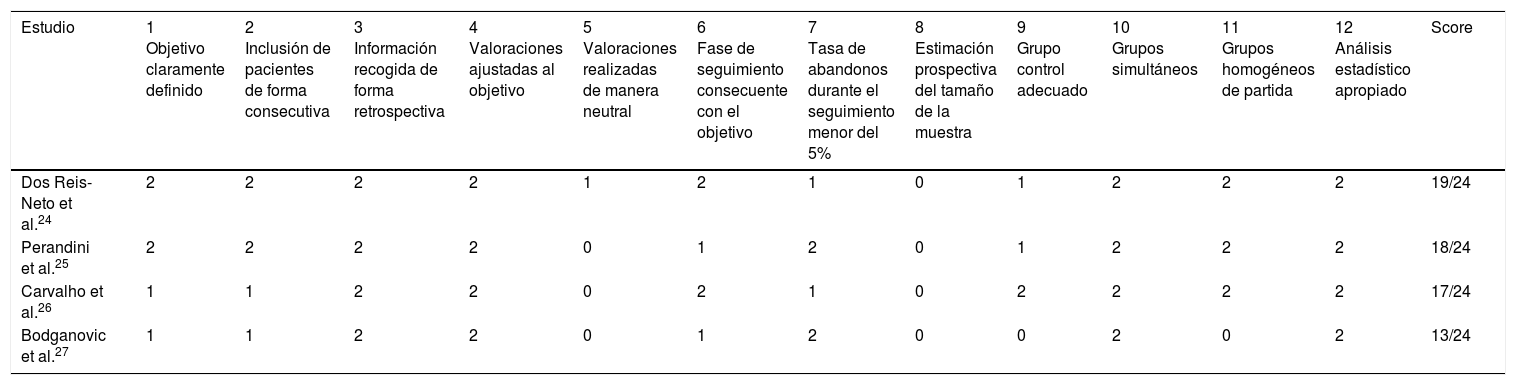
ResultadosLa búsqueda inicial permitió identificar 527 referencias, de las cuales, tras la lectura del título y resumen se llevó a cabo un primer cribado en el que se excluyeron 483 debido a que no guardaban relación con el objeto de la revisión. Se seleccionaron como elegibles para su lectura completa los 44 estudios restantes, siendo excluidos 30 de ellos por diversos motivos, por lo que el número final de estudios incluidos para su completo análisis fue 14 (fig. 1). Se identificaron un total de 10 ensayos clínicos aleatorizados y controlados14–23, calificándose la calidad metodológica de 4 de ellos como elevada14–17, y obteniéndose tras el análisis de cada uno un puntuación global media de 5,1 y una mediana de 4 (tabla 1). Con relación a la calidad metodológica de las 4 investigaciones restantes, todas ellas estudios controlados no aleatorizados, la media obtenida en la escala MINOR fue de 8 sobre 24 ptos. Dos investigaciones24,25 cumplieron satisfactoriamente 8 de los 12 criterios, mientras que los 2 estudios restantes26,27 cumplieron satisfactoriamente 7 y 5 de los 12 criterios, respectivamente (tabla 2).
Evaluación de la calidad metodológica de los ensayos clínicos según la escala PEDro (n=11)
| Estudio | 1 Criterios de elección | 2 Asignación aleatoria | 3 Asignación oculta | 4 Comparación datos baseline | 5 Cegado participantes | 6 Cegado terapeutas | 7 Cegado evaluadores | 8 Resultados de 85% de asignados | 9 Análisis intención de tratar | 10 Análisis comparación entre grupos | 11 Medidas puntuales y variabilidad | Score PEDro (2-11) | Score Validez externa (1) | Score Validez interna (2-9) | Score Validez estadística (10-11) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Boström et al.14 | + | + | + | + | - | - | + | + | + | + | + | 8/10 | 1/1 | 6/8 | 2/2 |
| Abrahão et al.15 | + | + | + | + | - | - | - | + | + | + | + | 7/10 | 1/1 | 5/8 | 2/2 |
| Ramsey-Goldman et al.16 | - | + | - | + | - | - | - | + | + | + | + | 6/10 | 0/1 | 4/8 | 2/2 |
| Tench et al.17 | - | + | - | + | - | - | - | + | + | + | + | 6/10 | 0/1 | 4/8 | 2/2 |
| Miossi et al.18 | + | + | - | + | - | - | - | - | + | + | + | 5/10 | 1/1 | 3/8 | 2/2 |
| Prado et al.19 | + | + | - | + | - | - | - | + | - | + | + | 5/10 | 1/1 | 3/8 | 2/2 |
| Benatti et al.20 | + | + | - | + | - | - | - | - | - | + | + | 4/10 | 1/1 | 2/8 | 2/2 |
| Robb-Nicholson et al.21 | + | + | - | + | - | - | + | - | - | + | - | 4/10 | 1/1 | 3/8 | 1/2 |
| Daltroy et al.22 | + | + | - | + | - | - | - | - | - | + | + | 4/10 | 1/1 | 2/8 | 2/2 |
| Avaux et al.23 | + | + | - | + | - | - | - | + | - | - | + | 4/10 | 1/1 | 3/8 | 1/2 |
Evaluación de la calidad metodológica de los estudios no aleatorizados según la escala MINOR (n=4)
| Estudio | 1 Objetivo claramente definido | 2 Inclusión de pacientes de forma consecutiva | 3 Información recogida de forma retrospectiva | 4 Valoraciones ajustadas al objetivo | 5 Valoraciones realizadas de manera neutral | 6 Fase de seguimiento consecuente con el objetivo | 7 Tasa de abandonos durante el seguimiento menor del 5% | 8 Estimación prospectiva del tamaño de la muestra | 9 Grupo control adecuado | 10 Grupos simultáneos | 11 Grupos homogéneos de partida | 12 Análisis estadístico apropiado | Score |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dos Reis-Neto et al.24 | 2 | 2 | 2 | 2 | 1 | 2 | 1 | 0 | 1 | 2 | 2 | 2 | 19/24 |
| Perandini et al.25 | 2 | 2 | 2 | 2 | 0 | 1 | 2 | 0 | 1 | 2 | 2 | 2 | 18/24 |
| Carvalho et al.26 | 1 | 1 | 2 | 2 | 0 | 2 | 1 | 0 | 2 | 2 | 2 | 2 | 17/24 |
| Bodganovic et al.27 | 1 | 1 | 2 | 2 | 0 | 1 | 2 | 0 | 0 | 2 | 0 | 2 | 13/24 |
Los ítems puntúan 0 (no informado), 1 (informado pero sin la claridad suficiente) y 2 (informado de manera clara y concisa).
En la tabla 3 se muestran las características de las intervenciones realizadas. Salvo una investigación realizada con niños19, la muestra del resto de los estudios estuvo formada por personas adultas, en su gran mayoría mujeres. La duración de las intervenciones varió entre 6 semanas27 y un año14, siendo 12 semanas el rango de tiempo más habitual para los programas de ejercicio. El tipo de intervención más común fue el ejercicio aeróbico, presente en todos los estudios analizados, bien como única intervención o combinado con fuerza18,20,23. Tan solo un trabajo comparó el ejercicio aeróbico con un grupo de intervención que realizaba fuerza15. Respecto al protocolo de los programas, la frecuencia de entrenamiento varió entre los 2 y los 5 días por semana, con una duración de la sesión de entre 1527 y 80min18,20. La adherencia al programa de ejercicio se detalló en 5 casos16,17,22–24. Dos estudios incluyeron fase de seguimiento tras la intervención17,23. Ninguna de las investigaciones que informaron de la existencia de abandonos, los consideraron consecuencia directa de la práctica de ejercicio físico.
Características y resultados de las investigaciones finalmente analizadas
| Autores (año) | Objetivo | Participantes | Intervención | Variables (test) | Resultados |
|---|---|---|---|---|---|
| Abrahão et al.15 (2015) | Evaluar y comparar la eficacia de un programa de EAS vs. EFS en la mejora de la calidad de vida y función física en pacientes con LES | Muestra: n=63 (97% mujeres) Distribución y edad: GI1: n=21 (43,8±14,6) GI2: n=21 (39,1±14,4) GC: n=21 (46,1±14,1) T diagnosticado (años): GI1: 4,9±4,3 GI2: 3,5±3,3 GC: 3,08±1,7 | Duración: 12 semanas GI1: EAS (caminar y bicicleta estática).Intensidad: 65-75% FCR.Volumen: 50min.Frecuencia: 3 días/semana GI2: EFS (peso libre y bandas elásticas).Intensidad: 65-75% 1 RM. Volumen y frecuencia ídem GI1 GC: mantener su actividad normal | Síntomas Calidad de vida (SF-36) Depresión (BDI) Actividad de la enfermedad SLEDAI Condición física CC (T12) | Adherencia: NE Abandonos en el grupo de intervención: 0 Cambios significativos tras la intervención: Intragrupo (pre-post) ↑Calidad de vida: GI1*; GI2* ↑SLEDAI: GC* ↑CC: GI1*; GI2*; GC* Intergrupos Calidad de vida: Rol físico (SF-36): ↑GI1* vs. GC; ↑GI1* vs. GI2 Vitalidad (SF-36): ↑GI1* vs. GC; ↑GI2* vs. GC Rol emocional (SF-36): ↑GI1* vs. GI2 CC: ↑GI1*vs. GC; ↑GI1* vs. GI2 |
| Daltroy et al.22 (1995) | Analizar la eficacia de un programa de ejercicio mínimamente supervisado y realizado en el hogar en pacientes con LES | Muestra: n=34 (93% mujeres) Distribución y edad: GI: n=16 (38,8±1,2) GC: n=18 (31,3±1,5) T diagnosticado (años): GI: 6,3±1,1 GC: 6,7±0,8 | Primera fase (12 semanas) GI: EAS domiciliario (bicicleta estática cedida). Intensidad: 60-80% FCM. Volumen: 30min. Frecuencia: 3 días/semana GC: mantener su actividad normal Segunda fase (12 semanas) GI: EANS domiciliario (bicicleta estática propia). Mismos parámetros que en la primera fase GC: mantener su actividad normal. | Síntomas Fatiga (POMS; MAC) Depresión (CES-D) Percepción de desamparo (HI) Actividad de la enfermedad SLAM Parámetros de laboratorio (TSE, creatinina, TSH, cortisol, lactato) Condición física Tolerancia al ejercicio (cicloergoespirometría) | Adherencia (sesiones/sem): GI (2,2±1,2); GC (2,2±1,1) Abandonos en el grupo de intervención: 5 Cambios significativos tras la intervención: Intragrupo (pre-post) No se encontraron cambios significativos Intergrupos No se encontraron cambios significativos |
| Robb-Nicholson et al.21 (1989) | Examinar los determinantes de la fatiga y evaluar los efectos del EANS en pacientes con LES | Muestra: n=23 (100% mujeres) Distribución y edad: GI: n=16 (40,9±9,8) GC: n=10 (38,3±10,9) T diagnosticado (años): GC: 6,25±4,43 GI: 8,7±4,62 | Duración: 8 semanas GI: EANS domiciliario (pedalear/caminar/ correr). Intensidad: 60-80% FCM Volumen: 30min. Frecuencia: 3 días/semana GC: estiramientos sin implicación aeróbica. Intensidad, volumen y frecuencia ídem GI | Síntomas Depresión (NIMH) Fatiga (POMS;VAS) Actividad de la enfermedad SLE-AI Parámetros de laboratorio (TSE, creatinina, hematocrito) Condición física Tolerancia al ejercicio (cicloergoespirometría) | Adherencia: NE Abandonos en el grupo de intervención: 2 Cambios significativos tras la intervención: Intragrupo (pre-post) ↓ Fatiga (VAS): GI* Intergrupo Tolerancia al ejercicio: ↑GI* vs. GC |
| Boström et al.14 (2016) | Evaluar el efecto de un programa combinado de EAS+EANS en la capacidad aeróbica, el nivel de AF y la calidad de vida en pacientes con LES | Muestra: n=27 (100% mujeres) Distribución y edad: GI: n=15 (52±10) GC: n=12 (53±9) T diagnosticado (años): GI: 15±9 GC: 21±14 | Primera fase (12 semanas) GI: EAS combinado de alta (65-80% FCM) y baja-moderada intensidad (45-60% FCM). Volumen:≥30min. Frecuencia: 2-3 días/semana para alta intensidad; 4-5 días/semana para baja-moderada intensidad GC: mantener su actividad normal Segunda fase (36 semanas) GI: EANS con idénticos parámetros de volumen, frecuencia e intensidad que en primera fase GC: mantener su actividad normal | Síntomas Calidad de vida (SF-36) Esfuerzo percibido (EB) Actividad de la enfermedad SLEDAI Condición física CC (cicloergoespirometría) Nivel de AF (cuestionario) | Adherencia: NE. Abandonos en el grupo de intervención: 3 Cambios significativos tras la intervención: Intragrupo (pre-post) Calidad de vida: ↑ Salud mental: GI** (0-6 meses) ↑ CC: GI**; GC** (0-6 meses) ↑ AF: GI**; GC** (0-12 meses) Intergrupos No se encontraron cambios significativos |
| Carvalho et al.26 (2005) | Determinar si el EAS provoca mejoras en la tolerancia al ejercicio, la capacidad aeróbica, la fatiga, la depresión, la capacidad funcional y la calidad de vida en pacientes con LES | Muestra: n=60 (100% mujeres) Distribución y edad: GI: n=41 (36,2±10,7) GC: n=19 (35,2±9,1) T diagnosticado (años): GI: 5,8±4,8 GC: 6,5±3,5 | Duración: 12 semanas GI: EAS (caminar). Intensidad: Uan. Volumen: 60min. Frecuencia: 3 días/semana. GC: mantener su actividad normal | Síntomas Dolor (VAS) Capacidad funcional (HAQ) Depresión (BDI) Fatiga (FSS) Calidad de vida (SF-36) Esfuerzo percibido (EB) Condición física CC (cicloergoespirometría) Tolerancia al ejercicio (ergoespirometría) | Adherencia: NE Abandonos en el grupo de intervención: 9 Cambios significativos tras la intervención: Intragrupo (pre-post) ↑ Capacidad funcional: GI** ↓ Depresión: GI** ↑ CC: GI** ↑ Tolerancia al ejercicio: GI** Intergrupos Capacidad funcional: ↑GI* |
| Avaux et al.23 (2016) | Comparar un programa hospitalario de ejercicio físico supervisado con un programa de ejercicio físico no supervisado realizado en casa en pacientes con LES | Muestra: n=29 (93% mujeres) Distribución y edad: GI1: n=18 (43±7) GI2: n=15 (37±7) GC: n=9 (46±11) T diagnosticado (años): GI1:16±10 GI2:12±7 GC:16±10 | Intervención (12 semanas) GI1: EAS (caminar o bici)+EFS (bandas elásticas y pesos libres) en el hospital Intensidad: 60-80% FCM para EAS. NE para ESF. Volumen: 60min. Frecuencia: 3h/semana GI2: EANS+EFNS en casa, con idénticos parámetros a GI1 GC: mantener su actividad normal Seguimiento (28 semanas) Se animó a los participantes a continuar con el programa de entrenamiento por su cuenta | Síntomas Fatiga (FSS) Esfuerzo percibido (EBM) Condición física Capacidad de trabajo (cicloergómetro PWC75%) | Adherencia: aproximadamente el 50%. Abandonos en el grupo de intervención: GI1 (5); GI2 (5) Cambios significativos tras la intervención: Intragrupo (pre-post) ↓ Fatiga: GI1**; GI2** (0-3 meses) Intergrupos No se encontraron cambios significativos Seguimiento: ↓ Fatiga: GI1**; GI2* (0-9 meses) |
| Perandini et al.25 (2014) | Investigar los efectos de un programa de EAS en las citocinas y su respuesta a periodos cortos de ejercicio agudo en mujeres sedentarias con LES | Muestra: n=18 (100% mujeres) Distribución y edad: GI: n=8 (35±6,5) GC: n=10 (30,6±5,2) T diagnosticado (años): GI: 11,6±6,4 GC: sanos | Duración: 12 semanas GI: EAS (caminar en cinta ergométrica) Intensidad: entre el Uan y 10%<PCR Volumen: 40-60min Frecuencia: 2 días/semana GC: mantener su actividad normal | Síntomas Calidad de vida (SF-36) Fatiga (FSS) Actividad de la enfermedad Biomarcadores (IFN-γ; IL-10; IL-6; TNF-α; sTNFR1; sTNFR2) Parámetros de laboratorio (CPR;C3;C4;CPK,TSE…) SLEDAI Condición física CC (cicloergoespirometría) | Adherencia: NE Abandonos en el grupo de intervención: 0 Cambios significativos tras la intervención: Intragrupo (pre-post) ↓ Fatiga: GI1* ↓ sTNFR1: GI1* Calidad de vida: Evaluación inicial: diferencias GI vs. GC (p<0,05) Evaluación final: diferencias GI vs. GCS (p>0,05) CC: Evaluación inicial: diferencias GI vs. GC (p<0,05) Evaluación final: diferencias GI vs. GCS (p>0,05) |
| Prado et al.19 (2013) | Evaluar la seguridad y eficacia de un programa de EAS en la mejora de la capacidad cardiorrespiratoria en pacientes con LES de inicio temprano | Muestra: n=29 (género NE) Distribución y edad: GI1: n=10 (12,9±2,3) GCL: n=9 (13±1,8) GCS: n=10 (12±1,8) T diagnosticado (años): GI1: 3,3±2,6 GCL: 4,3±2,6 GCS: sanos | Duración: 12 semanas GI: EAS (caminar/correr en cinta) Intensidad: [(Uan)−(10%<PCR)] Volumen: 30-80min. Frecuencia: 2 días/semana GCL: sin entrenamiento GCS: mantener su actividad normal | Actividad de la enfermedad Parámetros de laboratorio (TSE, CPR, C3,C4, anti-dsDNA) (DMO; AO) SLEDAI; SLICC/ACR-DI Condición física CC (ergometría en tapiz) Respuesta FC al ejercicio (ergometría en tapiz) Composición corporal (IMC) | Adherencia: NE Abandonos en el grupo de intervención: 1 Cambios significativos tras la intervención: Intragrupo (pre-post) ↑ CC: GI* ↑ Respuesta FC al ejercicio: GI* Intergrupos CC: ↑GI* vs. GCL Respuesta FC al ejercicio: ↑GI* vs. GCL Evaluación inicial: diferencias GI vs. GCS (p<0,05) Evaluación final: diferencias GI vs. GCS (p>0,05) Seguimiento: No |
| Tench et al.17 (2003) | Comprobar la eficacia de un programa de EANS gradual en el tratamiento de la fatiga en pacientes con LES | Muestra: n=82 (100% mujeres) Distribución y edad: Edad: 39±0,8 GI1: n=27 GI2: n=25 GC: n=31 T diagnosticado (años): Media: 2,5 (0,8-7) | Intervención (12 semanas) GI1: EANS domiciliario (caminar, bicicleta o nadar). Una sesión supervisada cada 2 semanas. Intensidad: FC al 60% de VO2 pico. Volumen: 30-50min. Frecuencia: 3 días o más/semana GI2: Ejercicios de relajación sin supervisión. 1 sesión supervisada cada 2 semanas. Ídem parámetros que GI1 GC: mantener su actividad normal Seguimiento (12 semanas) GI1 y GI2: se les animó a continuar con el programa de entrenamiento por su cuenta | Síntomas Fatiga (FSS;CFS; VAS) Calidad del sueño (PSQI) Calidad de vida (SF-36) Ansiedad/depresión (HAD) Autopercepción clínica (SRCGICS) Actividad de la enfermedad SLAM; SLICC/ACR-DI Condición física CC (ergoespirometría en tapiz) Composición corporal (IMC) | Adherencia: fase i (60%); fase ii (47,9%) Abandonos en el grupo de intervención: 10 Cambios significativos tras la intervención: Intragrupo (pre-post) No se encontraron cambios significativos Intergrupos Fatiga (CFS): ↓GI1* vs. GC CC: Duración del test: ↑GI1* vs. GI2; ↑GI1* vs. GC Autopercepción clínica: ↑GI1* vs. GI2; ↑GI1* vs. GC Seguimiento: Fatiga (VAS, CFS): ↓GI1* vs. GI2; ↓GI1* vs. GC Calidad de vida: Vitalidad: ↑GI1* vs. GC Rol físico: ↑GI1* vs. GI2; ↑GI1* vs. GC |
| Bogdanovic et al.27 (2015) | Determinar qué forma de AF mejora la calidad de vida de los pacientes con LES | Muestra: n=60 (100% mujeres) Distribución y edad: GI1: n=30 (38,8±12,6) GI2: n=30 (47,9±11,5) T diagnosticado (años): GI1: 5,5±4,1 GI2: 7,5±6,9 | Duración: 6 semanas GI1: EAS (cicloergómetro) Intensidad: NE. Volumen: 15min. Frecuencia: 3 días/semana GI2: EFS y flexibilidad. Intensidad: NE. Volumen: 30min. Frecuencia: 3 días/semana | Síntomas Calidad de vida (SF-36) Fatiga (FSS) Depresión (BDI) | Adherencia: NE Abandonos en el grupo de intervención: 0 Cambios significativos tras la intervención: Intragrupo (pre-post) ↑ Calidad de vida: GI1**; GI2** ↓ Fatiga: GI1**; GI2** ↓ Depresión: GI1**;GI2** Intergrupos Calidad de Vida: Dolor: ↓GI1* vs. GI2 Salud general: ↑GI1* vs. GI2 Salud mental: ↑GI1* vs. GI2 |
| Dos Reis-Neto et al.24 (2013) | Evaluar el efecto de un programa de EAS en la función endotelial, las variables ergoespirométricas y la actividad de la enfermedad en personas con LES | Muestra: n=38 (100% mujeres) Distribución y edad: GI: n=18 (35,3±6,8) GC: n=20 (30,8±7,2) T diagnosticado (años): GI: 6,6±5,4 GC:8,9±7,6 | Duración: 16 semanas GI: EAS (caminar en parque público) Intensidad: Uan Volumen: 60 min Frecuencia: 3 días/semana GC: mantener su actividad normal | Síntomas Función endotelial (FMD) Actividad de la enfermedad SLEDAI Condición física CC (ergoespirometría en tapiz) Tolerancia al ejercicio (ergoespirometría en tapiz) | Adherencia: GI=≥75% Abandonos en el grupo de intervención: 5 Cambios significativos tras la intervención: Intragrupo (pre-post) Función endotelial: ↑FMD, mm: GI1** ↑FMD, %: GI1** ↑CC: ↑Velocidad máxima: GI1** ↑Velocidad Uan: GI1** ↑Tolerancia al ejercicio: GI1** |
| Benatti, et al.20 (2015) | Evaluar los efectos de un programa de ejercicio físico en el perfil lipídico en pacientes con LES | Muestra: n=44 (100% mujeres) Distribución y edad: GI: n=17 (31,3±5,9) GCL: n=16 (29,7±5,3) GCS: n=11(30,9±7,2) T diagnosticado (años): GI: 6,1±3 GCL: 6,1±4,8 GCS: sanos | Duración: 12 semanas GI: EAS (en tapiz rodante) y EFS. Intensidad: EAS=FC[(Uan)−(10%<PCR)] EFS=RM. Volumen: 5¿ calentamiento en tapiz rodante, 35-40min EFS+30min ESA Frecuencia: 2 días/semana GCL: sin entrenamiento físico GCS: EAS (en tapiz rodante) y EFS ídem GI | Actividad de la enfermedad Perfil lipídico Composición de HDL Nivel sérico (glucosa, insulina) | Adherencia: NE Abandonos en el grupo de intervención: 7 Cambios significativos tras la intervención: Intragrupo (pre-post) Perfil lipídico ↑Colesterol total: GCL* ↑Triglicéridos: GCL* ↑Fosfolípidos en HDL2: GCL* Intergrupos Fosfolípidos en HDL2: ↑GI* vs. GCL |
| Miossi et al.18 (2012) | Evaluar el efecto del ejercicio sobre la reserva cronotrópica y la recuperación tras esfuerzo en pacientes con LES | Muestra: n=32 (100% mujeres) Distribución y edad: GI: n=14 (31,4±5,9) GCL: n=10 (31±4,8) GCS: n=8 (30±8,3) T diagnosticado (años): GI: 6,1 GCL: 6,4 GCS: sanos | Duración: 12 semanas GI: EFS (peso libre, autocarga y máquinas de poleas) y EAS (en tapiz rodante). Intensidad: EFS=RM; EAS=FC[(Uan)−(10%<PCR)]. Volumen: 35-40min EFS; 30min EAS. Frecuencia: 2 días/semana (igual ambos grupos) GCL: mantener su actividad normal GCS: mantener su actividad normal | Actividad de la enfermedad Niveles plasmáticos (C3, C4, aldolasa, ácido úrico, CK, CRP) SLEDAI Condición física Reserva cronotrópica (ergoespirometría en tapiz) Recuperación tras esfuerzo (ergoespirometría en tapiz) | Adherencia: NE Abandonos en el grupo de intervención: 6 Cambios significativos tras la intervención: Intragrupo (pre-post) Condición física ↑Reserva cronotrópica: GI* ↑Recuperación tras esfuerzo: GI* Intergrupos Reserva cronotrópica: ↑GI* vs. GCL Recuperación tras esfuerzo: ↑GI* vs. GCL |
| Ramsey-Goldman et al.16 (2000) | Evaluar el rol del ejercicio como intervención específica para mejorar los niveles de fatiga y status funcional en pacientes con LES | Muestra: n=10 (100% mujeres) Distribución y edad: GI1: n=5 (33,9) GI2: n=5 (43,2) T diagnosticado (años): GI1: 2,6 (0,5-8) GI2:14,4 (0,3–24,4) | Primera fase (8 semanas) GI1: EAS (cualquier tipo de ejercicio) Intensidad: 70-80% FCM. Volumen: 30-50min. Frecuencia: 3 días/semana GI2: movilidad articular. Intensidad: NE Volumen: 50min. Frecuencia: 3 días/semana. Segunda fase (28 semanas) GI1: EANS (cualquier tipo de ejercicio). Se recomendó mismo protocolo que fase 1 GI2: Movilidad articular y ejercicios de fortalecimiento. Intensidad: NE. Volumen: 2-3 seriesx10 rpts; ejercicios isotónicos. Duración: 40min. Frecuencia: 3 días/semana | Síntomas Fatiga (FSS) Calidad de vida (SF-36) Actividad de la enfermedad Densidad mineral ósea (DMO; biomarcadores óseos) SLEDAI Condición física Fitness cardiovascular (tapiz rodante) Fuerza muscular (prueba isométrica) | Adherencia: 80% en ambos grupos de intervención Abandonos en el grupo de intervención: 0 Cambios significativos tras la intervención: Ninguno |
AF: actividad física; AO: área ósea; Anti-dsADN: autoanticuerpos antinucleares; BDI: Beck Depression Inventory Questionnaire; CC: capacidad cardiorrespiratoria; CES-D: Centers for Epidemiological Studies Depression Scale; CFS: Chalder Fatigue Scale; CPR: proteína C-reactiva; C3, C4: proteínas del sistema de complemento; DMO: densidad mineral ósea; EANS: entrenamiento aeróbico no supervisado; EAS: entrenamiento aeróbico supervisado; EB: Escala de Borg; EBM: Escala de Borg modificada; EFS: entrenamiento de fuerza supervisado; FCM: frecuencia cardiaca máxima; FCR: frecuencia cardiaca de reserva; FSS: Fatigue Severity Scale; GC: grupo control; GCL: grupo control de pacientes con LES; GCS: grupo control de sujetos sanos; GI: grupo intervención; HAD: Hospital Anxiety and Depression Scale; HAQ: Health Assessment Questionnaire; HDL: lipoproteína de alta densidad; HI: Helplessness Index; IL-6: interleucina-6; IL-10: interleucina-10; IMC: índice de masa corporal; LES: lupus eritematoso sistémico; MFS: MAC Fatigue Scale; NE: no especificado; NIMH: National Institute of Mental Health Depression Scale; PCR: punto de compensación respiratoria; POMS: Profile of Mood States; PSQI: Pittsburg Sleep Quality Index; PWC75%: medida de capacidad física de trabajo al 75% frecuencia cardíaca máxima teórica; RM: repetición máxima; SF-36: Short Form Health Survey; SLAM: Systemic Lupus Activity Measure; SLE-AI: Systemic Lupus Erythematosus Disease Activity Index modified; SLEDAI: Systemic Lupus Erythematosus Disease Activity Index; SLICC/ACR: Systemic Lupus International Collaborating Clinics/ACR Damage Index; SRCGICS: Self-Rated Clinical Global Impression Change Score; sTNFR: receptor soluble del factor de necrosis tumoral; TNFR: receptor del factor de necrosis tumoral; TSE: tasa de sedimentación eritrocítica; TSH: hormona estimulante de la tiroides; T12: tiempo en el 12min walk test; Uan: umbral anaeróbico; VAS: Visual Analogue Scale; VO2: consumo de oxígeno.
*p<0,05.
**p<0,001.
Once estudios analizaron los efectos del ejercicio físico en los síntomas de las personas con LES14–17,21–27. La fatiga fue el síntoma más frecuentemente valorado, incluyéndose como variable de estudio en 8 investigaciones16,17,21–23,25–27. En 5 de ellas se observaron mejoras significativas en este síntoma tras el programa de ejercicio físico realizado17,21,23,25,27. Siete investigaciones analizaron el efecto del ejercicio físico en la CdV14–16,16,17,25,26, encontrando 4 de ellos cambios significativos al respecto14,15,17,27. La depresión fue el tercer síntoma más estudiado, siendo incluida en un total de 6 estudios15,17,21,22,26,27, observándose cambios significativos derivados de la práctica de ejercicio físico en 2 investigaciones26,27. El efecto del ejercicio sobre el esfuerzo percibido fue analizado en 3 estudios14,23,26, no reportando ninguno de ellos modificaciones significativas al respecto. En el estudio de Tench et al.17, la práctica de ejercicio resultó en cambio significativo en la autopercepción clínica del impacto de la enfermedad reportada por las personas con LES, pero no así en la calidad de su sueño. En la investigación de Carvalho et al.26 se observaron cambios significativos en la capacidad funcional reportada por las personas con LES, pero no en su nivel de dolor percibido. El impacto del ejercicio físico sobre la función endotelial fue analizado en un estudio24, encontrándose cambios significativos en la misma. Un total de 11 investigaciones analizaron el efecto del ejercicio sobre la actividad de la enfermedad14–22,24,25. En 9 se emplearon índices de valoración de la actividad lúpica14–19,21,22,24,25, y en 5 parámetros de laboratorio19–22,24,25, no observándose cambios significativos como resultado de la práctica de ejercicio en ninguno de ellos. La práctica de ejercicio físico no conllevó cambios significativos en el nivel plasmático18, sérico20, área16 y densidad mineral ósea19. Dos investigaciones encontraron un impacto significativo del ejercicio en el perfil lipídico20 y en la concentración del receptor soluble del factor de necrosis tumoral25.
El efecto del ejercicio físico sobre la condición física de las personas con LES fue analizado en 12 investigaciones14–19,21–26. Ocho valoraron el impacto de su práctica en la capacidad cardiorrespiratoria14,15,17,19,24,26, encontrando 6 trabajos cambios significativos en la misma14,15,17,19,24,26. La tolerancia al ejercicio mostró cambios positivos en dos24–26, de las 4 investigaciones en las que se incluyó como objeto de estudio21,22,24–26. Dos investigaciones analizaron el efecto del ejercicio sobre el índice de masa corporal17–19, no reportando ninguna la existencia de cambios significativos al respecto. No se encontraron cambios significativos tras la práctica de ejercicio físico ni en la capacidad de trabajo23 ni en la fuerza16, pero sí en la respuesta de la FC ante el ejercicio19, la recuperación tras esfuerzo y reserva cronotrópica18.
DiscusiónEsta revisión sistemática trató de aportar información sobre la factibilidad y los beneficios potenciales que la práctica de ejercicio físico tiene en personas con LES. Los resultados obtenidos pueden ser de utilidad para aquellos profesionales de la salud que se encuentren ante la responsabilidad de prescribir y pautar ejercicio físico en esta población. A juzgar por el número y características de las investigaciones localizadas y atendiendo especialmente al diseño metodológico de las mismas, se puede decir que la calidad de la evidencia científica al respecto del efecto de la práctica de ejercicio físico en personas con LES no es elevada. Esto es debido tanto al número de investigaciones que obtuvieron una puntuación baja en la escala PEDro como al valor de la mediana resultante de su aplicación. Sin embargo, del análisis de los estudios localizados y de sus características se han podido extraer hallazgos de interés. Así, por ejemplo, un primer aspecto relevante que se pone de manifiesto en esta revisión es el hecho de que la práctica de ejercicio físico es factible y es tolerada por personas con LES. Si bien recientes estudios han indicado que la actividad de la enfermedad no se ve afectada por la realización de sesiones aisladas de ejercicio físico intenso28, de cara a la adquisición de su práctica como un hábito de salud guarda un mayor interés el averiguar si este tipo de pacientes no padecen exacerbaciones o complicaciones como resultado de su participación en programas de entrenamiento. A este respecto, en ninguno de los estudios analizados se informaron de abandonos a causa de los efectos de la realización de ejercicio físico, por lo que se puede afirmar que su práctica es segura. De todos modos, conviene resaltar que a pesar de la dificultad que entraña el seguir un programa de ejercicio físico, es poca la información aportada sobre los porcentajes de adherencia a los mismos. A esto hay que añadir que no abundan los estudios que incluyen fase de seguimiento o que informan sobre si los participantes han continuado ejercitándose de manera autónoma. Este es un aspecto fundamental, dado que por lo general las investigaciones sobre los efectos del ejercicio físico se desarrollan en un entorno específico (laboratorio, gimnasio, centro deportivo, etc.), tienen una duración corta y cuentan con supervisión y monitorización por parte de un profesional, características que cumplen la gran mayoría de los estudios localizados en la presente revisión. Sin embargo, lo verdaderamente interesante en el ámbito de la rehabilitación física es observar si el paciente, tras un periodo de aprendizaje, es capaz de ejercitarse de manera autónoma e incluir su práctica como un hábito29. Con relación a esto, atendiendo a los resultados de los 2 estudios que contaron con fase de seguimiento17,23 y de la investigación de Boström et al.14 que incluyó un periodo de baja supervisión, parece que sí es factible que las personas con LES adquieran un estilo de vida más activo tras participar previamente en un programa de entrenamiento, si bien son necesarios más estudios al respecto. Con relación al tipo de ejercicio a prescribir, la evidencia científica existente se ciñe básicamente a modalidades aeróbicas «clásicas» (principalmente caminar o pedalear) y al entrenamiento de fuerza-resistencia muscular, siendo, en comparación, los efectos de este último de menor magnitud15. Por lo tanto, un hecho a reseñar es la ausencia de investigaciones que hayan analizado la factibilidad y efectos beneficiosos de modalidades deportivas alternativas que por lo general se proponen en enfermedades de especial prevalencia en mujeres, al objeto de facilitar la adherencia hacia su práctica, como es el caso de aerobic o pilates, o incluso el ejercicio en agua, entre otras30. Con relación a esto, conviene resaltar que en una primera búsqueda si se encontró una investigación sobre la utilidad de la Wii-fit en mujeres con LES, que fue descartada por ser un estudio piloto con un único grupo de pacientes en su diseño31. Se hacen necesarios más estudios de este tipo, ya no solo por el interés de testar la efectividad de programas de ejercicio físico alternativos, sino porque también permiten valorar la factibilidad y los beneficios potenciales de la realización de ejercicio en el hogar, aspecto que ha sido poco investigado en lo que a la población objeto de estudio se refiere.
Otro de los resultados de interés extraídos de la presente revisión es que la actividad del LES no se ve afectada por la práctica de ejercicio físico. Por lo tanto, su prescripción no es útil en este sentido. En esta línea, una vez analizados los estudios incluidos en este trabajo, tampoco se puede afirmar que la práctica de ejercicio físico se traduzca en mejoras en los principales síntomas que acompañan al LES, a excepción del nivel de fatiga percibido, que sí parece experimentar una reducción significativa. Este efecto podría ser una consecuencia directa de la existencia de mejoras en la condición física, dado que algunos autores han sugerido que el bajo nivel de forma física que presenta esta población incrementa la magnitud de este síntoma32. Sin embargo, otros investigadores han observado que este impacto positivo del ejercicio no se puede basar únicamente en la mejora condicional, sino que debe de haber otros factores involucrados23. A este respecto, conviene mencionar que la fatiga es uno de los principales síntomas que presentan las personas con LES y que más afecta a su CdV33, variable que se vio influenciada positivamente por la práctica de ejercicio físico en varios de los estudios localizados.
A juzgar por los resultados encontrados en las investigaciones finalmente analizadas, es muy probable que la prescripción de ejercicio físico en personas con LES resulte en mejoras en su nivel de forma física. En cierto modo este efecto se puede considerar como lógico y esperado, dado que esta población se caracteriza por presentar un bajo nivel tanto condicional7 como de práctica de actividad física34, lo que supone que también tengan un bajo umbral de mejora de entrenamiento. Como consecuencia de esta mejora condicional, si bien la actividad de la enfermedad y varios de los síntomas relacionados con la misma no experimentarán cambios significativos, es esperable que las personas con LES convivan mejora con su enfermedad a expensas de una reducción en su nivel de fatiga percibida y de un incremento en su forma física. Ambos aspectos ejercen una influencia directa tanto sobre la manera con la que la persona con LES pueden afrontar su día a día como sobre su nivel de independencia.
La realización de revisiones sistemáticas presenta por lo general ciertas limitaciones que deben ser tenidas en cuenta a la hora de interpretar sus hallazgos35. Una de las mismas se refiere a la existencia de un sesgo en la selección de las investigaciones, que pudiera ser debido a que los autores del trabajo conozcan de antemano algunos de los estudios a identificar y realicen un juicio «a priorístico» sobre la calidad de los mismos. Por otro lado, se debe tener también en cuenta el sesgo de publicación que indica que por lo general es mucho más probable que las investigaciones que aportan resultados significativos, y en cierto modo esperados, sean aceptadas para su publicación en las principales revistas científicas. A este respecto, conviene mencionar que la persona que realizó la búsqueda de investigaciones no tenía experiencia previa en el campo del LES y el ejercicio físico, y que varios de los estudios seleccionados no reportaron mejoras significativas en algunas de las variables testadas una vez finalizada la intervención, por lo que el impacto de las mencionadas limitaciones puede ser considerado como reducido.
Sin embargo, debe reconocerse que, aunque inicialmente el principal interés de este trabajo de investigación radicaba en la ausencia de revisiones sistemáticas sobre la relación entre ejercicio físico y LES, durante su redacción se publicaron 2 trabajos que deben ser tenidos en consideración, pues comparten temática de estudio y por lo tanto afectan a la originalidad de la presente revisión. Así, por un lado, Wu et al.9, y por otro O’Dwyer et al.36 realizaron sendas revisiones sistemáticas con metaanálisis, si bien los primeros se centraron únicamente en los efectos del ejercicio en la fatiga, y los segundos incluyeron un total de 11 investigaciones para ser analizadas en profundidad, frente a las 14 seleccionadas en el presente estudio. Por lo tanto, se puede considerar que la información aquí presentada al respecto de las características de los programas de intervención y sus efectos sobre la actividad, síntomas de la enfermedad y condición física de las personas con LES es más completa.
ConclusiónLa prescripción de ejercicio físico en personas con LES es factible y segura, siendo la actividad aeróbica la principal opción a aconsejar, a juzgar por la evidencia científica al respecto. De su práctica no son esperables cambios ni en la actividad de la enfermedad, ni en gran parte de los síntomas que esta población refiere. Sin embargo, sus efectos sobre el nivel de fatiga percibida y de forma física pueden propiciar que las personas con LES convivan mejor con su enfermedad.
FinanciaciónNo existe financiación por parte de ninguna institución pública o privada.
Conflicto de interesesTodos los autores declaran ausencia de conflicto de intereses.
Los autores de este trabajo agradecen la colaboración prestada por la Dra. Silvia Varela Martínez.