Aproximadamente 45% de los pacientes establecidos con falla cardiaca tuvieron una insuficiencia de hierro (ID) durante el resto de su vida.
ObjetivoDeterminar el efecto del tratamiento de hierro en pacientes con insuficiencia cardiaca (IC) e ID o anemia.
Materiales y métodosLos estudios fueron seleccionados en PubMed, Scopus, Cochrane y Google Académico, desde el inicio de junio hasta julio 2023. Los artículos escogidos que cumplieron con los criterios de inclusión, recopilaron la información relevante de las investigaciones según las variables de selección y se registraron en el programa Revman 5.0 de la colaboración Cochrane. El desenlace primario fue compuesto por hospitalización de falla cardiaca o muerte cardiovascular.
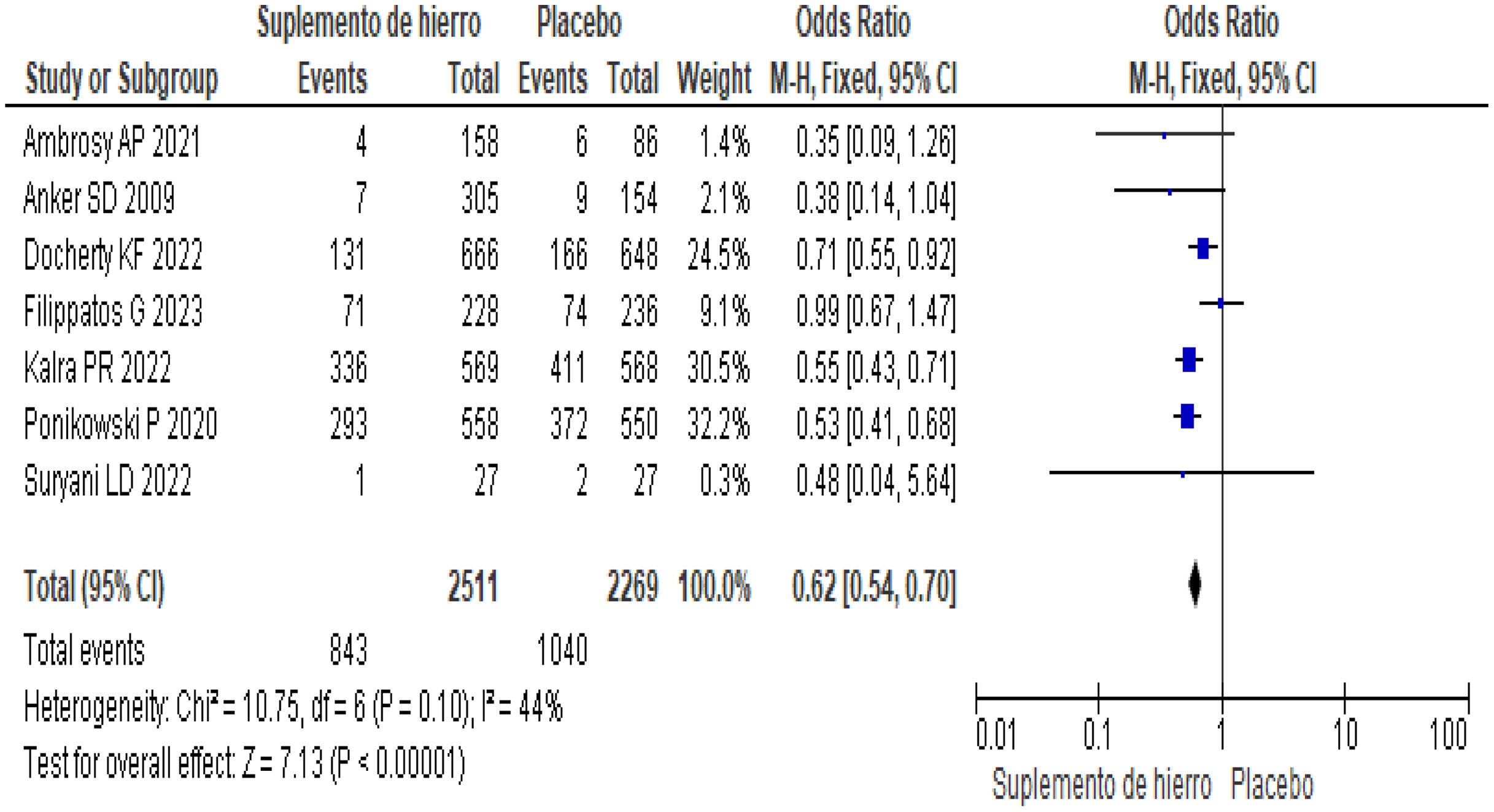
ResultadosDe los siete estudios incluidos, se obtuvo un total de 6.717 pacientes, la edad promedio fue 70, con predominio del género masculino (57%). El desenlace primario fue menor en los del grupo control, respecto al placebo (odds ratio [OR] 0,62; intervalo de confianza [IC] 95%, 0,54-0,70). La prueba de caminata durante los 6 min (6-MWT) mejoró en el grupo de suplemento de hierro comparado al placebo (OR, 0,79; IC 95%, 0,64-0,98). Los eventos adversos fueron menores en el de suplemento de hierro vs. grupo placebo (OR, 0,78; IC 95%, 0,67-0,91).
ConclusiónEn este metaanálisis de ensayos controlados aleatorizados (ECA), se demostró que el efecto del suplemento de hierro redujo la tasa de incidencia de hospitalización de falla cardiaca o muerte cardiovascular. Además, de una reducción de eventos adversos, como desordenes gastrointestinales y neurológicos, también de mejorar la 6-MWT.
Approximately 45% of patients with heart failure had iron deficiency for the rest of their lives.
ObjectiveTo determine the effect of iron treatment in patients with heart failure and iron deficiency or anemia.
Materials and MethodsThe studies were selected in: PubMed, Scopus, Cochrane and Google Scholar, from the beginning of June to July 2023. The selected articles that met the inclusion criteria, the relevant information of the studies were collected according to the selection variables and were recorded in the Revman 5.0 program of the Cochrane collaboration. The primary outcome was composed of hospitalization for heart failure or cardiovascular death.
ResultsOf the 7 included studies, 6717 patients were obtained, the average age was 70 years with a predominance of the male gender (57%). The primary outcome was lower in patients in the control group compared to the placebo group (OR, 0.62; 95%CI, 0.54-0.70). The 6-minute walk test (6-MWT) was improved in the iron-supplemented group compared to the placebo group (OR, 0.79; 95%CI, 0.64-0.98). Adverse events were fewer in the iron supplement group compared to the placebo group (OR, 0.78; 95%CI, 0.67-0.91).
ConclusionIn this meta-analysis of randomized controlled trials, the effect of iron supplementation is found to reduce the incidence rate of hospitalization for heart failure or cardiovascular death. In addition to a reduction in adverse events, such as gastrointestinal and neurological disorders, it also improves 6-MWT.
La insuficiencia cardiaca (IC) es un síndrome incapacitante crónico asociado a una baja calidad de vida y una corta longevidad; puede ser descrito como una condición maligna debido a un pobre pronóstico de vida1. Además, su prevalencia fue de 10 a 15% en las personas mayores de 65 años con IC y resulta en una alta mortalidad, así como carga social2. Aproximadamente 45% de las personas establecidas con IC tuvieron una insuficiencia de hierro (ID) o anemia durante el resto de su vida, lo cual es un factor de riesgo independiente para quienes tienen IC3. La ID reduce la capacidad funcional, perjudica la calidad de vida e incrementa la tasa de rehospitalización al igual que el costo de economía de los usuarios con IC4,5. Por lo tanto, el impacto del tratamiento de hierro sobre pacientes con IC e ID o anemia leve y moderada puede ser un problema frecuente en aquellos con IC, además de que compromete su pronóstico6.
El suplemento de hierro es una mejor opción para pacientes con IC y anemia. En varios ensayos controlados aleatorizados (ECA), se demostró que el tratamiento de hierro endovenoso contribuye a un incremento de biodisponibilidad de hierro y la capacidad de ejercicio, así como a una disminución de usuarios rehospitalizados7,8. Sin embargo, este tipo de terapia es costosa e inconveniente en aquellos no hospitalizados, especialmente en los tienen limitados recursos en salud primaria9,10. Por otra parte, el método oral es cada vez más validado, económico y accesible en los establecimientos de salud de atención primaria. Es por eso que a menudo los ECA lo recomiendan en personas con ID en IC, además de que las complicaciones del endovenoso son mayores con respecto al oral11,12. No obstante, la seguridad de la medicación de hierro oral aún está por ser establecida, debido a los efectos adversos gastrointestinales que producen al usuario con IC. Algunos ECA demostraron resultados inconsistentes en la medicación de hierro por vía oral en quienes padecen anemia modera a severa, además de la falla del alza del pico de consumo de volumen de oxígeno (VO2) y el estudio de la distancia en la caminata en los 6 min (6-MWT) comparado con el grupo placebo. Mientras en otras investigaciones, se demostró que el realizado por vía endovenosa mejora la función cardiaca13–16, siendo esta la primera línea de tratamiento en la IC. También se debe considerar que la ID tuvo implicaciones en el desarrollo de otros procedimientos en IC como, por ejemplo, los inhibidores de cotransportador de sodio-glucosa 2 (ISGLT-2), que mostraron un incremento del hematocrito y hemoglobina (Hb), por lo tanto, asegura una adecuada y correcta corrección, gracias al reflejo de la contracción del volumen circulante del cuerpo por la diuresis y estimulando la eritropoyesis5,15. Es por ello que se realizará un metaanálisis para determinar el efecto de la terapia de hierro en pacientes con IC e ID o anemia.
Materiales y métodosBúsqueda estratégicaLos estudios fueron seleccionados en relación con a una revisión sistemática de la literatura en las bases de datos PubMed, Scopus, Cochrane y Google Académico, desde el inicio de junio de 2023 hasta julio 2023 usando los siguientes términos de búsqueda: «ion hierro oral», «falla cardiaca», «ion hierro sérico» y «tratamiento». El investigador, H. Mejía-Zambrano, analizó de manera individual el título, resumen y contenido de cada uno de los estudios, además de los resultados.
Criterios de elegibilidadUsando el modelo de pregunta, intervención, comparación y resultados (PICO)17, se reunieron los ECA que juntaron los criterios considerados en la inclusión en el metaanálisis. Estos fueron a) todos los estadios sintomáticos de IC (New York Heart Association [NYHA] clases II–IV, con fracción de eyección del ventrículo izquierdo (LVEF) < 50%) con ID o anemia, b) pacientes ≥ 18 años, c) tratamiento de hierro oral en pacientes con IC, d) tratamiento de hierro endovenoso en usuarios con IC y e) ECA. Los criterios de exclusión fueron los siguientes: a) estudios similares sobre otras enfermedades no cardiacas, b) pacientes con IC que tuvieron cuadros de septicemia, c) pacientes que recibieron eritropoyetina, d) otros tipos de estudios como, metaanálisis, revisión sistemática, estudios descriptivos, estudios analíticos o textos completos no disponibles en alguna base de datos.
Selección de estudiosSe utilizó el programa Mendeley Desktop, para encontrar estudios duplicados y realizar el proceso de recopilación. Por lo tanto, todos los artículos relevantes fueron buscados, elegidos y contaban con acceso al texto completo. La información de todos cumplió con el criterio de selección y con el objetivo de obtener manuscritos con características similares como, por ejemplo, el objeto y la población de estudio, la metodología o diseño de investigación, tamaño de la muestra, mediciones de los outcomes, etc. Se empleó el programa estadístico Microsoft Excel 2016, para el registro de datos relevantes. Este informe de revisión sistemática se realizó siguiendo el protocolo Preferred Reporting Items for Systematic reviews and Meta-Analyses (PRISMA) 202018 (Suplemento 01).
Extracción de datosPor lo tanto, de los artículos seleccionados que cumplieron con los criterios de inclusión, H. Mejía-Zambrano recopiló la información relevante de los estudios según las variables de selección y se registraron en el programa Revman 5.0 de la colaboración Cochrane. Los datos obtenidos fueron autor, año, país, estudio designado, población de estudio, fracción de eyección, tiempo de seguimiento, drogas, dosis, ID y evaluación de resultados.
Evaluación de la calidad de estudioH. Mejía-Zambrano evaluó el riesgo de sesgo de los ECA y doble ciego, clasificando cada ítem de la herramienta Risk of bias 2 (RoB 2) de la colaboración Cochrane de manera individual como bajo, algunas preocupaciones y alto riesgo de sesgo, de acuerdo con los criterios que el manual Cochrane sugiere para revisiones sistemáticas de intervenciones (fig. 1)19.
Mediciones de resultadosEl desenlace primario estuvo compuesto de hospitalización por IC o muerte cardiovascular. Un episodio de empeoramiento de IC responde a una motivación de una visita urgente de emergencia, lo que da como resultado una terapia intravenosa para falla cardiaca. El desenlace secundario fue compuesto por primera hospitalización por IC o cardiovascular o primera admisión por muerte cardiovascular. Además de eventos adversos de las diferentes vías de tratamiento de hierro en pacientes con IC y 6-MWT.
Análisis estadísticoSe utilizó Review Manager versión 5.4, para realizar el análisis estadístico. La heterogeneidad se definió como significativa cuando el valor de p era < 0,10 o I2 > 50% (18). Se utilizó el modelo de efectos fijos cuando los datos eran homogéneos y el de efectos aleatorios cuando eran heterogéneos. Se calcularon el odds ratio (OR) agrupado y el intervalo de confianza (IC) de 95% para el análisis de resultados. La significación de las proporciones agrupadas se determinó mediante la prueba Z y un valor de p < 0,05 se consideró estadísticamente significativo.
ResultadosCaracterísticas de los estudiosSe buscó un total de 140 artículos relevantes a través de la estrategia de recuperación, donde se excluyeron 67 repetidos y se revisaron los 73 resúmenes restantes. Más tarde, también se dejaron fuera los 66 estudios que no eran ECA, farmacocinéticos, prueba de susceptibilidad in vitro o experimentales en animales. Finalmente, se incluyeron en este metaanálisis siete (fig. 1)20–26. Todos los artículos seleccionados fueron ECA, porque fueron designados para comparar el efecto del hierro oral (200 mg/día) y endovenoso (1.000 mg a 2.000 mg al día), además de otras terapias como ISGLT-2 (10 mg/día) vs. grupo placebo durante meses o años. Los trabajos incluidos procedieron de Reino Unido, Norte América, Alemania e Indonesia, donde se obtuvieron 6.717 pacientes, con una edad promedio de 70, a predominio del género masculino con respecto al femenino (57 vs. 43%, respectivamente). La fracción de eyección cardiaca del ecocardiograma de los atendidos de las investigaciones incluidas demostró una disminución media de alrededor de 45% para poder ser ingresados al estudio, también, los resultados de NYHA; de estos, incluyeron del grado II hasta el IV. Los marcadores bioquímicos de los pacientes estudiados tuvieron una Hb < 12 g/dl, la ferritina < 100 y saturación de transferrina (TSAT) de aproximadamente < 20%. La evaluación de los resultados de los diferentes análisis se concluyó en la demostración de una mejoría leve a moderada de usuarios hospitalizados por IC y muerte cardiovascular en relación con los grupos controles. Sin embargo, no hubo una diferencia significativa en los eventos adversos en los grupos de intervención y control (tabla 1). El riesgo de sesgo de las cinco dimensiones empleadas por el programa RoB 2 de la colaboración Cochrane de los siete estudios20–26, demostraron algunas preocupaciones con respecto a la desviación de la intervención de los resultados y la pérdida de datos en los del estudio por Ambrosy et al.23. No obstante, en el sesgo general, se presentó un bajo riesgo de sesgo en más de 50% (86%), vs. al riesgo de alguna preocupación de sesgo (14,3%) de los siete trabajos incluidos en este metaanálisis. (figs. 2 y 3)
Características de los estudios incluidos
| Autor, año (país) | Estudio designado | Población de estudio (n) | Fracción de eyección | Tiempo de seguimiento | Drogas, dosis | ID (ferritina, TSAT, Hb) | Evaluación de resultados |
|---|---|---|---|---|---|---|---|
| Docherty et al.20, 2022 (Reino Unido) | Ensayo aleatorizado y no controlado | n = 1.314 pacientesEdad media = 67,5M = 72,1%F = 27,9% | LVEF ≤ 40%NYHA = II-IV | 12 meses | Dapagliflozina, 10 mg/día | Hb = 13,8 g/dL | La dapagliflozina fue consistente en el grupo de ID con respecto al grupo placebo en muerte cardiovascular o empeoramiento de IC |
| Kalra et al.21, 2022 (Reino Unido) | Ensayo aleatorizado y no controlado | n = 1.137 pacientesEdad media = 73,4M = 74%F = 26% | LVEF ≤ 45%NYHA = II-IV | 2,7 a 5,4 años | Derisomaltosa férrica,< 50 kg = 20 mg/kg50 kg-70 kg = 1.000 mg/día> 70 kg = 1.500 mg/día | Hb = 12,1 g/dLFerritina = 49 ug/dLTSAT = 15% | Con respecto a las hospitalizaciones actuales por IC o muerte ECV en el grupo derisomaltosa férrica hubo 336 eventos, vs. al grupo control que hubo 411 |
| Ponikowski et al.22, 2020 (Europa, América del Sur y Singapur) | Ensayo aleatorizado y no controlado | n = 1.108 pacientesEdad media = 71M = 55,5%F = 44,5% | LVEF ≤ 50%NYHA = II-IV | 52 semanas | Carboximaltosa férrica, IV a dosis cortas | Hb = 12,2 g/dLFerritina = 83,5 ug/dLTSAT = 15,5% | En relación con a las hospitalizaciones hospitalarias y muerte de HF, no hubo una diferencia significativa entre el grupo de carboximaltosa férrica y el grupo control |
| Ambrosy et al.23, 2021 (EE. UU.) | Ensayo aleatorizado y no controlado | N = 1.538 pacientesEdad media = 70F = 53%M = 47% | LVEF ≤ 45%NYHA = II-IV | 8 semanas | Derisomaltosa férrica, 1.000 mg/día | Hb = 9,6 g/dLFerritina = 70 ug/dLTSAT = 14% | Los primeros eventos adversos cardiovascular fue más largo después de la primera administración de FDI respecto al grupo control |
| Anker et al.24, 2009 (Suiza, Alemania) | Ensayo aleatorizado y no controlado | n = 459 pacientesEdad media = 68M = 47%F = 53% | LVEF ≤ 45%NYHA = II-III | 24 semanas | Carboximaltosa férrica, 200 mg/día | Hb = 9,5-13,5 g/dLFerritina = 100 a 299 ug/dLTSAT < 20% | Con respecto al grupo carboximaltosa férrica hubo un mejoramiento leve de NYHA II-III comparado al grupo placebo |
| Suryani et al.25, 2022 (Indonesia) | Ensayo aleatorizado y no controlado | n = 54 pacientesEdad media = 57M = 65%F = 35% | LVEF ≤ 45%NYHA = II-III | 12 semanas | Sulfato ferroso, 200 mg/3 veces por día | Hb < 12 g/dLFerritina = 100 a 300 ug/dLTSAT < 20% | La capacidad funcional de la 6-MWT tuvo una mejoría del grupo sulfato ferroso con respecto al placebo |
| Filippatos et al.26, 2023 (Alemania) | Ensayo aleatorizado y no controlado | n = 1.107 pacientesEdad media = 71M = 57%F = 43% | LVEF ≤ 40%NYHA = II-IV | 52 semanas | Carboximaltosa férrica, 200 mg/día | Hb < 12g/dLFerritina < 100 ug/dLTSAT < 20% | Los pacientes hospitalizados por HF y muerte cardiovascular en el grupo carboximaltosa férrica fue menor con respecto al grupo control |
6-MWT: prueba de caminata durante los 6 min; ECV: enfermedad cardiovascular; F: femenino; H: hombre; Hb: hemoglobina; IC: insuficiencia cardiaca; ID: insuficiencia de hierro o anemia; LVEF: fracción de eyección del ventrículo izquierdo, NYHA: New York Heart Association; TSAT: saturación de transferrina.
En el desenlace primario, del grupo de tratamiento y/o suplemento de hierro se demostró una reducción estadísticamente significativa con respecto al grupo placebo en pacientes hospitalizados por IC o muerte cardiovascular (OR 0,62; IC 95% 0,54-0,70; I2 = 44%) (fig. 4).
Desenlace secundarioEn el subgrupo para determinar la primera admisión de hospitalización por IC o alguna enfermedad cardiovascular (ECV), se demostró una reducción estadísticamente significativa del grupo de suplemento de hierro en relación con el grupo placebo (OR 0,69; IC 95% 0,61-0,79; I2 = 0%) (fig. 5a). En otro subgrupo del desenlace secundario, se determinó al menos muerte cardiovascular en la primera hospitalización, donde se demostró que no hubo una diferencia significativa en la disminución de eventos de muerte cardiovascular de ambos grupos, (OR 0,86; IC 95% 0,72-1,03; I2 = 0%) (fig. 5b). En otro subgrupo de eventos adversos de todos los ECA incluidos, se demostró que hubo una naja de las reacciones adversas del grupo de suplemento de hierro frente al grupo placebo de todos los siete ensayos incluidos, (OR 0,78; IC 95%, 0,67-0,91; I2 = 0%) (fig. 5c). La 6-MWT es otro subgrupo del evento secundario, donde se comprobó una mejoría de 6-MWT del grupo de suplemento de hierro con respecto al placebo en pacientes hospitalizados por IC y deficiencia de hierro, (OR 0,79; IC 95%, 0,64-0,98; I2 = 5%) (fig. 5d).
DiscusiónEn este metaanálisis se incluyó la disposición de los datos sobre el tratamiento de hierro en pacientes con IC e ID, donde se demostró que la suplementación de hierro reduce los eventos hospitalarios por IC y muerte cardiovascular e incrementa la mejor tolerancia con respecto a 6-MWT, además, de la disminución de eventos adversos.
El hierro juega un papel importante en muchas funciones biológicas, incluye la producción de energía, proliferación de células, así como transporte y almacenamiento de oxígeno (como un componente de la mioglobina) y metabolismo oxidativo de los músculos esqueléticos y cardiacos, además de ser el elemento principal de la Hb y de muchos tipos de enzimas y de participar en varios procesos celulares. Es por eso que ante una eventual ID es muy perjudicial en varios órganos del cuerpo, principalmente en el sistema cardiovascular27,28.
La ID describe una disminución de la concentración de hierro y por eso no puede reunir una gran demanda metabólica de los diferentes órganos. Además, la ID es de las principales comorbilidades en pacientes con alguna enfermedad crónica, como la IC crónica29. La tolerancia al ejercicio está afectada debido a la reducción de almacenamiento del oxígeno en la mioglobina, la eficiencia de la energía y la disfunción mitocondrial está reducida cuando la concentración de hierro está depletada12.
Con respecto a las hospitalizaciones por IC o muerte cardiovascular, en nuestro estudio se demostró que la administración de hierro disminuye los eventos y muertes de IC y eventos cardiovasculares, por ende, mejora la LVEF. Esto se puede constatar en otro estudio, donde se mostró el favorecimiento del tratamiento de hierro en pacientes con IC e ID en relación con el grupo placebo (OR 0,74; IC 95% 0,58-0,92)22. Aquellos con diagnóstico de IC e ID fisiopatológicamente tienen altos niveles de hepcidina y ferritina, donde estos marcadores inflamatorios se observan en los que tienen síntomas leves de clase funcional I-II de NYHA, por ello, en algunas investigaciones se observó que la suplementación de hierro oral no contrarresta y/o disminuye los niveles de hepcidina y otros marcadores inflamatorios como la interleucina-6 (IL-6), debido a la poca absorción intestinal de suplemento de hierro oral. En cambio en la terapia de hierro endovenoso en los de clase funcional II-IV de la NYHA, los usuarios tienen una mejor tolerancia y biodisponibilidad en la reducción de la hepcidina y ferritina. Ante esto, se puede explicar la diferencia entre el suplemento de hierro oral vs. el endovenoso
Además, en este estudio se comprobó una mejoría de 6-MWT en relación con la calidad de vida, en pacientes del grupo que recibieron suplementos de hierro comparado al grupo control. Con lo que se pudo corroborar con otro estudio donde se demostró una mejora del grupo experimental conformado por personas que recibieron carboximaltosa (268), frente al grupo placebo (134)24. La fatiga, la pobre realización del estado físico y la diminución de la tolerancia de ejercicio se observaron en aquellos con IC con ID. Los suplementos de hierro de modo intravenoso, es beneficioso para mejorar 6-MWT, consumo del consumo de oxígeno y la calidad de vida, aunque los suplementos de hierro oral como el sulfato ferroso pueden mejorar el cuadro clínico en quienes padecen IC e ID por la adecuada absorción en comparación con el hierro polisacarido4,6,8,30.
Los eventos adversos, especialmente gastrointestinales, tuvieron una tasa de incidencia menor del grupo de pacientes con suplemento de hierro con respecto a los del placebo. Las revisiones encontradas, en suplementos de hierro vía oral como el sulfato ferroso o endovenoso, no tuvieron incidencia de eventos adversos, especialmente efectos gastrointestinales y nerviosos, por lo tanto, los efectos secundarios en el tratamiento de hierro en el grupo de suplemento fueron menores en comparación con los suplementos de hierro polisacáridos22–24.
Las limitaciones de este estudio dividieron en tres. Primero, se incluyeron estudios en pacientes con IC con LVEF < 50% y la ampliación de las conclusiones fueron limitadas. Segundo, en un ECA, no se pudo realizar la búsqueda completa de los resultados debido a la última fase clínica aun no publicadas. Tercero, nos centramos en los resultados claves de los ECA, pero no hubo concentración en los subgrupos de resultados, como los bioquímicos (ferritina, TSAT).
ConclusiónEn este metaanálisis de ECA, se demostró que el efecto del suplemento de hierro redujo la tasa de incidencia de hospitalización de falla cardiaca o muerte cardiovascular, además de una disminución de eventos adversos, como desórdenes gastrointestinales y neurológicos. Del mismo modo, mejoró la prueba 6-MWT. Se necesitan más ECA de alta calidad para optimar el diagnóstico y tratamiento en pacientes con falla cardiaca y anemia.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Consideraciones éticasEste estudio no requirió la aprobación de un comité de ética por tratarse de un análisis de datos secundarios agregados obtenidos de un dominio público de acceso abierto que nos permite la identificación de los casos evaluados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.