El embarazo ectópico es la implantación y desarrollo del óvulo fecundado fuera de la cavidad endometrial. Su incidencia ha aumentado en los últimos 30 años, y aunque ha disminuido su morbimortalidad, es la primera causa actual de mortalidad en el primer trimestre del embarazo. Su sospecha precoz es importante, ante toda mujer en edad fértil y con factores de riesgo indicativos de una gestación extrauterina.
La sintomatología suele ser amenorrea, abdominalgia, metrorragia, síntomas generales de gestación, e incluso síncope y shock.
El diagnóstico del embarazo ectópico se basa en los datos clínicos, resultados analíticos en sangre y orina maternas, estudio sonográfico, culdocentesis, inspección laparoscópica o laparotómica y estudio histológico.
El tratamiento puede ser quirúrgico (salpingostomía o salpingectomía), médico (metotrexato) o expectante, dependiendo de los factores del embarazo ectópico: precocidad diagnóstica, presencia de complicaciones agudas, condición clínica de la paciente, etc.
An ectopic pregnancy is the implantation and development of the ovum fertilized outside the endometrial cavity. Its incidence has increased in the last 30 years, and although its morbimortality has decreased, it is still the first cause of mortality in the first trimester of the pregnancy. Early suspicion is important, particularly in women of fertile age and with risk factors indicative of an extrauterine gestation.
The symptomatology is usually amenorrhea, abdominal pain, metrorrhagia, general pregnancy symptoms, and even syncope and shock.
The diagnosis of ectopic pregnancy is based on the clinical information, analytical results on mother blood and urine, ultrasound examination, transvaginal culdocentesis, laparoscopic or laparotomic inspection, and a histological study.
The treatment can be surgical (salpingostomy or salpingectomy), medical (methotrexate) or expectant, depending on the factors of the ectopic pregnancy: early diagnosis, presence of acute complications, clinical condition of the patient, etc.
El embarazo ectópico (EE) es la anidación y desarrollo del óvulo fecundado fuera de la cavidad endometrial. En las últimas 3 décadas su incidencia ha aumentado, ha disminuido su morbimortalidad y es la primera causa de mortalidad en el primer trimestre de embarazo, asociándose a otra nueva gestación en el 50% de los casos, de los cuales el 30-50% concluyen con el parto de un feto vivo. Por todo ello, su sospecha precoz por el médico de Atención Primaria y el ginecólogo es trascendental, ante toda mujer en edad fértil con: 1) factores de riesgo para gestión extrauterina (GE) (enfermedad inflamatoria pélvica, cirugía tubárica, dispositivo intrauterino, EE previo, tabaquismo, endometriosis, cromosomopatías, fecundación asistida, inducción de la ovulación); 2) síntomas típicos (amenorrea, abdominalgia, metrorragia, síntomas generales de gestación –náuseas y vómitos–, e incluso síncope y shock; en ocasiones es asintomática); 3) exploración física típica (tacto bimanual con masa anexial dolorosa, dolor ante la movilización cervical), y 4) marcadores biológicos positivos (fracción beta de la gonadotropina coriónica [β-hCG] en orina y sérica, progesterona sérica); posteriormente se ha de confirmar la sospecha clínica de GE o EE mediante las ecografías abdominal y transvaginal. El objetivo de esta publicación científica es mostrar al médico de familia que su sospecha o diagnóstico precoz del EE permite la aplicación de un tratamiento más conservador y lograr una mayor preservación de la fertilidad; dicha terapéutica puede ser: expectante, médica (metotrexato [MTX] administrado vía local o intramuscular [im]) o quirúrgica: a) salpingostomía lineal; b) expresión tubárica, y c) salpingectomía.
Consideraciones generalesLa fecundación del óvulo por el espermatozoide normalmente se lleva a cabo en el tercio externo de la trompa; habitualmente el óvulo fecundado permanece unos días en esta, para posteriormente, en la fase de blastocito, emigrar hacia el endometrio donde se implantará; toda anidación diferente a la comentada es una GE1.
El EE fue descrito por primera vez en el siglo x por Abulcasis2, médico de la ciudad de Córdoba y considerado como padre de la cirugía moderna.
La GE es una afección cuya frecuencia ha ido aumentando en los últimos 20 años en el mundo occidental, pasando de un caso por cada 200-300 embarazos intrauterinos a uno de cada 25-30 de estos3, debido al aumento de sus factores de riesgo y a su mayor facilidad diagnóstica, mientras que la morbimortalidad actuales han decrecido. A pesar de ello, dicha dolencia continúa siendo un problema de salud pública, presentando una incidencia global del 0,82% del total de los partos registrados, con una edad media de 32,2 años, correspondiendo a las nulíparas el 34,4% y a las primíparas el 23,6% de los casos de dicha afección. Un diagnóstico exacto y precoz permite al ginecólogo eliminar el EE y preservar la fertilidad de la paciente; la incidencia de este proceso es de prever que continúe aumentando a la vez que la de los factores predisponentes4.
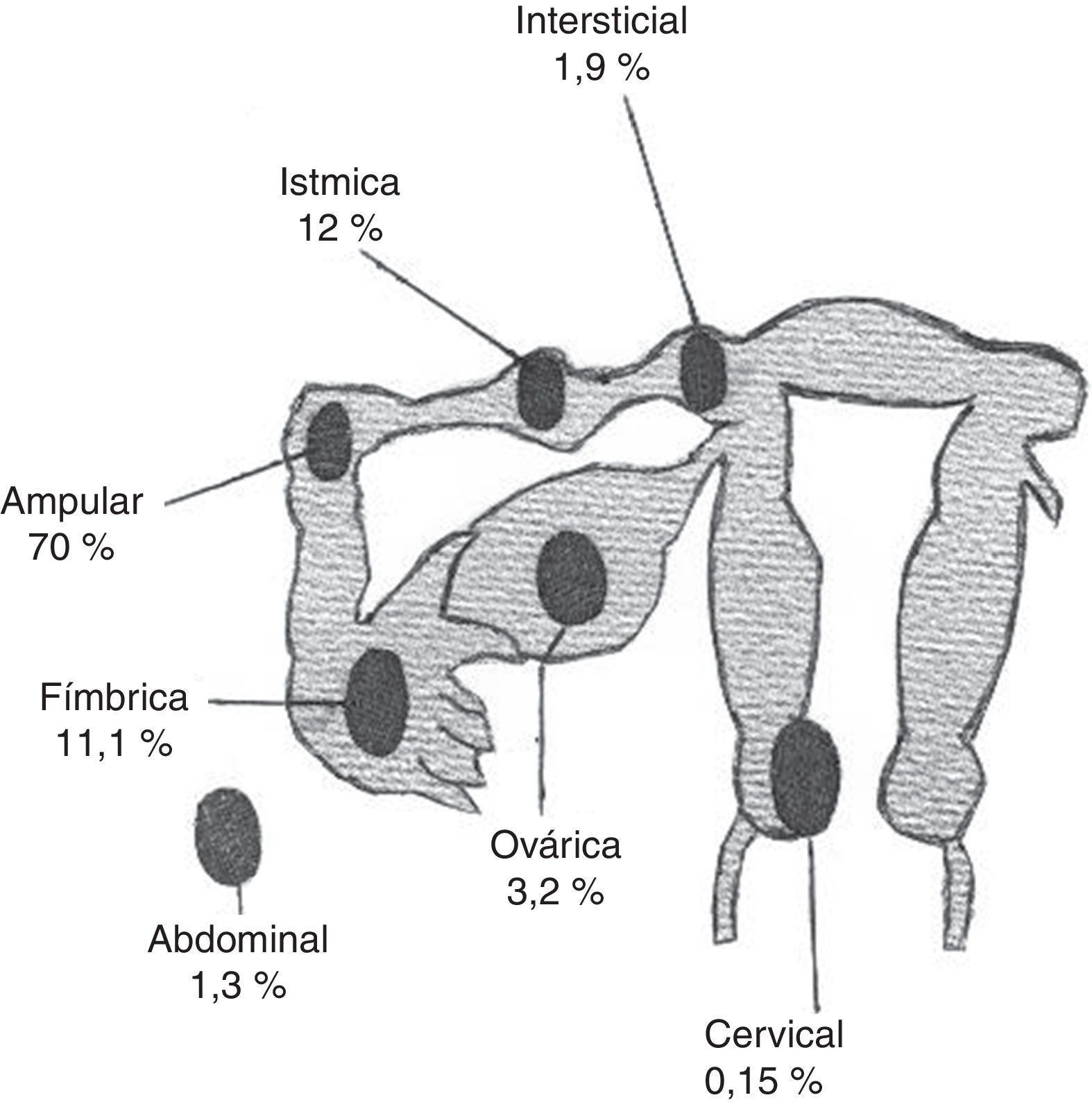
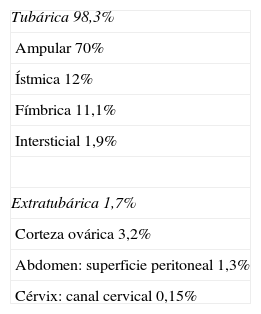
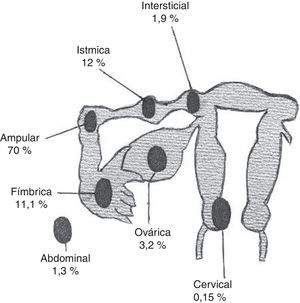
Su localización es tubárica en el 98,3% de los casos (ampular 70%; ístmica 12%; fímbrica 11,1%; intersticial 1,9%) y extratubárica en el 1,7% de ellos (corteza ovárica 3,2%; abdomen-superficie peritoneal 1,3%; cérvix-canal cervical 0,15%)5 (fig. 1 y tabla 1).
EtiologíaTodas las situaciones predictoras de un EE poseen en común una lesión del epitelio tubárico y/o una interferencia en la movilidad de las trompas. Entre los factores de riesgo, destacan6 (tabla 2):
- -
Enfermedad inflamatoria pélvica: afecta al 11% de las mujeres en edad fértil y es la causa más frecuente de GE (aumenta hasta 7 veces el riesgo de dicha afección; dificulta la permeabilidad, la motilidad y la actividad ciliar tubáricas), siendo Chlamydia trachomatis el germen predominante.
- -
Cirugía tubárica previa: eleva el riesgo de padecer EE un 5-20%.
- -
Antecedentes de cirugía pélvica o en el hemiabdomen inferior: incrementa el riesgo de presentar GE en un 0,92-3,8% debido a las adherencias posquirúrgicas (apendicectomía, etc.).
- -
Fallos en la anticoncepción: en la esterilización tubárica o con la implantación del dispositivo intrauterino liberador de progesterona.
- -
Hábito tabáquico: dificulta la motilidad de la pared y de los cilios de la trompa de Falopio.
- -
Endometriosis: tras la enfermedad inflamatoria pélvica, es la segunda causa más importante de EE.
- -
Inductores de ovulación: actúan por mecanismos similares a los inducidos por el tabaco.
- -
Fecundación asistida: por la presencia de altos niveles de estrógenos administrados o por el paso tubárico de embriones transferidos hacia el interior uterino.
- -
Aumento en el número de abortos provocados.
La evolución del EE depende de su localización inicial:
- 1.
EE tubárico:
- a.
Ampular: el embrión suele ser expulsado a la cavidad abdominal con discreta hemorragia en el fondo del saco de Douglas.
- b.
Ístmico: se asocia a rotura tubárica precoz con cuadro de abdomen agudo y shock.
- c.
Fímbrico: el huevo migra hacia la cavidad abdominal.
- d.
Intersticial: lo habitual es la progresión hacia la rotura uterina.
- e.
Cervical: suele evolucionar hacia la metrorragia, que puede ser desde leve hasta profusa.
- a.
- 2.
EE ovárico: suele progresar hacia la rotura y hemorragia en el lugar de implantación.
- 3.
EE abdominal: puede ser primario (fecundación e implantación en el peritoneo) o secundario (proveniente del ovario o las fimbrias).
El diagnóstico del EE se basa en los datos clínicos, los resultados analíticos en sangre y orina (test urinario de gestación, analítica general con hemograma, β-hCG en suero materno), estudio sonográfico (transvaginal y abdominal) y culdocentesis, junto a la inspección laparoscópica o laparotómica y el estudio histológico.
Afortunadamente la inmensa mayoría de las GE, al ser tubáricas y principalmente ampulares, presentan un diagnóstico y tratamiento más fáciles; no así las extrauterinas, las cuales, además, suelen asociarse a casos de reproducción asistida.
SintomatologíaLos síntomas de la GE se relacionan con la producción de un hematosálpinx secundario a la erosión trofoblástica de los vasos tubáricos que ocasiona la rotura de la estructura de anidación, con la hemorragia y dolor correspondientes; no obstante, el 40-60% de los casos de EE son asintomáticos por una reabsorción trofoblástica espontánea. Los síntomas habituales7, además de los comunes a una gestación (náuseas, vómitos y aumento de la sensibilidad mamaria), son el retraso menstrual, la abdominalgia y las metrorragias, siendo habitual que no se presente completa esta última tríada sintomática; otras manifestaciones menos usuales suelen ser la lipotimisa y, aún menos frecuentes, el shock tras una abdominalgia aguda e intensa –por hemorragia intraperitoneal–, el vértigo, el tenesmo rectal y la expulsión de la caduca.
Los síntomas más frecuentes se detectan ante la exploración abdominal: en el 90% de los casos se presenta sensibilidad palpatoria y signos de rebote positivo (principalmente ante un EE roto); las características del dolor abdominal dependen del momento evolutivo: 1) en las fases iniciales predomina en la parte inferolateral y es no intenso; 2) en la progresión gestacional hacia la rotura tubárica se hace más intenso, y 3) cuando dicha rotura está presente, el dolor correspondiente es agudo, severo –por la irritación peritoneal secundaria al hemoperitoneo– y con omalgia ocasional ––por la irritación diafragmática–. La abdominalgia súbita, intensa y unilateral puede ser detectada en el 90% de los casos sintomáticos.
El retraso menstrual suele estar presente, ser de corta duración y coincidir con el primer trimestre de la gestación (entre las semanas 7-10).
La metrorragia8 es consecuencia de la privación en la estimulación hormonal endometrial (dicha estimulación propicia previamente el surgimiento de la decidua); suele ser escasa y de sangre oscura y recurrente; cuando es abundante y roja obliga a plantear el diagnóstico de un posible aborto.
El examen ginecológico puede mostrar dolor ante la movilización del cérvix (75% de los casos), y una masa palpable anexial (50% de los casos; debida al quiste del cuerpo lúteo presente en el lado contralateral al del ectópico); mediante la inspección especular puede detectarse la metrorragia vía intrauterina, y síntomas indicativos de EE cervical (cérvix aumentado de tamaño, violáceo y con dolor en el cuello uterino ante el tacto vaginal).
La GE puede clasificarse según su progresión, en: 1) EE en evolución o no roto: sin rotura tubárica ni hemoperitoneo, y 2) EE accidentado o roto: a los síntomas iniciales se les añade la abdominalgia y/o la omalgia bruscas e intensas con peritonismo y clínica por hemorragia (hipotensión, shock hipovolémico, etc.).
Datos analíticosLa β-hCG9 es una glucoproteína producida por el sincitiotrofoblasto placentario. Su función más conocida es el mantenimiento del cuerpo lúteo. Sus valores séricos habitualmente se elevan de forma progresiva hasta alcanzar un pico máximo a los 60-80 días de gestación. Los test actuales con anticuerpos monoclonales para detectar dicha hormona en orina son muy sensibles, cuantificando valores mayores de 50mUI/ml con una fiabilidad superior al 90%; cuando dicho test muestre resultados negativos, debe ser evaluado el nivel sérico de la β-hCG, hormona que suele ser positiva en el suero a los 10 días tras la fecundación –con los métodos analíticos habituales–; en un embarazo intrauterino normal los niveles de β-hCG se duplican cada 48-72h, por lo que si su elevación es menor del 65% en un intervalo temporal de 48h se considerará con alta probabilidad el diagnóstico de GE.
Los valores séricos de progesterona son útiles y complementarios a los de β-hCG en la valoración del EE, pues cuando son mayores de 25ng/ml se relacionan con la presencia de un embarazo intrauterino en el 97,5% de los casos, y si son menores de 1,5-5ng/ml, son indicativos de una gestación no viable, sea cual sea su ubicación10.
Otros marcadores séricos también pueden ayudar a la identificación de EE, y se pueden dividir según la actividad fisiopatológica que representen:
- -
Función trofoblástica: además de la β-hCG se incluyen activina A, β-1 glucoproteína específica de la gestación, proteína plasmática A asociada a la gestación y lactógeno placentario humano.
- -
Actividad endometrial: glucodelina, activina B y factor inhibidor de la leucemia.
- -
Función luteínica: además de la progesterona, se incluyen inhibina A, estradiol, relaxina y renina.
- -
Crecimiento angiogénico de la trompa de Falopio: factor de crecimiento vascular endotelial.
- -
Irritación e inflamación peritoneal: interleucina-6, interleucina-8, factor alfa de necrosis tumoral, CA-125.
- -
Daño celular muscular: mioglobina, creatinquinasa, miosina de cadena pesada.
La ecografía suele ser útil para confirmar la sospecha clínica del EE, la cual, al facilitar el diagnóstico en las primeras fases evolutivas, conduce a un apreciable descenso en la morbimortalidad por dicha afección. La ultrasonografía abdominal puede permitir observar el saco gestacional intraútero a partir de la quinta semana de gestación, y una semana después de esta, el polo embrionario y la actividad cardíaca; también posibilita dicha técnica de imagen determinar la existencia o no de líquido en el fondo del saco de Douglas por un GE accidentado; si no se apreciase un embrión intrauterino y los niveles de β-hCG fuesen mayores de 6.500mUI/ml estaríamos ante un caso con alta sospecha de ser un EE. La ecografía transvaginal supone un gran avance en el diagnóstico de la GE, al cual se puede llegar con seguridad cuando se observa una masa anexial que contiene un saco ovular típico con trofoblasto envolvente y con un embrión que muestra latidos cardíacos, lo cual sucede en el 20% de los casos; dada la escasa frecuencia de hallazgos de certeza, son útiles los signos ecográficos indirectos: 1) ausencia del saco gestacional en el endometrio (aunque su presencia intrauterina no descarta totalmente un EE, principalmente en los casos de reproducción asistida); 2) la imagen mas frecuente11 es una masa anexial próxima al ovario, anexa al ligamento ancho y por fuera del contorno lateral del útero, visualizada en el 89% de los casos; 3) el movimiento independiente de dicha masa respecto del ovario, demostrado mediante una suave presión con el transductor ecográfico, lo cual está muy asociado a una GE y ayuda a distinguirla de un quiste exofítico en el cuerpo lúteo; 4) el anillo tubárico (el segundo dato más frecuente), consistente en un anillo hiperecoico rodeando la masa anexial, y 5) el patrón trilaminar, muy específico de GE, basado en el menor grosor endometrial. En un 26% de los casos los EE muestran una ecografía transvaginal normal.
El EE persistente sucede cuando dicha gestación no ha desaparecido tras haber sido aplicado un tratamiento quirúrgico o médico adecuado; predomina tras un tratamiento conservador; la persistencia de las imágenes ecográficas indicativas de EE junto a unas concentraciones elevadas de β-hCG, tras haber transcurrido 7 días de dicho tratamiento, indican la persistencia de la GE.
El sistema doppler color12: a pesar de que el EE suele diagnosticarse mediante una ecografía en escala de grises, dicho sistema ayuda a confirmar el diagnóstico mediante el «signo del latigazo» (típica «correa de vasos» excéntrica con flujo de baja resistencia que evidencia tejido trofoblástico, asociada a una sensibilidad del 100% y una especificidad del 99%); dicho método también es muy útil para identificar a un feto vivo por medio de sus pulsaciones cardíacas.
La ecografía tridimensional puede ser útil ante un EE intersticial al visualizarse más fácilmente en dicha área anatómica que mediante el modo bidimensional.
En el estudio ecográfico, la presencia de un saco gestacional intrauterino no descarta totalmente un EE, pues en el embarazo heterotópico coinciden al mismo tiempo una GE con una gestación intrauterina, todo lo cual sucede predominantemente ante los casos de reproducción asistida13.
LaparoscopiaDicha técnica de inspección visual puede aclarar los casos de pacientes con una GE y en los que la ecografía y la β-hCG no hayan facilitado dicho diagnóstico.
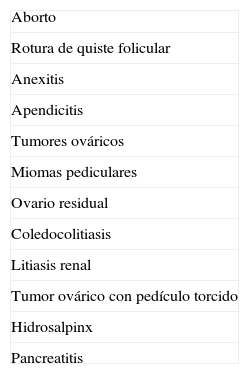
Diagnóstico diferencialEl diagnóstico diferencial del EE incluye las enfermedades que se enumeran en la tabla 3. En los casos en los que sea difícil diferenciar una GE de una gestación que va a ser abortada o no pueda proseguir, es de interés el estudio histológico del material intrauterino desprendido por el legrado, pues confirma el diagnóstico de EE mediante la constatación de la ausencia de vellosidades coriales y del fenómeno de Arias-Stella (presencia de una decidua intrauterina hipersecretora y atípica, patognomónica de EE).
TratamientoTratamiento quirúrgicoEl tratamiento del EE ha sido casi siempre mediante cirugía. En el año 1759 fue descrita por primera vez, por el cirujano John Bard14, la salpingectomía con extirpación ovárica; posteriormente se evolucionó hacia una nueva técnica quirúrgica, menos agresiva, al realizarse la extirpación de toda la trompa en la que se instala el EE, pero conservándose su ovario adyacente: la salpingectomía (sin ooforectomía); esta última técnica ha predominado en su realización hasta la sexta-séptima décadas del siglo xx, aunque actualmente sigue practicándose ante: 1) los casos de rotura tubárica con gran hemoperitoneo y compromiso hemodinámico, en los que debe completarse con la oclusión quirúrgica de la trompa contralateral –salpingoclasia– para evitar la repetición del GE, y 2) los casos de mujeres multíparas en las que no estén indicadas más gestaciones. Hasta la década de los años 60-70 del siglo pasado el EE fue la urgencia ginecológica más común.
En las últimas 3 décadas ha predominado la cirugía conservadora debido al diagnóstico más precoz de dicha afección y de sus complicaciones agudas, prevaleciendo la salpingostomía con conservación de la trompa, inicialmente mediante una laparotomía, y actualmente con predominio de la laparoscopia (aunque a veces es requerida la práctica laparotómica). Las condiciones para dicha cirugía conservadora de la GE son: integridad tubárica (o una rotura mínima), estabilidad hemodinámica, localización ístmica o ampular, presentar dicho EE un tamaño menor de 5cm, y presencia en la embarazada de deseos de conservar la capacidad reproductiva; dicha técnica quirúrgica consiste en la realización de una incisión lineal en el borde tubárico antimesentérico, seguida de la aspiración y eliminación de la GE, sin solerse practicar la sutura de dicha incisión.
Tras la salpingostomía son necesarios los controles semanales de β-hCG hasta que sus valores se negativicen, pues si se estabilizasen o ascendiesen habría de ser suplementada dicha cirugía con la administración de MTX vía im, pues el trofoblasto que aún persista sigue proliferando; esta técnica quirúrgica previa –también denominada salpingostomía lineal– conlleva que las trompas queden permeables en el 65-100% de los casos, y que en un 16% de ellos surja un posterior embarazo. La salpingostomía sola es menos exitosa, debido a la mayor incidencia de trofoblasto persistente, que cuando junto a ella se suministra a la paciente con EE una dosis única profiláctica de MTX sistémico dentro de las 24h posteriores a dicha cirugía; los efectos secundarios de este tratamiento con MTX, que ocurren en el 5,5-8% de las mujeres, son leves15.
El objetivo principal de la salpingostomía es la preservación de la integridad tubárica, para lo cual son requeridos un diagnóstico de GE y la aplicación de un tratamiento lo más precoces posibles. El abordaje laparoscópico respecto del laparotómico, para la práctica de una salpingostomía, se caracteriza por presentar unas menores: morbilidad, estancia hospitalaria, coste económico y recurrencias del EE; una mayor tasa de persistencia trofoblástica; e igualdad de posibilidades de alcanzarse fertilizaciones futuras con ambas técnicas salpingotómicas.
Según los resultados de la β-hCG y de la ecografía, la GE puede dividirse en los grupos: 1) EE no activo o no evolutivo: suele ser tratado de forma expectante; 2) EE con moderada actividad biológica: está indicada la terapéutica conservadora, médica o quirúrgica, y 3) EE con actividad biológica alta: requiere un tratamiento quirúrgico radical, es decir, una salpingectomía.
Tratamiento médicoEl tratamiento médico de la GE consiste en la administración de sustancias que lisen el trofoblasto, ante la presencia de una gestante con: un EE no complicado, hemodinámicamente estable, función hepática y renal normales, masa anexial de pequeño tamaño y niveles de β-hCG menores de 5.000mUI/ml; los fármacos pueden emplearse por vía sistémica (MTX, actinomicina D), o tópica (MTX, prostaglandinas, glucosa hiperosmolar, cloruro potásico, RU-486). El fármaco más utilizado en esta afección es el MTX, pues los restantes fármacos previos son considerados menos eficaces y usualmente no son empleados; dicho antimetabolito es un antagonista del ácido fólico, por lo que inhibe la síntesis de purinas y pirimidinas y, por consiguiente, bloquea la producción de ADN y la proliferación celular; sus efectos secundarios pueden ser: dolor abdominal (súbito, controlable con analgésicos, y debido al sangrado intratubárico farmacológico), estomatitis, conjuntivitis, gastroenteritis, depresión de la médula ósea, hepatopatía y fotosensibilidad; es el tratamiento de elección en caso de EE tubárico, cervical y abdominal. Cuando el MTX se administra de forma sistémica por vía im puede ser mediante un régimen de dosis múltiple fija (a 1mg/Kg de peso corporal, combinado con ácido folínico o leucovorina para reducir su toxicidad), o bien un régimen de dosis variable; dicha vía es más empleada actualmente respecto a la local, al ser más factible su administración y menos dependiente de las habilidades del médico; la vía local consiste en la inyección de MTX dentro del saco gestacional de forma transvaginal guiados por medio de la imagen ecográfica o de la visión laparoscópica. Para evaluar la respuesta de la paciente al fármaco previo se requiere la monitorización minuciosa de sus niveles séricos de β-hCG para que ante la detección de un descenso inadecuado en las cifras de dicha hormona le sea diagnosticado un eventual fracaso inminente de dicho tratamiento. En las gestantes que han recibido MTX, la tasa de éxito terapéutico es del 87%, la de permeabilidad tubárica del 81%, la de embarazo posterior del 61% y la de EE posteriores a dicha terapéutica del 7,8%; en dichas pacientes, durante los 3 meses siguientes a la administración de MTX, debe evitarse la gestación por el riesgo de teratogenicidad.
En los casos de mujeres con factor Rh negativo y no sensibilizadas previamente a dicho factor hemático, ante la sospecha de presentar un EE deben recibir profilaxis con 250UI (50mcg) de inmunoglobulina anti-D.
Tratamiento expectanteEl tratamiento expectante se basa en el principio de que muchas GE tempranas evolucionan hacia una reabsorción espontánea o hacia un aborto tubárico; está principalmente indicado en gestantes: 1) con EE pequeños (sin actividad cardíaca fetal; masa anexial menor de 2cm de diámetro), 2) con niveles séricos de β-hCG en descenso o menores de 1.000mUI/ml y de progesterona menores de 25ng/ml, 3) asintomáticas, 4) hemodinámicamente estables, 5) con deseo genésico, y 6) con la trompa de Falopio íntegra; en dichas pacientes, seleccionadas con las características previas, la conducta expectante se asocia a una resolución espontánea del EE en el 64-98% de los casos, con un 78% de ellos en los que surge una posterior gestación intrauterina y un 15% con recidiva de la GE16; el control de dicho tratamiento expectante no suele requerir hospitalización al ser evaluadas las pacientes por el ginecólogo mediante visitas periódicas cada 3-4 días; dicho manejo expectante se lleva a cabo en uno de cada 10 EE, y si los niveles de β-hCG permaneciesen estáticos o descendiesen escasamente, se debe plantear el subsiguiente tratamiento quirúrgico o médico17.
ConclusionesLos EE son cada vez más frecuentes, por lo que en la Atención Primaria de Salud es imprescindible pensar en dicho diagnóstico ante una abdominalgia asociada a retraso menstrual y/o metrorragia, y valorar los factores presentes favorecedores de la GE, para posteriormente realizar un diagnóstico precoz (test de orina o determinación sérica de β-hCG; ultrasonografía abdominal y transvaginal) que conduzca hacia un tratamiento exitoso y conservador de la fertilidad.
El EE es una causa común de morbilidad y, a veces, mortalidad, en mujeres en edad reproductiva. El tratamiento preferido, cumpliendo los requisitos adecuados, es el expectante, o bien el médico mediante la administración de MTX por vía im para la lisis del trofoblasto ectópico; dicho tratamiento conlleva, respecto de la modalidad quirúrgica, una reducción en la hospitalización y unas ulteriores y adecuadas permeabilidad tubárica y fertilidad.
En las pacientes hemodinámicamente estables y con indicación quirúrgica, debe practicárseles la salpingostomía por vía laparoscópica o laparotómica (microquirúrgica). Actualmente, la salpingectomía laparotómica está indicada principalmente ante la rotura tubárica y el hemoperitoneo masivo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Es la intención de los autores de este estudio científico mostrar nuestro agradecimiento a doña Katherine Stefany Ureña Núñez, por su sincera colaboración en el diseño del dibujo de la figura 1 de esta publicación científica, y a doña Manuela López Olivares, por su desinteresada colaboración en la traducción al inglés del resumen de esta revisión bibliográfica.