Dado que el dolor torácico no traumático representa un desafío diagnóstico con el que nos enfrentamos a menudo, resulta imprescindible por parte del médico de una correcta interpretación de la etiología, pruebas complementarias (electrocardiograma [ECG] y radiografía de tórax, fundamentalmente) y del significado de este síntoma. El objetivo principal es la diferenciación de las causas potencialmente graves de las que no necesitan un tratamiento inmediato1.
El síndrome de Brugada es una canalopatía que, aunque asintomática de forma habitual, presenta un patrón electrocardiográfico característico que debemos conocer. Es un trastorno eléctrico primario sin cardiopatía estructural descrito en 1992 por Pedro y Josep Brugada incluido dentro de las enfermedades producidas por alteraciones de los canales iónicos transmembrana que participan en el potencial de acción celular y predisponen a presentar arritmias ventriculares y muerte súbita en adultos jóvenes, y con menor frecuencia en lactantes y niños. Predomina en el sexo masculino2–4. El 70% son esporádicos y el 30% presentan mutaciones en el cromosoma 3, en el gen de la subunidad alfa del canal del sodio cardiaco SCN5A, transmitiéndose con una herencia autosómica dominante. Su importancia radica en tener una incidencia entre un 4-12% de las muertes súbitas inesperadas en jóvenes a causa de fibrilación ventricular, con una prevalencia estimada del 1-5/10.000 habitantes5.
Los pacientes habitualmente están asintomáticos pero si consultan, los motivos más frecuentes son síncopes y mareos. El dolor precordial no aparece descrito en ninguna de las series publicadas como manifestación clínico-diagnóstica del síndrome. Sin embargo, nosotros presentamos 2 casos de pacientes cuyo motivo de consulta fue el dolor torácico, en los cuales se encontraron patrones electrocardiográficos «tipo Brugada».
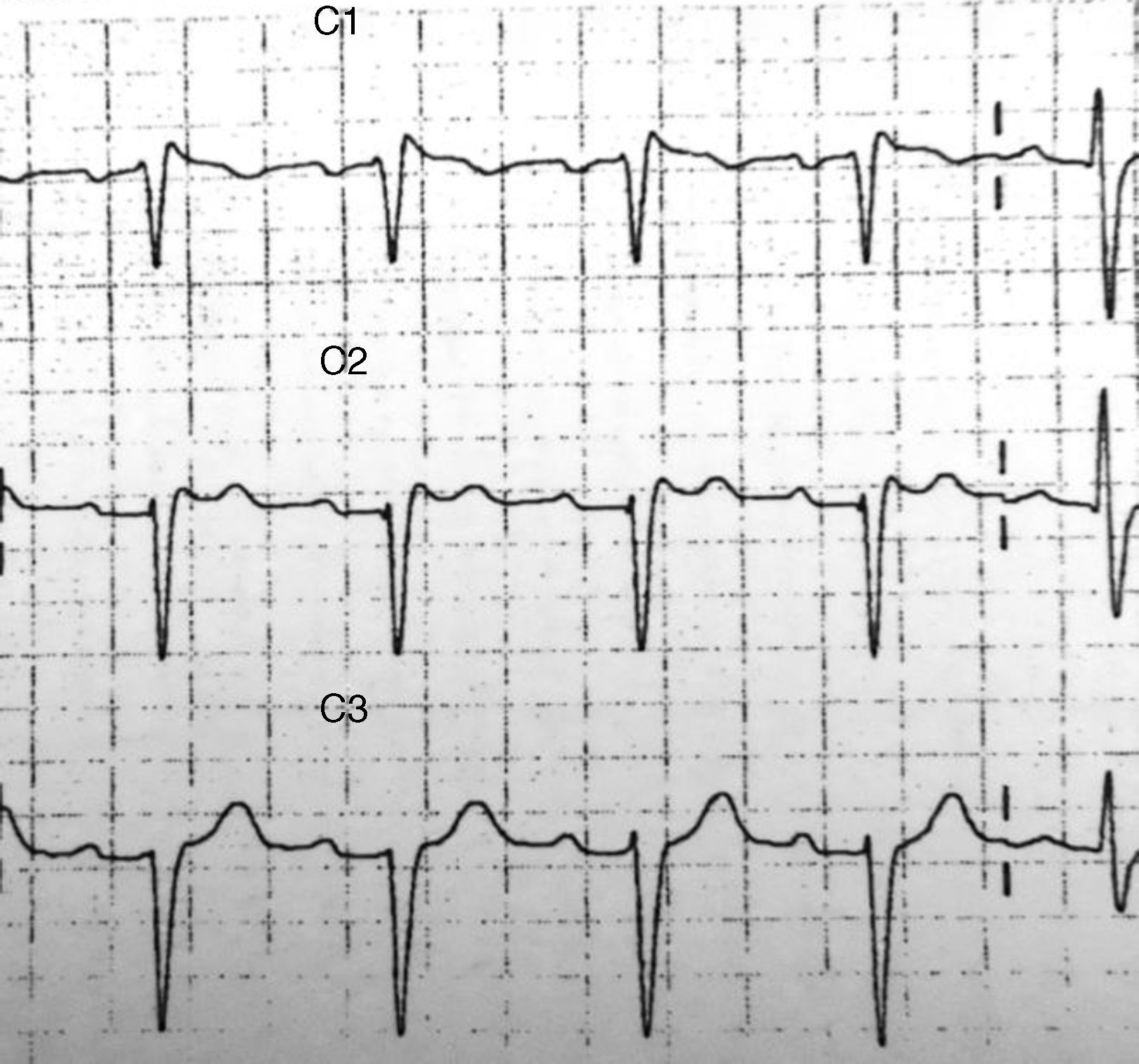
Caso clínico 1Paciente varón de 63 años con antecedentes de dislipidemia a tratamiento con fluvastatina y ex fumador, que acude a la consulta por dolor en hemitórax izquierdo que describe como un ardor, palpitaciones rítmicas, dolores osteomusculares y sensación distérmica desde las 10:00 h de la mañana. Se realiza ECG (fig. 1) y ante los hallazgos se deriva al servicio de urgencias. La auscultación cardiopulmonar es normal, el abdomen anodino, no presenta edemas, la presión arterial a su llegada es 145/100, frecuencia cardíaca de 100 latidos por minuto y la temperatura 37,8°C.
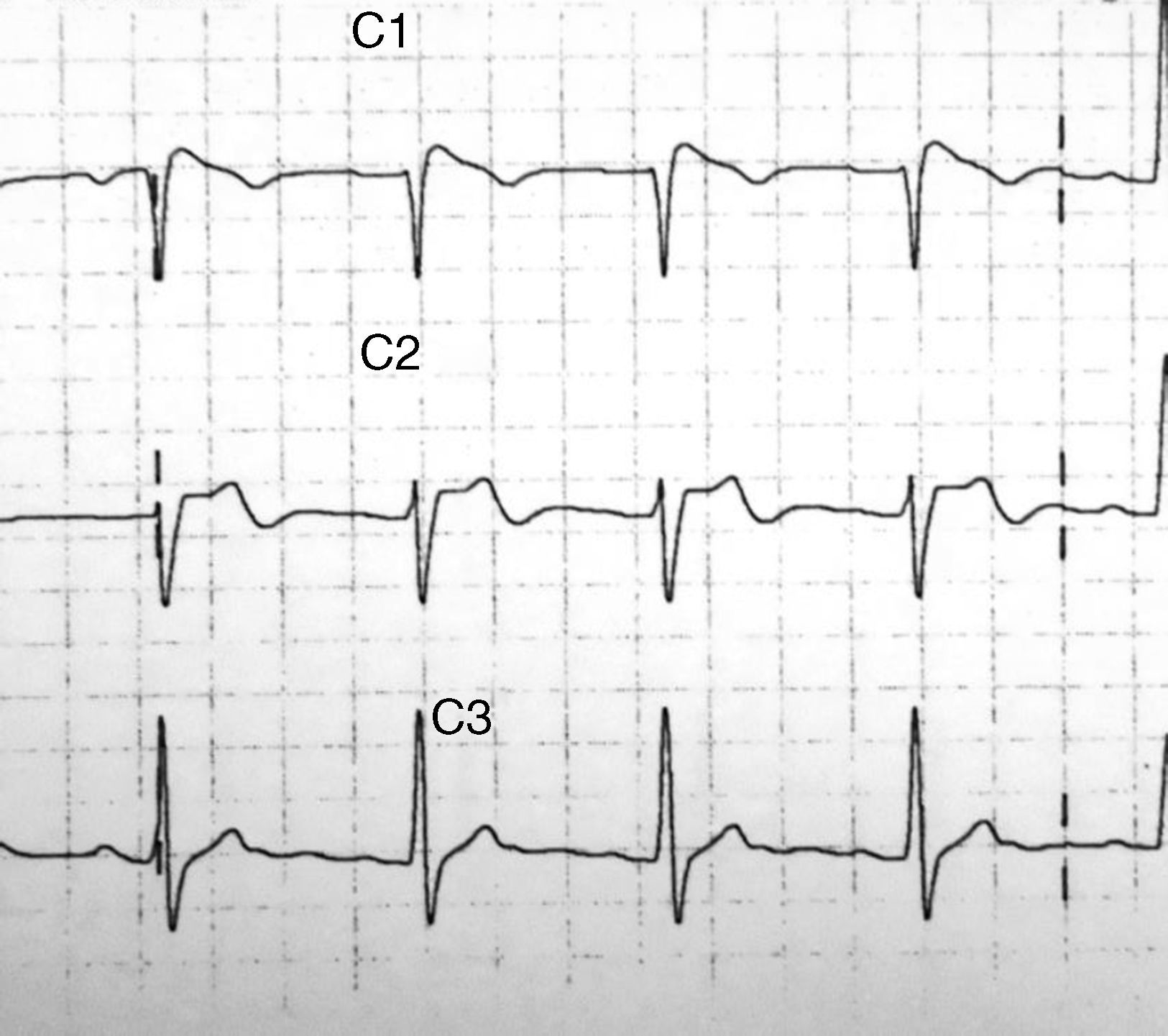
Caso clínico 2Varón de 38 años con antecedentes de pericarditis y dislipidemia en tratamiento con dieta que consulta por dolor torácico opresivo, sin irradiación y con aumento de intensidad con la inspiración profunda. En el ECG basal (fig. 2) muestra bloqueo incompleto de rama derecha del haz de Hiss (BIRDHH) con elevación del ST descendente de 1,5-2mm con T negativa en V1 y elevación «en silla de montar» en V2. Interrogado refiere que su padre es portador de marcapasos por «arritmias» y que un tío materno falleció de un infarto de miocardio. Refiere que año y medio antes su mujer se despertó por la noche porque notó que él presentaba una respiración muy ruidosa y anormal, que intentó despertarle pero estuvo inconsciente 5 min. Fue estudiado por el servicio de neurología siendo diagnosticado de presunción de crisis epiléptica generalizada dadas las alteraciones inespecíficas del electroencefalograma (EEG). A la exploración el paciente mantiene constantes vitales en rango normal y auscultación cardiopulmonar sin hallazgos relevantes. Diagnosticado de dolor torácico con ECG con patrón tipo ii de Brugada, se realiza ecocardiograma que resulta normal y se programa, bajo monitorización de constantes vitales, el test farmacológico con la administración de 2mg/kg de peso de flecainida en 10 min, donde presenta una elevación descendente del ST de 5-6mm con T negativa en V1-V2.
En el primer caso se trata de un patrón electrocardiográfico compatible con patrón de Brugada tipo ii desencadenado por la fiebre. El tratamiento es antipiréticos para controlar la temperatura. Se derivó al paciente a la consulta de cardiología para estudio. Se instauró un Holter donde no se demostraron arritmias ventriculares y se evidenciaron extrasístoles supraventriculares.
En el segundo caso se ha programado la colocación de un desfibrilador automático implantable (DAI) al paciente y se extrajo sangre para estudio genético, así como consulta de revisión cardiológica para cribado familiar a padres y hermanos.
Electrocardiográficamente, como mostramos en los casos clínicos, presentan una elevación del segmento ST > 2mm en precordiales V1-V3 con punto J elevado que estimula una R’ dando la apariencia de bloqueo de rama derecha.
Debe hacerse diagnóstico diferencial con otras entidades que cursan también con elevación del ST y/o bloqueo de rama derecha:
- -
Repolarización precoz. Las características clínicas similares en ambas entidades incluyen predominio en varones jóvenes, predisposición familiar, normalización transitoria de la patente ECG y parecida respuesta a la modulación autonómica y fármacos. Las principales características diferenciales, desde el punto de vista electrocardiográfico, son en la repolarización precoz; usualmente el supradesnivel del ST se localiza de V2-V4,V5 con concavidad superior, ondas T positivas y empastamiento o enlentecimiento del punto J; el síndrome de Brugada en cambio muestra un supradesnivel del ST prominente, seguido por un ST descendente y onda T negativa en V1-V3 (típico) o en otras derivaciones (atípico)6.
- -
Pericarditis, donde el patrón electrocardiográfico difiere del Brugada porque concurre una elevación del ST con concavidad hacia arriba en todas las derivaciones salvo en aVR y V1.
- -
Infarto agudo de miocardio septal. Se produce una elevación del ST en V1-V2 con concavidad dirigida a la línea de base7. En este caso se producirá elevación de marcadores de daño miocárdico (troponinas) y se pueden visualizar alteraciones ecocardiográficas y obtrucción de ramas septales de la arteria coronaria derecha en el cateterismo cardíaco. La obstrucción de esta arteria es la principal causa de aparición de un aneurisma ventricular que electrocardiográficamente se manifestará como una elevación persistente en el segmento ST de grado y morfología variable, asociado a ondas Q patológicas bien desarrolladas en las derivaciones precordiales anteriores y lateral alta (V1-V6, DI y aVL) y ondas T negativas en V4-V6 que puede desencadenar una arritmia ventricular.
- -
El síndrome de QT largo es también una canalopatía que predispone a la aparición de arritmias cardiacas y muerte súbita. Existen formas primarias congénitas en las que, entre otros, también está implicado el gen SCN5A8.
- -
Enfermedad de Chagas, que es una enfermedad parasitaria cuya manifestación más grave es la miocardiopatía dilatada que conduce a una amplia fibrosis cardiaca. Las anomalías del ECG incluyen diversas alteraciones de la conducción, alteraciones del ST-T, QRS de bajo voltaje, ondas Q patológicas y extrasístoles ventriculares, bloqueo de rama derecha del haz y hemibloqueo anterior izquierdo9.
Se han descrito 3 patrones electrocardiográficos distintos de Brugada:
- •
Tipo 1 (diagnóstico de enfermedad). Elevación descendente en forma de «aleta de tiburón» del segmento ST > 2mm en más de una precordial derecha (V1-V3), seguida de ondas T negativas. Este se asocia con muerte súbita en el seguimiento, por lo que no son necesarios otros estudios complementarios para realizar el diagnóstico. En la actualidad el tratamiento de este tipo es la implantación de un DAI.
- •
Tipo 2. Elevación del segmento ST > 2mm en precordiales derechas seguidas de ondas T positivas o bifásicas (aspecto de «silla de montar»). Diagnóstico inicial de ambos casos presentados.
- •
Tipo 3. Definido como cualquiera de los 2 anteriores si la elevación del segmento ST es < 1mm.
Los 3 patrones pueden observarse en un mismo paciente, en momentos diferentes, pero también puede presentar un ECG transitoriamente normal. El patrón electrocardiográfico típico puede ser permanente, transitorio o latente. El primer paciente presenta ECG previos en su historia clínica normales. El patrón tipo Brugada se desencadena por la fiebre.
El diagnóstico definitivo de síndrome de Brugada solo debe establecerse cuando el patrón ECG tipo i se documenta en combinación con al menos uno de los siguientes criterios clínicos: fibrilación ventricular (FV) documentada, taquicardia ventricular (TV) polimórfica documentada, inducibilidad de arritmias ventriculares durante el estudio electrofisiológico (EEF), síncope o respiración agónica nocturna, historia familiar de muerte súbita en edad previa a los 45 años o patrón ECG tipo i en otros miembros de la familia (documento de consenso publicado en 2002 y 2005)10.
No obstante, esta definición se postula anticuada, sobre todo porque se conocen otros aspectos importantes de la enfermedad no mencionados, como son las mutaciones causales. De hecho, la sola presencia de un patrón ECG tipo i, incluso cuando no se cumplen otros criterios clínicos, puede asociarse con muerte súbita en el seguimiento. Ello obliga a considerar como pacientes en riesgo a todos los que presentan un patrón ECG tipo i, incluso cuando este aparece de forma aislada.
La importancia del estudio de los patrones de los tipos 2 y 3 radica en su posible transformación en tipo 1 tras un test farmacológico con la administración de un bloqueante del canal del sodio (ajmalina, flecainida o procainamida).
El caso del paciente número 2 se comentó de nuevo con el servicio de neurología, quien refirió que el diagnóstico de epilepsia fue de presunción dados los hallazgos inespecíficos del EEG, considerándolo más dudoso tras el nuevo diagnóstico y siendo, por tanto, el episodio de pérdida de conciencia nocturna ocurrido año y medio antes más compatible con un episodio de respiración agónica nocturna.
Aparte del bloqueo farmacológico, otras circunstancias que influyen en la entrada y salida de sodio del canal desenmascarando un síndrome de Brugada oculto son fiebre (como hemos visto), estrés mental, consumo de alcohol, ergotamina, antidepresivos tricíclicos, agonistas alfaadrenérgicos, antihistamínicos de primera generación (dimenhidrato), cocaína, betabloqueantes, hipopotasemia o disminución del tono vagal. En el caso 1, el patrón de Brugada se desenmascara por la fiebre, ya que el paciente no lo presenta en ECG previos de su historia clínica.
Para finalizar, con todo lo explicado y a la vista de todas las publicaciones que existen hasta la actualidad, no podemos vincular el dolor torácico como una posible manifestación clínica de Brugada, haciéndose necesario el estudio de la prevalencia de aparición de este síntoma en el diagnóstico de esta enfermedad en las distintas o nuevas series de casos.
Aun así, como médicos debemos tener conocimiento de este síndrome, dado que inicialmente solo se necesita un ECG de sospecha o compatible y dirigir una correcta historia clínica. Clínicamente existen pacientes asintomáticos en los que el patrón electrocardiográfico no difiere de los sintomáticos y en el 40% de ellos, en los años subsiguientes al descubrimiento del patrón característico, se producirá un nuevo o primer episodio de taquicardia ventricular polimórfica rápida que podrá derivar en muerte súbita, que puede ser por tanto prevenible.