El glaucoma es la primera causa mundial de ceguera irreversible. Su prevalencia en nuestro medio es del 2%; la mitad de los pacientes permanecen sin diagnóstico. Determinados fármacos pueden desencadenar o exacerbar el glaucoma, de ahí la importancia del conocimiento de estos fármacos por parte del médico de atención primaria. Además, los fármacos empleados en el tratamiento del glaucoma, incluso por vía tópica, pueden tener efectos secundarios sistémicos que también debe conocer el médico de atención primaria.
El adecuado conocimiento de todos estos grupos farmacológicos y su correcta prescripción en pacientes con factores de riesgo y enfermedad de base, permitirá al médico de atención primaria una optimización de la relación riesgo/beneficio en el manejo terapéutico de este tipo de pacientes.
Se efectúa una actualización de esta enfermedad oftalmológica, con especial atención a sus implicaciones con los tratamientos farmacológicos.
Glaucoma is the first cause of irreversible blindness worldwide. Its prevalence in our country is 2%; half of patients remain undiagnosed. Certain drugs can trigger and/or exacerbate glaucoma; hence the importance of having knowledge of these drugs by Primary Care physician. In addition, the drugs used in the treatment of glaucoma, even topically, can have systemic side effects that should be also know to the Primary Care physician.
An adequate knowledge of all the drug groups and the prescribing of the appropriate drug in patients with risk factors and underlying pathology, will enable the Primary Care physician to optimise the risk/benefit ratio in the therapeutic management of these patients.
An update is presented on this ophthalmological disease, with special attention to its implications for pharmacological treatments.
El término glaucoma es un compuesto griego formado de glaukós, cuyo significado es «verde pálido», y -oma, «resultado de un proceso»1.
Se llama glaucoma a un conjunto de procesos patológicos oculares que tienen en común un aumento de la presión intraocular (PIO), que provoca el desarrollo de una neuropatía óptica progresiva, caracterizada por la atrofia del nervio óptico y una pérdida adquirida de células ganglionares retinianas, lo que produce pérdida visual. Dicha degeneración neuronal no afecta solo a la retina, sino también a las células del núcleo geniculado lateral y a la corteza visual. Aunque la lesión primaria no afecta a todas las fibras y células ganglionares, sí produce una alteración en el medio neuronal que aumenta la vulnerabilidad de las neuronas no afectadas2.
Es la primera causa de ceguera irreversible en todo el mundo. Su prevalencia global mundial en>50 años es del 1,5%. Se estima que 66,8 millones de personas tienen glaucoma, de los que 6,7 millones presentan ceguera bilateral por esta causa3.
En España, la prevalencia es del 2%, incrementándose con la edad; se calcula que un millón de personas presentan glaucoma, de las cuales 500.000 (50%) están sin diagnosticar4.
Determinados fármacos pueden desencadenar o exacerbar el glaucoma; de ahí la importancia del conocimiento de estos fármacos por parte del médico de atención primaria. Además, los fármacos empleados en el tratamiento del glaucoma, incluso por vía tópica, pueden tener efectos secundarios sistémicos que también debe conocer el médico de atención primaria. Se efectúa una actualización de esta enfermedad oftalmológica, con especial atención a sus implicaciones con los tratamientos farmacológicos.
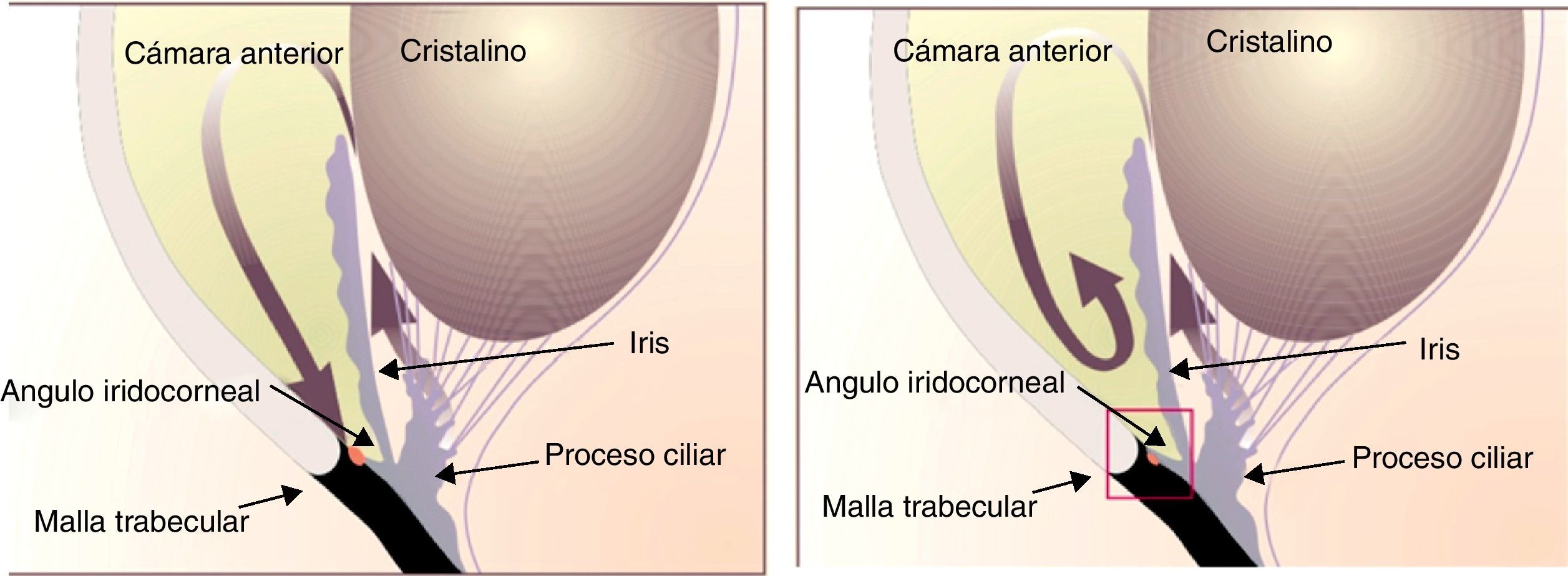
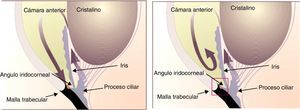
Fisiopatología del humor acuosoEl humor acuoso se produce en el proceso ciliar, vertido a la cámara posterior, y pasa a través de la pupila a la cámara anterior. A través del ángulo iridocorneal, es excretado a través de la malla trabecular, pasando al conducto de Schlemm, vasos colectores y venas epiesclerales. Proporciona nutrientes al cristalino, el iris y la parte interna de la córnea5 (fig. 1).
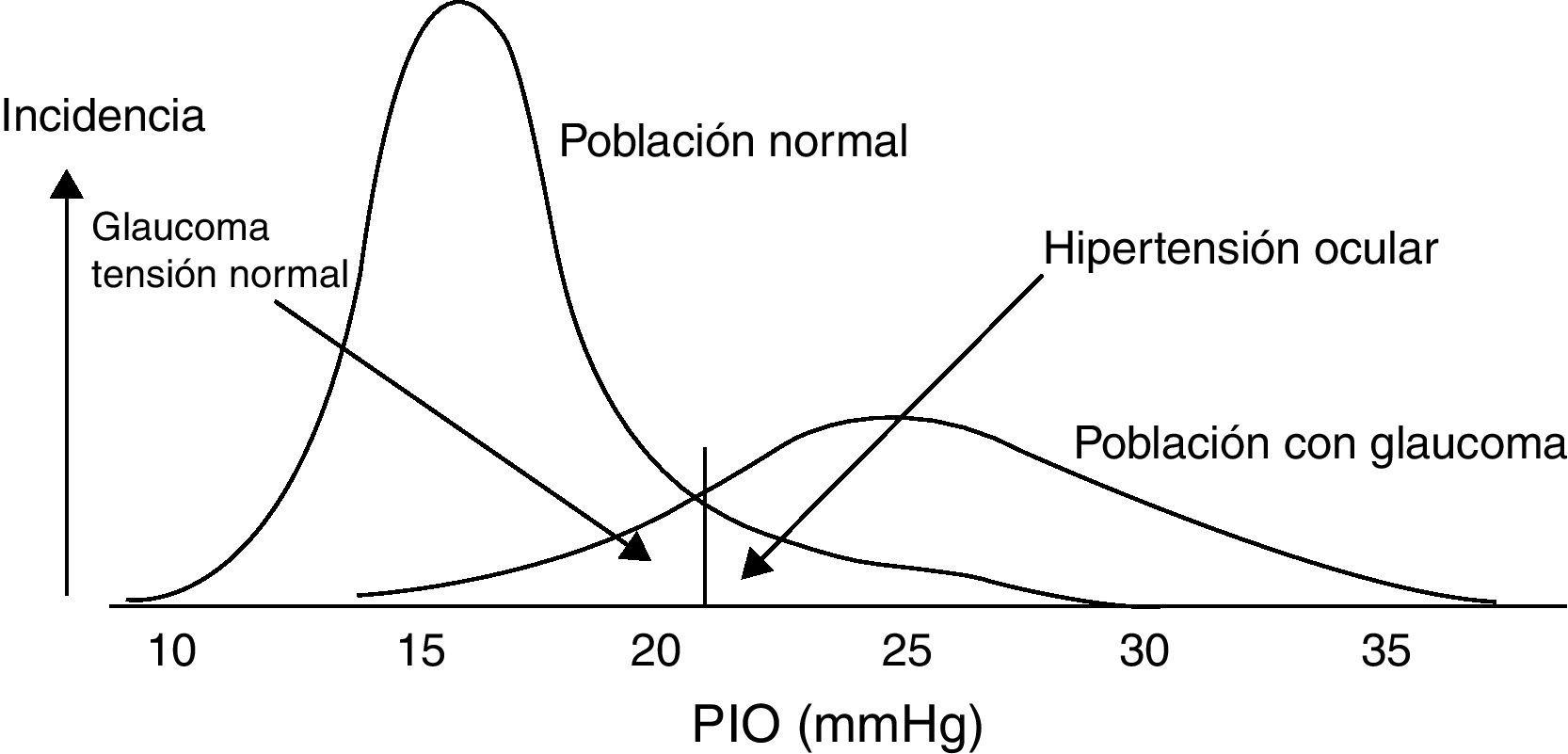
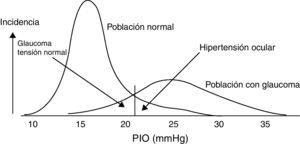
Ejemplo ilustrativo de la distribución de la PIO para la población normal y glaucomatosa. Tomada de González de la Rosa et al.5.
Desde el punto de vista fisiopatológico, la PIO se puede incrementar por el aumento de producción del humor acuoso (muy poco frecuente, asociado a ciertas uveítis), o por disminución de la evacuación. Dicha disminución puede ser pretrabecular (glaucoma de ángulo cerrado [GAC], glaucoma congénito [GC]), trabecular (el más frecuente; ocurre en el glaucoma primario de ángulo abierto [GPAA] y glaucomas secundarios [HTA], diabetes, etc.) o postrabecular, en el sistema venoso colector (raro, en fístulas carótido-cavernosas).
En personas sanas, los límites de la PIO se encuentran entre 10 y 21mmHg, con un valor medio de 15-16mmHg. Se considera hipertensión ocular (HTO) cuando la PIO>21mmHg. Es importante aclarar que HTO no es sinónimo de glaucoma, sino que se trata del factor de riesgo más decisivo para su desarrollo6. Puede existir glaucoma sin PIO elevada en el momento del diagnóstico (20-40%) y existir PIO elevada (HTO) sin glaucoma (10%)5,7 (fig. 2).
Fisiología y fisopatología del humor acuoso. Modificada de Carretero4.
Algunos fármacos pueden causar o agravar como efecto secundario un GPAA. Otros fármacos con efecto midriático, y especialmente en pacientes con un ángulo iridocorneal estrecho, desencadenarán o agravarán un glaucoma de ángulo cerrado.
Factores de riesgo2,7–10Su conocimiento es especialmente importante, porque debe alertar al médico de atención primaria sobre el riesgo de desencadenar o exacerbar un glaucoma en pacientes que van a recibir determinadas prescripciones farmacológicas:
- •
PIO elevada: es el único factor de riesgo causal que además resulta tratable.
- •
Edad: es, junto a la PIO, el factor que más aumenta el riesgo. El riesgo relativo se dobla cada 10 años.
- •
Raza: en la raza negra, el GPAA tiene una prevalencia 4-16 veces mayor que en la raza blanca (la tasa de ceguera es hasta 8 veces mayor); en la raza asiática y grupo étnico esquimal, la prevalencia es mayor para el GAC.
- •
Sexo: en hombres es más frecuente el GPAA, y en mujeres el GAC (4:1).
- •
Historia familiar de glaucoma: herencia multifactorial. Los familiares de primer grado de pacientes afectados por glaucoma tienen un riesgo 8 veces mayor que la población general. Aproximadamente un 20% de los sujetos con glaucoma presentan antecedentes familiares. La prevalencia del GPAA aumenta de un 2% en la población general hasta un 13,5% entre familiares de pacientes. Algo similar sucede en el GAC.
- •
Miopía magna (GPAA), córnea delgada, hipermetropía (GAC).
- •
HTA.
- •
Diabetes mellitus: aumento de la sensibilidad del nervio óptico por la lesión que produce sobre los vasos de pequeño calibre (GPAA), y la tracción del iris hacia el ángulo iridocorneal secundario a glaucoma neovascular (GAC secundario).
Diversos autores recomiendan derivar a oftalmología a los individuos mayores de 50-65 años, mayores de 40 años con historia familiar de glaucoma, individuos de raza negra, miopía magna o diabetes2,6,9,11.
Manifestaciones clínicasEl glaucoma cursa de forma asintomática hasta estadios avanzados, de ahí que hasta el 50% de los pacientes estén sin diagnosticar. Debido a la irreversibilidad del déficit visual que provoca, es esencial un diagnóstico temprano; el médico de atención primaria deberá por tanto estar alerta ante determinada semiología, especialmente durante el manejo de determinados fármacos1,6.
Los hallazgos clínicos dependerán del tipo de glaucoma, orientando hacia uno u otro tipo (tabla 1).
Es la forma más frecuente de glaucoma (60-70%). Evolución gradual, asintomática y lenta (años). No causa sintomatología alguna hasta fases muy avanzadas, de ahí que hasta el 50% de los pacientes estén sin diagnosticar. El descubrimiento suele ser casual: en una revisión rutinaria oftalmológica, o referir el paciente síntomas como que al taparse un ojo descubre que ve mal por el otro ojo, dificultad para conducir, pérdida de palabras al leer, problemas al bajar escaleras si se afecta el campo visual inferior. La afectación es bilateral, aunque suele ser asimétrica. En algunos casos puede haber cefaleas y dolor ocular, además de pérdidas del campo visual: la visión central es habitualmente la última en afectarse, perdiéndose primero la visión periférica9,12.
Glaucoma de ángulo cerradoRepresenta el 10% de todos los glaucomas. La sintomatología es unilateral y aguda, pero ambos ojos son susceptibles de afectación en distintos momentos evolutivos (tabla 1).
Existen distintos estadios:
- •
Preglaucoma: la PIO y el drenaje del humor acuoso son normales, pero existe un ángulo iridocorneal estrecho, que supone un peligro potencial. No hay síntomas12.
- •
Ataques prodrómicos: cierre transitorio del ángulo de drenaje y, por tanto, elevación de la PIO. Desencadenados por una serie de factores: ansiedad, circunstancias que producen dilatación pupilar (oscuridad, por ejemplo, en el cine). En general la PIO vuelve a la normalidad espontáneamente. El paciente puede describir cierta nubosidad visual, aparición subjetiva de halos coloreados rodeando las luces, y cefalea ocasional. A veces, estas molestias oculares mejoran al dormir, debido a la miosis inducida por el sueño, que puede resolver un ataque intermitente o subagudo de glaucoma por cierre angular9.
- •
Ataque agudo de glaucoma: se presenta precedido de ataques intermitentes, o bien de forma brusca. Representa una verdadera urgencia oftalmológica, con una PIO>40mmHg. Manifiesta una sintomatología característica: se inicia súbitamente, con dolor intenso en la zona de distribución del V par craneal, y disminución de la agudeza visual. Al cuadro se asocian síntomas vegetativos (sudoración profusa, náuseas, vómitos, taquicardia, etc.). Los pacientes que acuden a urgencias con un ataque de glaucoma agudo a veces son diagnosticados erróneamente, atribuyéndose sus síntomas a problemas neurológicos o gastrointestinales. En la exploración se observa inyección conjuntival y ciliar (región perilímbica corneal), edema corneal con pérdida de la transparencia de la córnea y dificultad para visualizar los detalles del iris en comparación con el ojo contralateral, pupila ovalada en midriasis media arreactiva, el ojo está duro (pétreo) a la presión: se palpa con ambos dedos índices y se compara con el ojo contralateral. En la anamnesis hay que investigar los antecedentes de cirugía ocular previa (expansión de gas intraocular, sinequias angulares). Puede ser complicado realizar la gonioscopia a causa de la opacificación corneal, aunque, no obstante, la exploración del otro ojo mostrará un ángulo estrecho susceptible de ocluirse. Si el ojo contralateral presenta un ángulo abierto, deben considerarse otros diagnósticos. Todo paciente con sospecha de GAC debe ser enviado urgentemente a un oftalmólogo para su diagnóstico y tratamiento inmediatos. Cada ataque agudo puede dejar como secuela una considerable disminución de la agudeza visual9,13.
Afecta al 0,05% de la población de 0-3 años (3-8 de cada 100.000 nacidos vivos). El 66-75% es bilateral, y afecta más a varones. El más frecuente es el glaucoma congénito primario: hidroftalmia o buftalmos, por desarrollo anormal de la estructura del seno camerular, con la presencia de la membrana de Barkan, que estaría imperforada cubriendo la malla trabecular, con la consiguiente obstrucción en la evacuación del HA. Sus síntomas son epífora, fotofobia y blefaroespasmo persistente14.
DiagnósticoPara realizar el cribado en individuos con antecedentes familiares de GAC, antes de dilatar la pupila, debe revisarse la cámara anterior ocular con la lámpara de hendidura; si el ángulo iridocorneal está abierto, se procede a la dilatación pupilar, pero si existen dudas se efectúa una gonioscopia. Si se confirma que el ángulo es estrecho, se procede a la laseriridotomía profiláctica, por lo que estos pacientes deben ser derivados al especialista6.
El diagnóstico de glaucoma se basa en la detección de cambios en la papila óptica, de defectos en el campo visual y, frecuentemente, de HTO14.
TonometríaEn cuanto a la medida de la PIO, se considera HTO si es mayor a 21mmHg. Es el único factor de riesgo para el glaucoma que puede tratarse. El valor de la PIO en personas sanas está entre 10-21mmHg (media: 15-16mmHg). Las oscilaciones a lo largo del día en los sujetos sanos son generalmente pequeñas, de hasta 3mmHg, siendo mayores en los individuos glaucomatosos. Las diferencias de presión entre los 2 ojos del mismo paciente solo deben considerarse como patológicas cuando, en repetidos exámenes comparativos, sean superiores a 5mmHg15.
En atención primaria, de forma sencilla, puede procederse mediante tonometría digital: comprimir el globo ocular a través del párpado superior con ambos dedos índices, valorando la depresión ocular que se produce; debe compararse con la obtenida en un ojo sano6. También puede determinarse la tonometría por aplanación, que es el método más exacto. Consiste en la medida directa, poco influida por las variaciones de la elasticidad ocular6,9, y en atención primaria puede utilizarse el tonómetro de Perkins (portátil), que muestra una buena validez.
GonioscopiaTécnica de visualización del ángulo iridocorneal6. Sirve para diferenciar GPAA y GAC.
Defectos del campo visualLa campimetría o perimetría es el método con más validez para el diagnóstico del glaucoma. Es muy importante para evaluar su evolución. Inicialmente aparecen escotomas paracentrales, después se afecta la periferia y, en estadios finales, a la visión central. En el GPAA la disminución de la visión es bilateral, pero asimétrica. En el GAC es unilateral habitualmente6,7.
Estudio de La PapilaSe realiza mediante oftalmoscopia directa o con lámpara de hendidura. La papila normal es ovalada, y en ella se distingue una zona central, excavada y pálida, que corresponde a la excavación papilar, y otra periférica anaranjada llamada anillo neurorretiniano. Una papila con una relación excavación/papila mayor de 0,5 se considera sospechosa de glaucoma, así como la aparición de hemorragias en astilla en el margen papilar, rechazo nasal de los vasos, y adelgazamiento del anillo neurorretiniano. En general, los cambios en la apariencia del nervio óptico preceden a las alteraciones campimétricas6,7,9,14.
Tratamiento y sus potenciales efectos secundariosTratamiento farmacológicoEl tratamiento de los individuos con HTO mayor de 23mmHg, sin glaucoma, retrasa la progresión de los defectos del campo visual. Ensayos clínicos de larga duración, recientemente completados, proporcionan evidencias convincentes de que la disminución de la PIO previene la progresión del glaucoma, tanto en estadios iniciales como tardíos6,11. No está claro que los pacientes con glaucoma y PIO normal obtengan un beneficio relevante al ser tratados16. Puede existir beneficio parcialmente contrarrestado con la mayor frecuencia de aparición de catarata (efecto secundario)15.
La mayoría de los pacientes con GPAA diagnosticados tempranamente en su curso evolutivo y que reciben un tratamiento adecuado, tienen una buena evolución. El tratamiento principal es farmacológico y debe ir dirigido fundamentalmente a mejorar la irrigación arterial de la papila óptica mediante la disminución de la PIO y el aumento del flujo sanguíneo. El objetivo del tratamiento es conseguir una reducción de la PIO lo suficiente como para disminuir la agresión al nervio óptico, lo que se denomina PIO diana. Esta es variable según la PIO inicial, la edad del paciente y el grado de daño del nervio óptico. Esta PIO diana se debe conseguir con la menor medicación posible y con la mejor relación beneficio/riesgo4.
A continuación se detallan los 5 grupos terapéuticos (y asociaciones) más utilizados en el tratamiento del glaucoma2,17.
Bloqueadores betaSon el tratamiento de primera elección, si no hay contraindicaciones. Actúan disminuyendo la secreción del humor acuoso, pero pueden producir bradicardia, hipotensión y broncoespasmo. Están contraindicados en la insuficiencia cardíaca, arritmias, enfermedad pulmonar obstructiva crónica, asma y miastenia grave. Entre los no selectivos encontramos el levobunolol, el timolol y el carteolol; como selectivo β 1 se encuentra el betaxolol (puede usarse en asmáticos).
ProstaglandinasSon la primera opción si no se toleran los β-bloqueantes, o en tratamientos combinados. Aumentan la salida del humor acuoso. Pueden producir pigmentación del iris, alargamiento de pestañas y edema macular cistoide en ojos afáquicos. Están contraindicadas en caso de antecedentes de uveítis o uveítis activa y en glaucomas de origen inflamatorio. Se encuentran comercializados el latanoprost (de primera elección en el GPAA), el bimatoprost y el travoprost.
Inhibidores de la anhidrasa carbónica (IAC)Los inhibidores de la anhidrasa carbónica (IAC) están indicados en pacientes que no pueden utilizar β-bloqueantes o prostaglandinas, y en tratamientos combinados. Disminuyen la secreción del humor acuoso. Pueden producir parestesias, alteraciones gastrointestinales y cálculos renales (vía oral), y por vía tópica: escozor, sabor amargo, visión borrosa y miopía transitoria. Contraindicados en alérgicos a sulfamidas. Por vía oral se usa la acetazolamida, y para tratamiento tópico están disponibles la dorzolamida y la brinzolamida (con menos efectos colaterales).
Agentes adrenérgicosEn este grupo encontramos los agonistas mixtos α y β (dipivefrina) y los selectivos α 2 (clonidina, apraclonidina y brimonidina). Son fármacos de segunda elección, por sus efectos secundarios. Los mixtos pueden producir conjuntivitis alérgica (más frecuente), cefalea, HTA, extrasístoles, taquicardia y midriasis. Los selectivos, escozor y enrojecimiento ocular, así como reacciones alérgicas (30%). La brimonidina tiene mínimos efectos cardiovasculares y no produce midriasis ni taquifilaxia (fármaco de elección de este grupo). Están contraindicados en alteraciones cardiovasculares graves, HTA grave, deterioro grave del campo visual, si se toman inhibidores de la monoaminooxidasa (IMAO) o antidepresivos tricíclicos, y en GAC (excepto la brimonidina).
Agentes colinérgicosFármacos de segunda elección, por sus efectos secundarios. El principio activo disponible es la pilocarpina. Aumenta la eliminación del humor acuoso, y puede provocar miosis, alteraciones de agudeza visual y espasmo de acomodación en jóvenes. Están contraindicados en pacientes jóvenes, con antecedentes de uveítis o cataratas, y asmáticos. Pueden producir disminución de la visión nocturna.
AsociacionesLa de uso más habitual es la asociación de prostaglandinas (latanoprost) con β-bloqueantes no selectivos (timolol). Los efectos secundarios esperables son los potenciales de cada uno de sus componentes.
- 1.
Tratamiento del ataque agudo de glaucoma. Se debe iniciar inmediatamente. El tratamiento inicial es farmacológico, con β-bloqueantes tópicos, hiperosmóticos (vía oral o intravenosa [glicerol o manitol]), inhibidores de la anhidrasa carbónica tópicos o vía oral (acetazolamida) y agonistas α2-adrenérgicos selectivos (brimonidina). A continuación se añade pilocarpina tópica al 1-2%, dos veces, con 15min de intervalo. Pueden usarse corticoides tópicos para suprimir la respuesta inflamatoria. Los mióticos no suelen ser efectivos si la PIO es mayor de 40-50mmHg, debido a anoxia del esfínter pupilar18.
- 2.
Tratamiento con cannabinoides. El cannabis medicinal ha demostrado, en series de casos, reducciones de la PIO de un 24%. Estas reducciones, sin embargo, son de corta duración y no mantenidas18. La dificultad para su uso terapéutico se debe a su efecto psicotrópico y a la escasa duración de su acción. Se están realizando estudios sobre la posibilidad de utilizar algunos derivados sintéticos del cannabis (WIN55212-2, anandamida), sin efectos sobre el sistema nervioso. A nivel experimental, han demostrado actuar como fármacos ideales en el tratamiento del glaucoma, al presentar buena tolerancia tras su aplicación tópica, reducir de forma eficaz la PIO y presentar un probado carácter neuroprotector sobre las células ganglionares de la retina. Existen receptores de cannabinoides en el cuerpo ciliar y en la malla trabecular, así como en las capas internas de la retina (CB1++ y CB2)19. Efectos adversos: midriasis e hiperemia conjuntival.
La lasertrabeculoplastia está indicada en el GPAA como terapia complementaria a la farmacológica2,14.
La laseriridotomía es el tratamiento de elección en el GAC, acompañado de medicación suplementaria para la rápida disminución de la PIO. Como el ojo contralateral tiene un riesgo del 80% de desarrollar un ataque agudo de glaucoma, debe realizarse iridotomía profiláctica9.
Si el láser no es eficaz, se practica la trabeculectomía, creándose un nuevo conducto por el que drena el humor acuoso hasta el espacio subconjuntival. Se ha demostrado un mayor riesgo de cataratas2,14.
El glaucoma congénito siempre requiere tratamiento quirúrgico, generalmente una goniotomía14.
Fármacos que causan o exacerban el glaucomaUna vez definidos los factores de riesgo, las manifestaciones clínicas y los procedimientos diagnósticos que debe conocer el médico de atención primaria sobre esta enfermedad, así como los potenciales efectos secundarios de su tratamiento terapéutico, a continuación se detallan los fármacos que pueden provocar su aparición o agravamiento, en función del tipo de glaucoma (tabla 1):
Glaucoma primario de ángulo abiertoCorticoidesLos corticoides, tanto por vía sistémica como local (tópico e inhalado), administrados a largo plazo, pueden causar un GPAA; los administrados tópicamente tienen un efecto más potente, especialmente en niños20,21. En los niños pequeños, el glaucoma inducido por corticoides se presenta clínicamente como el glaucoma congénito primario. En niños mayores, adultos y ancianos, el cuadro es similar al glaucoma primario de ángulo abierto. El glaucoma inducido por corticoides puede ser reversible, en la mayoría de los casos, al suspender el tratamiento21.
La rimexolona es el corticoide tópico de uso oftálmico, que tiene buena actividad antiinflamatoria, vida media corta y menor riesgo de elevación de la PIO20.
En un estudio de casos y controles en pacientes mayores de 66 años con enfermedad de la vía aérea, se encontró un riesgo mayor de glaucoma entre aquellos que utilizaban corticoides inhalados en dosis altas (> 1.600μg/día de beclometasona o budesonida) durante más de 3 meses (OR=1,44; IC del 95%, 1,01-2,06)22.
En otro estudio, transversal de base poblacional, se encontró mayor riesgo de glaucoma en los pacientes que utilizaban corticoides inhalados a dosis normales (OR=2,6; IC del 95%, 1,2-5,8) y especialmente a los que los utilizaban en dosis elevadas (OR=6,3; IC del 95%, 1,2-38,6); pero esta asociación solo se daba en las personas con antecedentes familiares de glaucoma (OR=2,8; IC del 95%, 1,2-6,8). El origen de la HTO estaría relacionado con los cambios histológicos que producirían los corticoides inhalados en las células trabeculares, que contienen altas concentraciones de receptores específicos corticoides23.
TaxanosEl paclitaxel y el docetaxel, agentes antineoplásicos, producen una exacerbación en los pacientes ya glaucomatosos, desconociéndose su mecanismo de acción21.
Glaucoma de ángulo cerradoPuede desencadenarse un GAC en pacientes que presentan previamente un ángulo iridocorneal estrecho, y que utilizan medicamentos que producen midriasis.
Antidepresivos tricíclicos, heterocíclicos y de tercera generación (inhibidores selectivos de la recaptación de aminas)Los antidepresivos tricíclicos (amitriptilina), los heterocíclicos (mirtazapina, trazodona, reboxetina), y los inhibidores de la recaptación de serotonina (citalopram, fluoxetina, fluvoxamina, paroxetina, sertralina, venlafaxina, duloxetina) pueden desencadenar o agravar un glaucoma.
Sobre todo, duloxetina y venlafaxina, que son inhibidores selectivos de la recaptación de noradrenalina y serotonina, y la reboxetina, que es un inhibidor selectivo de la recaptación de noradrenalina. Estos fármacos tienen un marcado efecto anticolinérgico.
Sin embargo, existe un grupo de antidepresivos sin efecto sobre la PIO: los IMAO selectivos y reversibles, con menor riesgo cardiovascular (moclobemida), y los agonistas melatoninérgicos y antagonistas de los receptores serotoninérgicos, de reciente aparición (agomelatina). Su mecanismo de acción carece de efectos sobre la recaptación de aminas24.
BenzodiacepinasSe debe extremar la precaución durante su uso, por su efecto anticolinérgico, que puede agravar el glaucoma25.
Descongestionantes nasales adrenérgicos tópicosSu uso está contraindicado en pacientes con este tipo de glaucoma24,26.
Medicaciones atropínicasAtropina, nebulizado de ipratropio y tiotropio, antiparkinsonianos anticolinérgicos (biperideno, prociclidina, trihexifenidilo), escopolamina (en la actualidad solo se emplea en cuidados paliativos, por su capacidad para disminuir las secreciones bronquiales, unida a su acción sedante moderada y antiemética)25,27.
Antihistamínicos H1Contraindicados, excepto la loratadina, la desloratadina y la fexofenadina24,25,27.
Antihistamínicos H2Deben utilizarse con precaución por su acción anticolinérgica, aunque débil25.
AntipsicóticosLas fenotiacinas (clorpromacina, levopromacina) y análogos (clozapina) están contraindicados en pacientes glaucomatosos, por sus efectos anticolinérgicos20,21.
Agonistas adrenérgicos β2El salbutamol y la terbutalina están contraindicados también. Se puede prevenir si el paciente utiliza máscaras o protección ocular en el momento de la inhalación, para evitar la absorción del fármaco a partir de la córnea y la conjuntiva20–22.
Anticoagulantes oralesDeben utilizarse con precaución, ya que pueden producir un desprendimiento de retina hemorrágico o una efusión uveal, lo que provocaría un movimiento anterior del diafragma iridocristaliniano, obstruyendo el ángulo iridocorneal24,27.
NitroglicerinaDebe utilizarse con precaución, valorando la relación riesgo/beneficio24,25.
CarbamacepinaEn caso de sobredosificación, por efecto anticolinérgico. Los pacientes tratados con este fármaco deben recibir controles periódicos de la PIO20,21.
Candesartán (ARA II)Es un antihipertensivo, habiéndose descrito en la literatura médica un caso de GAC maligno por efusión coroidea en un paciente tratado con este medicamento28.
ConclusionesEl glaucoma es la primera causa de ceguera irreversible en todo el mundo, su prevalencia en España es del 2%, incrementándose con la edad. Se estima que el 50% de los pacientes permanecen sin diagnosticar, por cursar de forma asintomática en muchos casos hasta fases avanzadas. Dada la irreversibilidad de la ceguera que produce, es importante un diagnóstico y tratamiento precoces. La hipertensión ocular es el único factor de riesgo causal, que además resulta tratable.
En este contexto, es importante que el médico sea consciente de que determinados fármacos, pautados para enfermedades diversas, pueden desencadenar o agravar un glaucoma. Del mismo modo, la población con glaucoma, de edad progresivamente mayor, con distinta comorbilidad asociada, presentan riesgo de agravar su enfermedad de base dependiendo del manejo terapéutico de su glaucoma.
El médico de atención primaria debe estar alerta en estas situaciones; se recomienda derivar a oftalmología a los individuos mayores de 50-65 años sin factores de riesgo, mayores de 40 años con historia familiar de glaucoma, individuos de raza negra, miopía magna o diabetes.
En pacientes con PIO>23mmHg sin glaucoma, el tratamiento adecuado retrasa la progresión de los defectos del campo visual.
El objetivo del tratamiento es conseguir una reducción de la PIO lo suficiente como para disminuir la agresión al nervio óptico, lo que se denomina PIO diana. Esta PIO diana se debe conseguir con la menor medicación posible y con la mejor relación beneficio/riesgo4.
En cuanto al tratamiento farmacológico del glaucoma, los β-bloqueantes son el tratamiento de primera elección, si no hay contraindicaciones.
Las prostaglandinas son la primera opción si no se toleran los β-bloqueantes, o en tratamientos combinados.
Los inhibidores de la anhidrasa carbónica están indicados en pacientes que no pueden utilizar β-bloqueantes o prostaglandinas, y en tratamientos combinados.
Los agentes adrenérgicos son fármacos de segunda elección, por sus efectos secundarios, al igual que los agentes anticolinérgicos.
Respecto a los fármacos que pueden causar o agravar un glaucoma de ángulo abierto, hay que tener especial cuidado con los corticoides (sistémicos o tópicos) en tratamientos de larga duración. Hay que tener especial consideración con los tratamientos tópicos en niños, en los que se presenta clínicamente como el glaucoma congénito primario.
En pacientes con glaucoma de ángulo abierto tratados con paclitaxel o docetaxel, agentes antineoplásicos, puede producirse una exacerbación.
Las pautas terapéuticas con fármacos potencialmente midriáticos obligan a mantener una actitud alerta por su potencial riesgo de desencadenar un glaucoma de ángulo cerrado, especialmente en pacientes con ángulo iridocorneal estrecho: antidepresivos tricíclicos, heterocíclicos y de tercera generación (inhibidores selectivos de la recaptación de aminas); benzodiacepinas; fármacos atropínicos; antihistamínicos H1 y H2; antipsicóticos; agonistas adrenérgicos β2; anticoagulantes orales; nitroglicerina; carbamacepina; candesartán. Los descongestionantes nasales adrenérgicos tópicos están contraindicados.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.