La secreción ectópica de ACTH de causa tumoral es una variante muy poco frecuente dentro de los casos de síndrome de Cushing dependientes de ACTH, representando entre el 7-15% de estos1,2. El 50% de estos casos se deben a un carcinoma microcítico de pulmón (SCLC)3. Otras causas son tumores tímicos, tiroideos, digestivos o feocromocitomas. No obstante, existe un infradiagnóstico de este síndrome debido a la alta agresividad de los tumores4 que pueden enmascarar los síntomas, o a que estos solo secretan precursores de ACTH con baja actividad biológica5. Presentamos un caso de síndrome de Cushing ectópico secundario a un SCLC productor de ACTH.
Se trata de una mujer de 69 años remitida a Urgencias por hallazgo incidental de hiperglucemia de 344mg/dl en analítica preoperatoria por hemorroidectomía, en paciente no diabética.
En la anamnesis dirigida refería polidipsia, poliuria, anorexia y pérdida de peso no cuantificada de 4 meses de evolución, así como tendencia al aislamiento social con aumento de irritabilidad, que había sido valorada por el Servicio de Neurología sin objetivarse enfermedad orgánica que justificase el cuadro.
Entre sus antecedentes personales destacaban tabaquismo de 50 paquetes/año, bebedora de 5 unidades de bebida estándar al día, hipertensión arterial en tratamiento con atenolol/clortalidona 100/25mg/día, bronquitis crónica y dislipidemia. Era catedrática de universidad, jubilada e independiente para las actividades básicas de la vida diaria. Sin hallazgos en la exploración física, salvo TA: 170/85mmHg y hepatomegalia de 3cm.
En la analítica de urgencias se evidenció glucosa 439mg/dl, potasio 2mmol/l, bilirrubina 0,8g/dl, LDH 1.085U/l, ALT 147U/l, AST 55U/l, fosfatasa alcalina 382U/l y gamma-glutamiltransferasa 955U/l, compatible con patrón de colestasis disociada. La gasometría venosa objetivó pH 7,543, pCO2 31,9mmHg, SBC 29mmol/l. El hemograma y la coagulación fueron normales. Análisis sistemático de orina y sedimento urinario con glucosa de 46,6g/l y piuria estéril.
Ante los niveles de potasio, se solicitó un electrocardiograma, el cual presentaba ritmo sinusal con extrasístoles supraventriculares y ventriculares frecuentes, con ondas T aplanadas e invertidas.
Dadas las alteraciones del comportamiento se realizó una TAC craneal urgente que fue normal.
Como parte del manejo terapéutico se administró potasio intravenoso a dosis de 60mEq/día, a un ritmo de infusión de 2,5mEq/h, además de potasio por vía oral a dosis de 96mEq/día. También se administraron 12 unidades de insulina de acción rápida en bolo para corregir la hiperglucemia. Se mantuvo a la paciente con monitorización, y a pesar de las medidas tomadas, tras 24h de reposición, el potasio persistía en 2,20mg/dl, por lo que se procedió al ingreso para estudio y tratamiento.
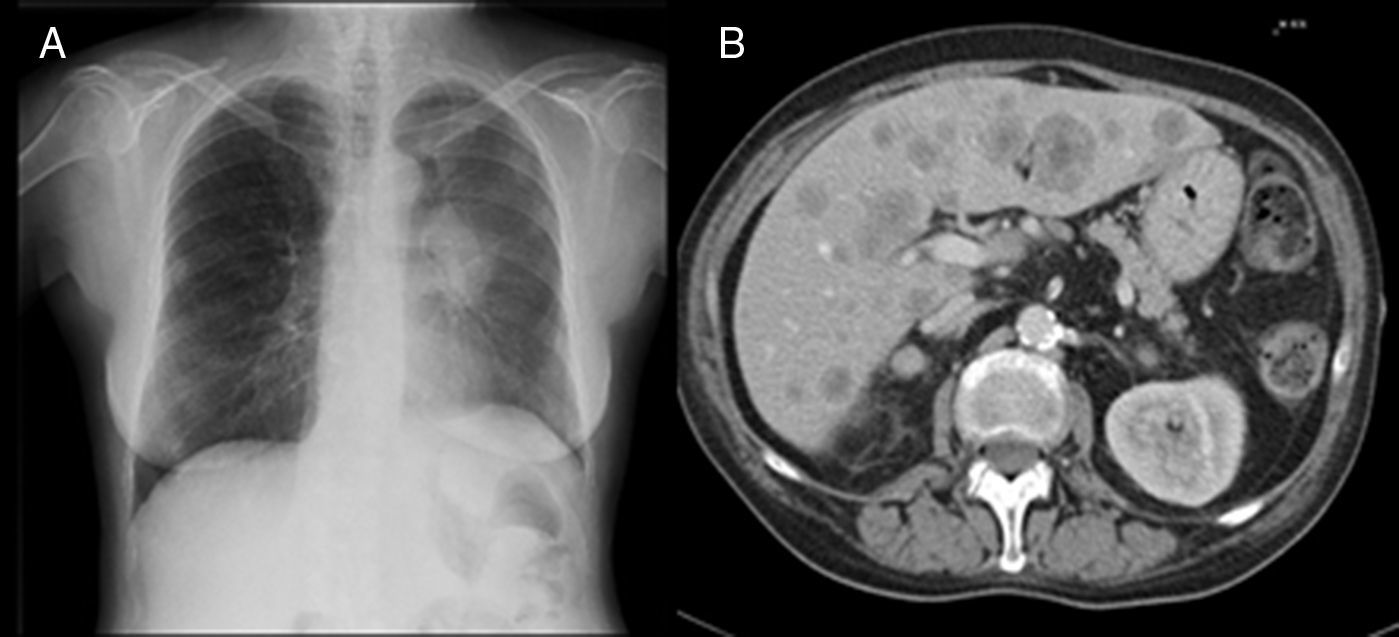
Durante su estancia en planta de hospitalización presentó valores de ACTH de 206pg/ml (valores normales: 9,0-55,0) y cortisol de 70g/dl (valores normales: 6 a 23mcg/dl). Se realizaron ecografía y TC abdominales, que mostraron múltiples lesiones hepáticas ocupantes de espacio indicativas de metástasis (fig. 1B). En la radiografía de tórax se objetivó una masa parahiliar izquierda con atelectasia completa del lóbulo superior, con alta sospecha de tumor primario (fig. 1A). Ante la alta probabilidad de que se tratara de un tumor productor de ACTH, se decidió no ampliar el estudio hormonal.
Con todo ello se estableció el diagnóstico final de SCLC (IV B) con secreción ectópica de ACTH, confirmado por biopsia transbronquial. En el estudio de extensión se objetivaron metástasis en calota y múltiples cuerpos vertebrales en RMN, y en TAC body, afectación pleural, mediastínica, suprarrenal y cerebral.
Se inició tratamiento con metopirona de 250mg, un comprimido cada 6h durante 4 días, y posteriormente se aumentó a dosis de 2 comprimidos cada 6h, con niveles en rango de potasio a los 15 días. La respuesta se mantuvo 8 meses después, con dosis de un comprimido cada 12h. Durante el seguimiento por parte de Oncología, se iniciaron ciclos de quimioterapia paliativa con esquema de carboplatino y etopósido. Debido a la progresión de la enfermedad se inició un segundo esquema con ciclofosfamida, adriamicina y vincristina, con respuesta favorable en mediastino. Finalmente, inició tratamiento con topotecán y radioterapia holocraneal, falleciendo posteriormente.
El SCLC ocurre de forma mayoritaria en fumadores, y aunque es más frecuente en varones, en mujeres tiende a aparecer más temprano y con menor consumo de tabaco6.
La proporción de cáncer de pulmón clasificada como SCLC ha descendido en la población general7; sin embargo, en mujeres ha aumentado debido a los nuevos patrones de consumo8.
La presentación clínica habitual de los SCLC incluye, entre otros, el hallazgo de masas perihiliares de gran tamaño con adenopatías mediastínicas, que se manifiestan con tos, disnea, pérdida de peso y debilidad. Un 70% de los pacientes presentan metástasis en el momento del diagnóstico, especialmente en hígado, glándulas suprarrenales, hueso, médula ósea y cerebro9.
Alrededor del 5% de los pacientes con SCLC desarrollan un síndrome de Cushing ectópico.
El síndrome de Cushing ectópico asociado a SCLC presenta una supervivencia inferior a 6 meses y se caracteriza por hipertensión, debilidad muscular proximal e hiperglucemia. Existe alcalosis hipopotasémica debido al exceso de mineralocorticoides, hallazgo poco frecuente en la enfermedad de Cushing.
La secreción ectópica de ACTH a partir de una neoplasia no se ve inhibida por cortisol. En general, estos tumores que causan secreción ectópica de ACTH tienden a sintetizar cantidades desproporcionadas de precursores de proopiomelanocortina.
Tumores de diverso origen, generalmente carcinomas, se han asociado al síndrome de secreción ectópica de ACTH. De las neoplasias de pulmón, las de estirpe microcítica son las más frecuentes, ya que crecen a partir de células neuroendocrinas en los bronquiolos distales10.
La relevancia de nuestro caso radica en su forma infrecuente de presentación, ya que lo más llamativo fue la hiperglucemia, y no la clínica constitucional y respiratoria que cabría esperar. La asociación de hiperglucemia, hipopotasemia y el patrón de colestasis disociada condujo a ampliar el estudio en la búsqueda de una única causa que justificara el cuadro.
Como conclusión, es importante que ante el hallazgo de una hiperglucemia se realice un diagnóstico diferencial exhaustivo, englobando los diferentes hallazgos clínicos, analíticos y estudios de imagen complementarios, y no solo limitarse a corregirla. Por tanto, ante el hallazgo de una glucemia elevada debemos investigar otras causas (procesos infecciosos, pancreáticos, endocrinopatías o el uso de determinados fármacos, como los diuréticos tiazídicos o los corticoides) antes de iniciar un tratamiento farmacológico asumiendo el diagnóstico de DM tipo 2. Los estudios recomendados en este perfil de paciente serían analítica con perfil renal, hepático, pancreático y hormonal, realización de analítica de orina, así como derivación para realización de radiografía de tórax y gasometría venosa. En nuestro caso, la hipopotasemia asociada (que nos obliga a pensar en un posible origen mineralocorticoide del cuadro) y la colestasis disociada exigieron un estudio más exhaustivo con las pruebas de imagen anteriormente comentadas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.