La leishmaniasis es una infección producida por diversas especies del género Leishmania, que se transmite por la picadura de hembras de mosca pertenecientes al género Phlebotomus.
En nuestro país, la leishmaniasis es una zoonosis que afecta principalmente al perro (reservorio) y al hombre. Aunque es una enfermedad muy prevalente en Latinoamérica y otros países tropicales, la incidencia en la cuenca mediterránea no es nada desdeñable. Hay 3 síndromes clínicos principales: leishmaniasis cutánea, mucocutánea y visceral. La leishmaniasis visceral (LV), también conocida como kala-azar, aparece fundamentalmente en pacientes con algún tipo de inmunodepresión1,2.
Presentamos a continuación un caso de LV en un paciente originario de Marruecos no inmunodeprimido que clínicamente se presentó con importante esplenomegalia y severa pancitopenia.
Caso clínicoVarón de 28 años, originario de Marruecos, residente en nuestro país (en la zona oeste de la comunidad de Madrid) desde hace 5 años. Ha realizado algunos viajes de escasa duración a su país durante este periodo. No antecedentes personales de interés. Acude por fiebre elevada de 7-8 días de evolución y acompañada de artro-mialgias generalizadas. La anamnesis orientada hacia focos infecciosos fue negativa. No factores de riesgo para infección VIH.
Exploración física: TA: 114/46mmHg, T.ª 38,9°C, Sat 95% y buen estado general. No lesiones cutáneas. No signos meníngeos. Cabeza y cuello: adenopatías latero-cervicales de pequeño tamaño, dolorosas a la palpación. Tórax: AC: no soplos; AP: murmullo vesicular conservado. Abdomen: hepatomegalia de 8-10cm en reborde costal derecho y esplenomegalia de 16-18cm en hipocondrio izquierdo del reborde costal izquierdo. Resto normal.
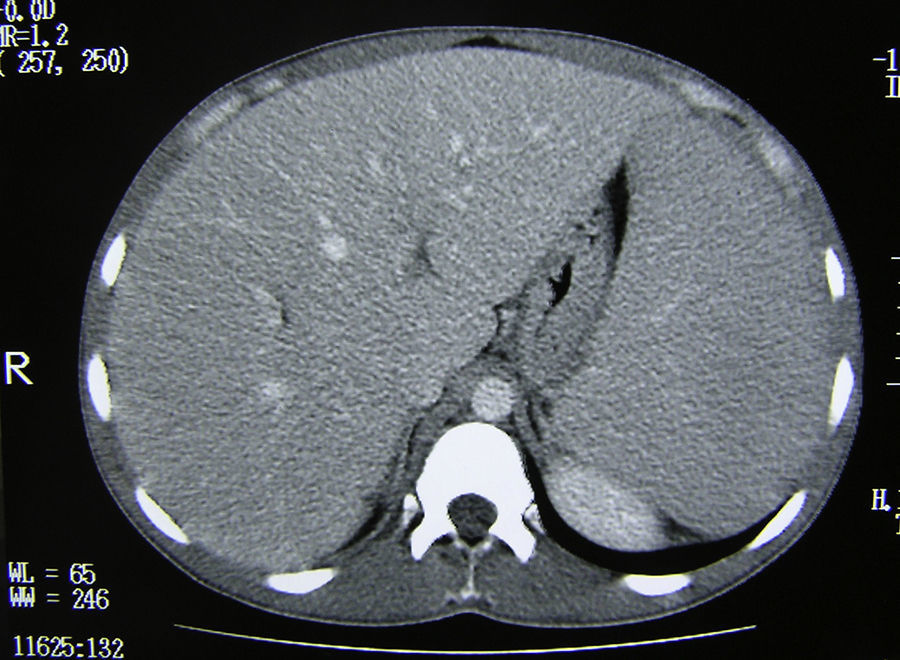
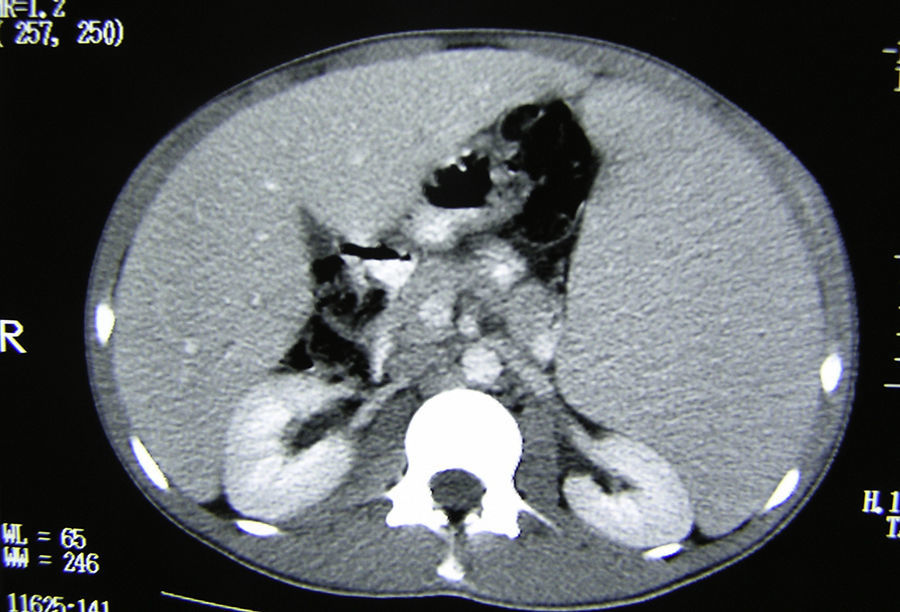
Exploraciones complementariasHemograma: leucocitos 1.400×103/μl (N 54%, L 24%, M 20%), Hb 8,3g/dl, Hto 24%, plaquetas 107×103/μl, VSG 103mm/h bioquímica básica, perfil hepático y coagulación normales. Radiografía simple de tórax (PA y L): normales. Estudio sangre periférica: anisocitosis, no esquistocitos ni poiquilocitos, abundantes granulaciones tóxicas citoplasmáticas. Serologías: VIH, VEB, CMV, VHA, VHB y VHC negativos. Mantoux: negativo. TAC toraco-abdominal: esplenomegalia homogénea gigante de unos 25cm, sin lesiones focales. Moderada hepatomegalia. Adenopatías retroperitoneales múltiples (figs. 1 y 2).
Ante la existencia de pancitopenia y hepatoesplenomegalia se realizó serología para Leishmania donovani (IFI IgG+ 1/64) y biopsia de cresta ilíaca, en la que se objetiva la presencia de formas amastigotes de dicho parásito. Se pautó tratamiento con anfotericina B liposomal, permaneciendo el paciente apirético a partir de las primeras 48h, remitiendo a lo largo del tratamiento la hepatoesplenomegalia y la pancitopenia.
DiscusiónLa LV es una infección sistémica producida por diversas especies del género Leishmania, que se transmite por la picadura de hembras de mosca pertenecientes al género Phlebotomus. Aunque la LV es una enfermedad hipoendémica en el área mediterránea, solo representa entre el 5-6% de todos los casos en el mundo, con una incidencia anual estimada entre 1.200-2.000 casos.
En España, la mayoría de casos de LV se producen en el área este y sur de la península ibérica. Entre 1997 y 2008, las tasas de hospitalización por leishmaniasis permanecieron estables en 0,41 casos por 100.000 habitantes3,4. Entre 2010 y 2012, se produjo un incremento de 5 veces el número de casos habitual en la provincial de Madrid, debido a la aparición de un brote en un área urbana al sur de la capital5,6. En la última década, los casos de leishmaniasis que requirieron ingreso hospitalario en nuestro país se ha asociado básicamente a estar infectado por el VIH (40% de los pacientes), o presentar otro tipo de inmunodepresiones (neoplasias malignas linfo-hematopoyéticas, pacientes trasplantados u otras causas de inmunodepresión)7.
La LV se manifiesta clínicamente con fiebre alta, astenia, pérdida de peso, esplenomegalia que puede ir acompañada de hepatomegalia, pancitopenia, hipoalbuminemia e hipergammaglobulinemia3–6.
El diagnóstico de LV se puede hacer mediante la demostración de la existencia del parásito (amastigotes en frotis o de promastigotes, por cultivo de tejidos o material de aspiración de médula ósea, bazo, y menos frecuentemente de un ganglio linfático o del hígado) o mediante test parasitológicos, serológicos o moleculares (antígeno rK39, IFI, aglutinación directa [DAT-LPC], y PCR en sangre periférica)8.
El tratamiento clásico de la LV fueron los antimoniales pentavalentes, introducidos al final de los 40. Sin embargo, debido a sus altas tasas de resistencias y a sus múltiples efectos secundarios, en los 80 se introdujo como tratamiento habitual la anfotericina B. En las últimas 2 décadas, el desarrollo de la anfotericina liposomal, más eficaz y mucho menos tóxica (aunque mucho más cara) que la tradicional, ha hecho que la FDA considere este como el fármaco de elección en la LV9.
Este es un paciente de origen marroquí no inmunodeprimido que presenta una LV con sintomatología clásica. Al ser tanto España como Marruecos; zonas endémicas de la infección10; el paciente podría haberla adquirido en cualquiera de los 2 países.
Creemos que este caso es útil para incluir en el diagnóstico diferencial de la esplenomegalia y/o pancitopenia vista en atención primaria de la LV.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.