INTRODUCCIÓN
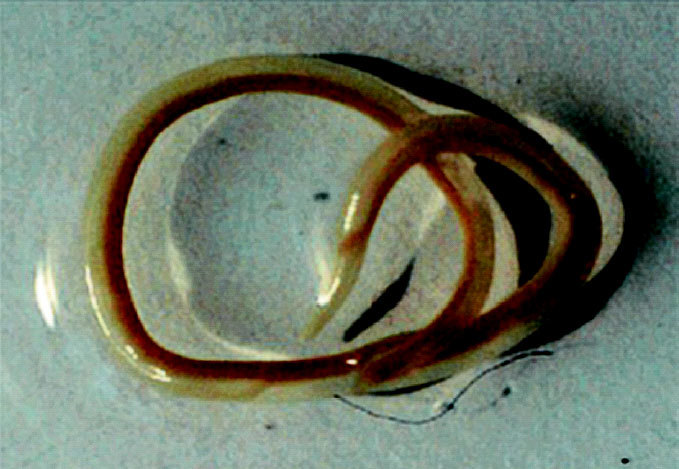
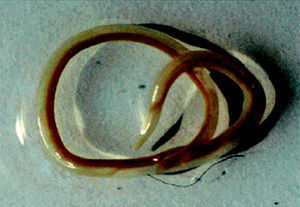
El Anisakis simplex (AS) es un parásito helminto perteneciente a la clase de los nemátodos, de color blanquecino, casi transparente de hasta 3 cm de longitud. Las formas maduras parasitan el estómago de mamíferos marinos, cuyos huevos se eliminan por las heces en una forma no patológica. En el interior del huevo tienen lugar las dos primeras mudas y eclosionan en tercer estadio larvario (L3) con capacidad de permanecer libres y viables en el agua hasta 14 semanas1 y pudiendo ser ingeridas por pequeños crustáceos del plancton. Los peces y cefalópodos se infestan con L3 al ingerir plancton o por depredación de otros que estén contaminados. En ellos el L3 puede migrar del intestino al peritoneo y de allí a los tejidos, enquistándose en vísceras y músculos. Puede tener varios pasos de un pez a otro, pero hasta no ser ingerida por mamíferos marinos no evoluciona a un cuarto estadio larvario (L4) y posteriormente a adulto, completándose el ciclo. Si es ingerida por huéspedes accidentales, como el hombre, permanece en ellos en L3 (fig. 1), aunque hay descritos casos de L4 inmaduros desarrollados en el aparato digestivo humano2,3.
Figura 1. Larva de Anisakis simplex.
Las tasas de parasitación de los pescados que consumimos son muy elevadas, oscilando entre el 40% y el 80% dependiendo de las especies, según datos de los mercados centrales4,5.
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas de la enfermedad se deben a dos mecanismos fisiopatológicos.
ACCION LOCAL DIRECTA
La primera manifestación es la acción local directa del parásito en diferentes localizaciones del tracto digestivo. Se adquiere tras la ingesta de pescados parasitados con larvas vivas que se enganchan a la mucosa gastrointestinal, la sintomatología está producida por la reacción inflamatoria y ocasionalmente por la penetración del parásito que puede invadir otros órganos.
Forma luminal
Sólo existe adherencia del parásito a la mucosa. Suele cursar asintomática, aunque pueden aparecer ligeros trastornos digestivos por un proceso irritativo. El parásito se elimina espontáneamente por la boca o las heces.
Formas invasivas
En las formas invasivas las larvas penetran hasta la submucosa. Se distinguen:
1) La forma gástrica. Es la más frecuente (60%), los síntomas se producen entre las 12 y 48 horas tras la ingesta de pescado y cursa con epigastralgia, náuseas, vómitos e incluso hemorragia digestiva alta por úlcera gastroduodenal6, fiebre o eosinofilia.
2) Forma intestinal. Habitualmente de curso crónico, presenta engrosamiento y edema en la pared intestinal y son frecuentes los granulomas eosinófilos que pueden tener restos del parásito en su interior. El segmento más afectado es el íleon distal7-9. Los síntomas suelen aparecer al séptimo día y comienza como un cuadro de abdomen agudo10, obstrucción intestinal8,9, ascitis hemorrágica por serositis11,12 o síndromes malabsortivos. Debe realizarse diagnóstico diferencial con la ileítis de Crohn y con neoplasias intestinales.
3) Son excepcionales las localizaciones extraintestinales (mesentérica, esplénica13, hepática o apendicular14) y extradigestivas (pulmonar15,16, amigdalina1 y conjuntival17).
REACCIONES DE HIPERSENSIBILIDAD INMEDIATA
Son mediadas por IgE frente a antígenos larvarios termoestables1,18,19, responsables de cuadros de prurito, urticaria, asma, angioedema o respuesta anafiláctica, que constituyen la forma alérgica de la enfermedad. Cursa sin manifestaciones digestivas en pacientes con antecedentes de ingesta de pescado, marisco o cefalópodos aparentemente bien cocinados y con pruebas alérgicas positivas.
Existe una forma mixta (gastroalérgica) con manifestaciones digestivas y alérgicas tras ingerir pescado insuficientemente cocinado, presenta parasitación digestiva y su extracción produce la remisión de los síntomas digestivos y alérgicos1,20,21. Estudios recientes22,23 sugieren que, tanto para producir sensibilización como reacciones alérgicas, es necesario que la larva esté o haya estado parasitando la mucosa digestiva para que los antígenos del parásito lleguen en cantidad suficiente al torrente sanguíneo20,22-24. Pacientes con clínica previa que ingirieron pescado adecuadamente cocinado o a los que se realizaron pruebas de provocación oral con larvas liofilizadas20,23 no presentaron nuevos episodios. Aunque no se puede descartar la existencia de una forma alérgica pura, ésta es menos frecuente de lo que se pensaba.
El diagnóstico de sospecha de esta enfermedad es fundamentalmente clínico. En nuestro medio el consumo de boquerones en vinagre es la fuente de la mayoría de los casos20,22. El diagnóstico de certeza se basa en la identificación de las larvas halladas en el vómito, las heces o la visualización endoscópica o por el estudio histológico de la pieza resecada. Las técnicas de imagen muestran signos inespecíficos. No se realizan pruebas coprológicas, pues la parasitación suele ser por una sola larva y, además, como no alcanza la madurez sexual en los seres humanos no se encontrarán huevos en las heces. En las determinaciones analíticas podemos encontrar leucocitosis con neutrofilia y ocasionalmente (4% al 41%) eosinofilia no muy intensa10,25.
La respuesta inmunológica se puede detectar mediante pruebas cutáneas o por determinación de IgE específica contra AS e IgE total en suero. El gold estándar es la prueba de provocación con larvas no viables, aunque en la práctica clínica habitual no se realiza. Las pruebas cutáneas se realizan por inoculación intradérmica de extracto de AS. La detección de IgE específica en suero permite valorar el grado de sensibilización según el nivel de la misma. Se ha observado una elevada prevalencia de sensibilización en la población asintomática, sin que se conozca por el momento su significado clínico22,26, podría estar relacionada con la elevada parasitación del pescado que consumimos o por las reacciones cruzadas que presenta esta técnica con otras parasitosis. Se han detectado tres antígenos del parásito mediante anticuerpos monoclonales27-29, el más estudiado es el Ani s 130, principal alergeno del que se observa una alta prevalencia de seropositividad entre pacientes con dispepsia acusada31.
La mayor parte de los cuadros de parasitación son autolimitados, ya que la larva se elimina espontáneamente (forma luminal). En la fase aguda de las formas invasivas el tratamiento de elección es la extracción endoscópica, las lesiones se resuelven en 2-3 semanas y remite la clínica alérgica acompañante si la hubiese. En las formas intestinales puede ser preciso resecar el segmento afectado. El tratamiento con antihelmínticos (mebendazol o tiabendazol) no ha demostrado ser eficaz. Las manifestaciones alérgicas se tratan con antihistamínicos, corticoides o adrenalina si fuese preciso, igual que las reacciones de hipersensibilidad de otra etiología.
El mejor tratamiento frente a la anisakiasis son las medidas profilácticas que eviten ingerir pescado crudo o cocinado de forma que permita la viabilidad de la larva. Sólo se conocen dos métodos eficaces capaces de destruir su capacidad infectiva conservando las propiedades del pescado que parasitan: calentándose a más de 60 °C durante 2 minutos y la congelación a -20° C durante al menos 2 horas32. No hay consenso médico sobre si es necesaria una dieta estricta sin pescado en pacientes diagnosticados de alergia al AS, teniendo en cuenta que éste forma parte de la dieta adecuada para otras patologías. Actualmente se recomiendan las siguientes pautas22,25:
Pacientes con formas gastroalérgicas y digestivas:
1) Exclusión total de la dieta de pescados y mariscos crudos o poco cocinados (debe alcanzar temperaturas superiores a 60 °C al menos durante 10 minutos) incluyendo salazones, ahumados, escabeche.
2) Congelar a -20 °C durante 72 horas el pescado o consumirlo ultracongelado.
3) Consumir la parte de la cola del pescado que es la menos parasitada.
4) Si los niveles de IgE específica son muy elevados, durante 2 a 3 meses exclusión total de pescado, cefalópodos o marisco de la dieta, tiempo en que descienden dichos niveles, reintroduciendo después los pescados ultracongelados y los frescos muy cocinados.
Pacientes con alergia:
1) Dieta exenta de pescado33 y, una vez normalizados los niveles de IgE, se suelen realizar las mismas recomendaciones que para las formas gastroalérgica y digestiva22,34.
Para pescados exclusivos de río como la trucha no se aplican estas restricciones.
CASO CLÍNICO
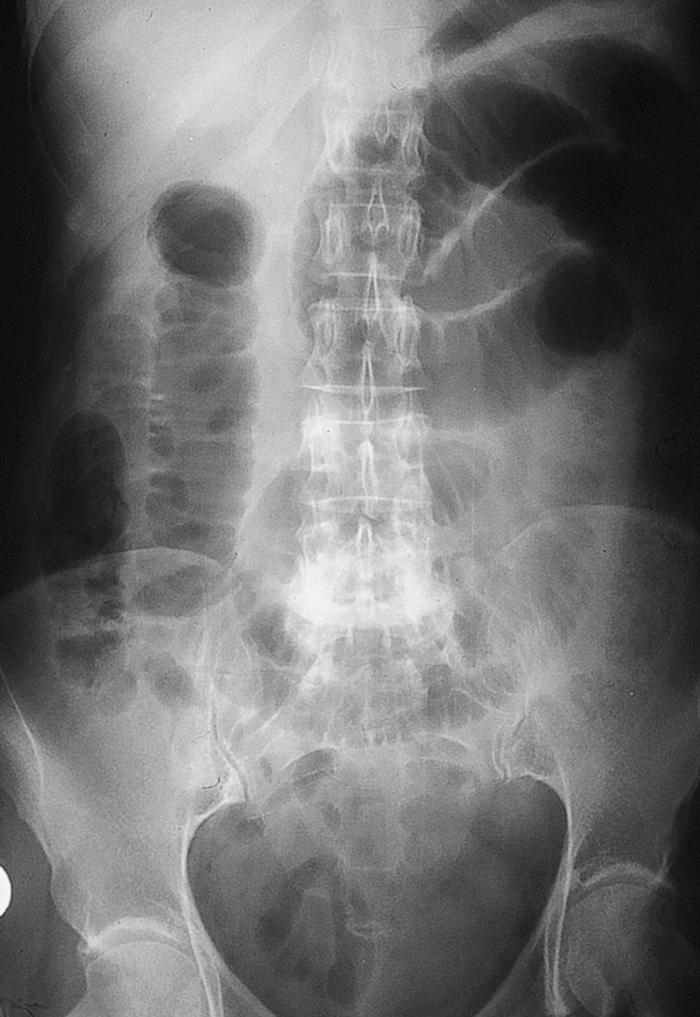
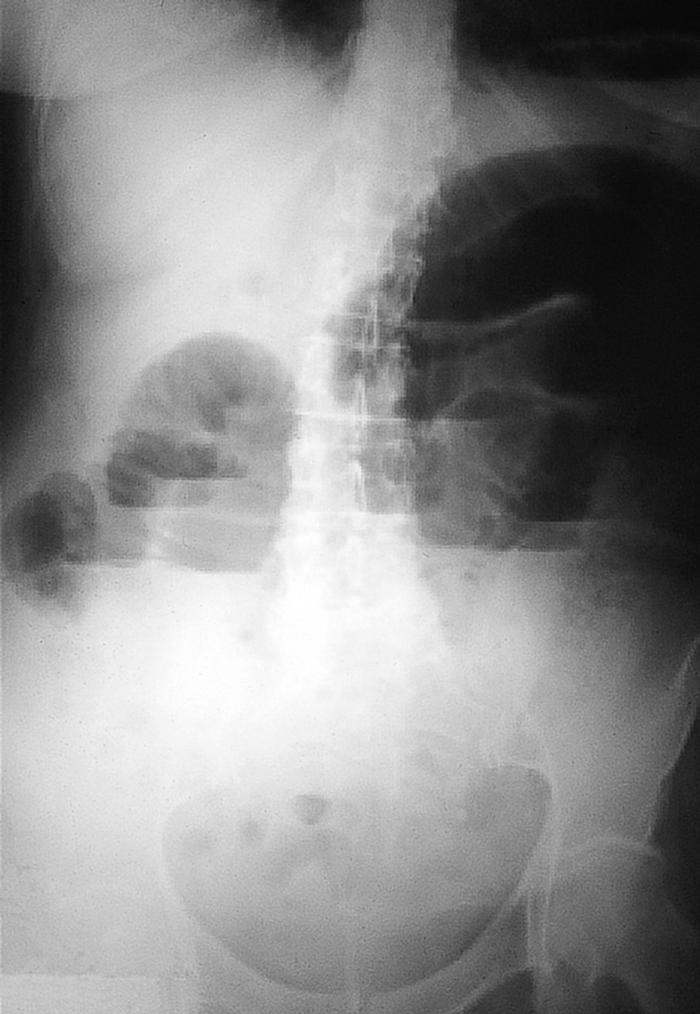
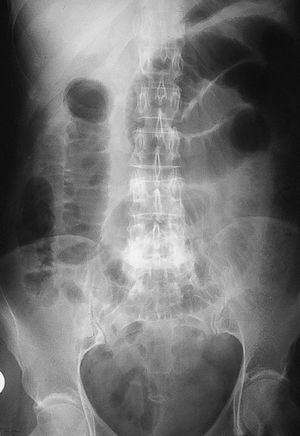
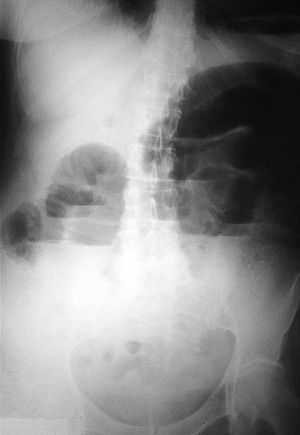
Mujer de 54 años, sin antecedentes de interés, que acude por presentar desde hace 2 días dolor en hemiabdomen superior tipo cólico acompañado de vómitos fecaloideos de 12 horas de evolución. Exploración física: afebril, destaca un abdomen doloroso, distendido y timpánico con aumento de los ruidos hidroaéreos, el resto sin hallazgos de interés. La analítica de sangre (hemograma, bioquímica básica y hemostasia) presenta una leucocitosis (12.900 leucocitos, 86,1% neutrófilos), el resto de los valores están dentro de la normalidad. Radiografía simple de abdomen (fig. 2): dilatación de las asas de intestino delgado y edema de pared. Radiografía en bipedestación (fig. 3): niveles hidroaéreos. Se realiza laparotomía exploradora ante el cuadro de obstrucción de intestino delgado, hallándose serositis segmentaria en yeyuno con restos larvarios de AS. Tras instaurar sueroterapia y dieta absoluta se produce una mejoría de su estado general en las siguientes 72 horas, con desaparición del dolor abdominal, reiniciándose la alimentación oral que tolera sin complicaciones. Ante el antecedente epidemiológico de ingesta de boquerones en vinagre 48 horas antes de la intervención, se realizaron tests cutáneos que fueron positivos para AS y negativos para la batería de pescados de consumo frecuente; así como niveles de IgE total (267 UI/ml; normal < 200) y específica para AS (44; normal < 0,35 RU/ml). La paciente fue diagnosticada de anisakiasis intestinal, se repiten las determinaciones de IgE cada 3 meses, normalizándose sus valores de IgE total despues de un año y permaneciendo elevada la IgE específica (15 RU/ml).
Figura 2. Radiografía simple de abdomen anteroposterior.
Figura 3. Radiografía de abdomen en bipedestación.
DISCUSIÓN
A pesar del gran aumento de casos publicados en los últimos 10 años, el ser una enfermedad de reciente conocimiento, la clínica inespecífica, la alta parasitación del pescado y los hábitos de consumo hacen suponer una incidencia real muy superior a la comunicada, tal como sugieren estudios recientes en los que se detecta una elevada prevalencia de sensibilizaciones en pacientes asintomáticos33, con urticaria26,33, reacciones anafilácticas1 y dispepsia ulcerosa31. Por ello, es importante un mayor conocimiento de esta parasitación que permita una mejor detección de los casos y distinguir las diferentes formas clínicas, para poder así realizar las recomendaciones dietéticas adecuadas que son la base del tratamiento. Los nuevos métodos en experimentación permitirán extender el diagnóstico, reservado hasta ahora para casos agudos o graves (endoscopia) y aclarar su implicación en casos de gastroenteritis o dispepsia ulcerosa.
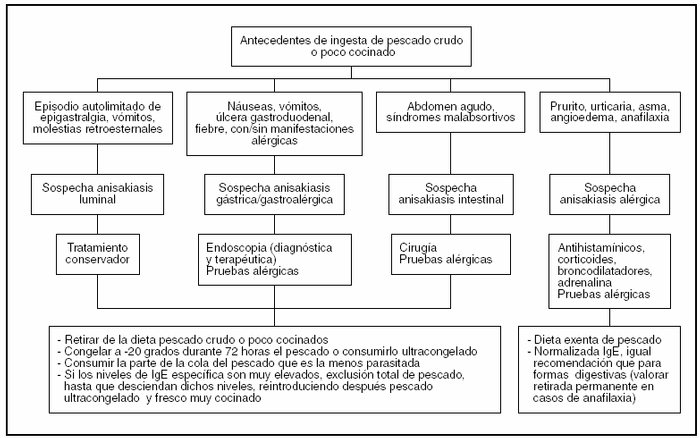
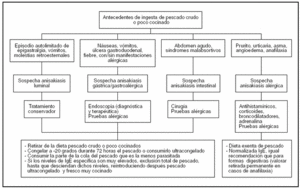
Posiblemente por las razones anteriormente expuestas no hemos encontrado en la literatura guías o protocolos de actuación claramente descritos ante cuadros de parasitación por Anisakis, por lo que describimos nuestra sugerencia respecto a cómo ha de proceder el médico de familia ante la sospecha de anisakiasis en la consulta de Atención Primaria a modo de esquema (fig. 4). La paciente del caso clínico anteriormente presentado podría, según estas recomendaciones, reintroducir en su dieta pescado ultracongelado y cocinado a altas temperaturas.
Figura 4. Guía de actuación ante la sospecha de anisakiasis.
Las normas CEE (Directiva del Consejo de las Comunidades europeas 91/493/CEE, de 22 de julio, traspuesta al Real Decreto 1437/1992, del 27 de noviembre) exigen la evisceración precoz y el examen visual del pescado para la detección y extracción de los parásitos visibles, prohíbe la venta de pescados o de sus partes claramente parasitadas, establece la obligación de congelar al menos a -20 °C durante 24 horas las especies destinadas a consumo crudo, marinado, salado, escabechado o que va-yan a ser sometidas a procesos de ahumado a menos de 60 °C.
Dado que las medidas profilácticas han demostrado ser eficaces, parecen claves fundamentales la información y concienciación de consumidores particulares, mayoristas
y establecimientos de restauración sobre la normativa vigente y la garantía por parte de las autoridades sanitarias de que ésta se cumple para que la incidencia de anisakiasis disminuya.