Parece necesario que las sociedades científicas de AP, ámbito en el cual la prevalencia de HTA es considerable, evalúen periódicamente las directrices internacionales para el manejo de la HTA, sobre todo ante recomendaciones dispares que dificultan la toma de decisiones, en la práctica clínica diaria. El presente documento tiene como objetivo analizar los cambios y novedades propuestos en la guía del American College of Cardiology y de la American Heart Association (ACC/AHA 2017) y en la guía de la European Society of Cardiology y de la European Society of Hypertension (ESC/ESH 2018). Además, analizar las posibles diferencias, limitaciones y su aplicabilidad a la AP de España. En definitiva, se trata de extraer la información más relevante disponible y pertinente, e integrarla para homogeneizar la asistencia al paciente hipertenso desde una perspectiva crítica, pero también razonada.
Las discrepancias entre ambas GPC en aspectos tan trascendentales como el manejo de la enfermedad obligan a la recopilación y análisis crítico de la información que nos permita tomar posición como sociedad científica, interesada en trasladar a todos los médicos de AP las recomendaciones más relevantes, pero a la vez sensatas, de ambas GPC.
The Scientific Societies of Primary Care, being the area in which there is a considerable prevalence of Arterial Hypertension (AHT), need to periodically evaluate the international guidelines for its management. This is particularly relevant when disparate guidelines make it difficult to make decisions in daily clinical practice. The present document has as its aim to analyse the changes and new developments proposed in the guidelines of the American College of Cardiology and the American Heart Association (ACC/AHA 2017), as well as in the guidelines of the European Society of Cardiology and European Society of Hypertension (ESC/ESH 2018). An analysis will be made of any differences, limitations, and their applicability to Primary Care in Spain. Finally, the most relevant available and appropriate information is extracted and integrated in order to homogenise the care of the hypertensive patient, from a critical, but also a reasoned, perspective.
The discrepancies between the recommendations in such essential aspects as the management of the disease, require the compiling and critical analysis of the information that enables us as scientific society, interested in providing all PC physicians with the most relevant, and at the same time, sensible, recommendations of all the guidelines.
La HTA sigue siendo el FRCV más prevalente y que más morbimortalidad y discapacidad produce en el mundo1. Numerosos estudios han demostrado que la falta de control de la PA se relaciona con una mayor incidencia de hospitalización, morbilidad y mortalidad por ECV y enfermedad renal. Las repercusiones sociosanitarias son enormes y ocasionan pérdida en la calidad de vida e incremento de la fragilidad y de la dependencia de las personas.
Las GPC son un elemento clave de la medicina actual, y proporcionan a médicos y a otros profesionales de la salud recomendaciones basadas en la mejor y más actual evidencia científica que ayudan a mejorar la práctica clínica asistencial y a disminuir la incertidumbre. En el campo de la HTA hemos asistido en los últimos años a la publicación de un gran número de guías. En algunos casos las discrepancias entre unas y otras han sido grandes, especialmente en los objetivos de control a alcanzar y mantener en el paciente hipertenso, lo que ha propiciado una falta de acuerdo entre ellas, incertidumbre e incluso desconfianza para su implementación y cumplimiento en la práctica clínica. Por otra parte, la diferente terminología usada en las guías (HTA estadio1 o HTA grado1) también puede llevar a confusión.
Es necesario, por tanto, establecer estrategias encaminadas, por una parte, a clarificar los aspectos confrontados entre guías y, por otra, a sintetizar la información, para así facilitar su buen uso en el ámbito de la AP.
En consonancia con lo anterior, y en el marco de la política puesta en marcha por la Junta Directiva Nacional de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), nace este documento como posicionamiento oficial de la Sociedad para el manejo de la HTA, sobre la base de las dos guías más relevantes y también más utilizadas en la actualidad. Este posicionamiento va dirigido a todos los médicos de AP, dado que la HTA supone uno de los motivos más frecuentes de consulta, con un elevado coste en recursos materiales y humanos.
JustificaciónParece necesario que las sociedades científicas de AP, ámbito en el cual la prevalencia de HTA es considerable, evalúen periódicamente las directrices internacionales para el manejo de la HTA, sobre todo ante recomendaciones dispares que dificultan la toma de decisiones en la práctica clínica diaria. El presente documento tiene como objetivo analizar los cambios y novedades propuestos en la guía del American College of Cardiology y de la American Heart Association (ACC/AHA 2017)2 y en la guía de la European Society of Cardiology y de la European Society of Hypertension (ESC/ESH 2018)3. Además, analizar las posibles diferencias, limitaciones y su aplicabilidad a la AP de España. En definitiva, se trata de extraer la información más relevante disponible y pertinente, e integrarla para homogeneizar la asistencia al paciente hipertenso desde una perspectiva crítica, pero también razonada.
Las discrepancias entre ambas GPC en aspectos tan trascendentales como el manejo de la enfermedad obliga a la recopilación y al análisis crítico de la información que nos permita tomar posición como sociedad científica, interesada en trasladar a todos los médicos de AP las recomendaciones más relevantes, pero a la vez sensatas, de ambas GPC.
MetodologíaEl presente posicionamiento de la SEMERGEN ha sido elaborado por un comité de redacción, constituido por miembros del Grupo de Trabajo de Hipertensión Arterial y Enfermedad Cardiovascular de la Sociedad, todos ellos expertos en cada uno de los apartados objetivo de examen. Para ello, los autores han revisado exhaustivamente la guía americana (ACC/AHA 2017)2 y la guía europea (ESC/ESH 2018)3, examinando y comparando cuáles son las líneas en común y sus diferencias más importantes, alcanzando finalmente un consenso sobre las recomendaciones que se exponen y resumen en este manuscrito.
Los autores manifestamos que esta es la opinión de este grupo de trabajo y que puede no coincidir con la de otros profesionales dedicados al manejo del RCV en los pacientes hipertensos, estimando que las reflexiones y recomendaciones que se plantean se adaptan a las necesidades del médico de familia que diagnostica y trata a estos pacientes. En consecuencia, de este trabajo surge la propuesta del Grupo de Trabajo de Hipertensión Arterial y Enfermedad Cardiovascular de la SEMERGEN para el manejo más adecuado del paciente hipertenso en el ámbito de la AP en España.
Las limitaciones son las propias de un documento de opinión de expertos en HTA que han analizado ambas guías intentando extraer la mejor evidencia de cada una de ellas y exponer en una lectura breve el posicionamiento de una sociedad científica conocedora de la AP en España.
Niveles de evidencia y clase de recomendaciónLa guía americana fue promovida por el ACC y la AHA en colaboración con el National Heart Lung and Blood Institute y nueve sociedades científicas más. La metodología utilizada está expuesta en el documento y se considera la clase (fortaleza) de la recomendación (CR) y el nivel (calidad) de la evidencia (NE) de forma sistemática (tabla 1). La guía impulsada por las Sociedades Europeas de Cardiología e Hipertensión valora el nivel de evidencia y la fuerza de la recomendación de una opción diagnóstica o terapéutica de acuerdo con escalas predefinidas, tal como se indica en la tabla 2.
Niveles de evidencia y clase de recomendación de la guía ACC/AHA 2017
| Clase (fortaleza) de las recomendaciones | Nivel (calidad) de las evidencias |
|---|---|
| Clase I fuerte. Beneficio>>Riesgo | Nivel A |
| Frases sugeridas para escribir las recomendaciones: | Evidencia de la calidad alta de más de un ensayo clínico aleatorio (ECA) |
| Se recomienda | Metaanálisis de ECA de alta calidad |
| Se indica/es útil/efectivo/beneficioso | Uno o más ECA corroborados de registros de estudios de alta calidad |
| Debería llevarse a cabo/administrado/otros | |
| Frases del efecto comparativo: | |
| El tratamiento o la estrategia A recomienda/se prefiere al tratamiento B | |
| El tratamiento A debería elegirse sobre el B | |
| Clase IIa (moderada). Beneficio>Riesgo | Nivel B-A (aleatorizado) |
| Frases sugeridas para escribir las recomendaciones: | Evidencia de calidad moderada de uno o más de un ECA |
| Es razonable | Metaanálisis de ECA de calidad moderada |
| Puede ser útil/efectivo/beneficioso | |
| Frases comparativas sobre efectividad | |
| El tratamiento/se recomienda probablemente la estrategia A/es preferible a la estrategia B | |
| Es razonable elegir el tratamiento A sobre el tratamiento B | |
| Clase IIB (débil). Beneficio≥Riesgo | Nivel B-NA (no aleatorizado) |
| Frases sugeridas para escribir las recomendaciones: | Evidencia de calidad proveniente de uno o más estudios no aleatorizados bien diseñados y ejecutados, estudios observacionales o registro de estudios |
| No se recomienda | Metaanálisis de esos estudios |
| No se indica/no es útil/efectivo/beneficioso | |
| No se debería realizar/administrar/otros | |
| Clase III: no es beneficioso (moderado). Beneficio=Riesgo | Nivel C-DL (datos limitados) |
| Frases sugeridas para escribir las recomendaciones: | Estudios observacionales o registros de estudios aleatorizados o no aleatorizados con limitaciones en el diseño o en la ejecución |
| No se recomienda | Metaanálisis de dichos estudios |
| No se indica/útil/efectiva/beneficiosa | Estudios sobre fisiología y mecánica realizados en humanos |
| No se debería realizar/administrar/otras | |
| Clase III: es perjudicial (fuerte). Riesgo>Beneficio | Nivel C-OE (opinión de expertos) |
| Frases sugeridas para escribir las recomendaciones: | Consenso de opinión de expertos basado en la experiencia clínica |
| Potencialmente perjudicial | |
| Causa daño, perjuicio | |
| Se asocia con un exceso de morbilidad/mortalidad | |
| No se debería realizar/administrar/otras |
Niveles de evidencia y clase de recomendación de la Guía ESC/ESH 2018
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metaanálisis |
| Nivel de evidencia B | Datos procedentes de un único ensayo clínico aleatorizado o de grandes estudios no aleatorizados |
| Nivel de evidencia A | Consenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos, registros |
| Clase de recomendación | Definición | Denominación propuesta |
|---|---|---|
| Clase I | Evidencia y/o acuerdo general en que un determinado procedimiento diagnóstico/tratamiento es beneficios, útil y efectivo | Se recomienda/está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento | |
| Clase IIa | El peso de la evidencia/opinión está a favor de la utilidad/eficacia | Se puede considerar |
| Clase IIb | La utilidad/eficacia está menos establecida por la evidencia/opinión | Se puede recomendar |
| Clase III | Evidencia o acuerdo general en que el tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda |
La guía ESC/ESH 20183 aconseja la medida de la PA con métodos auscultatorios y oscilométricos semiautomáticos o automáticos en consulta. Estos dispositivos deben ser validados de acuerdo a condiciones y protocolos estandarizados. La PA debe medirse en la primera visita en ambos brazos, utilizando un tamaño apropiado del manguito para la circunferencia del brazo. Si hay diferencia de PA entre ambos brazos, se debe usar el brazo con los valores de PA más altos para todas las mediciones.
Los pacientes deben estar sentados, en un ambiente tranquilo, durante 5min antes de comenzar la toma de la PA. Se deben registrar tres mediciones de la PA, con una diferencia de 1-2min, y se realizarán dos mediciones adicionales solo si las primeras lecturas difieren >10mmHg. La PA se registra como el promedio de las dos últimas lecturas. En ancianos y pacientes con DM se debe de tomar la PA en el minuto1 y3 tras ponerse de pie, para descartar hipotensión ortostática.
La AMPA se debe realizar en condiciones basales, con un monitor de PA semiautomático y validado. Se recomienda la medición 3días y preferiblemente 6-7días consecutivos, con lecturas por la mañana y por la noche, realizando dos determinaciones cada vez, separadas 1-2min. Se tiene en cuenta la media de todas las mediciones. La MAPA se realiza con registros de PA a intervalos de 15 a 30min durante un periodo generalmente de 24h. Se establecen los promedios para las horas diurnas, nocturnas y de 24h. Se requiere al menos un 70% de mediciones para considerar una MAPA válida.
La guía americana2 realiza las mismas consideraciones para la medida de la PA, con mínimas diferencias respecto a la guía europea. Así, para el diagnóstico se basará en la media de dos o más lecturas, en dos o más ocasiones y siguiendo las recomendaciones para la medida correcta de la PA.
Respecto a la AMPA, recomienda realizar por lo menos dos lecturas separadas 1min en la mañana, antes de tomar la medicación antihipertensiva, y en la noche, antes de la cena. Aconseja medir y registrar la PA a diario. Lo ideal es obtener lecturas semanales de la PA durante 2semanas tras un cambio en el régimen de tratamiento y durante la semana anterior a una visita a la clínica.
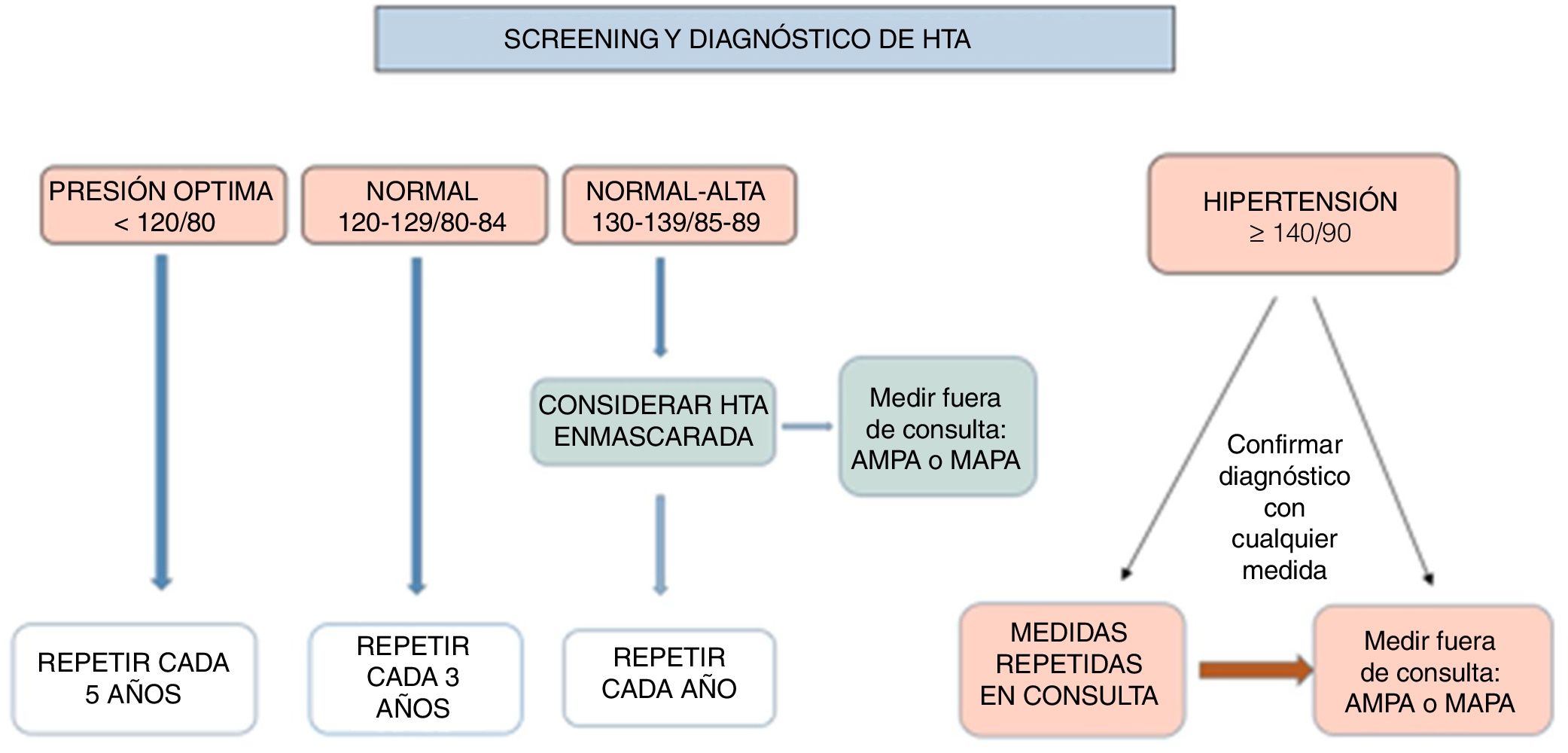
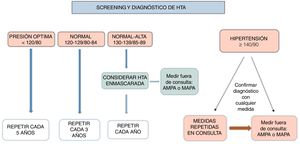
Cribado de HTALa guía europea3 dedica un capítulo a la detección de la HTA en los adultos. Dada la alta prevalencia de la HTA, considera conveniente que existan programas de detección que garanticen que la PA se mida en todos los adultos al menos cada 5años, y con mayor frecuencia en personas con una PA normal-alta.
La guía americana aconseja en personas con PA <120/80mmHg promover estilos de vida saludables y revisión anual (CRIIa)2,3.
Las recomendaciones de cribado según la guía europea (I/C) se muestran en la figura 1.
Nuestro grupo considera importante el cribado ocasional de la HTA en familiares de hipertensos y/o pacientes con otros factores de riesgo cardiovascular, y en todos los pacientes que acudan a consulta mayores de 40años, independientemente de la razón de esta, para identificar de forma precoz al hipertenso no conocido, implementando lo antes posible las medidas de confirmación y así evitar la progresión de la enfermedad.
Diagnóstico de HTALos valores de umbral para el diagnóstico de HTA son arbitrarios, pero se usan para simplificar el diagnóstico y las decisiones sobre el tratamiento, ya que la HTA se define como el nivel de PA en que los beneficios del tratamiento (ya sean cambios en el estilo de vida o farmacológico) superan los riesgos derivados del tratamiento, según los resultados de múltiples ensayos clínicos4,5.
Cuando, debido a una elevación de la PA, sospechamos que el paciente pueda ser hipertenso, necesitamos realizar mediciones repetidas en condiciones basales de la PA en clínica para confirmar el diagnóstico de hipertensión, y también, si es posible, fuera de la consulta, mediante AMPA o MAPA6. Estas técnicas son mejores a la hora de predecir morbilidad, mortalidad y LOD (I/C)3.
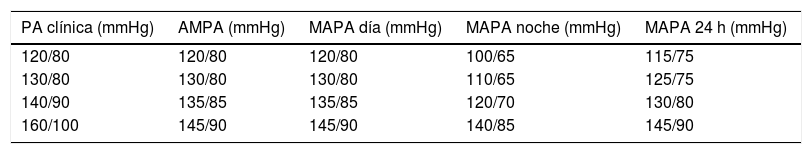
¿Qué dicen las dos guías sobre el diagnóstico de la HTA?La guía americana2 considera valores ≥130 y/o 80mmHg para establecer el diagnóstico de HTA y recomienda la medida de la PA fuera de la consulta para confirmar el diagnóstico o para titular dosis de fármacos (I/A). Se reconoce que la AMPA tiene mayor aplicabilidad que la MAPA y propone una pauta de 7días, con dos lecturas en la mañana y dos en la noche, antes de la toma de la medicación antihipertensiva. En la tabla 3 se expone la correspondencia de lecturas entre PA clínica, AMPA y MAPA.
Valores de PAS y PAD según PA clínica, AMPA y MAPA
| PA clínica (mmHg) | AMPA (mmHg) | MAPA día (mmHg) | MAPA noche (mmHg) | MAPA 24 h (mmHg) |
|---|---|---|---|---|
| 120/80 | 120/80 | 120/80 | 100/65 | 115/75 |
| 130/80 | 130/80 | 130/80 | 110/65 | 125/75 |
| 140/90 | 135/85 | 135/85 | 120/70 | 130/80 |
| 160/100 | 145/90 | 145/90 | 140/85 | 145/90 |
AMPA: automedida domiciliaria de la presión arterial; MAPA: monitorización ambulatoria de la presión arterial; PA: presión arterial.
La guía europea3 define HTA como valores de PAS en la consulta ≥140mmHg y/o valores de PAD ≥90mmHg. Las mismas cifras se usan en jóvenes, personas de mediana edad y ancianos, mientras que en niños y adolescentes se utilizan los centiles de PA. Estos valores de PAS en la consulta ≥140mmHg y/o PAD ≥90mmHg son equivalentes a un promedio de MAPA de 24h de ≥130/80mmHg, o un AMPA promedio ≥135/85mmHg (tabla 4). Se recomienda que cuando se diagnostica HTA se confirme el diagnóstico con AMPA o MAPA (I/C).
- •
Nuestro grupo, independientemente del punto de corte utilizado, también recomienda que se utilice AMPA y/o MAPA para confirmar el diagnóstico de HTA.
Definición de HTA de acuerdo a la PA clínica, AMPA o MAPA
| Categoría | PAS (mmHg) | PAD (mmHg) | |
|---|---|---|---|
| PA clínica | ≥ 140 | y/o | ≥ 90 |
| AMPA | ≥ 135 | y/o | ≥ 85 |
| MAPA | |||
| Media periodo diurno | ≥ 135 | y/o | ≥ 85 |
| Media periodo nocturno | ≥ 120 | y/o | ≥ 70 |
| Media 24 h | ≥ 130 | y/o | ≥ 80 |
AMPA: automedida domiciliaria de la presión arterial; MAPA: monitorización ambulatoria de presión arterial; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
La guía europea3 se refiere a la HTA de bata blanca como la HTA no tratada en la que la PA se eleva en la consulta pero es normal cuando se mide por AMPA, MAPA o ambos. Por el contrario, HTA enmascarada se refiere a pacientes no tratados en los cuales la PA es normal en la consulta pero está elevada cuando se mide por AMPA o MAPA. Aunque en su origen los términos HTA de bata blanca e HTA enmascarada se definieron para las personas que no estaban siendo tratadas por HTA, ahora también se usan para describir discrepancias entre la PA en consulta y fuera de ella en pacientes hipertensos tratados.
Aunque ambas guías hacen especial hincapié en la utilización del AMPA y MAPA para el diagnóstico de HTA en estas situaciones y para detectar el tránsito de HTA de bata blanca a HTA sostenida, la guía americana presenta algoritmos específicos para el diagnóstico de la HTA de bata blanca e HTA enmascarada tanto en pacientes no tratados como en los que ya reciben antihipertensivos.
Clasificación de la HTALa guía americana clasifica la PA en 4 niveles en base a las cifras medias de PAS y PAD obtenidas en la clínica (tabla 5).
Categorías de PA según PAS y PAD (I/B-NR)
| Categoría de PA | PAS (mmHg) | PAD (mmHg) | |
|---|---|---|---|
| Normal | < 120 | y | < 80 |
| Elevada | 120-129 | y | <80 |
| Hipertensión | |||
| Estadio 1 | 130-139 | o | 80-89 |
| Estadio 2 | ≥ 140 | o | ≥ 90 |
NR: hace referencia a estudios no aleatorizados; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Los sujetos con PAS y PAD en distintas categorías se clasifican en la categoría más alta.
La guía europea mantiene la clasificación previa. La categoría de PA (tabla 6) se define según la PA clínica en sedestación y por el nivel más alto de PA, ya sea sistólica o diastólica (I/C). La hipertensión sistólica aislada se clasifica en 1, 2 o 3 de acuerdo con los valores de PAS en los intervalos indicados. La misma clasificación se usa para todas las edades desde los 16años.
- •
Nuestro grupo considera que es evidente que a los pacientes con PA≥140/90 hay que considerarlos a todos como hipertensos y a los pacientes con estadio1 (130-139 y 80-89mmHg) considerarlos como pacientes de alto riesgo de hacerse hipertensos, y que en algunos casos, como en los de riesgo cardiovascular elevado (prevención secundaria o prevención primaria de riesgo elevado), se deberían considerar también hipertensos y valorar el inicio del tratamiento farmacológico; en este caso ambas guías coinciden, aunque la americana es más categórica.
Clasificación de la PA en consulta y definiciones de grado de HTA
| Categoría | PAS (mmHg) | PAD (mmHg) | |
|---|---|---|---|
| Óptima | < 120 | y | < 80 |
| Normal | 120-129 | y/o | 80-84 |
| Normal-alta | 130-139 | y/o | 85-89 |
| HTA grado 1 | 140-159 | y/o | 90-99 |
| HTA grado 2 | 160-179 | y/o | 100-109 |
| HTA grado 3 | ≥ 180 | y/o | ≥ 110 |
| HTA sistólica aislada | ≥ 140 | y | < 90 |
HTA: hipertensión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Debido a la coexistencia de la HTA con otras condiciones crónicas, la guía americana2 recomienda realizar cribado y manejo de otros FRCV modificables en pacientes con HTA: tabaquismo activo y pasivo, DM, dislipidemia, sobrepeso y obesidad, inactividad física y dieta no saludable. La interrelación entre la HTA y otros FRCV como causa de ECV está claramente demostrada. La guía europea3 comparte también la necesidad de realizar una valoración completa de los pacientes hipertensos.
La evaluación del paciente (protocolo de estudio de HTA) tiene los siguientes objetivos: establecer el diagnóstico y el grado de HTA, buscar posibles causas de una HTA secundaria (tabla 7), evaluar el RCV asociado mediante la detección de otros FRCV (tabla 8), así como detectar la presencia de LOD o de ECV establecida y de otras comorbilidades (tabla 9). Un aspecto relevante (y novedoso) en las guías europeas3 es la consideración por primera vez de la frecuencia cardíaca (>80lpm) como factor de riesgo para desarrollo de hipertensión y que habrá que tener en cuenta en la valoración clínica de los pacientes.
HTA esencial y secundaria. Diferencias entre ambas guías
| HTA esencial (ACC/AHA 2017) | HTA esencial (ESC/ESH 2018) |
|---|---|
| Aumento gradual y lento de la PAEstilos de vida que favorecen la elevación de la PA (ganancia de peso, dieta de alto contenido en sal, disminución de la actividad física, cambios laborales que conllevan cambios dietéticos; p.ej., por viajes frecuentes, consumo excesivo de alcohol)Historia familiar de HTA | Historial familiar y personal de HTA, ECV, ACV, enfermedad renalHistorial familiar y personal de los factores de riesgo asociados (hipercolesterolemia familiar…)Hábito tabáquicoDieta y consumo de salConsumo de alcoholFalta de ejercicio/sedentarismoAlteración del sueño, ronquidos, apnea del sueño…HTA en el embarazo/preeclampsiaSíntomas de afectación de órgano diana |
| Historial de posible HTA secundaria ACC/AHA 2017 | Historial de posible HTA secundaria 2018 |
|---|---|
| PA lábil, crisis de palpitaciones, palidez y mareos (feocromocitoma)Ronquidos, somnolencia (SAHS)Clínica miccional (ERC de etiología obstructiva)Calambres musculares, debilidad (hipopotasemia por hiperaldosteronismo primario o secundario por HTA renovascular)Pérdida de peso, palpitaciones, intolerancia al calor (hipertiroidismo)Edemas, fatiga, poliuria (ERC)Historia de coartación de aorta intervenida (HTA residual)Obesidad central, cara de luna llena, equimosis con traumatismos mínimos (síndrome de Cushing)Toma de fármacos o sustancias presoras (p.ej., alcohol, AINE, cocaína, anfetaminas)Ausencia de historia familiar de HTA | Inicio en < 40 años de HTA grado 2 o 3, desarrollo súbito de HTA o un empeoramiento rápido de la PA en pacientes mayoresEnfermedad del tracto urinario/renalAbuso de drogas, terapias con corticoides, vasoconstrictores nasales, quimioterapia, regalizEpisodios repetidos de sudoración, dolor de cabeza, ansiedad, palpitaciones sugestivas de feocromocitomaAntecedentes de hipocalemia espontánea o secundaria a diuréticos, debilidad muscular y tetania (hiperaldosteronismo)Síntomas sugestivos de enfermedad tiroidea o hiperparatiroidismoUso de anticonceptivos oralesApnea del sueño |
ACV: accidente cerebrovascular; AINE: antiinflamatorio no esteroideo; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; HTA: hipertensión arterial; PA: presión arterial; SAHS: síndrome de apnea-hipopnea del sueño.
Factores que influyen en el RCV del paciente hipertenso según ambas guías
| ACC/AHA 2017 | ESC/ESH 2018 | |
|---|---|---|
| CR/NE | Factores de riesgo modificables | Sexo: hombres > mujeresEdadTabacoColesterol total y cHDLÁcido úricoDiabetes mellitusSobrepeso-obesidadHistoria familiar de enfermedad cardiovascular prematura (hombres < 55 años y mujeres <65 años)Historia familiar de HTA prematuraMenopausia precozSedentarismoFactores socioeconómicosFrecuencia cardiaca (> 85 lpm) |
| I/B-NR | Fumador activo/pasivoDiabetes mellitusDislipemia/hipercolesterolemiaSobrepeso/obesidadInactividad físicaMalos hábitos dietéticos | |
| CR/NE | Factores de riesgo no modificables o difícil modificación | |
| I/B-NR | Enfermedad renal crónicaHistoria familiarEdad avanzadaNivel socioeconómico o educacional bajoSexo masculinoApnea obstructiva del sueñoStress psicosocial |
cHDL: colesterol ligado a lipoproteínas de alta densidad; CR/NE: clase de recomendación/nivel de evidencia; HTA: hipertensión arterial; NR: hace referencia a estudios no aleatorizados.
Lesión de órgano diana y enfermedad cardiovascular y renal según la guía europea3
| Lesión de órgano diana subclínica |
| Rigidez arterial: |
| Presión pulso (en personas mayores) ≥ 60mmHg |
| Velocidad de onda de pulso carótido-femoral > 10 m/s |
| ECG: HVI |
| Ecocardiografía: HVI |
| Microalbuminuria o elevación del cociente albumina/creatinina |
| Daño renal moderado (FG >30-59 ml/min) o severo (<30 ml/min) |
| Índice tobillo/brazo < 0,9 |
| Retinopatía: hemorragias o exudados, papiledema |
| Enfermedad cerebrovascular: ACV, AIT, hemorragia cerebral |
| Enfermedad cardiovascular: IAM, angina… |
| Presencia de placas de ateromatosis |
| Insuficiencia cardiaca (incluida IC preservada) |
| Fibrilación auricular |
| Enfermedad arterial periférica |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; ECG: electrocardiograma; FG: filtrado glomerular; HVI: hipertrofia ventricular izquierda; IAM: infarto agudo de miocardio; IC: insuficiencia cardíaca.
En la primera fase de evaluación global del paciente lo primero sería descartar HTA secundaria. En la tabla 7 se exponen las diferencias de ambas guías para el cribado de HTA secundaria.
- •
Nuestro grupo sugiere la importancia de la búsqueda sistemática de HTA secundaria, sobre todo ante circunstancias que hagan sospecharla. Alguna prueba de utilidad que sí está en la cartera de servicios de AP en nuestro país y podría hacerse en estos casos sería solicitar ecografía renal, hormonas tiroideas, test EPWORTH, cortisol en orina de 24h, etc.
Una vez descartada HTA secundaria, el siguiente paso sería la evaluación global del paciente para tomar decisiones terapéuticas. En las tablas 8 y 9 se describen los factores que ambas guías consideran que hay que tener en cuenta en esta valoración global.
La guía americana2 recomienda realizar una búsqueda activa de la existencia de LOD y hace especial hincapié en la velocidad de onda de pulso carótido-femoral, el GIM carotídeo y el score calcio coronario, indicando que en los dos últimos, a pesar de que se asocian a un incremento en el número de eventos cardiovasculares, hay poca información sobre si la actuación sobre estos marcadores se traduciría en una reducción de ellos. En este sentido la guía europea3 no incluye la medición del GIM dentro de las actuaciones a llevar a cabo para identificar LOD, aunque recalca la importancia de la existencia de placas de ateroma en las carótidas, que reclasificaría el RCV del paciente de intermedio a alto riesgo; no lo recomienda como una intervención rutinaria en el paciente hipertenso, excepto que clínicamente esté indicado.
La guía americana utiliza la ACC/AHA 2013 Cardiovascular Risk Assessment para la valoración del RCV en pacientes hipertensos7. La Guía ESC/ESH 20183 recomienda la estratificación del RCV en todos los pacientes hipertensos que no estén ya en riesgo alto o muy alto, mediante el sistema SCORE, para poder realizar una correcta clasificación de los pacientes y para decidir cuándo y qué pauta de tratamiento es la más adecuada. Es importante tener en cuenta en la valoración inicial del paciente hipertenso una serie de situaciones que aumentan el RCV estimado por SCORE8; esto es de especial relevancia en los pacientes con un RCV moderado, ya que podría obligarnos a reclasificar su nivel de riesgo, y esto tendría consecuencias en las medidas terapéuticas adoptadas (tabla 10).
Modificadores que incrementan el RCV estimado por SCORE (guía ESC/ESH 2018)
| Aislamiento social: origen de muchas causas de ECV |
| Obesidad (IMC) y obesidad central (circunferencia cintura) |
| Inactividad física |
| Estrés psicosocial |
| Historia familiar de ECV prematura (varones < 55 años y mujeres < 60 años) |
| Enfermedades autoinmunes y procesos inflamatorios |
| Trastorno psiquiátrico mayor |
| Tratamiento VIH |
| Fibrilación auricular |
| Hipertrofia VI |
| Enfermedad renal crónica |
| Síndrome de apnea obstructiva del sueño |
ECV: enfermedad cardiovascular; IMC: índice de masa corporal; VI: ventrículo izquierdo; VIH: virus de inmunodeficiencia humana.
En el estudio del paciente hipertenso hay una serie de pruebas rutinarias básicas y otras opcionales (tabla 11) encaminadas a una correcta valoración e identificación precoz de LOD.
Estudio del paciente hipertenso según las dos guías
| Pruebas básicas (ACC/AHA 2017) | Pruebas básicas (ESC/ESH 2018) | CR/NE |
|---|---|---|
| HemogramaGlucemia en ayunasPerfil lipídicoCreatinina sérica y FGSodio, potasio y calcio séricosTSHAnálisis de orina sistemático y sedimentoECG | Hemograma: hemoglobina y hematocritoGlucosa en ayunas y HbA1cColesterol total, LDL, HDL, triglicéridosSodio, potasioÁcido úricoFGe y creatininaPruebas de función hepáticaAnálisis de orina, cociente albúmina/creatininaECG | I/B |
| Pruebas opcionales (ACC/AHA 2017) | Pruebas opcionales (ESC/ESH 2018) | |
|---|---|---|
| EcocardiogramaÁcido úricoCociente albúmina/creatinina en una muestra aislada de orina | Ecocardiografía: pacientes con alteraciones en ECG o en caso de signos o síntomas de disfunción de VIEco-doppler carotídeo: para determinar la existencia de placas o estenosis carotídeas en pacientes con enfermedad vascular en otras localizacionesRetinografía: realizar a pacientes con HTA grado 2 o 3 y en DMEcografía abdominal: sospecha de HTA secundaria (adenoma suprarrenal/feocromocitoma), evaluar tamaño y morfología renal, descartar dilataciones aneurismáticas en la aorta…Velocidad de onda de pulso: valora rigidez aorticaÍndice tobillo brazo: arteriopatía periféricaTAC-RMN cráneo y test de evaluación cognitiva: síntomas neurológicos y/o deterioro cognitivo | I/BIIb/BI/CIIa/CIIb/BIIb/BIIa/B |
CR/NE: clase de recomendación/nivel de evidencia; DM: diabetes mellitus; ECG: electrocardiograma; FG (FGe): filtrado glomerular; HbA1c: hemoglobina glucosilada; HDL: lipoproteínas de alta densidad; HTA: hipertensión arterial; LDL: lipoproteínas de baja densidad; RMN: resonancia magnética nuclear; TAC: tomografía axial computarizada; TSH: hormona tirotrópica; VI: ventrículo izquierdo.
La guía europea3 aborda este aspecto de forma más completa, dándole una mayor importancia que en la guía americana2, ya que la identificación de una LOD puede reclasificar el riesgo del paciente según SCORE de bajo a intermedio y de intermedio a alto, teniendo esto importancia a la hora de tomar decisiones en la estrategia de tratamiento de nuestros pacientes hipertensos, recomendando en estos casos, en los que se identifique una LOD, iniciar tratamiento con terapia combinada de dos fármacos.
El tratamiento adecuado puede inducir la regresión de algunas LOD y a su vez una reducción del RCV, proporcionándonos una información valiosa sobre la efectividad del tratamiento instaurado.
- •
Desde nuestro grupo de trabajo, independientemente de las similitudes o diferencias existentes en ambas guías, se propone realizar una valoración inicial lo más exhaustiva posible de nuestros pacientes hipertensos, teniendo en cuenta los antecedentes personales y familiares, los síntomas y/o signos que nos puedan hacer sospechar la existencia de una HTA secundaria, las comorbilidades o características del paciente que pueden aumentar su RCV, realizar las pruebas complementarias de las que disponemos en cada paciente para detectar LOD o ECV establecida, y que en todo centro de AP se debería poder realizar la valoración de la función renal, ECG, índice tobillo-brazo y además tener posibilidad de AMPA-MAPA; todo ello nos permitirá una correcta estratificación del RCV del paciente hipertenso, esencial para decidir y adecuar el tratamiento y el seguimiento del paciente. Entre las novedades de las guías europeas destaca la introducción de la frecuencia cardíaca como determinante de riesgo para HTA.
- •
Queremos enfatizar la importancia de la valoración global del paciente y de su riesgo para tomar decisiones. Quizás en nuestro medio es más apropiada la ecuación de SCORE, pero tiene la limitación de la edad. Una posible solución sería utilizar QRISK9, que no tiene la limitación de la edad y permite calcular riesgo a lo largo de la vida y es muy didáctico para compartirlo con los pacientes. Otra opción posible es utilizar, en los grupos extremos de edad, la edad vascular o el riesgo relativo.
En relación al concepto «¿cuándo?» iniciar el tratamiento con fármacos en los pacientes según su nivel de PA, las guías americanas proponen que en HTA estadio2 se inicie inmediatamente, y las europeas, en grados2-3. Estas últimas proponen tratar inmediatamente a los pacientes con HTA grado1 solo si son de RCV elevado o tienen LOD, pero si son de RCV bajo/moderado y sin LOD sugieren modificar estilos de vida y reevaluar en 3-6meses2,3.
En cuanto a los pacientes con HTA estadio1 de las guías americanas y los pacientes con PA normal-alta de las europeas, en los de alto riesgo (prevención secundaria o prevención primaria y riesgo >10%) las americanas recomiendan tratamiento inmediatamente y las europeas proponen considerarlo. En los de bajo riesgo, las americanas sugieren modificar estilos de vida 3-6meses y reevaluar, y las europeas, no tratar2,3.
En los pacientes con PA elevada las guías americanas proponen cambios en los estilos de vida 3-6meses y reevaluar, y en los sujetos con PA normal los europeos no dan directrices2,3.
- •
Se puede considerar que hay acuerdo entre las dos directrices en tratar inmediatamente a todos los pacientes con HTA estadio2 o grado1 si son de alto riesgo. También hay acuerdo en tratar HTA estadio1 o PA normal alta en pacientes de alto riesgo, aunque en este caso las americanas son más contundentes y las europeas proponen solo considerarlo, pero no dicen en base a qué y lo dejan a criterio del médico.
- •
Creemos importante hacer énfasis en la importancia que dan ambas directrices en considerar el riesgo cardiovascular de los pacientes y tomar decisiones basadas en el mismo y no solo en las cifras de PA. Es un hecho conocido que la reducción absoluta del riesgo, debida al tratamiento, es mayor en pacientes con riesgo elevado.
- •
Por otra parte, hay discrepancias en los pacientes con HTA grado1 de bajo/moderado riesgo, en los que las directrices europeas proponen modificar estilos de vida y reevaluar en 3-6meses, y las americanas proponen tratamiento inmediatamente. La duda en este caso es poner en la balanza los pacientes que controlaríamos (momentáneamente) en estos 3-6meses con estilos de vida, y por otro lado los que perderíamos (por razones obvias) en el camino y aparecerán en los años siguientes con HTA en un estadio superior o ya con LOD.
- •
Otra discrepancia son los pacientes con PA estadio1 o PA normal alta y de bajo riesgo: las directrices americanas proponen modificar estilos de vida 3-6meses y las europeas dicen que no hay que tratarlos. La duda en este caso es que, si no los reevaluamos y no hacemos énfasis en la importancia de los estilos de vida, ocurrirá algo similar a lo comentado en cuanto a la evolución a estadios superiores de su PA.
- •
Algo similar ocurre con los sujetos con PA elevada o normal: las directrices americanas proponen modificar estilos de vida y las europeas ni siquiera dan directrices.
- •
Es un hecho bien conocido la mayor incidencia de HTA en los sujetos con PA elevada, o normal-alta o normal con respecto a los que tienen cifras óptimas de PA. Quizá una de las razones de los americanos sea un intento de disminuir la incidencia de HTA en el futuro con la modificación de estilos de vida (dieta hiposódica, control del sobrepeso, etc.).
- •
La propuesta de nuestro grupo de trabajo en los pacientes con HTA grado1 de bajo riesgo sería insistir en no demorar más allá de los 3-6meses, la modificación de estilos de vida, para evitar la progresión y la aparición de LOD. Las propias directrices europeas, que son algo más restrictivas, aconsejan en su documento no retrasar el tratamiento en pacientes con PA >140/90 y de riesgo todavía bajo-moderado, para evitar la aparición de LOD, que posteriormente dificultaría el alcanzar objetivos de control. En los pacientes con HTA estadio1 o PA normal alta evaluar el riesgo de forma adecuada y en los de bajo riesgo asegurar que se le da información precisa al paciente y que seguirá controles periódicos en consulta de enfermería. En este sentido, necesitamos pacientes informados y profesionales de enfermería motivados y bien formados.
Un aspecto a considerar es cuándo iniciar el tratamiento en pacientes mayores. Las directrices americanas dicen que, en pacientes mayores con elevada comorbilidad y esperanza de vida limitada, el juicio clínico, las preferencias del paciente y la evaluación del beneficio/riesgo sería lo razonable para tomar decisiones (IIa/C). Las europeas refieren que la edad per se nunca debe ser una causa para evitar un tratamiento. Es evidente que, para la mayoría de los pacientes de edad avanzada, esta no deber ser un factor limitante del tratamiento.
- •
Nuestro grupo, en este caso, para la toma de decisiones en estos pacientes mayores considera importante la individualización del tratamiento y el buen juicio clínico, y que efectivamente la edad por sí sola no debería ser el único determinante para tomar decisiones.
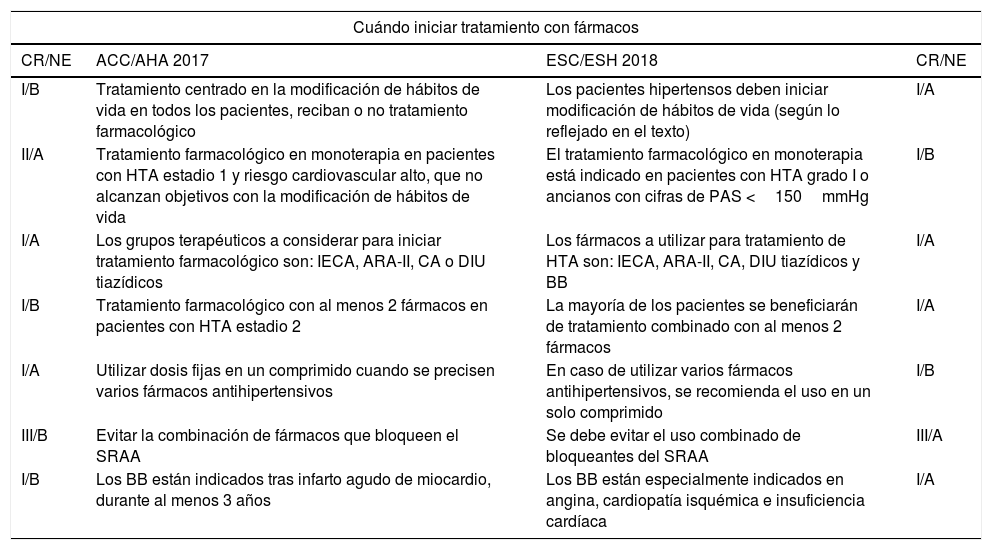
Los criterios en relación a cuándo iniciar tratamiento según cada una de las sociedades se describen en la tabla 12.2,3
Cuándo iniciar tratamiento con fármacos según ambas guías
| CR/NE | ACC/AHA 2017 | ESC/ESH 2018 | CR/NE |
|---|---|---|---|
| I/B-RI/B-RI/B-RI/B-R | HTA estadio 2InmediatamenteHTA estadio 1Prevención secundaria o riesgo alto: inmediatamentePrevención primaria o riesgo bajo: estilos de vida y reevaluar en 3-6 mesesPA elevadaEstilos de vida y reevaluar en 3-6 meses | HTA grado 2-3InmediatamenteHTA grado 1Alto riesgo/LOD: inmediatamenteBajo/moderado RCV/sin LOD: valorar si no control con estilos de vida en 3-6 mesesPA normal-alta: considerarlo en alto riesgo | I/AI/AI/AI/A |
CR/NE: clase de recomendación/nivel de evidencia; HTA: hipertensión arterial; LOD: lesión de órgano diana.
La guía americana2 propone un objetivo <130/80mmHg en todos los pacientes, haciendo énfasis en los de riesgo alto (prevención secundaria o primaria con riego >10%); este objetivo es recomendado, y en los hipertensos en prevención primaria sin riesgo elevado, este objetivo puede ser razonable.
La guía europea3 propone un objetivo de control <140/90 para todos los pacientes, aunque hace la consideración de que, si es bien tolerado el objetivo <130/80, se debería tener en cuenta en la mayoría de los pacientes.
Podemos deducir que hay un cierto acuerdo en que un objetivo <130/80 parecería razonable, tanto para las directrices americanas como para las europeas, siempre que estas cifras sean bien toleradas2,3. En la tabla 13 se describen los objetivos de control según ambas guías.
- •
Nuestra propuesta en este caso sería hacer énfasis en que «todos» los hipertensos deben tener un objetivo de PA <140/90 (en la actualidad apenas el 50% de nuestros pacientes alcanzan estos objetivos de control). Además, un objetivo <130/80, si es bien tolerado, es razonable para la mayoría de ellos, sobre todo en riesgo elevado. Se vuelve a insistir en la importancia de la valoración correcta del riesgo del paciente hipertenso y en la individualización de los objetivos de control.
- •
Nuestro grupo de trabajo recomienda encarecidamente la importancia de medidas complementarias de la PA (AMPA y/o MAPA) para identificar posibles hipotensiones con el tratamiento que, debido a la reacción de alerta de muchos pacientes en la consulta, no se identifica con la medida de la PA en la clínica1. Las directrices europeas recomiendan no bajar la PAS de 120mmHg.
- •
También hay que tener en cuenta, en los objetivos de control, la edad del paciente. Las directrices europeas recomiendan en menores de 65años un objetivo de PAS entre 120-130 y en los mayores de 65años entre 130-140. El objetivo de PAD deber ser <80 para todos, pero no bajar la PAD de 70mmHg.
Objetivos de control según ambas guías
| Objetivos de control | |||
|---|---|---|---|
| CR/NE | ACC/AHA 2017 | ESC/ESH 2018 | CR/NE |
| I/B-RaI/C-OEbIIb/B-NRaIIb/C-OEb | Prevención secundaria o riesgo >10%: <130/80Prevención primaria o riesgo <10%: <130/80 puede ser razonable | <140/90 para todos.<130/80 en muchos pacientes si es bien tolerado.PAD < 80 para todos, independiente del riesgo o comorbilidades | I/AI/AIIa/B |
CR/NE: clase de recomendación/nivel de evidencia.
Entre las recomendaciones clásicas referentes a los estilos de vida, solamente la restricción de sodio y consumo de alcohol han sufrido mínimas matizaciones en la guía europea3. Así, respecto a la restricción de sodio la recomendación actual incluye un límite inferior entre los 3,5-5g/día de sodio, que equivalen a unos 9-12g de sal diarios. La guía europea recuerda el posible efecto paradójico que descensos inferiores a 3g/día de sodio podrían elevar la mortalidad cardiovascular10. En relación con el alcohol, se modifican los gramos a unidades y se recomienda un consumo máximo de 14unidades/semana en varones y 8unidades/semana en mujeres3.
La guía americana plantea el objetivo de <1,5g/día, pero intentando reducir a <1g/día en la mayoría de adultos de sodio dietético. En relación con el alcohol, se incide en que en los individuos que lo consumen se debe reducir a ≤2bebidas día y ≤1 en mujeres. Destacan que una moderada ingesta se asocia a niveles más bajos de ECV que en abstemios2. El resto de las recomendaciones no cambian (reducción de peso, actividad física, tabaquismo y dieta rica en frutas y verduras) respecto a guías previas.
- •
Nuestro grupo de trabajo sugiere la prescripción de estilos de vida saludables: alimentación dentro de un patrón de dieta mediterránea y práctica regular de ejercicio físico (adaptado al paciente), reforzando siempre el mensaje de prescripción en cada visita programada. En cuanto a la dieta, consumo de sal inferior a 5g diarios de sodio y consumo de alcohol inferior a 14unidades/semana en varones y 8unidades/semana en mujeres.
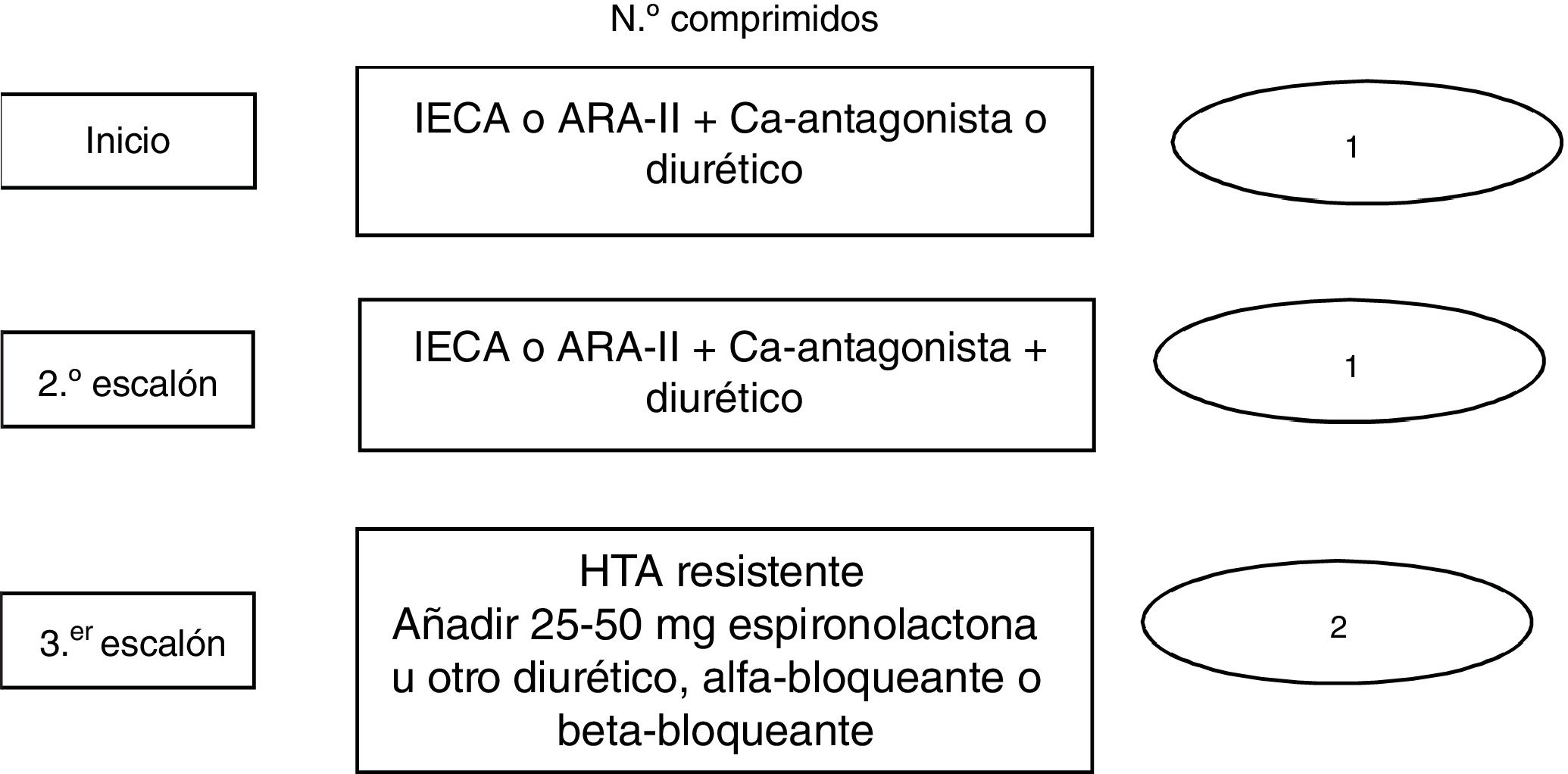
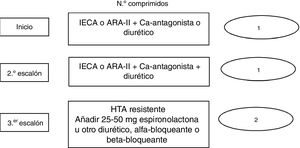
La guía europea3 recomienda, en la mayoría de los hipertensos, iniciar tratamiento farmacológico con combinaciones fijas de dos o más fármacos en un mismo comprimido, que además de permitir alcanzar el objetivo de PA precozmente mejorará la adherencia del paciente al tratamiento. La monoterapia quedaría indicada solamente en pacientes con HTA grado1 y bajo RCV o pacientes mayores de 80años o con fragilidad clínica. Las moléculas que se deben utilizar preferentemente en estas combinaciones son IECA o ARA-II más CA o DIU tiazídicos. En el caso de que, con triple terapia a dosis máximas (IECA o ARA-II más CA más DIU tiazídicos), no se alcance el objetivo terapéutico, se debe plantear el diagnóstico de HTA resistente, y el tratamiento incluirá una dosis de 25-50mg de espironolactona3 (fig. 2).
Algoritmo de tratamiento propuesto por la guía europea3.
ARA-II: antagonista de receptores AT1 de la angiotensina II; HTA: hipertensión arterial; IECA: inhibidores del sistema de conversión de la angiotensina.
La guía americana2, para iniciar el tratamiento antihipertensivo, como agentes de primera línea incluye DIU, CA e IECA o ARA-II2.
En la tabla 14 se muestran las diferencias entre ambas guías en cuanto a las recomendaciones más importantes del tratamiento del paciente hipertenso2,3.
- •
En relación con los grupos terapéuticos, consideramos que los fármacos a utilizar para el tratamiento de la HTA son: IECA/ARA-II, CA, DIU tiazídicos y betabloqueantes. La elección se debe hacer en base al estudio previo realizado al paciente y pensar en combinaciones desde el inicio en HTA grado2 a dosis bajas e ir titulando.
Estrategias farmacológicas en pacientes hipertensos
| Cuándo iniciar tratamiento con fármacos | |||
|---|---|---|---|
| CR/NE | ACC/AHA 2017 | ESC/ESH 2018 | CR/NE |
| I/B | Tratamiento centrado en la modificación de hábitos de vida en todos los pacientes, reciban o no tratamiento farmacológico | Los pacientes hipertensos deben iniciar modificación de hábitos de vida (según lo reflejado en el texto) | I/A |
| II/A | Tratamiento farmacológico en monoterapia en pacientes con HTA estadio 1 y riesgo cardiovascular alto, que no alcanzan objetivos con la modificación de hábitos de vida | El tratamiento farmacológico en monoterapia está indicado en pacientes con HTA grado I o ancianos con cifras de PAS <150mmHg | I/B |
| I/A | Los grupos terapéuticos a considerar para iniciar tratamiento farmacológico son: IECA, ARA-II, CA o DIU tiazídicos | Los fármacos a utilizar para tratamiento de HTA son: IECA, ARA-II, CA, DIU tiazídicos y BB | I/A |
| I/B | Tratamiento farmacológico con al menos 2 fármacos en pacientes con HTA estadio 2 | La mayoría de los pacientes se beneficiarán de tratamiento combinado con al menos 2 fármacos | I/A |
| I/A | Utilizar dosis fijas en un comprimido cuando se precisen varios fármacos antihipertensivos | En caso de utilizar varios fármacos antihipertensivos, se recomienda el uso en un solo comprimido | I/B |
| III/B | Evitar la combinación de fármacos que bloqueen el SRAA | Se debe evitar el uso combinado de bloqueantes del SRAA | III/A |
| I/B | Los BB están indicados tras infarto agudo de miocardio, durante al menos 3 años | Los BB están especialmente indicados en angina, cardiopatía isquémica e insuficiencia cardíaca | I/A |
ARA-II: antagonistas de los receptores de la angiotensina II; BB: betabloqueantes; CA: calcioantagonistas; CR/NE: clase de recomendación/nivel de evidencia; DIU: diuréticos; HTA: hipertensión arterial; IECA: inhibidores del sistema de conversión de la angiotensina; PAS: presión arterial sistólica; SRAA: sistema renina-angiotensina-aldosterona.
La práctica asistencial muestra que la HTA es una enfermedad que suele asociarse a otros problemas de salud, y con los años las GPC le dan cada vez más importancia. Tanto las guías americanas como las europeas le dedican un capítulo. En la tabla 15 se describen las comorbilidades y el tratamiento sugerido según guía, así como los niveles de evidencia2,3.
- •
En AP nuestro grupo sugiere como prioritario, en el tratamiento del paciente hipertenso: valorarlo en su conjunto, estudiar sus comorbilidades asociadas y prescribir el tratamiento y el seguimiento en función de estas.
Tratamiento de la HTA según comorbilidades asociadas
| ACC/AHA 2017 | NE | ESC/ESH 2018 | CR/NE | |
|---|---|---|---|---|
| Comorbilidad cardiovascular | ||||
| Cardiopatía isquémica estable | Primera elección: IECA, ARA-II y BB no clásicos. Si no control, DIU tiazídicos y ARM | PAS: I /BPAD: I /C | BB, IECA/ARA-IIEn angina sintomática: BB y CA preferencia | I/AIA |
| IC FE reducida | Primera elección IECA/ARA-II o ARM, DIU, BB. Se desaconsejan CA dihidropiridínicos | ICIII/B | IECA/ARA-II, BB, ARM.DIU si síntomas congestivosCA dihidropiridínicos en caso de no alcanzar objetivosIndica: sacubitrilo/valsartán como alternativa a IECA/ARA-II | I/AI/AIIB/C |
| IC FE preservada | Primera opción: DIU, IECA/ARA-II | I/C | Tratamiento óptimo no conocido, pero pueden utilizarse los mismos que en IC FE reducida | IIa/B |
| HVI | Ninguna recomendación | IECA/ARA-II en combinación con CA o DIU | I/A | |
| FA y otras arritmias | Control PA para prevenir FA. ARA-II para prevenir recurrencias (frente a CA y BB) | IIa/BR | Control PA para prevenir FAControl frecuencia con BB y CA dihidropiridinicos (contraindicados los CA no dihidropiridinicos con FE reducida)ARA-II han demostrado ↓ la primera aparición de FA (frente a BB y CA) pero no previenen recurrencias en FA paroxística o persistente | I/CIIa/B |
| Enfermedad valvular | Estenosis aórtica asintomática: iniciar con bajas dosis e ir titulandoInsuficiencia aórtica crónica: tratar la HTA sistólica con fármacos que no ↓ FCFármacos BB | I/B(NA)IIa/C(DL)I/C(OE) | Tratamiento incluso en estenosis aórtica severa. Los fármacos vasodilatadores son bien tolerados.Fármacos IECA o ARA-II y BB | |
| Comorbilidad cerebrovascular y neurodegenerativa | ||||
| Ictus hemorrágico | Tratamiento intravenoso si PAS >220mmHg y evitar ↓<140mmHg | IIa/C | Similar a la americana, pero una PAS <180mmHg puede ser beneficiosa | IIa/B |
| Ictus isquémico | Objetivo PA <180/110mmHg en pacientes que han recibido tratamiento fibrinolíticoSi PA >220/120 ↓PA un 15% en primeras 24 h | I (NA)III/A | Marca como clave de hemorragia intracraneal que el paciente haya recibido tratamiento fibrinolíticoPA reducir a <180/105 primeras 24 h. Si PA >220/120mmHg igual a guía americana | IIa/BIIa/B |
| Disfunción cognitiva y demencia | Similar a la guía europea | Un buen control de la PA reduce la incidencia. Se necesitan más estudios. No aportan indicación de fármacos | ||
| Otras comorbilidades | ||||
| EPOC | No realiza ninguna indicación | Modificación del estilo de vidaAbandono del hábito tabáquicoTratamiento: CA y IECA/ARA-II (y sus combinaciones). Si necesario DIU tiazídicos y BB beta1 selectivos | ||
| Enfermedad arterial periférica | Pacientes con EAP deben tratarse igual a los que no tienen EAP | I/B | Control PA reduce riesgoIECA/ARA-II más CA o DIUBB pueden considerarse | I/AIIa/BIIb/C |
| Disfunción eréctil | Mismas que para la guía europea | DIU tiazídicos, BB convencionales, no indicadosIECA o ARA-II, CA, BB vasodilatadores efectos neutros o beneficioInhibidores de la fosfodiesterasa-5 efectivos. No administrarse con Nitratos | ||
| HTA tras cirugía | Mismas que para la guía europea | HTA controlada suspensión perioperatoriaCirugía programada y HTA no controlada: retrasar la cirugía hasta control PA.HTA intraoperatoria, tratamiento intravenoso hasta posibilidad de tratamiento vía oral | I/CIIb/CI/C | |
ARA-II: antagonistas de los receptores de la angiotensina II; ARM: antagonistas de los receptores de los mineralcorticoides; BB: betabloqueantes; CA: calcioantagonistas; CR/NE: clase de recomendación/nivel de evidencia; DIU: diuréticos; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FC: frecuencia cardíaca; FE: fracción de eyección; HTA: hipertensión arterial; IECA: inhibidores del sistema de conversión de la angiotensina; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
La guía americana2 no hace ninguna consideración específica. La guía europea3 hace hincapié en la elevada prevalencia de HTA secundaria en este grupo de edad y en la necesidad de tenerlo en cuenta en el proceso diagnóstico. Respecto al tratamiento con fármacos en HTA grado2 o en HTA grado1 con alto riesgo vascular, no deja dudas: recomienda hacerlo siempre, y en los de grado1 sin complicaciones, a pesar de no existir pruebas directas, considera prudente tratarlos, y si no lo aceptan, al menos debe ofrecerse asesoramiento sobre estilo de vida y seguimiento periódico. El objetivo será conseguir cifras ≤130/80mmHg.
Entendemos muy razonables las recomendaciones de la guía europea. El objetivo principal debe ser <140/90 para personas jóvenes, de mediana edad y mayores, pero si el paciente lo tolera, un objetivo de ≤130/80mmHg es recomendable.
Edad avanzadaLa guía americana2 defiende como objetivo para todos los mayores de 65años no institucionalizados una PAS <130mmHg, si es tolerada. Se debe monitorizar en todos los pacientes el riesgo de hipotensión. Para aquellos con gran comorbilidad, así como una expectativa de vida limitada, desvía la decisión al juicio clínico y a las preferencias del paciente. Para la guía europea3, los umbrales para iniciar tratamiento con fármacos serían: una PAS ≥140 y/o PAD ≥90mmHg en clínica en <80años y una PAS ≥160 y/o PAD ≥90mmHg en clínica en ≥80años. En ancianos no institucionalizados debe perseguirse un objetivo de PAS entre 130-139mmHg y PAD entre 70-79mmHg, si es tolerado. Se debe evitar bajar en cualquier caso de 130 y de 70mmHg. Se recomienda comenzar el tratamiento con una combinación de dos fármacos, como en cualquier grupo de edad, pero en <80años y paciente frágil, o en HTA grado1 y bajo riesgo, se sugiere iniciar con monoterapia o con combinaciones a las dosis más bajas disponibles.
- •
Consideramos que en la población anciana es importante tener siempre presente la edad biológica más que la cronológica, monitorizar el riesgo de hipotensión, detectar efectos adversos y evaluar la función renal con frecuencia. Se deben evitar DIU de asa y alfabloqueantes (salvo que sean necesarios por otras patologías). Consideramos importante individualizar el tratamiento, evitar la iatrogenia y tener en cuenta las preferencias del paciente.
La guía americana2 no recomienda objetivos específicos en esta situación. Remarca la contraindicación del uso de IECA y ARA-II en embarazadas y considera que pueden usarse alfa-metildopa, nifedipino, labetalol o hidralazina.
La guía europea3 aconseja que debe iniciarse terapia con fármacos siempre que la PAS sea ≥150mmHg o la PAD ≥95mmHg, pero si es HTA gestacional o hay LOD, se iniciará si la PAS es ≥140mmHg y/o la PAD ≥90mmHg. Se insiste en que con PAS ≥170 o PAD ≥110mmHg se considera una emergencia y se recomienda ingreso hospitalario.
Los IECA y los ARA-II están contraindicados en el embarazo y deben evitarse en las mujeres que planean quedarse embarazadas. Los DIU deben evitarse si es posible en el embarazo. Alfa-metildopa, labetalol y nifedipino serían los fármacos recomendados en ambos casos.
- •
Nuestro grupo de trabajo considera importante que los médicos de familia conozcan los fármacos a utilizar durante el embarazo (alfa-metildopa y nifedipino fundamentalmente), y sobre todo los que están contraindicados (IECA y ARA-II).
La guía americana2 recomienda tratar con fármacos si la PA ≥130/80mmHg, buscando mantenerla siempre por bajo de esas cifras. Para ello, cualquiera de los cuatro fármacos de primera línea (IECA, ARA-II, CA, DIU) es adecuado para iniciar tratamiento. Si hay albuminuria puede considerarse usar IECA o ARA-II, preferentemente.
La guía europea3 aconseja tratar con fármacos si la PA ≥140 y/o ≥90mmHg, buscando mantener una PAS entre 130-139 y una PAD entre 71-79mmHg (incluso PAS entre 121-129mmHg si se tolera, salvo en mayores de 65años y en pacientes con ERC, en los que el objetivo siempre será una PAS entre 130-139mmHg). La PA nunca debe ser inferior a 120/70mmHg. Se recomienda utilizar una combinación de IECA o ARA-II con CA o DIU tiazídicos.
- •
Nuestro grupo de trabajo considera prudente acercar el objetivo de control a 130/80mmHg, siempre que sea factible y las características clínicas del paciente así lo aconsejen.
La guía europea3 destaca que empagliflozina y canagliflozina han demostrado reducir la PA, las hospitalizaciones por insuficiencia cardiaca, la mortalidad cardiovascular y la mortalidad total, y además presentan un efecto protector sobre la función renal.
- •
Consideramos que en pacientes con DM y ECV en los que la función renal lo permita, son fármacos de elección para bajar la glucemia, y ayudan a reducir la PA, disminuir la insuficiencia cardiaca, la mortalidad cardiovascular y a prevenir el daño renal.
El protagonismo que la ERC está teniendo en la actualidad hace que hayamos considerado abrir a debate un capítulo específico. En ambas guías2,3 se hace referencia a la importancia de la HTA como factor de riesgo principal para el desarrollo y la progresión de la ERC, independientemente de cuál sea la causa de esta. De hecho, la HTA es la principal comorbilidad que afecta a los pacientes con ERC (67-92%), y es mayor a medida que disminuye la función renal. La ERC es un importante factor de riesgo para la aparición de ECV. Esta progresión de la enfermedad y la aparición de acontecimientos cardiovasculares son más evidentes si hay proteinuria.
Inicio de tratamiento antihipertensivo en pacientes con ERCLa controversia sobre el inicio de tratamiento farmacológico ha sido tratada previamente, y en el caso de la ERC la posición de SEMERGEN es similar a la de hipertensos de la población general. Parece razonable considerar que el inicio de tratamiento en pacientes con ERC (pacientes de riesgo alto y muy alto) debería realizarse a partir de cifras de PA de 130 y/o 80mmHg, siempre que sea bien tolerado (tabla 16).
- •
Nuestro grupo de trabajo recomienda encarecidamente la importancia de medir la PA con AMPA y/o MAPA para establecer el nivel de PA, así como evitar el excedernos en bajar excesivamente la PA y, consecuentemente, deteriorar la función renal en el momento de iniciar el tratamiento farmacológico.
Cuando iniciar tratamiento con fármacos en pacientes con ERC
| NE | ACC/AHA 2017 | ESC/ESH 2018 | NE |
|---|---|---|---|
| I/B (para PAS)I/C (para PAD) | Como la mayoría de los pacientes con ERC presentan un riesgo de ECV aterosclerosa a 10años >10%, se sitúan en una categoría de riesgo elevado, por lo que se recomiendan medidas generales y administrar tratamiento farmacológico si la PA es ≥130 y/o 80mmHg | En pacientes con ERC (diabética o no diabética) se recomienda iniciar tratamiento mediante cambios en el estilo de vida y medicación antihipertensiva si la PA es ≥ 140 y/o 90mmHg | I/A |
ERC: enfermedad renal crónica; NE: nivel de evidencia; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Las recomendaciones de la guía europea3 son más conservadoras y recomiendan conseguir una PAS entre 140 y 130mmHg. A pesar de la importancia de la HTA en la ERC, son muy escasos los ensayos clínicos y los metaanálisis que han analizado el objetivo de PA en pacientes con ERC, ya que la mayoría de estos pacientes son excluidos de los ensayos y, por tanto, aún no se ha logrado establecer el objetivo adecuado de PA en estos pacientes. Pacientes con proteinuria >1g/día pueden beneficiarse de mayor reducción en la PA, pero los resultados no son concluyentes en pacientes con proteinuria <1g/día. No se hace una mención especial al objetivo de PA recomendado en relación con la presencia de proteinuria. Se realizan varias críticas al estudio Systolic Blood Pressure Intervention Trial (SPRINT)11. Además, el brazo de objetivo más estricto de PA en este estudio no consiguió beneficios en la variable cardiovascular, ni en la muerte por cualquier causa, en los pacientes con ERC (que suponían un 28% de los incluidos en el estudio).
Las recomendaciones de la guía americana2 sugieren un objetivo de PA más estricto. Se argumenta que el hecho de que la mayoría de los pacientes con ERC fallecen por complicaciones cardiovasculares apoya intentar un objetivo de PA <130/80mmHg para todos los pacientes con ERC. No obstante, se recomienda la individualización del tratamiento en pacientes con comorbilidades asociadas y ancianos frágiles, ya que han sido excluidos de los ensayos clínicos. Intentar conseguir objetivos de PA más estrictos en estos pacientes deberá realizarse de forma progresiva y con monitorización de la función renal. Tampoco hace referencia a la presencia de proteinuria para considerar el objetivo de PA.
Dos recientes publicaciones, una sobre el estudio SPRINT11 y otra que analizó simultáneamente los pacientes del estudio SPRINT y Action to Control Cardiovascular Risk in Diabetes (ACCORD)12, han demostrado que los pacientes con ERC en los que se consiguieron objetivos más estrictos de la PA presentaron más riesgo de incidencia de deterioro renal o ERC, y este riesgo fue mayor en los pacientes diabéticos. El incremento del riesgo de incidencia de ERC en pacientes con objetivo más estricto de la PA deberá sopesarse con los beneficios en el RCV y en la mortalidad total obtenidos por el control más estricto de la PA (tabla 17).
- •
Con las consideraciones de ambas guías y las más recientes publicaciones, nos parece razonable recomendar intentar conseguir un objetivo de PA menor de 140/90mmHg en todos los pacientes con ERC, especialmente en los de mayor edad. Este objetivo deberá tender a 130/80mmHg en pacientes más jóvenes o con proteinuria, y deberá intentarse de forma gradual. Tanto la realización de AMPA como la de MAPA deben ser consideradas fundamentales para intentar conseguir un objetivo adecuado de la PA sin que se presenten efectos derivados de la hipoperfusión renal.
Objetivos de control en la ERC
| CR/NE | ACC/AHA 2017 | ESC/ESH 2018 | CR/NE |
|---|---|---|---|
| I/B (para PAS) I/C (para PAD) | En pacientes con ERC se recomienda un objetivo de presión arterial <130/80mmHgEn pacientes con comorbilidades asociadas y ancianos frágiles, intentar conseguir el objetivo de forma progresiva y con monitorización de la función renal | En diabéticos y no diabéticos con ERC se recomienda objetivo de PA sistólica entre 130-139mmHgSe deberá individualizar el tratamiento de acuerdo con la tolerabilidad y el impacto en la función renal y electrólitos. | I/AIIa/C |
CR/NE: clase de recomendación/nivel de evidencia; ERC: enfermedad renal crónica; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
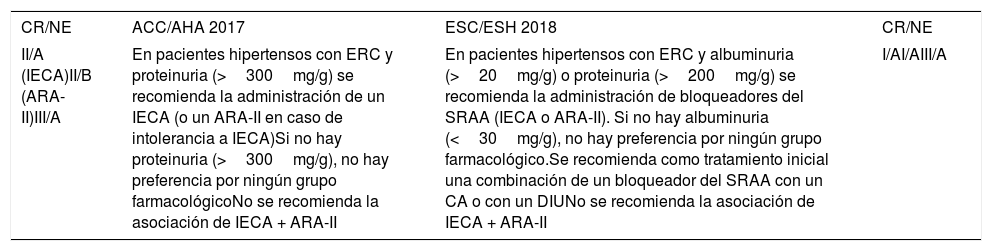
Los bloqueadores del SRAA son de elección para reducir la albuminuria y se recomiendan como parte de la estrategia de tratamiento en pacientes hipertensos en presencia de microalbuminuria o proteinuria.
Ambas guías2,3 están de acuerdo en iniciar el tratamiento con bloqueantes del SRAA ante la existencia de proteinuria. No obstante, es de destacar que las guías americanas2 no indican la administración de bloqueadores del SRAA en presencia de albuminuria (30-300mg/g) en pacientes con ERC no diabéticos, reservándolos solo para los pacientes con proteinuria (>200mg/g). En cambio, las guías europeas recomiendan el bloqueo del SRAA ya en presencia de albuminuria (>20mg/g)3.
Cuando se requiera bloqueo del SRAA, las guías americanas2 recomiendan un IECA, reservando el ARA-II solo para los pacientes con intolerancia a los IECA.
Las guías europeas3 recomiendan iniciar el tratamiento farmacológico con una combinación (un bloqueador del SRAA y un CA o un DIU) en los hipertensos con ERC, ya que la mayoría de los pacientes necesitan al menos dos fármacos para conseguir los niveles objetivo. Ambas guías están de acuerdo en evitar la asociación de un IECA con un ARA-II (tabla 18).
- •
Desde nuestro grupo de trabajo parece razonable recomendar bloqueadores del SRAA (IECA o ARA-II) en hipertensos con ERC y albuminuria o proteinuria. También recomendamos iniciar tratamiento farmacológico con combinación, ya que la mayoría de los pacientes con ERC requieren al menos dos fármacos para conseguir objetivos de PA. No se recomienda la asociación de IECA más ARA-II.
Tipo de tratamiento farmacológico en la ERC
| CR/NE | ACC/AHA 2017 | ESC/ESH 2018 | CR/NE |
|---|---|---|---|
| II/A (IECA)II/B (ARA-II)III/A | En pacientes hipertensos con ERC y proteinuria (>300mg/g) se recomienda la administración de un IECA (o un ARA-II en caso de intolerancia a IECA)Si no hay proteinuria (>300mg/g), no hay preferencia por ningún grupo farmacológicoNo se recomienda la asociación de IECA + ARA-II | En pacientes hipertensos con ERC y albuminuria (>20mg/g) o proteinuria (>200mg/g) se recomienda la administración de bloqueadores del SRAA (IECA o ARA-II). Si no hay albuminuria (<30mg/g), no hay preferencia por ningún grupo farmacológico.Se recomienda como tratamiento inicial una combinación de un bloqueador del SRAA con un CA o con un DIUNo se recomienda la asociación de IECA + ARA-II | I/AI/AIII/A |
ARA-II: antagonistas de los receptores de la angiotensina II; CA: calcioantagonistas; CR/NE: clase de recomendación/nivel de evidencia; DIU: diuréticos; ERC: enfermedad renal crónica; IECA: inhibidores de la enzima de conversión de aldosterona; SRAA: sistema-renina-angiotensina aldosterona.
Las dos guías coinciden en la definición clásica de HTAr: «Paciente que tomando tres fármacos a dosis plenas o al máximo de las toleradas (uno de ellos un diurético) no consigue bajar las cifras de 140/90mmHg, todo ello confirmado con AMPA o MAPA, y en los que se ha podido confirmar la adherencia al tratamiento antihipertensivo» (tabla 16)2,3.
Las propuestas de tratamiento de esta patología tampoco difieren sensiblemente en ambas guías: cambios de estilos de vida, fármacos a dosis terapéuticas o a las mejor toleradas posibles, siendo de elección los DIU tiazídicos o de asa, IECA o ARA-II, CA y los inhibidores de los mineralcorticoides (espironolactona)2,3 (tabla 19).
Recomendaciones para el tratamiento de la HTA resistente
| Tratamiento recomendado | ACC/AHA 2017 | ESC/ESH 2018 | CR/NE |
|---|---|---|---|
| Refuerzo de las medidas de estilo de vida, especialmente la restricción de sodio y alcohol | No | Sí | I/B |
| Adición de espironolactona a baja dosis al tratamiento existente | Sí | Sí | I/A |
| O adición de más terapia diurética si es intolerante a la espironolactona con eplerenona o amilorida o diurético de asa | Sí | Sí | I/B |
| O la adición de bisoprolol o doxazosina | Sí | Sí | I/B |
CR/NE: nivel de evidencia/clase de recomendación.
Antes de diagnosticar a un paciente de HTAr hay que tener en cuenta algunas situaciones clínicas que pueden simularla; una de ellas es la denominada hipertensión pseudorresistente, que se puede deber a situaciones de la más variada índole: mala técnica en la toma de la PA, reacción de alerta de la consulta, mala adherencia al tratamiento antihipertensivo (se da hasta en el 50% de las situaciones y está relacionada con el número de fármacos y las tomas), calcificación de las arterias braquiales, inercia clínica por parte del profesional, utilizar manguitos más pequeños, que elevan las cifras de PA, ingesta de sustancias vasopresoras o retenedoras de sodio (pensar en algunas hierbas, por ejemplo la hierba de San Juan) o drogas con fines recreativos (cocaína, esteroides anabolizantes, etc.), mala adherencia a los cambios de estilo de vida (obesidad, consumo excesivo de alcohol y sodio, etc.). La segunda situación clínica es la presencia de HTA secundaria, más frecuente en pacientes jóvenes (<40años), que comienza con cifras elevadas de PA, muy difíciles de controlar en una persona previamente normotensa, y que requeriría un estudio de las causas secundarias más frecuentes (hiperaldosteronismo primario, estenosis de las arterias renales, feocromocitoma, etc.)2,3.
La guía americana2 hace referencia al concepto de HTA refractaria, que define a un fenotipo extremo, en el que fracasa el tratamiento antihipertensivo, a pesar de utilizar al menos cinco fármacos hipotensores diferentes, incluido un DIU tiazídico de acción prolongada como la clortalidona y un antagonista de los receptores de los mineralocorticoides como la espironolactona o la eplerenona. La prevalencia de esta afección es baja y suele cursar, cuando no se trata, con graves complicaciones cardiovasculares, tales como HVI, IC y ACV.
La guía europea3 sumariza la estrategia diagnóstica de esta entidad en cuatro sencillos pasos:
- 1.
Historia clínica detallada del paciente, donde se incluya cuáles son sus estilos de vida (ejercicio físico, ingesta de alcohol y sal, sustancias que toma y patrón del sueño, etc.).
- 2.
Examen físico, con atención especial a la búsqueda de LOD y signos de HTA secundaria.
- 3.
Pruebas de laboratorio para detectar anormalidades electrolíticas (hipocalemia), FRCV (DM), disfunción renal avanzada o HTA secundaria.
- 4.
Medicación antihipertensiva, dosificación, tomas y confirmación de la adherencia al mismo, con determinaciones fuera de la consulta (AMPA o MAPA).
Respecto al tratamiento, ambas guías coinciden casi plenamente. Las dos priorizan las modificaciones de estilos de vida y evitar sustancias presoras. El régimen terapéutico tiene que ser simple, para ayudar a la cumplimentación por parte del paciente. Empíricamente la estrategia terapéutica más efectiva es la combinación sinérgica de fármacos; así, en primera línea tendríamos los CA, los inhibidores del SRAA (IECA y ARA-II) y los DIU tiazídicos de acción prolongada (clortalidona e indapamida) o los DIU de asa si el FG es <30ml/min, para reducir la sobrecarga de volumen, como la triple terapia inicial junto con la restricción de la ingesta de sal2,3.
En cuarta línea terapéutica, hay muchas evidencias (reciente estudio PATHWAY-2)13 que apoyan añadir espironolactona (hasta 50mg/día) o eplerenona y amilorida, frente a alfa o betabloqueantes; no obstante, debe restringirse su uso para la HTAr en pacientes con un FG ≥45ml/min y un potasio plasmático de ≤4,5mmol/l; además, hay que tener en cuenta los efectos secundarios, como ginecomastia e impotencia en hombres y alteraciones menstruales en la mujer. En la guía americana2 se aportan evidencias que apoyan añadir hidralazina o minoxidil cuando no se alcanza el nivel de PA óptimo. Con esta multiterapia se deben también usar dosis nocturnas.
La guía americana hace una mención especial a intervenciones para interrumpir la actividad nerviosa simpaticomimética de distintas localizaciones, tales como los barorreceptores carotídeos y la ablación con catéter de nervios simpáticos en las arterias renales; sin embargo, estos estudios no han aportado suficiente evidencia para recomendar su práctica masiva en el abordaje de la HTAr. Dos ensayos clínicos sobre denervación simpática renal han dado resultados negativos2.
- •
Nuestro grupo considera adecuado y razonable el uso de espironolactona como cuarto fármaco para el manejo de la HTAr.
El abordaje del capítulo de urgencias y emergencias hipertensivas en ambas guías es diferente, aunque en general coincide en los conceptos y las líneas generales de tratamiento2,3.
Urgencia hipertensivaEn cuanto al concepto de urgencia hipertensiva, las dos guías consideran que es una elevación importante de las cifras de PA en pacientes estables en la que no se dan disfunciones agudas o empeoramiento de las LOD. Las dos guías desaconsejan la derivación hospitalaria en estos casos2,3. La guía americana explicita, por su parte, que muchas de las urgencias hipertensivas son debidas a una adherencia deficiente al tratamiento antihipertensivo, o a cuadros de dolor intenso o ansiedad, y que eso es lo que hay que tratar, sin necesidad de utilizar fármacos antihipertensivos2. La guía europea3 parece desmarcarse algo de esa idea y dice que para el tratamiento de las urgencias hipertensivas se han de utilizar fármacos antihipertensivos orales para conseguir el control de la PA y después hacer un seguimiento «urgente» para comprobar que se ha conseguido normalizar la PA. También explica la posibilidad de que la ingestión de simpaticomiméticos, como meta-anfetamina o cocaína, pueda provocar un aumento agudo y severo de la PA y que incluso pueda llegar a emergencia hipertensiva.
Emergencia hipertensivaEn el caso de la emergencia hipertensiva, la única diferencia que llama la atención es en las cifras que se alcanzan en esta situación. Mientras que la guía americana2 habla de elevación grave y explicita >180 y/o 120mmHg, la guía europea3 se refiere a HTA grado3 que corresponde a ≥180 y/o a ≥110mmHg. Sin embargo, las dos coinciden en dar más importancia a la velocidad de la subida de la PA que a la cifra absoluta y en considerar la emergencia hipertensiva como de riesgo vital.
Ambas guías2,3 consideran que se ha de hablar de emergencia hipertensiva cuando a estas cifras elevadas de PA se les une una nueva afectación o empeoramiento de LOD (insuficiencia renal aguda, encefalopatía hipertensiva, ictus isquémico o hemorrágico, evento coronario agudo, IC, edema agudo de pulmón, disección aórtica, eclampsia o preeclampsia severa y feocromocitoma). La guía americana2 también valora como emergencia la HTA perioperatoria.
Por su parte la guía europea denomina «hipertensión maligna» a un cuadro de aumento súbito e importante de la PA que se asocia a hemorragias o papiledema en el fondo de ojo y se puede vincular con encefalopatía, IC y deterioro de la función renal3.
Únicamente la guía europea especifica síntomas que pueden significar emergencia hipertensiva, tales como cefalea, trastornos visuales, dolor torácico, disnea, mareos u otros déficits neurológicos3. En caso de encefalopatía hipertensiva: somnolencia, letargo, convulsiones tónico-clónicas y cegueras previas a la pérdida de conocimiento. Las lesiones neurológicas focales, indica, han de hacer pensar en ACV.
Asimismo, la guía europea hace hincapié en las pruebas que se tienen que efectuar para conocer la etiopatogenia de la crisis hipertensiva: fondo de ojo, ECG, analítica de sangre con hemograma, estudio de la función renal, analítica de orina con estudio del sedimento y prueba de embarazo en el caso de mujer fértil. Específicamente, según las sospechas, recomienda pedir troponinas, BNP o pro-BNP, radiografía de tórax, ecocardiograma, angio-TAC de tórax y/o abdomen, TAC craneal, ecografía renal y detección de drogas en orina3.
Manejo de las emergencias hipertensivasLas dos guías coinciden en que no existen ensayos clínicos de calidad para corroborar las recomendaciones que hacen, a excepción, dice la europea, de la disminución de la PA en el ACV, en que ambas recomiendan actuar con cautela. Ambas repiten que el tratamiento de la emergencia hipertensiva requiere de derivación hospitalaria (a una unidad de cuidados intensivos, según la americana) y que la administración de los fármacos ha de ser por vía intravenosa2,3.
La guía americana señala la disección aórtica, la preeclampsia severa o la eclampsia y el feocromocitoma como situaciones en las que es prioritario bajar rápidamente la PAS a niveles inferiores a 140 e incluso a 120mmHg. En otras entidades de menor riesgo se puede bajar más lentamente la PA (25% en la primera hora y hasta 160/100mmHg en las siguientes 2-6h)2.
De manera muy semejante, en los dos documentos se incluyen dos tablas. En una se exponen las recomendaciones en cada tipo de emergencia hipertensiva y en la otra las características de los fármacos que recomiendan utilizar. No es objetivo del presente documento entrar en analizar las diferencias, ya que ello se aleja de las funciones de los facultativos de AP. Sí compete a los médicos de familia el seguimiento posterior, teniendo en cuenta que, aunque la reciente guía europea destaca que la supervivencia de estos pacientes ha mejorado mucho en las últimas décadas, siguen permaneciendo en alto riesgo, hay que buscar la posible HTA secundaria, hacer un esfuerzo para obtener los objetivos de control y precisan de un seguimiento exhaustivo. Aunque recomienda que dicho seguimiento se efectúe en un entorno especializado.
La guía americana explica que las dosis elevadas de fármacos antihipertensivos en las emergencias no están exentas de riesgos. Y que las dosis de carga oral de los fármacos antihipertensivos, tanto en las emergencias como en las urgencias hipertensivas, pueden provocar efectos acumulativos, por lo que se puede producir una hipotensión con posterioridad al alta2.
Por último, cabe señalar la falta de evidencias en este tema y la nula coincidencia de las citas bibliográficas entre las dos guías. En la tabla 20 se resumen las discrepancias y coincidencias que se dan entre las dos guías.
- •
Nuestro grupo de trabajo considera que el tratamiento de las urgencias hipertensivas corresponde a AP y que es en este entorno donde tras una anamnesis y una exploración adecuadas se decidirá, junto con el paciente, el tratamiento a seguir. También es, a menudo, en AP donde se detectan las emergencias hipertensivas que se han de derivar y tratar en un contexto hospitalario.
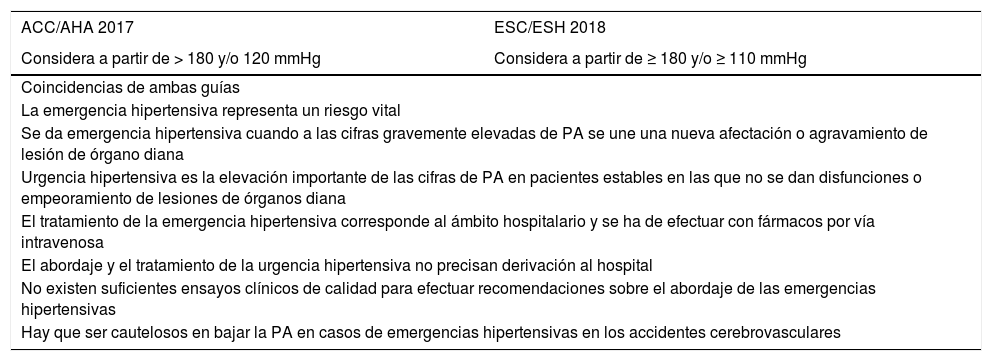
Diferencias entre las guías en las urgencias y emergencias hipertensivas
| ACC/AHA 2017 | ESC/ESH 2018 |
|---|---|
| Considera a partir de > 180 y/o 120 mmHg | Considera a partir de ≥ 180 y/o ≥ 110 mmHg |
| Coincidencias de ambas guías | |
| La emergencia hipertensiva representa un riesgo vital | |
| Se da emergencia hipertensiva cuando a las cifras gravemente elevadas de PA se une una nueva afectación o agravamiento de lesión de órgano diana | |
| Urgencia hipertensiva es la elevación importante de las cifras de PA en pacientes estables en las que no se dan disfunciones o empeoramiento de lesiones de órganos diana | |
| El tratamiento de la emergencia hipertensiva corresponde al ámbito hospitalario y se ha de efectuar con fármacos por vía intravenosa | |
| El abordaje y el tratamiento de la urgencia hipertensiva no precisan derivación al hospital | |
| No existen suficientes ensayos clínicos de calidad para efectuar recomendaciones sobre el abordaje de las emergencias hipertensivas | |
| Hay que ser cautelosos en bajar la PA en casos de emergencias hipertensivas en los accidentes cerebrovasculares | |
El seguimiento que proponen ambas guías está condicionado a los diferentes criterios diagnósticos de HTA. La guía americana2 recomienda la utilización de la AMPA y la MAPA. La guía europea también indica AMPA y MAPA en el seguimiento de paciente hipertenso y hace especial referencia a pacientes con PA normal-alta, o con HTA de bata blanca, sobre todo si tienen múltiples FRCV o LOD3.
La guía americana2 resalta que todos los hipertensos deben tener un plan de atención claro con la implicación del equipo de AP. Este plan incluirá el tratamiento no farmacológico y farmacológico, el manejo de comorbilidades y la educación al paciente y a la familia. Debe hacerse tanto verbalmente como por escrito, considerando las tecnologías de la comunicación y la información. Se propone que se implique también un familiar o un amigo en la consecución de objetivos. La guía europea3 pormenoriza más este plan y habla, además, de empoderar al paciente y de evitar la falta de adherencia terapéutica.
En concreto, la guía europea3 hace énfasis en conseguir los objetivos de control y recomienda detectar las causas de mal control, colaborar con otros profesionales (enfermería, farmacia), simplificar el tratamiento farmacológico, usar recordatorios y mejorar la accesibilidad a los fármacos. Se refiere también a la necesidad de evitar la inercia terapéutica cuando el tratamiento es ineficaz.
El seguimiento de las personas hipertensas o que presentan PA elevada se expone en la tabla 21.
Seguimiento de la HTA
| CR | ACC/AHA 2017 | ESC/ESH 2018 | CR |
|---|---|---|---|
| I | HTA estadio 2: revisión mensual hasta conseguir objetivos de control. Posteriormente cada 3-6 meses | HTA grado 2-3: revisión cada 3 meses | I |
| II | HTA estadio 1Prevención secundaria o riesgo alto: revisión mensual hasta conseguir objetivos de control. Posteriormente cada 3-6 mesesPrevención primaria o riesgo bajo: revisión cada 3-6 meses | HTA grado 1:Alto riesgo/LOD: revisión a los 3-6 mesesBajo/moderado riesgo/Sin LOD: revisión a los 3-6 meses | II |
| I | PA elevada:Estilos de vida y revisión cada 3-6 meses | PA normal-alta: considerarlo en alto riesgo (revisión anual) | I |
CR: clase de recomendación; HTA: hipertensión arterial; LOD: lesión órgano diana; PA: presión arterial.
En los pacientes con tratamiento farmacológico, la guía americana recomienda el seguimiento mensual hasta conseguir el objetivo de control de la PA2. La europea3, algo más laxa, indica que tras el inicio conviene una revisión en menos de 2meses, pero puntualiza sobre la importancia de observar efectos sobre la PA, así como efectos secundarios, y añade que la frecuencia de las revisiones dependerá del grado de HTA, de la urgencia para llegar a objetivos de control y de las comorbilidades. También destaca la importancia de evaluar los FRCV y el daño orgánico asintomático al menos cada 2años. Pero en lo que coinciden ambas guías es en indicar que cuando se cumpla el objetivo de control, las revisiones deben realizarse cada 3-6meses (CRI ACC/AHA)2,3. Las sociedades europeas sugieren la AMPA y la telemedicina como una buena alterativa para reducir las visitas en la consulta3.
Las diferencias de criterios diagnósticos condicionan notablemente las recomendaciones sobre el seguimiento, especialmente en los individuos que son considerados hipertensos por la guía americana y con PA normal-alta por la guía europea2,3.
La guía americana con cifras de PA elevada (120-129/<80mmHg) recomienda tratamiento no farmacológico y revisión cada 3-6meses (CRI), y en pacientes hipertensos estadio 1 (cifras 130-139/80-89mmHg) con RCV estimado en 10años <10% recomienda tratamiento no farmacológico y revisión cada 3-6meses (CRI).
Por su parte, la guía europea3 tan solo recomienda a los individuos con PA 120-129/80-84mmHg repetir la medida cada 3años y a los de PA entre 130-139 y/o 85-89mmHg repetirla cada año, y únicamente plantearse el tratamiento en pacientes con muy alto RCV. En estos últimos aconseja descartar HTA enmascarada mediante AMPA y/o MAPA (fig. 1).
- •
En las dos guías nuestro grupo de trabajo echa en falta una exposición más exhaustiva del trabajo de enfermería, tan importante en nuestras consultas, y sobre todo en el diagnóstico y posterior seguimiento de los pacientes.
- •
Por otra parte, consideramos que en cada visita debe realizarse un control exhaustivo del paciente con toma de la PA clínica en ambos brazos (si existe duda de buen control, completar con estudio AMPA y/o MAPA), analítica (hemograma; glucosa en ayunas —HbA1c si DM asociada—, perfil lipídico completo, iones (Na+, K+), ácido úrico, FG, creatinina, función hepática y análisis de orina con cociente albúmina/creatinina) y ECG. Al menos con una periodicidad de 2-3años sería razonable realizar un índice tobillo-brazo y, si hay opción, estudio con ecografía de ambas carótidas para valorar el GIM y/o la aparición de placas.
- •
Consideramos importante la realización de visitas cada 1-2meses hasta alcanzar objetivos de control y, una vez alcanzados, una visita cada 3-6meses podría ser suficiente.
Es importante conocer que ambas guías plantean su posición, a la que llegan por diferentes vías. Los americanos utilizaron un comité de revisión independiente, que revisó la literatura y analizó los datos en busca de preguntas clave; por el contrario, el grupo de trabajo europeo consideró revisiones sistemáticas relevantes publicadas recientemente en revistas de impacto. La diferente interpretación de los resultados, de las consideraciones de los factores locales, de las políticas y la de factibilidad de la implementación probablemente fue lo que condujo a las diferencias entre ellas.
Tras el análisis y la reflexión, se pueden observar más similitudes que diferencias entre ambas guías. Son aspectos comunes la importancia del cribado y del diagnóstico precoz, la importancia del diagnóstico correcto, la utilización de AMPA y/o MAPA para el diagnóstico y el seguimiento de los pacientes, la evaluación global del paciente y tener en cuenta el riesgo cardiovascular global, la importancia de alcanzar objetivos de control, las revisiones cada 1-2meses hasta alcanzar dichos objetivos y el abordaje de la hipertensión refractaria. También consideran importante la colaboración de otros profesionales y el uso de las tecnologías de la comunicación y la información.
Por otra parte, ambas guías difieren en aspectos relevantes, como la clasificación de los niveles de PA, cuándo iniciar tratamiento y los objetivos de control a alcanzar. La guía americana considera HTA valores ≥130/80mmHg y propone tratar con fármacos a estos pacientes (HTA estadio1) solo si son de alto riesgo, posiblemente en base a la preocupación por la progresión a estadios más avanzados de HTA y el mal control de la PA. Por su parte, la guía europea es menos categórica pero mantiene el concepto de PA normal-alta, sugiriendo que también estos pacientes están fuera de la «normalidad», y asimismo propone tratarlos si son de alto riesgo, aunque tras un período de modificación de estilos de vida.
Es evidente la preocupación de ambas guías por la elevada incidencia de HTA y la importancia que dan a la valoración global del riesgo del paciente —no solo a las cifras de PA— para tomar decisiones, aunque una guía es más tajante que la otra. Algo similar ocurre con la HTA estadio2 o grado1 de bajo riego: la guía americana es más categórica en cuanto al inicio precoz del tratamiento.
En cuanto a los objetivos de control, aunque lo expresan de forma diferente, ambas guías consideran que un objetivo <130/80mmHg podría ser razonable para la mayoría de los pacientes siempre que sea bien tolerado. Ambas guías —la americana es más explícita— consideran importante alcanzar objetivos algo más estrictos, pero siempre evitar la iatrogenia farmacológica, siendo la europea menos categórica, intentando evitar una medicalización excesiva de los pacientes.
Consideramos importante la modificación de estilos de vida para evitar la incidencia de HTA y su progresión a estadios más avanzados; alcanzar objetivos de control individualizados teniendo en cuenta el riesgo global del paciente, y evitar los efectos secundarios de la medicación.
Curiosamente, ambas guías consideran niveles normales/óptimos de PA <120/80mmHg, y las guías europeas desaconsejan bajar la PA por debajo de 120/70mmHg.
Resultados propios obtenidos del análisis de la cohorte IBERICAN (Identificación del Riesgo Cardiovascular y Renal)14 indican que son demasiados los pacientes atendidos en nuestras consultas a diario que, aun presentando un riesgo cardiovascular alto/muy alto, no alcanzan objetivos de control y son poco adherentes a los estilos de vida saludables.
Queda mucho por hacer, y disponemos de diversas opciones de mejora: un mayor conocimiento de las GPC por parte de los clínicos y la prescripción individualizada del tratamiento, evitar la inercia y mejorar la adherencia; todo ello redundará en un beneficio para los pacientes hipertensos y contribuirá a mejorar la salud poblacional.
Por último, recordar que la HTA es el motivo más frecuente de consulta y la causa más frecuente de discapacidad y mortalidad prematura relacionada con la ECV. De nuestra buena práctica clínica depende la mejora de la calidad de vida de nuestros pacientes, una mayor supervivencia y una gestión adecuada de los recursos del Sistema Nacional de Salud.
FinanciaciónLos autores declaran que no han recibido ningún tipo de financiación para la realización del presente trabajo.
AutoríaTodos los autores han revisado la bibliografía y han contribuido por igual a la redacción de cada una de las partes de este documento y participado en su revisión. VPC, JADG, MAPD han coordinado todo el trabajo, han revisado la literatura, han diseñado, han adaptado el manuscrito y han analizado críticamente la versión final.
Conflicto de interesesV. Pallarés-Carratalá declara haber recibido honorarios por conferencias de Almirall, Menarini, Boehringer-Ingelheim, Esteve, MSD y Novartis.
J.A. Divisón Garrote declara haber recibido honorarios de Menarini.
M.A. Prieto Díaz, en los últimos 5 años y en el campo de la Formación Continuada, ha recibido honorarios de Boehringer, Menarini, Almirall, Esteve, Pfizer, Merck Sharp & Dohme España S.A., Rubió, Ferrer Internacional S.A., Astra Zeneca, Editorial Médica Panamericana S.A., Mylan, Dynamic Science, Adknoma Health Research S.L., Bayer, IDEMM Farma, Saatchi & Saatchi S.L.U., Saned S.L., Clover SGM S.L. y Elsevier España S.L.U.
L. García Matarín ha participado como autor de capítulos de libros o de monografías, director de cursos, miembro de Comités Organizador o Científico, moderador o ponente en mesas, talleres y conferencias patrocinadas por el Servicio Extremeño de Salud y la Sociedad Española de Médicos de Atención Primaria (SEMERGEN).
El resto de los autores declara no tener ningún conflicto de intereses.
S. Velilla Zancada declara su conflicto de intereses en el campo de la Formación Continuada con las siguientes empresas: Servier, Norvatis, Ferrer y Esteve.
D. Rey Aldana, en los últimos años, solo ha recibido honorarios con SERVIER en temas relacionados directamente con la HTA.
S. Cinza-Sanjurjo refiere haber recibido honorarios por asesorías de Almirall, Astra Zeneca, Bayer, Bristol-Mayers-Squibb, Daichii-Sankyo, Novartis, Pfizer y Rovi. También ha recibido honorarios por conferencias de Almirall, Astra Zeneca, Bayer, Boehringer-Ingelheim, Bristol-Myers-Squibb, Esteve, GSK, Lacer, Lilly, MSD, Novartis, Novo-Nordisk, Pfizer, Rovi, Sanofi-Aventis y Teva. Finalmente, ha recibido financiación para estudios que lidera de Almirall, Astra Zeneca, Bayer y Boehringer-Ingelheim.
C. Santos Altozano declara honorarios por ponencias patrocinadas por Astra Zeneca, Lilly, Menarini, Novo Nordisk, MSD y Mylan.
J.L. Górriz declara honorarios por dar conferencias para Bial, Novartis, Menarini, Boehringer-Ingelgeim, Lilly, Jannsen, Mundipharma, Astrazeneca, Esteve, Novonordisk, Vifor Pharma y Bayer.
F.J. Alonso Moreno declara haber recibido honorarios por Menarini y Almirall.
J. Polo García declara haber recibido honorarios por ponencias de Boehringer Ingelheim, Bayer, Daiichi-Sankyo. Pfizer-BMS, Menarini y Almirall Bial. Por publicaciones por Boehringer Ingelheim, Bayer, Pfizer-BMS, Novartis y Bial, y como comité científico de estudios por Bayer, Pfizer-BMS y Boehringer Ingelheim.
A. Barquilla García ha participado como autor de capítulos de libros o de monografías, director de cursos, miembro de Comités Organizador o Científico, moderador o ponente en mesas, talleres y conferencias patrocinadas por el Servicio Extremeño de Salud, la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), la Cátedra de Investigación y Docencia SEMERGEN-UEX, Novartis, Esteve, MSD, AstraZeneca, Boehringer-Ingelheim, Novo-Nordisk, Almirall, Bayer, Heel, Daiichi Sankyo, Sanofi, Ferrer, Fresenius, GSK, Bristol Myers, VIR, Janssen, Juste, Lilly, Menarini, Tedec Meiji, Nutricia, Pfizer, Vegenat, Takeda, Teva y Vifor.
A. Adlbi Sibai, F.J. Alonso Moreno, L. Araujo Márquez, A. Arina Cordeu, L.M. Artigao Ródenas, A. Barquilla García, P. Beato Fernández, V. Caballero Pajares, F. Cabezudo Moreno, A. Calderón Montero, E. Carrasco, J.L. Carrasco Martín, J. Carrizo Sánchez, S. Cinza Sanjurjo, M.P. de las Cuevas Miguel, J.A. Divisón Garrote, S. Elligson Garcia, C. Escobar Cervantes, M.B. Esteban Rojas, J.M. Fernández Toro, M. Frias Vargas, E. García Criado, A. García Lerin, L. García Matarín, O. García Vallejo, R. Genique Martinez, I. Gil Gil, I. González Casado, J.L. Gorriz Teruel, E. Jimenez Baena, J.L. Llisterri Caro, J.C. Martí Canales, J.J. Mediavilla Bravo, F. Molina Escribano, S. Morales Quintero, A. Moyá Amengual (secretaria), G. Nieto Barco, V. Pallarés Carratalá (coordinador), A. Piera Carbonell, J. Polo García, M.A. Prieto Díaz, T. Rama Martínez, M. Redondo Prieto, D. Rey Aldana, B.E. Riesgo Escudero, G.C. Rodríguez Roca, G.A. Rojas Martelo, A. Romero Secén, A. Ruiz García, R. Sánchez Rodríguez, T. Sánchez Ruíz, C. Santos Altozano, F.J. Sanz García, M.C. Seoane Vicente, A. Serrano Cumplido, M. Turégano Yedro, F. Valls Roca, S.M. Velilla Zancada, A. Vicente Molinero