En la actualidad se considera a la calidad de vida relacionada con la salud como uno de los objetivos terapéuticos primordiales en pacientes que precisan tratamiento sustitutivo para seguir viviendo. La salud sexual es un derecho básico que afecta positivamente a la calidad de vida. Aunque una parte significativa de pacientes crónicos presenta algún tipo de disfunción sexual, esta no se plantea abiertamente en la consulta. Es importante que el médico aborde la dimensión sexual de estos pacientes. Repasamos la fisiopatología de las disfunciones sexuales del paciente renal crónico, tanto en hombres como en mujeres. Explicamos los efectos de la diálisis y el trasplante sobre la función sexual. Y exponemos las principales disfunciones sexuales y su tratamiento.
Quality of Life Related to Health is currently considered one of the primary therapeutic objectives in renal failure patients who need substitution treatment as life prolonging therapy. Sexual health is a basic right that positively affects the quality of life. Although a significant percentage of chronic patients have some type of sexual dysfunction, this is not openly discussed, making it important for doctors to address these issues in the clinic. A review is presented on the pathophysiology of sexual dysfunctions in both male and female chronic renal patients. The effects of dialysis and transplantation on sexual function will be addressed, as well as presenting the main sexual dysfunctions and their treatment.
El primer estudio epidemiológico sobre disfunción sexual y enfermedad renal crónica (ERC) fue publicado en 19731. En 1987 la Organización Mundial de la Salud declara la salud sexual como un derecho básico del ser humano y la define como un estado de bienestar físico, emocional, mental y social relacionado con la sexualidad2. De la misma manera, la Organización Panamericana de la Salud definió la salud sexual como la experiencia del proceso permanente de consecución de bienestar físico, psicológico y sociocultural relacionado con la sexualidad3. La salud sexual es, por tanto, un estado de bienestar que afecta positivamente a la calidad de vida.
La disfunción sexual4 se define como aquel trastorno que afecta al comportamiento sexual del hombre o la mujer, que le impide disfrutar de las relaciones sexuales, interfiere en sus relaciones personales, y afecta negativamente a su calidad de vida. Para ser clasificada con tal debe ser persistente o recurrente y generar distrés, discomodidad, bienestar o malestar.
La sexualidad es un fenómeno complejo que depende de mecanismos neurológicos, vasculares y endocrinos, y está condicionada por factores psicológicos, sociales y de pareja. Las enfermedades crónicas afectan de manera multifactorial la salud sexual5,6, produciendo un deterioro de la calidad de vida relacionada con la salud7, influyendo factores físicos y psicológicos. Los factores físicos incluyen los derivados de la propia enfermedad y sus terapias empleadas, destacando la malnutrición, la anemia y el dolor. Entre los factores psicológicos pueden aparecer problemas de autoestima o disminución del yo, ánimo depresivo y labilidad emocional, fatiga, o dificultades de pareja al convertirse en cuidador o cuidadora. En general, las enfermedades crónicas tienden a alterar las fases del deseo y la excitación, mientras que los tratamientos pueden interferir con cualquiera de las fases de la respuesta sexual.
Aunque una parte significativa de pacientes renales crónicos presentan algún tipo de disfunción sexual8,9, la mayoría de las personas que los atienden no plantean abiertamente este problema. Es importante que su médico general y especialista aborden la dimensión sexual de estos pacientes en el contexto de sus problemas médicos, régimen de tratamiento y situación social10. No podemos olvidarnos de que las disfunciones sexuales aparecen como síntoma centinela11 de enfermedades ocultas (dislipidemia, diabetes mellitus, hipertensión arterial, depresión). La identificación y el tratamiento de las disfunciones sexuales funcionarían como una red de conexiones, facilitando el tratamiento farmacológico de otras enfermedades comunes («ocultas»), contribuyendo a su mejor control. El estudio de las disfunciones sexuales va a repercutir en la mejora de la calidad de vida de nuestros pacientes, convirtiéndose la sexualidad en un marcador eficaz del estado de salud. En la actualidad se considera la calidad de vida relacionada con la salud como uno de los objetivos terapéuticos primordiales en pacientes que precisan tratamiento sustitutivo para seguir viviendo12.
Desarrollo del temaPrevalenciaExiste una relación, en ambos sexos, entre el grado de uremia y el porcentaje de disfunción sexual. Aunque más de la mitad de los pacientes en diálisis peritoneal pueden no tener relaciones sexuales1, esta alta incidencia está más relacionada con la pérdida de interés sexual que con problemas orgánicos o fisiológicos13. Un metaanálisis del 20128 concluye que el 84% de las mujeres en diálisis tiene disfunción sexual, definida como una puntuación en el Female Sexual Function Index (FSFI) de ≥ 18. Mor et al.10 utilizando una modificación validada del FSFI, examinan la percepción de la sexualidad en mujeres en hemodiálisis. El 81% de las mujeres informaron que no eran sexualmente activas. En el 64% de las evaluaciones, las mujeres informaron estar moderadamente o muy satisfechas con su vida sexual, mientras que solo el 19% de ellas estaban moderadamente o muy insatisfechas.
Con relación a los varones con insuficiencia renal crónica en hemodiálisis, entre el 20 y el 87%14 presentan disfunción eréctil (DE). Los estudios son variados en cuanto a mejoría o empeoramiento de la DE después de diálisis o trasplante renal15-18. Parece que el trasplante renal protege la función sexual al mejorar el hipogonadismo asociado19. La disminución del deseo sexual es la principal causa de disfunción sexual, aunque es poco consultada, constituyendo la DE el principal motivo de consulta13.
La edad es un determinante importante de la actividad sexual. El 60% de las mujeres entre 65-74 años y el 85% de las mujeres entre 75-85 años, informaron que no habían presentado actividad sexual en los últimos 12 meses20. El tener una pareja sexual potente está fuertemente asociado a la actividad sexual en mujeres tratadas mediante diálisis8. De igual manera, aquellos hombres en diálisis que no tienen pareja sexual presentan mayor disfunción sexual9.
Factores fisiopatológicos de la disfunción sexual masculinaEn el paciente con insuficiencia renal, los factores fisiopatológicos asociados a la disfunción sexual son múltiples y complejos (fig. 1). Ya en sus primeras fases, la insuficiencia renal puede ocasionar alteraciones en el eje hipotálamo-hipofisario-gonadal21. La deficiencia androgénica en varones con ERC afecta al 50-75% de los que reciben hemodiálisis22,23. Se trata de un hipogonadismo hipergonadotropo, con alteraciones en la producción de hormona liberadora de gonadotropinas, hormona foliculoestimulante (FSH), hormona luteinizante (LH) y testosterona testicular24. Este estado de hipogonadismo condiciona no solo problemas de erección y de disminución de la libido25, sino alteraciones cognitivas, anemia, disfunción endotelial, enfermedad cardiovascular y aumento de la mortalidad26. Tras el trasplante, los niveles de testosterona se restablecen o quedan muy discretamente disminuidos27.
La elevación de la LH ya en las primeras fases de la insuficiencia renal28 y su falta de respuesta a los bajos niveles de testosterona circulante indican una alteración en la regulación central que precede y no es corregida con la diálisis29 y sí con el trasplante renal30.
Aunque en menor medida que la LH, la FSH se incrementa27. Esta elevación de la FSH supone un mal pronóstico para la recuperación espermática después del trasplante renal, condicionando infertilidad31.
En la insuficiencia renal se observa un incremento en la secreción hipofisaria de prolactina (PRL) en hasta 3veces27, así como anomalías en su regulación. Estas elevaciones son explicadas en parte por el hiperparatiroidismo secundario común en pacientes con ERC, aunque también se ha referido que la depleción de cinc en estos pacientes tendría un papel decisivo32. Estos niveles elevados se asocian directamente con disfunción endotelial, infertilidad, pérdida de libido, testosterona circulante baja, incremento de eventos cardiovasculares y mortalidad. El trasplante suele conducir a la normalización de sus cifras séricas33.
La uremia por sí misma afecta a la espermatogénesis, produciendo diversos grados de infertilidad. La causa final de la alteración histológica testicular parece estar relacionada con resistencia a las gonadotropinas más que un efecto citotóxico directo sobre las espermatogonias27,34.
Las alteraciones eyaculatorias en el varón con ERC avanzada suelen ser secundarias a trastornos psíquicos o funcionales, fármacos (como los alfabloqueantes), trastornos metabólicos, neurológicos o vasculares. Infecciones locales frecuentes en los trasplantados (uretritis, prostatitis, epididimitis) pueden ocasionar eyaculaciones dolorosas o hemospermia35.
Factores fisiopatológicos de la disfunción sexual femeninaEn la etiopatogenia de la disfunción sexual femenina influyen los mismos factores endocrinos, cardiovasculares y tóxicos que en los varones.
La uremia produce alteraciones en la regulación hipotalámica de la secreción de gonadotropinas e incrementos en los niveles de PRL, dando lugar a picos de estradiol más bajos35. El pico preovulatorio de LH y estradiol rara vez tiene lugar, por lo que la mayoría de ciclos son anovulatorios34. El hipoestrogenismo se manifiesta con disminución de la libido, infertilidad y menopausia precoz37.
La hipersecreción de PRL en mujeres con ERC parece ser autónoma siendo resistente a las maniobras de estimulación o inhibición34. Esta elevación de PRL condiciona disfunción sexual y galactorrea. La ausencia de normalización de la galactorrea después del tratamiento con bromocriptina36 hace suponer que, aparte de la hiperproprolactinemia, deben de existir otros factores implicados.
En mujeres tratadas mediante hemodiálisis las disfunciones sexuales son significativamente mayores con relación a la población sana38,39. Utilizando el FSFI en 1.309 mujeres en hemodiálisis40, presentaban score más bajos en consonancia con mayor disfunción sexual, estando esta, a su vez, asociada a distintas comorbilidades (depresión o eventos cardiovasculares previos).
Función sexual tras el trasplanteVarios autores han confirmado el beneficio del trasplante renal, constatando como la libido y la función sexual se restablecen en muchos casos8,9,12,19,39,41. En pacientes tratados mediante hemodiálisis y que posteriormente habían recibido un trasplante renal, se han confirmado cambios en la motilidad de los espermatozoides y retorno a niveles normales de gonadotropinas (FSH, LH), PRL y testosterona42. Estos pacientes referían, a su vez, una mejora en su calidad de vida43.
Aplicando el International Index of Erectile Function (IIEF) a varones después de recibir un trasplante renal, entre el 41 y el 71% referían mejoría de su función sexual19,44,45 y de su calidad de vida44. La duración de la diálisis previa al trasplante no mostró influencia en la función eréctil45.
Otros estudios argumentan que los factores más importantes para la mejoría de la DE después del trasplante son: la normalización de la función renal, la disminución de la glucemia, el estar menos de 6 meses en diálisis, la disminución de la PRL y el aumento de testosterona46,47.
En 39 mujeres premenopáusicas tratadas mediante trasplante renal después de 6 meses de diálisis, el FSFI mostró mejoras significativas en todos los dominios48. El perfil hormonal mostró una correlación significativa entre los niveles de PRL y la disfunción sexual, observando un descenso de los mismos después del trasplante.
Aunque las disfunciones sexuales y las alteraciones hormonales pueden ser frecuentes a pesar de un trasplante renal funcionante49, las cifras más bajas de testosterona encontradas en pacientes dializados con respecto a los trasplantados sugieren un efecto protector de las capacidades sexuales del trasplante renal17.
Otros estudios concluyen que la ERC terminal empeora la función sexual y la calidad de vida, sin impacto sobre la función sexual el tipo de terapia sustitutiva18, ni la presencia o no de diabetes50. Concluyen que los pacientes trasplantados muestran una mayor satisfacción global, pero no un deseo sexual normal. Otros autores tampoco encuentran diferencias significativas en pacientes trasplantados renales, tanto en la función eréctil como en la satisfacción sexual en general51,52. Se estima que el trasplante renal puede mejorar en el 75% de los pacientes, aunque suele persistir entre el 20 y el 50%.
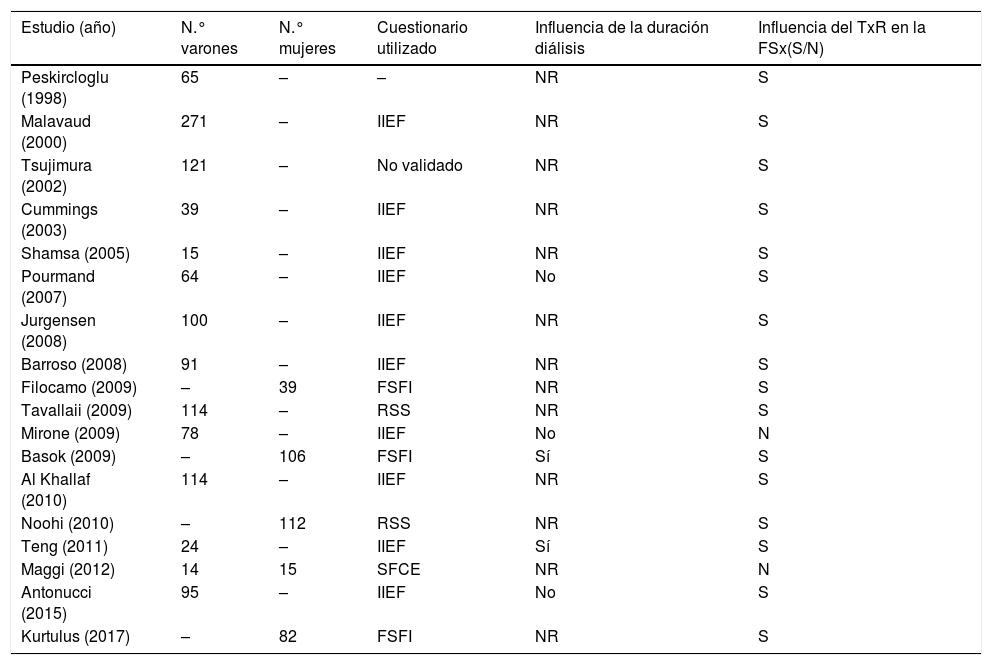
Con estos estudios (tabla 1) podemos decir que, en general, después del trasplante renal los pacientes experimentan una mejoría en su función sexual. El grupo de peor pronóstico serían aquellos de mayor edad, los que se mantuvieron más tiempo en diálisis, los retrasplantados o con función deficiente del trasplante, o donde persisten factores de riesgo cardiovascular (diabetes mellitus, hipertensión, hipercolesterolemia, tabaco)53,54.
Función sexual después del trasplante renal
| Estudio (año) | N.° varones | N.° mujeres | Cuestionario utilizado | Influencia de la duración diálisis | Influencia del TxR en la FSx(S/N) |
|---|---|---|---|---|---|
| Peskircloglu (1998) | 65 | – | – | NR | S |
| Malavaud (2000) | 271 | – | IIEF | NR | S |
| Tsujimura (2002) | 121 | – | No validado | NR | S |
| Cummings (2003) | 39 | – | IIEF | NR | S |
| Shamsa (2005) | 15 | – | IIEF | NR | S |
| Pourmand (2007) | 64 | – | IIEF | No | S |
| Jurgensen (2008) | 100 | – | IIEF | NR | S |
| Barroso (2008) | 91 | – | IIEF | NR | S |
| Filocamo (2009) | – | 39 | FSFI | NR | S |
| Tavallaii (2009) | 114 | – | RSS | NR | S |
| Mirone (2009) | 78 | – | IIEF | No | N |
| Basok (2009) | – | 106 | FSFI | Sí | S |
| Al Khallaf (2010) | 114 | – | IIEF | NR | S |
| Noohi (2010) | – | 112 | RSS | NR | S |
| Teng (2011) | 24 | – | IIEF | Sí | S |
| Maggi (2012) | 14 | 15 | SFCE | NR | N |
| Antonucci (2015) | 95 | – | IIEF | No | S |
| Kurtulus (2017) | – | 82 | FSFI | NR | S |
FSFI: Female Sexual Function Index; FSx: función sexual; IIEF: Index of Erectile Function; N: no mejora tras el trasplante; NR: no referido; RSS: Relationship and Sexuality Scale; S: sí mejora tras el trasplante; SFCE: Sexualmediziniscler Fragebogen bei Chromischen Erkrankungen; TxR: trasplante renal.
La erección es un fenómeno neuro-vascular-tisular, bajo control hormonal. La DE es definida como la incapacidad persistente o recurrente para conseguir o mantener una erección suficientemente firme para llevar a cabo una relación sexual satisfactoria55.
La DE es un problema de salud con un impacto en la calidad de vida y gran repercusión sobre el concepto de satisfacción global con la vida. Los hombres que la presentan experimentan con frecuencia sentimientos de baja autoestima, culpabilidad, ansiedad o depresión, y problemas en su relación de pareja.
Su prevalencia es alta. En el Massachusetts Male Aging Study, realizado en EE. UU.56, el 52% de los varones presentaba cualquier grado de DE (mínima 17%; moderada 25%; severa 10%). El estudio Epidemiología de la Disfunción Eréctil Masculina (EDEM), realizado en España57, el 12,1% de los varones presentaba DE (mínima 5,2%; moderada 5%; severa 1,9%). Entre varones de 40-70 años, el 17,7% presentaban DE. En pacientes tratados con diálisis por ERC en estadio terminal, la prevalencia está en torno al 50%, variando entre el 63% y 81%18. En pacientes trasplantados renales, la prevalencia de DE ocurre en aproximadamente el 65% de los casos19.
La causa más frecuente de DE en la población general es de origen vascular58. La etiología en la ERC es multifactorial incluyendo alteraciones del eje hipotálamo-hipofisario-gonadal, disfunción neuro-endotelial, anemia, hiperparatiroidismo secundario, fármacos, déficit de cinc y problemas psicológicos59. Aquellos varones con factores de riesgo cardiovascular tienen un riesgo significativamente más alto de padecerla58,60.
No hay que olvidar que la DE se comporta como síntoma centinela de otras enfermedades ocultas. En un estudio español sobre 125 pacientes que presentaban DE, se detectó enfermedad oculta (hipertensión arterial, diabetes, cardiopatía, dislipidemia, depresión, ansiedad, problemas urológicos) en el 48,8%61.
La diabetes mellitus es el factor que con más frecuencia conduce a ERC en estadio terminal. Esta provoca, a su vez, DE por daño neurogénico y endotelial62.
El tratamiento farmacológico de la DE en primera línea son los inhibidores de la fosfodiesterasa 5 (I-PDE 5). Estos se pueden utilizar de forma segura en pacientes con ERC, con una eficacia del 74,5-90,5%63-65. Hay que modificar la dosis en pacientes con aclaramiento de creatinina < 30ml/min66. Entre un 15-25% de pacientes, especialmente diabéticos, no responden a sildenafilo aun haciendo escalada de dosis62. Una alternativa a estos pacientes puede ser el vardenafilo67 o el udenafilo68. También se ha comunicado eficacia y la seguridad de tadalafilo en pacientes en diálisis69, y vardenafilo en trasplantados renales con DE70. Los efectos secundarios se presentan en porcentajes similares que en pacientes sin ERC71.
Los I-PDE 5 tienen cierto efecto inhibidor de CYP3A4 del citocromo P450. Cualquier fármaco que estimule o inhiba esa isoenzima puede alterar potencialmente la farmacocinética de agentes inmunosupresores, como el tacrolimús. La utilización de sildenafilo para la DE no ha obligado a una corrección en la dosificación ni ha incrementado los niveles sanguíneos de inmunosupresores, ni inducido efectos adversos sobre la función del riñón trasplantado72,73.
Debido al efecto estimulador de óxido nítrico de la testosterona, la combinación de I-PDE 5 y testosterona puede ser más eficaz que cada uno de ellos por separado, incluso en pacientes en diálisis o trasplantados renales74,75.
Otros tratamientos en segunda y tercera línea que pueden ser utilizados en estos pacientes incluyen los dispositivos de vacío, las inyecciones intracavernosas de sustancias vasoactivas (prostaglandina E1) y la cirugía de revascularización peneana59,76. La última opción de tratamiento ante la falta de respuesta a las distintas líneas sería el implante de una prótesis de pene.
Trastorno del deseo masculinoEl deseo sexual va ligado a la testosterona, conocida como «la hormona del deseo». En el paciente con ERC, las disfunciones sexuales y el hipogonadismo se inician antes de llegar a la fase avanzada y generalmente no son corregidas con la diálisis36.
El hipogonadismo conduce no solo a la disfunción sexual, sino que es causa de anemia, pérdida de masa corporal magra y alteraciones del metabolismo óseo74. En hombres tratados con hemodiálisis, la concentración de testosterona se correlaciona inversamente con todas las causas de mortalidad, incluyendo enfermedad cardiovascular77.
La libido disminuye en relación directa al descenso de testosterona en la ERC78. La estimulación aguda de la secreción de testosterona mediante la administración de gonadotropina coriónica humana produce una respuesta disminuida en varones urémicos79.
La hiperprolactinemia, presente en el 25-57% de los pacientes con ERC, es otra de las causas de descenso de la libido62, interfiriendo con la respuesta gonadal normal a las gonadotropinas. Como resultado se produce una reducción en la esteroidogénesis testicular, con disminución de los niveles séricos de testosterona80.
Una parte imprescindible del tratamiento de estos pacientes es la modificación de estilos de vida no saludables. El ejercicio físico aumenta el metabolismo de los andrógenos en los músculos, aumentando la testosterona libre81.
En aquellos pacientes con sospecha clínica (libido baja, DE, pérdida de masa muscular y de fuerza, aumento de masa magra, osteoporosis, disminución de la vitalidad, ánimo depresivo), es necesaria la determinación de testosterona total sérica. Un descenso de sus valores normales en pacientes sintomáticos requiere tratamiento sustitutivo.
Hay pocos estudios que evalúen la administración de testosterona en pacientes en hemodiálisis. En muchos casos ni la testosterona tópica en gel82, ni los preparados depot83, consiguen mejoría en los niveles séricos de testosterona ni efectos en la función sexual. Otros estudios sí demuestran que el tratamiento sustitutivo con testosterona mejora los niveles séricos en estos pacientes84 y distintos aspectos de la función sexual, como el deseo74.
Aunque el trasplante renal habitualmente no corrige los niveles de testosterona, sí disminuye los de PRL, mejorando la libido y la función sexual en general46,47.
Disfunciones sexuales femeninas en la insuficiencia renalLa respuesta sexual se describe como una secuencia cíclica de etapas o fases características: deseo, excitación, orgasmo y resolución.
Existe una influencia recíproca de las diferentes fases. Así, la excitación puede ser consecuencia o no del estado de deseo, pudiendo reforzar a este a modo de feedback positivo. La presencia de una determinada fase no requiere necesariamente de la precedente. Es decir, una estimulación sensorial intensa puede producir excitación y hasta orgasmo sin que haya deseo. Finalmente, tras el orgasmo, puede seguirse de la fase de resolución o del retorno a la excitación que conduzca a una o varias experiencias orgásmicas adicionales antes de entrar en la fase de resolución.
Deseo sexual hipoactivoEl Manual diagnóstico y estadístico de los trastornos mentales en su cuarta edición (DEM-IV-TR), habla del deseo sexual hipoactivo cuando existe disminución (o ausencia) de fantasías y deseos de actividad sexual de forma persistente o recurrente, provocando malestar acusado o dificultades de relación interpersonal85, en presencia de adecuados inductores externos del deseo86.
Aunque la DMS-V-TR ha aunado el trastorno de la excitación con el DSH, vamos a referirnos a cada uno de los trastornos por separado, ya que no todos los autores están de acuerdo con esta propuesta87.
La prevalencia de disfunciones sexuales en la mujer con ERC está en torno al 30-100%41. Aunque se desconoce en estos pacientes la prevalencia exacta del DSH, sabemos que el deseo disminuido es uno de los dominios del FSFI que más se altera en mujeres en diálisis10,41, y que después del trasplante renal mejora significativamente16,40.
La etiología del DSH es muy variada88. Las alteraciones neuroendocrinas, hormonales o metabólicas, y diversas afecciones crónicas (diabetes mellitus, ERC), influyen de forma negativa. Las alteraciones hormonales de la ERC avanzada, con disminución de andrógenos y elevación de PRL, repercuten en el deseo sexual. Los bajos niveles de estrógenos, también debidos a la menopausia, favorecen la pérdida de la elasticidad vaginal, afectando de este modo la excitabilidad89.
Fármacos, como los inhibidores selectivos de la recaptación de serotonina (ISRS), están relacionados con la falta de deseo y diversas disfunciones sexuales90. Las enfermedades crónicas conllevan en muchas parejas una relación insatisfactoria, por el hecho de convertirse uno de ellos en «cuidador». Esta situación produce una distimia, donde desde las consultas de atención primaria se les puede prescribir un ISRS, con lo que se agravará el problema de pareja.
Diversos factores psicológicos, como la ansiedad, la desmotivación o los trastornos del estado de ánimo, inciden de manera negativa en el deseo sexual.
Las pruebas analíticas que debemos solicitar ante la sospecha de un DSH son los valores de testosterona y, ante su déficit, descartar también una hiperprolactinemia.
Diversos cuestionarios validados91-93 pueden ser útiles para definir un diagnóstico y ver la evolución después del tratamiento.
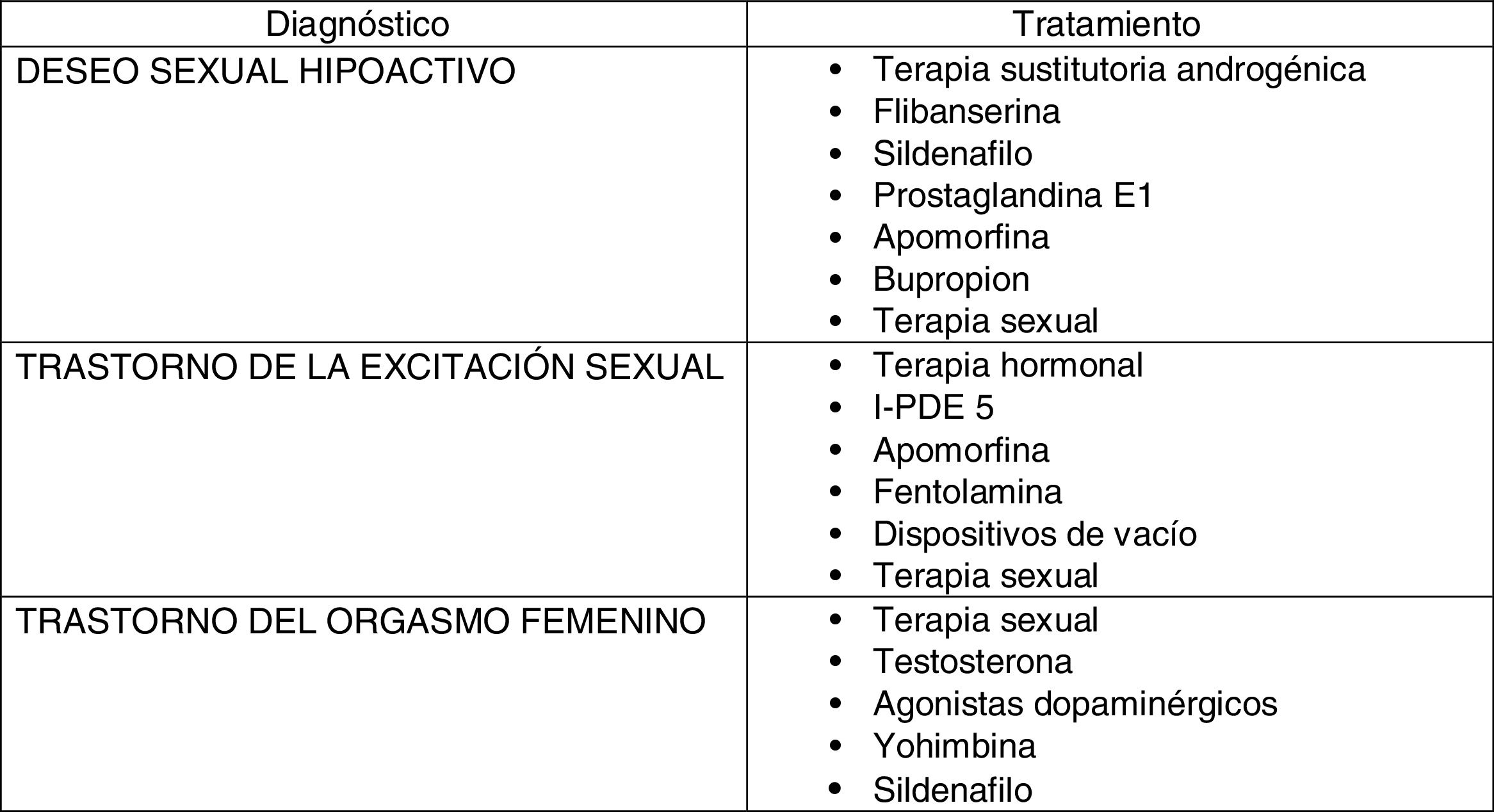
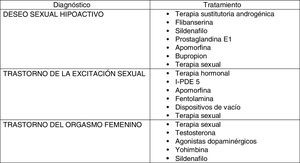
En la actualidad, no existe ningún tratamiento (fig. 2) aprobado con la indicación precisa y única de actuar sobre la falta de deseo, en cualquier etapa de la vida de la mujer. En aquellas con síntomas clínicos de déficit androgénico y niveles bajos de testosterona, pueden ser candidatas a terapia sustitutoria androgénica.
Aunque la excitación es una fase de la respuesta sexual distinta del deseo, pueden prescribirse fármacos que potencien la excitabilidad94 debido a la influencia recíproca entre las distintas fases. De este modo, se utilizan el sildenafilo, prostaglandina E1 y la apomorfina95.
En situaciones de disforia, o en aquellos pacientes donde la falta de deseo se acompaña de depresión, pueden emplearse diversos psicofármacos. El bupropión es un agonista dopaminérgico que estimula el pensamiento sexual y disminuye los efectos secundarios de los ISRS. Su empleo puede mejorar al 29% de las mujeres96. La flibanserina, modulador adrenérgico, dopaminérgico y serotoninérgico, mostró inicialmente buenos resultados97. En ensayos clínicos, el 25% de las mujeres experimentaron un incremento de 4 o más eventos sexuales satisfactorios con flibanserina frente al 15% asignadas a placebo98. Es actualmente el único tratamiento aprobado por la Food and Drug Administration para el tratamiento del DSH en mujeres premenopáusicas en los EE. UU. No ha sido aprobada por la Agencia Europea de Medicamentos.
Como en cualquier disfunción sexual es necesario, para una resolución adecuada del problema, emplear junto con el tratamiento farmacológico una terapia sexual en pareja.
Trastorno de la excitación sexualLas estructuras femeninas que participan en la respuesta sexual son principalmente el clítoris, el introito vaginal y los músculos pubococcígeos. El clítoris provee una fuente de estimulación erótica en la mujer. La vagina dispone de una abundante red vascular subepitelial responsable de la lubricación, permitiendo que la penetración peneana sea sin dolor.
Los principales cambios genitales durante la excitación son la lubricación vaginal, la tumescencia del clítoris y labios menores, el alargamiento y dilatación del fondo vaginal, y el estrechamiento del tercio externo de la vaginal. A su vez, se producen una serie de reacciones extragenitales: erección de los pezones, aumento de la frecuencia cardíaca y presión arterial, rubor sexual o ingurgitación de las aréolas mamarias99,100.
La disfunción sexual femenina de la excitación (DSFE) se define101,102 como la persistente o recurrente incapacidad para lograr o mantener suficiente excitación sexual, que causa angustia personal. Se puede manifestar como pérdida subjetiva de la excitación («estar excitada»), o como sequedad vaginal (pérdida de la lubricación).
La mayoría de los datos de prevalencia de la DSFE se obtienen teniendo en cuenta solo las dificultades en la lubricación, encontrando rangos del 13-24%103. De aquellas mujeres en diálisis que respondieron al cuestionario FSFI, el 14,9% reportó muy poca o ninguna excitación sexual, el 2,9% informó que lubricarse era extremadamente difícil y el 1,4% presentaba mucho dolor durante la actividad sexual40. Sobre 555 mujeres en hemodiálisis que respondieron al FSFI, la puntuación mediana para el dominio excitación fue de 1,8 (casi nunca o menos de la mitad), para lubricación 2,4 (pocas o alguna veces) y de 3,4 para el dolor (menos de la mitad o cerca de la mitad de las veces)41. Aquellas mujeres que previamente habían estado en hemodiálisis y se les realizó trasplante renal16 muestran mejorías estadísticamente significativas en todos los dominios del FSFI (libido, excitación, lubricación, dolor).
Varios estudios han demostrado mayor prevalencia de DSFE en pacientes con factores de riesgo cadiovascular104, donde se alteraría el necesario equilibrio hormonal, neurológico y vascular para el mantenimiento de la respuesta sexual.
El déficit de estrógenos circulantes en la insuficiencia renal produce alteraciones estructurales de la vagina y el clítoris, con trastornos de lubricación y dispareunia. Los bajos niveles de testosterona se asocian a disminución de la excitación sexual, además de cansancio y fatiga105.
Otros factores asociados con disfunciones sexuales (incluida la DSFE) de la mujer que requiere hemodiálisis son la edad, el no estar en lista de espera para trasplante renal, la depresión, la menopausia o la toma de diuréticos41.
La intervención terapéutica implica varias áreas. En mujeres con déficit estrogénico, la terapia hormonal mejora la sensibilidad clitorídea y la lubricación103. La sustitución androgénica puede contribuir a mejorar la lubricación106.
Como terapia no hormonal pueden emplearse I-PDE 5. La DSFE es el tipo de disfunción sexual que más se parece a la DE del varón, estando implicados los mismos factores etiológicos. La relajación muscular que producen los I-PDE 5 provoca un aumento del diámetro y la longitud de la vagina y el clítoris, asociándose tumescencia clitorídea y mejorando la lubricación vaginal107,108.
Otros fármacos empleados para mejorar la lubricación y la sensación placentera vaginal son la fentolamina o la apomorfina.
Los dispositivos de vacío, como el EROS-CTD, fueron aprobados para el tratamiento de la disfunción sexual femenina causada por insuficiente flujo de sangre a los genitales, mejorando la sensación clitorídea, la lubricación, el orgasmo y la satisfacción109.
Trastorno del orgasmo femeninoEl orgasmo es la sensación de máximo placer, que produce una alteración transitoria del estado de consciencia, acompañado de contracciones miotónicas generalizadas y que da como resultado sensación de bienestar y felicidad110.
El trastorno del orgasmo femenino (TOF), definido en el DSM-IV, es el persistente o recurrente retardo, o ausencia de orgasmo, posterior a una fase de excitación sexual normal. Si no causa marcado estrés o dificultad interpersonal, no debe realizarse el diagnóstico de TOF85.
Los cambios fisiológicos durante el orgasmo incluyen contracciones de la plataforma orgásmica vaginal (músculos estriados del suelo de la pelvis) y del ano. Estas contracciones se acompañan de secreciones uretrales y parauretrales (glándulas de Skene), y de manera variable, por contracciones uterinas.
La prevalencia de anorgasmia en mujeres varía entre el 24 y el 37%111. Los problemas sexuales más frecuentemente observados en mujeres en la población general son el deseo disminuido y la incapacidad del orgasmo112. La excitación y el orgasmo son los hallazgos que más severamente afectan a la salud sexual de las mujeres en diálisis41. De 659 mujeres en hemodiálisis que fueron encuestadas respondiendo completamente al cuestionario FSFI, el 75,1% informó no tener orgasmo o dificultad extrema para conseguirlo40.
Entre las posibles etiologías de TOF se encuentran las alteraciones propias de la ERC, como el hipoestrogenismo, la hiperprolactinemia y el hipoandrogenismo.
En aquellas mujeres que toman ISRS se observa, en el 50% de ellas, ausencia o retardo del orgasmo113.
Enfermedades crónicas, como la diabetes mellitus y la hipertensión arterial, pueden también producir trastornos del orgasmo.
La baja autoestima, la alteración de la imagen corporal (fístulas arterio-venosas, palidez, atrofia muscular) o las alteraciones de pareja pueden impactar negativamente en la sexualidad.
En cuanto al tratamiento, hay que tener en cuenta que generalmente no se presenta de manera aislada, estando de este modo frecuentemente relacionado con los trastornos del deseo o de la excitación. Es fundamental en este trastorno el psicólogo sexual para promover cambios cognitivos-conductuales. Se ha experimentado también con testosterona, agonistas dopaminérgicos o yohimbina, aunque sin ensayos clínicos que respalden su recomendación generalizada. Se ha mostrado mejoría en la sensación y la habilidad para conseguir orgasmo después del uso de sildenafilo114.
ConclusiónExiste una alta prevalencia de disfunciones sexuales masculinas y femeninas en el paciente renal crónico. Los factores fisiopatológicos asociados son múltiples y complejos, estando implicadas las alteraciones en el eje hipotálamo-hipofisario-gonadal, la hiperprolactinemia o las alteraciones en los niveles de estrógenos circulantes. Es difícil establecer en la mayoría de los casos una única causa responsable, siendo los factores de riesgo cardiovascular una de sus principales causas. Los trastornos más comunes son las alteraciones del deseo y de la excitación. Muchas de estas disfunciones sexuales aparecen como síntomas centinela de enfermedades ocultas, como la hipertensión, la diabetes o trastornos ansioso-depresivos. La diálisis agrava estas disfunciones y el trasplante renal parece mejorarlas, aunque en un porcentaje alto de pacientes pueden persistir. Aun así, la población de trasplantados goza de una mejor salud sexual que la sometida a diálisis. Aquellos pacientes de edad más avanzada, retrasplantados o en quienes persistan los factores de riesgo cardiovascular, tendrán un pronóstico peor en cuanto a la recuperación de la sexualidad. Sería importante que en pacientes con ERC avanzada y en aquellas en diálisis, se evaluase de manera sistemática su función sexual mediante la administración del cuestionario FSFI. El tratamiento de estas disfunciones incluye la corrección de factores de riesgo y la modificación de estilos de vida no saludables, terapia hormonal y no hormonal, y un apoyo psicológico que promueva cambios cognitivo-conductuales.
Conflicto de interesesLos autores declaramos que no existen conflictos de intereses.