La neumonía adquirida en la comunidad (NAC) es una enfermedad infecciosa respiratoria aguda que tiene una incidencia de 3-8 casos/1.000 habitantes, y que aumenta con la edad y las comorbilidades. El neumococo es el microorganismo más frecuentemente implicado en la neumonía adquirida en la comunidad en los adultos (30-35%).
El 40% de los pacientes con neumonía adquirida en la comunidad requieren ingreso hospitalario, y alrededor del 10% necesitan ser admitidos en una unidad de cuidados intensivos. Las formas más graves de infección neumocócica se incluyen en la enfermedad neumocócica invasiva (ENI), que agrupa los casos de bacteriemia (asociadas o no a neumonía), meningitis, pleuritis, artritis, peritonitis primaria y pericarditis.
En la actualidad, el mayor problema con el neumococo es la aparición de resistencias a los agentes antimicrobianos y su elevada morbimortalidad, a pesar del uso de antibióticos apropiados y de un tratamiento médico correcto. Ciertas condiciones médicas subyacentes aumentan el riesgo de ENI y de sus complicaciones, destacando, desde el punto de vista neumológico, el tabaquismo y las enfermedades respiratorias crónicas.
La enfermedad neumocócica, según la OMS, es la primera causa de muerte prevenible en el mundo en niños y adultos. Entre las estrategias para prevenir la ENI se encuentra la vacunación. La OMS considera esencial y prioritaria su introducción e implementación frente al neumococo, de forma universal, en todos los países. Actualmente disponemos de 2 vacunas antineumocócicas para el adulto: la polisacárida de 23 serotipos y la conjugada de 13 serotipos.
Las sociedades científicas aquí representadas han trabajado para elaborar unas recomendaciones, basadas en la evidencia científica actual, respecto a la vacunación antineumocócica en el adulto inmunocompetente con enfermedad respiratoria crónica y en fumadores con riesgo de padecer ENI.
Community-acquired pneumonia is an acute respiratory infectious disease which has an incidence of 3-8 cases/1,000 inhabitants, and increases with age and comorbidities. The pneumococcus is the organism most frequently involved in community-acquired pneumonia in the adult (30-35%).
Around 40% of patients with community-acquired pneumonia require hospital admission, and around 10% need to be admitted to an intensive care unit. The most serious forms of pneumococcal infection include invasive pneumococcal disease (IPD), which covers cases of bacteremia (associated or not to pneumonia), meningitis, pleuritis, arthritis, primary peritonitis and pericarditis.
Currently, the biggest problem with the pneumococcus is the emergence of resistance to antimicrobial agents, and its high morbimortality, despite the use of appropriate antibiotics and proper medical treatment. Certain underlying medical conditions increase the risk of IPD and its complications, especially, from the respiratory diseases point of view, smoking and chronic respiratory diseases.
Pneumococcal disease, according to the WHO, is the first preventable cause of death worldwide in children and adults. Among the strategies to prevent IPD is vaccination. WHO considers that its universal introduction and implementation against pneumococcus is essential and a priority in all countries. There are currently 2 pneumococcal vaccines for adults: the 23 serotypes polysaccharide and conjugate 13 serotypes.
The scientific societies represented here have worked to develop some recommendations, based on the current scientific evidence, regarding the pneumococcal vaccination in the immunocompetent adult with chronic respiratory disease and smokers at risk of suffering from IPD.
La neumonía adquirida en la comunidad (NAC) es una enfermedad infecciosa respiratoria aguda, que tiene una incidencia que oscila entre 3 y 8 casos por 1.000 habitantes-año. Esta incidencia aumenta con la edad y las comorbilidades, con unas tasas en Europa y América del Norte que varían desde 30 a 100 casos/100.000 personas-año, según la población estudiada y las pruebas diagnósticas utilizadas1.
Streptococcus pneumoniae (neumococo) es el microorganismo más frecuentemente implicado en la NAC en los adultos, donde está presente en el 30-35% de los casos2,3.
El 40% de los pacientes con NAC requieren ingreso hospitalario, y alrededor del 10% necesitan ser admitidos en una unidad de cuidados intensivos. Las formas más graves de infección neumocócica se incluyen en la enfermedad neumocócica invasiva (ENI), que agrupa los casos de bacteriemia (asociada o no a neumonía), meningitis, pleuritis, artritis, peritonitis primaria y pericarditis. No obstante, el problema está infravalorado, dado que se estima que para cada caso de NAC bacteriémica hay 3 casos de NAC no bacteriémica4.
En la actualidad, el mayor problema con el neumococo es la aparición de resistencias a los agentes antimicrobianos5 y su elevada morbimortalidad, ya que, a pesar del uso de antibióticos apropiados y de un tratamiento médico correcto, la mortalidad global de la NAC está alrededor del 10%, siendo del 30-40% en población de edad avanzada con ENI2. En pacientes ingresados en una unidad de cuidados intensivos6, la mortalidad es del 36%, y del 50% en mayores de 64 años7. Aunque, como se indica, las tasas más altas se dan entre los lactantes, niños menores de 2 años y personas mayores de 65 años6,8,9, la presencia de ciertas condiciones médicas subyacentes aumenta el riesgo de ENI y de sus complicaciones9–14, destacando, desde el punto de vista neumológico, el tabaquismo y las enfermedades respiratorias crónicas.
Un estudio prospectivo multicéntrico de vigilancia hospitalaria de la ENI, realizado en España en 2010-201115, muestra que el 93% de los 191 pacientes incluidos presentaba al menos una comorbilidad: el 21,9%, antecedentes de hepatopatía crónica; el 20,8%, de neoplasias; el 18%, de enfermedad pulmonar obstructiva crónica (EPOC); el 18%, de diabetes mellitus; el 15,7%, de enfermedad cardiaca crónica, y el 14%, de infección por el virus de la inmunodeficiencia humana. De forma global, el 44% de los pacientes refería alguna condición de inmunosupresión. La tasa de mortalidad global estimada fue del 14%, y la edad media, de 62 años16.
La ENI es un grave problema en adultos con determinadas enfermedades (tabla 1)14 que les hacen más susceptibles a la infección y favorecen la aparición de cuadros de mayor gravedad, con una elevada morbimortalidad pese al tratamiento médico correcto, todo lo cual hace de la ENI un importante problema de salud pública. Según la OMS, la enfermedad neumocócica es la primera causa de muerte prevenible en el mundo en niños y adultos. Entre las estrategias para prevenirla se encuentra la vacunación, y la OMS considera esencial y prioritaria su introducción e implementación frente al neumococo, de forma universal, en todos los países11.
Condiciones médicas subyacentes que aumentan el riesgo de enfermedad neumocócica invasiva
| 1. Inmunodeficiencia/inmunosupresión: enfermedad de Hodgkin, leucemia, linfoma, mieloma múltiple, insuficiencia renal, síndrome nefrótico, trasplante de órgano sólido o de células hematopoyéticas, implantes cocleares, tratamiento quimioterápico o inmunosupresor, infección por el virus de la inmunodeficiencia humana |
| 2. Asplenia anatómica o funcional |
| 3. Hepatopatía crónica/cirrosis |
| 4. Enfermedad respiratoria crónica, cardiovascular y diabetes mellitus |
| 5. Tabaquismo y alcoholismo |
Tomada de Picazo et al.14.
Actualmente disponemos de 2 vacunas antineumocócicas para el adulto: la polisacárida y la conjugada, esta última disponible en España desde junio de 2010. La vacuna neumocócica polisacárida contiene 23 serotipos (VNP23) y se emplea en mayores de 2 años de edad desde hace varias décadas. Las coberturas vacunales en estos grupos de riesgo son más bajas de lo deseable, ya que la VNP23 no genera memoria inmunitaria, los niveles de anticuerpos disminuyen con el tiempo, provoca un fenómeno de tolerancia inmunitaria y no actúa sobre la colonización nasofaríngea. La vacuna neumocócica conjugada contiene 13 serotipos (VNC13), puede emplearse tanto en lactantes como en la edad adulta (la indicación en mayores de 18 años ha recibido la aprobación de la Agencia Europea de Medicamentos en julio de 2013)17,18, induce memoria inmunológica y genera una respuesta inmunitaria más potente que la VNP23.
Las sociedades científicas aquí representadas han trabajado para elaborar unas recomendaciones, basadas en la evidencia científica actual, respecto a la vacunación antineumocócica en el adulto inmunocompetente con enfermedad respiratoria crónica y en fumadores con riesgo de padecer ENI. Este documento pretende exponer, de forma sencilla y clara, las bases para las recomendaciones de la vacunación antineumocócica en este grupo de pacientes, en los que la VNC13 podría ser beneficiosa. Se actualizará cuando dispongamos de nuevas evidencias científicas y estará accesible en Internet a través de las páginas web de las sociedades científicas participantes.
Streptococcus pneumoniaeStreptococcus pneumoniae es un coco grampositivo, que presenta una cápsula polisacarídica como factor de virulencia más importante2. El reservorio del neumococo son los seres humanos y coloniza con frecuencia la nasofaringe sin causar síntomas. La prevalencia del estado de portador oscila entre el 38-60% en los niños en edad preescolar, entre el 29-35% en edad escolar, y entre el 18-29% en adultos jóvenes6,19.
Se distinguen más de 93 serotipos, según la estructura química y antigénica de los polisacáridos capsulares, aunque solo de 15 a 20 causan la mayoría de las enfermedades neumocócicas en el mundo20,21. El polisacárido capsular es el principal factor de virulencia y de patogenicidad del neumococo, e induce la producción de anticuerpos protectores específicos en el huésped. El polisacárido capsular desempeña un papel relevante en la biología de esta bacteria y en la fisiopatología de las enfermedades que produce, ya que la protege de la fagocitosis por polimorfonucleares neutrófilos y macrófagos, e impide que los anticuerpos y el complemento lleguen a las estructuras internas22. No todos los serotipos producen enfermedad. El 85% de los aislados procedentes de muestras de enfermos se agrupan en 17 serotipos, y 6 de ellos (19, 6, 3, 23, 14 y 9) son los responsables del 60% de las enfermedades neumocócicas. Los distintos serotipos se comportan de manera diferente en cuanto a su capacidad antigénica, virulencia, capacidad colonizadora, cuadro clínico que producen y sensibilidad a los antibióticos (el 80% de los neumococos con resistencias antibióticas pertenecen a solo 5 serotipos). Además, la incidencia de los distintos serotipos es variable según la edad, la estación del año y el área geográfica. Por todo ello, las vacunas neumocócicas desarrolladas hasta la fecha están basadas en los polisacáridos capsulares20,21,23.
El neumococo produce colonización asintomática de la nasofaringe (portador) y su importancia en el ser humano se debe a que puede desencadenar gran variedad de síndromes infecciosos, entre los que destacan formas graves de ENI (neumonía con bacteriemia, meningitis o septicemia) que pueden causar la muerte del paciente24. La transmisión se produce desde portadores del microorganismo a los convivientes. El periodo de transmisión dura hasta que las secreciones de las vías respiratorias altas ya no contienen un número considerable de neumococos, lo cual suele ocurrir en las 24h siguientes a la instauración de un tratamiento antibiótico eficaz. Factores como el hacinamiento, la estación del año y la presencia de otras infecciones del tracto respiratorio influyen en esta transmisión. La incidencia de infecciones neumocócicas es mayor durante el invierno y al comienzo de la primavera, cuando las infecciones respiratorias son más frecuentes1,20,23. Los brotes epidémicos son excepcionales25.
Las personas mayores de 65 años, así como aquellas otras que padecen alguna enfermedad crónica, reflejadas en la tabla 1, presentan un mayor riesgo de infección14. La susceptibilidad de las personas de edad avanzada a la neumonía neumocócica podría reflejar el envejecimiento del sistema inmune, especialmente la disminución de la producción de inmunoglobulinas. La mortalidad por NAC neumocócica varía según la edad, y oscila entre un 5-10% en personas de todas las edades, y el 10-30% en mayores de 65 años. El neumococo ha sido el principal microorganismo productor de enfermedades invasivas en España durante el periodo 1993-1998. Las infecciones invasivas causadas por este microorganismo sufrieron un incremento a partir del año 1995, afectando más a los mayores de 64 años, seguidos por los de 45 a 64 años. La mortalidad por ENI es del 16-36% en adultos, aumentando al 28-51% si se considera a los mayores de 65 años26.
Neumonía adquirida en la comunidad por neumococoEl neumococo es el agente patógeno más frecuentemente identificado en la NAC, estando implicado en el 30-35% de los casos2,3. La incidencia de NAC en nuestro país en mayores de 65 años se estima en 14 casos por 1.000 personas-año (IC 95% 12,7-15,3), y aumenta con la edad (29,4 casos por 1.000 personas-año en mayores de 85 años). Además, genera un importante impacto sanitario, ya que hasta el 75% de los casos requiere de ingreso hospitalario27.
La tasa anual de incidencia estimada de hospitalizaciones por NAC en España durante el periodo 2003-2007 fue de 6,27 casos/1.000 habitantes en mayores de 50 años, y de 10,29 casos/1.000 habitantes en mayores de 65, sin diferencias en las tasas de incidencia, mortalidad o letalidad a lo largo del periodo28. Las variables asociadas significativamente a la hospitalización por NAC para el periodo 2008-2009, según un estudio de Badalona, fueron la hepatopatía crónica (OR 5,9), el ictus (OR 5,9), la demencia (OR 3,5), la EPOC (OR 2,9) y la diabetes mellitus (OR 1,9). En este estudio, el patógeno más frecuentemente identificado fue el neumococo (57,5%; 34,7% en los pacientes ambulatorios y 71,9% en los hospitalizados)29. Determinar la mortalidad por NAC es muy complejo. En el ámbito de la Atención Primaria es inferior al 1%, y a nivel hospitalario fluctúa entre el 5,7-14%, llegando hasta el 50% en pacientes ingresados en la unidad de cuidados intensivos30.
Enfermedad neumocócica invasivaLa ENI es la forma más grave de enfermedad neumocócica y se define como la presencia de neumococo en sangre, líquido cefalorraquídeo u otro fluido normalmente estéril31. Las tasas de incidencia más elevadas se dan en los grupos de edad extremos de la vida27. En nuestro país, en el periodo 2007-2009, la incidencia en menores de 2 años fue de 49,79 casos/105 habitantes y de 20,76 casos/105 a partir de los 65 años32. La ENI se presenta de diferentes formas clínicas, siendo la neumonía bacteriémica la más frecuente. En el adulto, el 60-87% de todos los casos de bacteriemia neumocócica son atribuibles a neumonías.
En el estudio ODIN (estudio prospectivo español, multicéntrico, de vigilancia hospitalaria de la ENI), que incluyó 637 pacientes en el periodo 2010-2013, el 33,5% de los casos presentó una neumonía no complicada, el 37,8% una neumonía complicada (definida como neumonía con derrame pleural, y/o empiema, y/o afectación multilobar), el 11,2% una meningitis, el 8,2% una bacteriemia sin foco, el 3,7% peritonitis y el 5,5% otras formas clínicas. La edad media fue de 63 años, pero hay que destacar que más del 50% eran menores de 65 años. Respecto al lugar de adquisición, el 77,7% fue comunitaria, el 15,4% asociada a cuidados de salud, y un 6,9%, nosocomial33. Además de la edad, se ha descrito que determinadas condiciones y enfermedades concomitantes subyacentes aumentan el riesgo de ENI y su evolución. Entre ellas, destacan aquellas condiciones médicas que conllevan un estado de déficit inmunitario (tabla 1)14.
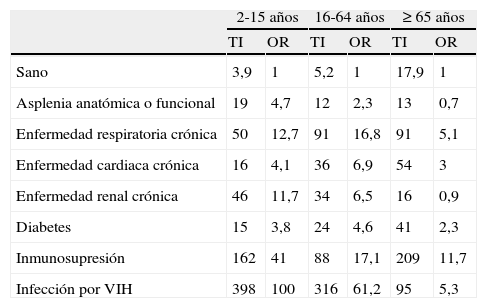
Una revisión de las historias clínicas de más de 22.000 pacientes hospitalizados por ENI en Inglaterra y Gales en 2008 y 2009 (tabla 2) muestra que los principales factores de riesgo para padecer ENI en el grupo de edad entre 16 y 64 años son la infección por el virus de la inmunodeficiencia humana, la hepatopatía crónica, la enfermedad respiratoria crónica y la inmunodepresión en comparación con sujetos sanos, en los que estimaron una tasa de incidencia de 5,2 casos/105 habitantes13. Respecto a los sujetos de edad igual o superior a 65 años, el mayor riesgo se correspondió con los que padecían inmunodepresión.
Odds ratio y tasas de incidencia/105 habitantes por grupos de edad, según enfermedad de base, en más de 22.000 pacientes hospitalizados por enfermedad neumocócica invasiva en Inglaterra y Gales en 2008-2009 (
| 2-15 años | 16-64 años | ≥65 años | ||||
| TI | OR | TI | OR | TI | OR | |
| Sano | 3,9 | 1 | 5,2 | 1 | 17,9 | 1 |
| Asplenia anatómica o funcional | 19 | 4,7 | 12 | 2,3 | 13 | 0,7 |
| Enfermedad respiratoria crónica | 50 | 12,7 | 91 | 16,8 | 91 | 5,1 |
| Enfermedad cardiaca crónica | 16 | 4,1 | 36 | 6,9 | 54 | 3 |
| Enfermedad renal crónica | 46 | 11,7 | 34 | 6,5 | 16 | 0,9 |
| Diabetes | 15 | 3,8 | 24 | 4,6 | 41 | 2,3 |
| Inmunosupresión | 162 | 41 | 88 | 17,1 | 209 | 11,7 |
| Infección por VIH | 398 | 100 | 316 | 61,2 | 95 | 5,3 |
OR: odds ratio; TI: tasas de incidencia/105 habitantes; VIH: virus de la inmunodeficiencia humana.
Tomada de Van Hoek et al.13.
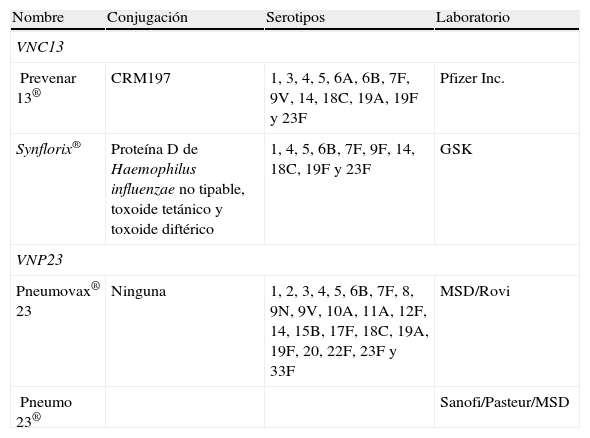
Las vacunas son preparados biológicos (proteínas, polisacáridos o ácidos nucleicos), compuestos fundamentalmente por antígenos de los microorganismos patógenos, capaces de inducir y producir una inmunoprotección (anticuerpos y/o inmunidad mediada por células) en un individuo sano susceptible de padecer la enfermedad, mediante la generación de respuestas inmunitarias específicas protectoras dirigidas a inactivar, destruir o suprimir el agente infeccioso patógeno34. Disponemos de 2 vacunas antineumocócicas (tabla 3) que desde su origen presentan aspectos diferenciales, que van a condicionar los resultados en eficacia y seguridad en función de sus diferentes mecanismos de acción.
Vacunas antineumocócicas disponibles en España
| Nombre | Conjugación | Serotipos | Laboratorio |
| VNC13 | |||
| Prevenar 13® | CRM197 | 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F | Pfizer Inc. |
| Synflorix® | Proteína D de Haemophilus influenzae no tipable, toxoide tetánico y toxoide diftérico | 1, 4, 5, 6B, 7F, 9F, 14, 18C, 19F y 23F | GSK |
| VNP23 | |||
| Pneumovax® 23 | Ninguna | 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F y 33F | MSD/Rovi |
| Pneumo 23® | Sanofi/Pasteur/MSD | ||
CRM 197: corynebacterium diphtheriae proteine 197; GSK: GlaxoSmithKline; MSD: Merck, Sharp & Dohme; VNC13: vacuna neumocócica conjugada de 13 serotipos; VNP23: vacuna neumocócica polisacárida de 23 serotipos.
VNP23 se elabora a partir de los polisacáridos purificados presentes en la cápsula de 23 de los serotipos más frecuentes causantes de infección neumocócica comunitaria en adultos (1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, 33F), y que representan el 85-90% de los serotipos de neumococo causantes de ENI35. VNP23 induce una respuesta inmune independiente de células T en el 80% de los adultos sanos, aunque con distinta magnitud, según los serotipos incluidos en la vacuna, la edad y las comorbilidades del sujeto vacunado36. Sus recomendaciones de uso se establecieron por el Comité Asesor sobre Prácticas en Inmunización en 201037. Esta vacuna está recomendada para todas las personas adultas a partir de los 65 años, o aquellos mayores de 2 que presentan algún factor de riesgo para ENI38,39.
VNP23 está disponible en España desde 1999 con 2 presentaciones comerciales, Pneumo 23® (Sanofi/Pasteur/Merck, Sharp & Dohme) y Pneumovax® 23 (Merck, Sharp & Dohme/Rovi) (tabla 3), y se administra en una única dosis de 0,5ml por vía intramuscular (adultos y niños mayores de 2 años)38. La administración de VNP23 es segura y no comporta mayores inconvenientes que la reacción local, o raramente síntomas generales40. Actualmente, se recomienda una única revacunación a los vacunados de hace más de 5 años, los mayores de 60 años y a personas de cualquier edad con alto riesgo de ENI14,38. Las siguientes limitaciones condicionan la eficacia de la VNP2314,41:
- -
Ausencia de memoria inmunitaria: los polisacáridos son antígenos reconocidos por el sistema inmunitario mediante las inmunoglobulinas de superficie de los linfocitos B, sin intervención de las células T. El linfocito B estimulado desarrolla una respuesta primaria, que se caracteriza por una producción lenta de anticuerpos con escasa avidez y afinidad por el antígeno. Tras el contacto del linfocito B con el antígeno, no queda ningún recuerdo en el sistema inmunitario, y en el mejor de los casos, ante un nuevo contacto con el mismo antígeno se producirá una respuesta similar a la inicial.
- -
Inducción del fenómeno de tolerancia inmunitaria o hiperrespuesta con las revacunaciones: la respuesta inmune a la revacunación frente a la mayoría de los serotipos es inferior a la observada después de la primovacunación. Por ello, la segunda dosis de la vacuna no se considera un refuerzo.
- -
No actúa sobre la colonización nasofaríngea y, por lo tanto, no confiere protección significativa frente a las infecciones neumocócicas de la mucosa, ni frente a la disminución de cepas neumocócicas resistentes a los antibióticos.
Los estudios de eficacia clínica realizados en los últimos 30 años, incluyendo metaanálisis, no han sido concluyentes debido a la heterogeneidad de la metodología aplicada y a que la mayor parte de ellos no han valorado la calidad de los ensayos42–44. En estudios observacionales, VNP23 muestra una efectividad en la prevención de la ENI en adultos sanos inmunocompetentes del 50-80%, sin demostración concluyente de protección frente a la neumonía no bacteriémica45. Respecto a poblaciones pertenecientes a grupos de riesgo, otro metaanálisis44, que evalúa 18 ensayos clínicos aleatorizados y controlados y 7 estudios observacionales no controlados, muestra que, si bien la eficacia estimada de VNP23 en adultos sanos frente a la prevención de la ENI fue de un 74% (IC 95% 56-85), en pacientes de riesgo no hubo evidencia de protección frente a la neumonía por todas las causas, ni redujo la mortalidad. En otro metaanálisis tampoco se observó en pacientes con EPOC una disminución de las agudizaciones (OR 0,58; IC 95% 0,3-1,1), neumonía por todas las causas (OR 0,72; IC 95% 0,5-1,0) o visitas al hospital por infecciones del tracto respiratorio superior (OR 1,29; IC 95% 0,68-2,47) o inferior (OR 1,00; IC 95% 0,75-1,33)46, ni se evidenció protección frente a exacerbaciones.
En países con altas coberturas vacunales, como el Reino Unido, en el que en el año 2003 se amplió la vacunación a todos los adultos de 65 años o mayores (75% de la población vacunada en 2009 y 2010), la efectividad vacunal observada en el periodo 2003-2010 fue significativamente mejor para la población más joven, los adultos entre 65 y 74 años y los pacientes sin enfermedad de base. No se observó protección para la población con enfermedad de base ni para la población mayor de 75 años. Dos años después de la vacunación no se demostró protección para 20 de los 23 serotipos, siendo solo significativa para los serotipos 7F, 9N y 1447.
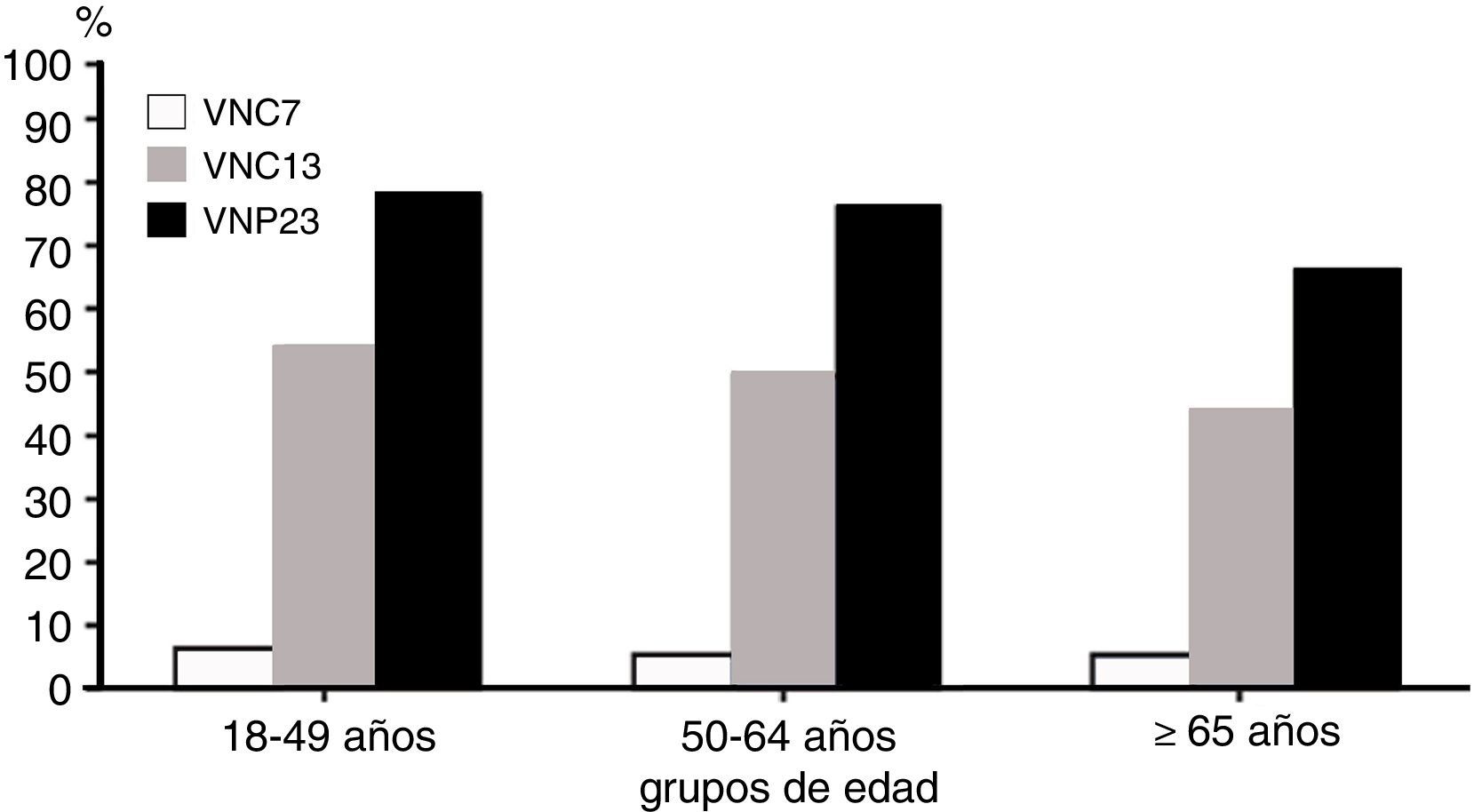
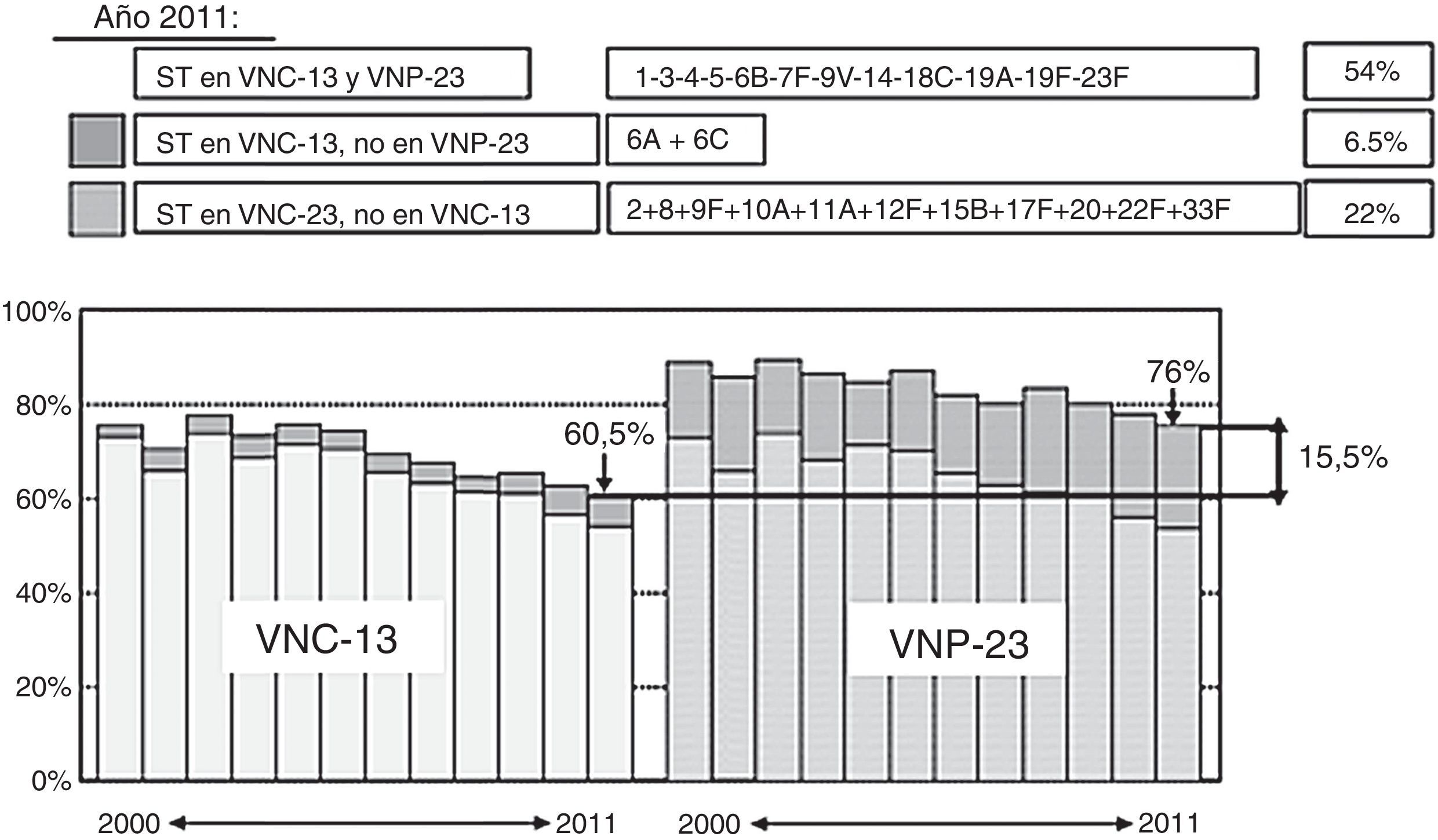
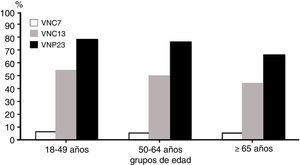
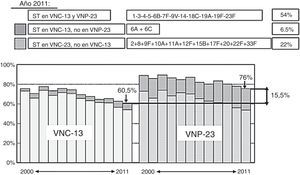
Vacuna neumocócica de polisacáridos conjugados 13-valenteVNC13 se elabora a partir de los 7 polisacáridos capsulares presentes en la vacuna neumocócica de polisacáridos conjugados 7-valente, que son 4, 6B, 9V, 14, 18C, 19F y 23F, más 6 polisacáridos adicionales (1, 3, 5, 6A, 7F, 19A)48, todos ellos conjugados con la proteína transportadora corynebacterium diphtheriae protein 197, que son responsables del 50-76% de los casos de ENI en adultos de 50 años de edad o mayores49. Ambas vacunas, conjugada y polisacárida, comparten 12 serotipos, mientras que la conjugada incluye el serotipo 6A (y 6C, por protección cruzada del 6A), que no se encuentra en la polisacárida. VNP23 contiene 11 serotipos no existentes en la conjugada41 (tabla 3). En España, datos del periodo 2010-2012 indican que la cobertura para los serotipos de VNC13 es del 63% en adultos inmunocompetentes y del 45% en adultos inmunocomprometidos. Los serotipos más frecuentemente identificados fueron el 3 (11,2%), el 19A (8,9%) y el 7F (8,3%)14,50. El porcentaje de casos de ENI cubiertos por los 3 tipos diferentes de vacunas antineumocócicas en mayores de 18 años10 se recoge en la figura 1, y en la figura 2, la cobertura de serotipos de la VNC13 y la VNP23 en los aislados de neumococos de ENI en adultos mayores de 18 años, recibidos en el laboratorio de referencia de neumococos en el periodo 2000-201151. En el año 2011, la diferencia de cobertura de serotipos de la VNC13 y la VNP23 era tan solo del 15,5%41,51.
Porcentaje de casos de enfermedad neumocócica invasiva cubiertos por los 3 tipos diferentes de vacunas antineumocócicas en mayores de 18 años.
VNC7: vacuna neumocócica conjugada de 7 serotipos; VNC13: vacuna neumocócica conjugada de 13 serotipos; VNP23: vacuna neumocócica polisacárida de 23 serotipos.
Adaptada de Centers for Disease Control and Prevention; Advisory Committee on Immunization Practices10.
Comparación de la cobertura de serotipos de la VNC13 y la VNP23 en los aislados de neumococos de enfermedad neumocócica invasiva en adultos mayores de 18 años, recibidos en el laboratorio de referencia de neumococos en el periodo 2000-2011.
ST: serotipos; VNC13: vacuna neumocócica conjugada de 13 serotipos; VNP23: vacuna neumocócica polisacárida de 23 serotipos.
Adaptada de Sociedad Española de Medicina Preventiva, Salud Pública e Higiene41.
La VNC13 induce una respuesta inmune dependiente de T, y a diferencia de la vacuna polisacárida, genera memoria inmunológica52. Además, se produce una respuesta de anticuerpos IgA en las mucosas, que reduce la colonización nasofaríngea53 por los serotipos presentes en la vacuna y genera una inmunidad de grupo, que dificulta la adquisición de nuevos portadores y de futuros enfermos14.
La Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, en su resolución de 17 de julio de 2012, autorizó la inmunización activa con VNC13 para la prevención de la ENI en adultos de 50 años o más, con cargo a fondos públicos del Sistema Nacional de Salud, en pacientes con: inmunosupresión, enfermedad de Hodgkin, leucemia, linfoma, mieloma múltiple, insuficiencia renal, síndrome nefrótico, trasplante de órgano sólido o de células hematopoyéticas, tratamiento quimioterápico e infección por el virus de la inmunodeficiencia humana. Tras la reciente opinión positiva del Committee for Medicinal Products for Human Use de la Agencia Europea de Medicamentos17, la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, en su resolución de 30 de mayo de 2013, ha ampliado estas indicaciones a adultos entre 18 y 49 años18. Algunas comunidades autónomas han aceptado las mencionadas indicaciones y el rango etario14.
En adultos se precisa de una sola dosis, independientemente de las comorbilidades, sin ser necesaria en la actualidad una dosis de recuerdo14. VNC13 genera una respuesta inmunitaria más potente que VNP23 frente a la mayoría de los 13 serotipos en ella incluidos. La administración de VNC13 puede realizarse a partir de las 6 semanas de vida, es segura y no comporta mayores inconvenientes que la reacción local, o raramente síntomas generales. Los sujetos mayores de 65 años comunicaron menos reacciones adversas que los más jóvenes, independientemente del estado de vacunación previo con VNP2348.
En España se ha observado, tras el uso de VNC13, una reducción significativa en la tasa de incidencia de hospitalizaciones por ENI del 55% en niños menores de 15 años y del 63% en los niños entre 12 y 24 meses54. La reducción observada es dependiente del serotipo, al igual que se evidenció con la vacuna neumocócica de polisacáridos conjugados 7-valente, con un descenso en la tasa de incidencia de ENI en la Comunidad de Madrid por los 13 serotipos vacunales del 67% (p<0,001), fundamentalmente a expensas del serotipo 19A (87%, p<0,001) y del serotipo 1 (47%, p<0,01)54. Respecto al impacto sobre la reducción dependiente de la forma clínica, 2 años después de su inclusión se ha observado un descenso significativo en las hospitalizaciones por neumonía bacteriémica (74%), neumonía complicada con derrame pleural (45%) y meningitis (54%). Estos datos son similares a los observados en EE. UU. o Reino Unido55.
Los datos clínicos sobre inmunogenicidad y seguridad han sido obtenidos de estudios realizados en más de 6.000 adultos de entre 50 y 95 años de edad, incluyendo a mayores de 65 años vacunados con una o más dosis de VNP23. Se utilizaron los títulos de anticuerpos funcionales de actividad opsonofagocítica específicos de serotipo, como medida para evaluar la eficacia potencial de VNC13 en ENI y NAC. En cada estudio se incluyeron adultos sanos e inmunocompetentes con enfermedades crónicas (respiratorias, hepáticas [incluyendo hepatopatía alcohólica], cardiovasculares, renales y diabetes mellitus) y con hábitos como tabaquismo o ingesta de bebidas alcohólicas, que se han descrito como factores de riesgo para la infección neumocócica. Estos estudios fundamentan la indicación actual de la VNC13 en sujetos mayores de 50 años48,56,57. La ficha técnica aprobada por la Food and Drug Administration incluye, además de la ENI, la indicación para prevención de la NAC en adultos de 50 años o más58. En el estudio pivotal realizado en adultos que no habían recibido previamente la VNP23 se incluyeron sujetos de 60 a 64 años, a los que se asignó aleatoriamente a recibir una dosis de VNC13 o VNP23, y de 50 a 59 años que recibieron una única dosis de VNC13. Un mes después de la vacunación, en los sujetos de 60 a 64 años se demostró no inferioridad de la respuesta inmune funcional para los 13 serotipos y superioridad para 9 serotipos56. Al comparar las respuestas inmunes obtenidas tras una única dosis de la VNC13 en los 2 grupos de edad, se observó que en los adultos de 50 a 59 años las respuestas eran mayores para 9 de los 13 serotipos que las obtenidas en el grupo de 60 a 64 años, lo que pone de manifiesto que la edad es un factor importante en la respuesta inmune de los sujetos56,58.
Se realizó una ampliación del estudio inicial con objeto de evaluar la respuesta a una segunda dosis de VNC13 o de VNP23, administrada a los 3,5-4 años. Los resultados obtenidos al mes de la segunda dosis de VNC13 o de VNP23 evidenciaron una mayor respuesta inmune para la mayoría de los serotipos comunes en las cohortes que habían recibido inicialmente VNC1357,58. Estos resultados indican que la VNC13 estimula al sistema inmune para que genere una respuesta booster ante una segunda administración de cualquiera de las 2 vacunas, y, por tanto, que la VNC13 genera memoria inmunológica. Por el contrario, cuando los sujetos se vacunaron y revacunaron con VNP23, las respuestas inmunológicas obtenidas, en comparación con la primera dosis, fueron más bajas para 8 de los 12 serotipos57,58.
En el estudio pivotal, realizado en adultos de al menos 70 años de edad que habían sido vacunados con VNP23 al menos 5 años antes, se compararon los títulos de anticuerpos funcionales de actividad opsonofagocítica obtenidos un mes después de haber recibido una dosis única de VNC13 o de VNP23. Las respuestas inmunes obtenidas tras la administración de VNC13 fueron no inferiores significativamente para 12 serotipos y superiores para 10 de los serotipos comunes y para el 6A, a las obtenidas con la VNP2359.
Enfermedades respiratorias crónicasDesde el año 1992, se recomienda la vacunación con VPN23 en pacientes mayores de 65 años y en aquellos grupos de riesgo con mayor probabilidad de sufrir infección neumocócica, entre los que se encuentran aquellos con enfermedades respiratorias crónicas, como la EPOC, bronquiectasias, fibrosis quística, fibrosis pulmonar intersticial y neumoconiosis60.
En un análisis de 22.000 pacientes que habían tenido ENI, realizado por Van Hoek et al.13 en Inglaterra y Gales entre los años 2002 a 2009 y en los que ya se había introducido la vacuna conjugada de 7 serotipos 3 años antes, los sujetos con mayor riesgo para presentar ENI eran los que previamente tenían enfermedad crónica hepática, inmunosupresión y enfermedad crónica respiratoria. Casi todos los estudios que evalúan los factores de riesgo que favorecen el desarrollo de la ENI incluyen las enfermedades crónicas respiratorias como un factor común, y no distinguen entre las distintas entidades. Esto es debido, en parte, a que un elevado número de ellos son retrospectivos y no es posible disponer de mayor información que ayude a delimitar el tipo de enfermedad respiratoria. Sin embargo, hay algunas enfermedades respiratorias más frecuentes de las que sí disponemos de información.
Enfermedad pulmonar obstructiva crónicaEn la EPOC es donde hay más evidencias y donde se han llevado a cabo más estudios en relación con las infecciones respiratorias de las vías bajas, el papel que estas desempeñan en la evolución de dicha enfermedad, y, concretamente, sobre el que juega el neumococo en las exacerbaciones agudas y su participación etiológica en las neumonías.
Los mecanismos de defensa locales en los pacientes con EPOC están alterados, permitiendo que gérmenes que, en condiciones normales, serían eliminados, puedan persistir colonizando la vía aérea de forma crónica61. Aunque inicialmente se apuntaba a gérmenes gramnegativos casi exclusivamente, los recientes estudios del microbioma han mostrado en estos pacientes una gran diversidad de bacterias, y se han identificado, en muestras obtenidas de varias localizaciones del árbol bronquial, tales como esputo, aspirado bronquial, lavado broncoalveolar o mucosa bronquial, Streptococcus, Prevotella, Moraxella, Haemophilus, Acinetobacter, Fusobacterium y Neisseria, entre los más frecuentes62.
Estudios epidemiológicos apuntan a una mayor frecuencia de neumonías en los pacientes con EPOC, a lo que contribuiría, además de la toxicidad local producida por el tabaco como causa más frecuente de EPOC, la edad avanzada a la que suele aparecer clínicamente la enfermedad y el excesivo uso de corticoides inhalados en gran número de estos pacientes.
Conscientes de la importancia de las infecciones respiratorias en los pacientes con EPOC, una medida recomendada en las guías de práctica clínica es la prevención de las mismas. La vacunación antigripal se recomienda desde hace tiempo, y en los últimos años se ha añadido a esta recomendación la prevención de la infección neumocócica. Durante muchos años se ha aconsejado la VNP23, y recientemente lo ha sido la vacuna conjugada de 13 serotipos.
Asma bronquialInicialmente el asma no se consideraba un factor de riesgo favorecedor del desarrollo de ENI. Sin embargo, en un estudio caso-control, llevado a cabo en 635 sujetos63 con ENI y 6.350 controles, de los cuales el 18 y 8%, respectivamente, padecían asma, se observó un incremento del riesgo de padecer ENI en los pacientes asmáticos respecto a los controles (OR 2,4; IC 95% 1,9-3,1). Este incremento podía variar según la diferente intensidad del asma. En ese mismo estudio, al analizar únicamente a los pacientes sin otras comorbilidades asociadas, observaron que la incidencia anual de ENI era de 4,2/105 en los asmáticos de alto riesgo (definido como una o más hospitalizaciones o visitas a Urgencias; uso de tratamiento de rescate o corticoides orales por periodos largos de tiempo o prescripción de 3 o más beta2-agonistas el año anterior), de 2,3/105 en los de bajo riesgo y de 1,2/105 en los sujetos sanos.
Tras este primer estudio, que apuntaba a un riesgo más elevado de padecer ENI en sujetos con asma, un trabajo posterior realizado en Finlandia en 1.282 asmáticos de alto y bajo riesgo (según hubieran tenido o no un ingreso hospitalario en el último año) y 12.785 controles encontró que el asma era un factor de riesgo independiente para padecer ENI. Después de ajustar para otros factores independientes de riesgo en un modelo de regresión logística lineal, el riesgo para ENI estaba relacionado con el asma de bajo riesgo (matched OR 2,8; IC 95% 2,1-3,6) y de alto riesgo (matched OR 12,3; IC 95% 5,4-28,0)64. Esta asociación en grado variable se reafirmó en un metaanálisis que confirmó la asociación entre estos 2 procesos, aunque de forma heterogénea. La probabilidad ajustada oscilaba entre 6,7 (IC 95% 1,6-27,3) en adultos mayores de 18 años y 1,7 (IC 95% 0,99-3,0) en sujetos de 2-49 años con asma de bajo riesgo65.
TabaquismoLa evidencia científica actual confirma que el tabaquismo es uno de los factores de riesgo independiente más importantes para el desarrollo de NAC y de ENI. Los mecanismos específicos por los que la exposición al tabaco incrementa el riesgo de ENI no están del todo claros. En algunos estudios se demuestra que la exposición al humo del tabaco disminuye las defensas del epitelio respiratorio, incrementando la susceptibilidad para la colonización y la infección66.
Fumar afecta el aclaramiento mucociliar, aumenta la adherencia de las bacterias y afecta al epitelio respiratorio67,68. Además, en algunos estudios, los fumadores tienen un nivel de inmunoglobulinas séricas un 10-20% más bajo69. Los fumadores, por el contrario, parece que tienen niveles aumentados de anticuerpos antineumocócicos, probablemente por un incremento de la frecuencia de infecciones respiratorias70. Algunos autores describen mayor frecuencia de colonizaciones nasofaríngeas por neumococo en fumadores, tanto activos como pasivos. También se describe un mayor porcentaje de portadores de neumococos entre fumadores. Los fumadores, como ya se ha comentado, son más susceptibles a infecciones virales de vías respiratorias, y un antecedente de infección respiratoria frecuente o actual aumenta el riesgo de ENI71. Nuorti et al. realizaron un estudio donde analizaron a todos los sujetos inmunocompetentes que habían padecido ENI en diferentes ciudades de EE. UU. y Canadá. La ENI se asoció significativamente con el consumo de tabaco (OR 4,1; IC 95% 2,4-7,3) y un riesgo atribuible del 51%, siendo la asociación más fuerte de un factor de riesgo independiente71. Además, se encontró una relación dosis/respuesta positiva, no solo con la carga de tabaquismo medida en paquetes/año, sino también con el tiempo transcurrido desde el cese14.
En el estudio de Almirall et al., sobre una población de más de 850.000 personas mayores de 14 años, atendidas en 64 centros de Atención Primaria de Cataluña, encontraron que el tabaquismo era un importante factor de riesgo para la NAC (OR 1,34; IC 95% 1,11-1,62), siendo más elevado cuanto mayor es el consumo (OR 2,13; IC 95% 1,56-2,91). Exfumadores que habían dejado de fumar hacía más de 4 años tenían un riesgo inferior que aquellos que lo habían dejado hacía menos de un año (OR 0,39; IC 95% 0,17-0,89). Este estudio es uno de los primeros que apunta cierta relación del tabaquismo pasivo con la NAC, aunque no de manera significativa72. En otro estudio se detectó que el tabaquismo era uno de los principales factores de riesgo, independiente del shock séptico, como complicación de la neumonía neumocócica73.
En el documento Prevención del tabaquismo, publicado por el grupo de estudio de tabaquismo de la Sociedad Española de Neumología y Cirugía Torácica, se describe que el mayor riesgo de ENI y el mayor beneficio de su prevención se encuentra en el grupo de fumadores activos con una carga de 15 o más paquetes/año sin comorbilidad, grupo de exfumadores con una carga de al menos 20 paquetes/año y que llevan menos de 10 años sin fumar, y cualquier fumador, independientemente de su edad, e intensidad y/o carga, que padece enfermedad respiratoria crónica74.
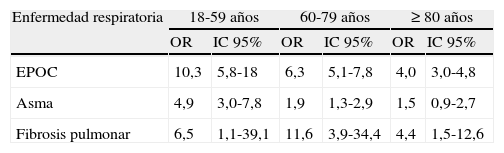
Otras enfermedades respiratorias crónicasHay pocas publicaciones en las que se haga referencia a una enfermedad respiratoria crónica poco frecuente, como puede ser la fibrosis pulmonar idiopática. Sin embargo, un estudio sueco caso-control75, donde se analizaron 4.058 casos de ENI y 40.353 controles, encontró un aumento de 4 veces en la probabilidad de padecer ENI en EPOC, el doble de riesgo en el asma y 5 veces más riesgo en los sujetos que tenían fibrosis pulmonar idiopática (tabla 4). Otras enfermedades, como la sarcoidosis y las bronquiectasias, se asociaron a un incremento de 2 a 7 veces en la probabilidad de padecer una ENI, y no encontraron relación en los sujetos con alveolitis alérgica extrínseca o neumoconiosis.
Riesgo de enfermedad neumocócica invasiva por grupos de edad según enfermedad respiratoria
| Enfermedad respiratoria | 18-59 años | 60-79 años | ≥80 años | |||
| OR | IC 95% | OR | IC 95% | OR | IC 95% | |
| EPOC | 10,3 | 5,8-18 | 6,3 | 5,1-7,8 | 4,0 | 3,0-4,8 |
| Asma | 4,9 | 3,0-7,8 | 1,9 | 1,3-2,9 | 1,5 | 0,9-2,7 |
| Fibrosis pulmonar | 6,5 | 1,1-39,1 | 11,6 | 3,9-34,4 | 4,4 | 1,5-12,6 |
EPOC: enfermedad pulmonar obstructiva crónica; IC: intervalo de confianza; OR: odds ratio.
Adaptada de Inghammar et al.75.
Las enfermedades ocupacionales respiratorias, como las neumoconiosis, pueden representar una situación de vulnerabilidad del aparato respiratorio ante las infecciones. En su publicación de 2004, la Sociedad Torácica Americana76 recomendaba, tras realizar el diagnóstico de asbestosis y como prevención terciaria en su seguimiento, la inmunización frente a gripe y neumonía neumocócica. Posteriormente, en un estudio realizado en una cohorte de 590 extrabajadores expuestos a amianto, que habían sido sometidos a cribado de cáncer de pulmón mediante tomografía computarizada de tórax y en los que se había encontrado algún grado de fibrosis pleural o pulmonar, Vehmas et al. encontraron una mortalidad debida a neumonía 2,26 y 3,70 veces mayor, respectivamente, que en los que no tenían fibrosis77.
Las enfermedades neumocócicas son poco frecuentes en la fibrosis quística. En la actualidad no hay ensayos clínicos con vacuna antineumocócica en pacientes con fibrosis quística, por lo que no se puede establecer ninguna conclusión sobre la eficacia de la inmunización neumocócica sistemática en estos pacientes para reducir la morbimortalidad. No obstante, la inmunización neumocócica puede ofrecer alguna protección contra las exacerbaciones pulmonares causadas por el neumococo, y es por ello por lo que en EE. UU. y el Reino Unido se recomienda la vacunación antineumocócica para todos los niños y adultos con fibrosis quística78.
Las exacerbaciones respiratorias en pacientes con bronquiectasias se asocian con una menor calidad de vida, un deterioro más rápido de la función pulmonar, ingresos hospitalarios y una mayor mortalidad. Un estudio abierto, controlado y aleatorizado, realizado en 167 adultos con enfermedad pulmonar crónica (bronquiectasias y otras enfermedades asociadas con estas), comparó la vacuna contra la influenza y la VPN23, con la vacuna contra la influenza sola (grupo de control). El estudio encontró una reducción significativa de las exacerbaciones respiratorias infecciosas agudas en el grupo de la VPN23, comparado con el grupo de control (OR 0,48; IC 95% 0,26-0,88); el número necesario a tratar para lograr un beneficio durante más de 2 años fue de 6 (IC 95% 4-32). Sin embargo, no hubo ninguna diferencia en los episodios de neumonía entre grupos, y no había datos sobre el deterioro pulmonar79. Las pruebas actuales, aunque limitadas, apoyan el uso de la VNP23 en adultos con bronquiectasias, pero se necesitan más ensayos controlados que analicen su eficacia y la de VNC13 en diferentes grupos etarios. No existen datos sobre la eficacia de la vacuna antineumocócica sobre el deterioro funcional pulmonar. Se recomienda que los profesionales de la salud sigan las recomendaciones de cada país80.
- 1.
La incidencia de la NAC aumenta con la edad y las comorbilidades. El neumococo es el microorganismo más frecuentemente implicado en la NAC en los adultos.
- 2.
La ENI es una importante causa de morbimortalidad en el mundo. Determinadas condiciones y enfermedades concomitantes subyacentes aumentan el riesgo de ENI y de sus complicaciones, destacando, desde el punto de vista neumológico, el tabaquismo y las enfermedades respiratorias crónicas.
- 3.
La enfermedad neumocócica, según la OMS, es la primera causa de muerte prevenible en el mundo en niños y adultos. Entre las estrategias para prevenir la ENI se encuentra la vacunación, y la OMS considera esencial y prioritaria la introducción e implementación de la vacunación frente al neumococo de forma universal, en todos los países.
- 4.
La prevención de la infección neumocócica mediante vacunación puede contribuir a la disminución de las resistencias del neumococo a los antibióticos.
- 5.
Actualmente disponemos de 2 vacunas antineumocócicas para el adulto: la VNP23 y la VNC13.
- 6.
VNP23 se emplea en mayores de 2 años de edad y es la que mayor número de serotipos incluye (23), pero no genera memoria inmunitaria, los niveles de anticuerpos disminuyen con el tiempo, no actúa sobre la colonización nasofaríngea y no ha mostrado efectividad vacunal en estos grupos de riesgo, a pesar de coberturas vacunales del 75%.
- 7.
VNC13 genera memoria inmunológica, produce una respuesta de anticuerpos IgA en las mucosas que reduce la colonización nasofaríngea por los serotipos presentes en la vacuna, y genera una inmunidad de grupo, que dificulta la adquisición de nuevos portadores y de futuros enfermos.
- 8.
La administración de VNC13 puede realizarse a partir de las 6 semanas de vida, es segura y no comporta mayores inconvenientes que la reacción local, o raramente síntomas generales. VNC13 genera una respuesta inmunitaria más potente que VNP23 frente a la mayoría de los 13 serotipos en ella incluidos.
- 9.
En adultos inmunocompetentes, se precisa una sola dosis de VNC13, independientemente de las comorbilidades, sin ser necesaria la revacunación en la actualidad.
- 10.
Aunque son necesarios más estudios sobre el efecto protector para la infección neumocócica en los adultos con enfermedades respiratorias crónicas con riesgo de ENI, es predecible un claro beneficio de la VNC13.
Durante los años 2012 y 2013, varias comunidades autónomas y diferentes sociedades científicas publicaron la actualización de sus recomendaciones sobre la vacunación antineumocócica en el adulto por indicaciones médicas, o pertenecientes a grupos de riesgo14,24,34,38,41,74.
Las recomendaciones para la vacunación antineumocócica realizadas por las sociedades científicas firmantes aquí representadas se centran en el adulto inmunocompetente con enfermedad respiratoria crónica y en fumadores con riesgo para padecer ENI:
- 1.
Sujetos de cualquier edad con EPOC, asma grave (una o más hospitalizaciones, visitas a Urgencias, o uso de corticoides orales), fibrosis pulmonar idiopática, neumoconiosis, fibrosis quística, bronquiectasias y fumadores con enfermedades respiratorias, independientemente de su carga de consumo.
- 2.
Fumadores mayores de 50 años sin comorbilidades y que tienen una carga de consumo de al menos 15 paquetes/año, y exfumadores con una carga de al menos 20 paquetes/año y que llevan menos de 10 años sin fumar.
- 3.
Los adultos inmunocompetentes no vacunados previamente con vacuna antineumocócica deben vacunarse frente a neumococo con VNC13.
- 4.
Los adultos vacunados previamente con VNP23 (≥1 año) deben recibir una dosis de VNC13.
- 5.
En adultos inmunocompetentes, se precisa una sola dosis de VNC13, independientemente de las comorbilidades, sin ser necesaria en la actualidad una dosis de recuerdo.
Para estas recomendaciones no existe en la actualidad financiación pública, por lo que habrán de ser prescritas indicando a los usuarios que deberán abonarlas íntegramente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este documento está avalado por las 4 sociedades científicas indicadas. El artículo ha sido publicado previamente en Rev Esp Patol Torac 2014; 26 (2) Suplemento 1: 1-20.