Estas recomendaciones de práctica clínica se han realizado tras una revisión sistemática de las diferentes guías mundiales y nacionales sobre hipertrofia benigna de próstata (HBP), la revisión de artículos de metaanálisis y la revisión de Cochrane, Pubmed, Medline y www.uroportal.net. Se ha tenido en consideración la opinión de otros médicos de familia y de los pacientes.
Para la evaluación de la evidencia y el grado de recomendación de las diferentes pruebas diagnósticas y terapéuticas hemos utilizado la clasificación de la Agency of Healthcare Research and Quality, utilizada por la Asociación Europea de Urología:
Clasificación de las recomendaciones en función del nivel de evidencia disponible:
Ia.La evidencia científica procede de metaanálisis de ensayos clínicos controlados y aleatorizados.
Ib.La evidencia científica procede de al menos un ensayo clínico controlado y aleatorizado.
IIa.La evidencia científica procede de al menos un estudio prospectivo controlado, bien diseñado y sin aleatorizar.
IIb.La evidencia científica procede de al menos un estudio casi experimental, bien diseñado.
III.La evidencia científica procede de estudios descriptivos no experimentales, bien diseñados como estudios comparativos, de correlación o de casos y controles.
IV.La evidencia científica procede de documentos u opiniones de expertos y/o experiencias clínicas de autoridades de prestigio.
Grados de recomendación:
A.Existe buena evidencia en base a la investigación para apoyar la recomendación.
B.Existe moderada evidencia en base a la investigación para apoyar la recomendación.
C.La recomendación se basa en la opinión de expertos o en un panel de consenso.
X.Existe evidencia de riesgo para esta intervención.
El principal objetivo de estas recomendaciones de práctica clínica en la HBP es proporcionar los conocimientos basados en la evidencia clínica sobre el manejo diagnóstico y terapéutico de la HBP.
Están dirigidas a todo el colectivo de médicos que desarrollan su labor asistencial en el ámbito de la Atención Primaria (AP).
Debe incluirse a todos los varones mayores de 50 años con síntomas de tracto urinario inferior (STUI) sugestivos de HBP.
Excluiremos a los varones que presenten alguna de estas situaciones:
1.Ser menor de 50 años.
2.Tener antecedentes de neoplasia prostática.
3.Haber empleado tratamientos invasivos previos para la obstrucción del flujo urinario.
4.Tener diabetes mellitus mal controlada y/o neuropatía diabética.
5.Sufrir alteraciones neurológicas.
6.Haberse sometido a cirugía pélvica o traumatismo pélvico.
7.Sufrir enfermedades de transmisión sexual.
8.Haberse sometido a tratamiento previo con fitoterápicos, bloqueantes alfa o inhibidores de la 5α reductasa.
INTRODUCCIÓN Y DEFINICIÓN
La HBP es una patología que se caracteriza por un crecimiento histológico de la glándula prostática produciendo una obstrucción al flujo de salida urinario que se manifiesta clínicamente por unos síntomas definidos como STUI1.
Constituye una de las patologías más frecuentes del varón de 50 o más años de edad. A partir de la sexta década de la vida repercute muy negativamente en la calidad de vida (CV) y consume una parte significativa de los recursos sanitarios disponibles. Más de un tercio de los pacientes que consultan al urólogo por este proceso reciben tratamiento médico y el 38% necesitará algún tipo de procedimiento invasivo. La HBP es un problema sanitario en los países desarrollados, si se incluye bajo este epígrafe de acuerdo con Baena González et al2 a cualquier proceso patológico de alta incidencia, carga económica y severa repercusión en la CV del enfermo.
Es la primera causa de consulta ambulatoria al especialista3. La edad es el factor que más influencia tiene en su aparición y desarrollo, ya que esta tendencia es creciente por el envejecimiento de la población. Con estas premisas, el conocimiento de su coste y su posible evolución adquiere un interés evidente a todos los efectos4.
EPIDEMIOLOGÍA
Es el tumor benigno más frecuente en los varones mayores de 50 años5 y representa la segunda causa de intervención quirúrgica. Se sabe muy poco de la evolución y la historia natural de la HBP.
El crecimiento histológico no siempre se encuentra asociado a sintomatología prostática, ya que se conoce que un 40% de las HBP histológicas tienen sintomatología que afecta negativamente a la CV en la mitad de los pacientes.
Según el estudio realizado por Chicharro y Burgos5 en Andalucía, publicado en 1998, la prevalencia de la HBP es del 11,8% del total de la población masculina mayor de 40 años, oscilando desde el 0,75% en la población masculina de 40 a 49 años hasta el 30% en los mayores de 70 años. Esta prevalencia se obtiene definiendo la HBP como tamaño prostático mayor de 30 g, flujo máximo (Qmáx) menor de 15 ml/s y puntuación en la escala internacional de los síntomas prostáticos (IPSS) mayor a 7.
La prevalencia histológica de la HBP depende de la edad. El desarrollo inicial generalmente comienza por encima de los 40 años y llega al 50% a los 60 años, alcanzando una prevalencia del 90% a los 85 años de vida. En España, con una población de varones que supera los 19 millones (6,1 millones con más de 50 años y 2 millones con más de 70 años), la HBP supone un problema de salud pública de primera magnitud6.
Es la patología urológica más frecuente en el hombre y su prevalencia varía según la edad, siendo excepcional que se presente por debajo de los 40 años7.
La HBP y los STUI derivados de la misma son la primera causa de consulta por el urólogo.
La HBP supone un problema de salud pública de primera magnitud debido al progresivo envejecimiento de la población.
ETIOPATOGENIA
Anatomía y fisiología de la próstata
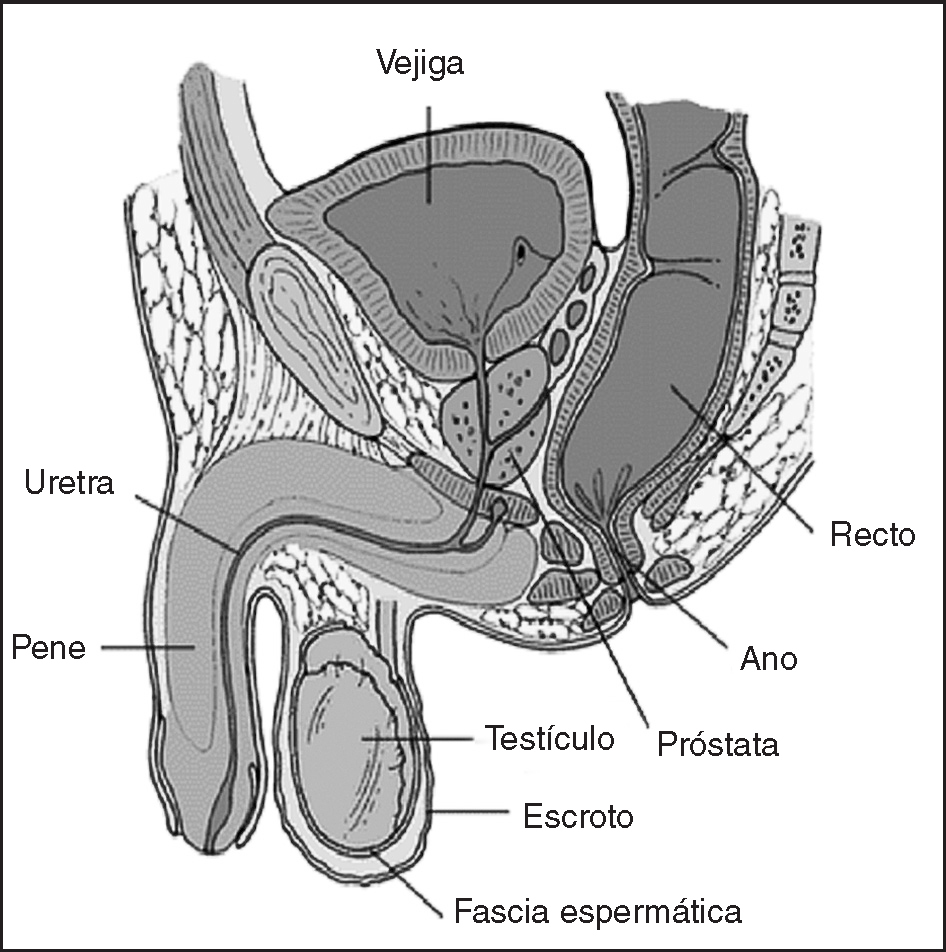
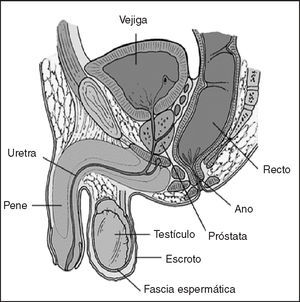
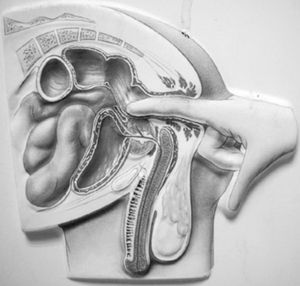
La próstata es una glándula sexual masculina que participa junto a las vesículas seminales y las glándulas periuretrales en la producción del líquido seminal. Consta de un componente glandular y otro muscular; está localizada en la cavidad pélvica, por delante del recto, debajo del cuello vesical, donde rodea el primer segmento de la uretra; en ella drenan las vesículas seminales por medio de los conductos deferentes y tiene relaciones anatómicas importantes con otros órganos pélvicos (fig. 1).
Figura 1. Relaciones anatómicas de la próstata.
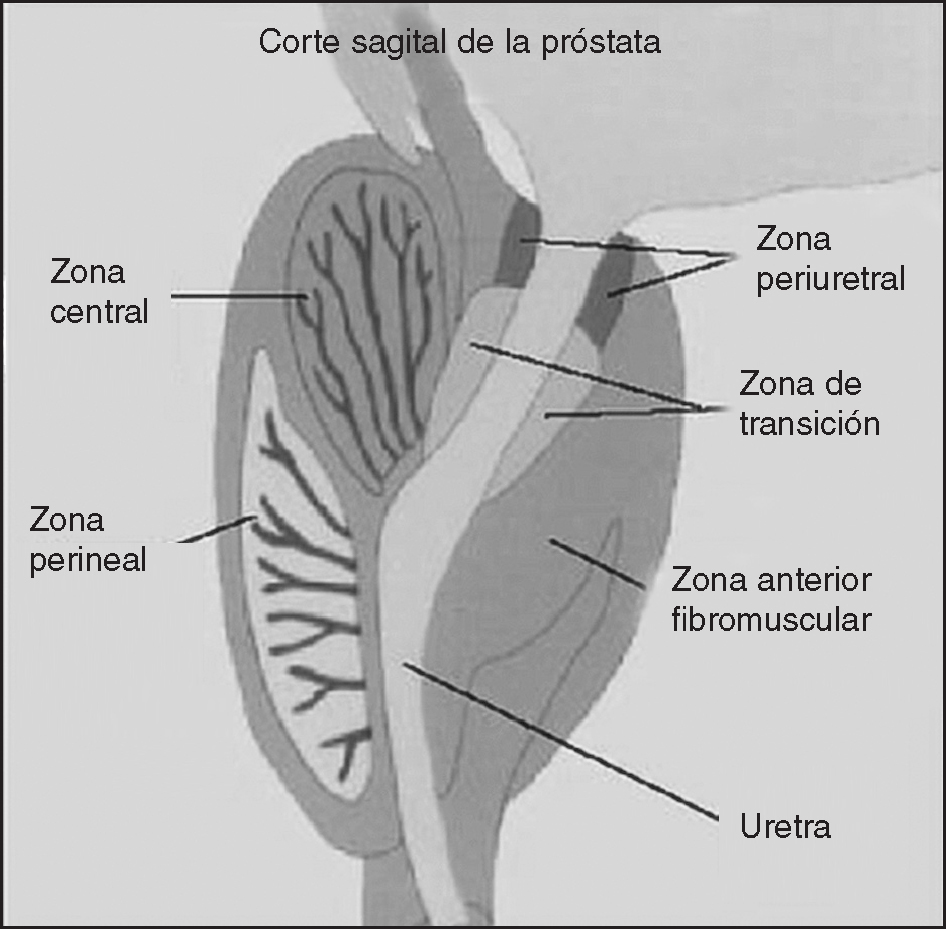
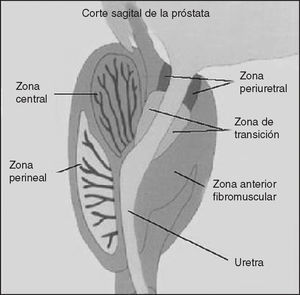
Anatómicamente se acepta la descripción de McNeal8, quien divide a la próstata en 4 zonas (fig. 2):
Figura 2. Anatomía de la próstata.
1. Anterior. No participa de la patología de la próstata. Es de naturaleza fibromuscular y no contiene glándulas.
2. Periférica o perineal. Su origen embriológico es endodérmico. Es una zona con un gran componente glandular y poco estromal. Forma el 70% de la glándula prostática y sus glándulas drenan por debajo del utrículo prostático y de los conductos eyaculadores. Suele ser la zona más afectada por la prostatitis y el adenocarcinoma de próstata (70-80%).
3. Transicional y periuretral. Su origen embriológico es mesodérmico, representa el 5% de la próstata y se sitúa rodeando a la uretra prostática. Es la zona de más afectación por HBP.
4. Central. Representa el 25% de la próstata y se ve afectada por un 10% de los adenocarcinomas de próstata.
Es usual que a partir de los 30-40 años de edad comiencen a aparecer focos de hiperplasia en el tejido glandular y fibromuscular, de preferencia en la zona periuretral y transicional. Tales focos son los responsables de la obstrucción al flujo urinario, en especial cuando se desarrollan en el espesor del lóbulo medio de la glándula8.
La porción posterior de la próstata descansa sobre el recto y es posible palparla mediante tacto rectal (TR), más aún si se encuentra aumentada de tamaño9.
Etiología
1. La edad superior a 50 años es uno de los principales factores de riesgo.
2. Se ha comprobado que se requieren testes funcionantes con producción de andrógenos (testosterona) por las células de Leydig y la existencia en la célula prostática de 5α reductasa, que es la enzima que transforma la testosterona en dihidrotestosterona (DHT), un metabolito activo.
Ambas condiciones son necesarias pero no suficientes, ya que existen otros factores implicados en su génesis, como son7:
1. Factores genéticos. Aparece más frecuentemente en familiares de primer grado.
2. Factores dietéticos. El consumo de vegetales ricos en carotenos y fitoestrógenos produce una acción protectora.
3. Raza. Es más frecuente en negros que en blancos americanos.
4. Hiperinsulinismo. Se ha relacionado con la presencia de síndrome metabólico10.
5. Se han encontrado factores de crecimiento epidérmico y fibroblastos implicados11,12.
Aspectos fisiopatológicos
Cada vez se acepta más que la sintomatología de la HBP se produce por el aumento del tono del componente muscular de la glándula y por diversas alteraciones del funcionamiento del músculo detrusor de la vejiga13.
En su génesis hay tres factores responsables: uno estático, otro dinámico y las mencionadas alteraciones del funcionamiento de la vejiga. El primero de ellos, el componente estático, también denominado mecánico, se refiere a la hipertrofia de los nódulos de tejido glandular en la zona de transición, que conduce a estrechamiento de la luz uretral. El componente dinámico se refiere al aumento del tono del músculo liso, tanto de la cápsula de la glándula como en el cuello vesical.
Por último, un hallazgo común en individuos con HBP que presentan obstrucción del flujo urinario es la presencia concomitante hasta en uno de cada cuatro pacientes, de alteraciones de contractilidad de la vejiga así como de inestabilidad del músculo detrusor. Este último factor reviste particular importancia entre los ancianos, en quienes se suma la reducción progresiva de la capacidad vesical, empeorando los síntomas relacionados con la obstrucción al flujo urinario13.
EVOLUCION NATURAL DE LA ENFERMEDAD
La HBP involucra tanto el componente glandular como el estromal y genera síntomas en grado variable. Uno de cada cuatro hombres de 55 años nota disminución del chorro urinario, proporción que aumenta a uno de cada dos después de los 75 años de edad. Esta alta incidencia y creciente prevalencia de síntomas obstructivos permite inferir que todo hombre de 40 a 50 años de edad tiene una probabilidad del 20 al 30%, a lo largo de su vida, de requerir prostatectomía para el tratamiento de sus STUI14.
No existe una relación lineal entre la presencia de crecimiento histológico de la próstata y la aparición de síntomas15; más del 40% de los individuos mayores de 70 años y el 80% de quienes superan los 80 años presentan STUI. Más del 10% de los pacientes con HBP, en particular los más ancianos, sufrirán grados variables de retención urinaria.
DIAGNÓSTICO
Como se ha comentado anteriormente, la HBP es una de las enfermedades más frecuentes en varones a partir de los 50 años, aumentando progresivamente con la edad.
El diagnóstico precoz es importante para modificar la progresión de la enfermedad y evitar las complicaciones.
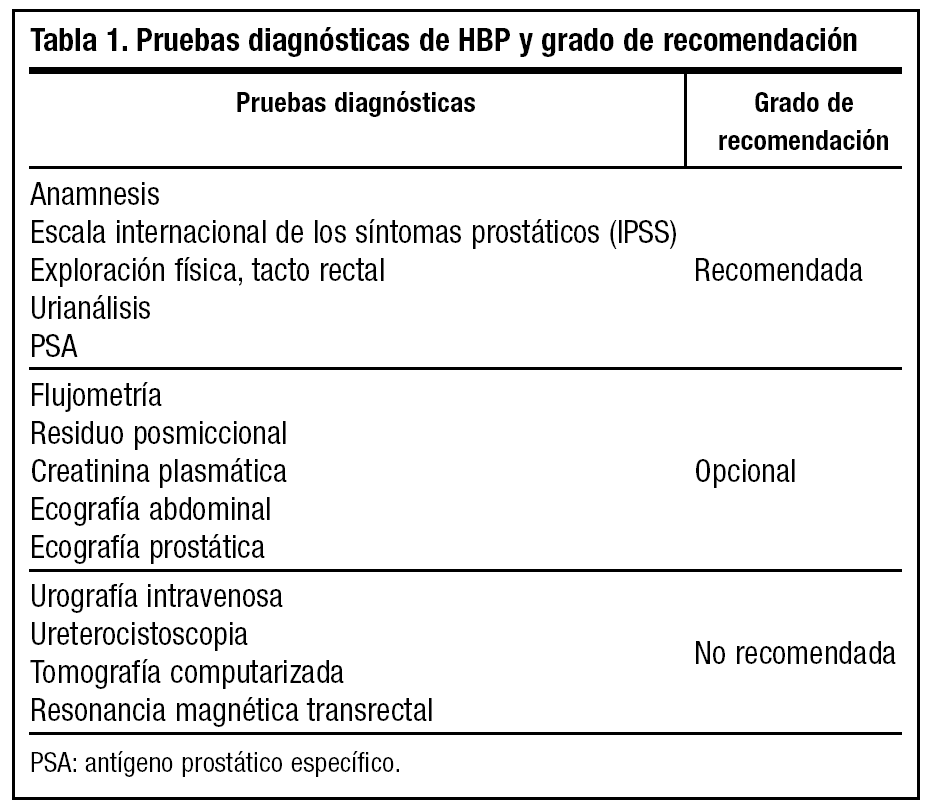
Según la importancia en la realización de las diferentes pruebas, las clasificamos en:
1. Recomendadas. Las pruebas diagnósticas deberían ser utilizadas en todos los hombres que presenten STUI.
2. Opcionales. Las pruebas diagnósticas se utilizarán según el paciente, en base al juicio del profesional.
3. No recomendadas. Son aquellas pruebas diagnósticas en las cuales no existe evidencia de que su uso rutinario sea beneficioso; únicamente se utilizarán en circunstancias especiales o ensayos clínicos.
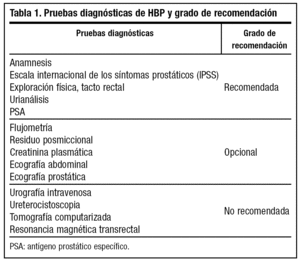
De este modo, analizando diversos estudios y diferentes guías sobre HBP publicadas recientemente, las recomendaciones para el diagnóstico de HBP se muestran en la tabla 116,17.
Anamnesis (nivel de evidencia IV, grado de recomendación C)
Deberemos realizar una anamnesis detallada que incluya:
1. Antecedentes familiares de patología prostática.
2. Antecedentes personales:
a) Enfermedades neurológicas: neuropatía periférica (diabetes), enfermedad de Parkinson, esclerosis múltiple, accidente vásculo-cerebral, lesiones medulares, etc.
b) Intervenciones quirúrgicas pélvicas e instrumentaciones uretrales.
3. Fármacos: diuréticos (aumento de la frecuencia miccional), antagonistas del calcio (disminución de la contractibilidad vesical), antidepresivos tricíclicos (aumento del tono prostático), antihistamínicos de 1.a generación (disminución de la contractibilidad vesical), etc.
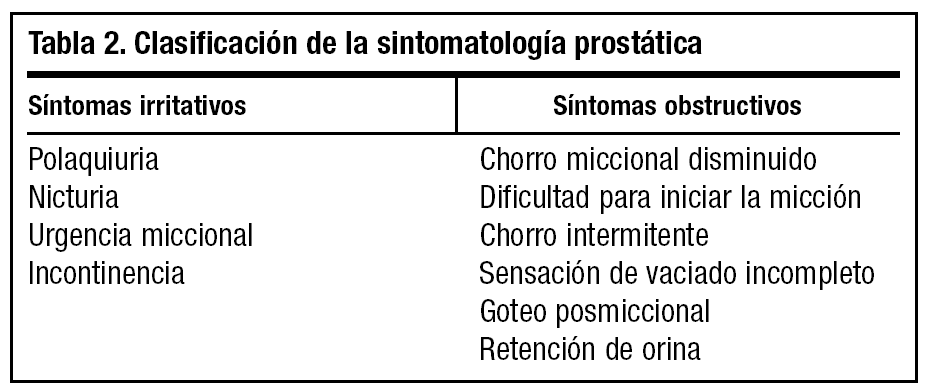
4. Sintomatología de la HBP. Está dividida en dos grandes grupos, obstructiva e irritativa, como se muestra en la tabla 2.
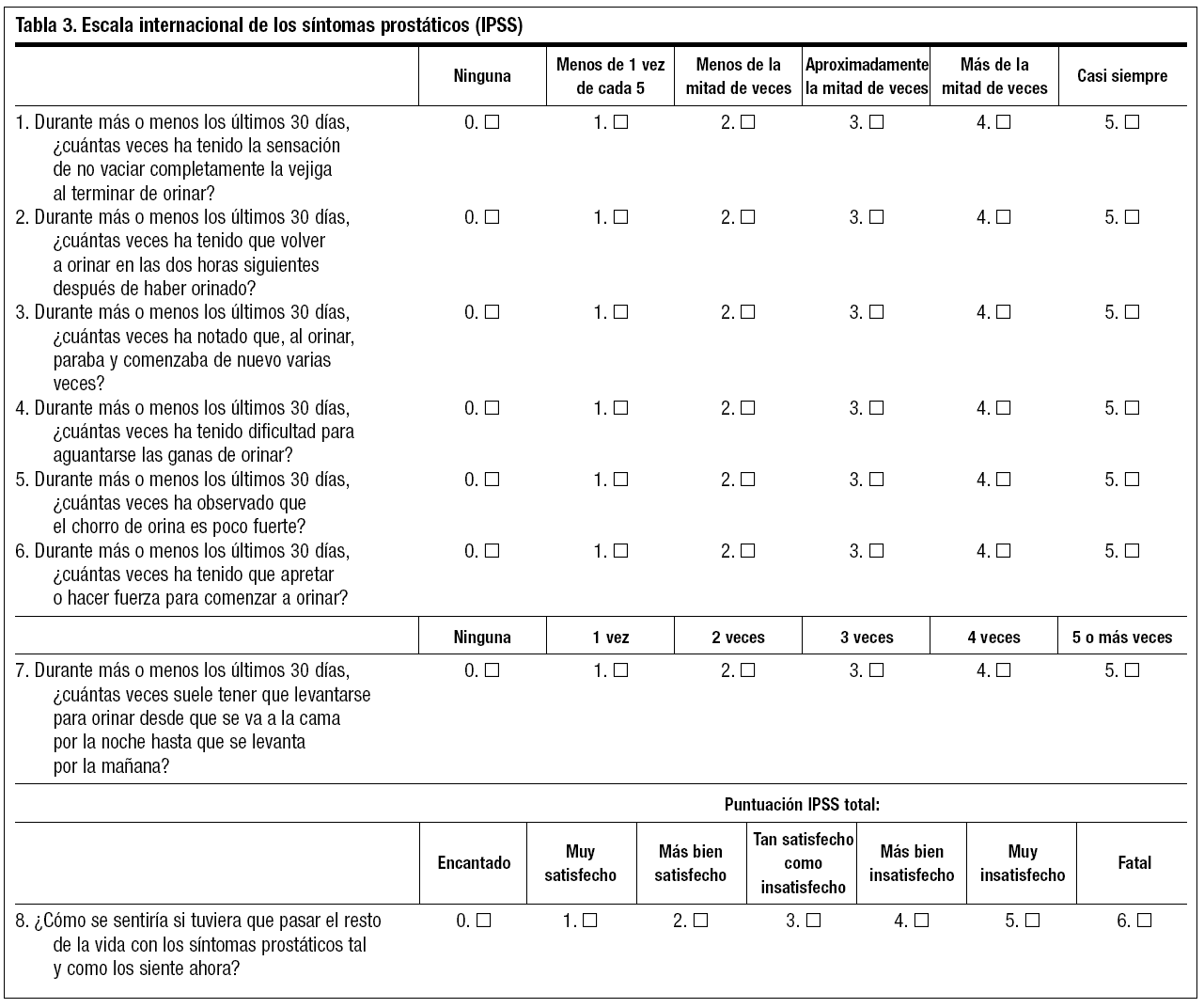
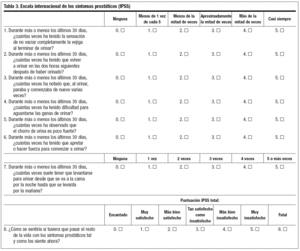
Escala internacional de los síntomas prostáticos (nivel de evidencia III, grado de recomendación B)
Clasifica los síntomas prostáticos según la severidad (tabla 3)18-20:
Leve: 0-7 puntos.
Moderada: 8-19 puntos.
Severa: 20-35 puntos.
Exploración física (nivel de evidencia III, grado de recomendación B)
Exploración abdominal
Descartar masas abdominales y globo vesical (IV, C).
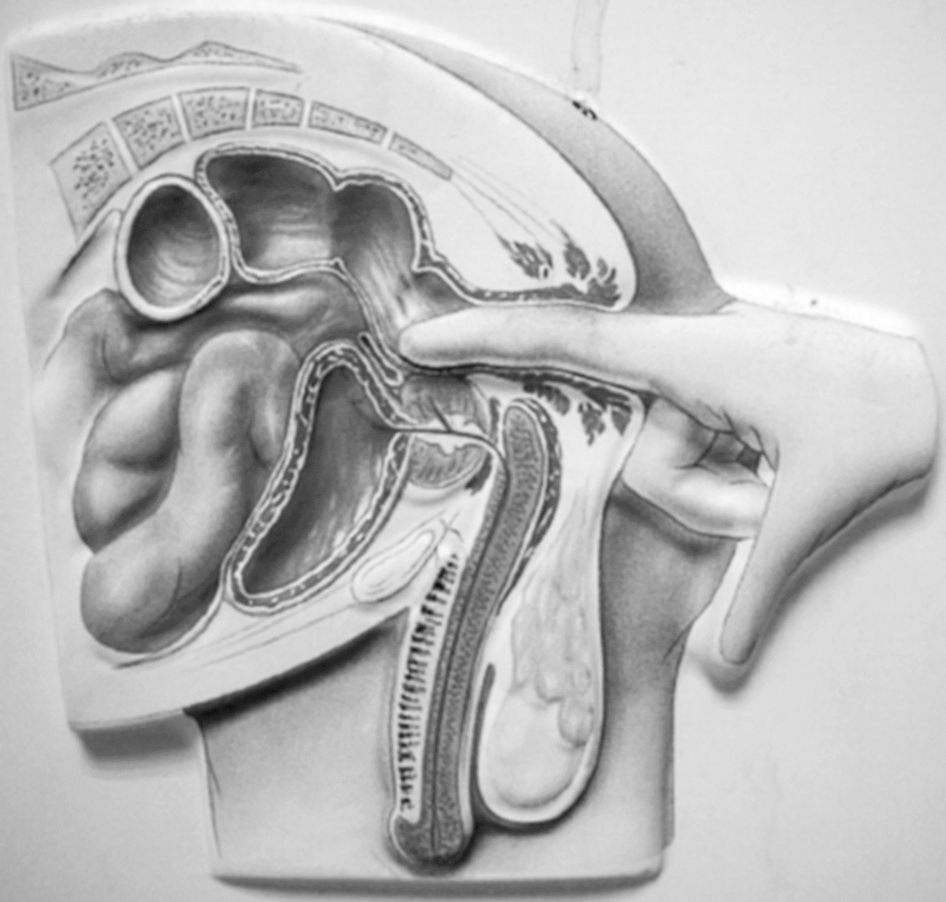
Tacto rectal (III, B) (fig. 3)
Figura 3. Tacto rectal (cortesía de Dr. J Castiñeiras, presidente de la Asociación Española de Urología).
Obtendremos información acerca de la morfología, el tamaño, la consistencia, la movilidad, la regularidad de sus límites, la presencia de nódulos y la sensibilidad de la próstata. Según el tamaño se clasifica en21:
1. Pequeña o normal (volumen I): 40 g.
2. Mediana (volumen II): 40-60 g.
3. Grande (volumen III): > 60 g.
En la HBP, la próstata se encuentra aumentada de tamaño, presenta una forma uniforme, una consistencia firme y elástica y no es dolorosa. El objetivo de la realización del TR es descartar la presencia de otras patologías como el cáncer de próstata, donde ésta presenta una consistencia pétrea y nodular; la prostatitis, donde el tacto resulta doloroso y la próstata está caliente; y otras enfermedades pélvicas.
Sin embargo, según un estudio realizado por Catalona et al, el valor predictivo positivo del TR es bajo para el cáncer de próstata, ya que sobre un 20% de los tactos sospechosos se corresponden con una biopsia positiva para cáncer22.
Exploración neurológica (IV, C)
Se debe valorar la sensibilidad de la zona perineal, los reflejos bulbocavernoso y anal superficial y el tono del esfínter rectal, indicador indirecto de integridad neurológica pélvica.
Urianálisis (nivel de evidencia IV, grado de recomendación C)
Se recomienda su realización23 como estudio inicial para descartar la presencia de infección, hematuria y/o proteinuria, y es de gran utilidad en el diagnóstico diferencial y en la búsqueda de complicaciones.
PSA (nivel de evidencia III, grado de recomendación B)
En combinación con el TR, aumenta la detección del cáncer de próstata y es superior al TR sólo para el diagnóstico de carcinoma prostático16.
Existe una gran controversia en cuanto a su realización de forma rutinaria en el paciente con STUI y HBP24: la Asociación Americana de Urología no recomienda su uso rutinario, mientras que la Organización Mundial de la Salud sí lo recomienda1.
No solicitaremos PSA si la expectativa de vida del paciente es inferior a 10 años16.
Existen múltiples estudios que establecen la relación positiva y estadísticamente significativa entre el PSA y el volumen prostático, remarcando la importancia en la evaluación de este parámetro como eficaz marcador de crecimiento prostático25-27.
Así pues, valores superiores a 1,4 ng/ml orientan a patología prostática y, a la vez, su determinación nos ayuda a evaluar la progresión de la HBP.
Varones con próstatas pequeñas (< 30 g) y valores de PSA < 1,4 ng/ml presentan un riesgo menor de progresión de la enfermedad28.
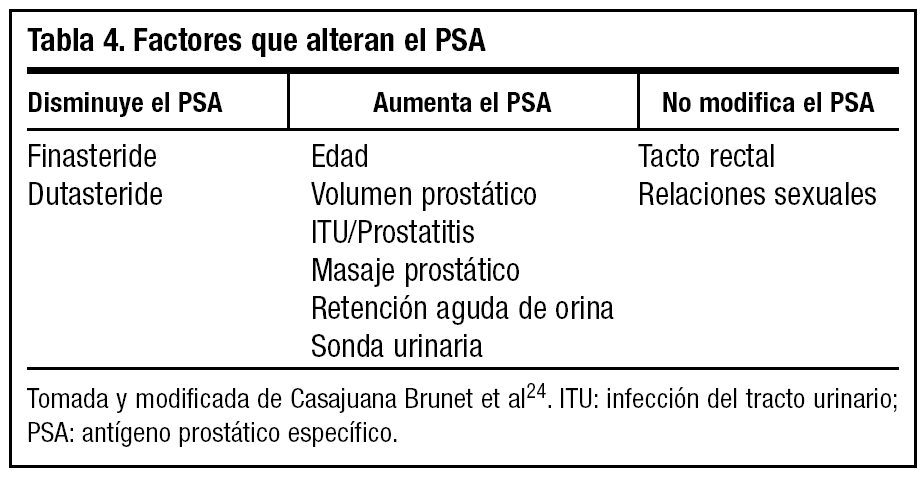
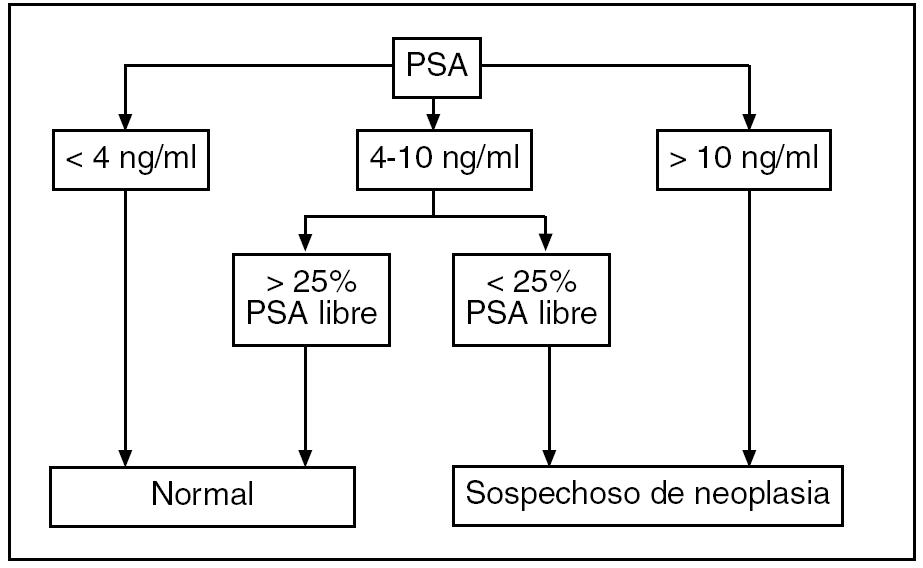
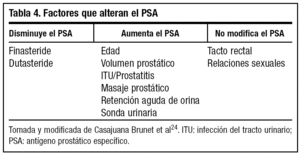
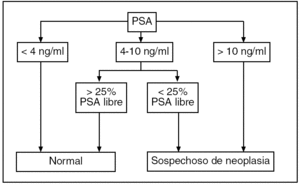
Por otro lado, debemos tener en cuenta que existen otros factores que alteran el PSA24, como se muestra en la tabla 4. Si las cifras de PSA se encuentran entre 4-10 ng/ml, se debe evaluar el valor de PSA libre (fig. 4).
Figura 4. Interpretación de los valores de PSA. Fuente: Catalona et al22. PSA: antígeno prostático específico.
El valor del PSA también se ve modificado por la edad del siguiente modo20.
1. 40-49 años: 2,5 ng/ml.
2. 50-59 años: 3,5 ng/ml.
3. 60-69 años: 4,5 ng/ml.
4. 70-79 años: 6,5 ng/m.
La combinación de la historia clínica, la IPSS, el TR y el PSA es la estrategia diagnóstica más sensible y con mayor valor predictivo positivo29. Nivel de evidencia IIa, grado de recomendación B.
Flujometria (nivel de evidencia III, grado de recomendación B)
Es una prueba simple, no invasiva, que puede poner de manifiesto un anormal vaciamiento de la vejiga, pero no está al alcance del médico de AP. Se utiliza en Atención Especializada para valorar la severidad de la obstrucción y la respuesta al tratamiento.
Se valoran diversos parámetros, entre ellos el Qmáx, que se considera normal si es superior a 15 ml/s16. Un flujo lento indica una obstrucción en el tracto de salida en el 90% de los casos.
Residuo posmiccional (nivel de evidencia III, grado de recomendación B)
Se evalúa mediante ecografía abdominal o sondaje vesical16. Si el volumen posmiccional es > 100-200 ml se constata disfunción vesical y elevada probabilidad de retención aguda de orina (RAO) y predice una menor respuesta al tratamiento, por lo que debe plantearse la cirugía.
Niveles permanentemente elevados de residuo posmiccional requieren la realización de pruebas de imagen del tracto urinario superior para descartar fallo renal y por otro lado también pueden indicar baja actividad del detrusor, por lo que se deberían valorar estudios urodinámicos.
Creatinina plasmática (nivel de evidencia IV, grado de recomendación C)
El reciente estudio MTOPS30 ha mostrado que el riesgo de desarrollar fracaso renal en varones con STUI es < 1%, lo que sugiere que no es necesario un control periódico de creatinina en su seguimiento. Por tanto realizaremos determinación de niveles plasmáticos si existe:
1. Insuficiencia renal preexistente.
2. Sospecha de RAO.
3. Volumen residual > 100 ml.
Ecografía transrectal y abdominal (nivel de evidencia III, grado de recomendación B)
Se recomienda la ecografía transrectal para determinar el volumen prostático y valorar la próstata cuando el TR es patológico: presencia de nódulos, próstata muy agrandada, consistencia pétrea; en caso de PSA > 10 ng/ml o PSA > 4 ng/ml y PSA libre < 0,20.
Se recomienda ecografía abdominal para valorar complicaciones en caso de: litiasis, hematuria, insuficiencia renal o infección urinaria16. También se recomienda en caso de clínica sugestiva de obstrucción uretral que pueda ocasionar aumento del residuo miccional. Valores > 150 ml se consideran indicativos de obstrucción.
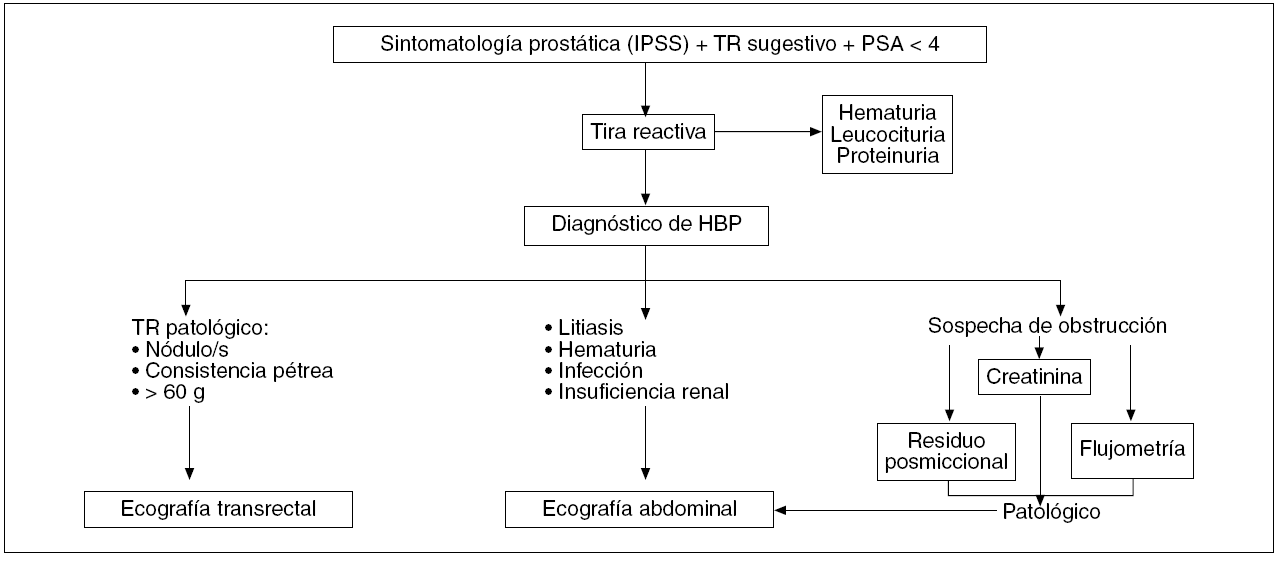
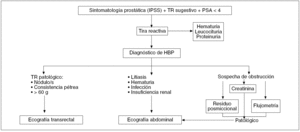
En la figura 5 se resumen los pasos que se deben seguir ante la sospecha HBP.
Figura 5. Algoritmo diagnóstico de hiperplasia benigna de próstata (HBP).TR: tacto rectal; PSA: antígeno prostático específico.
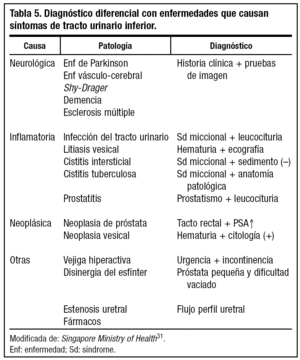
DIAGNOSTICO DIFERENCIAL
Deberemos realizar diagnóstico diferencial con enfermedades que causen STUI, según se muestra en la tabla 531.
Las más frecuentes son las inflamatorias y las neoplásicas, mientras que en menor frecuencia se presentan aquellas patologías que causan alteración en el mecanismo o patrón de la micción y los fármacos anteriormente comentados32.
TRATAMIENTO DE LA HIPERPLASIA BENIGNA DE PROSTATA
Más de la mitad de los pacientes con HBP pueden ser controlados únicamente por el médico de AP23. Antes de iniciar su tratamiento, debemos evaluar la magnitud de los síntomas y su CV. Es muy importante que no valoremos la HBP aisladamente. Comprobaremos la presencia de otras patologías asociadas y su morbilidad antes de adoptar una decisión terapéutica, en la que también, como es lógico, debe intervenir el paciente tras ser correctamente informado32,33.
1. En pacientes con sintomatología leve-moderada y buena CV pautaremos: espera vigilada.
Consiste en aconsejar16,32-34 medidas higiénicas dietéticas: evitar el consumo de picantes, disminuir la ingesta de líquidos por la noche, abstinencia de alcohol y café y orinar cada 2-3 horas y antes de acostarse.
En pacientes con síntomas leves existe una recomendación absoluta sobre su eficacia (1aA).
En aquellos pacientes con clínica moderada y aceptable CV, la recomendación es más relativa (C), ya que se equipara su nivel de beneficio al del placebo. Un 40% de los pacientes mejora de sus síntomas aunque sea en una pequeña cantidad por el efecto placebo.
2. En pacientes con síntomas moderados-severos, con alteración de su CV (en ausencia de complicaciones, que aconsejen un tratamiento quirúrgico y la derivación para su control al urólogo) pautaremos: bloqueantes alfa o inhibidores de la 5α reductasa16,23,33,34. La decisión de iniciar el tratamiento de la HBP con uno u otro grupo terapéutico vendrá condicionada por:
a) El tamaño de la próstata. Las próstatas agrandadas, junto a la presencia de STUI moderados-severos se asocian a una mayor progresión de la enfermedad35, que con el tiempo puede desembocar en RAO36. Igualmente son factores de riesgo de RAO la presencia de un flujo miccional disminuido37 y el crecimiento paulatino de la próstata38, que requieren en muchas ocasiones un tratamiento quirúrgico36. Se sabe que a partir de los 70 años aumenta el riesgo de RAO. Algunos autores sugieren que a partir de esta edad casi todos los varones desarrollarán un crecimiento micronodular de la próstata, la mitad presentarán un crecimiento macronodular y de éstos la mitad precisará un tratamiento quirúrgico23,33.
b) El valor del PSA al diagnóstico de la HBP23. Los pacientes con HBP y próstatas de unos 30-40 g y PSA inferior a 1,4 ng/ml tienen menos riesgo de progresión de la enfermedad. Si presentan síntomas moderados-severos, sin complicaciones y con alteración de la CV son pacientes a los que el tratamiento más indicado se corresponde con bloqueadores de los receptores alfa adrenérgicos de la próstata23.
Los criterios para derivar al urólogo a un paciente para tratamiento quirúrgico se desarrollan en la tabla 616,23,31,34,39.
Tratamiento farmacológico
Como hemos comentado, existen dos tipos de tratamiento farmacológico de la HBP que son recomendados por las distintas guías de actuación según la evidencia científica16,23,31,34,39:
1. Bloqueantes alfa.
2. Inhibidores de la 5α reductasa.
Los bloqueantes alfa
Son fármacos recomendados en el tratamiento de la HBP con síntomas moderados y mala CV (IaA)31,39. Intervienen sobre los receptores alfa simpáticos, alfa1A, alfa1D (de la musculatura lisa del cuello vesical y la próstata). Los fármacos que debemos utilizar de este grupo son:
1. Terazosina 5-10 mg.
2. Doxazosina 4-8 mg.
3. Alfuzosina 10 mg.
4. Tamsulosina 0,4-0,8 mg.
Los dos primeros deben iniciarse con dosis bajas e ir aumentando paulatinamente al actuar también con efecto hipotensor. Son fármacos con una parecida eficacia clínica y con efectos adversos algo diferentes. Puede aparecer hipotensión con terazosina y doxazosina. Con la tamsulosina, al ser muy selectivo de los receptores alfa1A, puede aparecer como efecto secundario eyaculación retrógrada. Algunos autores han descrito beneficios en la esfera sexual con doxazosina y alfuzosina. Su inicio de acción aparece a partir de la 2.a-4.a semana de iniciado el tratamiento. Son fármacos que actúan fundamentalmente sobre el aspecto sintomático de la HBP y son más eficaces en próstatas < de 30-40 g. No han demostrado acción sobre la progresión de la enfermedad23,33,35.
Reducen el residuo miccional, aumentan el flujo urinario y disminuyen los síntomas comparados con placebo (IaA)31. Son fármacos muy eficaces usados en pacientes que presentan RAO, junto al uso de catéter urinario, al disminuir el tono muscular de la zona de transición23.
No debe usarse prazosina ni fenoxibenzamina en el tratamiento de la HBP debido a sus efectos secundarios23,33.
Estudios recientes han evidenciado que el uso previo de bloqueantes alfa en pacientes a los que se realiza una facotomía presentan un riesgo elevado de presentar lo que se denomina síndrome del iris flácido intraoperatorio40,41. Aparece más frecuentemente esta complicación en los pacientes en tratamiento con tamsulosina, por su mayor selectividad en los receptores alfa 1a del músculo dilatador del iris. En el resto de fármacos bloqueantes alfa el riesgo es menor40.
Se recomienda la supresión de este tipo de tratamiento durante al menos dos semanas previas a la intervención quirúrgica de cataratas. No se recomienda el inicio de tratamiento de la HBP con bloqueante alfa en aquellos pacientes que estén a la espera de tratamiento de facoemulsión de cataratas. Deben incluirse preguntas referidas a la utilización de fármacos bloqueantes alfa en todos los pacientes de forma previa a su tratamiento quirúrgico. La reintroducción de este tipo de fármacos posteriormente a la cirugía parece ser que no representa ningún riesgo41.
Inhibidores de la 5α reductasa
Son fármacos recomendados en el tratamiento de la HBP (IaA)16,31,34,39 y son más eficaces en pacientes con próstatas agrandadas de 40 g o más (IbA)16,31,34. Disminuyen el tamaño de la próstata en más de un 30%16,42 e inciden sobre la progresión de la enfermedad.
Como efectos secundarios pueden presentar en menos del 8%, disminución de la libido y disfunción eréctil. Bajan los niveles de PSA a la mitad de su valor, por lo que se aconseja multiplicarlos por dos. El beneficio terapéutico aparece a partir de los 3-6 meses (IaA)31.
La próstata presenta dos tipos de receptores 5α reductasa 1 y 2. Existen dos fármacos que actúan inhibiendo la 5α reductasa.
1. Finasteride. Inhibe la acción de la 5α reductasa tipo 2 y disminuye los niveles plasmáticos de DHT en un 70%. La posología es de 5 mg al día. Es un fármaco que tras más de 10 años de empleo se ha mostrado como un fármaco con escasos efectos adversos y una eficacia duradera en el tiempo43. Estos beneficios son más frecuentes en las próstatas de mayor volumen (> 40 ml)43.
2. Dutasteride. Actúa sobre las enzimas 1 y 2 y disminuye los niveles de DHT en un 90%44. Utilizado durante más de 4 años no se aprecia disminución de los niveles de testosterona45. La posología es de 0,5 mg al día. Sus efectos secundaros son similares al finasteride. Algunos estudios sugieren mayor eficacia en la prevención de RAO en un 57% y reduce la necesidad de cirugía en un 48%, cifra ésta muy similar a la de finasteride46.
En el estudio Medical Therapy of Prostatic Symptoms (MTOPS)30,35 se asocia finasteride, un fármaco 5α reductasa, con doxazosina, un fármaco bloqueante alfa. Demuestra mayor eficacia que la actuación de estos dos fármacos aislados. Este tipo de asociación puede ser útil en pacientes con próstatas grandes y con un componente obstructivo acentuado al poder mejorar antes la sintomatología por la acción del bloqueante alfa y conseguir una reducción del tamaño de la próstata en el tiempo por la acción de la 5α reductasa.
Podemos afirmar que no existe ninguna duda para asegurar que el tratamiento combinado es muy superior al de ambos fármacos por separado: se reduce el riesgo de RAO en el 67% y el tratamiento quirúrgico se reduce en un 64% al cabo de 5 años de tratamiento35.
En este estudio se ha podido comprobar que los fármacos bloqueantes alfa disminuyen el número de complicaciones pero no consiguen detener la evolución de la enfermedad35. Otro aspecto importante que aporta este estudio y distinto a otros realizados es que en él se valora el número necesario de tratamientos (NNT)47 para evitar la progresión y las complicaciones, que es de 8,4, y si la próstata es > de 40 g el NNT es de 5, NNT muy inferiores a los necesarios para evitar un evento cardiovascular con simvastatina, que es de 25 en pacientes con dislipemia47.
Si bien se trata de una combinación muy eficaz, debemos valorar antes de indicar esta asociación el gasto económico que genera, por lo que debe prescribirse en aquellos pacientes en los que esté verdaderamente aconsejado su uso33.
Los derivados de plantas
No son recomendados en las guías16,34 fundamentalmente por la falta de estudios bien diseñados para su evaluación. Son fármacos poco utilizados en Estados Unidos y más utilizados en Europa. No se conoce muy bien su mecanismo de acción. Algunos autores indican que tienen efectos antiandrogénicos y antiflogísticos. En nuestro medio, las dos sustancias más utilizadas son:
1. Serenoa repens. A dosis de 160 mg cada 12 h. Sobre este tratamiento sí que existen algunos estudios, aunque cortos en el tiempo, y en ellos se describe una eficacia parecida al finasteride y la tamsulosina. Una reciente revisión de la Cochrane48 analiza 21 estudios en los que se utiliza Serenoa repens observando que los pacientes presentan mejoría sobre la nicturia, el residuo miccional, el flujo urinario máximo y el tamaño de la próstata, aunque constata los problemas metodológicos de los estudios, el escaso tiempo de estudio y el bajo número de pacientes estudiados, aconsejando la realización de estudios a más largo plazo. En el año 2006 un estudio realizado por Bent et al49 contradice estas cualidades al no observar mejoría si se comparaba con placebo. Es un fármaco con un grado de recomendación IIaB. Puede ser una opción válida en pacientes a los que no se les pueda tratar con bloqueante alfa o 5α reductasa.
2. Pygeum africanum. Es un fármaco no aconsejado por la variabilidad de su efecto. En España se encuentra comercializado solo o asociado a otros fármacos fitoterápicos. El grado de recomendación de este fármaco es III,C. No podemos aconsejar el uso de este fármaco como tratamiento de la HBP.
Los bloqueantes alfa mejoran los síntomas, no disminuyen el tamaño de la próstata y son útiles en próstatas menores de 40 g.
Las 5α reductasas disminuyen el tamaño de la próstata, evitan la progresión de la enfermedad y son útiles en próstatas de 40 o más gramos.
Tratamiento quirúrgico
No es objetivo de estas recomendaciones de práctica clínica evaluar el tratamiento quirúrgico de la HBP, aunque pensamos que si bien no compete al médico de AP decidir qué tipo de intervención quirúrgica es la más adecuada, sí que creemos que se deben conocer las técnicas más recomendadas.
Las distintas guías en términos generales coinciden en estas apreciaciones en relación a los tratamientos quirúrgicos más aconsejados16,31,34,39.
La resección transuretral prostática (IbA) y la prostatectomía (IbA) siguen siendo las intervenciones quirúrgicas más apropiadas en aquellas situaciones en las que hay una indicación absoluta de tratamiento quirúrgico.
Otra opción con resultados prometedores es la resección prostática con láser Holmium y láser Verde (IbA)31.
La termoterapia transuretral (IbA)39 debe reservarse para aquellos pacientes que no quieren someterse a la cirugía y no quieren tomar medicamentos de forma prolongada.
El tratamiento con Transurethral Needle Ablation of the Prostate (C) no puede aconsejarse como tratamiento de primera línea.
RESUMEN DEL TRATAMIENTO DE LA HIPERTROFIA BENIGNA DE PRÓSTATA
El tratamiento de la HBP dependerá fundamentalmente de distintos factores, como son: los síntomas, las complicaciones, la edad del paciente, su CV y sus expectativas y preferencias.
Tengamos en cuenta que la HBP es una enfermedad progresiva que dejada a su libre evolución en un número elevado de sujetos puede acabar produciendo una RAO que generalmente va a requerir un tratamiento quirúrgico. En los años ochenta, esta opción terapéutica era la más frecuente y no estaba exenta de una elevada morbilidad y también mortalidad. Posteriormente, con la aparición de fármacos que incidían sobre los síntomas y otros sobre la progresión, ha disminuido el número de intervenciones quirúrgicas. De aquí la importancia que han tenido los estudios de Olmnsted36-38 en el conocimiento de la enfermedad y sus factores de riesgo (Qmáx < 12 ml/seg, edad > 70 años, PSA > 1,4 ng/ml), que debemos considerar antes de decidir si tratamos o no farmacológicamente y el tipo de fármaco.
Correspondencia: F.J. Brenes Bermúdez.
Passatge Can Costa, n.o 5.
08338 Premià de Dalt. Barcelona.
Recibido el 17-09-07; aceptado para su publicación el 17-09-07.