La enfermedad tromboembólica venosa (ETV) es una complicación frecuente en pacientes diagnosticados de cáncer, y una causa importante de morbimortalidad. Aproximadamente el 30% de los episodios tromboembólicos se desarrollan en relación con un cáncer activo. Se estima que alrededor del 2-12% de los casos el episodio tromboembólico es la primera manifestación de un cáncer oculto, diagnosticado en ese momento o con posterioridad, lo que ofrece una oportunidad para su diagnóstico y tratamiento precoces.
Existen múltiples factores que contribuyen a aumentar el riesgo de ETV en pacientes oncológicos en relación con características específicas del paciente, del tumor y de los tratamientos. Conocer estos factores de riesgo (FR) contribuirá al diagnóstico precoz cuando aparezcan signos de ETV, así como al inicio de la tromboprofilaxis si estuviera indicada.
El diagnóstico de ETV en pacientes con cáncer no difiere del de los que no lo padecen.
En cuanto al tratamiento de la ETV en estos pacientes, la heparina de bajo peso molecular (HBPM), los anticoagulantes de acción directa (ACOD) y los antivitamina K (AVK) son los más empleados, aunque no está claro todavía el régimen posológico ni la duración.
El manejo de estos pacientes debe ser interdisciplinar y precoz, por lo que el médico de familia juega un papel fundamental en este proceso al estar en contacto continuo con sus pacientes. También es necesaria una actualización de conocimientos que mejoren la atención a estos enfermos.
Por estos motivos se ha elaborado este documento desde el Grupo de Trabajo de Vasculopatías de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), cuyo objetivo es presentar la información disponible en relación con el manejo de la ETV que puede aparecer en pacientes oncológicos, así como valorar la tromboprofilaxis y el tratamiento, si procede, desde un enfoque centrado en el ámbito de nuestra práctica clínica habitual.
Venous thromboembolic disease (VTE) is a frequent complication in patients diagnosed with cancer and a cause of morbidity and mortality. Approximately 20% of thromboembolic episodes develop in association with active cancer. On the other hand, it is estimated that about 2-12% of cases, the thromboembolic episode is the first manifestation of an occult cancer, diagnosed at that time or subsequently, which offers an opportunity for early diagnosis and treatment.
There are multiple factors that contribute to increase the risk of VTE in oncological patients in relation to specific characteristics of the patient, the tumor and the treatments. Knowledge of these risk factors will contribute to early diagnosis when signs of VTE appear, as well as the assessment of thromboprophylaxis if indicated. The diagnosis of VTE in patients with cancer does not differ of those who do not suffer from it.
Regarding the treatment of VTE in these patients, low molecular weight heparin (LMWH), direct acting anticoagulants (DACs) and antivitamin K (VKA) are the most commonly used, although the dosing regimen and length are not clear yet.
The management of these patients should be interdisciplinary and early, so the primary care physician plays a key role in this process as he/she is liaise with his/her patients. It is also necessary to update knowledge in order to improve the care of these patients.
For these reasons, this document has been prepared by the Working Group on Vasculopathies of the Spanish Society of Primary Care Physicians (SEMERGEN) whose objective is to present the available information regarding the management of VTE that may appear in oncological patients, as well as the assessment of thromboprophylaxis and treatment, if appropriate, from an approach focused on a primary care field.
La enfermedad tromboembólica venosa (ETV), en forma de trombosis venosa profunda (TVP) o tromboembolismo pulmonar (TEP), es una complicación frecuente en los pacientes diagnosticados de cáncer, y una causa importante de morbimortalidad. Representa la segunda causa de muerte en pacientes con procesos oncológicos1. Múltiples estudios informan una mayor mortalidad en pacientes con cáncer que desarrollan una ETV con respecto a los que no. El estudio Múltiple Environmental and Genetic Assessment (MEGA)2 observó que el riesgo de padecer un fenómeno trombótico es 9 veces mayor en pacientes con cáncer respecto a controles sanos; si bien su frecuencia varía de unas series a otras, se estima que entre un 3-9% de los pacientes van a desarrollarla, pudiendo alcanzar hasta el 20% en tumores de alto riesgo, representando la primera manifestación de enfermedad oncológica en un 20-30% de los casos.
Más estudios recientes revelan que dicha complicación se produce con más frecuencia el primer año, siendo el período de mayor incidencia los 3 primeros meses tras el diagnóstico3.
Existen además, múltiples factores que contribuyen a aumentar el riesgo de ETV en pacientes oncológicos, destacando los relacionados propiamente con el cáncer, como son el tipo de cáncer (mayor riesgo los de páncreas, gástrico, del sistema nervioso central o neoplasias hematológicas), la estadificación y el tratamiento oncoespecífico; así como como los factores relacionados con el paciente: edad, inmovilización, mutaciones genéticas que promuevan estados protrombóticos, presencia de catéteres intravasculares, enfermedad pulmonar o renal crónicas, anemia o infecciones.
Dada la elevada incidencia de fenómenos tromboembólicos venosos y la identificación precisa de los FR, se recomienda el uso de modelos predictivos validados con el objetivo de definir el subgrupo de pacientes con alto riesgo de eventos trombóticos que pueden beneficiarse mediante el uso de tratamiento tromboprofiláctico4.
En cuanto al tratamiento de la ETV en estos pacientes, la heparina de bajo peso molecular (HBPM), los nticoagulantes orales directos (ACOD) y los antagonistas de la vitamina K (AVK) son los más empleados, aunque no está claro todavía el régimen posológico en cuanto a la duración de tratamiento, en todas las guías nacionales e internacionales se recomienda mantener la anticoagulación mientras el tumor esté activo, especialmente en enfermedad metastásica5. Sin embargo, entre otras consideraciones un informe sobre el cáncer asociado a trombosis6 advierte que la mayoría de los oncólogos subestima la prevalencia de la ETV y su impacto negativo en los pacientes con cáncer, o que el gasto anual del tratamiento de los enfermos con cáncer y trombosis es casi un 50% más caro que el de los pacientes con cáncer sin trombosis. Así quedó demostrado en los estudios Fundamental Research in Oncology and Thrombosis (FRONTLINE) 20037 y 20208, donde se objetivó que solo un 50% de los cirujanos oncológicos y un 5% de los oncólogos médicos realizaban una evaluación del riesgo de TVP de forma sistemática, así como la indicación de tromboprofilaxis primaria de ETV de acuerdo al riesgo y las recomendaciones en las guías National Cáncer Crompenhensive Network (NCCN), demostrando una inercia continuada pese al conocimiento de los riesgos. No obstante, actualmente la indicación de tromboprofilaxis primaria de ETV constituye un área de investigación y son necesarias guías de manejo e identificación que incluyan sistemas hospitalarios y de atención primaria para su aplicación. La encuesta realizada por el Grupo de Trabajo de Vasculopatías de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), donde participaron 262 médicos, muestra que el 52,7% no evaluaba el riesgo trombótico de los pacientes oncológicos y el 75% no conocía ninguna escala para hacerlo en aquellos que recibían quimioterapia, aunque el 94% sí conocía que los procesos de cáncer aumentaban el riesgo de ETV. El 94,9% de los encuestados desearía recibir formación sobre ETV y cáncer9.
El manejo del cáncer asociado a trombosis (CAT) es una tarea compleja que requiere una evaluación cuidadosa de la evidencia de los ensayos clínicos sobre la eficacia y la seguridad de los agentes anticoagulantes, además de considerar muchos otros factores relacionados con el paciente, el cáncer y su tratamiento. También es importante recordar que el plan de anticoagulación más adecuado puede cambiar a medida que el paciente continúa su viaje a través de su enfermedad.
Por estos motivos, en base a una serie de preguntas, se ha elaborado desde dicho grupo de trabajo este documento cuyo objetivo es presentar la información disponible según la evidencia científica en relación con el manejo de la ETV que puede aparecer en pacientes oncológicos, así como la valoración de tromboprofilaxis y el tratamiento, si procede, respondiendo a dichos interrogantes desde un enfoque centrado en la atención primaria.
¿Por qué debemos pensar en la enfermedad tromboembólica venosa durante un proceso oncológico?La relación entre cáncer y trombosis fue descrita en 1865 por el médico francés Armand Trousseau, y a la combinación de ambas entidades se la conoce como síndrome de Trousseau, complicación paraneoplásica consistente en la activación sistémica de la coagulación10. Desde entonces, la trombosis se ha establecido, en su presentación, como una complicación común y grave en algunos pacientes con proceso neoplásico, manifestándose mayormente como eventos tromboembólicos, incluyendo la trombosis arterial y venosa profunda, la TEP, la tromboflebitis migratoria (signo de Trousseau), la endocarditis trombótica no bacteriana, síndromes sistémicos, como la anemia hemolítica macroangiopática y la coagulación intravascular diseminada (CID)3.
La prevalencia cáncer-ETV es mayor y más grave que la de cáncer-ictus e incluso que la de cáncer-infarto11. Según datos epidemiológicos, un paciente oncológico presenta un riesgo de 5 a 9 veces superior de padecer una ETV que la población general. En sentido contrario, se estima que alrededor del 2-12% de los casos el episodio tromboembólico es la primera manifestación de un cáncer oculto, diagnosticado en ese momento o con posterioridad, lo que ofrece, en teoría, una oportunidad para su diagnóstico y tratamiento precoces. Por tanto, la relación entre la ETV y el cáncer es bidireccional, presentando una serie de características epidemiológicas en función de la dirección en que se observe dicha relación11,12.
El riesgo de ETV es alto en los 3 primeros meses tras el diagnóstico de un cáncer (odds ratio [OR]: 54), desciende durante los 3-12 meses siguientes (OR: 14) y es bajo durante el segundo y tercer año tras el diagnóstico (OR: 4). La mayor incidencia en los primeros meses desde el diagnóstico puede estar relacionada con una elevada agresividad biológica del tumor, intervenciones médicas, como la realización de cirugía mayor o el inicio de la quimioterapia.
La incidencia de cáncer oculto se sitúa en torno al 4-13% entre los primeros 6 meses y los 2 años, y pasa a ser del 34% a los 5 años tras el diagnóstico de la ETV. El 40% de los pacientes diagnosticados de cáncer después de un primer episodio de ETV tienen metástasis en el momento del diagnóstico13. Asimismo, encontramos que el riesgo de ETV tras cirugía y el de recurrencia son superiores en pacientes con proceso oncológico, presentando efectos adversos sobre el curso natural del tumor, ya que empeora su pronóstico y compromete el tratamiento antitumoral, disminuyendo la supervivencia del paciente.
El proceso neoplásico, además conlleva un riesgo 2 veces mayor de tromboembolismo arterial (TEA), incluidos infarto de miocardio y accidente cerebrovascular isquémico, siendo mayor en varones de edad avanzada y en pacientes con cáncer de pulmón o riñón. Las enfermedades relacionadas con el TEA en el cáncer incluyen accidente cerebrovascular isquémico inducido por fibrilación auricular, enfermedad de la arteria carótida, embolización por células tumorales o endocarditis trombótica no bacteriana, tromboembolismo micro-circulatorio periférico relacionado con CID, embolismo cerebral paradójico en el curso de ETV y seno cerebral1.
La fisiopatología de la trombosis asociada a neoplasia implica la participación de los componentes de la tríada de Virchow: estasis del flujo sanguíneo, alteraciones endoteliales e hipercoagulabilidad. Existe una relación bidireccional entre la progresión tumoral, la activación de la coagulación y la inflamación. Las células tumorales liberan moléculas inflamatorias y micropartículas cargadas de factor tisular (FT) que estimulan la agregación plaquetaria y la formación del trombo. El FT favorece la angiogénesis y, por lo tanto, el crecimiento tumoral y su diseminación. Una vez activado el sistema de la coagulación, se desarrolla un estado de hipercoagulabilidad donde son frecuentes las alteraciones en las pruebas de coagulación, incluso sin manifestaciones trombóticas o hemorrágicas14.
Así pues, debemos pensar siempre en la posibilidad de una ETV durante el proceso oncológico:
- 1.
Por su alta incidencia.
- 2.
Por los mecanismos patogénicos que relacionan la trombosis en pacientes neoplásicos con una interacción compleja entre las células tumorales, el paciente y el sistema hemostático que dependerá a su vez de la angiogénesis del tumor, su crecimiento y la formación de metástasis12.
Dada la naturaleza multifactorial de la ETV, existen múltiples factores que influyen en el riesgo individual de padecer un evento trombótico.
La aparición de una ETV en el curso de una enfermedad oncológica supone un FR independiente de morbimortalidad. El conocer los FR que pueden favorecer la aparición de una ETV nos va a ayudar a poder hacer un diagnóstico temprano y una tromboprofilaxis eficaz.
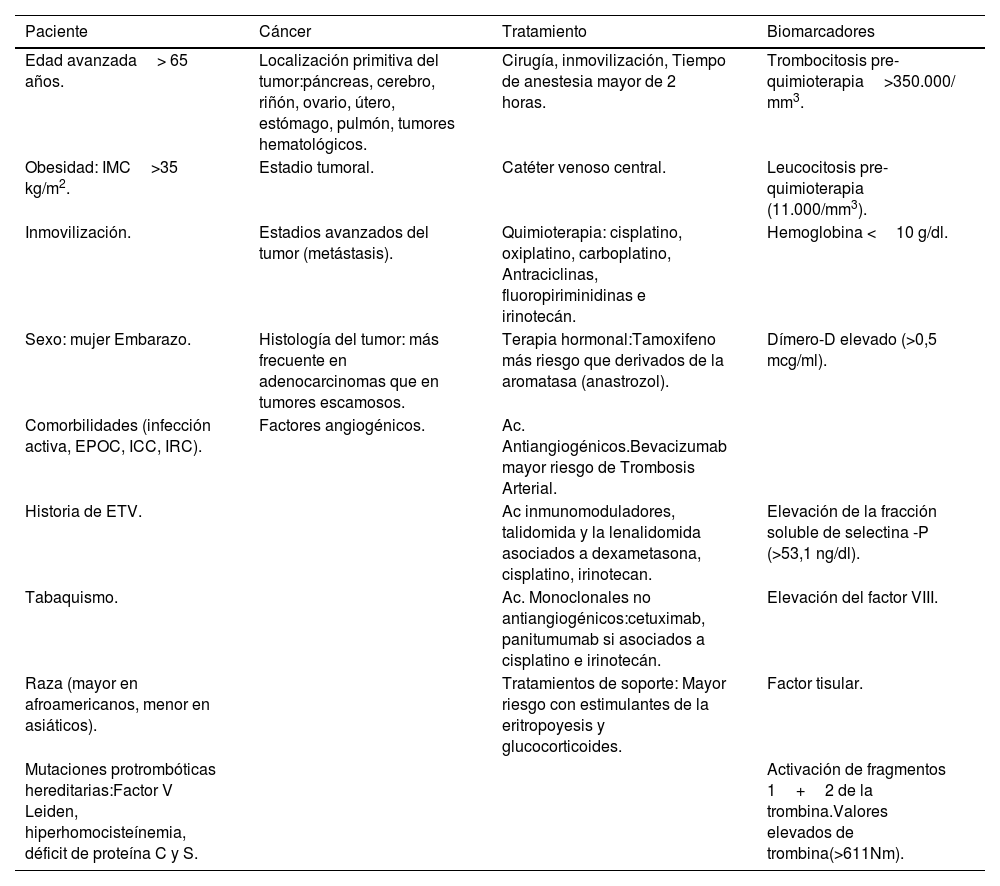
Este riesgo tromboembólico no es igual en todos los procesos oncológicos, varía de unos pacientes a otros, y va a depender de factores relacionados tanto con el paciente, como con el tipo de tumor y el tratamiento oncológico (tabla 1).
Factores de riesgo de enfermedad tromboembólica venosa en pacientes oncológicos
| Paciente | Cáncer | Tratamiento | Biomarcadores |
|---|---|---|---|
| Edad avanzada> 65 años. | Localización primitiva del tumor:páncreas, cerebro, riñón, ovario, útero, estómago, pulmón, tumores hematológicos. | Cirugía, inmovilización, Tiempo de anestesia mayor de 2 horas. | Trombocitosis pre-quimioterapia>350.000/ mm3. |
| Obesidad: IMC>35 kg/m2. | Estadio tumoral. | Catéter venoso central. | Leucocitosis pre-quimioterapia (11.000/mm3). |
| Inmovilización. | Estadios avanzados del tumor (metástasis). | Quimioterapia: cisplatino, oxiplatino, carboplatino, Antraciclinas, fluoropiriminidinas e irinotecán. | Hemoglobina <10 g/dl. |
| Sexo: mujer Embarazo. | Histología del tumor: más frecuente en adenocarcinomas que en tumores escamosos. | Terapia hormonal:Tamoxifeno más riesgo que derivados de la aromatasa (anastrozol). | Dímero-D elevado (>0,5 mcg/ml). |
| Comorbilidades (infección activa, EPOC, ICC, IRC). | Factores angiogénicos. | Ac. Antiangiogénicos.Bevacizumab mayor riesgo de Trombosis Arterial. | |
| Historia de ETV. | Ac inmunomoduladores, talidomida y la lenalidomida asociados a dexametasona, cisplatino, irinotecan. | Elevación de la fracción soluble de selectina -P (>53,1 ng/dl). | |
| Tabaquismo. | Ac. Monoclonales no antiangiogénicos:cetuximab, panitumumab si asociados a cisplatino e irinotecán. | Elevación del factor VIII. | |
| Raza (mayor en afroamericanos, menor en asiáticos). | Tratamientos de soporte: Mayor riesgo con estimulantes de la eritropoyesis y glucocorticoides. | Factor tisular. | |
| Mutaciones protrombóticas hereditarias:Factor V Leiden, hiperhomocisteínemia, déficit de proteína C y S. | Activación de fragmentos 1+2 de la trombina.Valores elevados de trombina(>611Nm). |
La evolución de la ETV en pacientes oncológicos es más agresiva, con un riesgo de recidiva de hasta 3 veces superior a pacientes sin cáncer. Se han validado diversos índices para predecir el riesgo clínico de ETV asociado a la quimioterapia en pacientes oncológicos; el más utilizado en el ámbito ambulatorio es el de Khorana et al.15 (tabla 2).
| Características del paciente | Puntuación |
|---|---|
| Localización del tumor primario:• Muy alto riesgo (páncreas, estómago).• Alto riesgo (pulmón, linfoma, ginecológico, vejiga, testicular) | 21 |
| Recuento plaquetario ≥ 350.000/mm3 (pre-quimioterapia) | 1 |
| Hb<10g/L o uso de agentes estimuladores de eritropoyesis | 1 |
| Recuento leucocitario pre-quimioterapia>11.000/mm3 | 1 |
| IMC ≥ 35 kg/m2 | 1 |
| RIESGO DE ETV: | PUNTUACIÓN |
| Riesgo bajo | 0 puntos |
| Riesgo intermedio | 1-2 puntos |
| Riesgo alto | ≥ 3 puntos |
Fuente: Khorana et al.15. ETV: enfermedad tromboembólica venosa; Hb: hemoglobina; IMC: índice de masa corporal
El cáncer empeora la evolución de la ETV: uno de cada 10 pacientes con cáncer que fallece por un TEP tiene menos de 50 años. Esto suscita la búsqueda de modelos predictores de trombosis en pacientes con cáncer. Los modelos predictivos son sistemas de puntuación que intentan calcular el riesgo de ETV en función de los FR. Su utilidad radica en identificar subgrupos de pacientes con mayor riesgo y así valorar el establecimiento de la tromboprofilaxis primaria cuando no existe contraindicación para su uso. Sin embargo, pese a su importancia, existen pocos modelos robustos con una precisión adecuada. Esos modelos deben tener un alto valor predictivo positivo (VPP) que permita apoyar el uso de tromboprofilaxis primaria o un alto valor predictivo negativo (VPN) para limitar la duración del tratamiento.
Actualmente las sociedades científicas recomiendan el uso de modelos de riesgo bien validados con el objetivo de, una vez identificados los pacientes con alto riesgo, se pueda valorar iniciar tromboprofilaxis primaria de forma precoz16–18.
Khorana et al. identificaron diferentes FR para el desarrollo de ETV en pacientes con cáncer, estratificando su riesgo en bajo, intermedio y alto (tabla 2). En la aplicación de este modelo hubo controversias al detectarse un bajo VPP, pero al ser un modelo validado interna y externamente, se concluyó que la escala de Khorana estratificaba el riesgo de ETV en pacientes con cáncer en tratamiento con quimioterapia en medio ambulatorio e identificaba a aquellos que podrían beneficiarse de la tromboprofilaxis15.
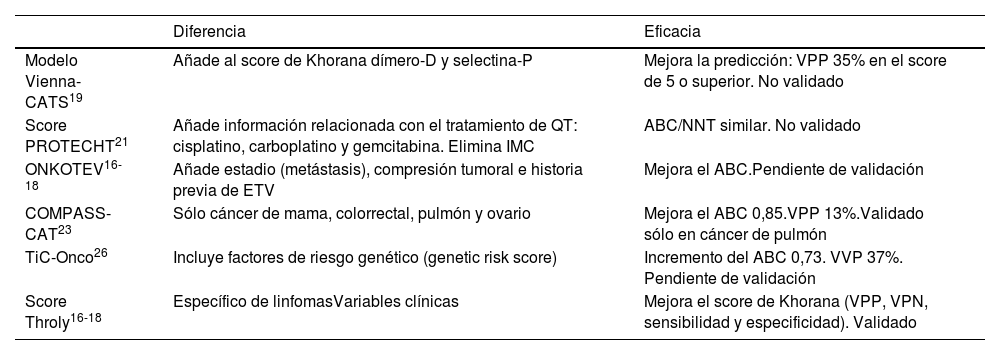
Con el estudio Vienna Cáncer and Thrombosis Study (CATS)19 se amplió el modelo de Khorana añadiendo 2 variables más, el dímero-D y la selectina P. Se comprobó que el grado tumoral se asocia con un mayor riesgo de ETV en pacientes con cáncer, aumentando su probabilidad en un 35%20. Este modelo identifica FR adicionales como: localización del tumor, cifra de plaquetas, leucocitos, nivel hemoglobina e índice de masa corporal (IMC). De este modo, se han descrito modelos predictivos adicionales con la incorporación de los parámetros descritos anteriormente que evaluarían de forma más específica el riesgo de TVP y la intervención frente a los pacientes de alto riesgo (PROTECHT, CONKO, COMPASS-CAT)21–25. Otros modelos de predicción como el ONCOTHROMB-Tic Onco26 integran factores clínicos y genéticos para el desarrollo de la trombosis, confirmándose la mejor identificación de los pacientes de alto riesgo de ETV en comparación con el modelo de Khorana (tabla 3).
Modelos predictivos de riesgo de ETV en pacientes con cáncer
| Diferencia | Eficacia | |
|---|---|---|
| Modelo Vienna-CATS19 | Añade al score de Khorana dímero-D y selectina-P | Mejora la predicción: VPP 35% en el score de 5 o superior. No validado |
| Score PROTECHT21 | Añade información relacionada con el tratamiento de QT: cisplatino, carboplatino y gemcitabina. Elimina IMC | ABC/NNT similar. No validado |
| ONKOTEV16-18 | Añade estadio (metástasis), compresión tumoral e historia previa de ETV | Mejora el ABC.Pendiente de validación |
| COMPASS-CAT23 | Sólo cáncer de mama, colorrectal, pulmón y ovario | Mejora el ABC 0,85.VPP 13%.Validado sólo en cáncer de pulmón |
| TiC-Onco26 | Incluye factores de riesgo genético (genetic risk score) | Incremento del ABC 0,73. VVP 37%. Pendiente de validación |
| Score Throly16-18 | Específico de linfomasVariables clínicas | Mejora el score de Khorana (VPP, VPN, sensibilidad y especificidad). Validado |
Fuente: adaptado de Ferrer M et al.20. ABC: área bajo la curva; C index: índice de concordancia; IMC: índice de masa corporal; NNT: número de pacientes necesario tratar para evitar un evento; QT: quimioterapia; VPN: valor predictivo negativo; VPP: valor predictivo positivo
Es necesario pensar que estamos frente a un proceso dinámico y sujeto a cambios, por lo que se recomienda la utilización de nuevas herramientas que aborden los nuevos modelos que incluyen biomarcadores, perfiles de riesgo genómico o puntuaciones específicas existentes para ciertos tumores que nos pueden servir de gran ayuda para la estratificación del riesgo, mejorando la predicción de la ETV27,28.
Probablemente la clave de la generalización y el uso rutinario en la práctica clínica va a depender del desarrollo de modelos predictivos de riesgo eficaces y fácilmente aplicables que seleccionen al paciente adecuado para recibir este tratamiento (predicción del riesgo de ETV y predicción del riesgo de sangrado asociado a la terapia anticoagulante).
¿Que sucede si se presenta una trombosis venosa superficialQueda clara la relación entre ETV y cáncer, pero si lo que se nos presenta es una trombosis venosa superficial (TVS), ¿tenemos respuestas?, ¿cuáles son sus escalas de validación?, ¿nos sirven las mismas? La respuesta para todas las preguntas es NO. Se ha visto que sus FR son comunes a los de la TVP, pero no tenemos escalas para su validación. Se desconoce la incidencia real, ha sido muy poco estudiada en estos pacientes, se ha considerado hasta hace unos años una enfermedad benigna con poca proyección para complicaciones sistémicas, pero recientemente se le ha detectado que dicho diagnóstico va acompañado de ETV en forma de TVP (desde un 6 a un 44%) o TEP llegando en algunos pacientes a ser diagnosticada primero la TVS y tras unos meses desarrollar una TVP29.
Se ha confirmado la alta incidencia de complicaciones asociadas a la TVS, por lo que se recomienda un estrecho seguimiento de estos pacientes al menos durante los 3 meses posteriores al diagnóstico. A este vacío se añade que tan solo la guía americana NCCN Clinical Practice Guidelines in Oncology recomienda tratarla como si fuera una TVP durante 6 semanas30. Tras la realización de ecografía Doppler, se recomienda iniciar tratamiento con fondaparinux 2,5mg/día como primera opción o HBPM a dosis intermedia/terapéutica durante al menos 6 semanas si el trombo se localiza a más de 3cm del sistema venoso profundo (SVP) y tratar como si fuera una TVP si el trombo estuviera a menos de 3cm del SVP. En caso de persistencia de los FR desencadenantes se debe evaluar la continuidad del tratamiento24. Una revisión encargada por el Programa de Educación de la Sociedad Estadounidense de Hematología sugirió fondaparinux 2,5mg/día o rivaroxabán 10mg/día durante 45 días en pacientes seleccionados con TVS mayor de 5cm con FR de ETV (cáncer), sin contraindicaciones para la terapia anticoagulante y, como alternativa, HBPM a dosis profilácticas durante 30 días31,32.
¿Cuándo pensar en la enfermedad tromboembólica venosa relacionada con un proceso oncológico?El método diagnóstico de ETV en pacientes oncológicos no difiere del que se realiza en otras situaciones generales.
El TEP se suele presentar con disnea, dolor torácico, taquicardia, síncope, tos y menos frecuentemente con hemoptisis, cianosis, hipotensión y shock. Según las directrices de la European Society of Cardiology (ESC) 2019 (frente al TEP y TVP)33,34 a los pacientes que presenten edemas unilaterales de miembros inferiores (MMII) y/o disnea inexplicable se les debe iniciar estudio para descartar un TEP. En el electrocardiograma puede aparecer taquicardia sinusal, inversión de la onda T en precordiales, bloqueo de rama derecha, o de forma infrecuente, el patrón típico S1Q3T3. Las alteraciones radiológicas pulmonares son inespecíficas (atelectasia, derrame pleural) y se puede añadir una disminución de la saturación de oxígeno en la pulsioximetría y también en la gasometría.
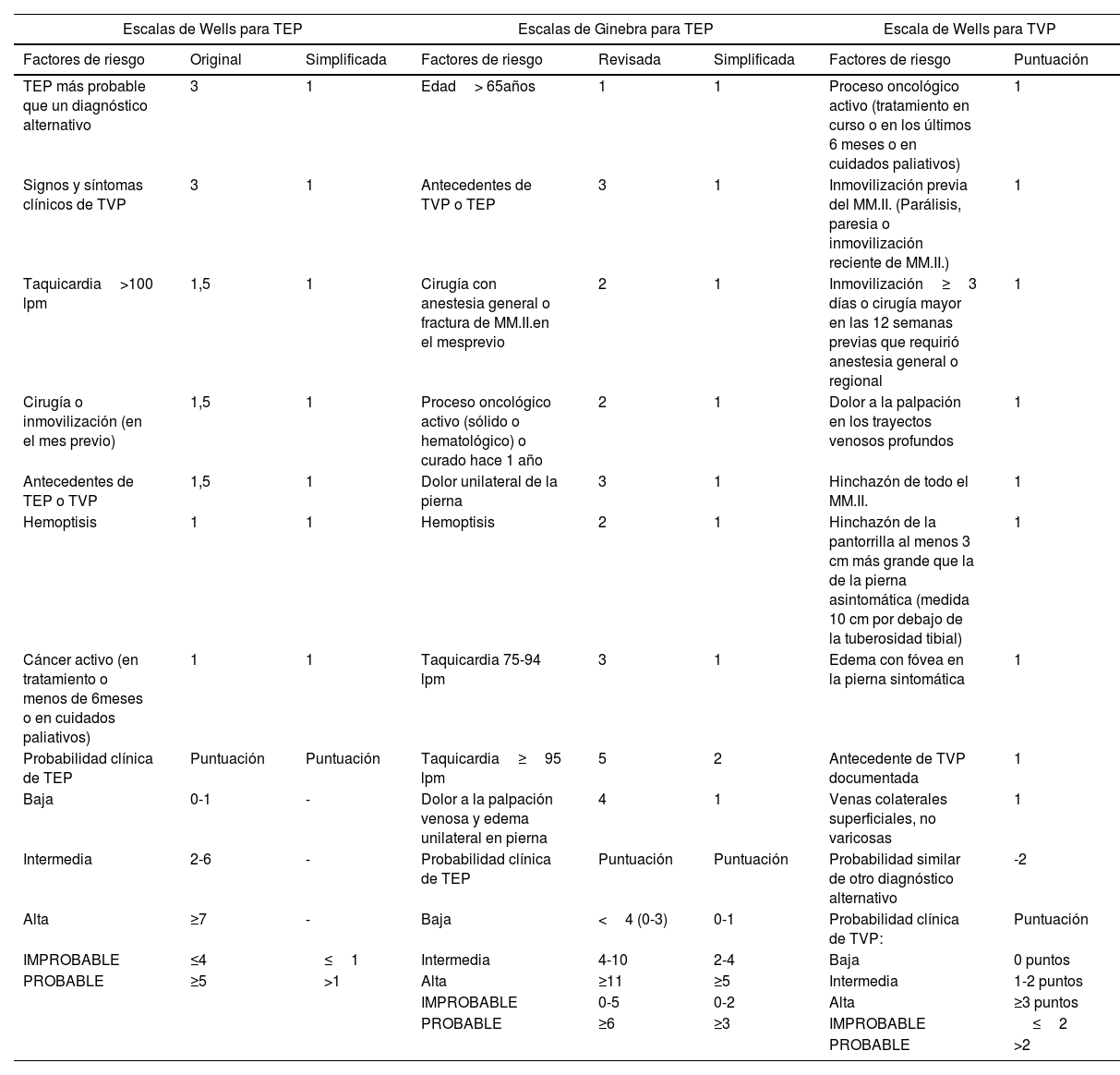
El dímero-D tiene una alta sensibilidad, pero muy baja especificidad, por lo que su negatividad (menor de 0,5μg por mililitro) excluye el diagnóstico con un VPN del 98%. Si el dímero-D resulta positivo, el diagnóstico debe apoyarse en un riesgo alto de TEP con escalas, como la escala de Wells o la escala de Ginebra (tabla 4)33.
Escalas de Wells y de Ginebra para valorar la probabilidad clínica de tromboembolismo pulmonar y trombosis venosa profunda
| Escalas de Wells para TEP | Escalas de Ginebra para TEP | Escala de Wells para TVP | |||||
|---|---|---|---|---|---|---|---|
| Factores de riesgo | Original | Simplificada | Factores de riesgo | Revisada | Simplificada | Factores de riesgo | Puntuación |
| TEP más probable que un diagnóstico alternativo | 3 | 1 | Edad> 65años | 1 | 1 | Proceso oncológico activo (tratamiento en curso o en los últimos 6 meses o en cuidados paliativos) | 1 |
| Signos y síntomas clínicos de TVP | 3 | 1 | Antecedentes de TVP o TEP | 3 | 1 | Inmovilización previa del MM.II. (Parálisis, paresia o inmovilización reciente de MM.II.) | 1 |
| Taquicardia>100 lpm | 1,5 | 1 | Cirugía con anestesia general o fractura de MM.II.en el mesprevio | 2 | 1 | Inmovilización≥3 días o cirugía mayor en las 12 semanas previas que requirió anestesia general o regional | 1 |
| Cirugía o inmovilización (en el mes previo) | 1,5 | 1 | Proceso oncológico activo (sólido o hematológico) o curado hace 1 año | 2 | 1 | Dolor a la palpación en los trayectos venosos profundos | 1 |
| Antecedentes de TEP o TVP | 1,5 | 1 | Dolor unilateral de la pierna | 3 | 1 | Hinchazón de todo el MM.II. | 1 |
| Hemoptisis | 1 | 1 | Hemoptisis | 2 | 1 | Hinchazón de la pantorrilla al menos 3 cm más grande que la de la pierna asintomática (medida 10 cm por debajo de la tuberosidad tibial) | 1 |
| Cáncer activo (en tratamiento o menos de 6meses o en cuidados paliativos) | 1 | 1 | Taquicardia 75-94 lpm | 3 | 1 | Edema con fóvea en la pierna sintomática | 1 |
| Probabilidad clínica de TEP | Puntuación | Puntuación | Taquicardia≥95 lpm | 5 | 2 | Antecedente de TVP documentada | 1 |
| Baja | 0-1 | - | Dolor a la palpación venosa y edema unilateral en pierna | 4 | 1 | Venas colaterales superficiales, no varicosas | 1 |
| Intermedia | 2-6 | - | Probabilidad clínica de TEP | Puntuación | Puntuación | Probabilidad similar de otro diagnóstico alternativo | -2 |
| Alta | ≥7 | - | Baja | <4 (0-3) | 0-1 | Probabilidad clínica de TVP: | Puntuación |
| IMPROBABLE | ≤4 | ≤1 | Intermedia | 4-10 | 2-4 | Baja | 0 puntos |
| PROBABLE | ≥5 | >1 | Alta | ≥11 | ≥5 | Intermedia | 1-2 puntos |
| IMPROBABLE | 0-5 | 0-2 | Alta | ≥3 puntos | |||
| PROBABLE | ≥6 | ≥3 | IMPROBABLE | ≤2 | |||
| PROBABLE | >2 | ||||||
Otras pruebas son:
- -
La angiografía pulmonar por tomografía computarizada (angio-TC) con multidetector, que es la primera prueba de imagen a realizar ante la sospecha de un TEP agudo, gammagrafía de ventilación-percusión (V/Q), ecografía transesofágica y angiografía por resonancia magnética (angio-RM), indicada en pacientes alérgicos a contrastes yodados.
La TVP de miembros inferiores puede ser:
- -
Proximal: se asocia con enfermedades crónicas, como el proceso oncológico activo, la insuficiencia cardíaca o respiratoria y con pacientes ancianos. Presenta mayor riesgo de TEP.
- -
Distal: está más relacionada con FR transitorios, como cirugía reciente, viajes o inmovilización, cursando con menor riesgo de TEP.
Clínicamente puede variar desde hinchazón, dolor, calor, enrojecimiento del miembro afectado, hasta ser asintomática debiéndose realizar la valoración de riesgo mediante la escala de Wells para TVP34–36 (tabla 4).
Un dímero-D negativo descarta con seguridad el diagnóstico de TVP, sin realizar otras pruebas, en pacientes con baja probabilidad clínica. En los que tienen alta probabilidad clínica habría que hacer ecografía de compresión venosa. En la TVP de miembro inferior el dímero-D tiene un VPP bajo, que incluso puede ser menor en pacientes con tumores malignos, por lo que no se recomienda su uso34–36.
Las pruebas de imagen para el diagnóstico de TVP son:
- -
Ultrasonografía por compresión y ecografía Doppler: técnicas no invasivas, con alta sensibilidad y especificidad (menor en pacientes asintomáticos). Deben ser la prueba inicial cuando la probabilidad clínica es de riesgo intermedio o alto. Un resultado negativo no descarta el diagnóstico de TVP, por lo que se recomienda determinar el dímero-D y repetir la ultrasonografía una semana después si resulta negativo34,36.
- -
La venografía y la pletismografia son bastante sensibles, pero su uso es excepcional.
- -
La angio-RM y la angio-TC, son técnicas con una sensibilidad y especificidad muy altas utilizables si la ecografía no es concluyente.
La trombosis venosa relacionada con el uso del catéter (TRC) puede aparecer por lesión venosa durante su inserción, por estasis venoso, hipercoagulabilidad o por el movimiento continuo del catéter en la vena. Este hecho puede desarrollar TVP recurrente, síndrome protrombótico, TEP o sepsis. Entre los FR de la TRC se encuentran los asociados al catéter en sí, como el lugar de inserción (femoral mayor que en subclavia y esta mayor que en yugular), la ubicación de la punta, el tipo de catéter venoso (central o periférico), y los asociados al proceso oncológico, como la inmovilización, la cirugía, la quimioterapia, la enfermedad metastásica, la compresión vascular, el tumor de alto riesgo trombótico o la presencia de un estado de hipercoagulabilidad, como el factor V de Leiden o la mutación del gen de la protrombina entre otros3,36.
Asociada al proceso oncológico, la TRC presenta una incidencia en los adultos entre el 27 y el 80%, siendo común también en los niños en un 50%11.
La mayoría de los pacientes son asintomáticos, pero pueden presentar: dolor, edema, eritema del miembro afectado, impotencia funcional y molestias en la región escapular. La vena subclavia, axilar, yugular interna y braquiocefálica son las que se ven con más frecuencia afectadas por la trombosis24,36.
Sus métodos diagnósticos son la ecografía Doppler, que es la más utilizada en un paciente oncológico portador de catéter venoso central (CVC); la venografía, que es la prueba más sensible y exacta, pero poco utilizada actualmente; dejando la angio-RM y el angio-TC para cuando la ecografía no sea resolutiva.
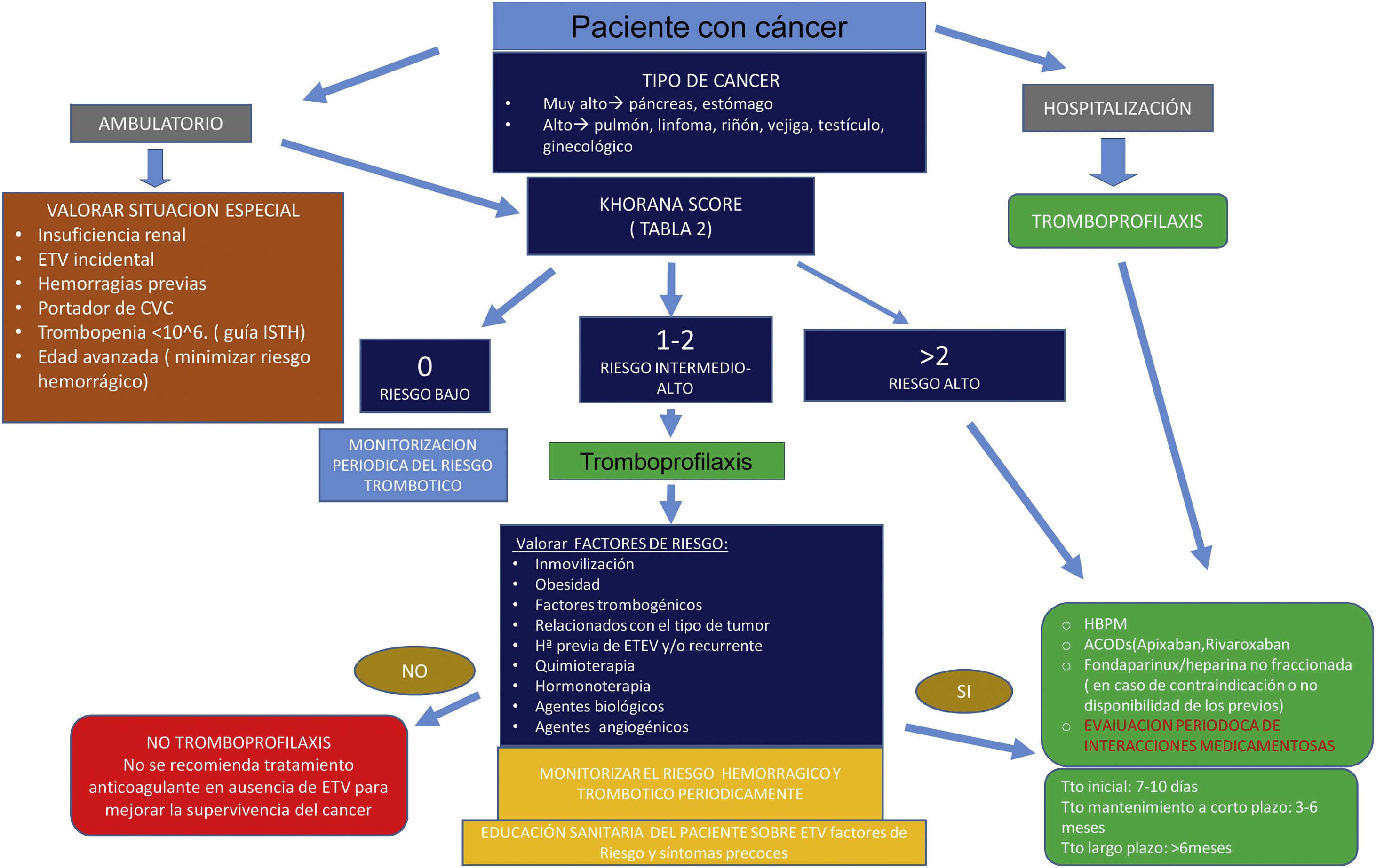
¿Cómo disminuir la incidencia de la enfermedad tromboembólica venosa en un proceso oncológico?Los enfermos diagnosticados de cáncer presentan, como ya hemos comentado, un riesgo elevado para el desarrollo de ETV y pueden ser candidatos a recibir tromboprofilaxis en determinadas situaciones clínicas, salvo que existan contraindicaciones, como coagulopatías, cirugía mayor con alto riesgo de sangrado, trombocitopenia severa, sangrado activo o hemorragia cerebral reciente, entre otras37.
Una de las limitaciones en la aplicación generalizada de la tromboprofilaxis es la ausencia de un beneficio en la supervivencia global, por lo que su indicación debe realizarse de forma individual, valorando riesgos y beneficios, no debiéndose ofrecer de forma rutinaria (grado 1A)3,5,38,39.
La quimioterapia aumenta 6,5 veces más el riesgo de sufrir un evento tromboembólico38, como también lo hace el tratamiento con hormonoterapia, agentes biológicos y otros fármacos relacionados. Se recomienda valorar el riesgo de ETV en pacientes ambulatorios con cáncer al inicio del tratamiento, durante la evolución del mismo y de la enfermedad, utilizando modelos de riesgo predictivos validados, como la escala de Khorana (evidencia 2C)3,37.
El tratamiento tromboprofiláctico antitrombótico ha demostrado eficacia y seguridad en la prevención de eventos tromboembólicos en pacientes oncológicos considerados de alto riesgo a través de una herramienta de valoración de riesgo validada (p. ej., escala de Khorana), que inician o están recibiendo quimioterapia, sin contraindicaciones ni interacciones a la anticoagulación y con bajo riesgo de sangrado3,5,37. Actualmente se considera a las HBPM y ACOD (apixabán, rivaroxabán) como fármacos de elección en pacientes de intermedio o alto riesgo de ETV (grado 1B)1,3,5,37–40. Los ACOD no se recomiendan en tumores gastrointestinales y genitourinarios por aumentar el riesgo de sangrado, prestando especial atención a los pacientes con grave compromiso de las funciones renal y hepática. Se debe realizar también una evaluación del riesgo de interacciones medicamentosas de forma contínua3,5,38,39.
No hay consenso sobre la dosis y duración de la tromboprofilaxis, aunque se sugiere que debe durar al menos 12 semanas desde el inicio de la terapia sistémica y hasta 6 meses3,5,37–39.
Se recomienda profilaxis en los pacientes con mieloma múltiple en tratamiento con agentes angiogénicos (talidomida o lenalidomida) junto con quimioterapia y/o dexametasona (grado 1A)5,38,39. En este contexto, se pueden utilizar anticoagulantes orales (AVK a dosis bajas o terapéuticas y apixabán a dosis profilácticas), HBPM a dosis profilácticas o ácido acetilsalicílico a dosis bajas (100mg/día), porque han mostrado efectos similares con respecto a la prevención de ETV (grado 2B)3,5,38.
También está indicada en pacientes con cáncer de páncreas localmente avanzado o metastásico en tratamiento sistémico con bajo riesgo de hemorragia, siendo de elección HBPM (grado 1A)5 o ACOD (rivaroxabán o apixabán; grado 1B)5, y en algunos tipos de cáncer de pulmón, aunque hay datos para no recomendar la profilaxis farmacológica con HBPM en pacientes con cáncer de pulmón metastásico o localmente avanzado tratados con terapia anticancerosa sistémica, aunque tengan bajo riesgo de hemorragia5.
La escala de Khorana se puede utilizar para calcular el riesgo de ETV en pacientes ambulatorios con otro tipo de cáncer37.
En pacientes con cáncer que se someten a cirugía, la ETV es una complicación común, con un riesgo 2 veces mayor de TVP y 4 veces mayor de TEP postoperatoria mortal, en comparación con la población sin cáncer. La ETV se convierte en la causa de una tasa de mortalidad temprana postoperatoria del 10%. El riesgo de ETV depende de factores específicos del paciente, del tumor y del procedimiento quirúrgico, como el tipo y la duración de la anestesia, la edad avanzada del sujeto, la enfermedad residual después de la cirugía, la obesidad, los estadios avanzados de la enfermedad, la inmovilidad prolongada (más de 3 días), y el más importante: antecedente de tromboembolismo3.
Se recomienda realizar tromboprofilaxis durante 7-10 días en los casos de cirugía mayor, siempre que no exista contraindicación, comenzando el tratamiento antes de la intervención. En los casos que la cirugía mayor sea abdominal o pélvica y alto riesgo trombótico (historia previa de ETV, mayores de 60 años, duración de la anestesia superior a 2h, enfermedad en estado avanzado o encamamiento prolongado y obesidad o movilidad reducida); la profilaxis debe mantenerse durante 4 semanas (grado IB)1 (grado 1A)3,5,38,39.
El anticoagulante preferido es la HBPM a dosis profilácticas altas (grado 1A)3,5, con evidencia insuficiente para fondaparinux (grado 2C) o ACOD (grado 2B) como alternativa a la HBPM5.
Los métodos mecánicos no deben usarse en monoterapia a menos que la terapia farmacológica esté contraindicada por alto riesgo de hemorragia, pero pueden agregarse a la terapia farmacológica (grado 2A)1,3,5,40.
El CVC supone un factor de riesgo añadido para la aparición de ETV, especialmente en los primeros meses tras su colocación. Sin embargo, la utilización de HBPM o de AVK no ha demostrado eficacia en la prevención en la ETV sintomática o asintomática, por lo que no se recomienda su uso de forma rutinaria (grado 1A)3,5,11,38. Si se va a colocar un nuevo CVC y existen antecedentes de trombosis, se debe realizar profilaxis con HBPM durante al menos 30 días tras la implantación plantear mantenerla hasta retirarlo, valorando el riesgo hemorrágico y las preferencias del paciente11,41.
¿Cuál es el tratamiento de la enfermedad tromboembólica venosa una vez establecido el proceso oncológico?Los objetivos del tratamiento de la ETV asociado al cáncer son: limitar la extensión del trombo, disminuir el riesgo de recurrencias, disminuir la morbimortalidad y mejorar los síntomas y la calidad de vida.
El tratamiento de la ETV en pacientes con cáncer siempre debe equilibrar el riesgo trombótico con el mayor riesgo de hemorragia por la anticoagulación. Las decisiones de tratamiento deben individualizarse, teniendo en cuenta las posibles consecuencias de la ETV y/o de los episodios hemorrágicos (incluida la mortalidad, el coste socio-económico, la calidad de vida, etc.), así como los valores y las preferencias de los pacientes (fig. 1).
Se debe usar HBPM o ACOD durante un mínimo de 6 meses para tratar la ETV establecida en pacientes con cáncer (grado 1A)1,5.
Tratamiento inicialCorresponde a la primera semana (7-10 días) de tratamiento tras el diagnóstico del TEV. Se recomienda HBPM (grado 1A) o ACOD (grado 1A), principalmente (tabla 5)3,5,42.
Tratamiento de inicio y mantenimiento de la ETV asociada a cáncer según diferentes guías de práctica clínica
| Tratamiento inicial (7-10 días) | Tratamiento mantenimiento (3-6 meses) | |||
|---|---|---|---|---|
| Guías | Elección | Alternativa | Elección | Alternativa |
| ASCO 201938 | HBPM, fondaparinux o rivaroxabán*. | HBPM o ACOD* (edoxabán o rivaroxabán) (grado 1A) durante al menos 6 meses. | AVK | |
| SEOM 20203 | ACOD* (apixabán o rivaroxabán*) o HBPM frente a HNF o fondaparinux. (recomendación débil, evidenciade calidad muy baja) | fondaparinux (grado1B) | HBPM o ACOD* (apixabán, rivaroxabán, edoxabán) durante 6 meses (grado 1A) | |
| ASH 202139 | HBPM (grado 1B) o ACOD (rivaroxabán* o apixabán) (grado 1B) | fondaparinux si TIH HNF si insuficiencia renal grave | ||
| ACCP 202132 | ACOD* (apixabán, edoxabán o rivaroxabán) frente aHBPM (recomendación fuerte, evidencia de calidadmoderada). | apixabán o HBPM en tumores gastrointestinales luminales frente a edoxabán y rivaroxabán. | ACOD (apixabán, edoxabán o rivaroxabán) frente a HBPM (recomendación fuerte, evidencia de calidad moderada). | apixabán o HBPM en tumores gastrointestinales luminales. |
| NCCN37 | ACOD* frente a HBPM | HBPM (dalteparina, categoría 1A) en tumores gastroesofágicos. | ACOD* frente a HBPM | apixabán puede ser más seguro que edoxabán o rivaroxabán en tumores gastroesofágicos (categoría 2B) |
| 2022 ESC Guidelines on cardiooncology1 | ACOD* o HBPM (evidencia IA) | ACOD* o HBPM (grado IA) | ||
| Second consensus document on diagnosis and management of acute deep vein thrombosis 202234 | Se prefiere HBPM a ACOD en pacientes con cáncer, con situaciones clínicas inestables, como recuento bajo de plaquetas, náuseas y vómitos, y un riesgo de interacciones farmacológicas esperadas con la terapia contra el cáncer, así como con las que se someten cirugía que involucra el tracto gastrointestinal superior. | 1.edoxabán y rivaroxabán pueden ser alternativa a la HBPM en pacientes sin cáncer gastrointestinal o urotelial.2.apixabán debe considerarse como una alternativa a la HBPM en pacientes sin cáncer cerebral primario o metastásico o leucemia aguda. | Se prefiere HBPM a ACOD en pacientes con cáncer, con situaciones clínicas inestables, como recuento bajo de plaquetas, náuseas y vómitos, y un riesgo de interaccionesfarmacológicas esperadas con la terapia contra el cáncer, así como con las que se someten a cirugía que involucra el tracto gastrointestinal superior. | 1.edoxabán y rivaroxabán pueden ser alternativa a la HBPM en pacientes sin cáncer gastrointestinal o urotelial.2.apixabán debe considerarse como una alternativa a la HBPM en pacientes sin cáncer cerebral primario o metastásico o leucemia aguda. |
| GUIA ITAC 20225 | HBPM (grado 1A) | 1.rivaroxabán o apixabán (en los primeros 10 días) o edoxabán (iniciado después de al menos 5 días de anticoagulación parenteral) en pacientes sin alto riesgo de hemorragiagastrointestinal o genitourinaria (grado 1A).2.fondaparinux (grado 2D) | HBPM o ACOD* vs AVK (grado 1A). Precaución en FG <30 ml/min, interacciones medicamentosas o trastorno absorción gastrointestinal. | HBPM o ACOD* (grado 1A). |
Corresponde al tratamiento en los primeros 3 a 6 meses3. Los objetivos principales son prevenir las recurrencias y disminuir las complicaciones a largo plazo (síndrome postrombótico, hipertensión pulmonar). Se prefieren las HBPM o ACOD (edoxabán, rivaroxabán o apixabán) a los AVK (grado 1A), con precaución en pacientes con tumores malignos del tracto gastrointestinal, especialmente de la porción superior, ya que los datos disponibles muestran un mayor riesgo de hemorragia en estos tumores con edoxabán y rivaroxabán5,40,42.
Las diferentes recomendaciones de las guías de práctica clínica se pueden ver en la tabla 5.
Tratamiento a largo plazoCorresponde al tratamiento a partir de los 6 meses del evento.
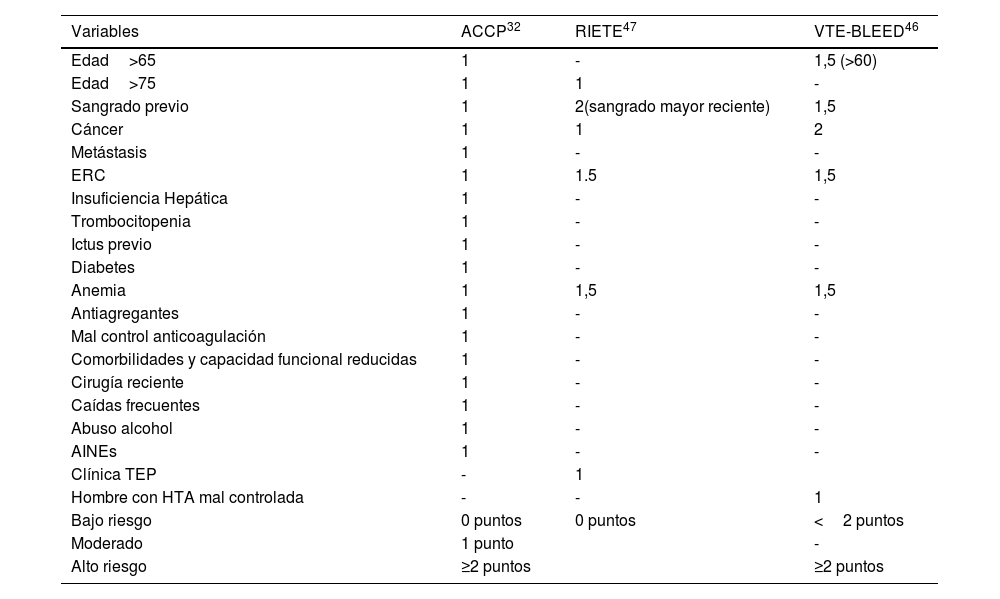
Existe información limitada sobre los riesgos y los beneficios de la anticoagulación más allá de los 6 meses en pacientes con cáncer. La decisión de continuar debe sopesarse con el riesgo de hemorragia, el costo del tratamiento, la terapia oncológica, la calidad y esperanza de vida y las preferencias del paciente5,42,43. La evaluación del riesgo de hemorragia es el paso más complejo. Se han analizado varios modelos predictivos en pacientes con ETV (VTE-BLEED, ACCP, RIETE, HEMORR2HAGES, ATRIA, etc.)44, pero como el impacto de estos modelos no se probó en un estudio de resultados de ETV, no se puede recomendar su uso como entidades independientes para definir la duración óptima del tratamiento.
De esta forma45:
- -
Se recomienda estimar el riesgo de sangrado en el momento del diagnóstico de ETV agudo antes de iniciar el tratamiento anticoagulante.
- -
Se recomienda que la evaluación del riesgo de hemorragia incluya la identificación de la indicación del uso concomitante de inhibidores plaquetarios o fármacos antiinflamatorios no esteroideos (AINE) y evitar su uso, si es posible.
- -
Se sugiere que otros predictores (potencialmente) modificables se identifiquen de manera temprana y específica, en particular, la hipertensión (tabla 6).
Tabla 6.Diferentes modelos de evaluación del riesgo hemorrágico
Variables ACCP32 RIETE47 VTE-BLEED46 Edad>65 1 - 1,5 (>60) Edad>75 1 1 - Sangrado previo 1 2(sangrado mayor reciente) 1,5 Cáncer 1 1 2 Metástasis 1 - - ERC 1 1.5 1,5 Insuficiencia Hepática 1 - - Trombocitopenia 1 - - Ictus previo 1 - - Diabetes 1 - - Anemia 1 1,5 1,5 Antiagregantes 1 - - Mal control anticoagulación 1 - - Comorbilidades y capacidad funcional reducidas 1 - - Cirugía reciente 1 - - Caídas frecuentes 1 - - Abuso alcohol 1 - - AINEs 1 - - Clínica TEP - 1 Hombre con HTA mal controlada - - 1 Bajo riesgo 0 puntos 0 puntos <2 puntos Moderado 1 punto - Alto riesgo ≥2 puntos ≥2 puntos Definiciones: HTA descontrolada: PAS≥140mmHg (VTE-BLEED); anemia: hemoglobina <130g/l (varón) o <120g/l (mujer) (RIETE, VTE-BLEED); insuficiencia renal: creatinina >1,2mg/dl (ACCP), o FG 30-60ml/min (VTE-BLEED); abuso bebidas alcohólicas: consumo semanal ≥8 unidades
- -
Se sugiere que la evaluación del riesgo de sangrado incluya combinar la medición de predictores individuales con el uso de un modelo de predicción validado para respaldar las decisiones de gestión de la anticoagulación. Para ello, identificamos que el Predictive value of venous thromboembolism VTE-BLEED46, el registro Informatizado de Pacientes con Enfermedad Tromboembólica (RIETE score)47 y la tabla de riesgo del de la AmericanCollege of Chest Physiciens (ACCP)32 se encuentran entre los más validados externamente (tabla 6). Se necesitan futuros estudios de validación y de resultados prospectivos para confirmar la utilidad clínica de estos modelos.
Los cánceres gastrointestinales y genitourinarios se asocian con un exceso significativo de riesgo de sangrado en comparación con otros tumores sólidos. La trombocitopenia y la disfunción plaquetaria debidas a neoplasias malignas hematológicas o supresión de la médula ósea pueden exacerbar el sangrado. Otros FR de hemorragia incluyen un IMC bajo y tratamiento con ibrutinib, inhibidores del factor de crecimiento vascular endotelial (VEGFi), cetuximab o bevacizumab1.
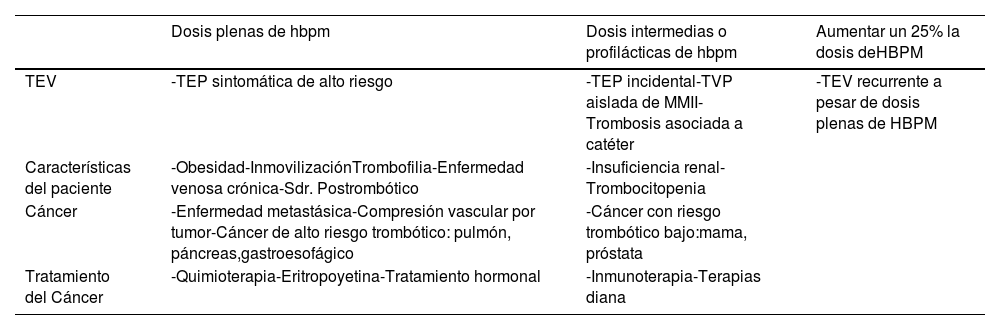
Los datos acerca de la dosis de mantenimiento con HBPM tampoco están establecidos. A este respecto, el consenso de expertos de la Sociedad Española de Medicina Interna (SEMI), Sociedad Española de Oncología Médica (SEOM) y Sociedad Española de Trombosis y hemostasia (SETH) sugiere valorar la dosis más allá de 6 meses en función de las características del paciente (tabla 7)41.
Valoración de la dosis de HBPM más allá de 6 meses en función de las características del paciente
| Dosis plenas de hbpm | Dosis intermedias o profilácticas de hbpm | Aumentar un 25% la dosis deHBPM | |
|---|---|---|---|
| TEV | -TEP sintomática de alto riesgo | -TEP incidental-TVP aislada de MMII-Trombosis asociada a catéter | -TEV recurrente a pesar de dosis plenas de HBPM |
| Características del paciente | -Obesidad-InmovilizaciónTrombofilia-Enfermedad venosa crónica-Sdr. Postrombótico | -Insuficiencia renal-Trombocitopenia | |
| Cáncer | -Enfermedad metastásica-Compresión vascular por tumor-Cáncer de alto riesgo trombótico: pulmón, páncreas,gastroesofágico | -Cáncer con riesgo trombótico bajo:mama, próstata | |
| Tratamiento del Cáncer | -Quimioterapia-Eritropoyetina-Tratamiento hormonal | -Inmunoterapia-Terapias diana |
Tomada de Pachón V et al.41. Para dalteparina, la dosis plena tras el primer mes de tratamiento es 150IU/kg/24h. HBPM: heparina de bajo peso molecular; TEP: tromboembolia pulmonar; TEV: tromboembolismo venoso; TVP: trombosis venosa profunda
Las diferentes recomendaciones de las guías de práctica clínica se exponen en la tabla 6. Hay que tener en cuenta que las restricciones actuales de las autoridades sanitarias limitan el uso de ACOD en pacientes con ETV en España y otros países.
Catéter venoso central y tromboembolismo venosoPara los pacientes con cáncer y TRC se debe considerar la anticoagulación con HBPM o HBPM seguida de AVK, durante un mínimo de 3 meses (nivel IC)1,5, y considerarlo tratamiento indefinido si el catéter no es eliminado y el cáncer sigue activo (evidencia 2B)1,5,41,42. Los ACOD pueden ser una alternativa (evidencia 2C)42.
Para los pacientes con cáncer y TRC que reciben tratamiento anticoagulante, se sugiere mantener el CVC antes que retirarlo (evidencia 2B)1,42. Si se desarrolla una ETV y se deja colocado el CVC, se requiere anticoagulación1,37. Se debe considerar la extracción del catéter cuando no sea necesario, no sea funcional, esté infectado, la anticoagulación esté contraindicada, los síntomas no se resuelvan con la anticoagulación, la trombosis sea de una extremidad o amenace la vida (evidencia 2B)1,36,37,42.
Si ya no se requiere el CVC, se recomienda la anticoagulación durante 5 o 7 días antes de la extracción del CVC, si es factible37.
Cuando el CVC se mantiene después de haber completado de 3 a 6 meses el tratamiento con HBPM debido a un evento de CVC-TVP en un paciente con cáncer, se sugiere prolongar el tratamiento con HBPM utilizando dosis intermedias o profilácticas. El tratamiento debe continuar hasta la extracción del CVC, siempre que el riesgo de hemorragia del paciente no sea alto41.
¿Cómo prevenir la recurrencia de la enfermedad tromboembólica venosa en procesos oncológicos y cuál es su manejo?Tras un episodio de ETV los pacientes con cáncer activo tienen mayor riesgo de recidiva que los pacientes sin ellos, tanto durante el tratamiento como una vez suspendido. A pesar del tratamiento anticoagulante, la recidiva a los 12 meses es hasta 3 veces superior (hazard ratio [HR]: 3,2; intervalo de confianza del 95% [IC 95%]: 1,9-5,4) y duplican el riesgo de sangrado de la población no oncológica (HR: 2,2; IC 95%: 1,2-4,1), aumentando en estadios avanzados de la enfermedad48,49.
Los FR de retrombosis en los pacientes con cáncer se estiman en función de: estadio del tumor (mayor en estadio IV), localización (mayor en caso de cáncer de pulmón y gastrointestinal junto con páncreas, riñón o de origen desconocido), edad (mayor incidencia en pacientes más jóvenes), diagnóstico reciente del proceso neoplásico (menos de 3 meses), tipo de cáncer (más frecuente en adenocarcinoma), trombosis residual y, antes de iniciar el tratamiento, se considera también factor de riesgo la compresión venosa, los tumores hepatobiliares y la presencia de biomarcadores, como el FT elevado (mayor de 65pg./ml), la elevación de la proteína C reactiva de alta sensibilidad (mayor de 75mg/l) o el dímero-D49–51.
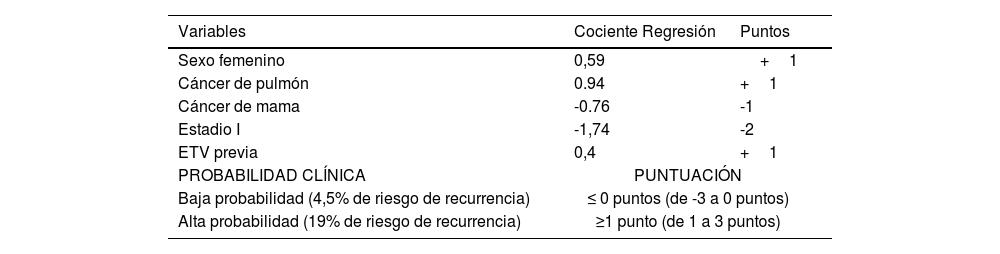
Actualmente existen escalas para la determinación del riesgo de recurrencia e incluso para individualizar el tratamiento más allá de los seis meses en pacientes con enfermedad oncológica. Una mención especial es la escala de Otawa48,49 (tabla 8), que valora de forma específica el riesgo de recurrencia, pero los estudios de validación externa (datos de los ensayos CANTHANOX52 y CLOT53) que utilizan este modelo, son contradictorios concluyendo que se necesitan estudios aleatorizados de validación con una población más diversa, introduciendo nuevos marcadores moleculares para evaluar mejor esta escala o bien crear nuevas escalas que puedan implementarse en la práctica clínica43,49,50.
Riesgo de recurrencia de la ETV en pacientes oncológicos
| Variables | Cociente Regresión | Puntos |
|---|---|---|
| Sexo femenino | 0,59 | +1 |
| Cáncer de pulmón | 0.94 | +1 |
| Cáncer de mama | -0.76 | -1 |
| Estadio I | -1,74 | -2 |
| ETV previa | 0,4 | +1 |
| PROBABILIDAD CLÍNICA | PUNTUACIÓN | |
| Baja probabilidad (4,5% de riesgo de recurrencia) | ≤ 0 puntos (de -3 a 0 puntos) | |
| Alta probabilidad (19% de riesgo de recurrencia) | ≥1 punto (de 1 a 3 puntos) | |
Escala de Otawa. Fuente: adaptada de Becattini C et al.48
Ante una ETV recurrente siempre debemos descartar que haya una dosificación inadecuada del anticoagulante, falta de cumplimiento, interacciones farmacológicas, interrupción temporal por hemorragias o trombocitopenia por heparina. Asimismo, debemos establecer si la recurrencia es por un trombo nuevo o es una trombosis residual.
Centrándonos en los tratamientos empleados se ha obtenido una mayor eficacia de la HBPM comparada con los fármacos AVK, con unas tasas de recurrencias de ETV del 7-10% frente al 10-21% para AVK, sin observarse diferencias significativas en seguridad (sangrado mayor y muerte)49.
A pesar de la relevancia clínica y de la alta incidencia de recurrencia de ETV en el paciente oncológico en la práctica clínica habitual, existe escasa evidencia científica sobre el manejo óptimo de estos pacientes. Las recomendaciones para el tratamiento de la ETV recurrente relacionada con el cáncer en pacientes que ya reciben tratamiento anticoagulante, consisten en ajuste de dosis o inicio de fármacos alternativos, valorando siempre el riesgo hemorrágico.
Con todo ello, las principales guías3,5,32,38,39,50,54, sugieren tratar la retrombosis con el siguiente esquema:
- -
Si el paciente está en tratamiento con dosis de HBPM profilácticas: aumentar a dosis terapéutica ajustada al peso.
- -
Si está con dosis terapéutica de HBPM: aumentar un 25%38,50,54,55 la dosis siempre que el grado de insuficiencia renal lo permita o cambiar a ACOD (grado 2B)3. La guía ACCP incrementar entre el 25-30% la dosis grado 2C, la American Society of Clinical Oncology (ASCO) entre el 20-25%, sin establecer grado de recomendación, al igual que el Consensus on prevention and treatment of cancer-associated thrombosis (CAT) in controversial clinical situations with low levels of evidence, pero con una recomendación fuerte para una evidencia de baja calidad55.
- -
Si está tomando ACOD, cambiar a HBPM o elevar dosis de ACOD si es que se utilizaron dosis infraterapéuticas.
- -
Si se produce recidiva en pacientes que toman AVK con el ratio internacional normalizado (INR) en el rango subterapéutico: se debe añadir HBPM hasta que el INR alcance el rango terapéutico e investigar las posibles causas, como pueden ser las interacciones medicamentosas, el incumplimiento o el aumento de la ingesta de vitamina K, o cambiar a HBPM sola o cambiar a ACOD (recomendación fuerte, evidencia de baja calidad)3,5,32,50,54.
- -
Si se produce recidiva en pacientes con AVK en rango terapéutico: cambiar a HBPM a dosis terapéuticas o a ACOD5 (recomendación fuerte, evidencia de calidad baja)3,32,50,54. Como medida adicional para ajustar la dosis óptima de HBPM se puede medir en suero los niveles de factor anti-Xa, aunque no existe en la actualidad suficiente evidencia para su uso rutinario en la clínica. El tratamiento anticoagulante debe mantenerse mientras el cáncer esté activo o el paciente esté en terapia oncoespecífica (recomendación fuerte, evidencia de baja calidad)32,54.
Se entiende por enfermedad tromboembólica incidental el hallazgo casual de ETV al realizar una prueba complementaria (TC, RM, etc.) por otra indicación durante el diagnóstico y el seguimiento de la enfermedad tumoral. La prevalencia estimada de TEP incidental en los pacientes oncológicos se sitúa entre el 1,9 y el 4,4%32,56. Los FR más relevantes para desarrollar un TEP incidental son edad avanzada, tipo histológico del tumor como los adenocarcinomas, enfermedad metastásica, quimioterapia, cirugía reciente, hospitalización, estado general deteriorado, historia previa de ETV y catéteres venosos centrales56.
La recomendación por parte de las guías de práctica clínica es el tratamiento anticoagulante (HBPM o ACOD) de elección, desde el momento del diagnóstico de la ETV incidental, como si se tratara de un evento sintomático, durante 3 a 6 meses. En casos de trombosis esplácnica incidental las guías recomiendan tratar con anticoagulación si el evento parece agudo, progresa en el tiempo y en aquellos que no sangran activamente o no tienen muy alto riesgo de sangrado1,3,37–39. No hay muchos estudios evaluando la trombosis venosa distal incidental, pero 2 trabajos recientes sobre trombosis venosa distal sintomática en pacientes con cáncer evidencian un riesgo de mortalidad similar a la TVP y alto riesgo de recurrencia de evento tromboembólico, por lo que parece preferible iniciar tratamiento anticoagulante como se sugiere en la guía ACCP 201632.
TrombocitopeniaLa trombocitopenia se define como un recuento de plaquetas por debajo de 100.000/μl57. La terapia antitrombótica en el contexto de la trombocitopenia es un problema común que se observa en hasta el 45% de los pacientes con cáncer.
La guía de la International Society of Thrombosis and Hemostasis (ISTH) recomienda57:
Durante el periodo agudo (30 primeros días desde la ETV):
- 1.
Pacientes con 50.000 o más plaquetas/mm3: Se recomiendan dosis plenas anticoagulantes.
- 2.
Pacientes con menos de 50.000 plaquetas/mm3:
- a.
Alto riesgo trombótico (p. ej., TEP sintomática segmentaria o más proximal, TVP proximal o antecedentes de trombosis recurrente/progresiva): Se sugiere dar dosis terapéuticas de HBPM con soporte de transfusión de plaquetas para mantener el recuento por encima de 40.000-50.000mm3, lo que obliga al ingreso hospitalario (recomendación fuerte, evidencia calidad débil).
- b.
Menor riesgo trombótico (p. ej., TVP distal, TEP sub-segmentaria incidental, TRC u otras características de menor riesgo):
- i.
25.000-50.000mm3: se sugiere reducir dosis terapéuticas de HBPM al 50% o usar dosis profilácticas.
- ii.
Menor de 25.000 plaquetas/mm3: se sugiere detener temporalmente la anticoagulación.
- iii.
Se recomienda reanudar la anticoagulación a dosis plenas cuando el recuento sea mayor de 50.000mm3 sin trasfusión de soporte ni otras contraindicaciones.
Durante el periodo subagudo (más de 30 días del evento): se debe considerar reducir o modificar la dosis de anticoagulación para reducir el riesgo de hemorragia y evitar una carga transfusional:
- 1.
25.000-50.000mm3: se sugiere reducir dosis terapéuticas de HBPM al 50% o usar dosis profilácticas.
- 2.
Menos de 25.000mm3: considerar suspender temporalmente la anticoagulación.
- 3.
En ciertos pacientes con bajo riesgo de trombosis recurrente puede ser razonable suspender la anticoagulación durante todo el período de trombocitopenia (recuento de plaquetas menor de 50.000mm3).
- 4.
El anticoagulante de elección en pacientes con CAT y trombocitopenia sería la HBPM. Heparina no fraccionada es la alternativa o los ACOD si el recuento plaquetario es mayor de 50.000mm3.
Se recomienda realizar un recuento plaquetario antes del comienzo del tratamiento con heparina, y monitorizar las plaquetas en las semanas posteriores.
HemorragiaLas hemorragias mayores pueden suceder entre el 3-8% de los pacientes con eventos tromboembólicos en tratamiento anticoagulante durante 3 a 6 meses. Debemos tener en cuenta que la hemorragia clínicamente significativa se asocia con una supervivencia reducida. Los factores que aumentan el riesgo de sangrado son: inmovilidad, metástasis, sangrado reciente, edad avanzada o fallo renal (aclaramiento de creatinina menor de 30ml/min)36:
- •
Si se trata de un sangrado menor57 (epistaxis), se recomienda mantener la anticoagulación y las medidas van encaminadas a resolver el sangrado.
- •
Si se trata de un sangrado mayor57, que amenaza la vida del paciente, se aconseja derivar al hospital.
- •
Si el paciente presenta un alto riesgo de recurrencia del evento tromboembólico (trombosis aguda o subaguda), se recomienda derivación hospitalaria.
- •
Una vez que el sangrado se haya resuelto y el riesgo haya desaparecido, se debe reanudar la anticoagulación (se recomienda dentro del primer mes), valorando la reducción de dosis.
- •
Si la causa permanece, deberemos individualizar cada caso y ajustar la dosis.
La prevalencia de la insuficiencia renal en pacientes con cáncer se estima en torno al 12%, alcanzando el 23% en aquellos mayores de 75 años
La mayoría de los fármacos anticoagulantes se eliminan por vía renal, existiendo diferencias en su bioacumulación dependiendo de la clasificación de la insuficiencia renal55.
- a)
Insuficiencia renal estadios 1 a 3 (filtrado glomerular [FG] mayor de 30ml/min): no es necesario modificar dosis anticoagulante.
- b)
Insuficiencia renal estadio 4 (FG: 15-30ml/min): se sugiere el uso de HBPM ajustada a la concentración de anti-Xa para el tratamiento de la ETV establecida seguida de AVK tempranos (posible desde el primer día)38.
- c)
Insuficiencia renal estadio 5: anticoagulación no recomendada.
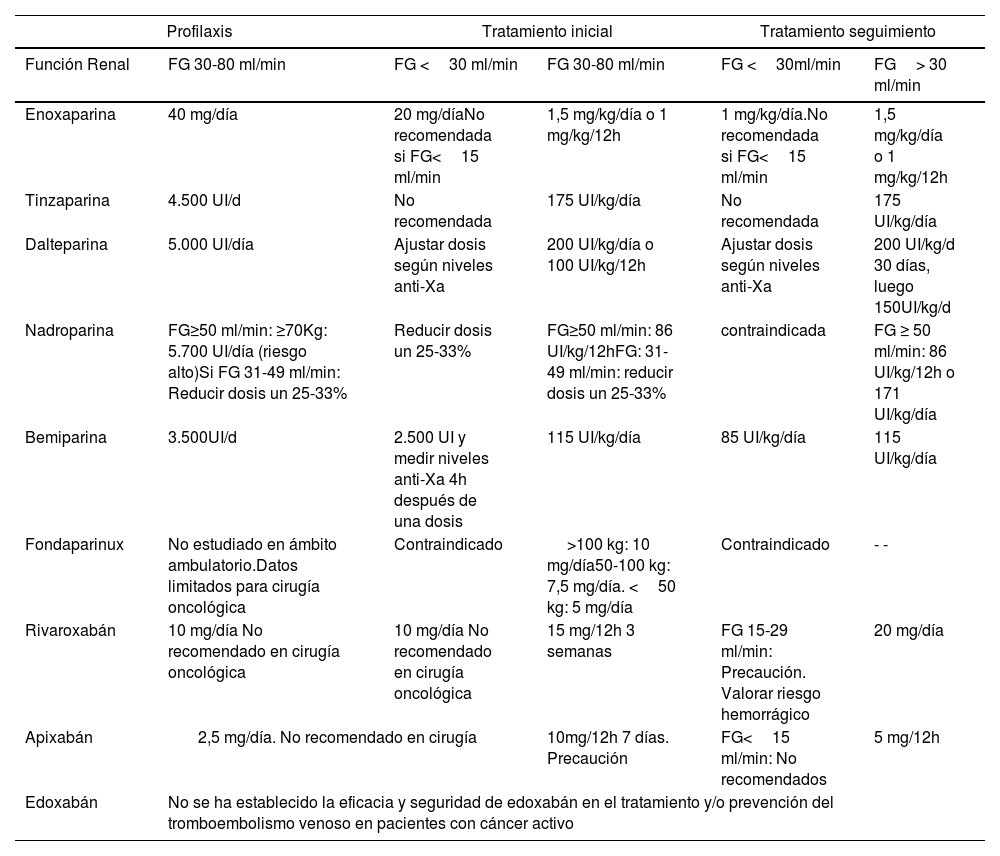
Es preferible utilizar una HBPM que muestre una eliminación dependiente del riñón, pero que permita una titulación de la dosis que pueda medirse en función de la actividad anti-Xa. Las HBPM no requieren ajuste de dosis para pacientes con FG mayor de 30ml/min, mientras que con FG de 15-30ml/min se recomiendan ajustes de dosis para algunas heparinas, así como retirarlas por completo con FG menor de 15ml/min. La dosificación recomendada de los diferentes anticoagulantes empleados en el tratamiento de la ETV en pacientes con cáncer, según función renal, basadas en sus fichas técnicas (tabla 9).
Dosis de HBPM, fondaparinux y ACOD recomendadas en el tratamiento de la enfermedad tromboembólica venosa en pacientes con cáncer, según función renal y duración del tratamiento, basadas en sus fichas técnicas
| Profilaxis | Tratamiento inicial | Tratamiento seguimiento | |||
|---|---|---|---|---|---|
| Función Renal | FG 30-80 ml/min | FG <30 ml/min | FG 30-80 ml/min | FG <30ml/min | FG> 30 ml/min |
| Enoxaparina | 40 mg/día | 20 mg/díaNo recomendada si FG<15 ml/min | 1,5 mg/kg/día o 1 mg/kg/12h | 1 mg/kg/día.No recomendada si FG<15 ml/min | 1,5 mg/kg/día o 1 mg/kg/12h |
| Tinzaparina | 4.500 UI/d | No recomendada | 175 UI/kg/día | No recomendada | 175 UI/kg/día |
| Dalteparina | 5.000 UI/día | Ajustar dosis según niveles anti-Xa | 200 UI/kg/día o 100 UI/kg/12h | Ajustar dosis según niveles anti-Xa | 200 UI/kg/d 30 días, luego 150UI/kg/d |
| Nadroparina | FG≥50 ml/min: ≥70Kg: 5.700 UI/día (riesgo alto)Si FG 31-49 ml/min: Reducir dosis un 25-33% | Reducir dosis un 25-33% | FG≥50 ml/min: 86 UI/kg/12hFG: 31-49 ml/min: reducir dosis un 25-33% | contraindicada | FG ≥ 50 ml/min: 86 UI/kg/12h o 171 UI/kg/día |
| Bemiparina | 3.500UI/d | 2.500 UI y medir niveles anti-Xa 4h después de una dosis | 115 UI/kg/día | 85 UI/kg/día | 115 UI/kg/día |
| Fondaparinux | No estudiado en ámbito ambulatorio.Datos limitados para cirugía oncológica | Contraindicado | >100 kg: 10 mg/día50-100 kg: 7,5 mg/día. <50 kg: 5 mg/día | Contraindicado | - - |
| Rivaroxabán | 10 mg/día No recomendado en cirugía oncológica | 10 mg/día No recomendado en cirugía oncológica | 15 mg/12h 3 semanas | FG 15-29 ml/min: Precaución. Valorar riesgo hemorrágico | 20 mg/día |
| Apixabán | 2,5 mg/día. No recomendado en cirugía | 10mg/12h 7 días. Precaución | FG<15 ml/min: No recomendados | 5 mg/12h | |
| Edoxabán | No se ha establecido la eficacia y seguridad de edoxabán en el tratamiento y/o prevención del tromboembolismo venoso en pacientes con cáncer activo | ||||
Fuente: tomada de Falanga A et al.58. ERC: enfermedad renal crónica; FG: filtrado glomerular.
La edad es un FR para desarrollar ETV, de modo que los mayores de 85 años tienen 100 veces más probabilidad de sufrirla que los menores de 45, y el 70% de todos los eventos tromboembólicos venosos ocurren en los mayores de 70 años. La edad da lugar a modificaciones en la composición corporal, como aumento de la grasa, pérdida de masa magra, disminución del porcentaje de agua, reducción de la albúmina sérica, reducción de la absorción de vitamina K con merma de la capacidad para sintetizar factores de coagulación, y disminución del metabolismo hepático, lo que altera la farmacodinámica de los tratamientos. Diversos FR se asocian al desarrollo de hemorragia. Entre ellos, la edad mayor de 75 años y el cáncer metastásico son FR independientes para sufrir hemorragia durante los primeros 3 meses de anticoagulación en el tratamiento de la ETV, quedando incluidos en la escala RIETE de predicción de riesgo de sangrado59.
Las guías clínicas de tratamiento de la ETV no hacen recomendaciones específicas para el tratamiento de los pacientes con edad avanzada y cáncer. Lo más importante es minimizar las circunstancias que favorezcan la hemorragia, como evitar prolongar innecesariamente el tiempo de tratamiento, evitar el uso concomitante de fármacos antiagregantes o de AINE, prevenir las caídas, vigilar la función renal y el número de plaquetas. Los estudios publicados indican que el uso de ACOD puede ser seguro y no inferior en eficacia al tratamiento estándar con HBPM/AVK en los pacientes de edad avanzada38,60,61.
Alteraciones en el pesoLas HBPM se dosifican ajustadas al peso, por lo que pacientes con pesos extremos pueden tener riesgo de sobre o infra dosificación. Los estudios sugieren que en obesos grado I-II (IMC: 30-40 kg/m2) es seguro el uso de dosis habitual calculada por peso, considerando monitorizar anti-Xa en función del riesgo del paciente. En casos de obesidad mórbida-extrema, grado III-IV (IMC mayor de 40-50kg/m2), la evidencia es muy escasa y se recomienda monitorizar actividad anti-Xa38.
El uso en dosis fijas de los ACOD puede conllevar una dosificación inadecuada en obesos. Dada la escasa evidencia en pesos extremos y que los estudios farmacocinéticos sugieren una disminución de la concentración pico y de la vida media, la guía de la ISTH recomienda su uso en dosis habitual hasta IMC 40kg/m2 y peso menor o igual a 120kg, y se desaconseja su uso en IMC mayor de 40kg/m2 y peso mayor de 120kg. Respecto al bajo peso, solo precisa ajuste de dosis en ETV el edoxabán, recomendándose 30mg/cada 24h para peso menor o igual de 60kg38.
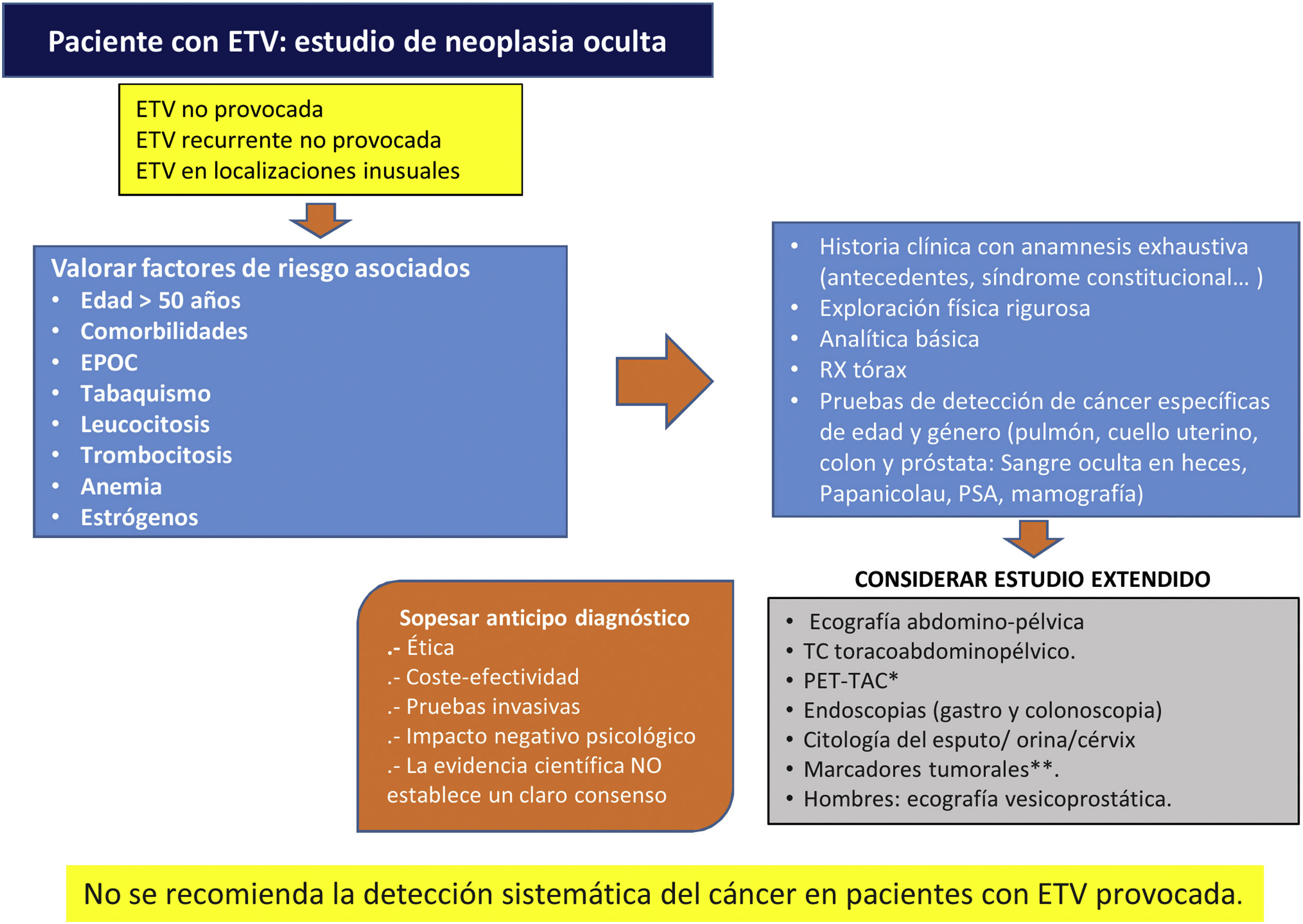
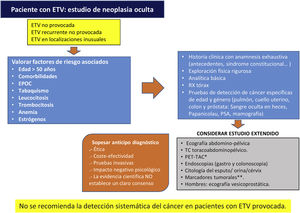
Cáncer ocultoSe estima que alrededor del 2-12% de los casos el episodio tromboembólico es la primera manifestación de un cáncer oculto, diagnosticado en ese momento o con posterioridad, lo que ofrece, en teoría, una oportunidad para su diagnóstico y tratamiento precoces. Sin embargo, no se ha observado el beneficio del diagnóstico precoz en términos globales de supervivencia, y hay una ausencia de evidencia con suficiente potencia estadística sobre el impacto de la mortalidad por cáncer62,63. Por todo ello los autores del presente trabajo, tras haber realizado una revisión bibliográfica acerca del cribado de neoplasia oculta en pacientes con ETV idiopática, consideran elaborar este algoritmo como aproximación, ya que los estudios publicados al respecto, no establecen un claro consenso (fig. 2)62–64.
Algoritmo del cribado de neoplasia oculta en pacientes con ETV, creación propia. ETV: enfermedad tromboembolica; PSA: antígeno prostático especifico; VPN: valor predictivo negativo; TAC: tomografía axial computerizada. PET-TAC: tomografía por emisión de protones. Fuente: tomado de D’Astous J y Carrier M64, Casco Aguilar C et al.62, Delluc A. et al.63
*PET-TAC: prueba que presenta elevada sensibilidad y alto VPN para la detección de tumor oculto, pero con baja especificidad creando falsos positivos que serían sometidos a exploraciones innecesarias.
**El despistaje a través de marcadores tumorales, demuestra un elevado VPN (en torno al 75%), pero escasa sensibilidad y especificidad, además de que no se cuenta con marcadores adecuados que identifiquen ciertos tipos de tumores que provocan con frecuencia ETV, tales como los hematológicos y glioblastomas. No obstante, se trata de una prueba poco invasiva que puede aportar información significativa, evitando exploraciones adicionales molestas para los pacientes, clasificando adecuadamente aquellos con ETV idiopática y baja incidencia de neoplasia.
Adicionalmente, tampoco queda demostrado un claro beneficio clínico del estudio extendido comparado con el limitado (historia clínica, exploración física, pruebas de laboratorio básico y de imagen torácicas) para el diagnóstico de TEP en pacientes con ETV. Sugiriendo no realizar estudio extendido de cáncer oculto en pacientes con TEP idiopático64.
Recomendaciones- •
Recomendamos la estrecha vigilancia del paciente ante la posible aparición de una ETV, tanto si es la primera manifestación de un tumor o como inicio posterior, dada su alta incidencia.
- •
Se recomienda la valoración de los factores que contribuyen a aumentar el riesgo de ETV en pacientes oncológicos en relación con las características específicas del paciente, del tumor y de los tratamientos.
- •
Se recomienda el uso de modelos validados, como el de Khorana, que nos permiten el cálculo del riesgo de ETV en pacientes oncológicos ambulatorios, en función de sus FR.
- •
Se recomienda utilizar las escalas de predicción clínica para TVP y TEP antes de solicitar una prueba diagnóstica de ETV.
- •
Se recomienda solicitar las pruebas fundamentales de imagen para el diagnóstico de la ETV tras una sospecha clínica y valoración de la probabilidad pre-test mediante escalas validadas para la ETV (Wells y Ginebra).
- •
Se recomienda la determinación del dímero-D porque un resultado negativo por debajo de 0,5μg/ml asociado a una baja probabilidad clínica evitaría pruebas de imagen y descartaría una TVP.
- •
Se recomienda utilizar la profilaxis primaria de forma individualizada y no de forma rutinaria en pacientes con cáncer asociado a trombosis.
- •
Se recomienda el uso de la HBPM, en general, para la profilaxis de la ETV, aunque actualmente se considera a los ACOD como una alternativa eficaz en determinados pacientes aunque todavía no está la indicación en ficha técnica.
- •
Se recomienda la monitorización del recuento plaquetario en los pacientes que reciben heparina para el diagnóstico precoz de la trombocitopenia.
- •
Se recomienda individualizar el tratamiento anticoagulante equilibrando el riesgo trombótico con el mayor riesgo de hemorragia, teniendo en cuenta las posibles consecuencias de la ETV y/o de los episodios hemorrágicos (incluida la mortalidad, el coste socio-económico, la calidad de vida, etc.), así como los valores y las preferencias de los pacientes.
- •
No hay una escala validada para evaluar el riesgo hemorrágico en los pacientes con CAT, debiendo combinar la valoración de los FR para el sangrado, y un modelo predictivo de riesgo de hemorragia para la toma de decisiones.
- •
Debido a la alta incidencia de complicaciones asociadas a la TVS, se recomienda un estrecho seguimiento de estos pacientes al menos durante los 3 meses posteriores al diagnóstico.
- •
Se recomienda utilizar HBPM frente a AVK por una mayor eficacia en el tratamiento de las retrombosis, sin diferencia en seguridad.
- •
En general, ante la aparición de una retrombosis en un paciente que ya está en tratamiento, se recomienda modificar la dosis de HBPM o cambiar de anticoagulante.
- •
En cuanto al abordaje de la ETV durante procesos oncológicos en poblaciones especiales:
- ∘
Se recomienda el tratamiento anticoagulante (HBPM de elección) desde el momento del diagnóstico de la ETV incidental como si se tratara de un evento sintomático y durante 3 a 6 meses como mínimo.
- ∘
Se recomienda el tratamiento anticoagulante en casos de trombosis asplácnica incidental, si el evento parece agudo y progresa en el tiempo.
- ∘
Se recomienda valorar la función renal antes de prescribir un anticoagulante y confrontar las características del paciente con las farmacodinámicas antes de la elección.
- ∘
Se recomienda consultar la ficha técnica del fármaco anticoagulante para calcular la dosis en los pacientes con obesidad.
- ∘
La edad avanzada no es criterio de cese del tratamiento anticoagulante según las características del paciente.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, comercial o entidades sin ánimo de lucro.
Conflicto de interesesAna Piera ha declarado haber recibido honorario por concepto de docencia, investigación, publicaciones de los laboratorios Novo Nordisk, Novartis, MSD, Ferrer, Bayer, Sanofi-Aventis, AstraZeneca, Esteve y Boehringer Ingelheim. Mylan Olga García declara haber recibido honorarios en concepto de docencia en taller y cursos por Sanofi, Viatris y Servier. El resto de autores declaran no tener ningún conflicto de intereses.
Aguado Castaño, Ana Carlota. Centro de Salud Parque Lo Morant. Alicante.
Aicart Bort, María Dolores. Médico jubilado.
Babiano Fernández, Miguel Ángel. Centro de Salud Argamasilla de Calatrava. Ciudad Real.
Bonany Pagés, María Antonia. CAP Ernest Lluch. ABS Figueres. Girona.
Caballer Rodilla, Julia. Centro de Salud Algete. Madrid.
Cabrera Ferriols, María Ángeles. Centro de Salud San Vicente del Raspeig I. Alicante.
Carrasco Carrasco, J. Eduardo. Centro de Salud de Abarán. Murcia.
Frías Vargas, Manuel. Centro de Salud Comillas. Madrid.
Fuertes Domínguez, Diana. Centro de Salud Cervera de Pisuerga. Palencia.
García Lerín, Aurora. Centro de Salud, Almendrales. Madrid.
García Vallejo, Olga. Centro de Salud Comillas. Madrid.
Gil Gil, Inés. Centro de Salud Vielha. Lleida.
Lahera García, Ana. Hospital Universitario de Getafe. Madrid.
López Téllez, Antonio. Centro de Salud Puerta Blanca. Málaga.
Lozano Bouzón, Víctor Manuel. Hospital Universitario de Getafe. Madrid.
Padilla Sáez, Alicia. Centro de Salud San Vicente del Raspeig I. Alicante.
Parra Valderrama, Adriana. UGC La Lobilla. Estepona. Málaga.
Peiró Morant, Juan. Centro de Salud Ponent. Islas Baleares.
Pérez Vázquez, Estrella. Centro de Salud Vielha. Lleida.
Piera Carbonell, Ana. Centro de Salud Luanco-Gozón, Asturias.
Pietrosanto, Teresa. Centro de Salud San Vicente del Raspeig I. Alicante.
Ramírez Torres, José Manuel. Centro de Salud Puerta Blanca. Málaga.
Vázquez Gómez, Natividad. Centro de Salud Auxiliar Moncófar. Castellón.