Analizar la relevancia clínica de las notificaciones de reacciones adversas y, dentro del programa de notificación espontánea, comparar dicha relevancia en las notificaciones recibidas mediante tarjeta amarilla (TA) y OMI-AP.
Material y métodoLas notificaciones de sospechas de reacciones adversas recibidas entre los años 1998 y 2007 se clasificaron en: 1) espontáneas de profesionales sanitarios; 2) espontáneas de industrias farmacéuticas; 3) casos publicados, y 4) estudios poscomercialización. Del primer grupo se seleccionaron las procedentes de atención primaria, clasificándolas según el formulario (TA u OMI-AP) y analizando su relevancia clínica. Se consideraron clínicamente relevantes las notificaciones que cumplían alguno de los siguientes criterios: 1) principio activo nuevo implicado (<5 años en el mercado); 2) reacción adversa notificada grave o desconocida. Se estudió la evolución anual de las notificaciones totales y relevantes.
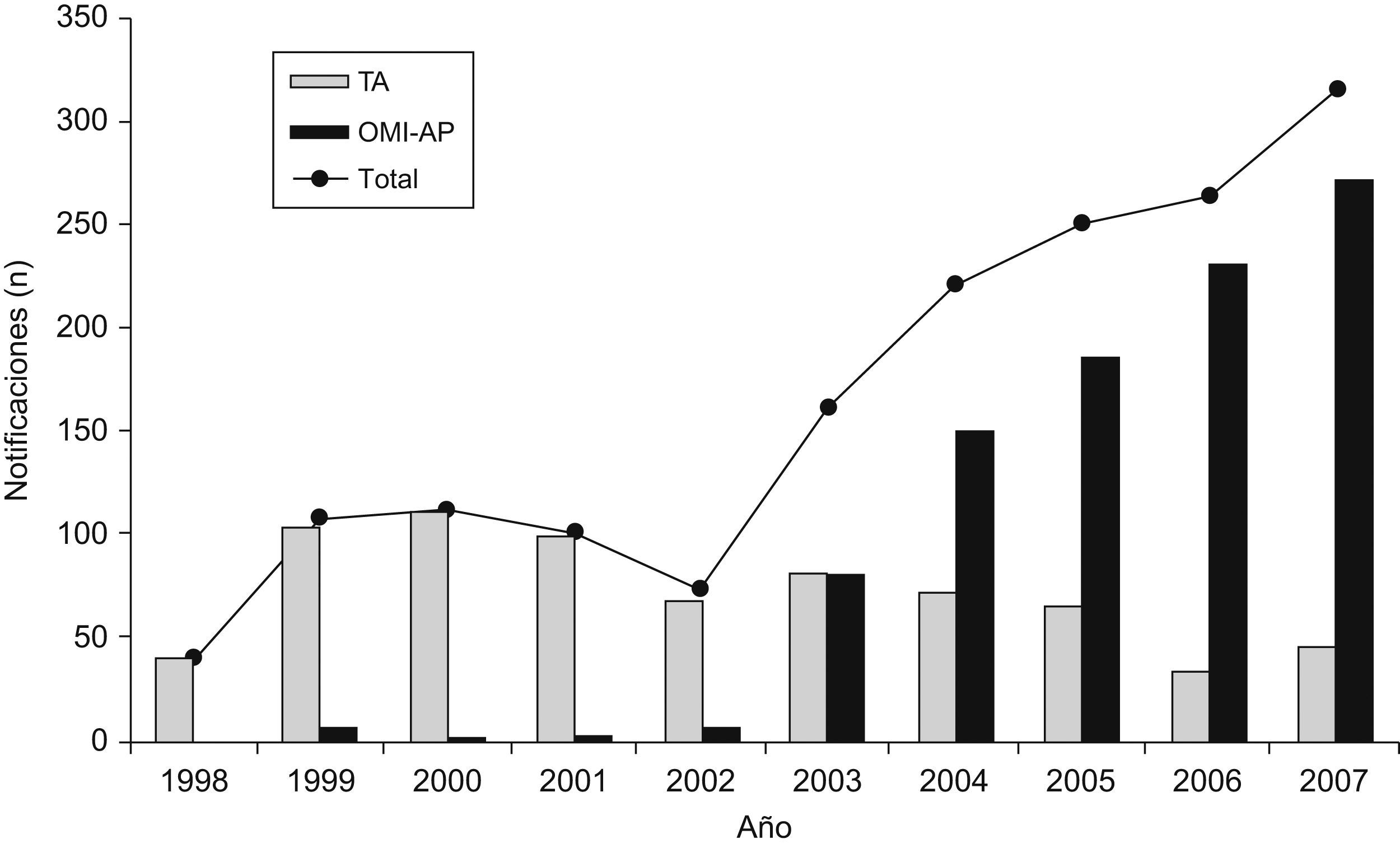
ResultadosSe obtuvieron 3.150 notificaciones, de las cuales 1.651 eran espontáneas procedentes de médicos de origen extrahospitalario y mostraban una evolución anual en aumento. Al analizar separadamente los 2 formularios se observó un progresivo incremento de la notificación a través de OMI-AP, que además incluía un aumento, aunque menor, de la notificación de casos relevantes. Simultáneamente disminuyó la notificación por TA, que mantiene su porcentaje de notificaciones relevantes.
ConclusiónEn Asturias, la aceptación del formulario de OMI-AP ha facilitado la notificación de reacciones adversas. Debemos seguir trabajando en sistemas automatizados de recogida de la información para obtener resultados más eficientes en farmacovigilancia.
To analyze the clinical relevance of the adverse reactions reports and to compare this relevance with those sent by yellow card (YC) versus OMI-AP formularies within the Spontaneous Reporting Program.
Material and methodReports of suspected adverse reactions received from 1998 to 2007 were classified into one of the following groups: 1) spontaneous from health professionals, 2) spontaneous from drug companies, 3) published cases, 4) post-marketing studies. In regards to the first group, we selected those sent from primary health care and studied their clinical relevance according to the formulary used (YC or OMI-AP). Reports that fulfilled at least one of the following criteria were considered relevant: 1) new drug involved (<5 years in the market), 2) serious or unknown adverse reaction reported. The annual evolution of the relevant and total reports was studied.
ResultsOut of the 3150 reports analyzed, 1651 were spontaneous from primary health care physicians and showed an increased annual evolution. The separate analysis of the 2 formularies showed a progressive increase in the total reports through the OMI-AP form that included a lower increase in the relevant reports. Simultaneously, the total number of reports received by YC decreased, although the percentage of relevant reports sent with this formulary was maintained.
ConclusionIn Asturias, the acceptance of the OMI-AP form has made reporting of adverse reactions easier. We should continue working with automatized systems to collect information in order to obtain more efficient results in Pharmacovigilance.
El análisis de la seguridad de un medicamento no finaliza con su comercialización, sino que es necesario estudiar las reacciones adversas, especialmente en los primeros años en el mercado, para caracterizar el perfil de seguridad del nuevo medicamento en la práctica clínica1. En España, el principal sistema de recogida de información sobre reacciones adversas es el «sistema de notificación espontánea»2. Las sospechas de reacciones adversas a medicamentos son notificadas por los profesionales sanitarios y la industria farmacéutica a los centros autonómicos de farmacovigilancia3, que codifican, evalúan y registran estas sospechas de reacciones adversas en Farmacovigilancia Española Datos de Reacciones Adversas (FEDRA), la base de datos del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H). Se incluyen también en FEDRA las notificaciones de reacciones adversas procedentes de estudios poscomercialización y casos clínicos de reacciones adversas publicadas en la literatura médica4.
El sistema de notificación espontánea utiliza como formulario oficial la «tarjeta amarilla» (TA). En 1999 se implantó en muchas comunidades autónomas, incluida Asturias, el programa informático para el registro de historias clínicas en atención primaria (AP) OMI-AP, que incluye la posibilidad de crear un episodio con código CIAP A85 asociado a descripciones como «alergia fármacos», «efecto adverso fármaco dosis correcta». En el momento de generarlo se le otorga al profesional la posibilidad de rellenar un formulario que recoge los datos de manera similar a la TA. En la actualidad no existe la posibilidad de transmitir directamente estos datos vía electrónica desde OMI-AP a los centros de farmacovigilancia, pero es posible imprimirlos y enviarlos por correo ordinario, ya que los centros de farmacovigilancia aceptan estos impresos como formularios de notificación de reacciones adversas.
La ley de garantías y uso racional del medicamento5 establece la obligatoriedad para profesionales sanitarios e industria farmacéutica, de notificar al SEFV-H todas las reacciones adversas de las que tengan conocimiento. Se consideran de especial relevancia clínica aquellas que afectan a medicamentos de reciente comercialización, así como las graves e inesperadas asociadas a cualquier medicamento6. El objetivo de este trabajo fue analizar la relevancia clínica de las notificaciones de reacciones adversas recibidas en el centro de farmacovigilancia de Asturias, desde su creación en 1998 y, dentro del programa de notificación espontánea, comparar dicha relevancia en las notificaciones recibidas mediante TA y OMI-AP.
Material y metodosSe seleccionaron las notificaciones registradas en FEDRA 2.0 con el código de localización 03 (Asturias), clasificándolas por años, de acuerdo con la fecha de entrada en el centro de farmacovigilancia, desde 1998 hasta 2007. Para cada año, las notificaciones obtenidas se subdividieron en: 1) espontáneas de profesionales sanitarios (TA u OMI-AP), 2) espontáneas de industrias farmacéuticas, 3) revisiones bibliográficas, 4) estudios poscomercialización. En el caso de que una notificación procediera de más de una fuente, se asignó solo a una de ellas, utilizando el orden de preferencia descrito en la enumeración anterior. A continuación, de las notificaciones espontáneas de profesionales sanitarios, se extrajeron las enviadas por un médico con origen extrahospitalario. Estas notificaciones de AP se dividieron en: TA Y OMI-AP. Las notificaciones recibidas con ambos formularios se consideraron en el grupo de OMI-AP.
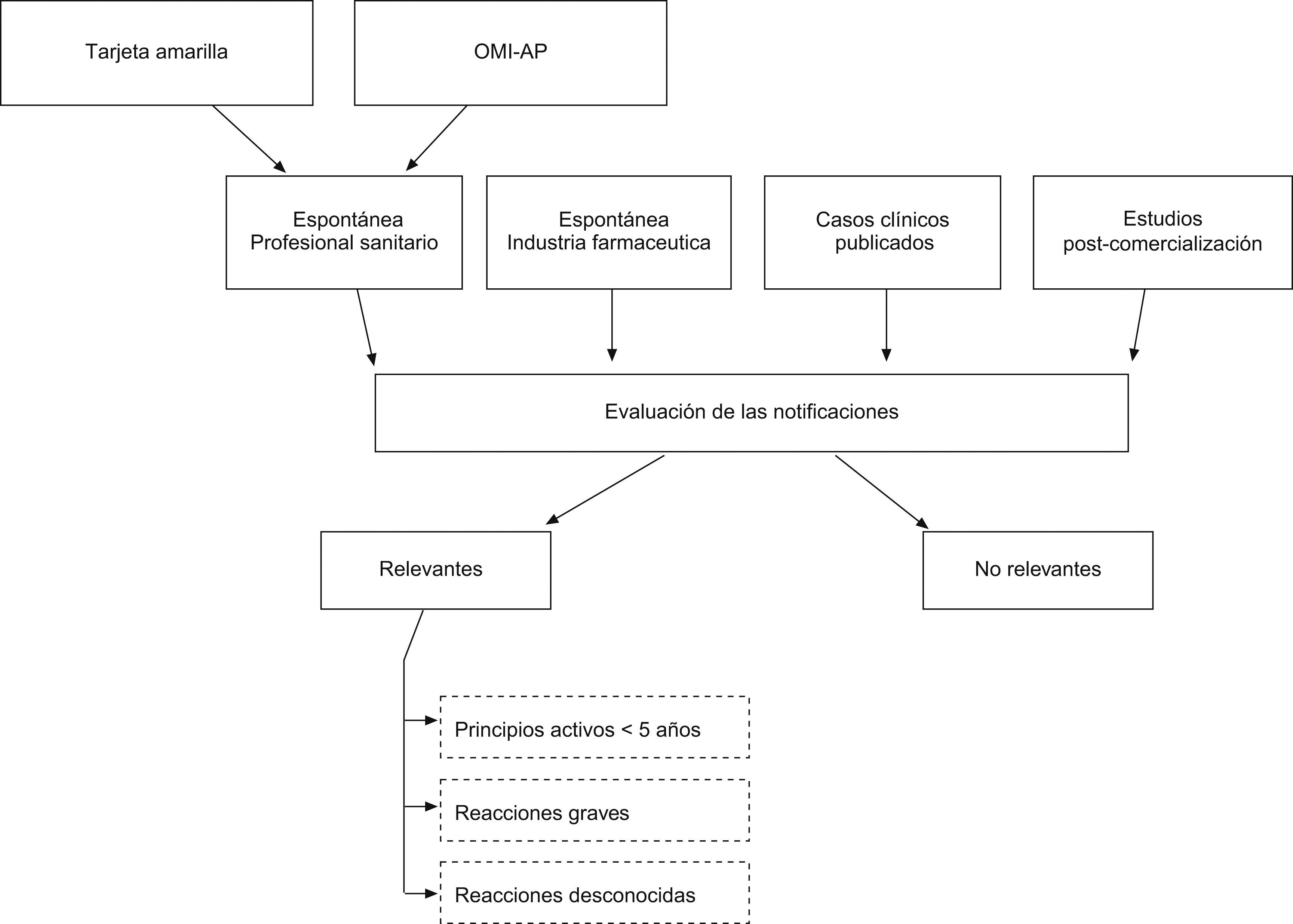
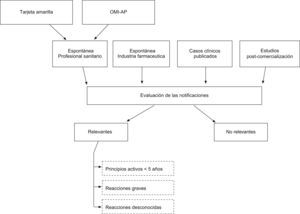
De todas las notificaciones procedentes de AP se seleccionaron las que cumplían alguno de los siguientes criterios: 1) El medicamento sospechoso asociado a la reacción adversa incluía, al menos 1 principio activo autorizado, como máximo 5 años antes del año de entrada de la notificación en el centro de farmacovigilancia. Para establecer este criterio se utilizaron las fechas de autorización de comercialización de los medicamentos, disponibles en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (www.aemps.es); 2) La reacción adversa había sido evaluada como grave, de acuerdo con los criterios de clasificación de la Unión Europea7, y 3) La reacción adversa había sido valorada como desconocida o de conocimiento ocasional, por no estar recogida en la ficha técnica del medicamento y no encontrarse referida en la literatura médica7. Cualquier notificación que cumpliera al menos uno de estos criterios se consideró una notificación relevante. El manejo de los datos y los cálculos estadísticos se realizaron con el programa estadístico «R»8. En la figura 1 se presenta un esquema general del estudio.
Esquema general del estudio. Estudio descriptivo de evaluación de las notificaciones de reacciones adversas recibidas en el centro de farmacovigilancia de Asturias procedentes de atención primaria. OMI-AP: Programa informático para el registro de historias clínicas electrónicas en atención primaria.
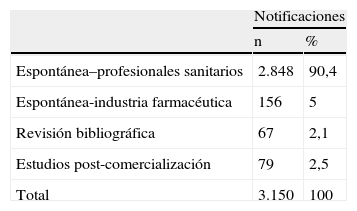
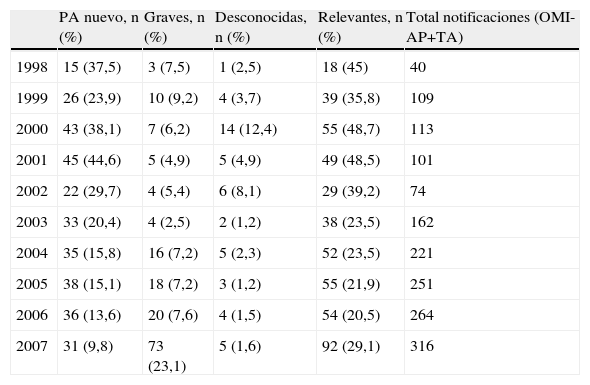
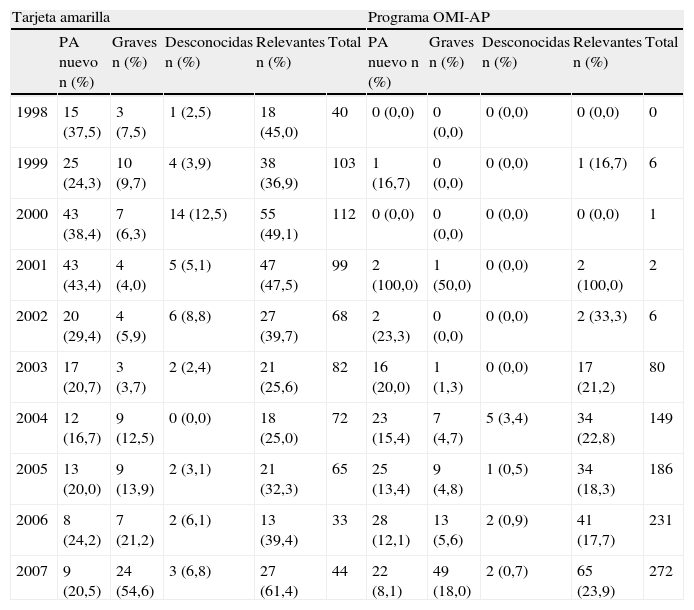
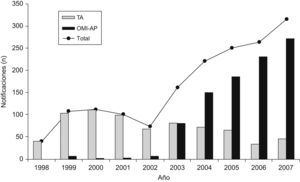
En el centro de farmacovigilancia de Asturias recibimos un total de 3.150 notificaciones entre los años 1998–2007. En la tabla 1 se observa la distribución, según el tipo de notificación. De las 2848 notificaciones espontáneas de profesionales sanitarios 1651 procedían de AP. La distribución de estas notificaciones a lo largo de los años se muestra en la figura 2, observándose un incremento cuantitativo global, debido al aumento de la notificación con el formulario de OMI-AP. La tabla 2 muestra la distribución de las notificaciones procedentes de AP según la novedad del principio activo, gravedad y conocimiento previo. En los 10 años analizados el número de notificaciones asociadas a principios activos nuevos muestra valores similares, aunque su porcentaje se va reduciendo. Las notificaciones graves aumentan ligeramente en frecuencia, mostrando una tendencia equiparable al total de notificaciones. El número de notificaciones desconocidas es muy bajo y, en porcentaje, tiende a descender. Analizando en conjunto estos 3 parámetros se observa una tendencia al alza del número de notificaciones relevantes a lo largo de los años cuyo porcentaje es, sin embargo, inferior al aumento global del número de notificaciones procedentes de AP. La tabla 3 presenta desglosados los datos de AP para TA y OMI-AP. En la actualidad la notificación procedente de AP se recibe mayoritariamente a través de OMI-AP, que además muestra una tendencia creciente a la notificación de casos relevantes. Al mismo tiempo, las notificaciones por TA procedentes de AP han ido disminuyendo, aunque se mantiene el porcentaje de notificaciones relevantes.
Distribución de las notificaciones recibidas desde atención primaria según criterio de relevancia
| PA nuevo, n (%) | Graves, n (%) | Desconocidas, n (%) | Relevantes, n (%) | Total notificaciones (OMI-AP+TA) | |
| 1998 | 15 (37,5) | 3 (7,5) | 1 (2,5) | 18 (45) | 40 |
| 1999 | 26 (23,9) | 10 (9,2) | 4 (3,7) | 39 (35,8) | 109 |
| 2000 | 43 (38,1) | 7 (6,2) | 14 (12,4) | 55 (48,7) | 113 |
| 2001 | 45 (44,6) | 5 (4,9) | 5 (4,9) | 49 (48,5) | 101 |
| 2002 | 22 (29,7) | 4 (5,4) | 6 (8,1) | 29 (39,2) | 74 |
| 2003 | 33 (20,4) | 4 (2,5) | 2 (1,2) | 38 (23,5) | 162 |
| 2004 | 35 (15,8) | 16 (7,2) | 5 (2,3) | 52 (23,5) | 221 |
| 2005 | 38 (15,1) | 18 (7,2) | 3 (1,2) | 55 (21,9) | 251 |
| 2006 | 36 (13,6) | 20 (7,6) | 4 (1,5) | 54 (20,5) | 264 |
| 2007 | 31 (9,8) | 73 (23,1) | 5 (1,6) | 92 (29,1) | 316 |
OMI-AP: programa informático para el registro de historias clínicas electrónicas en atención primaria; PA: principio activo;. TA: tarjeta amarilla.
Relevancia clínica de las notificaciones recibidas por TA y OMI-AP
| Tarjeta amarilla | Programa OMI-AP | |||||||||
| PA nuevo n (%) | Graves n (%) | Desconocidas n (%) | Relevantes n (%) | Total | PA nuevo n (%) | Graves n (%) | Desconocidas n (%) | Relevantes n (%) | Total | |
| 1998 | 15 (37,5) | 3 (7,5) | 1 (2,5) | 18 (45,0) | 40 | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 |
| 1999 | 25 (24,3) | 10 (9,7) | 4 (3,9) | 38 (36,9) | 103 | 1 (16,7) | 0 (0,0) | 0 (0,0) | 1 (16,7) | 6 |
| 2000 | 43 (38,4) | 7 (6,3) | 14 (12,5) | 55 (49,1) | 112 | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 1 |
| 2001 | 43 (43,4) | 4 (4,0) | 5 (5,1) | 47 (47,5) | 99 | 2 (100,0) | 1 (50,0) | 0 (0,0) | 2 (100,0) | 2 |
| 2002 | 20 (29,4) | 4 (5,9) | 6 (8,8) | 27 (39,7) | 68 | 2 (23,3) | 0 (0,0) | 0 (0,0) | 2 (33,3) | 6 |
| 2003 | 17 (20,7) | 3 (3,7) | 2 (2,4) | 21 (25,6) | 82 | 16 (20,0) | 1 (1,3) | 0 (0,0) | 17 (21,2) | 80 |
| 2004 | 12 (16,7) | 9 (12,5) | 0 (0,0) | 18 (25,0) | 72 | 23 (15,4) | 7 (4,7) | 5 (3,4) | 34 (22,8) | 149 |
| 2005 | 13 (20,0) | 9 (13,9) | 2 (3,1) | 21 (32,3) | 65 | 25 (13,4) | 9 (4,8) | 1 (0,5) | 34 (18,3) | 186 |
| 2006 | 8 (24,2) | 7 (21,2) | 2 (6,1) | 13 (39,4) | 33 | 28 (12,1) | 13 (5,6) | 2 (0,9) | 41 (17,7) | 231 |
| 2007 | 9 (20,5) | 24 (54,6) | 3 (6,8) | 27 (61,4) | 44 | 22 (8,1) | 49 (18,0) | 2 (0,7) | 65 (23,9) | 272 |
OMI-AP: programa informático para el registro de historias clínicas electrónicas en atención primaria; PA: principio activo.
En el centro de farmacovigilancia de Asturias, la notificación espontánea procedente de profesionales sanitarios supone más del 90% de las notificaciones anuales. Este porcentaje es superior al global de la base de datos, que se sitúa en el 75%4, lo que concuerda con la alta tasa de notificación por habitante observada en Asturias en los últimos años9. La notificación espontánea de reacciones adversas sirve para generar señales sobre la seguridad de nuevos medicamentos, y para completar la información sobre reacciones adversas conocidas10. Algunas de las reacciones adversas detectadas recientemente por este sistema en España han sido: la hepatotoxicidad asociada a nimesulida11, la hiponatremia secundaria al consumo de inhibidores selectivos de la recaptación de serotonina12 y la hepatotoxicidad secundaria a la utilización de productos adelgazantes Herbalife®13,14. La infranotificación es quizás el principal inconveniente del sistema de notificación espontánea, aunque algunos estudios han demostrado que es selectiva y afecta más a las reacciones leves y los efectos mejor conocidos15,16.
En las notificaciones analizadas en este estudio, la gravedad de las procedentes de AP solo ocasionalmente supera el 10%, mientras que en los datos del SEFV-H4 se registra un 40% de reacciones adversas graves contenidas en la base de datos. Es importante recordar que en el análisis de toda la base de datos se incluyen también las notificaciones por TA de hospitales, las procedentes de la industria farmacéutica, los casos publicados en la literatura y los estudios poscomercialización; todos ellos son tipos de notificación que, por el contexto del que proceden, tienden a ser de mayor gravedad que las procedentes de AP, lo que podría explicar estas diferencias en el número de notificaciones graves.
Aunque las notificaciones referidas a principios activos nuevos son de especial interés, parecen verse también afectadas por la infranotificación. En el sistema de farmacovigilancia británico se ha estimado que solo son notificadas el 9% de las reacciones adversas asociadas a principios activos nuevos17,18. En España, para facilitar al profesional sanitario la identificación de los principios activos de reciente comercialización, el Real Decreto 1344/20076 establece la inclusión en el cartonaje y otras fuentes de información de estos medicamentos de un «triángulo amarillo», equivalente al triángulo negro invertido que desde hace tiempo se viene utilizando en el Reino Unido.
Facilitar la notificación de reacciones adversas mediante el uso de sistemas automatizados de registro es imprescindible en un sistema moderno de farmacovigilancia. Prácticamente ya todos los centros autonómicos de farmacovigilancia españoles disponen de páginas web desde las cuales los profesionales sanitarios pueden notificar reacciones adversas19. Un paso más en la automatización de la información sería la conexión de los registros de historias clínicas con los registros de farmacovigilancia. En su defecto, funciona el envío por correo ordinario de los episodios A85 de OMI-AP. A juzgar por los resultados obtenidos en nuestro estudio el envío de este formulario ha facilitado enormemente la notificación desde AP, observándose también un lento incremento en la relevancia de los casos notificados. La informatización de las historias clínicas y su adaptación o conexión a otras bases de datos es una herramienta fundamental para la realización de estudios en farmacovigilancia20. En esta línea se están desarrollando proyectos como BIFAP21, en el que colaboran ya un número considerable de médicos de AP.