INTRODUCCIÓN
En ocasiones nos encontramos en nuestra consulta patología aparentemente banal en la que un enfoque inicial determinado puede modificar la evolución de forma importante. Esto nos obliga a estar siempre en alerta y pensar en patologías no habituales y potencialmente graves que se presentan con síntomas comunes como es el caso de los sarcomas de partes blandas. Es sabido que el diagnóstico de estos tumores puede retrasarse por la falta de sintomatología específica, y este retraso en el diagnóstico y el gran tamaño que pueden alcanzar estas lesiones influyen de forma importante en el pronóstico y tratamiento de la enfermedad, poniendo en peligro, en muchas ocasiones, la conservación funcional de la extremidad afecta, objetivo ideal en el tratamiento de esta enfermedad.
EXPOSICIÓN DEL CASO
Se trata de un varón de 43 años, sin antecedente de interés. Acude a consulta por presentar desde hace un mes dolor de tipo mecánico en cara posterior de rodilla derecha, sin trauma previo. Días antes había sido tratado por un cuadro de febrícula y dolor en esta misma articulación con antiinflamatorios no esteroideos (AINES), antibiótico y reposo funcional, presentando una mejoría relativa.
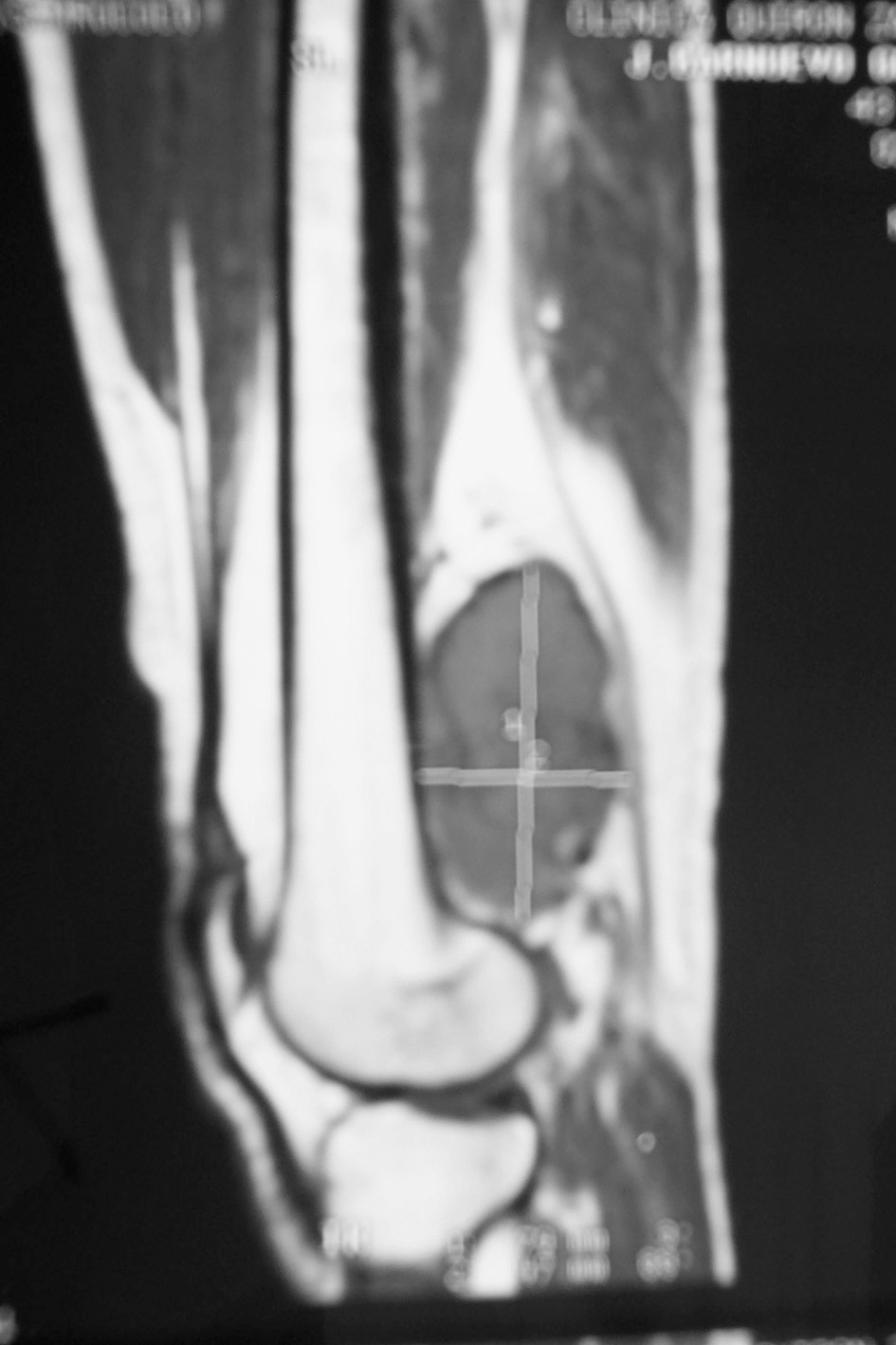
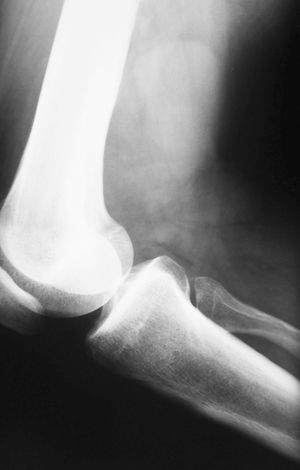
Diagnóstico y evolución: paciente obeso, con exploración general normal. En la rodilla presenta dolor a nivel de la zona superior del hueco poplíteo sin palparse masas ni objetivarse otras alteraciones. Dado el tiempo transcurrido y la no mejoría se realiza radiografía simple de rodilla donde se observa la existencia de un aumento de densidad fusiforme en tercio inferior de fémur (fig. 1). Ante estos hallazgos se deriva a segundo nivel para completar estudio. Se realiza resonancia magnética (RM), donde se observa la existencia de una masa sólida de partes blandas compatible con sarcoma de partes blandas (fig. 2). El paciente fue remitido a un centro con amplia experiencia en este tipo de patología, donde se realizó resección quirúrgica de masa tumoral completa, siendo sometido posteriormente a radioterapia en la zona tumoral. El diagnóstico de anatomía patológica fue de sarcoma de bajo grado con patrón hemangiopericitoide.
Figura 1. Radiografía lateral de rodilla. Llama la atención la existencia de una masa de partes blandas fusiforme, situada en parte posterior de extremo distal de fémur.
Figura 2. Resonancia magnética de rodilla, plano sagital, T1: masa de señal intermedia en T1 y alta señal en T2 (no mostrada), de 80 $ 50 mm, compatible con sarcoma de partes blandas que contacta con metáfisis distal de fémur sin signos de invasión.
El paciente ha seguido revisiones periódicas desde hace 8 años y nunca se han detectado recidivas ni afectación metastásica; actualmente está asintomático de su enfermedad y con la función de la extremidad preservada.
DISCUSIÓN
Los sarcomas de partes blandas son un grupo heterogéneo de tumores que pueden desarrollarse en cualquier parte del cuerpo y que se originan del tejido mesodérmico embrionario. Se trata de una enfermedad poco frecuente, con una incidencia de 2-3/100.000 casos nuevos al año1,2. La edad de máxima incidencia se sitúa en los 50 y 65 años. Estos tumores pueden producirse en cualquier parte del cuerpo, pero son más frecuentes en extremidades (50-59%), especialmente en piernas3.
En la mayoría de los casos no se ha podido demostrar un agente causal definido, pero se han descrito la influencia de diferentes factores: víricos, genéticos, radioterapia (RT) y factores ambientales, principalmente sustancias químicas como fenoxi herbicidas, clorofenoles y dioxina1,4.
Los sarcomas de tejido blando se clasifican histológicamente según las células de origen del tejido blando, aunque la histología es menos útil desde el punto de vista clínico y para decidir el tratamiento que el grado tumoral.
La clínica es inespecífica, el síntoma inicial más frecuente es la existencia de una masa inicialmente indolora, de lento crecimiento, móvil en sus primeras fases, y que puede alcanzar un gran tamaño antes de ser diagnosticado5.
Para realizar el diagnóstico nos debemos ayudar de diferentes métodos de imagen. La radiografía simple es poco útil, puede demostrar un aumento de partes blandas, habitualmente inespecífico. Los ultrasonidos, debido a su gran disponibilidad y su inocuidad, cada vez son más empleados y habitualmente son capaces de confirmar la presencia de una masa inespecífica de tejidos blandos, permiten valorar la localización anatómica y la naturaleza, sólida, líquida o mixta del tumor, además de ser útiles para dirigir la toma de muestras en caso de realización de punción aspiración con aguja fina (PAAF) o biopsia con tru-cut. Tanto la tomografía computarizada (TC) como la RM son útiles y se recomiendan en el estudio prequirúrgico de las lesiones y en el control tras tratamiento; no existen grandes ventajas en ninguna de las dos técnicas6. La RM permite realizar cortes sagitales y coronales y diferencia mejor los músculos y los vasos, demostrando en muchas ocasiones con más fiabilidad la invasión de planos vecinos, y además no da radiación al paciente. La tomografía por emisión de positrones (PET) también se está utilizando para esta patología, pero todavía no se han definido sus verdaderas aplicaciones; un reciente metaanálisis sobre PET publicado por Bastiaannet concluye que su uso rutinario no está justificado7.
Se recomienda la realización de un diagnóstico anatomopatológico de cualquier masa de tejido blando sospechosa. Para no perjudicar la resección curativa posterior, es importante planear con cuidado la biopsia inicial4. La biopsia excisional sólo debería realizarse en lesiones muy pequeñas y accesibles, siempre debería realizarse con amplios bordes. La biopsia incisional se considera como el método de elección para determinar el tipo histológico y el grado del tumor. Según un trabajo publicado por Hoeber8, la biopsia percutánea con aguja de corte (core biopsie) suele ser suficiente para establecer el diagnóstico con mínimas complicaciones locales, es segura y efectiva y permite definir el subtipo y el grado del tumor en el 80% de los casos8; la sensibilidad y especificidad de esta prueba es mayor del 95% y se considera como alternativa estándar a la biopsia incisional en el diagnóstico histológico.
El estadiaje ideado por la International Union Against Cancer y la American Joint Committee on Cancer (UICC/AJCC) utiliza 4 estadios (I-IV) y combina las más importantes características para poder establecer un pronóstico9. El peor pronóstico se da en pacientes mayores de 60 años, tumores mayores de 5 cm y alto grado histológico.
Respecto al tratamiento, habitualmente la cirugía, complementada con radioterapia si precisa, es con frecuencia curativa para los sarcomas de tejidos blandos localizados.
En una de las últimas revisiones sobre el tema, Clark4 afirma que para determinar el tratamiento óptimo para pacientes con esta enfermedad es necesario efectuar una clasificación completa y dejar que un equipo multidisciplinario de especialistas en cáncer lo planifique. En la mayoría de los casos se usa una modalidad combinada de la RT preoperatoria o postoperatoria, en vez de los procedimientos quirúrgicos radicales que se utilizaban en el pasado. Se considera como excisión amplia la que incluye la zona reactiva con un margen de tejido sano de 2-3 cm en todas las direcciones4. La re-excisión está justificada en los casos en que existan dudas acerca de la cirugía previa. La amputación solamente es necesaria en 5-10% de sarcomas en extremidades.
El empleo de la RT en este tipo de tumores es bien conocido10. Debe usarse en tumores de alto grado y de grado intermedio con márgenes dudosos. La radioterapia sin cirugía solamente se emplea en pacientes inoperables o si hay rechazo a la intervención, logrando el control local en un 30-60% de los casos.
La función de la quimioterapia (QT) no está tan bien definida, de hecho varios ensayos prospectivos aleatorios han sido incapaces de confirmar de manera concluyente que la quimioterapia adyuvante a base de doxorrubicina beneficia a los adultos con sarcomas resecables de tejido blando11. Un metaanálisis realizado sobre 1.568 pacientes que participaron en 14 ensayos de terapia adyuvante a base de doxorrubicina mostró un beneficio absoluto, como resultado de la terapia adyuvante, de 6% en el intervalo sin recaída local (intervalo de confianza [IC] de 95% 1-10), de 10% en el intervalo sin recaída distante (IC de 95% 5-15) y de 10% en la supervivencia sin recaída (IC de 95% 5-15); sin embargo, no hubo ventaja en la supervivencia general a 10 años12.
Se recomienda QT cuando la cirugía o la RT no se pueden llevar a cabo. Los fármacos que han demostrado ser más activos en los sarcomas de partes blandas son doxorrubicina e ifosfamida. Otros fármacos de segunda línea son: gemcitabina, vinorrelbina, taxanos y ecteinascidin5. En el futuro es de esperar que se desarrollen terapias moleculares específicas (targeted molecular therapy) tal como ya ha ocurrido con otros tumores, como en los sarcomas del estroma gastrointestinal, con el uso del imatinib13.
CONCLUSIONES
La cirugía sigue siendo el tratamiento de elección, la RT es útil en pacientes seleccionados, la QT convencional tiene escaso efecto en la mayoría de estos tumores, pero el desarrollo de terapias moleculares puede mejorar en un futuro el tratamiento de los sarcomas de partes blandas. El diagnóstico temprano y el tratamiento en un centro especializado por una unidad multidisciplinar consigue los mejores resultados.
Correspondencia: A.M. Martínez Guerrero.
Centro de Salud Soria Norte.
C/ Concepciones 1, 8.o B.
42001 Soria.
Correo electrónico: anamargue@hotmail.com
Recibido el 05-06-06; aceptado para su publicación el 19-10-06.