Los médicos de atención primaria atienden a las mujeres embarazadas y en edad reproductiva, por lo que han de decidir sobre el tratamiento que deben seguir. Para ello, han de enfrentarse a la difícil situación de evaluar el riesgo que las diferentes alternativas terapéuticas pueden suponer para el desarrollo embrionario/fetal. Una evaluación que no es sencilla porque no se pueden establecer normas de aplicación general. De hecho, un mismo medicamento puede ser utilizado en algunas mujeres embarazadas y no ser adecuado en otras. Esto implica que la decisión sobre el tratamiento que se debe aplicar durante el embarazo requiera una evaluación individualizada en cada mujer.
Por otra parte, la identificación del efecto de los diferentes medicamentos sobre el desarrollo embrionario y fetal humano es muy difícil y, además, está generalmente basada en estudios epidemiológicos observacionales. Esto supone una dificultad añadida porque en muchos casos este tipo de publicaciones no resultan fáciles de entender, lo que dificulta su traslación a la práctica clínica. Esto dio lugar en muchos países a la organización de servicios de información telefónica sobre teratógenos, atendidos por expertos tanto en evaluación de los riesgos para el embrión y feto, como sobre los procesos del desarrollo prenatal. No obstante, sabemos que hay fármacos que no parecen alterar el desarrollo y que pueden utilizarse durante el embarazo si se necesitan, otros que sí conllevan riesgo pero tienen que utilizarse para controlar la enfermedad materna y, por último se conocen otros cuya utilización en mujeres embarazadas o que planean estarlo está contraindicada. Estos últimos en mujeres en edad reproductiva han de utilizarse siguiendo unas estrictas normas para prevención de embarazos. En este artículo se ofrece una visión general sobre los tratamientos en mujeres embarazadas o que pueden estarlo, junto con sus potenciales efectos y se ofrece la lista de aquellos fármacos que se consideran seguros de utilizar durante la gestación y los que están contraindicados.
As primary care doctors treat pregnant women and those of fertile age, they must decide which treatments they should follow. Therefore, they have to confront the difficult situation of assessing the risks that different alternative treatments may have on embryo/foetal development. An assessment that is not straightforward as established general guidelines may not be applicable. For example, one drug may be used in some pregnant women but may not be appropriate in others. This implies that the decision on treatments given during pregnancy requires an individualised assessment in each woman.
On the other hand, identifying the effects of different drugs on human embryo and foetal development is very difficult, and is also mainly based on observational epidemiological studies. This makes it even more difficult as in many cases these publications are not easy to understand, making it difficult to apply in clinical practice. This has led to introducing Telephone Information Services on Teratogenics in many countries, which are answered by experts in the assessment of risks for the embryo and foetus, as well as on the processes of prenatal development. However, we know that there are drugs that do not seem to affect this development and can be used during pregnancy if required. Similarly, others are also known to be used in pregnant women or those planning a pregnancy are totally contraindicated. For this reason, women who take these have to follow strict guidelines to prevent becoming pregnant. This article provides a general view on treatments for pregnant women or those planning a pregnancy, together with their potential effects, as well as a list of those drugs that may be considered safe to use during pregnancy, and those that are contraindicated.
Los médicos de atención primaria atienden a las mujeres en edad reproductiva, por lo que con frecuencia se enfrentan a mujeres embarazadas a las que tienen que tratar, o que les llegan con tratamientos crónicos que les plantean dudas. En situaciones como estas, el médico de atención primaria se suele orientar por las clasificaciones de medicamentos según su riesgo para el desarrollo embrionario/fetal, particularmente la de la FDA. Sin embargo, en la actualidad y debido al avance de los conocimientos científicos, se considera que estas clasificaciones no son suficientes ni adecuadas para hacer una correcta evaluación del riesgo de un determinado tratamiento farmacológico. De hecho, hoy día se acepta que la evaluación del riesgo en mujeres embarazadas, o que planean una gestación, debe ser siempre individualizada en cada paciente, teniendo en cuenta distintos aspectos de la misma que permitan evaluar de forma más adecuada el binomio beneficio materno/riesgo fetal.
Por otra parte, una dificultad añadida a esa evaluación es que la información disponible sobre los efectos de muchos de los fármacos a los que están expuestas las mujeres embarazadas es escasa y cuando la hay, se basa en estudios epidemiológicos complejos que, aparte de publicarse en revistas especializadas, no son fáciles de interpretar por profesionales sin una buena base de las técnicas estadísticas utilizadas. En numerosas ocasiones estos aspectos dan lugar a que se produzcan sobreestimaciones o infravaloraciones de los riesgos de ciertos tratamientos, con consecuencias indeseables tanto para la salud de la madre como para el bienestar del embrión y/o feto. Para evitar estas situaciones, hace ya un par de décadas, se pusieron en funcionamiento en muchos países los llamados Servicios de Información Telefónica sobre Teratógenos (SIT). El objetivo de estos servicios es que los profesionales dedicados a la investigación (tanto de los fármacos como de otros factores ambientales y de los procesos del desarrollo prenatal), y expertos en evaluación de riesgos pudieran asesorar a los médicos sobre el riesgo para el desarrollo embrionario/fetal de las diferentes alternativas terapéuticas de cada mujer embarazada o que pudiera estarlo.
Por todo lo expuesto, el objetivo de este artículo es ofrecer a los médicos de atención primaria qué medicamentos se consideran totalmente contraindicados en mujeres que planean una gestación o en mujeres que ya están embarazadas, aquellos que se consideran seguros, junto con la información necesaria para la actuación con otros fármacos.
¿Qué efectos cabe esperar tras la exposición a fármacos durante el embarazo?El peso molecular de la gran mayoría de los fármacos es inferior a 600Da y prácticamente nunca superan los 800Da (como excepciones se pueden citar la insulina, la hormona de crecimiento y algunos esteroides conjugados). Por ello, en la práctica clínica hay que asumir que todo tratamiento materno conlleva, inevitablemente, la exposición fetal. A este respecto hay que tener en cuenta que en el tercer mes de gestación, el hígado fetal ya está capacitado para activar/inactivar sustancias químicas a través de procesos de oxidación, si bien la detoxificación de los fármacos y de sus metabolitos se produce más lentamente. Este hecho, junto con la eliminación por vía renal de la mayoría de los medicamentos y la consiguiente reabsorción por deglución fetal de líquido amniótico, hace que con frecuencia se produzca la acumulación en el feto de las sustancias activas. Es decir, niveles plasmáticos más elevados en el feto que en la madre y a unas dosis que son dosis de adulto. Por este motivo, se ha de ser especialmente cuidadoso en mujeres embarazadas, utilizando siempre las menores dosis con las que se obtenga el beneficio terapéutico materno deseado.
Dependiendo del momento en el que tenga lugar la exposición, el efecto de los distintos medicamentos sobre el desarrollo puede diferir. Así, algunos productos farmacológicos son capaces de interferir en el desarrollo embrionario (10 primeras semanas de gestación contando desde F.U.R) y causar alteraciones morfológicas (físicas), que es lo que se ha denominado efecto teratogénico. Sin embargo, durante las siguientes 30 semanas algunos fármacos pueden alterar tanto la maduración de los diferentes órganos como inducir la destrucción de ciertos tejidos (fundamentalmente a través de la alteración del flujo sanguíneo). Este tipo de efectos adversos pueden dar lugar a aparentes «malformaciones» (por destrucción de estructuras o disrupciones), retraso del crecimiento intrauterino, muerte fetal intrauterina, disfunciones de diferentes órganos o sistemas (neurológica, renal, cardiaca…), e incluso, cuando el tratamiento tiene lugar en momentos cercanos al parto, síntomas de toxicidad neonatal o síndromes de abstinencia (sedación, hipoglucemia, alteración de la termorregulación, temblores, convulsiones, etc.).
¿Cómo se clasifican los fármacos para su uso durante la gestación?Se pueden establecer cinco grupos en base a su potencial riesgo para el desarrollo embrionario/fetal humano:
- 1.
Fármacos sin evidencias de riesgo.
- 2.
Fármacos teratogénicos cuyo uso está contraindicado durante la gestación.
- 3.
Fármacos teratogénicos cuyo uso puede estar justificado durante la gestación.
- 4.
Fármacos con otros efectos adversos.
- 5.
Fármacos de reciente comercialización.
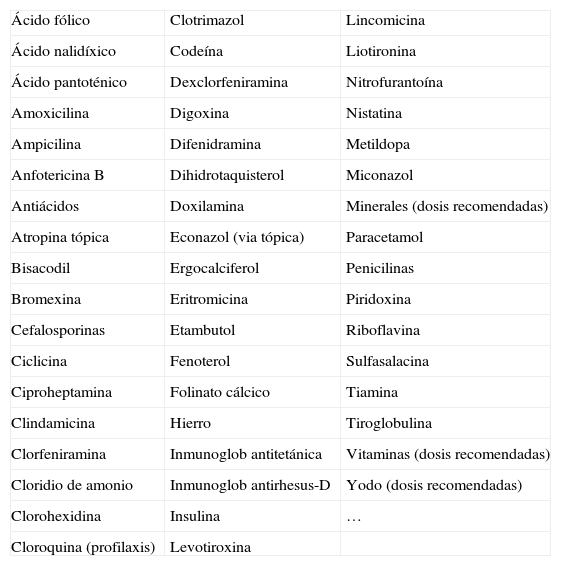
El primer grupo, los fármacos sin evidencias de riesgo, incluye una amplia gama de productos que se indican en la tabla 1. Es importante destacar que algunos de estos fármacos no solo no suponen un riesgo para el embrión/feto en desarrollo, sino que previenen la aparición de defectos congénitos. El ácido fólico o el yodo, a las dosis adecuadas y en el momento adecuado, o el tratamiento con hormona tiroidea en madres con hipotiroidismo son ejemplos claros de medicamentos que disminuyen el riesgo de defectos congénitos (tanto morfológicos como neurológicos). No obstante, aun cuando se consideren fármacos sin riesgo demostrado, durante la gestación se utilizarán solo aquellos con eficacia terapéutica demostrada y exclusivamente si existe una clara indicación médica. Esto es importante porque no podemos descartar que alguno de ellos pueda alterar algunos procesos epigenéticos cuyos efectos aparezcan a lo largo de la vida del individuo expuesto. Esto ya se ha mostrado para algunos factores ambientales y ciertos fármacos que se han relacionado con diabetes tipo ii, alteraciones de las células T y cánceres, entre otros.
Fármacos «seguros» a la luz de los conocimientos actuales
| Ácido fólico | Clotrimazol | Lincomicina |
| Ácido nalidíxico | Codeína | Liotironina |
| Ácido pantoténico | Dexclorfeniramina | Nitrofurantoína |
| Amoxicilina | Digoxina | Nistatina |
| Ampicilina | Difenidramina | Metildopa |
| Anfotericina B | Dihidrotaquisterol | Miconazol |
| Antiácidos | Doxilamina | Minerales (dosis recomendadas) |
| Atropina tópica | Econazol (via tópica) | Paracetamol |
| Bisacodil | Ergocalciferol | Penicilinas |
| Bromexina | Eritromicina | Piridoxina |
| Cefalosporinas | Etambutol | Riboflavina |
| Ciclicina | Fenoterol | Sulfasalacina |
| Ciproheptamina | Folinato cálcico | Tiamina |
| Clindamicina | Hierro | Tiroglobulina |
| Clorfeniramina | Inmunoglob antitetánica | Vitaminas (dosis recomendadas) |
| Cloridio de amonio | Inmunoglob antirhesus-D | Yodo (dosis recomendadas) |
| Clorohexidina | Insulina | … |
| Cloroquina (profilaxis) | Levotiroxina |
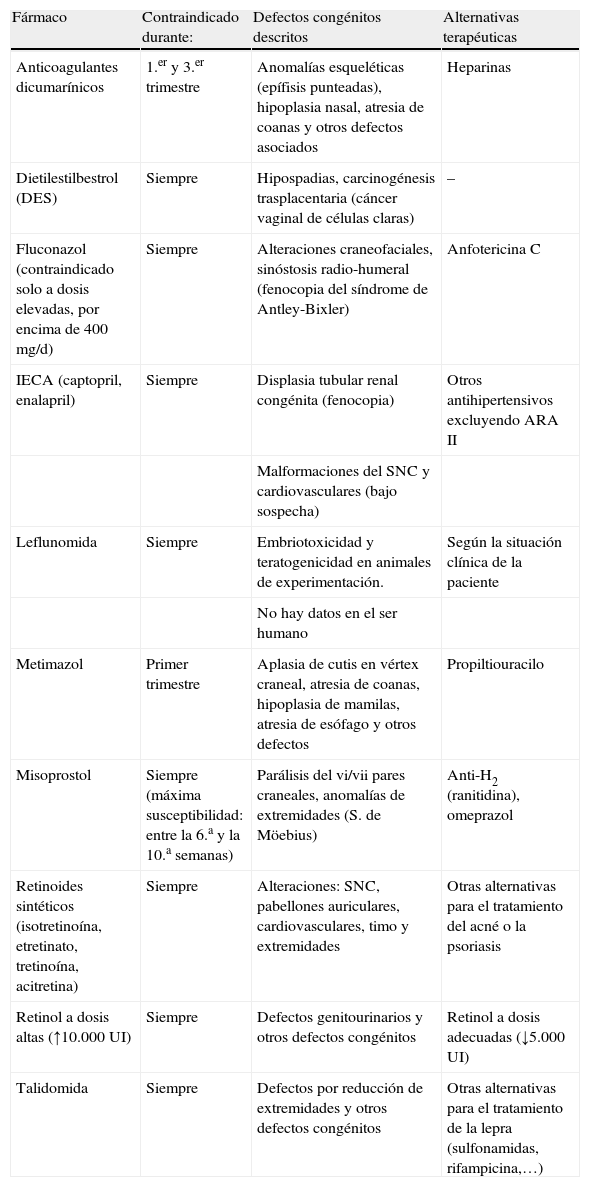
El segundo grupo, el de fármacos contraindicados (tabla 2), está formado por medicamentos para los que no existe justificación alguna de prescripción en mujeres embarazadas o que planean una gestación. Estos fármacos deben cumplir una de las siguientes premisas:
- a)
Que se utilicen para el control de enfermedades maternas que si no reciben tratamiento no implican un serio riesgo para la salud de la mujer.
- b)
Que se utilicen para tratar enfermedades graves, pero que existen otras alternativas terapéuticas que, controlando la patología materna, no conlleven riesgo para el desarrollo embrionario/fetal, o este sea menor.
Fármacos teratogénicos contraindicados durante la gestación
| Fármaco | Contraindicado durante: | Defectos congénitos descritos | Alternativas terapéuticas |
| Anticoagulantes dicumarínicos | 1.er y 3.er trimestre | Anomalías esqueléticas (epífisis punteadas), hipoplasia nasal, atresia de coanas y otros defectos asociados | Heparinas |
| Dietilestilbestrol (DES) | Siempre | Hipospadias, carcinogénesis trasplacentaria (cáncer vaginal de células claras) | – |
| Fluconazol (contraindicado solo a dosis elevadas, por encima de 400mg/d) | Siempre | Alteraciones craneofaciales, sinóstosis radio-humeral (fenocopia del síndrome de Antley-Bixler) | Anfotericina C |
| IECA (captopril, enalapril) | Siempre | Displasia tubular renal congénita (fenocopia) | Otros antihipertensivos excluyendo ARA II |
| Malformaciones del SNC y cardiovasculares (bajo sospecha) | |||
| Leflunomida | Siempre | Embriotoxicidad y teratogenicidad en animales de experimentación. | Según la situación clínica de la paciente |
| No hay datos en el ser humano | |||
| Metimazol | Primer trimestre | Aplasia de cutis en vértex craneal, atresia de coanas, hipoplasia de mamilas, atresia de esófago y otros defectos | Propiltiouracilo |
| Misoprostol | Siempre (máxima susceptibilidad: entre la 6.a y la 10.a semanas) | Parálisis del vi/vii pares craneales, anomalías de extremidades (S. de Möebius) | Anti-H2 (ranitidina), omeprazol |
| Retinoides sintéticos (isotretinoína, etretinato, tretinoína, acitretina) | Siempre | Alteraciones: SNC, pabellones auriculares, cardiovasculares, timo y extremidades | Otras alternativas para el tratamiento del acné o la psoriasis |
| Retinol a dosis altas (↑10.000UI) | Siempre | Defectos genitourinarios y otros defectos congénitos | Retinol a dosis adecuadas (↓5.000UI) |
| Talidomida | Siempre | Defectos por reducción de extremidades y otros defectos congénitos | Otras alternativas para el tratamiento de la lepra (sulfonamidas, rifampicina,…) |
SNC: sistema nervioso central.
A la hora de prescribir fármacos contraindicados en mujeres en edad reproductiva es importante recordar que durante las dos primeras semanas de gestación la mujer difícilmente puede saber que está embarazada. Por ello, la única forma de evitar la exposición durante ese periodo de prerreconocimiento de la gestación es descartar que exista embarazo. Esto implica que en toda mujer en edad fértil a la que se le va a instaurar un tratamiento con alguno de los fármacos de la tabla 2, el médico debe asegurarse que la mujer no esté embarazada. Para ello, es necesario insistir en que una prueba de embarazo negativa no es suficiente para que la paciente inicie el tratamiento con el medicamento contraindicado. Aparte de una prueba negativa de embarazo, se debe indicar a la paciente que el tratamiento lo debe comenzar en el primero o segundo día de la menstruación (cuando ya exista una descamación abundante del endometrio). Además se debe informar a la paciente del riesgo que la medicación conllevaría para defectos congénitos si se quedara embarazada, por lo que debe utilizar uno/dos métodos anticonceptivos seguros y eficaces durante, al menos, todo el periodo del tratamiento. También se informará del plazo durante el cual, una vez finalizado el tratamiento, la paciente deberá evitar un embarazo que, en general suele variar entre uno y tres meses, aunque hay excepciones de medicamentos con una vida media muy prolongada (como metotrexate, etretinato o leflunomida). En el caso del Fluconazol, es necesario insistir en que se considera contraindicado en embarazadas exclusivamente en tratamientos crónicos y a dosis elevadas. De hecho, su uso a dosis únicas de 150mg en el tratamiento de las candidiasis vulvovaginales no se considera una exposición de riesgo para el desarrollo prenatal.
¿Qué hacer con el resto de grupos?En el caso del tercer grupo, el de los fármacos teratogénicos cuyo uso puede estar justificado, su uso estará en relación con la gravedad de la enfermedad materna (que requiera necesariamente tratamiento farmacológico) y de la inexistencia de alternativas terapéuticas sin riesgo o de menor riesgo. En estos casos la evaluación «beneficio materno/riesgo fetal» es a veces muy compleja y tiene que ser realizada siempre en cada mujer de forma individual. Esto implica que no pueden establecerse reglas generales de utilización, ya que en cada caso la decisión es diferente. Pertenecen a este grupo medicamentos tales como los antiepiléticos (fenitoína, ácido valproico, trimetadiona, carbamazepina, etc.), los antineoplásicos (metotrexate), el litio y la penicilamina. Todos ellos indicados en el control de enfermedades graves que requieren control farmacológico y sin alternativas farmacológicas exentas de riesgo. No obstante, es importante también valorar si el efecto sobre el embrión/feto de cada fármaco se circunscribe a un determinado momento de la gestación, ya que si la mujer que lo requiere no se encuentra en esa fase del desarrollo, la evaluación beneficio/riesgo se modifica sustancialmente.
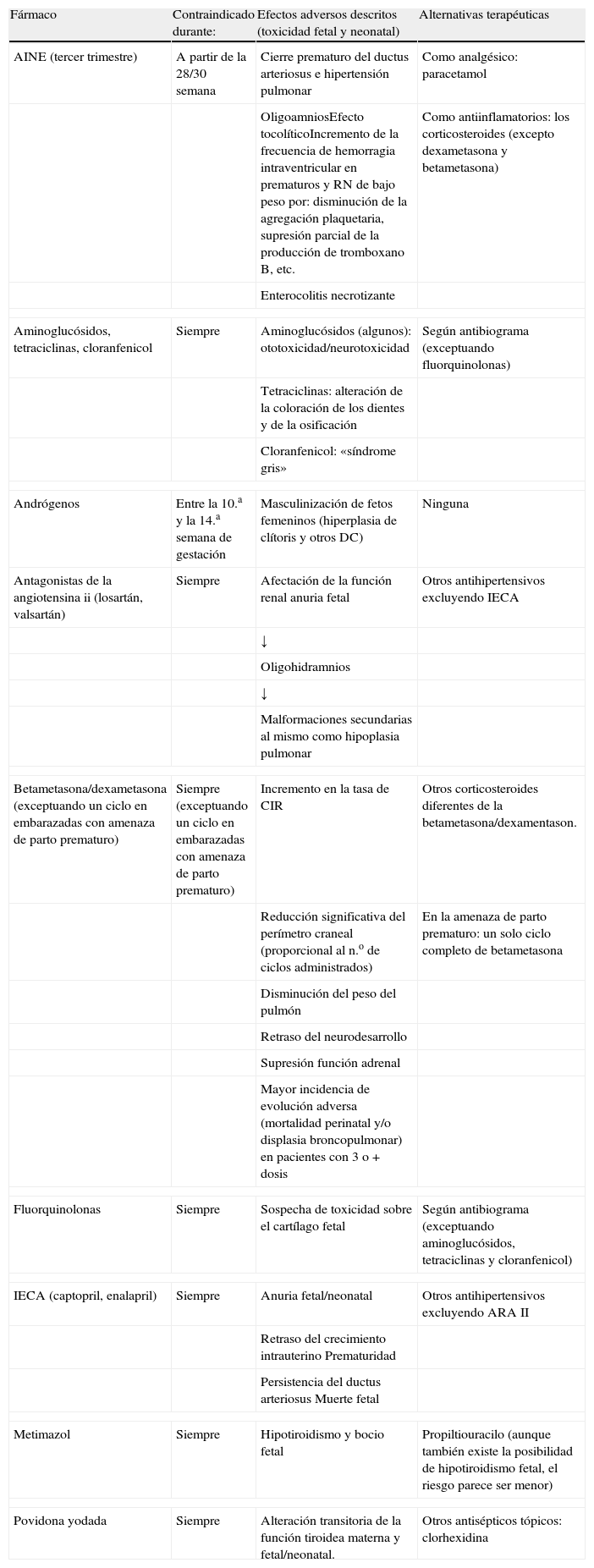
Respecto a los fármacos con otros efectos adversos, es también de una gran utilidad conocer el momento del embarazo a partir del cual su utilización supone un riesgo, ya que podrán utlizarse en mujeres que responden bien durante el periodo de la gestación en el que no conllevan riesgo. En la tabla 3, se indican la mayoría de los fármacos incluidos en estos grupos, junto con sus efectos y momentos del embarazo en que los producen. Respecto a los glucocorticoides dexametasona y betametasona, es importante resaltar que su uso está indicado para maduración pulmonar fetal, en embarazadas con amenaza de parto prematuro (y un solo ciclo completo).
Fármacos contraindicados por toxicidad fetal/neonatal (2.° y/o 3.er trimestres)
| Fármaco | Contraindicado durante: | Efectos adversos descritos (toxicidad fetal y neonatal) | Alternativas terapéuticas |
| AINE (tercer trimestre) | A partir de la 28/30 semana | Cierre prematuro del ductus arteriosus e hipertensión pulmonar | Como analgésico: paracetamol |
| OligoamniosEfecto tocolíticoIncremento de la frecuencia de hemorragia intraventricular en prematuros y RN de bajo peso por: disminución de la agregación plaquetaria, supresión parcial de la producción de tromboxano B, etc. | Como antiinflamatorios: los corticosteroides (excepto dexametasona y betametasona) | ||
| Enterocolitis necrotizante | |||
| Aminoglucósidos, tetraciclinas, cloranfenicol | Siempre | Aminoglucósidos (algunos): ototoxicidad/neurotoxicidad | Según antibiograma (exceptuando fluorquinolonas) |
| Tetraciclinas: alteración de la coloración de los dientes y de la osificación | |||
| Cloranfenicol: «síndrome gris» | |||
| Andrógenos | Entre la 10.a y la 14.a semana de gestación | Masculinización de fetos femeninos (hiperplasia de clítoris y otros DC) | Ninguna |
| Antagonistas de la angiotensina ii (losartán, valsartán) | Siempre | Afectación de la función renal anuria fetal | Otros antihipertensivos excluyendo IECA |
| ↓ | |||
| Oligohidramnios | |||
| ↓ | |||
| Malformaciones secundarias al mismo como hipoplasia pulmonar | |||
| Betametasona/dexametasona (exceptuando un ciclo en embarazadas con amenaza de parto prematuro) | Siempre (exceptuando un ciclo en embarazadas con amenaza de parto prematuro) | Incremento en la tasa de CIR | Otros corticosteroides diferentes de la betametasona/dexamentason. |
| Reducción significativa del perímetro craneal (proporcional al n.o de ciclos administrados) | En la amenaza de parto prematuro: un solo ciclo completo de betametasona | ||
| Disminución del peso del pulmón | |||
| Retraso del neurodesarrollo | |||
| Supresión función adrenal | |||
| Mayor incidencia de evolución adversa (mortalidad perinatal y/o displasia broncopulmonar) en pacientes con 3 o + dosis | |||
| Fluorquinolonas | Siempre | Sospecha de toxicidad sobre el cartílago fetal | Según antibiograma (exceptuando aminoglucósidos, tetraciclinas y cloranfenicol) |
| IECA (captopril, enalapril) | Siempre | Anuria fetal/neonatal | Otros antihipertensivos excluyendo ARA II |
| Retraso del crecimiento intrauterino Prematuridad | |||
| Persistencia del ductus arteriosus Muerte fetal | |||
| Metimazol | Siempre | Hipotiroidismo y bocio fetal | Propiltiouracilo (aunque también existe la posibilidad de hipotiroidismo fetal, el riesgo parece ser menor) |
| Povidona yodada | Siempre | Alteración transitoria de la función tiroidea materna y fetal/neonatal. | Otros antisépticos tópicos: clorhexidina |
RN: recién nacido.
Por último, en cuanto a los fármacos de reciente comercialización, no se dispone de información en relación con sus potenciales efectos sobre el desarrollo embrionario y fetal en los seres humanos (o la información es escasa) y no hay experiencia clínica suficiente de su uso durante la gestación. En general, el uso de un medicamento de reciente comercialización puede estar justificado solo si se trata de un fármaco con un mecanismo de acción que «a priori» se sospeche que no es teratogénico y si se espera una mejor respuesta terapéutica en una patología grave que requiere un tratamiento eficaz, o si está descrita una menor probabilidad de efectos adversos que queremos evitar en el feto, respecto a otros medicamentos del mismo grupo terapéutico pero más antiguos (por ejemplo menores efectos sedantes…). No obstante, la evaluación de la necesidad de su utilización en las mujeres embarazadas ha de hacerse de forma muy precisa e igualmente, siempre individualizada.
¿Y la información que se indica en el prospecto?Es importante tener presente que cuando se comercializa un fármaco no se sabe si puede tener efectos adversos sobre el desarrollo embrionario o fetal humano. Los resultados de los estudios en animales de experimentación de los efectos sobre el embrión/feto no son extrapolables al ser humano y no se pueden hacer ensayos clínicos con embarazadas cuyo objetivo sea estudiar efectos teratogénicos u otros efectos adversos fetales. Por ello, con frecuencia se incluye una advertencia en los prospectos que puede ser alarmista, no en base a evidencias de riesgo, sino a la falta de datos en el hombre. De hecho, como ya hemos comentado, debido a todas estas dificultades y a la gran cantidad de información y conocimientos que se necesitan a la hora de evaluar cada medicación en cada paciente en concreto, es por lo que se pusieron en marcha los SIT.
¿Por qué hablamos siempre de «incremento» del riesgo?Como ya se ha comentado en otros capítulos de este curso, todas las embarazadas tienen un riesgo entre un 5 y un 6% de que cada embarazo termine en un feto/hijo con defectos congénitos de cualquier tipo. Este es el riesgo basal o poblacional para defectos congénitos. Por tanto, para que un fármaco se considere que produce un defecto congénito tiene que demostrar que el defecto relacionado se observa con una frecuencia significativamente superior en los hijos (fetos) de las embarazadas expuestas a la medicación que en las no expuestas al mismo fármaco. Cuando se demuestra esto, se dice que ese fármaco «incrementa» el riesgo para ese defecto (o cuadro de defectos). Es decir, que lo incrementa sobre el riesgo basal que tiene la población general para ese defecto. Por ello, a la hora de prescribir a una mujer embarazada un fármaco que se considera «seguro» se le debe informar que ello no garantiza que el recién nacido nazca sin defectos congénitos ya que toda mujer embarazada tiene el riesgo basal. La información que se le debe ofrecer es que su riesgo (sea cual sea) es el mismo tanto si toma el fármaco como si no lo toma. No obstante, dependiendo de la enfermedad, esta sí puede suponer un riesgo si no se trata.
Servicios de información telefónica sobre teratógenos en EspañaBasándonos en la amplia y multidisciplinaria experiencia en el área de los defectos congénitos del Grupo del Estudio Colaborativo Español de Malformaciones Congénitas (ECEMC, que se había iniciado en 1976), en el año 1991 se decidió poner en marcha dos servicios de información. El «Servicio de Información Telefónica sobre Teratógenos Español (SITTE)», dirigido a los médicos y otros profesionales sanitarios y el «Servicio de Información para la Embarazada (SITE)», dirigido a la población general. Las llamadas en ambos servicios son atendidas por médicos especializados en la evaluación del riesgo reproductivo de los diferentes factores ambientales, incluyendo los fármacos, así como en la transmisión de la información. Sin embargo, cuando se hicieron las transferencias sanitarias a las diferentes comunidades autónomas, no todas quisieron asumir parte del coste del SITTE para mantener su funcionamiento.
Por último, en el momento actual existen dos redes internacionales que agrupan los servicios de información sobre teratógenos existentes. Una europea, denominada Network of Teratology Information Services (ENTIS), de la que el SITTE es miembro fundador y otra de EE.UU. y Canadá denominada Organization of Teratology Specialists (OTIS).
Conflicto de InteresesLos autores declaran no tener ningún conflicto de intereses.