En los momentos de extrema gravedad en los que nos encontramos, y ante la incertidumbre acerca de los tratamientos más eficaces en la lucha contra la enfermedad COVID-19 y con el objetivo de conocer las evidencias que pueden sostener la recomendación de utilización de cloroquina/hidroxicloroquina en el COVID 19, se realizó una revisión sistemática de estudios publicados y EC puestos en marcha con fecha hasta 28 de abril 2020.
Material y métodosSe realizó una búsqueda sistemática en PubMed con las palabras clave COVID-19 y sus sinónimos y cloroquina/hidroxicloroquina. La selección y extracción de los datos aparecidos en dicha búsqueda fue realizada por dos investigadores de forma independiente. Los resultados se discutieron con un grupo clínico de médicos de Atención Primaria y se sintetizaron los resultados mediante tablas de GRADE.
ResultadosSe encontró una revisión sistemática de buena calidad que incluye artículos con elevado riesgo de sesgos. Y 8 EC puestos en marcha que arrojarán resultados más allá de mayo de 2020.
ConclusionesAunque las conclusiones de la revisión sistemática generan una baja confianza en los resultados, y las variables clínicas que muestran beneficio son variables intermedias, los efectos secundarios son asumibles y podrían ser minimizados con el uso de herramientas de riesgo de alargamiento del QT, por lo que se podría hacer una recomendación débil a favor del uso de cloroquina/hidroxicloroquina en pacientes con COVID-19 en estadio leve-moderado.
: In this moments, of extreme gravity in which we find ourselves, and in the uncertainty face about the most effective treatment against COVID-19 disease and with the aim of find the evidence that support the chloroquine/hydroxychloroquine use recommendation to treat COVID-19 disease, a systematic review of published studies and RCT studies publishes until April 28, 2020 was carried out.
Material and methodsA systematic search was carried out in PubMed with the keywords COVID-19 and their synonyms and hydroxychloroquine/chloroquine. The data selection and extraction was elaborated by two researchers, independently. The results were discussed with a Primary Care physicians clinical group and the results were synthesized using GRADE methodology.
ResultsA good quality systematic review was found that includes articles with a high risk of bias. And 8 EC launched that will produce results beyond May 2020.
ConclusionsAlthough the conclusions of the systematic review generate a low confidence in the results, and the clinical variables that show benefit are intermediate variables, the side effects are acceptable and could be minimized with the use of QT lengthening risk tools, so it is could make a weak recommendation in favor of the use of chloroquine/hydroxychloroquine in patients with mild-moderate stage COVID-19.
En estos momentos de pandemia en que atención primaria se enfrenta a una enfermedad sin parangón con otras viriasis conocidas, los médicos de familia se plantean la utilización o no de fármacos en fases tempranas de la enfermedad en pacientes con sintomatología leve/moderada.
Los protocolos de los hospitales incluyen grupos diferentes de tratamientos, desde antiinflamatorios potentes como los corticoides hasta antirretrovirales y fármacos biológicos, pero en casi todos ellos se incluye la cloroquina/hidroxicloroquina. Este fármaco ha demostrado previamente la plausibilidad biológica, puesto que presenta datos in vitro de eficacia antiviral contra el SARS-CoV-21. Además, es conocido el efecto inmunomodulador de la potencial cascada patogénica de esta enfermedad2; por ello, y con el objetivo de revisar la evidencia científica que sustenta la eficacia clínica y seguridad de este fármaco, se realizó una búsqueda sistemática de cloroquina/hidroxicloroquina, con o sin antibiótico, en la mejoría del paciente con COVID-19.
Material y métodosSe ha realizado una búsqueda sistemática de todo tipo de estudios publicados en PubMed y Cochrane Database que incluyan tratamiento con cloroquina o hidroxicloroquina para el tratamiento de la COVID-19 a fecha del 28 de abril de 2020 (tablas 1 y 2 del Anexo).
La búsqueda en Cochrane Database no arrojó ningún estudio publicado, pero sí 8 ensayos clínicos puestos en marcha y registrados en la base de datos de registros de ensayos clínicos (EC) ClinicalTrials.gov (estos ensayos clínicos se detallan en la tabla 3 del Anexo).
La búsqueda en PubMed dio como resultado 144 estudios, y se filtró por revisiones sistemáticas (RS). Este filtro arrojó 3 resultados (ver tabla 4 del Anexo).
La revisión de Cortegiani et al.3 muestra fundamentalmente los efectos in vitro de la cloroquina en el manejo de la infección y se desechó de la pregunta clínica.
De las otras 2 RS encontradas4,5, para responder a esta pregunta se seleccionó la de fecha de realización más reciente, pues es de muy buena calidad, según la tabla de valoración de calidad de las RS, AMSTAR, y elabora metaanálisis para 4 de las variables de resultado.
La RS de Sarma et al. tiene como objetivo evaluar la seguridad y la eficacia de CQ/HCQ solo o en combinación, en términos de «tiempo de curación clínica», «cura virológica», «muerte o empeoramiento clínico de la enfermedad», «progresión radiológica» y «seguridad». Para ello hicieron una búsqueda muy sensible en 16 bases de datos de publicaciones hasta el 8 de abril de 2020 sin restricciones de lenguaje. De la búsqueda, identificaron 278 publicaciones, de las que seleccionaron 7 estudios para incluir en la RS; la selección y extracción fue realizada de forma independiente por 2 investigadores.
Estos 7 estudios arrojan un total de 1.358 pacientes que fueron incluidos en la revisión, aunque solo 3 estudios fueron metaanalizados. Dos fueron EC (Zhaowei et al.6 y Chen et al.7) y uno fue un estudio observacional (Gautret et al.)8, los cuales fueron los incluidos en el metaanálisis; los otros 49–12 son series de casos y es el motivo por el que no se incluyeron en el metaanálisis.
Se evaluó el riesgo de sesgos con la herramienta Rob 2 para los EC y con la escala de ROBINS-I para el estudio observacional.
Para complementar la búsqueda se realizó otra, no sistemática, entre las publicaciones de distintas agencias de evaluación de tecnologías de diferentes países y de aprobación de medicamentos y se encontró un informe de evaluación de la Agencia Austriaca de Tecnologías, e información de las Agencias NICE, Agencia Europea del Medicamento y FDA.
Resultados de revisión sistemática seleccionada- 1)
Para la variable tiempo de normalización de la temperatura corporal: con un grado de certeza bajo, se vio una mejoría de este parámetro en el grupo de hidroxicloroquina, frente a otros tratamientos de un día de media (2,2±0,4 días) en comparación con el grupo control (3,2±1,3 días) en el EC de Zhaowei et al.6. Mientras que en la serie de casos de Jun et al.7, el tiempo medio era de un día en ambas ramas. Este resultado no fue incluido en el metaanálisis.
- 2)
Para la variable alivio de la tos, con un grado de certeza muy bajo, se encontró una mejora significativa de la tos en el estudio de Zhaowei et al.6, el único que analizó esta variable, en el grupo HCQ (2,0±0,2 días) en comparación con el grupo control (3,1±1,5 días).
- 3)
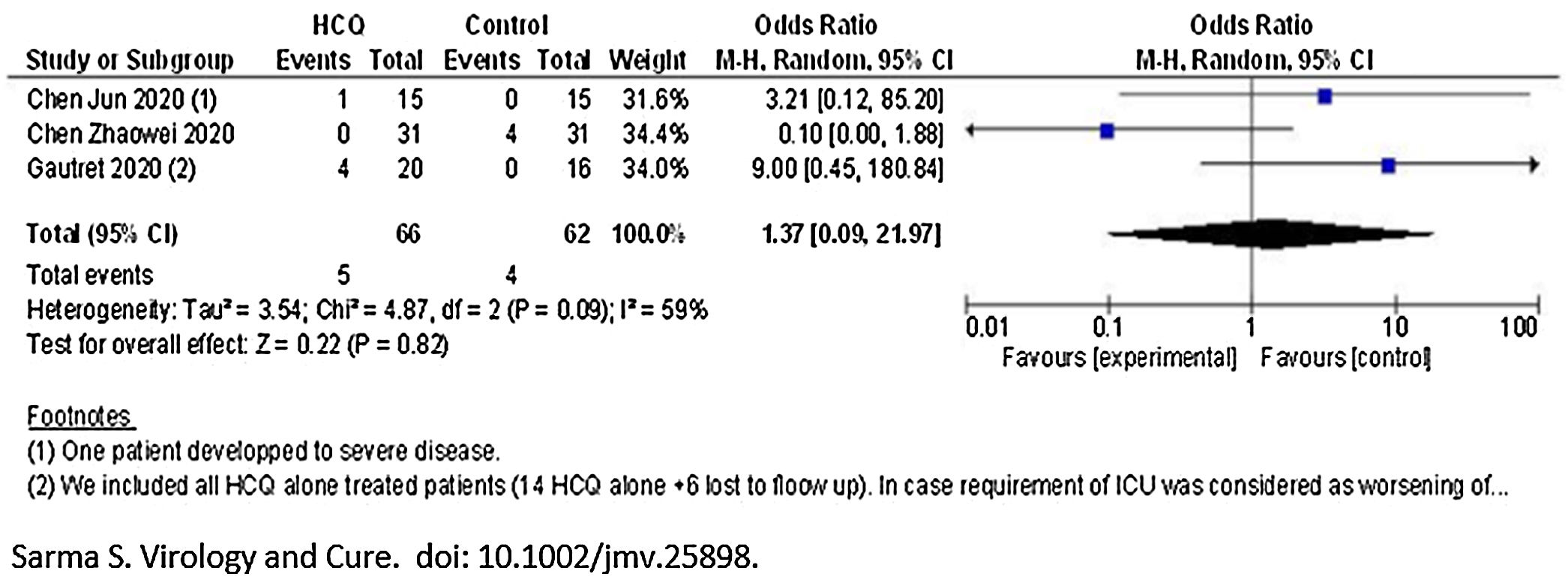
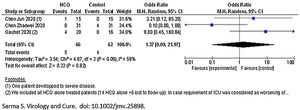
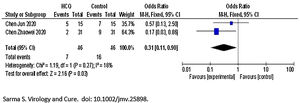
Para la variable muerte o empeoramiento clínico de la enfermedad/progresión a enfermedad grave, con un grado de certeza bajo no se observó diferencia entre los dos brazos [OR 1,37 (IC 95% 0,09 a 21,97)], con un grado de heterogeneidad moderada (I2=59%) (fig. 1).
- 4)
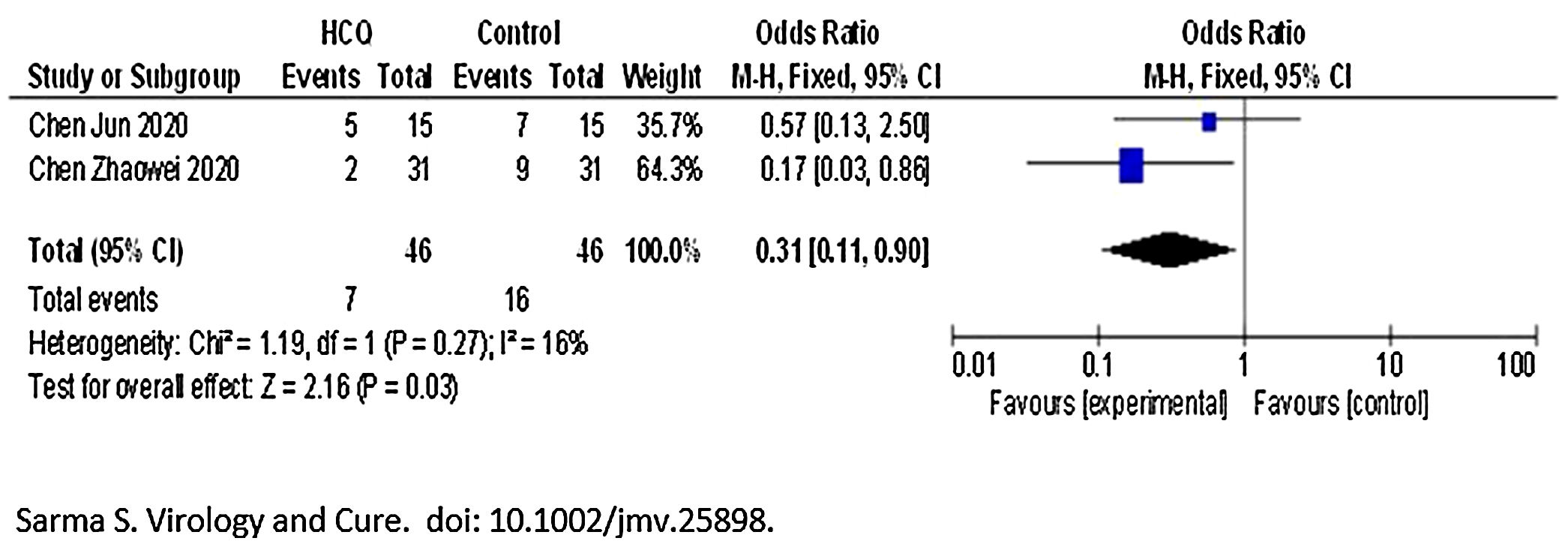
Para la variable progresión radiológica durante el tratamiento, en términos de progresión radiológica de neumonía/daño pulmonar, el tratamiento con HCQ resultó en una disminución significativa en la progresión radiológica [OR 0,31 (0,11 a 0,9)], con una heterogeneidad entre los estudios baja (I2=16%) y siendo n=46 tanto en el grupo HCQ como en el grupo control/tratamiento estándar (fig. 2).
- 5)
Para la variable recurrencia, entendida como negatividad de PCR inicialmente durante el tratamiento, seguida de recurrencia de positividad de PCR, con una confianza baja en los resultados, se encontró un caso de recurrencia a los 8 días de la primera prueba, tras haber negativizado el día 6, en el ensayo publicado por Gautret et al.8.
- 6)
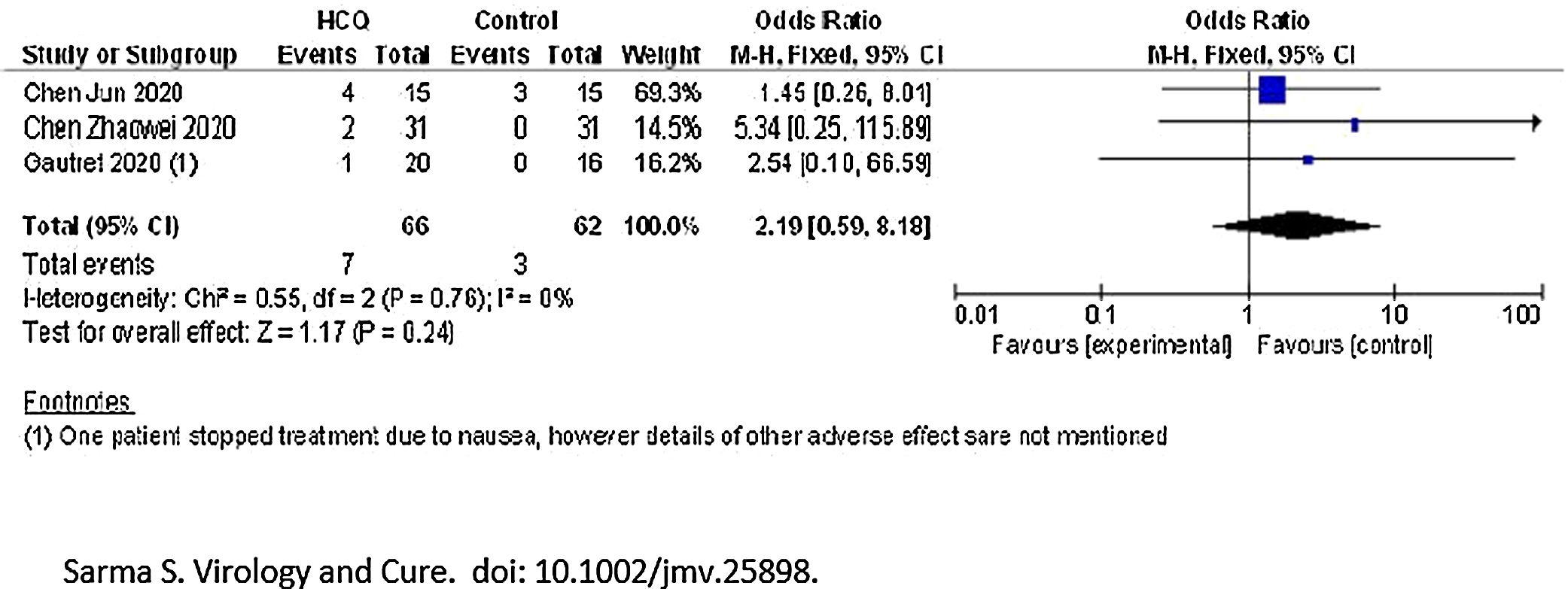
En cuanto a la seguridad, en el total de los 66 pacientes tratados en el conjunto de los 3 estudios metaanalizados6–8 se registraron un total de 7 eventos adversos en el grupo HCQ. Por otro lado, en el grupo de tratamiento estándar se informaron solo 3 eventos adversos de 62 pacientes analizados. En el estudio de Jun et al., 4 casos (26,7%) del grupo HCQ y 3 casos (20%) del grupo control tuvieron diarrea transitoria y función hepática anormal. En el estudio de Zhaowei et al.6, 2 pacientes en el grupo de HCQ mostraron reacciones adversas leves, un paciente desarrolló una erupción cutánea y un paciente experimentó dolor de cabeza. En el estudio de Gautret et al.8, un paciente interrumpió el tratamiento el día 3 debido a náuseas, y un caso falleció en el brazo de HCQ (como no había información sobre los detalles del caso de muerte, los autores no lo incluyeron como efecto adverso). Sin embargo, cuando se combinaron los resultados, no se observaron diferencias significativas entre los dos brazos con respecto a la aparición de efectos adversos [OR 2,19 (0,59 a 8,18)]. Muy baja heterogeneidad (I2=0%) (fig. 3).
Los autores, conscientes del alto riesgo de sesgos del estudio de Gautret et al.8, realizaron un análisis de sensibilidad, eliminando del análisis los datos del estudio. Sin embargo, independientemente de la eliminación del estudio, las conclusiones del mismo no cambiaron en términos de cura virológica en los días 6-7 después del inicio de la terapia, muerte o empeoramiento clínico de la enfermedad/progresión a enfermedad grave, progresión radiológica de la enfermedad pulmonar durante el tratamiento y la seguridad.
En la tabla 1 se muestran las tablas de GRADE para los desenlaces analizados.
Tabla de resumen de la evidencia GRADE PRO
| Certainty assessment | N.o de pacientes | Efecto | Certainty | Importancia | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N.o de estudios | Diseño de estudio | Riesgo de sesgo | Inconsistencia | Evidencia indirecta | Imprecisión | Otras consideraciones | Cloroquina | Tratamiento habitual | Relativo (IC 95%) | Absoluto (IC 95%) | ||
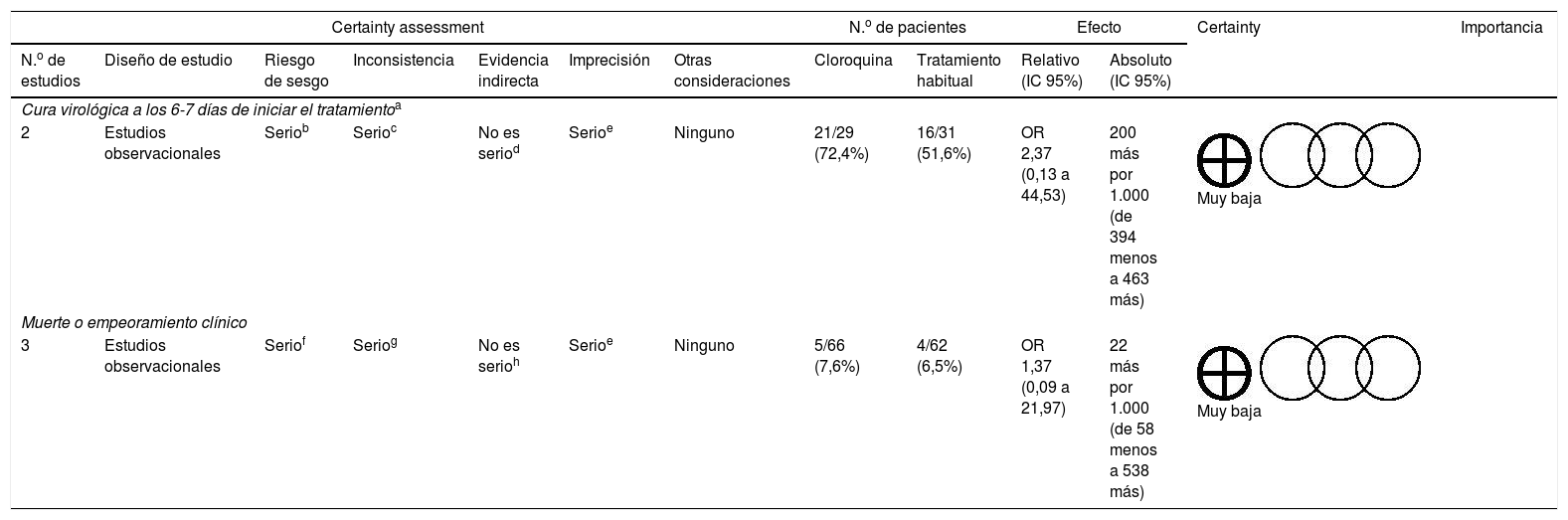
| Cura virológica a los 6-7 días de iniciar el tratamientoa | ||||||||||||
| 2 | Estudios observacionales | Seriob | Serioc | No es seriod | Serioe | Ninguno | 21/29 (72,4%) | 16/31 (51,6%) | OR 2,37 (0,13 a 44,53) | 200 más por 1.000 (de 394 menos a 463 más) | Muy baja | |
| Muerte o empeoramiento clínico | ||||||||||||
| 3 | Estudios observacionales | Seriof | Seriog | No es serioh | Serioe | Ninguno | 5/66 (7,6%) | 4/62 (6,5%) | OR 1,37 (0,09 a 21,97) | 22 más por 1.000 (de 58 menos a 538 más) | Muy baja | |
En el trabajo de Gautret et al. las pérdidas son del 16% en el grupo intervención y 0 en el grupo control (curioso siendo pacientes hospitalizados). Los datos de Jun et al. solamente se conocen por el resumen.
I2=72% p=0,06. Los tratamientos no son homogéneos. En el trabajo de Gautret et al. los pacientes del grupo intervención reciben HCQ y algunos además AZT. En el trabajo de Jun et al. solo reciben HCQ. Las dosis diarias de HCQ empleadas y la duración del tratamiento son distintas.
La situación clínica de los pacientes del trabajo de Jun et al. no es conocida (original en idioma chino) y los pacientes del trabajo de Gautret et al. están ingresados en un hospital, su situación clínica no está descrita aunque están hospitalizados.
En el trabajo de Gautret et al. las pérdidas son del 16% en el grupo intervención y 0 en el grupo control (curioso siendo pacientes hospitalizados). Los datos de Jun et al. solamente se conocen por el resumen. Los pacientes del grupo de intervención del trabajo de Zhaowei et al. se encontraban en un en día antes del curso clínico de la patología.
La situación clínica de los pacientes del trabajo de Jun et al. no es conocida (original en idioma chino) y los pacientes del trabajo de Gautret et al. están ingresados en un hospital, su situación clínica no está descrita aunque están hospitalizados. Los pacientes control del trabajo de Zhaowei et al. recibieron también antivirales pero no se encuentra detallado.
Cuando se estudió la eficacia y la seguridad de HCQ asociada a otros agentes, 4 estudios estudiaban la eficacia en asociación con azitromicina8–11 y 5 estudios la seguridad8–12.
En cuanto a la eficacia de la combinación en pacientes con COVID-19, en el primer estudio de Gautret et al.8 el uso de la combinación HCQ+azitromicina (n=6) resultó en una cura virológica al 100%, en comparación con una cura virológica del 57,1% en el brazo de HCQ solo (n=14) y del 12,5% de cura virológica en el brazo de control (n=16). Sin embargo, los datos de seguridad detallados no están disponibles para el mismo. En el segundo estudio de Gautret et al.8 de un solo brazo realizado por los mismos autores con un tamaño de muestra más alto (n=80 casos COVID-19), se observó cura virológica en el 83% de los pacientes el día 7 y en el 93% de los pacientes el día 8. En el momento de publicar el informe del estudio, 65 pacientes fueron dados de alta del hospital con una duración media de la estancia hospitalaria de 4,6 días. En otro informe del mismo grupo9 (n=1.061), se observó cura virológica en el 91,7% de los participantes en el día 10 y se observó un mal resultado en solo el 4,3% de los pacientes, con una tasa de mortalidad del 0,47%.
Por otro lado, otro estudio prospectivo publicado por Molina et al.9, que evaluó la eficacia de la misma combinación a la misma dosis, no encontró una eficacia significativa de la combinación en términos de cura virológica (8 de cada 10 positivos para el virus a los 5- 6 días después de la terapia). Entre los 11 pacientes inscritos, un paciente falleció y 2 necesitaron ingreso en UCI. Sin embargo, este era el único estudio que incluía pacientes COVID-19 grave con comorbilidades significativas en 8 casos de los 11 estudiados.
En cuanto al perfil de seguridad de la combinación, en el segundo estudio de Gautret et al.11, los efectos adversos informados del tratamiento combinado fueron náuseas y vómitos (2,5%), diarrea (5%) y visión borrosa (1,2%). En el estudio de Million et al.10, ninguno de los participantes mostró signos de toxicidad cardíaca. En el estudio de Molina et al.9, un solo paciente mostró prolongación persistente del QT y los medicamentos tuvieron que ser retirados. Chorin et al.12 encontraron que entre 84 pacientes que reclutaron, en el 30% de los pacientes, el QTc se prolongó en >40ms y el 11% de los pacientes mostraron un QTc de más de 500ms. En un análisis multivariado, encontraron que el desarrollo de insuficiencia renal aguda era un predictor más estricto de la prolongación extrema de QTc.
Resultados de ensayos clínicos puestos en marchaLos resultados de los EC encontrados a través de la evaluación de la Agencia Austriaca de Evaluación de Tecnologías13 muestran que aunque recientemente la cloroquina también se aplica en pacientes con infección por COVID-19, la búsqueda en los ensayos clínicos (solo en humanos) no arrojó ningún estudio sobre la seguridad y la eficacia de la cloroquina en los pacientes con COVID-19. Se han encontrado 8 ensayos controlados de fase IV en curso (ChiCTR2000029988, ChiCTR2000029975, ChiCTR2000029542, ChiCTR2000029609, ChiCTR2000029741, ChiCTR2000029898, ChiCTR2000029992, ChiCTR2000029899), se pudo identificar un ensayo controlado chino en curso con fase 0 (ChiCTR2000030054), y otros 2 ensayos controlados con fases no comunicadas (ChiCTR2000029939, ChiCTR2000029935).
Se espera que los 8 ensayos controlados de fase IV se completen en la primavera o a principios del verano de 2020, pero aún no hay resultados disponibles. Se espera que el ensayo controlado de fase 0 se complete en mayo de 2020 y los 2 ensayos controlados sin fase definida se espera que terminen en febrero de 2021 (ver tabla 5 del Anexo).
Respecto a la hidroxicloroquina tampoco se encontraron estudios completos sobre eficacia y seguridad con este fármaco, pero sí se pudieron identificar 8 ensayos controlados de fase IV en curso (NCT04316377, EudraCT: 2020-000982-18, ChiCTR2000029559, ChiCTR2000029992, ChiCTR2000029898, ChiCTR2000029899, ChiCTR2000029868, ChiCTR2000029740), 5 ensayos controlados de fase III en curso (NCT04315896, NCT04321278, NCT04308668, NCT04315948, EudraCT: 2020-000890-25), un ensayo controlado de fase II en curso (EudraCT: 2020-001224-33) y un ensayo controlado chino adicional en curso de fase 0 (ChiCTR2000030054). Se espera que 6 ensayos controlados de fase IV se completen en la primavera o a principios del verano de 2020, pero aún no hay resultados disponibles. Un ensayo controlado de fase IV se terminará en la primavera de 2021 y los que están terminando no se especifican más. Se espera que el primer estudio de fase III se termine en abril de 2020, los 2 siguientes a finales del verano/otoño de 2020, otro en marzo de 2023 y el último ensayo controlado de fase III que termina no se especifica. El estudio clínico de fase II no tiene más detalles sobre cuándo se completará. Se espera que el ensayo controlado chino en fase 0 se complete en mayo de 2020. En la tabla 7 del Anexo se presentan más detalles de los estudios en curso identificados.
DiscusiónTras la revisión de la literatura que muestra una escasa confianza en los estudios que muestran la eficacia y la seguridad, pero que podría apoyar una recomendación muy débil a favor, y en espera de los numerosos EC puestos en marcha, la Agencia Europea del Medicamento14 desaconseja su indicación. En el mismo sentido lo hace el NICE15.
No obstante, la FDA16, constatando que los EC puestos en marcha no darán resultados antes del verano de 2020, y estos no aportarán —en el mejor de los casos— evidencias mucho más sólidas, apoya su indicación con autorización de uso en emergencias.
Los clínicos, bajo gran presión, discuten, como dice Goodman y Borio, en la carta publicada en JAMA con fecha del 16 de abril17, la necesidad de iniciar tratamiento en pacientes con clínica leve/moderada, basado en la esperanza de los beneficios encontrados en los datos limitados de ensayos clínicos de fármacos conocidos y ya probados en otras indicaciones, y aquellos otros atemorizados por la idea de provocar efectos secundarios no intencionados, que no compensen los beneficios que se puedan encontrar en los EC puestos en marcha.
Por último, no hay que olvidar el miedo a que el acaparamiento ponga en riesgo a los pacientes en tratamiento con cloroquina o hidroxicloroquina para otras indicaciones bien evaluadas.
También hay que señalar las últimas dos evidencias publicadas en The New England Journal of Medicine de abril 202018,19, de los resultados negativos en eficacia de lopinavir-ritonavir e hidroxicloroquina en pacientes graves con neumonía por COVID-19, que han obligado a abandonar esta alternativa en pacientes graves.
A esta información hay que incluir sin duda las recomendaciones del Ministerio de Sanidad a través de la Agencia Española del Medicamentos y Productos Sanitarios20, actualizadas a fecha del 16 de abril del 2020, que incluyen cloroquina e hidroxicloroquina dentro de los «Tratamientos disponibles para el manejo de la infección respiratoria por SARS-CoV-2» y que señalan como opciones válidas para el tratamiento hidroxicloroquina sulfato en comprimidos de 200 o 400 mg y cloroquina 155mg, con dosis inicial de carga. Advierten que el acceso a la medicación, para los pacientes que ya tomaban cloroquina/hidroxicloroquina por enfermedades no relacionadas con COVID-19, seguirá realizándose en el ámbito ambulatorio, mientras que los relacionados con COVID-19 se dispensarán en los hospitales en una única solicitud semanal que incluirá el número de envases necesarios para el tratamiento de pacientes, para evitar el desabastecimiento.
Es importante señalar las precauciones necesarias en el uso de estos dos medicamentos a la hora de utilizar estas dosis, de modo que siempre habrá que:
- •
Revisar la medicación que no se considere necesaria en estos momentos, especialmente los que puedan producir reacciones adversas o presentar interacciones con él.
- •
Extremar las precauciones especialmente en pacientes con patologías crónicas como insuficiencia renal, enfermedad hepática o medicamentos que puedan aumentar el riesgo de arritmias.
- •
No prescribir en pacientes con déficit de glucosa-6-fosfato-deshidrogenasa por el riesgo de aparición de anemia hemolítica.
- •
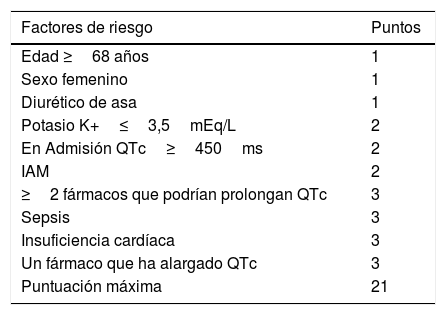
La cloroquina/hidroxicloroquina puede prolongar el intervalo QT del ECG, por lo que se debe extremar la precaución en pacientes con síndrome congénito de intervalo QT largo, desequilibrio hidroelectrolítico no corregido, cardiopatía o en tratamiento simultáneo con medicamentos que pueden alargar el intervalo QT del ECG; por lo tanto, se debe suspender toda la medicación no esencial que alargue el QT y extremar las precauciones en aquellos a los que se asocian antibióticos que también pueden prolongarlo. Se recomienda el uso del «Risk Score For Drug-Associated QTc Prolongation»21, recomendado por el American College of Cardiology22 (tabla 2), y realizar ECG en el momento de inicio de tratamiento a los sujetos con riesgo moderado y alto. Se recomienda también si el tratamiento con hidroxicloroquina se prolonga más de 5 días, especialmente si concurre alguna de las circunstancias especificadas anteriormente.
Tabla 2.Factores que contribuyen al aumento de riesgo
Factores de riesgo Puntos Edad ≥68 años 1 Sexo femenino 1 Diurético de asa 1 Potasio K+≤3,5mEq/L 2 En Admisión QTc≥450ms 2 IAM 2 ≥2 fármacos que podrían prolongan QTc 3 Sepsis 3 Insuficiencia cardíaca 3 Un fármaco que ha alargado QTc 3 Puntuación máxima 21 Riesgo bajo=≤6 puntos Riesgo moderado=7-10 puntos Riesgo alto=≥11 puntos - •
Durante el tratamiento, son frecuentes los trastornos digestivos como náuseas, vómitos y diarrea. Puede producir trastornos oculares (reversibles tras interrumpir el tratamiento de forma temprana), trastornos neuropsiquiátricos, pérdida del apetito y de peso. Entre otras reacciones adversas descritas, cabe destacar la hipoglucemia, discrasias sanguíneas, cefalea, sordera, acúfenos, alteración de la función hepática y fotosensibilidad. El tratamiento podría exacerbar los cuadros de porfiria y miastenia gravis.
Uno de los posibles sesgos del estudio es el de que se incluyen, según los diferentes estudios, pacientes en distintos grados de evolución, tanto leve como moderada y con distintos riesgos de comorbilidad, lo que es importante a la hora de seleccionar a los pacientes para este tratamiento. Esto podría influir en los resultados, que pueden no ser similares entre sí. Es importante señalar que los pacientes incluidos en los estudios seleccionados en la RS utilizada para contestar a esta pregunta eran pacientes ingresados con COVID-19, aunque el único estudio dirigido a pacientes con mayor riesgo por comorbilidad fueron los incluidos en el estudio de Molina et al.9. Ninguno de los pacientes analizados presentaba neumonía por COVID-19 en el momento de la inclusión, motivo por el que creemos que podrían extrapolarse los resultados a pacientes con evolución leve y moderada.
ConclusiónA la vista de las evidencias más actualizadas y las recomendaciones de las diferentes agencias reguladoras, y a la vista que los ensayos clínicos no empezarán a dar resultados antes de finales del primer semestre del 2020, se concluye que en este momento sería conveniente, siguiendo las indicaciones de la Agencia Española de Medicamentos, utilizar la cloroquina/hidroxicloroquina en pacientes con enfermedad leve/moderada y especialmente con factores de riesgo para mala evolución. También se hace especial hincapié en la necesidad de seguir atentos a los resultados de los EC puestos en marcha que modificarán esta conclusión. Y sobre todo se recomienda la realización de electrocardiograma en pacientes con riesgo de arritmia y cuando se administre el fármaco más de 5 días.
Aunque las conclusiones de la RS generan una baja confianza en los resultados, y las variables clínicas que muestran beneficio son variables intermedias, los efectos secundarios son asumibles y podrían ser minimizados con el uso de herramientas de riesgo de alargamiento del QT, por lo que se podría hacer una recomendación débil a favor del uso de cloroquina/hidroxicloroquina en pacientes con COVID-19 en estadio leve-moderado.
La MBE señala la necesidad de una forma juiciosa, consciente y explícita de utilizar las mejores evidencias disponibles, y no obliga a esperar a tener la mejor evidencia23.
FinanciaciónEste artículo no ha recibido financiación para su realización.
Conflicto de interesesLos autores no declaran conflicto de interés.