La neumonía adquirida en la comunidad (NAC) continúa siendo una causa importante de morbimortalidad en adultos. El objetivo de este trabajo es actualizar la guía práctica de prevención de la NAC mediante vacunación en España desarrollada en 2016 y actualizada en 2018, en función de las vacunas y las evidencias disponibles mediante revisión bibliográfica y opinión de expertos. La llegada de la COVID-19 como nueva causa de NAC y la reciente aprobación y disponibilidad de cuatro vacunas seguras y eficaces constituyen el cambio más significativo. Las vacunas frente al neumococo, la gripe, la tosferina y la COVID-19 pueden contribuir a disminuir la carga de enfermedad por NAC y sus complicaciones asociadas. La evidencia disponible avala las indicaciones prioritarias establecidas en esta guía, y sería recomendable tratar de lograr una difusión e implementación amplia en la práctica clínica rutinaria de estas recomendaciones.
Community-acquired pneumonia (CAP) continues to be an important cause of morbidity and mortality in adults. The aim of this study is to update the practical prevention guide for CAP through vaccination in Spain developed in 2016 and updated in 2018, based on available vaccines and evidence through bibliographic review and expert opinion. The arrival of COVID-19 as a new cause of CAP and the recent availability of safe and effective vaccines constitutes the most significant change. Vaccines against pneumococcus, influenza, pertussis and COVID-19 can help to reduce the burden of disease from CAP and its associated complications. The available evidence supports the priority indications established in this guide, and it would be advisable to try to achieve a widespread dissemination and implementation of these recommendations in routine clinical practice.
La importancia de la neumonía adquirida en la comunidad (NAC) en el contexto de la salud global y la práctica clínica diaria, las posibilidades de prevención mediante vacunación de una fracción importante de esta patología, y la ausencia de calendarios o recomendaciones específicas nacionales motivaron que en el año 2016, el grupo de Neumoexpertos en Prevención desarrollase una guía práctica de vacunación frente a la NAC en el adulto1 y que posteriormente fue actualizada en 2018. La pandemia por SARS-CoV-2 ha revolucionado el panorama de la neumonía, y la reciente disponibilidad de vacunas seguras y eficaces puede constituir su punto de inflexión. Además, se han acumulado en los últimos años nuevos datos objetivos y opciones en la prevención de la neumonía por gripe y por neumococo. Introducimos también la indicación de protección contra la tosferina en pacientes de riesgo. El presente trabajo pretende reevaluar y actualizar el calendario recomendado de vacunación frente a la NAC en el adulto en función de las nuevas evidencias disponibles.
MétodosHemos aplicado la misma metodología que en ediciones previas1,2, basada en la revisión bibliográfica extensa en Medline, PubMed y Cochrane sobre recomendaciones preventivas de vacunación en la NAC en el adulto desde julio de 2018 hasta el 29 de marzo de 2021. Durante el proceso se realizaron 2 reuniones de trabajo telemáticas específicas. Después de la revisión, se discutieron y consensuaron las recomendaciones de vacunación frente a la NAC en el adulto basándose en la mejor evidencia disponible y en la opinión de expertos según los criterios de Oxford3.
ResultadosComo consecuencia de la revisión, se establece la propuesta de recomendaciones de vacunación frente a la neumonía de la tabla 1, y se resumen a continuación las principales novedades y argumentos que las sustentan.
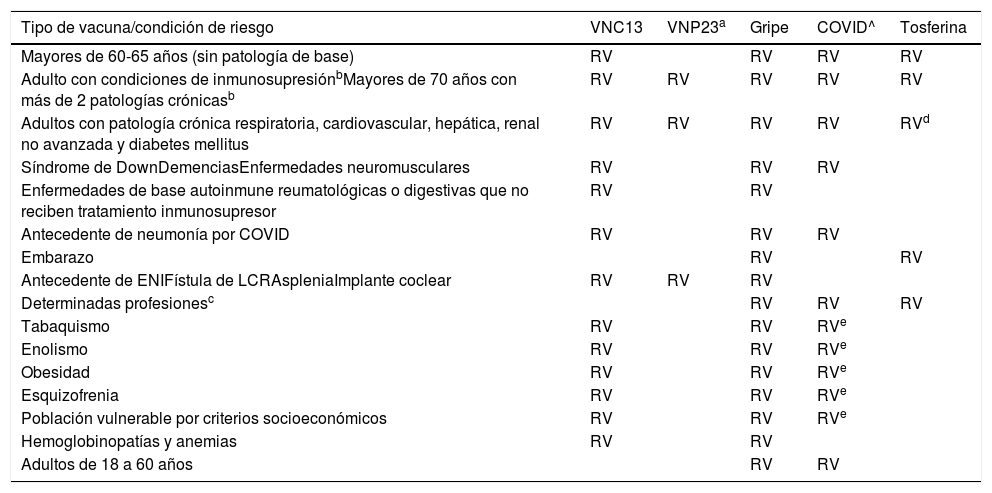
Guía de vacunación frente a la neumonía adquirida en la comunidad (NAC) en el adulto. Ver texto para más especificaciones
| Tipo de vacuna/condición de riesgo | VNC13 | VNP23a | Gripe | COVID^ | Tosferina |
|---|---|---|---|---|---|
| Mayores de 60-65 años (sin patología de base) | RV | RV | RV | RV | |
| Adulto con condiciones de inmunosupresiónbMayores de 70 años con más de 2 patologías crónicasb | RV | RV | RV | RV | RV |
| Adultos con patología crónica respiratoria, cardiovascular, hepática, renal no avanzada y diabetes mellitus | RV | RV | RV | RV | RVd |
| Síndrome de DownDemenciasEnfermedades neuromusculares | RV | RV | RV | ||
| Enfermedades de base autoinmune reumatológicas o digestivas que no reciben tratamiento inmunosupresor | RV | RV | |||
| Antecedente de neumonía por COVID | RV | RV | RV | ||
| Embarazo | RV | RV | |||
| Antecedente de ENIFístula de LCRAspleniaImplante coclear | RV | RV | RV | ||
| Determinadas profesionesc | RV | RV | RV | ||
| Tabaquismo | RV | RV | RVe | ||
| Enolismo | RV | RV | RVe | ||
| Obesidad | RV | RV | RVe | ||
| Esquizofrenia | RV | RV | RVe | ||
| Población vulnerable por criterios socioeconómicos | RV | RV | RVe | ||
| Hemoglobinopatías y anemias | RV | RV | |||
| Adultos de 18 a 60 años | RV | RV |
RV: recomendamos vacunación.
Insuficiencia renal avanzada, cáncer de órgano sólido o hematopoyético. Inmunosupresión originada por la infección de VIH, por fármacos, en los receptores de trasplantes, u otras causas de inmunosupresión o inmunodeficiencia.
El catálogo de profesiones puede ser diferente en cada enfermedad y queda definido en el Real Decreto 1299/2006, de 10 de noviembre, por el que se aprueba el cuadro de enfermedades profesionales en el sistema de la Seguridad Social y se establecen criterios para su notificación y registro. Disponible en: https://www.boe.es/buscar/pdf/2006/BOE-A-2006-22169-consolidado.pdf
EPOC y diabetes mellitus.
Las indicaciones de vacunación frente a COVID quedan recogidas en la siguiente bibliografía:
• Documento de consenso de la SEMPSPH sobre la priorización de vacunación frente a SARS-CoV-2 en adultos con condiciones de riesgo. Disponible en: https://www.sempsph.com/images/Consenso_Recomendaciones_SEMPSPH_08022021_PDF_M%C3%81S_CLARO1%201.pdf
• Gao YD, Ding M, Dong X, Zhang JJ, Kursat Azkur A, Azkur D, et al. Risk factors for severe and critically ill COVID-19 patients: A review. Allergy. 2021 Feb;76(2):428-455. doi: 10.1111/all.14657. Epub 2020 Dec 4. PMID: 33185910.
• Brodin P. Immune determinants of COVID-19 disease presentation and severity. Nat Med. 2021 Jan;27(1):28-33. doi: 10.1038/s41591-020-01202-8. Epub 2021 Jan 13. PMID: 33442016.
• Haute Autorité de Santé. Stratégie de vaccination contre le Sars-Cov-2 — Actualisation des facteurs de risque de formes graves de la Covid-19 et des recommandations sur la stratégie de priorisation des populations à vacciner. Saint-Denis La Plaine: HAS; 2021. Disponible en: https://www.has-sante.fr/jcms/p_3240117/fr/strategie-de-vaccination-contre-le-sars-cov-2-actualisation-des-facteurs-de-risque-de-formes-graves-de-la-covid-19-et-des-recommandations-sur-la-strategie-de-priorisation-des-populations-a-vacciner
• Preliminary Recommendations of the NCCN COVID-19 Vaccination Advisory Committee. 22/01/2021. Disponible en: https://www.nccn.org/covid-19/pdf/COVID-19_Vaccination_Guidance_V1.0.pdf
La llegada del SARS-COV-2 supone una nueva causa global de NAC, la más frecuente en el adulto en el momento actual. La tasa de letalidad de la neumonía por SARS-CoV-2 para el conjunto de España se estimó en 9,6/1.000, oscilando entre el 1/1.000 en Melilla y el 26,6/1.000 en La Rioja, con un exceso de mortalidad significativo especialmente en la población por encima de los 64años. La circulación de SARS-COV-2 ha tenido también un impacto significativo sobre la estacionalidad y la prevalencia de otros agentes infecciosos, y en particular sobre otros patógenos responsables de NAC como la gripe, si bien los mecanismos específicos (competencia viral, impacto de las medidas de control de COVID-19, etc.) y las consecuencias a medio y largo plazo son todavía desconocidas. La disponibilidad en tiempo récord de vacunas seguras, eficaces y efectivas frente a la COVID-19 marcan el punto de inflexión de esta pandemia, y estamos inmersos en una campaña de vacunación universal. En marzo 2021 ya hay cuatro vacunas autorizadas para su uso en nuestro país (tabla 2).
Características de las vacunas frente a SARS-COV-2 aprobadas para su utilización en España (marzo 2021): tipo de vacuna, número de pacientes estudiados, pauta empleada, eficacia demostrada, indicaciones por edad
| Compañía | País | Tipo | Nombre | Número de pacientes | Pauta | Eficacia | Edad |
|---|---|---|---|---|---|---|---|
| Pfizer/BioNTech | Alemania | ARNm | TozinameranComirnaty® | 43.548 (fase 3) | 0-21 | 95%; IC95%: 90,3-97,6 | > 12 |
| Moderna | EE.UU. | ARNm | mRNA-1273 | 30.400 (fase 3) | 0-28 | 94,5%; IC95%: 86,5-97,8 | > 18 |
| Oxford/AstraZeneca | Reino Unido | Vector viral(ChadOx) | AZD1222Vaxzevria® | 13.414 (fase 2/3 y 3) | 0-28 a 60 | 70,4% IC95%: 54,8-80,6 | > 18 a 55 |
| Johnson & Johnson's | EE.UU. | Vector viral(adenovirus 26) | JNJ-78436735 Ad26.COV2.S | 43.783 (fase 3) | Dosis única | 66,9% IC95%: 59-73,4 | > 18 |
Vacuna de ARNm incluida en nanopartículas liposomales que codifica la proteína espicular (spike o S) del SARS-CoV-2. El ensayo clínico multicéntrico pivotal fase 2/34 se realizó con 43.548 pacientes, de los cuales la mitad recibieron la vacuna y la otra mitad placebo. El 57% tenían entre 16 y 55años y el 43% restante eran mayores de 55. El 50% eran mujeres y el 30% de los participantes eran obesos. Dentro de los criterios de exclusión se incluía haber padecido COVID-19 con anterioridad, empleo de tratamiento inmunosupresor o pacientes inmunodeprimidos. Sí se incluyeron pacientes con enfermedad crónica estable, como HepatitisC o VIH. La pauta de h empleada fueron dos dosis separadas entre sí 21días.
Las reacciones adversas más frecuentes con Comirnaty® durante el ensayo clínico fueron leves o moderadas y mejoraron unos días después de la vacunación. Estas reacciones incluyen dolor e hinchazón en el lugar de inyección, cansancio, dolor de cabeza, dolor muscular y articular, escalofríos y fiebre. Estas reacciones adversas ocurrieron en más de una persona de cada 10. El enrojecimiento en el lugar de inyección y las náuseas ocurrieron en menos de una persona de cada 10. El picor en el lugar de inyección, dolor en el miembro, linfadenopatías (también descritas en vida real5), dificultad para dormir y malestar fueron efectos adversos poco comunes (menos de una persona de cada 100). Se describieron 4 casos de parálisis facial periférica aguda (parálisis de Bell) en menos de una de cada 1.000 personas. La tasa de efectos adversos graves fue del 1,1% en el grupo de vacuna.
La eficacia está calculada en base a 36.000 voluntarios a partir de los 16años de edad (incluyendo mayores de 75años), sin signo previo de infección. El ensayo mostró una reducción del 95% en el número de casos sintomáticos de COVID-19 en personas que recibieron la vacuna (8 casos de 18.198 tuvieron síntomas de la COVID-19) frente a las personas que recibieron la inyección de placebo (162 casos de 18.325 tuvieron síntomas de la COVID-19). Esto significa que la vacuna mostró una eficacia del 95% en el ensayo (IC95%: 90,3-97,6) al 7.° día tras la administración de la segunda dosis.
El ensayo también mostró una eficacia de alrededor del 95% en los participantes en riesgo de contraer de forma grave la COVID-19, incluyendo participantes con asma, enfermedad pulmonar obstructiva crónica, diabetes, hipertensión o con índice de masa corporal >30kg/m2.
Ha sido la primera vacuna que ha recibido aprobación provisional de uso en el mundo frente al SARS-CoV-2 tanto por la Food and Drug Administration (FDA) estadounidense como por la Agencia Europea del Medicamento (EMA) y por la Organización Mundial de la Salud (OMS). De hecho, comenzamos a disponer de datos en vida real con resultados muy esperanzadores en relación con el impacto sobre infección, hospitalización y muerte. En Israel, tras la vacunación de cerca del 90% de la población mayor o igual a 60años de edad con dos dosis de la vacuna de Pfizer/BioNTech, se observó un descenso del 41% en casos confirmados de infección y un 31% en las hospitalizaciones entre enero y febrero6. Además, se ha observado una disminución de la carga vírica en las personas vacunadas que se infectan con respecto a las no vacunadas, lo cual puede reflejar que, incluso aunque las personas vacunadas puedan infectarse, la transmisión puede ser menor7. Más recientemente se ha demostrado su seguridad y su eficacia en los adolescentes de 12 a 15años de edad, ampliándose en la ficha técnica la posibilidad de vacunación también en estas edades.
En The New England Journal of Medicine8 se han publicado los resultados de 596.618 vacunados entre el 20 de diciembre de 2020 y el 1 de febrero de 2021 apareados con el mismo número de no vacunados (controles). La edad media fue de 45años para ambos grupos. Se evaluó la efectividad entre los días 14 y 20 tras la primera dosis y a los 7días o más tras la segunda. Frente a la infección la efectividad fue del 46% y 92%, del 57% y 94% para COVID-sintomático, del 74% y 87% para las hospitalizaciones y del 62% y 92% para la enfermedad grave, respectivamente. La efectividad fue similar para todos los grupos de edad (desde los 16 hasta más de 70años) y ligeramente inferior para los vacunados con patologías basales múltiples.
En un estudio retrospectivo de cohortes9 en sanitarios se analizó la efectividad en los primeros 14días o entre los días 15 a 28 tras recibir la primera dosis comparando los vacunados frente a los no vacunados. La tasa ajustada de reducción de la infección por SARS-CoV-2 fue del 30% (IC95%: 2-50) y del 75% en el primer y segundo periodo, respectivamente. La tasa ajustada de reducción de los casos sintomáticos fue del 47% (IC95%: 17-66) y del 85% (IC95%: 71-92) para los dos periodos, respectivamente.
En otra publicación preprint10, con al menos el 39% de la población vacunada con una dosis de vacuna, se estima la efectividad de la vacunación en las personas de 60 o más años: 14días tras la segunda dosis, se observó una efectividad del 72% en la reducción de casos sintomáticos y asintomáticos, reducción de las hospitalizaciones por COVID-19 del 83% y reducción de los casos graves del 86%. En las semanas 3-4 tras la segunda dosis, la efectividad para esos desenlaces se aproximaría a cifras superiores al 90%.
El estudio de cohortes prospectivo SIREN (publicación sin revisión por pares)11, realizado en Inglaterra con sanitarios que trabajan en hospitales públicos, muestra una efectividad en la prevención de infección, tanto sintomática como asintomática, del 72% (IC95%: 58-86) a los 21días de la primera dosis y del 86% (IC95%: 76-97) a los 7días tras la segunda dosis. Estos datos se han observado cuando la cepa que circula de SARS-CoV-2 era de forma dominante B.1.1.7, demostrando de esta manera efectividad frente a esta variante.
b) Vacuna mRNA-1237 (Moderna®)Vacuna de ARNm incluida en nanopartículas liposomales que codifica la proteína espicular del SARS-CoV-2. La seguridad y la inmunogenicidad de la vacuna Moderna se evaluó en un ensayo clínico fase312, multicéntrico, que incluyó 30.400 voluntarios de diferentes edades, razas y etnias; de ellos, la mitad recibieron la vacuna y la otra mitad placebo. Los pacientes se estratificaron en tres grupos: pacientes de 18 a 65años sin factores de riesgo (59,6%), pacientes de 18 a 65años con factores de riesgo (15,1%) y pacientes mayores de 65años (25,3%). Se consideró que el 82% estaban en riesgo de exposición ocupacional (el 25% eran profesionales sanitarios) y el 22,3% tenían al menos una condición de alto riesgo. A diferencia de la vacuna de Pfizer, sí se incluyeron participantes con historia de enfermedad por COVID-19 previa (2,2%). La pauta de administración fueron dos dosis con un intervalo de 28días.
La mayoría de los efectos secundarios detectados fueron leves o moderados y autolimitados. A nivel local, el más frecuente fue dolor en el lugar de la inyección (91,6%), así como linfadenopatías en estudios en vida real5. A nivel sistémico los más frecuentes fueron fatiga (68,5%), cefalea (63,0%), dolor muscular (59,6%), dolor articular (44,8%) y escalofríos (43,4%). Se produjeron efectos adversos graves en el 0,2% al 9,7% de los participantes.
La eficacia observada 14días después de la administración de la segunda dosis sugiere que puede prevenir la enfermedad en el 94,1% de los adultos vacunados y en hasta el 86,4% de adultos mayores de 65años con o sin comorbilidades. La eficacia observada en personas con alguna comorbilidad en cualquier grupo de edad fue del 90,9%.
c) Vacuna de vectores ChAdOx1 AZD1222 – Vaxzevria® (Oxford-AstraZeneca)Vacuna de vector viral empleando adenovirus que expresa la glucoproteína spike de SARS-CoV-2. La eficacia y la seguridad de la vacuna se analizaron mediante ensayos clínicos fase 2/313,14. Se realizó simultáneamente un estudio en fase 2/3 en el Reino Unido y otro en fase 3 en Brasil. En el de Reino Unido se reclutaron 10.673 pacientes, de los cuales la mitad recibieron vacuna y la otra mitad placebo. En el grupo de vacuna existían dos subgrupos: el subgrupo SD/SD, formado por 2.741 participantes, y el subgrupo LD/SD, con 4.807. El subgrupo de SD/SD recibió dos dosis de vacuna a dosis estándar de carga viral, mientras que el LD/SD recibió una primera dosis de vacuna de baja carga viral (mitad de dosis) y otra segunda dosis de vacuna de alta carga viral (dosis completa). El 86,7% de los pacientes tenían entre 18 y 55años, con la particularidad de que en el grupo LD/SD solo se reclutaron pacientes de este grupo etario. En el estudio de Brasil se reclutaron 4.088 pacientes y todos ellos recibieron dos dosis de carga estándar de la vacuna. En este estudio, el 89,9% de los participantes tenía entre 18 y 55años. Entre los dos estudios, el 60,5% eran mujeres y la mayoría de los participantes eran trabajadores sanitarios. Se incluyeron pacientes que había padecido COVID-19 anteriormente.
En el protocolo se establecían dos dosis separadas 4semanas, pero en los ensayos clínicos existió gran variabilidad respecto a la pauta de administración. El grupo SD/SD recibió la segunda dosis en las primeras 6semanas tras la primera, con una mediana de 36días. El grupo LD/SD recibió la segunda dosis en las primeras 12semanas.
A partir de los 14 días después de la segunda dosis de la vacuna, en el grupo de la vacuna se detectaron 30 casos y 101 en el grupo control, lo que supone una eficacia del 70,4% (IC95%: 54,8-80,6). Si estratificamos los resultados en el grupo SD/SD la eficacia fue del 62,1% (IC95%: 41,0-75,7) y en el LD/SD 90,0% (67,4-97). No existían diferencias significativas entre otros subgrupos.
Los efectos secundarios más comunes (que pueden afectar a más de una de cada 10 personas) fueron sensibilidad, dolor, calor, enrojecimiento, picazón, hinchazón o hematomas en el lugar de la inyección, malestar general, sensación de cansancio (fatiga), escalofríos o sensación de fiebre, dolor de cabeza, malestar (náuseas), dolor en las articulaciones o dolor muscular. La mayoría fueron de naturaleza leve a moderada y se resolvieron en unos pocos días, mientras que algunos todavía estaban presentes una semana después de la vacunación. Recientemente se detectó una relación temporal entre la vacunación y la aparición de fenómenos tromboembólicos graves (fundamentalmente de senos venosos cerebrales), asociados con trombocitopenia, en menos de un caso por 100.000 vacunados, fundamentalmente en mujeres menores de 60años; las agencias supranacionales, y en concreto la EMA, han ratificado la relación riesgo-beneficio de la vacunación y actualizado la ficha técnica para incluir este posible efecto adverso15.
Comenzamos a disponer de datos en vida real de la utilización de esta vacuna. En Escocia, un estudio de cohortes prospectivo (publicado antes de la revisión por pares)16 tras la administración de una dosis a 5,4 millones de personas observó una efectividad en la prevención de hospitalización del 94% (IC95%: 73-99), con datos similares cuando el estudio se restringe a la población de 80 y más años de edad (81%; IC95%: 65-90, a los 28-34días tras la vacunación).
Finalmente, cabe destacar el estudio AvonCAP (preprint en Lancet)17, un estudio prospectivo unicéntrico de diseño de test negativo de casos y controles, realizado en adultos de 80años o más hospitalizados por COVID-19 u otra enfermedad respiratoria aguda. La efectividad de la primera dosis de la vacuna de AstraZeneca fue del 80,4% (IC95%: 36,4-94,5), siendo la mediana de edad de los sujetos estudiados de 88años. La efectividad de la primera dosis de la vacuna de Pfizer fue del 71,4% (IC95%: 46,5- 90,6), con una mediana de edad de 87años. Cuando el análisis de efectividad para la vacuna de Pfizer se limitó al mismo período de estudio que el cubierto por la vacuna de AstraZeneca, la estimación fue del 79,3% (IC95%: 47,0-92,5). La eficacia de la vacuna AstraZeneca aumentó hasta un 81,3% (IC95%: 60-91) con un intervalo entre dosis de 12semanas o más, frente a una eficacia vacunal del 55,1% (IC95%: 33-69) si el intervalo era de menos de 6semanas.
d) Vacuna de vectores JNJ-78436735 o Ad26.COV2.S (Johnson & Johnson)Vacuna de vector viral empleando adenovirus 26 que codifica una variante estabilizada de la proteína espicular del SARS-CoV-2, que precisa una dosis única.
Los datos de seguridad disponibles incluyen un análisis de 43.783 participantes en un ensayo clínico aleatorizado y controlado con placebo en curso, que se realiza en Sudáfrica, ciertos países de Sudamérica, México y Estados Unidos. Un total de 21.895 participantes recibieron la vacuna y 21.888 recibieron placebo.
La eficacia general de la vacuna frente a la COVID-19 de moderada a grave fue del 66,9% (IC95%: 59-73,4) y del 66,1% (IC95%: 55-74,8) para los casos que ocurrieron al menos 14días y 28días después de la vacunación, respectivamente. La eficacia de la vacuna fue algo mayor en Estados Unidos (74%) que en Sudáfrica (52%), donde la cepa dominante ha sido la variante B.1.351.
Todos fueron seguidos durante una media de 8semanas después de la vacunación. Las reacciones adversas notificadas con mayor frecuencia fueron dolor en el lugar de la inyección (49%), cefalea (39%), astenia (38%) y mialgias (33%). La mayoría de estos efectos secundarios fueron de intensidad leve a moderada y duraron de 1 a 2días.
Esta vacuna ha sido autorizada por la FDA18 y la EMA19 para su uso de emergencia. Durante su aplicación poblacional, la FDA detecto casos aislados de fenómenos de trombosis-trombocitopenia similares a los registrados con la vacuna Vaxzevria® de AstraZeneca, lo que ha condicionado su vigilancia específica sistemática como efecto adverso de especial interés y la actualización de su ficha técnica incluyendo esta posibilidad.
Criterios de priorización de vacunaciónSi bien el objetivo es la vacunación universal, en el contexto de un suministro limitado de vacunas se ha establecido una priorización de la utilización de vacunas frente a la COVID-19, que fundamentalmente ha incluido a las personas más expuestas o de mayor riesgo de curso grave de enfermedad, una estrategia común para otras enfermedades como la gripe y la enfermedad neumocócica, con la que comparte grupos de riesgo. En la práctica, esta estrategia se ha concretado en nuestro país en 15 grupos de población: personal sanitario y sociosanitario (incluyendo personas que prestan cuidados a las personas vulnerables en sus hogares); residentes en centros de mayores; población general mayor de 64años; personas con gran dependencia; personas con condiciones de riesgo; personas que viven o trabajan en comunidades o entornos cerrados; personas pertenecientes a poblaciones vulnerables por su situación socioeconómica; personas con trabajos esenciales; personal docente; población infantil; población adolescente y joven (mayores de 16años); población adulta; población de áreas de alta incidencia y/o situaciones de brotes; embarazadas; y población seropositiva a SARS-CoV-220. Se utilizarán todas las vacunas disponibles de manera simultánea y en función de sus fichas técnicas.
2. Vacunación frente a neumococoSituación actual de la infección neumocócica en EspañaLa enfermedad neumocócica está asociada a elevadas tasas de morbimortalidad en todo el mundo y genera un elevado coste sanitario, principalmente debido a que está asociada a periodos largos de hospitalización21. Un estudio nacional reciente sobre la infección neumocócica en hospitales españoles entre 2008 y 2017 mostraba una incidencia hospitalaria del 31,1/10.000 pacientes, con una edad media de 63años, y con la neumonía neumocócica como causa del 64%, con una mortalidad intrahospitalaria del 7,0%, una estancia media de 11,1días y un coste medio de 5.676euros22. El incremento de los costes sanitarios en los próximos años, así como el aumento de la edad y la presencia de patologías crónicas, deben tenerse en cuenta para mejorar las estrategias de vacunación de estos grupos.
Durante la década de 2009 a 2019 se observa que mientras que la incidencia de enfermedad neumocócica invasora (ENI) por serotipos vacunales en menores de 2años se ha visto reducida en un 89%, esta disminución ha sido tan solo del 50% en adultos de 65años y de mayor edad, donde todavía el 25% de los casos son producidos por serotipos incluidos en VNC13. Además, los serotipos más frecuentes en adultos de 65años o mayores fueron, por orden, los serotipos 8, 3, 22F, 12F y 19A. El uso de la vacuna VNC13 en población pediátrica mostró un efecto indirecto en la población adulta, reduciéndose la carga de enfermedad por serotipos vacunales en adultos. Sin embargo, no se observó este efecto frente al serotipo3 en adultos, lo que contrasta con una reducción del 38% de casos de ENI por este serotipo en población pediátrica. Estos resultados sugieren que la vacunación pediátrica no es capaz de frenar de forma indirecta los casos de ENI por serotipo3 en población adulta23. En este mismo estudio se objetiva que en las comunidades autónomas (CCAA) donde se vacuna a los adultos inmunocompetentes con VCN13 existe una mayor reducción de los casos por serotipos incluidos en VCN13, incluyendo el serotipo3, en comparación frente aquellas CCAA donde se vacuna preferiblemente con VPP23, sin que se aprecien diferencias en los casos por otros serotipos no incluidos en VNC1323.
Prevención de la enfermedad neumocócica en el contexto de infecciones respiratorias de etiología viralEl papel del neumococo como co-patógeno o principal causa de sobreinfección en pacientes con infecciones virales respiratorias es ampliamente conocido. Ya en anteriores pandemias, como la de 1918, se pudo objetivar que el neumococo constituía la causa más frecuente de sobreinfección bacteriana24. Se ha estimado que durante la pandemia de gripe de 2009-2010 la prevención de la infección secundaria por neumococo podría haber reducido hasta el 20% de las muertes25. También es conocida la relación estacional de la incidencia de la infección neumocócica con la gripe estacional o el virus respiratorio sincitial26,27.
La prevalencia y el impacto del neumococo en la gravedad de la patología infecciosa de pacientes que padecen infecciones por el virus SARS-CoV-2 todavía no están muy aclarados. Estudios en los que se han analizado las co-infecciones en pacientes hospitalizados en intensivos por neumonías debidas a SARS-CoV-2 han identificado el neumococo como una de las principales causas de co-infección28,29. En España también hay evidencias, tanto en población pediátrica como adulta, que demuestran que la co-infección de neumococo con el virus SARS-CoV-2 agrava la severidad del proceso infeccioso30-32. Aunque la información sobre el papel del neumococo en las infecciones por SARS-CoV-2 todavía es limitada, se ha propuesto que la vacunación antineumocócica podría disminuir las infecciones secundarias28-33, encontrándose que personas vacunadas frente al neumococo tienen menos probabilidad de dar positivo en un test frente a SARS-CoV-234. De hecho, cuanto mayor es la cobertura vacunal antineumocócica (tanto en niños como en adultos), menores son las tasas de morbimortalidad por el virus SARS-CoV-235. Este efecto beneficioso de la vacunación también se ha observado recientemente frente a otros coronavirus responsables de patología respiratoria, en los que la vacunación pediátrica con vacuna conjugada antineumocócica redujo la hospitalización en niños con y sin VIH36. Todas estas evidencias han permitido a la OMS y a la UNICEF reforzar el interés de mantener los programas de vacunación antineumocócica para proteger de las posibles co-infecciones y reducir la gravedad de las neumonías en el actual contexto de pandemia por el virus SARS-CoV-237.
Estado actual de la vacunación antineumocócica en EspañaEl Ministerio de Sanidad anualmente publica el calendario común de vacunación a lo largo de toda la vida recomendando la vacunación frente al neumococo a partir de los 65años en el calendario de 202138.
En los últimos años las CCAA han ido incorporando de forma progresiva la vacunación antineumocócica conjugada como parte de su calendario vacunal, si bien en indicaciones y momentos diferentes. En concreto:
a) Pacientes inmunodeprimidos y/o de alto riesgoEn este grupo se incluyen los pacientes con inmunodeficiencias y deficiencias del sistema de complemento, tratamiento inmunosupresor, asplenia o disfunción esplénica grave, infección VIH, insuficiencia renal crónica y síndrome nefrótico, trasplante, fístula de LCR o implante coclear, antecedente de enfermedad neumocócica invasora confirmada, cirrosis hepática y alcoholismo crónico, síndrome de Down. Todas las CCAA vacunan con pauta secuencial: vacunas PCV13 +PPV23, separadas idealmente 12meses (al menos 8semanas)39.
b) Pacientes con factores de riesgo y/o patología crónicaAunque hay CCAA en las que todavía la recomendación es exclusivamente con la vacuna PPV23, otras han incorporado la vacuna antineumocócica conjugada en pauta secuencial, como Asturias40 y Andalucía, para adultos de 65 o más años con una patología crónica o menores de 65años con al menos dos patologías crónicas41.
Con pauta única de PCV13 se vacuna en Madrid42 y en Andalucía para pacientes hasta 64años con solo una patología crónica, y para quienes hayan sido hospitalizados con COVID-19 grave43.
c) Indicación por edadEntre las CCAA que vacunan con PCV13 a los adultos de 60/65años en pauta secuencial se encuentran Galicia44, La Rioja45, Asturias40 y Castilla-León46 a todos los mayores de 65años.
Madrid42 y Andalucía47 vacunan a todos los mayores de 60años con una única dosis PCV13 (en el caso de Andalucía, si no presentan otros factores de riesgo).
d) Nuevas indicacionesDurante la temporada 2020-2021 se ha incluido la vacunación con PCV13 en la Comunidad de Castilla-La Mancha48 en grupos de riesgo, en Galicia49 y en La Rioja50 en personas en residencias de tercera edad, y en Murcia51 y las Baleares52 en personas institucionalizadas ≥65años.
Cambios en recomendaciones oficiales de vacunación antineumocócicaDesde la anterior actualización, el Advisory Committee on Immunization Practices (ACIP) americano cambió en 2019 la recomendación de vacunación con PCV13 para mayores de 65años inmunocompetentes por una decisión clínica compartida médico-paciente, en base al potencial riesgo de dicho paciente, como son los pacientes institucionalizados o los que residen en zonas con menores coberturas vacunales infantiles53.
Dentro de sus recomendaciones para la prevención y control de infecciones en residencias de cuidados a largo plazo, la OMS también recomienda la vacunación anual de la gripe y la vacuna conjugada PCV1337.
Considerando los datos epidemiológicos españoles y los serotipos más frecuentes responsables de enfermedad neumocócica invasiva en adultos ≥65años anteriormente expuestos, desde el grupo de Neumoexpertos recomendamos continuar vacunando con VNC13 a los adultos inmunocompetentes con patologías crónicas y a la población de 65 o más años de edad. No obstante, y debido al aumento de otros serotipos no incluidos en VCN13, especialmente en la población adulta, como son los serotipos 8, 22F y 12F, y al desarrollo de nuevas vacunas conjugadas con más valencias, planteamos que una vez sean autorizadas, se deberán replantear las actuales recomendaciones de vacunación antineumocócica del adulto, para su sustitución por las nuevas vacunas de cobertura ampliada.
Nuevas vacunas antineumocócicas conjugadas pendientes de aprobación por la Agencia Europea de Medicamentos (EMA)- •
Vacuna conjugada 15-valente. Esta vacuna añade a los serotipos incluidos en VCN13 los serotipos 22F y 33F. El serotipo 22F produce una elevada morbimorbilidad en los mayores de 65años. La fracción de ENI potencialmente prevenible mediante vacunación con VCN15 en ≥65años se estima en el 31%54.
- •
Vacuna conjugada 20-valente. Esta vacuna añade a los serotipos incluidos en VCN13 y VCN15 los serotipos 8, 10A, 11A, 12F y 15B. Con esta vacuna la fracción estimada de enfermedad potencialmente prevenible mediante vacunación es del 61%54.
La gripe, hasta la aparición de la COVID-19, era, según datos del European Centre for Disease Prevention and Control (ECDC), la enfermedad infecciosa con mayor morbimortalidad en Europa55. La población mayor de 64años concentra la mayoría de los casos graves, como muestran los datos de hospitalizaciones en España, con un 47% de las mismas en dicha población en la temporada 2019-2020. La mayoría de estos pacientes presentaban algún factor de riesgo de complicaciones de gripe, siendo la complicación más frecuente, en el 78% de los casos, la neumonía56. Como ha sucedido en las últimas temporadas de gripe en nuestro país, las coberturas vacunales en este grupo de mayores de 64años (53,65%) siguieron muy lejos del 75% recomendado por la OMS en la temporada 2019-2020 según los datos oficiales56.
En esta temporada pandémica 2020-2021 las coberturas han mejorado sustancialmente, como muestran los datos proporcionados por el gripómetro (https://gripometro.es/), una herramienta de consulta telefónica que estima en tiempo real las coberturas de vacunación antigripal. Estos datos muestran un aumento del 12% en las coberturas en mayores de 64años con respecto a 2019, siendo del 20 y del 16% en los enfermos crónicos y en los sujetos con enfermedad respiratoria, respectivamente. En los sujetos de 18 a 64años con enfermedad crónica y en embarazadas el aumento respecto a 2019 se estima que es del 25%57.
También ha habido una notable mejora en las coberturas de los profesionales sanitarios (del 41,8% en 2019 al 73,9%), lo que, junto con la pandemia por SARS-CoV-2, ha podido jugar un rol esencial en la mejora de coberturas poblacionales.
Si bien la mortalidad asociada a la gripe se debe fundamentalmente a sobreinfecciones bacterianas (principalmente neumocócicas) o a descompensaciones de una enfermedad de base, la co-infección neumocócica posterior a la gripe puede ocasionar una sinergia letal58. El virus gripal causa daño epitelial alveolar y disrupción del surfactante, lo que conduce a la exposición de la membrana basal y de las células epiteliales respiratorias progenitoras, determinando este hecho dos importantes consecuencias: facilitar la adherencia bacteriana en el epitelio expuesto y dificultar la reparación del epitelio, de forma que el daño se perpetúa59. Un trabajo reciente ha puesto de manifiesto que el virus gripal aumentaría la permeabilidad vascular, facilitando sustratos que favorecerían y perpetuarían la infección neumocócica60. Además, el virus influenza produce una disminución del aclaramiento mucociliar, lo que impediría la limpieza de los gérmenes adheridos al epitelio respiratorio dañado. En esta sinergia, y de forma simultánea, el neumococo respondería con distintos factores de virulencia que le permitirían adherirse a los receptores epiteliales expuestos. Por otro lado, la respuesta inmune innata desencadenada por las toxinas virales y bacterianas en el punto de infección produciría una respuesta inflamatoria exagerada con gran afluencia de neutrófilos y liberación de citoquinas que perpetuarían el daño tisular epitelial y favorecerían la progresión de la neumonía hacia formas invasivas61.
Ahondando en este mismo mecanismo etiopatogénico se han publicado trabajos que señalan la relación entre la infección respiratoria por virus gripal y la respuesta inflamatoria desencadenada a nivel de la microcirculación cerebral o miocárdica. Este hecho determinaría la rotura o la erosión de la placa de ateroma y fenómenos de agregación plaquetaria que favorecerían la aparición de un accidente vascular cerebral61 o de infarto de miocardio, constatándose un riesgo, para infarto de miocardio, hasta 6 veces superior en pacientes mayores de 77años y en los primeros 7días de la infección gripal59.
Otro trabajo de revisión analiza la variación del riesgo cardiovascular con la gravedad de la infección y el tiempo transcurrido desde el inicio de la misma, observándose una correlación positiva entre la gravedad de la infección y el nivel de riesgo cardiovascular. Padecer una neumonía supone un riesgo cardiovascular que se mantiene elevado durante años desde el inicio de la infección62.
Por otro lado, cabe destacar la interacción del virus de la gripe y SARS-CoV-2. Estudios recientes han hallado una correlación negativa entre cobertura vacunal y mortalidad por COVID-19 en Italia, en los que la co-infección está relacionada con un riesgo de muerte 2,27 veces mayor (IC95%: 1,23-4,19) que en la infección aislada por SARS-CoV-2, y 5,92 veces mayor (IC95%: 3,21-10,91) que en ausencia de ambos virus63. Además, se ha visto que la vacunación está asociada a una reducción de la mortalidad por COVID-19 en los adultos mayores64 y a una menor probabilidad de formas graves de la enfermedad65. Finalmente, un estudio del Public Health England66 muestra los beneficios de la vacunación antigripal en la época del COVID-19, así como la existencia de interacción y una cierta sinergia (más que competencia) de ambos virus cuando afectan, de forma simultánea, a algunas personas.
Recomendaciones de vacunación antigripalLas actuales estrategias de vacunación antigripal en nuestro país tienen como objetivo la reducción de la carga de enfermedad grave asociada a la infección gripal. Son numerosos los estudios que muestran la efectividad de la vacunación antigripal en la reducción de eventos cardiorrespiratorios asociados a la gripe67; uno de los más recientes, un estudio de serie de casos autocontrolados, a nivel nacional, llevado a cabo en Noruega, demostró una reducción del 28% del riesgo de infarto agudo de miocardio, del 23% en el riesgo de ictus y del 27% de embolismo pulmonar en las 2semanas siguientes a la vacunación en comparación con el periodo previo a la vacunación68.
En la actualidad en Europa se muestra una tendencia a aumentar los márgenes de la edad recomendada para la vacunación antigripal, para cubrir una mayor población con enfermedades crónicas69, en la misma línea que nuestra recomendación de vacunación antigripal en los 60años (tabla 1) se posiciona, por ejemplo, el Comité Permanente de Vacunación del Instituto Robert Koch de Alemania (STIKO, por sus siglas en alemán)70.
Desde hace pocos años se empezaron a emplear en España vacunas tetravalentes con el fin de evitar las discordancias entre la cepaB incluida en la vacuna y la circulante en cada temporada, como en 2017-201871.
Actualmente hay disponibles en España vacunas antigripales con diferente composición (diferente cantidad de antígeno, con y sin adyuvantes, trivalentes y tetravalentes), diferentes procesos de fabricación (en huevos, de cultivo celular) y con diferentes indicaciones, todas ellas inactivadas72-77.
Cabe destacar tres novedades en vacunación antigripal. La primera fue la llegada, en 2019, de una vacuna de cultivo celular que disminuye el riesgo de mutación de la cepa vacunal durante el proceso de fabricación y no requiere la adición de antibióticos ni conservantes78. La fabricación a partir de células MDCK podría mejorar la efectividad de la vacuna en temporadas en las que ocurra el fenómeno de adaptación al huevo durante el proceso de fabricación. Respecto a esta vacuna, el Comité de Inmunización de Canadá (NACI, por sus siglas en inglés), el ECDC europeo o el STIKO alemán indican que se requieren estudios adicionales que confirmen su mejor efectividad frente a las vacunas producidas en huevo. En cualquier caso, su eficacia en la prevención de la gripe ha quedado suficientemente probada70,79,80.
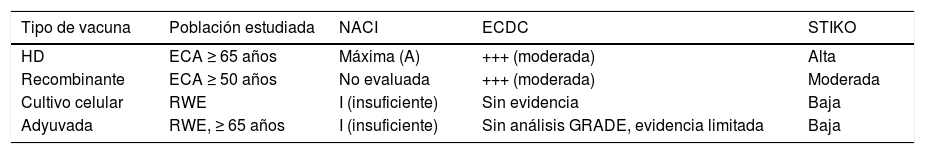
La segunda novedad ha sido la llegada de una vacuna de alta carga antigénica (60μg de HA por cepa) para sujetos a partir de los 65años de edad que se ha utilizado en la temporada 2020-2021 en las residencias de ancianos y que ha demostrado de forma consistente una mayor inmunogenicidad, eficacia y efectividad que las vacunas de 15μg/cepa sin que se vea afectado su perfil de seguridad81,82. Recientes revisiones con metodología GRADE o similar de organismos internacionales independientes, como el NACI canadiense, el ECDC europeo o el STIKO alemán, confirman la mayor eficacia y efectividad de la vacuna de alta dosis con el mejor nivel de evidencia entre las vacunas antigripales70,79,80. Ver cuadro comparativo en tabla 3.
Evaluación de evidencia científica de las nuevas vacunas de gripe en comparación con las vacunas antigripales clásicas. Se muestran ejemplos de la agencia canadiense (NACI) que establece el máximo nivel de evidencia en A, del Centro para el Control de Enfermedades Europeo (ECDC), cuyo grado de evidencia más alto se establece en ++++, y del Comité decisor alemán (STIKO)
| Tipo de vacuna | Población estudiada | NACI | ECDC | STIKO |
|---|---|---|---|---|
| HD | ECA ≥ 65 años | Máxima (A) | +++ (moderada) | Alta |
| Recombinante | ECA ≥ 50 años | No evaluada | +++ (moderada) | Moderada |
| Cultivo celular | RWE | I (insuficiente) | Sin evidencia | Baja |
| Adyuvada | RWE, ≥ 65 años | I (insuficiente) | Sin análisis GRADE, evidencia limitada | Baja |
ECA: ensayos clínicos aleatorizados; RWE: datos de evidencia en mundo real.
En cualquier caso, la llegada de estas nuevas herramientas preventivas debería suponer una mejora frente a las ya existentes hasta ahora.
Teniendo en cuenta que la mayoría de los casos graves de gripe con complicaciones neumónicas suceden en mayores de 65años, y que en ellos la respuesta inmune es menos efectiva debido a la inmunosenescencia, es importante el uso de vacunas específicas para este grupo etario. En Alemania, esta temporada 2020-2021 se ha establecido el uso preferencial de vacuna cuadrivalente de alta dosis en la población mayor de 60años70. Los beneficios económicos de la vacuna de alta dosis en la población mayor o igual a 65años de edad se han demostrado en 9 evaluaciones económicas mediante estudios de coste-efectividad realizados a nivel mundial con diferentes metodologías y acercamientos, concluyendo todas ellas que su utilización es coste-efectiva cuando se consideran las hospitalizaciones por causas respiratorias y puede generar ahorros al sistemas de salud (estrategia dominante) si, además, en su evaluación se contemplan los eventos cardiovasculares y respiratorios relacionados con la gripe83-91.
La última de las novedades es la aprobación, a nivel europeo, de una vacuna recombinante que elimina por completo el riesgo de mutación del virus vacunal durante el proceso de fabricación y que ha demostrado, en un ensayo clínico aleatorizado y doble ciego, un 30% más de eficacia que la vacuna clásica gripal en el grupo de mayores de 50años92.
A futuro, la aparición de una vacuna antigripal universal que proporcionase protección cruzada y duradera frente a diversas cepas del virus, y que solventara el problema de la prevención de la gripe y sus complicaciones, parece situarse todavía lejos de la práctica clínica93.
4. Vacunación frente a la tosferinaLa infección por Bordetella pertussis sigue siendo, a día de hoy, un problema importante de salud pública. Si bien el grupo más afectado y con mayores consecuencias en términos de hospitalización y fallecimientos son niños menores de un año, cada vez existe mayor evidencia sobre la afectación a otros grupos etarios y a grupos con condiciones médicas específicas (asma, enfermedad pulmonar obstructiva crónica [EPOC], obesidad, inmunodepresión, entre otras)94.
Ni la infección natural ni la inmunización mediante las vacunas disponibles confieren inmunidad de por vida, por lo que el planteamiento de estrategias que cubran las diferentes etapas vitales y situaciones de riesgo particulares resultan de especial interés.
Según datos del último informe del ECDC recientemente publicado, en el año 2018 se notificaron un total de 35.627 casos de tosferina por parte de 30 países de la Unión Europea, siendo Alemania, Países Bajos, Noruega, España y Reino Unido los que agrupaban el 72% de todos los casos notificados. En este sentido, la tasa de notificación en este año fue de 8,2 casos por 100.000 habitantes, siendo específicamente de 44,4 casos por 100.000 habitantes en el grupo de niños menores de un año95.
La presentación sintomática clásica de la tosferina, con las tres fases, catarral o prodrómica, paroxística o de estado y de convalecencia, se limita a los recién nacidos y personas no vacunadas. En personas adultas y en las correctamente vacunadas frente a la tosferina, las fases descritas pueden no estar presentes o hacerlo de una forma subclínica, expresándose en muchos casos únicamente con tos paroxística de duración superior a 2semanas. Todo ello dificulta enormemente la sospecha clínica, el diagnóstico y la notificación epidemiológica96,97.
Esta dificultad añadida promueve, al mismo tiempo, otra situación de especial preocupación, ya que el tratamiento puede demorarse, aumentando el riesgo de brotes en el ámbito doméstico, familiar y laboral, en los que se estima que la tasa de ataque puede ser de hasta el 90%98. Por otro lado, es bien conocido que desde el punto de vista epidemiológico esta enfermedad se encuentra infra-notificada, sabiendo que afecta a un mayor número de personas que las identificadas en las estadísticas nacionales e internacionales.
Vacunas y estrategias de vacunación frente a tosferina disponibles en la actualidadA pesar de que las vacunas son la mejor estrategia preventiva para hacer frente a esta enfermedad, desde hace años se observan limitaciones con respecto a la protección que estas confieren a largo plazo. Se sabe que la protección conferida a través de las vacunas comienza a descender a partir de los 2años de haber recibido las vacunas.
En el informe del ECDC mencionado anteriormente, el 62% de los casos totales notificados correspondieron a personas mayores de 14años, y el 34% de los casos habían recibido 4 o más dosis de vacunas con componente anti-pertussis95. Estos hallazgos que, de manera similar, habían sido observados en informes previos, han supuesto en algunos países las mejoras de los calendarios de vacunación del adolescente o adulto, sin antecedentes de vacunación, en los que se cambia la dosis de vacuna frente tétanos-difteria por una dosis de tétanos-difteria-tosferina en el calendario sistemático infantil a los 13-14años, y una dosis de tétanos-difteria-tosferina en la pauta de primovacunación frente a tétanos-difteria en el adulto sin antecedentes previos de vacunación frente a tétanos-difteria99.
En la tabla 4 se describen las vacunas disponibles en España (composición, dosis y edad mínima de administración) que contienen tosferina.
Vacunas que contienen antígeno de tosferina disponibles en España para la administración en paciente adulto. Se detalla composición, dosis y edad mínima de administración
| Nombre comercial | Laboratorio | Composición | Dosis | Edad de administración |
|---|---|---|---|---|
| Boostrix Polio® | GSK (dTpa-IPV) | Toxoide tetánico; toxoide diftérico; antígenos de Bordetella pertussis (TP, HAF, PRN); virus de la poliomielitis (tipos 1, 2 y 3) inactivados | 0,5 ml | Edad mínima: 3 años |
| Boostrix® | GSK (dTpa) | Toxoide tetánico; toxoide diftérico; antígenos de Bordetella pertussis (TP, HAF, PRN) | 0,5 ml | Edad mínima: 4 años |
| Triaxis® | Sanofi-Pasteur (dTpa) | Toxoide tetánico; toxoide diftérico; antígenos de Bordetella pertussis (TP, HAF, PRN, FIM2, FIM3) | 0,5 ml | Edad mínima: 4 años |
Referencias de la tabla:
Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica Boostrix Polio [consultado 4 Mar 2021]. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/66462/FT_66462.html.pdf
Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica Boostrix [consultado 4 Mar 2021]. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/63684/FT_63684.html.pdf
Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica Triaxis [consultado 4 Mar 2021]. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/71870/FT_71870.html.pdf
En los últimos años se ha visto que la infección por Bordetella pertussis puede afectar de manera concreta a ciertos grupos con condiciones médicas específicas (asma, EPOC, obesidad, inmunodepresión, entre otras)94, por lo que la valoración de vacunación frente a tosferina en estas situaciones sería particularmente beneficiosa.
Se sabe que la carga de enfermedad medida en términos de complicaciones médicas y necesidades de hospitalización puede ser mayor en estos grupos, sobre todo en el caso del asma, y por ello, y teniendo en cuenta la infra-notificación por falta de realización de diagnóstico adecuado de la infección97, los Centers for Disease Control and Prevention (CDC) y la Global Initiative for Chronic Obstructive Lung Disease (GOLD) recomiendan oficialmente la vacunación frente a tosferina en los adultos con EPOC que no hubieran sido vacunadas en la adolescencia100.
Así pues, la vacunación frente a tosferina en el adulto que no haya recibido esta vacuna previamente, y más aún en los grupos de alto riesgo de complicaciones por Bordetella pertussis, debería incorporarse, junto con la vacunación antigripal y antineumocócica, en la estrategia preventiva de infecciones respiratorias del adulto.
DiscusiónLa llegada del SARS-CoV-2 ha revolucionado el panorama de la de NAC y constituye la etiología más frecuente en el adulto en el momento actual. Si bien se ha visto claramente disminuida101,102 la circulación de otros patógenos respiratorios en el contexto pandémico, en la actual situación de elevada transmisión comunitaria del SARS-CoV-2, y considerando además la probabilidad de interacción con neumococo y gripe como coadyuvantes o agravantes en el caso de co-infección24-33,63-66, es necesario reforzar, además de las medidas de control de la transmisión general de virus respiratorios y la vacunación frente a COVID-19, la vacunación neumocócica y antigripal.
La vacunación antineumocócica del adulto en nuestro país pivota ya mayoritariamente sobre la utilización de la vacuna conjugada, bien en exclusiva en indicaciones por edad en pacientes sin otra patología acompañante, o bien en pauta secuencial con la vacuna polisacárida, tanto por edad, como en pacientes con factores de riesgo o enfermedad de base. Parece razonable desear la unificación de todos los calendarios de las diferentes CCAA, y la llegada de las nuevas vacunas conjugadas frente a neumococo de 15 y 20 serotipos puede constituir una oportunidad importante para lograrlo.
El inicio de la utilización de vacunas antigripales tetravalentes en España parece una respuesta a las recientes recomendaciones oficiales y una acción que se ha implementado en gran cantidad de CCAA, consiguiendo así una protección ampliada frente a las dos cepas tipoB, independientemente de la que circule en cada temporada. Además, la llegada de nuevas vacunas especialmente diseñadas para la población más vulnerable, como la tetravalente de alta dosis autorizada en institucionalizados y mayores dependientes, supondrán un avance en la protección frente a la gripe y sus consecuencias. Sin embargo, a pesar de esto, debería producirse un mayor esfuerzo por alcanzar el objetivo establecido en cuanto a coberturas vacunales antigripales y que estas se mantuvieran en el tiempo.
La tosferina también puede ser una causa de neumonía en el adulto, y consideramos importante resaltar la importancia de la vacunación frente a tosferina en el adulto que no haya recibido esta vacuna previamente, y más aún en los grupos de alto riesgo de complicaciones, como estrategia preventiva global de las infecciones respiratorias que causan neumonía en el adulto.
La propuesta de calendario que realizamos, además de las limitaciones inherentes a la metodología aplicada, sobre todo por las recomendaciones en las que la evidencia es menor y la recomendación que realiza el grupo es arbitraria, incluye exclusivamente las patologías de NAC para las que existen vacunas con indicación en el adulto.
Nuestras recomendaciones no pretenden interferir con las recomendaciones oficiales vigentes en cada comunidad o ciudad autónoma de nuestro país, ya que en algunos casos no están financiadas por el Sistema Nacional de Salud. No obstante, este calendario tiene una perspectiva de salud individual y persigue orientar la recomendación del profesional sanitario a cada usuario individual, de modo que se pueda realizar una información y una educación individualizadas que permitan al potencial candidato vacunal la decisión que más le convenga en función de la indicación y las circunstancias particulares del individuo.
En conclusión, este documento de posicionamiento sobre la vacunación frente a la neumonía adquirida en la comunidad del adulto por parte del grupo de Neumoexpertos en Prevención, a través de las evidencias disponibles, pone de relieve la importancia de la vacunación frente a SARS-CoV-2, neumococo, gripe y tosferina como medidas de prevención frente a una patología de alta prevalencia como es la NAC del adulto.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesNeumoexpertos en prevención (NEP) ha recibido fondos de Pfizer a través del Instituto de Investigación Sanitaria de Santiago para cobertura logística de reuniones de sus miembros.
ER ha recibido honorarios como consultor/asesor y/o ponente, así como becada para asistir a conferencias o cursos por GlaxoSmithKline (GSK), Sanofi Pasteur MSD, Merck, Sanofi Pasteur, Pfizer y Novartis.
IRC ha recibido honorarios por ponencias de MSD, GSK, Sanofi y Pfizer; ha recibido becas/ayudas de investigación de Sanofi Pasteur, MSD, Novartis y Pfizer; ha recibido honorarios por consultorías para Pfizer, MSD, GSK y Sanofi; y ha participado como subinvestigador en ensayos clínicos de vacunas de Ablynx, Abbot, Seqirus, Sanofi Pasteur MSD, Sanofi Pasteur, Cubist, Wyeth, Merck, Pfizer, Roche, Regeneron, Jansen, Medimmune, Novavax, Novartis y GSK, siendo todos los honorarios pagados a la institución.
EM ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por AstraZeneca, Boehringer Ingelheim, Esteve, GSK, MSD, Menarini, Mundifarma, Novartis, Orion, Pfizer, Roche, Rovi, Takeda y TEVA.
JEY ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por Pfizer, GSK y MSD.
MFP ha recibido honorarios por ponencias de diferentes promotores de vacunas (MSD, GSK, Pfizer, Sanofi, Seqirus) como asesora o docente en actividades científicas. También ha recibido becas/ayudas para la asistencia a actividades científicas o formativas.
DO ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por Lilly, Boehringer Ingelheim, Novartis, Pfizer, Takeda, Esteve, Almirall, GSK, AstraZeneca, Chiesi, Mundipharma, Teva, Solvay Pharma, Rovi, Gebro Pharma, Janssen, MSD, Novo Nordisk y Menarini.
IJ ha colaborado como ponente y/o asesor en iniciativas y proyectos promovidos por Pfizer, Sanofi Pasteur, así como becado para asistencia a cursos o congresos por parte de Menarini y Esteve.
AG ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por Pfizer, GSK, Janssen, MSD y Sanofi Pasteur.
JM ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por AstraZeneca, Boehringer Ingelheim, Esteve, GSK, MSD, Menarini, Mundifarma, Novartis, Pfizer, Roche, Rovi, Sandoz, Takeda y TEVA.
JLDM ha colaborado como ponente y/o asesor para asistir a congresos o cursos de Pfizer y AstraZeneca
ML ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por Pfizer.
FMT ha recibido honorarios de GSK, Pfizer Inc, Sanofi Pasteur, MSD, Seqirus, Novavax y Janssen como asesor, consultor, o ponente fuera del objetivo del presente trabajo. FMT ha trabajado como investigador principal en ensayos clínicos promovidos por las compañías farmacéuticas arriba mencionadas y además Ablynx, Regeneron, Roche, Abbott y MedImmune, siendo todos los honorarios pagados a la institución.
Estos autores han contribuido de forma similar al manuscrito.
Neumoexpertos en Prevención (www.neumoexpertos.org), Grupo nacional de trabajo en la prevención de la neumonía auspiciado por el Instituto de Investigación Sanitaria de Santiago.