Al reseñar de forma escueta, casi esquemática en ocasiones, las evidencias disponibles en el momento de redactar el texto propuesto, nos planteamos un doble objetivo:
1) Crear una voz única que agrupara la de las Sociedades Científicas Españolas más influyentes para que los mensajes transmitidos por todas ellas fueran similares en forma y fondo, evitando en lo posible mensajes confusos o contradictorios.
2) Ofrecer a los profesionales sanitarios y a las autoridades sanitarias un documento de evidencias y recomendaciones que les sirviera de referencia básica en sus actividades preventivas y asistenciales y en los procesos de toma de decisiones.
Creemos, como grupo, que el objetivo de alcanzar amplias coberturas vacunales es prioritario. Una vacuna tan eficaz, segura y eficiente como la vacuna frente al VPH debe ser un bien preventivo al alcance del mayor número de las mujeres que las evidencias disponibles definan como diana de vacunación.
Como coordinador del proyecto, debo resaltar el gran trabajo de todos los integrantes del Grupo, todos ellos profesionales del más alto prestigio y a quienes agradezco enormemente su dedicación y su gran sentido del trabajo en equipo.
EL VIRUS DEL PAPILOMA HUMANO (VPH) Y LESIONES ASOCIADASCuatro de cada 10 mujeres son positivas para VPH al año de su debut sexual; 6 de cada 10, a los 2 años. Se estima que el 80% de la población mundial sufrirá un episodio VPH a lo largo de su vida1,2.
Se han descrito más de 120 tipos de VPH. Un tipo se diferencia de otro en que los aminoácidos estructurales de la proteína mayor L1 de su cápside presentan una diferencia secuencial superior al 10%3. De doce de ellos, hay evidencia establecida para que sean considerados de alto riesgo (AR) para el desarrollo de un cáncer de cuello de útero (CCU); de seis tipos más, la evidencia no es aún concluyente4.
El VPH es causa necesaria pero no suficiente para el desarrollo de un CCU5. El VPH es la causa del 100% de los cánceres de cuello uterino, escamosos o glandulares6: no hay posibilidad de desarrollo de un CCU en ausencia de VPH. Además, se relaciona causalmente con el 90% de los cánceres de canal anal, con el 40% de los cánceres de vulva y pene y con el 12% de cánceres orofaríngeos. Su relación con otros cánceres (de piel no melanómicos, subungueal, retinoblastoma) está siendo investigada7.
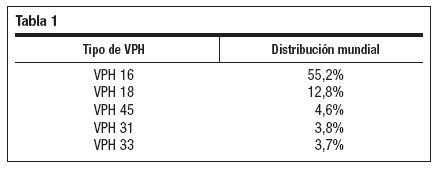
La distribución mundial de tipos de VPH en biopsias de CCU y en biopsias de neoplasias intraepiteliales de alto grado (CIN 3) ha sido publicada recientemente8. En CCU la distribución para los cinco tipos más prevalentes se recoge en la tabla 1.
Tabla 1
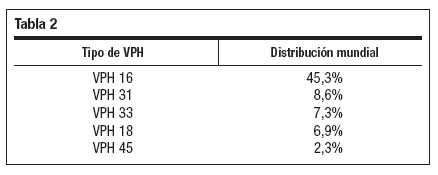
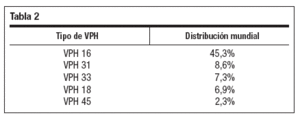
En CIN 2+, la distribución para los cinco tipos más prevalentes aparece en la tabla 2.
Tabla 2
En España, datos no publicados9 describen que en el CCU el VPH 16 es el tipo más prevalente, (64,5%), seguido por el VPH 33 (6,1%), el VPH 18 (5,8%), el VPH 31 (3,6%) y el VPH 45 (3,5%). En definitiva, los CCU causados por VPH 16 y/o 18 son el 72,3%. La distribución es bastante uniforme en las provincias estudiadas (Barcelona, Las Palmas, Valencia, Navarra y Madrid).
La incidencia anual media del CCU en España es 8/100.000 mujeres, con un rango que oscila entre 3 en Cuenca y 12 en Mallorca. Estas cifras corresponden al segmento medio-bajo europeo10.
Los registros que informan sobre tasas poblacionales de CIN 3, lesión previa necesaria para el desarrollo de un CCU, muestran cifras del orden del 30/100.000 mujeres/año11.
Datos preliminares de un estudio en curso12 indican que los cuatro tipos de VPH más comunes en cáncer de vulva son 16, 18, 45 y 52; en cáncer de vagina, el tipo 16 es el más frecuente.
Los VPH 6 y 11 se relacionan causalmente con el 90% de las verrugas genitales. Una de cada 10 personas sexualmente activas va a presentar un episodio de verrugas genitales a lo largo de la vida13. En España la incidencia de episodios de verrugas genitales se estima en 182 casos/100.000 personas/año, correspondiendo a 56.446 casos anuales en población general entre 14 y 64 años, de ellos 24.613 en mujeres14.
Se estima que 291 millones de mujeres en el mundo son portadoras de VPH, de las que el 32% tiene VPH 16 y/o 1815. La prevalencia mundial del VPH en mujeres con citología normal presenta una fuerte variación geográfica. Las tasas más altas se observan en Europa del este (29,1%), África (22,1%) y América Central (20,4%); las más bajas, en Europa del sur (6,8%), Europa del oeste (8,4%) y Asia (8%)15.
La infección por el VPH en condiciones de inmunocompetencia desaparece espontáneamente durante el primer o el segundo año.
En España, se estima que el 3% de la población general a partir de los 30-35 años es portadora crónica del VPH. Sólo este grupo presenta riesgo de desarrollar un CCU. A partir de los 50-55 años se observa, en Europa y en toda América un repunte de la prevalencia que podría explicarse por nuevos contactos sexuales o por el envejecimiento del sistema inmunitario que permite la expresión de infecciones latentes hasta entonces indetectables15.
En las mujeres, los VPH–AR persisten más que los VPH de bajo riesgo (BR). La infección múltiple es un importante determinante de persistencia16. El tipo 16 es el que más persiste y el que coloca a la mujer en mayor riesgo de desarrollar un CIN 3 en los siguientes 10 años17.
En los varones, los escasos datos sobre prevalencia e historia natural del VPH indican que la incidencia media acumulada a lo largo de la vida en heterosexuales entre 18 y 44 años oscila entre el 56 y el 65%, con un 26-50% para los VPH–AR. Los homosexuales y bisexuales tienen prevalencias más altas. Los tipos más prevalentes son 16, 31, 51, 84. La duración media de la infección es de 4-5 meses, igual para los virus de AR que para los de BR. El epitelio del pene, sin zonas de conflicto epitelio-epitelio como en el cuello de útero, es menos receptivo a la infección. La infección múltiple y la localización en surco balanoprepucial son variables ligadas directamente a la persistencia18.
LA PREVENCIÓN SECUNDARIA DEL CÁNCER DE CUELLO DE ÚTERO. NUEVAS ESTRATEGIASPero éste es un procedimiento mejorable, ya que la sensibilidad de la citología para CIN 3 no supera, en el mejor de los casos, el 80%20,21, lo que genera reiteraciones en su práctica. Por otra parte, los cribados citológicos se han mostrado ineficaces en la prevención del adenocarcinoma de cuello de útero22.
En España la incidencia del carcinoma escamoso invasor de cuello de útero ha permanecido estable, aunque los últimos datos estiman un incremento anual del orden del 1%23, probablemente por la estructura oportunista del cribado citológico, una estructura muy mejorable24 que penaliza la equidad (la mujer que no consulta no es cribada), tiende a sobreutilizar el recurso en la población con alta frecuentación del sistema sanitario (ineficiencia) y difícilmente alcanza coberturas suficientes (ineficacia). Alcanzar coberturas altas es la variable fundamental relacionada con el éxito de un programa preventivo. Ocho de cada 10 CCU incidentes aparecen en España en mujeres con historia de cribado inadecuado25. La cobertura del cribado citológico en España se ha estimado en un 75,6%, con amplias diferencias territoriales26.
Por otro lado, la incidencia del adenocarcinoma de cuello de útero mantiene una tendencia al incremento en términos absolutos en toda Europa23, probablemente debido a la ineficacia del cribado citológico en su detección.
La citología en medio líquido mejora la calidad de la muestra y acorta el tiempo de lectura, pero no mejora de forma clara la sensibilidad de la citología convencional para CIN 2 o superior y dispara los costes27,28. La lectura automática de las citologías ofrece pequeñas ventajas comparada con la convencional y añade costes al proceso sin mejorar sustancialmente la efectividad29.
En España se ha propuesto una nueva estrategia para el cribado30 que incluye, en mujeres mayores de 35 años, la determinación del ADN del VPH por captura híbrida II combinada con la citología. Está descrito que esta política mejora la efectividad, es más eficiente que el cribado citológico convencional y puede tener impacto en las tasas de adenocarcinoma de cérvix31. No obstante, los datos disponibles apuntan a un escaso seguimiento de estas recomendaciones. Los programas españoles siguen teniendo mayoritaria estructura oportunista, con la citología como única técnica de cribado32. Solamente un estudio piloto en Asturias y el nuevo diseño de los programas de Cataluña, Castilla y Léon y la Comunidad Valenciana introducen en mayor o menor grado la detección del VPH e incorporan a la estrategia la base poblacional.
VACUNAS PROFILÁCTICAS FRENTE AL VPH: SITUACIÓN ACTUALObjetivoEl objetivo a medio plazo de las vacunas es la prevención de las lesiones precursoras del cáncer de cuello de útero, neoplasia intraepitelial de cuello de útero, CIN, especialmente la considerada lesión precursora necesaria, CIN 3. Ambas vacunas podrían prevenir también las neoplasias de vulva y vagina, aunque hasta este momento sólo se han publicado resultados para la vacuna tetravalente.
En el objetivo a corto plazo de la vacuna VPH se espera un impacto apreciable en una gran disminución de resultados citológicos cervicales anómalos33, que incluyen atipias inciertas, escamosas o glandulares (ASC–US, ASC.H y AGC), y lesiones intraepiteliales de bajo grado (L.SIL), que no representan más que la respuesta citohistológica aguda a la presencia viral, pasajera la mayoría de las veces. La evaluación de dichos casos representa una carga elevada de ansiedad para la mujer, trabajo para el profesional y costes para el sistema sanitario.
Una encuesta que incluyó a 12 laboratorios de referencia españoles34 encontró 11.144 resultados citológicos de atipias inciertas y lesiones intraepiteliales para un total de 409.443 citologías, un 3,56%. Tomando en consideración los datos de cobertura citológica española descritos en el estudio Afrodita35, se ha publicado una previsión del potencial preventivo de esta enfermedad de la vacuna tetravalente, con la conclusión de que en España se podría evitar un total de 149.673 resultados citológicos anómalos26.
Además, la vacuna tetravalente ofrece también protección a corto plazo frente a las verrugas genitales y probablemente frente a la papilomatosis respiratoria recurrente, causadas por los tipos 6 y 11 del VPH36.
ComposiciónGardasil®
Vacuna tetravalente que incluye VLP de los tipos 6 (20 mg), 11 (40 mg), 16 (40 mg) y 18 (20 mg) expresadas en células de levadura Saccharomyces cerevisiae CANADE 3C–5 (Cepa 1895). Utiliza como adyuvante hidroxifosfato sulfato de aluminio amorfo37.
Cervarix®
Vacuna bivalente que incluye VLP de los tipos 16 (20 mg) y 18 (20 mg) expresadas en Baculovirus que utiliza células Hi–5 Rix4446 derivadas de Trichoplusia ni. Utiliza como adyuvante AS04, una formulación compuesta por hidróxido de aluminio y MPL (3–O–desacil–4’–monofosforil lípido A) un lipopolisacárido desintoxicado obtenido de Salmonella Minnesota38.
InmunogenicidadGardasil®
Se han publicado datos39 de inmunogenicidad puente entre varones y mujeres de 9 a 15 años y mujeres de 16 a 26 años, demostrando títulos muy altos de anticuerpos neutralizantes en todos los segmentos de edad, siempre muy por encima de los niveles generados por la infección natural.
La evidencia de una respuesta anamnésica se observó en individuos vacunados que eran seropositivos a los tipos relevantes antes de la vacunación. Un subgrupo de individuos vacunados que recibieron una dosis de prueba de Gardasil, 5 años después del comienzo de la vacunación mostraron una rápida y fuerte respuesta anamnésica que excedía las GMT de VPH observadas 1 mes después de la tercera dosis37,40. La demostración de memoria inmunitaria es el marcador principal de protección a largo plazo41.
Hay evidencia de ausencia de interferencia inmunitaria cuando las VLP del VPH 16 se combinan en una vacuna polivalente. Los títulos de GMT para VPH 16 alcanzados por las mujeres vacunadas con Gardasil® fueron los mismos que los alcanzados por las mujeres vacunadas con vacuna monovalente 1642.
Cervarix®
Se ha publicado43 que el sistema adyuvante AS04 induce de forma significativa títulos más altos de anticuerpos tanto frente a VPH 16 como frente a VPH 18, comparado con los mismos antígenos adyuvados con hidróxido de aluminio aislado, así como una mayor frecuencia de linfocitos B de memoria específicos.
También se ha publicado que las mujeres de 10 a 14 años vacunadas con Cervarix® producían títulos de anticuerpos con niveles que doblaban a los producidos por mujeres entre 15 y 25 años44.
Los anticuerpos frente al VPH se han identificado trasudados en los epitelios del tracto genital inferior. En mujeres vacunadas con Cervarix® existe correlación entre los niveles de anticuerpos en suero y los hallados en mucosa cervical45.
Se ha comunicado46 que los títulos de anticuerpos inducidos tras la vacunación con Cervarix® se mantienen al menos 10 veces más elevados en relación con los inducidos tras una infección natural durante al menos 5,5 años y que estos niveles permanecen altos en mujeres hasta 55 años45.
EficaciaLa imposibilidad metodológica y ética de establecer el CCU como variable de eficacia en los ensayos sobre vacunas anti-VPH hizo que la Organización Mundial de la Salud estableciera como variables subrogadas de eficacia la infección persistente y el CIN 2/3 histológicamente documentado47.
Gardasil®
Además, se ha demostrado que en las mujeres vacunadas con Gardasil®53 la presencia de un tipo viral no interfiere ni modifica la protección generada frente a las lesiones producidas por otros tipos virales. La vacunación ha sido al 100% efectiva (intervalo de confianza [IC] del 95%, 79%-100%) en prevenir CIN 2/3 o AIS incidente causados por el tipo o tipos de VPH a los que la mujer era negativa al entrar en el estudio. La eficacia en prevenir lesiones vulvares y vaginales ha sido del 94% (IC del 95%, 81%-99%).
Gardasil®
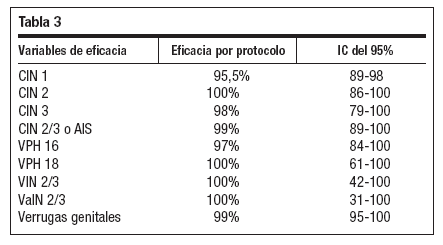
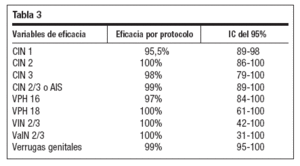
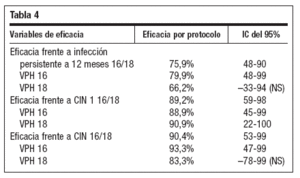
Se han publicado datos de eficacia frente a CIN 1/2/3, AIS, VIN, VaIN y verrugas genitales con seguimiento a tres años48-52. Los resultados de protección frente a las lesiones descritas aparecen recogidos en la tabla 3. también ha mostrado54 efecto protector frente a enfermedad asociada al VPH en mujeres de hasta 45 años. La eficacia frente a enfermedad asociada al VPH en población por protocolo es del 91% para los cuatro tipos vacunales, del 83% para las lesiones asociadas al VPH 16 y 100% para las asociadas al VPH 18.
Tabla 3
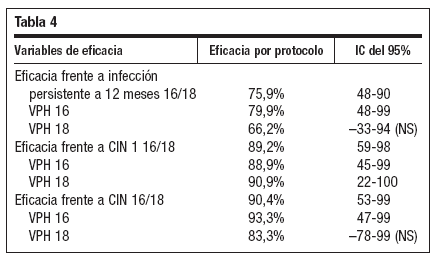
Tabla 4
Cervarix®
Se ha publicado que Cervarix® en mujeres positivas para ADN de VPH no acelera el aclaramiento del virus y no se debe usar para tratar infecciones prevalentes55.
Posología y forma de administración
Gardasil®
– Puede ser administrada de forma concomitante en sitio de inyección diferente con la vacuna de la hepatitis B (recombinante). En noviembre de 2007, la ACIP ha dado autorización para que se pueda administrar simultáneamente con las vacunas Tdap y MCV4.
– No debe ser administrada en el embarazo, pero puede serlo en la lactancia.
– El uso de anticoncepción hormonal no afectó en los ensayos a la respuesta inmunitaria.
– Debe posponerse en individuos que padezcan una enfermedad aguda grave que curse con fiebre. Sin embargo, la presencia de infección leve no es una contraindicación para la inmunización.
Cervarix®
– No se dispone de datos de su administración concomitante con otras vacunas.
– No debe administrarse en el embarazo. Sólo debe administrarse durante la lactancia cuando las posibles ventajas sobrepasen los posibles riesgos.
– No hay evidencia de que el uso de anticoncepción hormonal tenga un impacto en su eficacia.
– Debe posponerse en individuos que padezcan una enfermedad aguda grave que curse con fiebre. Sin embargo, la presencia de una infección leve no es una contraindicación para la inmunización.
En ambas vacunas es muy importante garantizar la aplicación de los protocolos de conservación (cadena de frío), administración (zona anatómica, vía y técnica) y prevención de reacciones adversas (anamnesis previa y vigilancia posvacunal). Asimismo, es importante garantizar el registro y favorecer el cumplimiento del esquema vacunal completo.
SeguridadSe han comunicado como efectos adversos frecuentes (> 10% de casos):
– De carácter general: Gardasil®, fiebre; Cervarix®, cansancio, mialgia y cefalea.
– De carácter local: Gardasil®, dolor, inflamación y rubor; Cervarix®, dolor, inflamación y rubor.
Los ensayos en fase IV de ambas vacunas incluyen mecanismos de registro y comunicación de efectos adversos, controlados por agencias reguladoras internacionales y organismos sanitarios. La descripción de acontecimientos adversos acaecidos en mujeres vacunadas –al igual que sucede con otras inmunizaciones– debe ser interpretada en el contexto de la necesaria aparición de afecciones de asociación casual. En este sentido, se ha publicado recientemente una valoración predictiva de las tasas previstas de incidencia de enfermedades autoinmunitarias en las cohortes vacunadas56.
La información actualizada sobre seguridad de las vacunas puede ser consultada en: http://www.who.int/vaccine_safety/en/
Autorizaciones de comercializaciónEn Europa, el Comité de Expertos de la Agencia Europea del Medicamento (CHMP.EMEA)59 emitió el 27 de julio de 2006 una opinión positiva para Gardasil® autorizando su comercialización.
Las indicaciones de Gardasil® incluyen la prevención de la displasia cervical de alto grado (CIN 2/3), carcinoma cervical, lesiones displásicas vulvares de alto grado (VIN 2/3) y verrugas genitales externas (condiloma acuminado) relacionadas causalmente con los tipos 6, 11, 16 y 18 del VPH.
Actualmente Gardasil® está autorizado en más de 90 países. La comercialización en España se inició en octubre de 2007 con un precio de venta al público de 464 euros/tres dosis.
Para la autorización de comercialización de Cervarix® en Europa, el CHMP.EMEA emitió el 25 de julio de 2007 una opinión positiva60. La FDA está en fase de evaluación de la documentación de Cervarix® presentada con fines de autorización.
Las indicaciones de Cervarix® incluyen la prevención de la neoplasia cervical intraepitelial de alto grado (CIN 2 /3) y cáncer de cérvix relacionados causalmente con los tipos 16 y 18 del VPH. Actualmente Cervarix® está autorizada en más de 20 países. La comercialización en España se inició en enero de 2008 con un precio de venta al público de 449 euros/tres dosis.
TEMAS PENDIENTESProtección cruzadaGardasil®
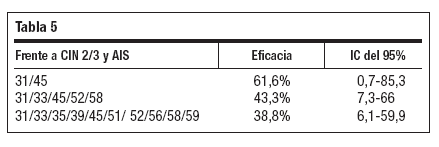
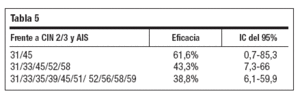
Se ha comunicado61 protección cruzada frente a CIN 2/3 y AIS por tipos de VPH oncogénicos no vacunales por al menos 4 años con tres variables de eficacia (tabla 5).
Tabla 5
Cervarix®
Se ha publicado62 protección cruzada frente a infección persistente por tipos de VPH oncogénicos no vacunales (tabla 6).
Tabla 6
Vacunación a varones
Disponemos de ensayos publicados de inmunogenicidad en adolescentes con datos muy satisfactorios (Gardasil ®)39. No conocemos todavía datos sobre la modificación de la transmisibilidad ni sobre la protección frente a lesiones y/o cánceres.
Ambas vacunas tienen en curso ensayos en varones homosexuales y heterosexuales. Este último es un subgrupo poblacional del máximo interés preventivo, dada la alta incidencia de cáncer anal por VPH en esta población, especialmente la infectada por el VIH63.
En el contexto de salud pública, está aceptado que la vacunación a niños únicamente sería eficiente con coberturas vacunales bajas en niñas, especialmente en países con recursos escasos64.
Vacunación a inmunodeprimidos65
En las fichas técnicas de ambas vacunas se recoge que los individuos con respuesta inmunitaria alterada, ya sea por uso de tratamientos inmunosupresores potentes, un defecto genético, infección por VIH u otras causas, podrían tener una respuesta disminuida a la vacuna. La experiencia acumulada en sujetos trasplantados vacunados contra el neumococo o los virus de las hepatitis A y B es estimulante: presentan respuestas disminuidas, pero muchas veces eficaces, sin circunstancias adversas graves (aumento de rechazos). Es probable que, tal como ocurre con otras vacunas, el nivel de recuento de las células T CD4+ sea un buen marcador de respuesta.
Efecto de sustitución de tipos66
VACUNA Y CRIBADO: SINERGIA E IMPLEMENTACIÓNLa alta protección vacunal frente a la infección incidente y persistente por VPH producirá un descenso, estimado superior al 40%20, en los resultados citológicos anómalos. Este impacto ha sido evaluado en España25 y ya se ha mencionado.
En condiciones de menor prevalencia de la lesión en búsqueda, la citología –con problemas de sensibilidad para CIN 2+ bien documentados25,27– deberá ser sustituida en primera línea de cribado por un test más sen-sible.
El test de determinación de VPH, más sensible que la citología y muy específico cuando se usa en el grupo de edad adecuado, tiene el perfil adecuado para ser usado en las cohortes vacunadas como test de primera línea de cribado. Las mujeres vacunadas muy probablemente podrán iniciar sus controles más tarde y realizarlos de forma más espaciada: una estrategia de cribado con inicio a los 30-35 años, con intervalo cada 5 años, se muestra muy eficaz y eficiente en los modelos publicados67.
Es muy importante que las mujeres vacunadas no perciban una falsa sensación de protección total frente al CCU. Esta situación conllevaría un abandono de la asistencia y una pérdida del potencial preventivo de un buen cribado, que incluso podría compensar deficitariamente el beneficio de la vacuna68.
Además, la solicitud de vacunación debería servir para reconducir y/o captar situaciones de cribado inadecuado o inexistente en la persona vacunada o sus familiares, en un esfuerzo conjunto de las diferentes especialidades médicas implicadas en la vacunación. Ya se ha citado que 8 de cada 10 CCU son diagnosticados en mujeres mal cribadas o no cribadas en Europa y España31. Esta proporción permanece estable en los últimos años69.
COSTE/EFECTIVIDAD DE LA APLICACIÓN DE LA VACUNA EN ESPAÑASe ha supuesto la vacunación con la vacuna tetravalente de una cohorte de niñas de 11 años a las que se ha seguido hasta cumplir 100 años, comparando los resultados con una cohorte no vacunada.
La vacunación evitaría 656 casos de CCU y 310 muertes, ganando un total de 11.132 años de vida, con un coste adicional frente a la no vacunación de 63 millones de euros.
Para evitar un CCU habría que vacunar a 308 mujeres; para evitar una muerte por CCU, a 653.
El coste por año de vida salvado en la rama de pacientes vacunadas se ha calculado en 5.688,39 euros, con coste-efectividad incremental de 5.646,55 euros.
Una conclusión derivada de este estudio es que la vacunación frente al CCU en España con la vacuna tetravalente produciría un beneficio clínico y social superior a la mayoría de las intervenciones terapéuticas del Sistema Nacional de Salud (SNS), incluidos los tratamientos de determinadas enfermedades crónicas, con costes farmacológicos totales muy superiores a los de esta vacuna.
Una intervención preventiva con un coste por año de vida ganado inferior al producto interior bruto per cápita (PIB.C) debe ser considerada según la Organización Mundial de la Salud como “muy eficiente”71.
El PIB.C 2007 en España se sitúa entre 30.599 (País Vasco) y 16.080 euros (Extremadura), con una media de 23.396 euros, algo por debajo de la europea (24.700 euros) (disponible en: http://www.ine.es/pren–sa/np495.pdf). Por lo tanto, incluso para las comunidades autónomas de nivel económico más bajo, la aplicación de la vacuna tetravalente resulta una intervención preventiva muy eficiente.
RECOMENDACIONES DE VACUNACIÓNNiñas de 9 a 14 años
– Elevada inmunogenicidad en esta franja de edad.
– No hay exposición previa al VPH y, por lo tanto, se tiene el máximo potencial preventivo de la vacuna. En España, el 7% de los menores de 16 años han tenido relaciones sexuales (RS). Edad media de inicio: 17 años. Un 0,1% de 14 años tiene RS34.
Mujeres hasta 25 o 26 años
– Elevada inmunogenicidad en esta franja de edad y eficacia demostrada.
– Aquéllas sin relaciones sexuales no habrán contactado con el VPH.
– Algunas con relaciones sexuales pueden no haber estado aún expuestas al VPH.
– Algunas que hayan podido estar expuestas al VPH no necesariamente han tenido que estar expuestas a uno o todos los tipos de VPH frente a los que protege la vacuna.
– En las positivas para VPH, no induce modificación del curso del tipo de VPH presente, pero pueden obtener alta protección sin interferencia frente a los otros tipos de VPH contenidos en la vacuna (Gardasil®).
– No hay necesidad de realizar determinación de VPH previa a la vacunación.
– El refuerzo hasta esta edad mejora la eficiencia de la vacunación y acorta significativamente el tiempo que tiene que transcurrir hasta la obtención de los beneficios de la vacunación en términos de salud pública.
– Podrían reducirse transmisión, reinfección y persistencia.
Mujeres mayores de 26 años
– Vacuna no contraindicada para mujeres en esta edad.
– Datos de eficacia hasta 45 años comunicados para Gardasil®.
– Datos de inmunogenicidad hasta 55 años comunicados para Cervarix®.
Varones
– Gardasil®: datos publicados de inmunogenicidad superior en niños de 9-15 años comparados con niñas de la misma edad.
– Pendientes los resultados de ensayos sobre eficacia frente a la transmisión, la infección persistente, las verrugas genitales y las lesiones peneanas y anales.
– Puede ser clave desde la perspectiva de la salud pública en caso de no lograr altas coberturas en mujeres.
Correspondencia: J. Cortés. Capitán Salom 29, Despacho 7 Piso 1. 07004 Palma de Mallorca. España.
Correo electrónico: cortes@ocea.es Recibido el 20-9-2008; aceptado para su publicación el 22-09-2008.
*Documento publicado simultáneamente en Prog Obstet Ginecol. 2009;52:20-8.
Ficha técnica de Gardasil®. Disponible en: www.emea.europa.eu/humandocs/PDFs/EPAR/gardasil/H–703–PI–es.pdfFicha técnica de Cervarix®. Disponible en: www.emea.europa.eu/humandocs/PDFs/EPAR/cervarix/H–721–PI–es.pdf