Contribuir a dilucidar la fisiopatología de la disnea y de la intolerancia al esfuerzo en pacientes con síndrome post-COVID con pruebas funcionales y de imagen cardiopulmonares normales en reposo, a la vez que determinar su aptitud y el nivel de resistencia orgánica con el fin de individualizar los parámetros de trabajo para la rehabilitación física.
Material y métodosTras una anamnesis y exploración clínica en reposo, 27 sujetos (50±11,9 años) (14 mujeres) con síndrome post-COVID de más de 6 meses de evolución realizaron una prueba de esfuerzo cardiopulmonar (CPET) incremental, continua y máxima, con análisis de gases respirados y monitorización ECG continua, en un cicloergómetro de freno electromagnético. Los valores obtenidos fueron comparados con los de referencia, sexo y/o controles, usando los test chi-cuadrado, t de Student o ANOVA.
ResultadosLas exploraciones clínicas en reposo y las CPET fueron clínicamente normales, sin alteraciones cardiorrespiratorias relevantes, finalizando por agotamiento muscular de los miembros inferiores. Cabe destacar un IMC=29,9 ±5,8kg/m2 y un lactato basal de 2,1±0,7mmol/l. La valoración funcional de la resistencia orgánica mostró los siguientes resultados en relación con el VO2máx predicho: 1)VO2máx=80,5 ±18,6%; 2)umbral ventilatorio1 (VO2VT1): 46,0±12,9%; 3)VO2VT2: 57,2±16,4%; 4)tiempo de trabajo en acidosis: 5,6±3,0 minutos, y 5)lactato máximo: 5,1±2,2mmol/l.
ConclusionesLas CPET identificó la limitación del metabolismo aeróbico y el aumento precoz del metabolismo glucolítico como causas de la disnea e intolerancia al esfuerzo, determinó la aptitud para la rehabilitación física, e individualizó la misma en función del nivel de resistencia orgánica.
Contributing to elucidate the pathophysiology of dyspnoea and exertion intolerance in post-COVID syndrome patients with normal cardiopulmonary imaging and functional tests at rest, while determining their fitness and level of endurance in order to individualize working parameters for physical rehabilitation.
Material and methodsAfter an anamnesis and clinical examination at rest, 27 subjects (50±11.9 years) (14 women) with post-COVID syndrome of more than 6 months of evolution performed a continuous maximal-incremental graded cardiopulmonary exercise test (CPET) with breath-by-breath gas-exchange monitoring and continuous ECG registration, on an electromagnetically braked cycle ergometer. The values obtained were compared with those of reference, gender or controls, using the Chi-square, t-Student or ANOVA test.
ResultsThe clinical examination at rest and the CPET were clinically normal and without adverse events. Reasons for stopping exercise were leg discomfort. It is only worth noting a BMI=29.9±5.8kg/m2 and a basal lactate concentration of 2.1±0.7mmol/L. The physiological assessment of endurance showed the following results relative to predicted VO2máx: 1)peakVO2=80.5±18.6%; 2)VO2 at ventilatory threshold1 (VO2VT1): 46.0±12.9%; 3)VO2VT2: 57.2±16.4%; 4)working time in acidosis: 5.6±3,0minutes; and 5)maximum lactate concentration: 5.1±2.2mmol/L.
ConclusionsThe CPET identified limited aerobic metabolism and early increase in glycolytic metabolism as causes of dyspnoea and exercise intolerance, determined fitness for physical rehabilitation, and individualized it based on the level of endurance.
El «síndrome post-COVID» es una entidad definida por la OMS que se da en individuos con antecedentes de infección por SARS-CoV-2 probable o confirmada, generalmente 3 meses después del inicio de la misma, con síntomas que duran al menos 2 meses y que no pueden explicarse con un diagnóstico alternativo1. Los síntomas son numerosos y variados2 e incluyen, entre otros, disnea, fatiga física y mental, trastornos de tipo ansioso-depresivo e intolerancia al ejercicio. La incidencia descrita es muy variable, oscilando entre el 10%3 y el 80%4, y no parece estar relacionada con la severidad de la infección aguda5. Estos pacientes acuden a menudo a la consulta de atención primaria, desde donde son derivados a las consultas de neumología o cardiología, dada su sintomatología y los antecedentes clínicos de infección aguda por SARS-CoV-2, y las pruebas funcionales y de imagen a las que son sometidos son con frecuencia normales.
La fisiopatología, la historia natural y el tratamiento de este síndrome son aún poco conocidos, habiendo sido propuestos como mecanismos fisiopatológicos: 1)la existencia de una disfunción neurovegetativa2, que sería responsable de la mayor parte de síntomas neurológicos, cardiovasculares y respiratorios; 2)una disfunción endotelial6; 3)una disfunción mitocondrial7-9, y 4)el desacondicionamiento físico, producido como consecuencia de la inmovilización durante la hospitalización junto a una mayor inactividad tras el alta debido a la disnea de esfuerzo10. En relación con este último punto, los trabajos que no han encontrado alteraciones cardiorrespiratorias relevantes que limitaran el esfuerzo11,12, a pesar de la persistencia de los síntomas y de registrar un VO2máx bajo, han pensado en una alteración periférica que disminuyera la extracción y/o la utilización del O23,7,13. La alteración del metabolismo oxidativo aeróbico muscular, sin alteraciones cardiorrespiratorias que la justificaran, indicaría un bajo nivel de resistencia orgánica, cualidad física que involucra al metabolismo energético y al equilibrio ácido-base, a la vez que la aptitud para el trabajo físico rehabilitador.
La prueba de esfuerzo cardiopulmonar (cardiopulmonary exercise test [CPET]) constituye la exploración de elección para la valoración clínica y funcional de estos pacientes14,15, pues permite una evaluación integrada de las adaptaciones del aparato respiratorio y de los sistema cardiovascular y musculoesquelético al esfuerzo, lo que puede contribuir a esclarecer los mecanismos fisiopatológicos responsables de la disnea y de la intolerancia al ejercicio, a determinar su aptitud clínica para la rehabilitación física, y a individualizar la intensidad del trabajo durante dicha rehabilitación.
En consecuencia, planteamos el presente trabajo con los principales objetivos de: 1)contribuir a esclarecer los mecanismos fisiopatológicos de la disnea y la intolerancia al esfuerzo de estos pacientes; 2)determinar su eventual aptitud para el tratamiento físico rehabilitador; 3)valorar su nivel de resistencia orgánica, y 4)proporcionar parámetros individualizados de trabajo para la rehabilitación física.
Sujetos y métodosEstudio observacional, retrospectivo, realizado sobre una muestra lineal de 27 pacientes, diagnosticados de síndrome post-COVID de más de 6 meses de evolución, remitidos desde la sección de Neumología del Hospital La Plana de Vila-real a la Unidad de Medicina Deportiva del Consorcio Hospitalario de Castellón, entre septiembre de 2021 y junio de 2023, para la realización de una CPET por presentar disnea e intolerancia al esfuerzo, a pesar de la normalidad o cuasi normalidad de las pruebas funcionales y de imagen cardiopulmonares realizadas en reposo.
Tras la firma del correspondiente consentimiento informado, se realizó una anamnesis, con registro de los antecedentes clínicos personales y familiares, y una exploración física que incluyó: estudio antropométrico (talla, peso e índice de masa corporal [IMC]), auscultación cardiopulmonar, palpación de pulsos periféricos, electrocardiograma (ECG) de 12 derivaciones (Cardiosoft®), toma manual de presión arterial (PA) (Prima Manometer®), espirometría simple y forzada (VyntusCPX®), pulsioximetría digital (Quirumed®) y determinación de lactato basal (Lactate Pro 2®).
Posteriormente, los sujetos realizaron una CPET incremental (calentamiento: 20-25W/5min; ejercicio: Δ20-25W/3min; recuperación: 20-25W/5min), continua, y máxima, con análisis de gases respiración a respiración, monitorización ECG continua y pulsioximetría auricular (VyntusCPX®) en un cicloergómetro de freno electromagnético (Ergoline, VIAsprint 150P®). Se imprimió un ECG de 12 derivaciones en papel, se registró de forma manual la PA en el último minuto de cada estadio, al final de la prueba, y a los 10minutos de la recuperación, y se determinó de nuevo el lactato en el primer minuto de recuperación. Se consideraron como criterios de prueba máxima: alcanzar una meseta en el VO2 (VO2máx), la frecuencia cardiaca (Fc) máxima predicha (220-edad), un cociente de intercambio respiratorio (RER) >1,1, y/o signos de fatiga periférica (agotamiento muscular).
Tras la finalización de la prueba, se procedió a promediar por minuto y a imprimir de forma tabulada los datos registrados para su posterior análisis y valoración. A partir de dicho análisis se determinaron los siguientes parámetros metabólicos16: 1)potencia aeróbica, determinada por el VO2máx o VO2pico (en adelante VO2máx); 2)capacidad aeróbica o de resistencia, determinada por la zona de transición aero-anaeróbica, situada entre los umbrales ventilatorios1 (VT1) y2 (VT2), según el modelo trifásico de Skinner y McLellan17; 3)capacidad anaeróbica láctica, determinada a partir del tiempo trabajado y de las cargas desarrolladas tras cruzar el VT2, y 4)potencia anaeróbica láctica, determinada por la concentración máxima de lactato en sangre. Dado que la resistencia orgánica es una cualidad física que no posee dimensión y, por tanto, tampoco unidades de medida, los anteriores parámetros metabólicos se expresaron en función del tiempo (minuto), carga de trabajo (W), Fc (latidos/min=lpm), VO2 (l/min, ml/kg/min y MET), %VO2máx medido, %VO2máx predicho, tiempo y W en acidosis (min y vatios), y concentración de lactato en sangre (mmol/l).
Las variables continuas se mostraron como media (X)±desviación estándar (DE), y las categóricas como frecuencias (n) y porcentajes (%). Los valores medidos se compararon con los de referencia14,15,18-20 (tabla 1), sexo y controles (n=33), formados por sujetos sanos deportistas que realizaron una CPET para valoración funcional. Para el estudio estadístico (Microsoft Excel 2010®) de las variables continuas se utilizaron los test t de Student y ANOVA, mientras que para las variables categóricas se utilizó el test chi-cuadrado. El nivel de significación estadística se fijó en p<0,05 y se expresó en el texto.
Resumen de criterios de normalidad en la CPET
| FVC | >80% |
| FEV1 | >80% |
| FEV1/FVC | >70% |
| MVV | FEV1 x 35 |
| Reserva ventilatoria (rV) | >15% |
| Frecuencia respiratoria (BR) | <60rpm |
| Ti/Tt | <0,5 |
| Vd/Vt | <0,30 |
| IC | >90% Fcmáxpredicha(220-edad) |
| HRR | >80% |
| PA máxima | <220/90mmHg |
| Δ PA sistólica | >30 mmHg |
| Fc × PA sist | >21.700 |
| Pulso O2 | >80% |
| PaO2 | >80mmHg |
| P(A-a)O2 | <35mmHg |
| %SatO2 | >90 |
| VO2máx o pico | >84% del predicho |
| VT1 | >40% VO2máx predicho |
| VE/VCO2 en VT2 | <35 |
| VE/VCO2 máximo | <40 |
Fc: frecuencia cardiaca; Fc × PA: doble producto; FEV1: flujo espiratorio en el 1.er segundo de la FVC; FEV1/FVC: cociente FEV1/FVC; FVC: capacidad vital forzada; HRR: porcentaje de reserva de frecuencia cardiaca; IC: índice cronotrópico; MVV: máxima ventilación voluntaria; PA: presión arterial; PaO2: presión parcial arterial de O2; P(A-a)O2: gradiente alvéolo-arterial de O2; %SatO2: porcentaje de saturación de la hemoglobina; Ti/Tt: cociente tiempo inspiratorio/tiempo total; Vd/Vt: cociente espacio muerto/volumen corriente; VE/VCO2: equivalente ventilatorio del CO2; VO2máx o pico: consumo máximo de O2; VT1: umbral ventilatorio1; VT2: umbral ventilatorio2.
Fuente: tomado de ATS/ACCP statement on cardiopulmonary excercise testing14, Balady et al.15, Quanjer et al.18, Hansen et al.19 y Vilella et al.20.
Este trabajo se realizó de conformidad con el Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki) para experimentos con seres humanos, con el consentimiento informado de los pacientes, y fue aprobado por el Comité de Ética e Investigación del Consorcio Hospitalario Provincial de Castellón.
ResultadosValoración clínicaLa muestra estuvo formada por 27 sujetos (53,0±11,9 años), distribuida en 13 varones (56,0±11,9 años) y 14 mujeres (50,2±10,0 años) (p>0,05), de los cuales 14 requirieron ingreso hospitalario y 13 sufrieron un cuadro leve (p>0,05).
La anamnesis y la exploración clínica en reposo no mostraron contraindicaciones para la CPET. La anamnesis mostró la persistencia de disnea, debilidad muscular y agotamiento precoz de más de 6 meses de evolución, que aquellos pacientes con algún factor de riesgo cardiovascular lo tenían controlado en el momento de la prueba, y que 8 pacientes (30%) tenían antecedentes o estaban padeciendo en ese momento trastornos de tipo ansioso-depresivo.
Los resultados del estudio antropométrico mostraron: 1)talla: 165,4±8cm; 2)peso: 82,0±18,2kg; IMC: 29,9±5,8kg/m2. Distribuidos por frecuencias, solo 6 pacientes tuvieron un IMC ≤25,0kg/m2, 7 presentaron un IMC=25,1-29,9kg/m2, 12 tenían un IMC=30,0-39,9kg/m2, y 2, un IMC ≥40kg/m2. El porcentaje de pacientes con sobrepeso u obesidad fue, por tanto, del 77,8% (p<0,05).
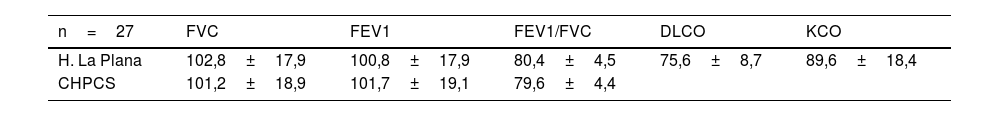
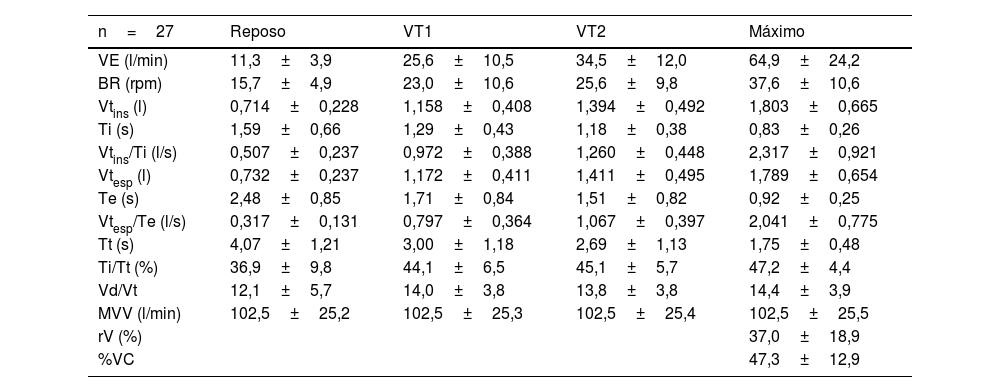
La auscultación pulmonar en reposo fue normal. Los volúmenes y los flujos ventilatorios en reposo fueron normales y no diferentes a los registrados en el hospital La Plana (p>0,05) (tablas 1 y 2), si bien 3 pacientes mostraron un patrón restrictivo leve en la espirometría basal (capacidad vital forzada [FVC]: 71%-76%). Durante la CPET, los volúmenes y los flujos respiratorios fueron normales, existiendo un patrón respiratorio regular. A la finalización de la prueba, la frecuencia respiratoria (BR) máxima, la reserva ventilatoria (rV), el cociente VE/VCO2 en VT2 y al final de la CPET, y los valores del cociente Vd/Vt estuvieron dentro del rango de normalidad, no sufriendo el cociente Vd/Vt cambios significativos durante el esfuerzo (p>0,05). Asimismo, las cinéticas de los valores de Vtins y Vtesp, y de los cocientes Vtins/Ti y Vtesp/Te durante el esfuerzo, no sugirieron la existencia de importante fatiga respiratoria, siendo el cociente Ti/Tt <0,5 al final de la CPET (tablas 3 y 4).
Resultado de las pruebas funcionales pulmonares en reposo
| n=27 | FVC | FEV1 | FEV1/FVC | DLCO | KCO |
|---|---|---|---|---|---|
| H. La Plana | 102,8±17,9 | 100,8±17,9 | 80,4±4,5 | 75,6±8,7 | 89,6±18,4 |
| CHPCS | 101,2±18,9 | 101,7±19,1 | 79,6±4,4 |
CHPCS: Consorcio Hospitalario Provincial de Castellón; DLCO: prueba de difusión de monóxido de carbono; FEV1: flujo espiratorio en el 1.er segundo de la FVC; FEV1/FVC: cociente FEV1/FVC; FVC: capacidad vital forzada; H. La Plana: Hospital La Plana; KCO: factor de transferencia del CO.
Los resultados vienen expresados como media ±desviación estándar.
Adaptaciones respiratorias al esfuerzo
| n=27 | Reposo | VT1 | VT2 | Máximo |
|---|---|---|---|---|
| VE (l/min) | 11,3±3,9 | 25,6±10,5 | 34,5±12,0 | 64,9±24,2 |
| BR (rpm) | 15,7±4,9 | 23,0±10,6 | 25,6±9,8 | 37,6±10,6 |
| Vtins (l) | 0,714±0,228 | 1,158±0,408 | 1,394±0,492 | 1,803±0,665 |
| Ti (s) | 1,59±0,66 | 1,29±0,43 | 1,18±0,38 | 0,83±0,26 |
| Vtins/Ti (l/s) | 0,507±0,237 | 0,972±0,388 | 1,260±0,448 | 2,317±0,921 |
| Vtesp (l) | 0,732±0,237 | 1,172±0,411 | 1,411±0,495 | 1,789±0,654 |
| Te (s) | 2,48±0,85 | 1,71±0,84 | 1,51±0,82 | 0,92±0,25 |
| Vtesp/Te (l/s) | 0,317±0,131 | 0,797±0,364 | 1,067±0,397 | 2,041±0,775 |
| Tt (s) | 4,07±1,21 | 3,00±1,18 | 2,69±1,13 | 1,75±0,48 |
| Ti/Tt (%) | 36,9±9,8 | 44,1±6,5 | 45,1±5,7 | 47,2±4,4 |
| Vd/Vt | 12,1±5,7 | 14,0±3,8 | 13,8±3,8 | 14,4±3,9 |
| MVV (l/min) | 102,5±25,2 | 102,5±25,3 | 102,5±25,4 | 102,5±25,5 |
| rV (%) | 37,0±18,9 | |||
| %VC | 47,3±12,9 |
BR: frecuencia respiratoria; MVV: máxima ventilación voluntaria (FEV1 × 35); rpm: respiraciones/minuto; rV: reserva ventilatoria; Te: tiempo espiratorio; Ti: tiempo inspiratorio; Ti/Tt: cociente Ti/Tt; Tt: tiempo total; Vd/Vt: cociente volumen espacio muerto/volumen corriente; VE: volumen minuto ventilatorio; VO2máx: consumo máximo de O2; VT1: umbral ventilatorio1; T2: umbral ventilatorio2; Vtesp/Te: cociente Vtesp/Te; Vtesp: volumen corriente espiratorio; Vtins/Ti: cociente Vtins/Ti; Vtins: volumen corriente inspiratorio; %VC: fracción de la capacidad vital (Vt × 100/VC).
Los resultados están expresados como media±desviación estándar.
Valoración funcional de la resistencia orgánica
| n=27 | Base | VT1 | VT2 | Máximo |
|---|---|---|---|---|
| Tiempo (min) | 0 | 2,9±1,8 | 5,8±3,0 | 11,4±3,5 |
| W (vatio) | 0 | 25,0±10,3 | 43,9±26,0 | 95,2±35,4 |
| Fc (lpm) | 71,4±12,6 | 107,6±17,6 | 119,0±21,5 | 151,9±20,0 |
| VO2 (l/min) | 0,322±0,082 | 0,887±0,343 | 1,089±0,389 | 1,544±0,512 |
| VO2 (ml/kg/min) | 4,0±0,7 | 10,6±2,7 | 13,2±3,6 | 18,9±4,1 |
| VO2 (MET) | 1,1±0,2 | 3,0±0,8 | 3,8±1,0 | 5,4±1,2 |
| %VO2máx | 21,8±5,2 | 57,8±14,3 | 70,9±14,0 | 100 |
| %VO2máx predicho | 80,5±18,6 | |||
| VO2/W (ml/vatio) | 44,0±38,5 | 38,4±41,6 | 17,2±6,6 | |
| VO2/W teórico (ml/vatio) | 15,8±2,0 | |||
| RER | 0,88±0,09 | 0,86±0,07 | 0,98±0,10 | 1,14±0,10 |
| VE/VO2 | 34,8±6,2 | 28,8±3,8 | 31,7±3,8 | 41,8±6,9 |
| VE/VCO2 | 39,6±4,6 | 33,6±4,0 | 32,5±3,9 | 36,9±5,4 |
| FeO2 (%) | 17,42±0,48 | 16,75±0,58 | 17,04±0,62 | 17,89±0,60 |
| FeCO2 (%) | 3,11±0,33 | 3,62±0,41 | 3,72±0,44 | 3,31±0,55 |
| PetO2 (mmHg) | 114,8±5,3 | 108,8±6,8 | 112,5±4,5 | 119,3±5,3 |
| PetCO2 (mmHg) | 32,3±3,8 | 36,0±4,5 | 37,5±4,5 | 33,0±5,3 |
| Lactato (mmol/l) | 2,1±0,7 | 5,1±2,2 |
Fc: frecuencia cardiaca; FeCO2: fracción espiratoria de CO2; FeO2: fracción espiratoria de O2; lpm: latidos/minuto; MET: metabolic equivalent of task; PetCO2: presión parcial final espiratoria de CO2; PetO2: presión parcial final espiratoria de O2; RER: cociente de intercambio respiratorio (VCO2/VO2); VE/VCO2: equivalente ventilatorio de CO2; VE/VO2: equivalente ventilatorio de O2; VO2: consumo de O2; VO2/W: eficiencia energética; VO2máx: consumo máximo de O2; VO2máx: consumo máximo de O2; VT1: umbral ventilatorio1; VT2: umbral ventilatorio2; W: carga.
Los resultados están expresados como media±desviación estándar.
La auscultación cardiaca en reposo, la palpación de los pulsos periféricos, el ECG basal, el %SatO2 y las cifras basales de PA fueron, asimismo, normales. Durante la CPET existió una buena adaptación eléctrica y hemodinámica al esfuerzo, registrándose un índice cronotrópico (IC), una reserva cronotrópica (HRR), pulso de O2, PA sistólica y diastólica, doble producto y %SatO2, dentro del rango de normalidad (tabla 5).
Adaptaciones cardiovasculares al esfuerzo
| n=27 | Reposo | VT1 | VT2 | Máximo |
|---|---|---|---|---|
| Fc (lpm) | 71,4±12,6 | 107,6±17,6 | 119,0±21,5 | 151,9±20,0 |
| Fcmáx predicha (lpm) | 167,0±11,1 | |||
| IC (%) | 91,0±11,4 | |||
| HRR (%) | 84,6±20,1 | |||
| SatO2 (%) | 98,4±0,6 | 98,2±1,2 | 98,2±1,0 | 97,9±1,5 |
| VO2/Fc (ml/beat) | 4,6±1,3 | 8,2±2,9 | 9,1±3,1 | 10,2±3,0 |
| VO2/Fc predicho (ml/latido) | 11,6±2,8 | |||
| % Pulso de O2 predicho | 88,5±16,8 | |||
| PA sist (mmHg) | 117,2±15,2 | 125,7±21,4 | 139,1±25,7 | 167,8±26,5 |
| PA diast (mmHg) | 77,0±7,6 | 72,8±8,2 | 73,9±8,0 | 74,3±6,8 |
| Fc × PA sist | 8305±1397 | 13507±2993 | 16672±4499 | 25512±5442 |
Fc: frecuencia cardiaca; Fc × PAsist: doble producto; HRR: reserva cronotrópica; IC: índice cronotrópico; lpm: latidos/minuto; PA diast: presión arterial diastólica; PA sist: presión arterial sistólica; SatO2: saturación de la hemoglobina; VO2máx: consumo máximo de O2; VO2/Fc: pulso de O2; VT1: umbral ventilatorio1; VT2: umbral ventilatorio2.
Los resultados están expresados como media±desviación estándar.
Finalmente, la concentración basal de lactato de los pacientes fue significativamente más alta que la de los controles (2,1±0,7 vs 1,6±0,3mmol/l) (p<0,001) (tabla 4).
A los 10 minutos de recuperación se registró una Fc=98,0±17,3lpm y una PA=113,1±15,5/72,8±8,1mmHg.
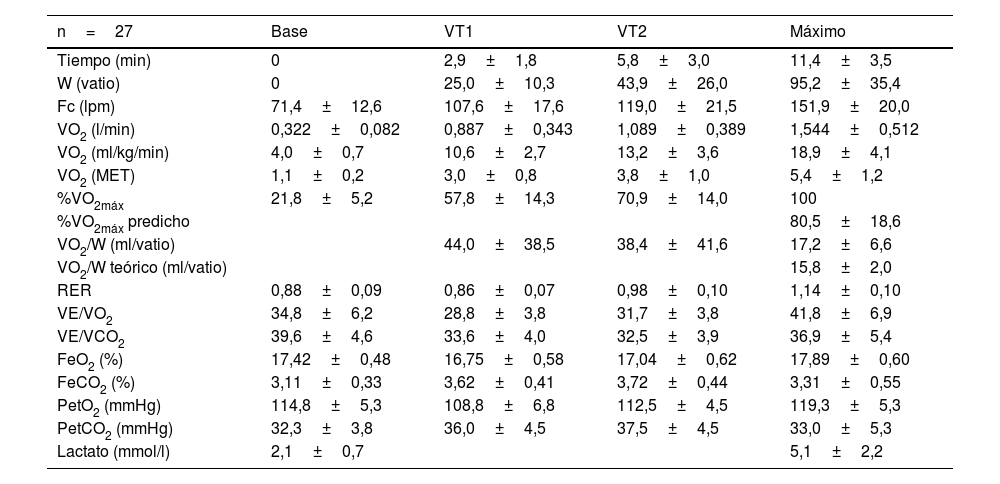
Valoración fisiológica de la resistencia orgánicaLa causa de finalización de las CPET fue en todos los casos el agotamiento muscular de los miembros inferiores, no produciéndose incidencias clínicas relevantes durante las mismas. Al término, todos los sujetos habían cumplido algún criterio de prueba máxima.
La W, la Fc y el VO2 máximos predichos fueron de 126±41vatios, 167,0±11,1lpm y 1,935±0,493l/min, respectivamente.
Potencia aeróbica máximaMinuto: 11,4±3,5. W: 95,2±35,4vatios=78,6±1,8%W predicha (p<0,005). Fc=151,9±20,0lpm (91,0±1,8%Fcmáx predicha). VO2máx=18,9±4,1ml/kg/min=1,544±0,512l/min=5,4±1,2MET=80,5±18,6%VO2máx predicho (p<0,005). El cociente VO2/W fue ligeramente superior al predicho, aunque sin significación estadística (p>0,05) (tabla 4).
Capacidad aeróbica o de resistenciaUmbral ventilatorio 1 (VT1). Minuto: 2,9±1,8. W=25,0±10,3vatios. Fc=107,6±17,6lpm. VO2=10,6±2,7ml/kg/min=0,887±0,343l/min=3,0±0,8 MET=57,8±14,3%VO2máx=46,0±12,9%VO2máx predicho.
Umbral ventilatorio 2 (VT2): Minuto: 5,8±3,0. W=43,9±26,0vatios. Fc=119,0±21,5lpm. VO2=13,2±3,6ml/kg/min=1,089±0,389l/min=3,8±1,0 MET=70,9±14,0%VO2máx=57,2±16,4%VO2máx predicho.
La transición aero-anaerobia se efectuó, por tanto, durante el tiempo transcurrido entre el VT1 y el VT2 (tabla 4).
Capacidad anaeróbica lácticaTiempo: 5,6±3,0min (rango: 5,8-11,4min). W: 51,3±25,2vatios (rango: 43,9-95,2 vatios).
Potencia anaeróbica lácticaLactatemia máxima: 5,1±2,2 mmol/l (tabla 4).
DiscusiónDeterminar la aptitud física de una persona implica constatar la adecuada adaptación funcional de los diferentes aparatos y sistemas del organismo al ejercicio y, por tanto, la ausencia de contraindicaciones para la realización del mismo. En este sentido, nuestros resultados mostraron la aptitud física de todos los pacientes, dado que, al contrario que en otros estudios3,11,12, no encontramos disfunciones pulmonares o hemodinámicas relevantes que contraindicaran el ejercicio físico o que justificaran su limitada capacidad funcional (tablas 3, 4 y 5); sin embargo, y coincidiendo con aquellos, la adaptación al esfuerzo del metabolismo oxidativo aerobio fue pobre, pues el VO2máx fue <85% del predicho. No ocurrió lo mismo, sin embargo, con el metabolismo glucolítico, dadas la elevada lactatemia e hipocapnia basales (PetCO2 <35mmHg) y la precocidad con que se cruzaron el VT1 (punto de tamponamiento isocápnico) y el VT2 (punto de compensación respiratoria)21, todo lo cual contribuye a explicar la disnea y la intolerancia al esfuerzo de estos pacientes.
En efecto, la disociación del ácido láctico implica que el organismo deba neutralizar y eliminar las cargas ácidas (H+) liberadas (VT1). Cuando se sobrepasa la capacidad de neutralización y eliminación de los H+ (VT2), estos se acumulan e inducen una acidosis metabólica que, además de limitar la oxidación intramitocondrial de los ácidos grasos7,22, inhibe la actividad enzimática del metabolismo energético e interfiere en la contracción muscular al alterar la liberación de Ca+2 del retículo sarcoplásmico y la interacción Ca+2-troponinaC, todo lo cual es causa de fatiga y agotamiento. Por otra parte, una alta tasa glucolítica conlleva la depleción de los limitados depósitos musculares de glucógeno, lo cual también es causa de fatiga y agotamiento23.
Existen estudios que han descrito un aporte normal asociado a una disminución de la extracción periférica de O23,7,13, lo cual en nuestro caso estaría más relacionado con la existencia de un gradiente de presión de difusión pequeño entre la sangre y la fibra muscular que con alteraciones de la difusión a nivel del endotelio capilar tisular, dada la ausencia de alteraciones significativas de la difusión alvéolo-capilar (normalidad del %SatO2) y del pulso de O2 (tabla 5). En consecuencia, el bajo VO2máx registrado sería consecuencia de una disminución de su utilización al final de la cadena de transporte de electrones más que de un déficit intracelular del mismo. En relación con el metabolismo energético muscular24, este hecho podría ser explicado por: 1)la existencia de un defecto en la reoxidación citoplásmica del NADH2 (fallo de las lanzaderas de sustrato) y/o en el transporte intramitocondrial del piruvato formados durante la glucólisis, con lo que ambos metabolitos tendrían que acoplarse a la reacción citoplásmica que reduce el ácido pirúvico a ácido láctico y oxida el NADH2 a NAD+ (glucólisis anaerobia) con el fin de evitar su acúmulo y, por tanto, el cese de la glucólisis por efecto de la ley de acción de masas; 2)la disminución del transporte intramitocondrial de piruvato disminuiría, a su vez, la tasa metabólica del ciclo de Krebs, como también lo haría una disminución de la actividad de sus enzimas25, y 3)finalmente, una alteración en la cadena de transporte de electrones afectaría a la oxidación del NADH2 proveniente tanto de la glucólisis como del ciclo de Krebs. Cualquiera de estos supuestos alteraría la fosforilación oxidativa y, por tanto, la resíntesis de ATP. En este sentido, algunos estudios han relacionado la mayoría de signos y síntomas de la infección aguda por COVID-19 con una disfunción mitocondrial generalizada26,27, atribuida a la existencia de inflamación crónica y aumento del estrés oxidativo8,9.
Por otra parte, el valor del VO2máx se ha relacionado, además de con la aptitud para los esfuerzos de larga duración16, con el riesgo de mortalidad general28, de tal forma que aquellos sujetos con una capacidad de ejercicio inferior a 5MET son considerados de alto riesgo, en tanto que aquellos con un valor mayor de 8MET los son de bajo riesgo. Los sujetos de nuestro estudio tuvieron un VO2máx=5,4±1,2 MET (tabla 4), por lo que intentar normalizar su VO2max hasta 8MET o, como mínimo, por encima del 85% del VO2máx predicho debería ser una prioridad.
En cuanto a la baja capacidad o resistencia aeróbica (VT1 y VT2)21 registrada, esta estaría relacionada con la baja utilización del O2 y con la escasa correlación ente la tasa de producción y la capacidad de neutralización y eliminación de los H+ producidos como consecuencia del aumento precoz del metabolismo glucolítico.
En relación con la capacidad anaeróbica láctica, el tiempo trabajado en acidosis por los sujetos de nuestro estudio estuvo en rango con el observado habitualmente en gente sana, si bien las cargas de trabajo desarrolladas fueron inferiores (datos no publicados), lo cual sugiere la habituación de los pacientes a la misma dado que la tolerancia a la acidosis es entrenable29, si bien su margen de mejora es limitado, pues la tolerancia a la acidosis también lo es.
Finalmente, la potencia anaeróbica láctica registrada fue baja (tabla 4). Teniendo en cuenta las concentraciones basales de lactato y el tiempo de trabajo en acidosis, lo lógico es pensar en una alta tasa de aclaramiento más que en una baja tasa de producción, pues el lactato constituye un importante sustrato energético durante el ejercicio físico30.
Una vez determinada la aptitud física de los pacientes y su nivel de resistencia orgánica, lo lógico sería incluirlos en un programa de rehabilitación física con el fin de mejorar fundamentalmente la potencia y la capacidad aeróbicas, dada la relación de estos parámetros con el riesgo de mortalidad general28, para lo cual podría aplicarse cualquiera de los métodos clásicos de entrenamiento de la resistencia orgánica29. En este sentido, la determinación de la transición aero-anaeróbica permitió individualizar las W y Fc específicas para la rehabilitación física de nuestros pacientes, que oscilaron entre 25-45vatios y 110-120lpm, respectivamente.
Dadas las características de la muestra de nuestro estudio, a la rehabilitación física habría que añadir, además, la corrección del IMC, apoyo psicológico y, quizá, moduladores de la función mitocondrial8,9,27, por lo que el tratamiento de estos pacientes debería ser multidisciplinar (físico, nutricional y psicológico).
Las limitaciones del presente trabajo provienen principalmente de: 1)el pequeño tamaño de la muestra; 2)no se realizaron determinaciones de la hemoglobina, gasometrías arteriales ni venosas, ni ecocardiografías de estrés, por lo que algunas deducciones se han realizado de forma indirecta; 3)los resultados no son extrapolables a todos los pacientes con síndrome post-COVID; no obstante, será la CPET la que establezca la eventual aptitud física de estos pacientes para la rehabilitación física y los parámetros de trabajo más adecuados en función de su nivel de resistencia orgánica, y 4)no presenta los resultados de la aplicación individualizada de la rehabilitación física propuesta, lo cual queda pendiente para otros trabajos.
ConclusionesLas CPET identificaron la limitación del metabolismo oxidativo aeróbico y el aumento precoz del metabolismo glucolítico como principales mecanismos fisiopatológicos de la disnea y de la intolerancia al esfuerzo de los pacientes de nuestro estudio, determinaron su aptitud para la rehabilitación física e individualizaron los parámetros de trabajo de la misma en función del nivel de resistencia orgánica de cada paciente.
Consideraciones éticasEl presente trabajo se ha llevado a cabo de conformidad con el Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki) para experimentos con seres humanos, con el consentimiento informado de los pacientes, y ha sido aprobado por el Comité de Ética e Investigación del Consorcio Hospitalario Provincial de Castellón.
FinanciaciónNinguna. La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Contribución de los autoresJoaquín Montoliu Nebot, Antonio Iradi Casal, Luis Miguel Miravet Sorribes y José Daniel Molés Gimeno han participado en la planificación, redacción y corrección del trabajo. Sonia Cepeda Madrigal, Giuliana Rissi Castro y Sandra Sanz Saz han participado en la recolección de los datos y en la realización de las pruebas de esfuerzo, así como en la corrección del trabajo.
Conflicto de interesesNinguno.