y por ello cursa con clínica variable. Para el diagnóstico se debe tener sospecha clínica de la enfermedad. El pronóstico suele ser sombrío, especialmente en la forma primaria, a pesar de los avances terapéuticos actuales.
La amiloidosis es una entidad consistente en la acumulación extracelular de fibrillas proteicas que muestran una birrefringencia a la luz polarizada con la tinción del rojo Congo. Dicha enfermedad se debe a un trastorno del metabolismo de las proteínas en el que se produce el depósito extracelular de un material proteico fibrilar (amiloide) que es el responsable de la insolubilidad de los depósitos amiloideos y de su resistencia a la digestión proteolítica. El amiloide ocasiona de forma progresiva el fracaso lento y gradual del órgano afecto.
Clasificación
Se han propuesto múltiples clasificaciones de la amiloidosis en función de la presencia o no de patología subyacente, de la localización histológica del depósito de amiloide, del patrón de distribución por órganos y del tipo de proteína depositada: AL en las amiloidosis primarias y AA en las amiloidosis secundarias. Atendiendo a la presencia o ausencia de enfermedad subyacente y al tipo de proteína depositada (tabla 1), las clasificamos en :
Amiloidosis primaria (AL)
En este apartado incluimos la amiloidosis primaria, en la que no existe enfermedad acompañante, y la asociada a mieloma múltiple o a otras discrasias sanguíneas como, por ejemplo, la macroglobulinemia.
Estos casos suelen acontecer en edades medias avanzadas, con preferencia en varones, y la mayoría de ellos presentan un mieloma múltiple, una inmunoglobulina monoclonal (en suero, orina o ambas) o una plasmocitosis en médula ósea. Los síntomas más frecuentes son astenia y pérdida de peso junto a otra clínica diversa según el órgano afecto.
Amiloidosis AA
En este grupo se engloban las amiloidosis secundarias, es decir, aquellas originadas en el seno de otra enfermedad, las formas familiares o hereditarias como la fiebre mediterránea familiar y el síndrome de Muckle-Wells o nefropatía amiloide familiar.
Amiloidosis secundaria
Esta forma de amiloidosis se relaciona con enfermedades crónicas de tipo infeccioso (como la tuberculosis, las bronquiectasias, la lepra, etc.), neoplásico (como el hipernefroma y la enfermedad de Hodgkin) e inflamatorio (tabla 2). Con respecto a la amiloidosis secundaria ligada a la patología reumática, la artritis reumatoide ocupa el primer lugar, seguida de la espondilitis anquilosante, síndrome de Reiter, artropatía psoriásica, enfermedad inflamatoria intestinal, artritis crónica juvenil, enfermedad de Behçet, lupus eritematoso sistémico, etc. Habitualmente aparece tras varios años de evolución con predominio entre la cuarta y séptima década de la vida. La sintomatología inicial es inespecífica, siendo la proteinuria uno de los primeros datos sospechosos, que en algunos casos puede seguirse o acompañarse de insuficiencia renal. Resulta menos frecuente que los síntomas iniciales radiquen en el aparato gastrointestinal (diarreas y/o malabsorción) o cardiocirculatorio.
Formas familiares o hereditarias
Dentro de este grupo se encuentra la fiebre mediterránea familiar que es la más importante en nuestro medio, con primacía en varones jóvenes y una transmisión autosómica recesiva (aunque no siempre se encuentran antecedentes familiares). En el aspecto clínico se pueden observar edemas maleolares secundarios a la afección renal, ocasionalmente diarrea y/o vómitos, así como visceromegalias (hepatomegalia y esplenomegalia).
En cuanto al síndrome de Muckle-Wells o nefropatía amiloide familiar se define como una enfermedad inflamatoria hereditaria que cursa con episodios de fiebre, dolor abdominal, urticaria y artritis, y que en su evolución se complica con afectación multiorgánica, incluida la participación renal, por amiloidosis tipo AA.
Amiloidosis beta-2-microglobulina
Se trata de la amiloidosis asociada a hemodiálisis que en pocas ocasiones produce manifestaciones clínicas. En estos casos la afección sistémica es poco llamativa, con prevalencia en intestino y corazón. Aunque este tipo de amiloidosis tiene gran tendencia por estructuras del aparato locomotor (es frecuente la aparición de fracturas del cuello femoral por infiltración trabecular), estos pacientes tienen muchas posibilidades de afectación extraarticular que excepcionalmente dan clínica debido a que no llevan el tiempo de evolución suficiente.
Amiloidosis por depósito de transtirretina
Dentro de este grupo citamos a la amiloidosis senil sistémica y la polineuropatía familiar portuguesa. Esta última se caracteriza por tener antecedentes hereditarios con un patrón autosómico dominante y que sucede antes de la tercera o cuarta década de la vida. La clínica más sugestiva es la polineuropatía sensitiva y el método diagnóstico empleado es la biopsia del nervio perifé rico.
Clínica
Las manifestaciones clínicas son variables y dependen del órgano o tejido infiltrado de amiloide (tablas 3 y 4). A continuación comentamos los aspectos clínicos más destacados en función del órgano o tejido afectado.
Amiloidosis renal
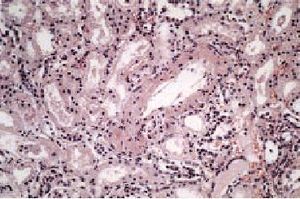
Es una localización muy frecuente tanto en la amiloidosis secundaria (AA) como en la primaria (AL), por lo que carece de especificidad (fig. 1). La afectación renal puede oscilar entre un cuadro de proteinuria leve y una nefrosis florida. Clínicamente, en todos los casos se
observa proteinuria acompañada o no de un síndrome nefrótico y, en ocasiones, hematuria que suele ser debida a infiltración de las vías urinarias inferiores (uréter, vejiga, etc.). La aparición de edemas es habitual, y resulta poco usual la hipertensión, a excepción de la amiloidosis crónica. En la amiloidosis AA se produce una aparente recuperación de la función renal al tratar la enfermedad causal. En la actualidad tanto el uso de he-modiálisis crónica como el trasplante son útiles en el tratamiento final de la amiloidosis renal, mejorando claramente el pronóstico.
Fig. 1. Presencia de material amiloide en paredes de vasos renales. HE 200*.
Amiloidosis cardíaca
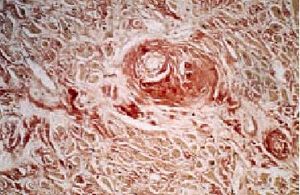
Es importante en la amiloidosis tipo AL y en la amiloidosis hereditaria familiar; sin embargo, es poco común en las formas secundarias y, aunque en éstas puede aparecer, los depósitos son pequeños y no suelen causar disfunción miocárdica. El amiloide se acumula, principalmente, en el miocardio, pero puede existir participación de otras estructuras como el endocardio, las válvulas y el pericardio (figs. 2 y 3). La forma de presentación más habitual en la clínica es la de una insuficiencia cardíaca que se acompaña de disfunción sistólica. El tratamiento resulta poco efectivo, ya que estos pacientes, además de presentar defectos de conducción y arritmias con cierta frecuencia, parecen ser especialmente sensibles a la digital (por lo que su administración debe utilizarse con mucha prudencia). La evolución suele ser rápida, con un pronóstico sombrío para el paciente. Otras formas de presentación incluyen la de una cardiopatía restrictiva con signos de insuficiencia cardíaca derecha y alteraciones del ritmo cardíaco y de la conducción que pueden dar lugar a muertes súbitas.
Fig. 2. Amiloidosis cardíaca con presencia de material amorfo eosinófilo en paredes vasculares e intersticio. HE, 200*.
Fig. 3. Amiloidosis cardíaca. Rojo Congo 200*.
En cuanto a las pruebas complementarias, las principales alteraciones electrocardiográficas consisten en un complejo QRS de bajo voltaje y anomalías en la conducción auriculoventricular e intraventricular que pueden causar diferentes grados de bloqueo cardíaco. En el ecocardiograma se observa un aumento simétrico de la pared ventricular izquierda, hipocinesia y disminución de la contracción sistólica con engrosamiento del tabique interventricular y de la pared posterior del ventrículo izquierdo, siendo la cavidad ventricular izquierda de tamaño normal o pequeño. La ecocardiografía bidimensional muestra un «moteado granular» en la estructura de las paredes, pero lo más normal es el aspecto de una miocardiopatía hipertrófica con hipertrofia septal asimétrica. La gammagrafía con 99Tc suele ser positiva, y la intensidad de la fijación está en relación con el grado de infiltración cardíaca. Incluso dicha prueba puede mostrar fijaciones precoces antes de que el electrocardiograma o el ecocardiograma sean anormales.
Amiloidosis del tubo digestivo
La afección anatómica del tubo digestivo es frecuente en todos los tipos de amiloidosis, de ahí la importancia de la biopsia rectal en el diagnóstico de la enfermedad. Es debido a la afectación directa del aparato gastrointestinal o de la infiltración amiloide del sistema nervioso autónomo. Las manifestaciones clínicas son más raras, destacando la afectación lingual que es propia de la amiloidosis primaria (en torno a un 20%) o de la amiloidosis que acompaña al mieloma múltiple. Cursa con macroglosia (que puede protuir y dificultar la alimentación y el habla), y cuando la lengua no está aumentada de tamaño puede presentar rigidez y dureza a la palpación. La localización esofágica se presenta con disminución del peristaltismo y disfagia. La infiltración del estómago da lugar a cambios en la motilidad, hemorragias y aclorhidria, pudiendo simular un carcinoma gástrico. A nivel del intestino delgado se pueden producir alteraciones clínicas y radiológicas de carácter obstructivo y en algunos casos se evidencia un síndrome de malabsorción. También se han descrito en este contexto hemorragias, oclusiones, perforaciones o necrosis isquémicas.
Amiloidosis hepática
La afectación hepática es frecuente; sin embargo, las alteraciones de la función hepática suelen ser escasas y aparecen en las fases tardías de la enfermedad. Comienza con sintomatología inespecífica, hepatomegalia y ligera elevación de las enzimas de colestasis. No obstante, se han registrado casos de colestasis intrahepática intensa en aproximadamente un 5% de pacientes con amiloidosis primaria. La hipertensión portal y la insuficiencia hepática aguda grave son excepcionales, aunque pueden producirse ocasionalmente con un pronóstico sombrío.
Amiloidosis del sistema nervioso periférico
La localización amiloide en el sistema nervioso autónomo es común, siendo responsable de alteraciones digestivas (acalasia esofágica, diarreas) y de neuropatías periféricas (incapacidad para sudar, hipotensión arterial, paresia vesical, pupila de Adie e impotencia). Generalmente, los pares craneales están respetados con exclusión de los que se relacionan con reflejos pupilares.
Dicha clínica aparece casi exclusivamente en las amiloidosis AL y en la asociada a hemodiálisis. El síndrome del túnel carpiano es la manifestación clínica más importante. Algunos casos de amiloidosis heredofamiliar, como la polineuropatía familiar portuguesa, pueden cursar con polineuropatía progresiva de miembros inferiores, con especial afectación de la sensibilidad térmica y dolorosa.
Diagnóstico
Para realizar el diagnóstico de la enfermedad se debe sospechar su existencia y así en pacientes con procesos crónicos predisponentes (artritis reumatoide, tuberculosis, etc.) que desarrollan proteinuria, hepatomegalia, esplenomegalia, malabsorción o cardiopatía es obligado descartar una amiloidosis secundaria. La amiloidosis sistémica primaria hay que tenerla presente en cualquier persona con un proceso infiltrativo difuso, no inflamatorio, con afectación de tejidos mesenquimatosos o parenquimatosos. Además, en cualquier síndrome heredofamiliar con neuropatía periférica, nefropatía o cardiopatía es necesario contemplar el diagnóstico de amiloidosis.
El diagnóstico se basa en la biopsia de aquellos órganos en los que aparecen datos de sospecha de infiltración amiloidea. Si ello no pudiera realizarse, lo más adecuado es la biopsia-aspiración de la grasa subcutánea ab-dominal o una biopsia rectal (que suele ser positiva en el 75%-85% de los casos) cuya toma debe incluir una muestra de tejido submucoso adecuado. Posteriormente todas las muestras obtenidas se tiñen con rojo Congo y bajo el microscopio de luz polarizada se aprecia una birrefringencia verde manzana característica. Con el fin de diferenciar el amiloide AA del no-AA se desarrolló la técnica histológica del permanganato potásico.
La inmunohistoquímica es el método más específico para distinguir los tipos de amiloidosis. El más empleado es el de la inmunoperoxidasa utilizando antisueros marcados contra los distintos tipos de proteínas amiloides: anti-AA, anti-cadenas ligeras, anti-prealbúmina, anti-beta-2-microglobulina, etc.
El análisis proteico es un procedimiento para clasificar las amiloidosis según la secuencia de aminoácidos de la cadena proteica. Un nuevo método, que permite valorar la extensión de la amiloidosis, consiste en marcar con 123I el componente P de la amiloide. También se ha empleado la beta-2-microglobulina marcada con 131I para el diagnóstico gammagráfico de extensión de la amiloidosis tipo beta-2-microglobulina.
Pronóstico
La amiloidosis tiene una evolución fatal en un plazo de pocos años. Habitualmente, la causa de la muerte suele ser la insuficiencia cardíaca o renal, pero también es muy frecuente la muerte súbita, presumiblemente por arritmias. A veces el fallecimiento es consecuencia de hemorragia gastrointestinal, insuficiencia respiratoria, insuficiencia cardíaca incoercible o infecciones superpuestas.
En la amiloidosis AA el pronóstico depende de la enfermedad subyacente, cuyo tratamiento puede dar lugar a la regresión, en general más clínica que histológica, del proceso. Se han visto casos de amiloidosis secundaria a infecciones potencialmente curables, como la osteo-mielitis o la tuberculosis que, tras el tratamiento adecuado, presentaron mejoría clínica notable.
La amiloidosis generalizada expone una supervivencia media, en la mayor parte de las series, de uno a cuatro años, aunque algunos pacientes con amiloidosis han permanecido con vida de cinco a diez años o más. Cuando la amiloidosis está asociada a mieloma múltiple, el pronóstico es muy sombrío y la esperanza de vida se encuentra en torno a los seis meses.
Tratamiento
No existe un tratamiento específico para ninguna de las formas de amiloidosis. Los principales objetivos son disminuir el estímulo crónico que produce el depósito de amiloide, inhibir la síntesis y la acumulación extracelular de los filamentos proteicos y facilitar la lisis o movilización de los depósitos de amiloide.
El tratamiento de la amiloidosis AL es poco satisfactorio. Se emplean fármacos alquilantes eficaces contra procesos proliferativos como el mieloma múltiple; no obstante, estos fármacos pueden producir depresión de la médula ósea, y se han observado casos de leucemia aguda en enfermos tratados con melfalán.
La colchicina también resulta un fármaco prometedor, pues previene la liberación de la proteína AA sérica en los neutrófilos cultivados y su síntesis por los hepatocitos. Se ha demostrado su utilidad, en dosis bajas continuas, para disminuir los brotes periódicos de fiebre mediterránea familiar y para evitar la aparición de la amiloidosis renal de la misma.
En la amiloidosis beta-2-microglobulina el uso de membranas más permeables (polisulfona, poliacrilonitrilo) parece disminuir la incidencia de manifestaciones musculoesqueléticas; sin embargo, el tratamiento ideal es el trasplante renal.
En estudios recientes se comprobó en una serie de 100 pacientes con amiloidosis AL que la supervivencia se incrementaba en aquellos enfermos tratados con prednisona (0,8 mg/kg), melfalán (0,15 mg/kg) y colchicina (1,2 mg/kg) frente a los tratados sólo con colchicina. En otra serie de 220 pacientes con amiloidosis AL resultó más efectiva (con aumento de supervivencia) la asociación de melfalán y prednisona en comparación con el tratamiento de colchicina sola. Es importante destacar que en este tipo de amiloidosis (AL) se han propuesto otras alternativas terapéuticas como el empleo de agentes quimioterápicos a dosis elevadas e incluso el trasplante celular. Sin embargo, es difícil valorar la eficacia de los tratamientos, y en distintos centros se están haciendo estudios en este sentido.
Con respecto a la amiloidosis secundaria (AA) el tratamiento se basará fundamentalmente en el de la enfermedad responsable además de las medidas pertinentes correctoras.
Bibliografía recomendada
Cohen AS, Rubinow A, Anderson JJ, Skinner M, Mason JH, Libbey A, Kayne H. Survival of patients with primary (AL) amyloidosis. Colchicine-treated cases from 1976 to 1983 compared with cases seen previous years (1961 to 1973). Am J Med 1987; 82:1.182-1.190.
Comenzo RL, Vosburghh E, Falk RH, Sanchorawala V, Reisinger J, Dubrey S, et al. Dose-intensive melphalan with blood stem-cell support for the treatment of AL (amyloid light-chain) amyloidosis: survical and responses in 25 patients. Blood 1998; 91:3.662-3.670.
Cuisset L, Drenth JP, Berthelot JM, Meyrier A, Vaudur G, Watts RA, et al. Genetic linkage of the Muckle-Wells syndrome to chromosome 1q44. Am J Human Genetic 1999; 65:1.054-1.059.
Fiter Areste J, Nolla Solé JM, Vaquero C, Valverde García J, Roig Escofet D. Amiloidosis secundaria a la artritis reumatoide. Estudio clínico de una serie de 29 casos. Ann Med Interna (Madrid) 1999; 16:615-619.
García Morán JI, Cascante Barat A, Aldámiz Oliva H. Amiloidosis sistémicas: estudio clínico patológico de 69 casos. Rev Clin Esp 1992; 191:181-186.
Gertz M, Kyle RA. Hepatic amyloidosis (primary [AL], inmunoglobulin light chain): the natural history in 80 patients. Am J Med 1988; 85:74-80.
Gertz M, Kyle RA. Secondary systemic amyloidosis. Response and survical in 64 patients. Medicine (Baltimore) 1991; 70:246-256.
Gilmore JD, Hawkins PN, Pepys MB. Amyloidosis: a review of recent diagnostic and therapeutic developments. Br J Haematol 1997; 99:245-256.
Hawkins PN. Diagnosis and treatment of amyloidosis. Ann Rheum Dis 1997; 56:631-633.
Hawkins PN, Lavender JP, Pepys MB. Evaluation of systemic amyloidosis by scintingraphy with 123 I-labelled serum amyloid P component. N Engl J Med 1990; 323:508-513.
Kyle RA, Gertz MA, Greipp PR, Witzig TE, Lust JA, Lacy MQ, Therneu TM. A trial of three regimens for primary amyloidosis: colchicine alone, melphalan and prednisone, and melphalan, prednisone and colchicine. N Engl J Med 1997; 336:1.202-1.207.
Kyle RA, Gertz MA, Greipp PR, Witzig TE, Lust JA, Lacy MQ, Therneau TM. Long-term survival (10 years or more) in 30 patients with primary amyloidosis. Blood 1999; 93:1.062-1.066.
Martínez Vázquez JM, Pigrau C, Ocaña I, Muñiz R, Capdevilla JA, Ribera E. Valoración clínica de 66 casos de amiloidosis secundaria. Med Clín (Barc) 1985; 85:350-355.
Rubinow A, Koff R, Cohen A. Severe intrahepatic cholestasis in primary amyloidosis. A report of four cases and a review of the literature. Am J Med 1978; 64:937-946.
Skinner M, Anderson JJ, Simms R, Falk R, Wang M, Libbey CA, et al. Treatment of 100 patients with primary amyloidosis: a randomyzed trial of melphalan, prednisone and colchicine versus colchicine only. Am J Med 1996; 100:290-298.