El bocio, definido como el aumento del tamaño del tiroides, es la afección más frecuente de la glándula, tanto en su forma difusa como uni o multinodular. Prácticamente, toda la patología tiroidea puede cursar con bocio y la forma de presentación más frecuente de las neoplasias del tiroides, tanto benignas como malignas, es como un nódulo tiroideo, generalmente único. Todo ello hace que la consulta por bocio sea muy frecuente en la práctica clínica endocrinológica y confiere una importancia especial al problema del nódulo tiroideo, que siempre plantea la duda diagnóstica en cuanto a su posible malignidad.
En este artículo se revisan las causas más frecuentes tanto de bocio difuso como de enfermedad nodular tiroidea
y las pautas de actuación para su diagnóstico y tratamiento que se recomiendan en la actualidad.
Se denomina bocio al aumento de tamaño del tiroides, independientemente de su etiología. El bocio puede clasificarse en difuso o nodular (único o multinodular) y se conoce como bocio simple al que no se debe a la existencia de una enfermedad autoinmunitaria, una tiroiditis o una neoplasia, aunque, en ocasiones, alguno de estos procesos puede acompañarlo. El bocio simple es la enfermedad más común del tiroides y su historia natural demuestra la evolución del aumento de tamaño difuso inicial a la formación de nódulos tiroideos (NT). La prevalencia del trastorno en zonas no endémicas es del 4-7%, con un predominio en la mujer de 7-13:1, y resulta mayor, en las zonas con endemia, dependiendo de la gravedad del déficit de aporte de yodo. También debe recordarse que tanto el peso como la nodularidad del tiroides aumentan con la edad.
Etiología
Los factores etiológicos del bocio son múltiples y, en ocasiones, pueden asociarse dos o más de ellos. Las causas principales de bocio difuso y de enfermedad nodular tiroidea (ENT) se detallan en las tablas 1 y 2, respectivamente.
El déficit de aporte yódico es la causa más importante del bocio simple y constituye la etiología fundamen tal del bocio endémico, que se define cuando más del 10% de la población general de una zona geográfica presenta bocio. Desde la introducción de los programas de profilaxis yódica, la prevalencia del bocio endémico ha disminuido mucho. La ingesta de yodo que se re comienda para un sujeto adulto oscila entre 150 y
300 µg/día.
Otro factor bociógeno importante es el aumento del aclaramiento de yodo por el riñón que puede observarse en la pubertad, el embarazo, la lactancia y el climaterio, especialmente cuando estas situaciones se asocian con cierta insuficiencia en la ingesta de yodo. El exceso de aporte yódico también puede originar la formación de bocio, aunque esta etiología es infrecuente.
Los bociógenos son sustancias capaces de producir experimentalmente bocio y que pueden intervenir en la bociogénesis. Así, el tiocianato y el perclorato disminuyen la captación tiroidea de yodo, los fármacos antitiroideos (propiltiouracilo, metimazol y carbimazol) y otros como las sulfanilureas, las isoniazidas, los salicilatos y la fenilbutazona producen un déficit en la organificación intratiroidea de yodo. El propio yodo, el litio, la vinblastina y la colchicina pueden interferir en la liberación de hormonas tiroideas, y el consumo de harina de soja, nueces, aceite de girasol, cacahuete y algodón puede aumentar la excreción fecal de tiroxina.
Se conoce una serie de defectos congénitos y genéticamente determinados de la hormonosíntesis tiroidea que se heredan de forma autosómica recesiva y que, aunque con poca frecuencia, pueden originar la aparición de bocio (dishormonogénico), acompañado o no de hipotiroidismo.
La resistencia a las hormonas tiroideas es un síndrome clínico heterogéneo, en la mayoría de los casos familiar, que se produce por alteraciones en el receptor intracelular de las hormonas tiroideas y puede cursar
con bocio.
Varios datos apoyan la posibilidad de que algunas alteraciones autoinmunitarias desempeñen un papel coadyuvante en el desarrollo del bocio simple, y otros que pueden intervenir en su aparición son algunos factores de crecimiento y algunas mutaciones de determinados oncogenes.
La enfermedad de Graves-Basedow y algunas tiroiditis, como la de Hashimoto y la subaguda linfocitaria, son alteraciones de etiología autoinmunitaria, mientras que en el desarrollo de la tiroiditis de De Quervain intervienen fenómenos infecciosos y la causa de la tiroiditis de Riedel no se conoce.
En cuanto a las causas de ENT, cabe recordar la evolución del bocio simple hacia la nodularidad y la etiología específica de algunas enfermedades ya citadas.
El adenoma folicular es una neoplasia tiroidea benigna que puede encontrarse entre el 4 y el 20% de los estudios necrópsicos, en glándulas normales o en el seno de un bocio multinodular. Esta frecuencia es mayor en áreas con endemia bociosa y en pacientes con antecedentes de exposición a radiaciones ionizantes. En algunos de estos adenomas, se han identificado mutaciones en los oncogenes GSP y RAS y aumento de expresión en los MYC y FOS. Algunas de estas alteraciones se han descrito también en carcinomas tiroideos, lo que ha llevado a considerar la posible existencia de mecanismos fisiopatológicos comunes en el desarrollo de estos procesos. Además, más del 40% de los adenomas tóxicos tiroideos se debe a mutaciones somáticas que determinan la activación constitutiva del receptor de la tirotropina (TSH), y un porcentaje importante de los nódulos autónomos que aparecen dentro de los bocios multinodulares es también portador de este tipo de
mutaciones. Las relaciones etiopatogénicas entre el adenoma folicular y el bocio multinodular no están claramente establecidas, ya que existen situaciones «intermedias» entre ambas afecciones que justifican las teorías unicistas defendidas por muchos autores. En este sentido, cabe señalar que la cirugía del adenoma permite descubrir con cierta frecuencia la presencia de pequeños nódulos contralaterales. Según estudios recientes, una minoría de células foliculares poseería un elevado grado de autonomía en relación con la TSH, mientras que otras tendrían un elevado potencial de crecimiento. Ambas capacidades serían completamente independientes, lo que explicaría el hecho observado en la clínica de que crecimientos nodulares tiroideos discretos, apenas detectables, pueden originar un cuadro de tirotoxicosis. La base molecular de este diferente comportamiento celular se ha hallado recientemente al demostrarse mutaciones somáticas del receptor de la TSH que determinan su activación constitutiva en los nódulos de bocios multinodulares. Por otra parte, en más del 45% de los pacientes con bocio multinodular se han detectado anticuerpos antitiroideos séricos a títulos bajos, que tienen relación con los infiltrados linfoides tiroideos. Aunque tales alteraciones autoinmunitarias pueden representar sólo un epifenómeno, existe la posibilidad de que determinados bocios multinodulares posean una etiopatogenia autoinmunitaria.
Las neoplasias tiroideas malignas son más frecuentes en el sexo femenino (2-4:1) y su incidencia aumenta con la edad y en los individuos con antecedentes de radioterapia cervical o exposición a radiaciones ionizantes. La radiación externa durante la infancia aumenta claramente el riesgo de desarrollar carcinoma papilar de forma lineal con la dosis de radiación que haya recibido la glándula pero, cuando se superan los 150-200 cGy, la carcinogénesis disminuye. El riesgo de carcinoma no aumenta en los pacientes que han recibido 131I a las dosis utilizadas en el diagnóstico o para el tratamiento de otras enfermedades tiroideas. Las radiaciones ionizantes pueden causar también neoplasias tiroideas benignas.
Diversos trabajos llevados a cabo en animales de experimentación demuestran que algunos estímulos bociógenos (déficit de yodo, administración de tioderivados o de TSH) pueden producir neoplasias tiroideas malignas. Sin embargo, no se ha podido demostrar la existencia de relación alguna entre el estímulo bociógeno y el cáncer de tiroides en humanos, aunque no puede negarse categóricamente que la TSH desempeñe cierto papel en el desarrollo de algunas neoplasias tiroideas, en particular del tipo folicular. En este sentido, hay que destacar que, cuando la ingesta de yodo es baja, existe un aumento relativo del porcentaje de carcinomas foliculares y anaplásicos y una disminución del de papilares.
La mayor parte de los tumores epiteliales del tiroides no son familiares, pero aproximadamente el 3% de los carcinomas papilares y algunos foliculares pueden tener un componente hereditario, como sucede en el síndrome de Gardner, en la enfermedad de Cowden, en el síndrome de Peutz-Jeghers y en la ataxiatelangiectasia. También se han descrito familias con carcinomas papilares aislados y los pacientes con tiroiditis de Hashimoto presentan un riesgo aproximadamente 60 veces superior al de la población general para el desarrollo de linfoma tiroideo.
El 20% de los carcinomas medulares tiene un mecanismo de transmisión hereditaria de tipo autosómico dominante con un elevado grado de penetrancia y que puede originar la aparición de carcinoma medular familiar aislado o en el contexto de una neoplasia endocrina múltiple (NEM) tipo 2A o 2B. Estos carcinomas familiares son debidos a mutaciones que se localizan en diferentes exones del protooncogén RET del cromosoma 10 y que se han identificado en el 90% de los carcinomas medulares familiares y en una pequeña proporción (5-6%) de los esporádicos.
Entre el 3 y el 33% de los carcinomas papilares sin antecedentes de irradiación, y entre el 60 y el 80% de los irradiados, presenta reordenamientos del oncogén RET y, con menor frecuencia, de los oncogenes TRK, RAS y GSP, e hiperexpresión de los MET, MYC y FOS, en distintos porcentajes. Se han encontrado mutaciones puntuales activadoras de los oncogenes GSP y RAS, tanto en adenomas como en carcinomas foliculares, dato que sugiere que estas mutaciones pueden constituir un fenómeno inicial en el proceso de la tumorogénesis. Mutaciones puntuales inactivadoras de al menos dos oncogenes supresores, el p53 y el RB, se han hallado con mucha frecuencia en los carcinomas anaplásicos y, en cambio, son raras en las células de los carcinomas diferenciados. El hecho de haberse detectado las mismas mutaciones y/o hiperexpresiones de determinados oncogenes en neoplasias tiroideas benignas y malignas ha llevado a algunos autores a especular con la posibilidad de la existencia de un proceso evolutivo común que se iniciaría con el desarrollo de una neoplasia benigna, se seguiría de la transformación de ésta en un carcinoma diferenciado y finalizaría con la evolución a carcinoma indiferenciado. Todo ello, debido a la acción de los diferentes cambios sufridos por varios oncogenes.
Diagnóstico y diagnóstico diferencial del bocio difuso
El bocio simple no suele dar sintomatología, a excepción de la relacionada con la eventual compresión de estructuras vecinas, como disfonía, disfagia o disnea. En ocasiones, puede aparecer dolor secundario a he morragia local. En las fases iniciales de la enfermedad, el bocio es difuso y, luego, puede hacerse nodular y aumentar de tamaño. El crecimiento intratorácico y la evolución a bocio multinodular tóxico son relativamente frecuentes en sujetos de edad avanzada y suelen cursar con signos y síntomas de compresión y de hipertiroidismo.
Las enfermedades en las que se asocian bocio y alteración de la función tiroidea, como la enfermedad de Graves-Basedow o las tiroiditis, pueden cursar con clínica de hiper o hipofunción, según el caso y el momento evolutivo.
La forma más frecuente de presentación clínica tanto del adenoma folicular como de los carcinomas tiroideos diferenciados es un NT «frío» en la gammagrafía, en un paciente con normofunción tiroidea (v. el apartado de diagnóstico diferencial de la ENT). En ocasiones, los adenomas, especialmente los que son mayores de 3 cm y/o llevan largo tiempo de evolución, pueden causar hipertiroidismo primario (con una incidencia aproximada del 5% anual).
En general, el diagnóstico del bocio simple no plantea dificultades. Su tamaño y características se determinan fundamentalmente por palpación; para su clasificación resulta útil el método propuesto recientemente por la OMS, que se detalla en la tabla 3.
La determinación de las concentraciones séricas de TSH permite confirmar la normofunción tiroidea característica del bocio simple o detectar las alteraciones que pueden aparecer en otras enfermedades, tanto en el sentido de hipertiroidismo como de hipotiroidismo. En los pacientes de zonas geográficas con bocio endémico puede ser útil la determinación de la yoduria. La endemia se considera leve si la yoduria es de 50 a 99 µg/l, moderada si oscila entre 20 y 49 µg/l, y grave si es inferior a 20 µg/l.
La positividad de los anticuerpos antitiroperoxidasa (TPO) y/o antitiroglobulina (Tg) a títulos superiores a 50 y a 100 U/ml, respectivamente, sugiere el diagnóstico de afección tiroidea autoinmunitaria; sin embargo, hay que recordar que pacientes con enfermedades tiroideas de etiología no autoinmunitaria (como los afectados de bocio simple o ENT) y algunos sujetos normales pueden presentar anticuerpos antitiroideos circulantes a títulos bajos y, en otros casos, pueden existir falsos negativos en tiroidopatías autoinmunitarias. La determinación de los anticuerpos antirreceptor de la TSH puede ser útil, aunque no imprescindible, en pacientes con bocio e hipertiroidismo, ya que su positividad confirma el diagnóstico de enfermedad de Graves-Basedow.
La práctica de una ecografía cervical puede resultar útil en el estudio del bocio simple, ya que proporciona información tanto sobre su tamaño como sobre las características de la glándula y permite identificar los posibles NT no palpables («incidentalomas tiroideos»).
En algunos casos, puede ser también útil realizar una gammagrafía tiroidea, que demostrará la existencia de un bocio difuso en las fases iniciales o de captación heterogénea del trazador, con áreas de hipocaptación e hipercaptación, en casos de multinodularidad. Mediante esta exploración puede detectarse la existencia de prolongación endotorácica del bocio. La gammagrafía proporciona información en determinados casos de hipertiroidismo para establecer el diagnóstico diferencial entre la enfermedad de Graves-Basedow, que cursa con hipercaptación, y las tiroiditis silente y subaguda, que presentan una fase inicial transitoria de hipocaptación coincidente con la situación de hiperfunción.
La radiología simple es un método de escasa utilidad en el diagnóstico de las tiroidopatías, aunque, en ocasiones puede hacer sospechar la existencia de extensión endotorácica de un bocio, y la práctica de la tomografía computarizada (TC) y de la resonancia magnética (RM) debe reservarse para casos seleccionados en los que las otras técnicas de diagnóstico morfológico no hayan aportado datos concluyentes.
El estudio citológico del material aspirado mediante punción-aspiración con aguja fina (PAAF) es útil en todos los casos de bocio. El diagnóstico citológico más frecuente en los pacientes con bocio simple es el de bocio coloide, que se basa en el hallazgo de abundante material coloide y escasa celularidad.
En la fase de bocio difuso, puede plantearse el diagnóstico diferencial del bocio simple con la enfermedad de Graves-Basedow o con alguna tiroiditis. En ambas situaciones, las determinaciones de TSH, T4 libre, anticuerpos antitiroideos y, eventualmente, de anticuerpos antirreceptor de la TSH y la práctica de una gammagrafía tiroidea suelen ser suficientes para aclarar el diagnóstico.
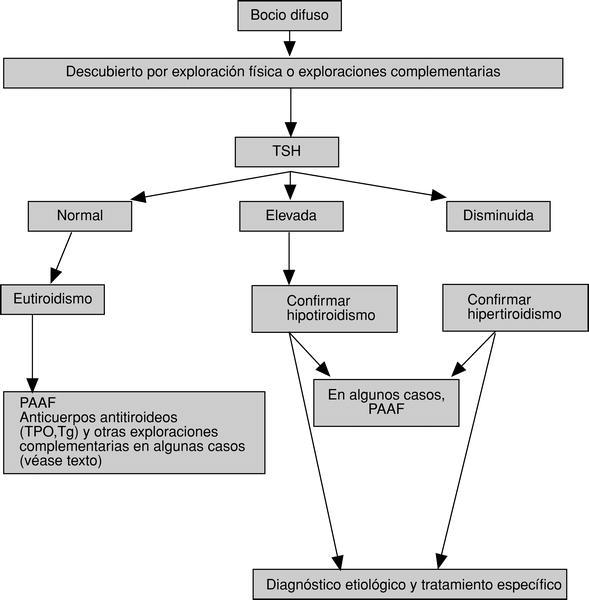
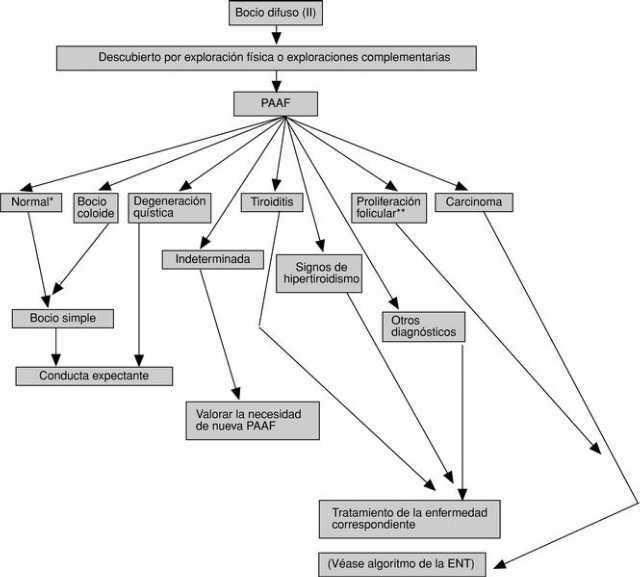
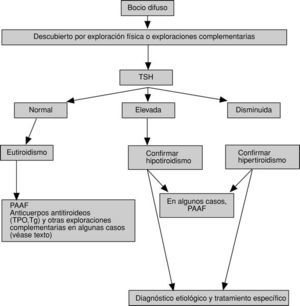
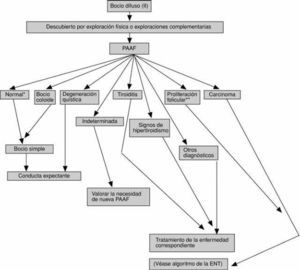
En las figuras 1 y 2 se detallan las exploraciones que se recomienda realizar en un paciente con bocio difuso.
Fig. 1. Algoritmo diagnóstico y terapéutico del bocio difuso (I). TSH: tirotropina; PAAF: punción-aspiración con aguja fina para examen
Fig. 2. Algoritmo diagnóstico y terapéutico del bocio difuso (II). PAAF: punción-aspiración con aguja fina para examen citológico. *Celularidad benigna y arquitectura normal. **Celularidad folicular abundante, coloide escaso y, con frecuencia, formación de microfolículos.
Diagnóstico y diagnóstico diferencial de la enfermedad nodular tiroidea
La forma de presentación clínica más habitual de las neoplasias tiroideas tanto benignas como malignas es la aparición de un NT. Esta forma de presentación ocurre hasta en el 75-90% de los casos de carcinoma, aunque sólo el 5-15% de los NT únicos sin antecedentes de irradiación y el 20-25% de los que han sido irradiados son malignos. Por otra parte, la ENT es un motivo de consulta muy frecuente en la práctica clínica endocrinológica ya que la palpación cervical sistemática permite la detección de entre un 4 y un 7% de NT en la población general, y entre un 20 y un 30% en la población irradiada. La prevalencia de la ENT es mayor en el sexo femenino, y aumenta con la edad; en estudios necrópsicos, es de más del 50% y, en exploraciones ecográficas, su hallazgo casual («incidentalomas tiroideos») llega al 67% (intervalo: 13-67). En cualquier caso, el carcinoma tiroideo, a pesar de ser la neoplasia endocrinológica más común, es poco frecuente (se diagnostican de 36 a 60 nuevos casos clínicamente relevantes por 100.000 habitantes/año). Los carcinomas llamados «ocultos» (generalmente papilares), de menos de 1 o 1,5 cm, llegan a ser un hallazgo casual entre el 3 y el 35% de las necropsias y el 4-17% de los bocios extirpados por otra causa, si bien, la relevancia clínica real de estos carcinomas «ocultos» no se conoce, ya que mientras que algunos de ellos son capaces de metastatizar, otros permanecen totalmente silentes y se comportan como lesiones benignas. Todos estos hechos confieren especial importancia al problema del NT, que siempre plantea la duda diagnóstica en cuanto a su posible malignidad. Además, prácticamente cualquier enfermedad tiroidea puede manifestarse como un NT único o no (tabla 2), y el diagnóstico del cáncer de tiroides sólo puede establecerse con certeza mediante el estudio anatomopatológico. No obstante, existe una serie de datos de la historia clínica y de la exploración física que resultan orientativos de malignidad ante un NT tiroideo, que se recogen en la tabla 4.
En un paciente con ENT, se recomienda determinar siempre la concentración de TSH, ya que su alteración es indicativa de la existencia de patología que cursa con disfunción tiroidea, dato que hace más improbable la malignidad, aunque no la descarta totalmente. En el diagnóstico de los carcinomas medulares familiares, es importante la caracterización de la mutación del pro tooncogén RET y el estudio familiar completo para identificar a los portadores lo antes posible. Los sujetos afectados deben ser sometidos a determinaciones sucesivas de calcitonina basal y estimulada con pentagastrina y calcio para establecer el diagnóstico de hiperplasia de células C (estadio previo al carcinoma medular), lo más precozmente posible.
Al igual que sucede en los pacientes con bocio difuso, en los portadores de una ENT de etiología no autoinmunitaria, es relativamente frecuente la positividad de los anticuerpos antitiroideos a títulos bajos.
La ecografía de alta resolución es una exploración muy sensible para detectar NT muy pequeños (de 1-3 mm de diámetro), pero tiene poca especificidad. Así, aunque se considera que un NT sólido (70% de los NT) tiene más posibilidades de ser maligno, únicamente lo es en el 20% de los casos. Además, entre el 1 y el 7% de los quistes tiroideos y aproximadamente el 12% de las lesiones mixtas (sólido-líquidas) son carcinomas, generalmente papilares. La ecografía puede ser útil para diagnosticar la existencia de un bocio multinodular en el que, según algunos estudios, la frecuencia de malignidad es menor que en los NT únicos y para detectar los denominados «incidentalomas tiroideos».
Según su capacidad para captar el radioisótopo en la gammagrafía, los NT se clasifican en «fríos» o no captantes (80-85%), isocaptantes (15%) o hipercaptantes (5%). Los tumores malignos suelen ser «fríos» aunque se han descrito carcinomas foliculares isocaptantes e hipercaptantes, pero sólo el 10-20% de los NT «fríos» son malignos y muchas de las lesiones benignas se manifiestan también como un NT «frío». Por todo ello, no se considera que la gammagrafía sea necesaria en la valoración de los pacientes con ENT.
No existe ninguna exploración con el 100% de sensibilidad y especificidad para el diagnóstico diferencial de la ENT, a excepción del estudio anatomopatológico. A pesar de ello, con la introducción del examen citológico del material obtenido por PAAF, la aproximación diagnóstica a esta patología ha cambiado totalmente. Así, en el momento actual, la mayoría de autores recomienda la PAAF como primera exploración para el diagnóstico de la ENT. En manos de un citólogo experto, esta técnica segura, sencilla, indolora y de bajo coste, posee una sensibilidad del 65-98%, una especificidad del 72-100% y un rendimiento diagnóstico del 85-100%, siendo el porcentaje de falsos negativos del 1-11%. Su única limitación es el diagnóstico citológico de proliferación folicular (aproximadamente el 15% de las PAAF), que se define por la presencia de celularidad folicular abundante, coloide escaso y, con frecuencia, formación de microfolículos y que no permite diferenciar el adenoma folicular de la hiperplasia nodular, ni del carcinoma folicular (10-20% de las proliferaciones foliculares). Algunos autores recomiendan la práctica repetida de PAAF para aumentar su rendimiento diagnóstico, hecho no confirmado en todos los estudios. También se ha intentado diferenciar las proliferaciones foliculares malignas de las benignas mediante criterios tanto citológicos como clínicos sin que se haya llegado a conclusiones satisfactorias. La PAAF tiene utilidad terapéutica en aproximadamente el 50% de los quistes tiroideos que desaparecen tras la punción.
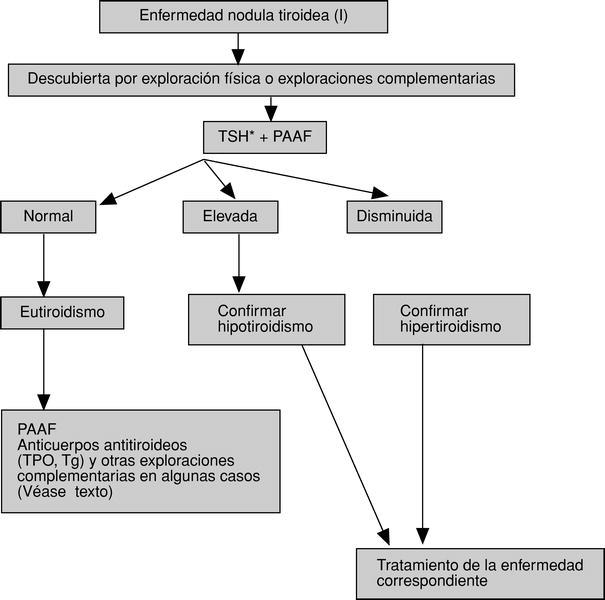
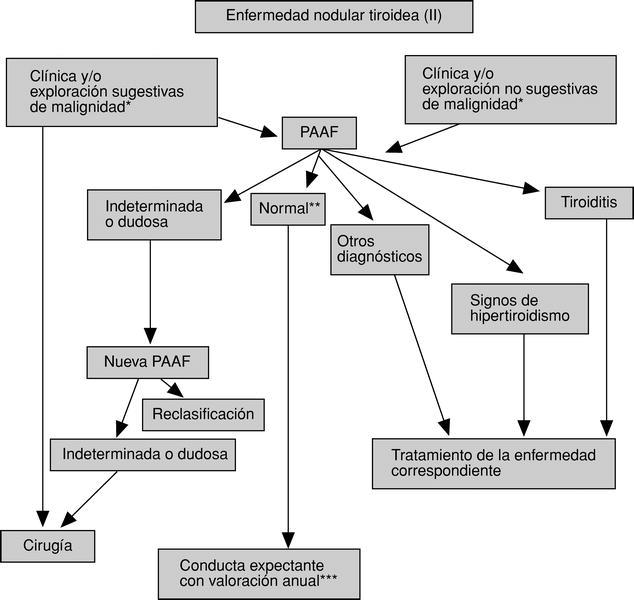
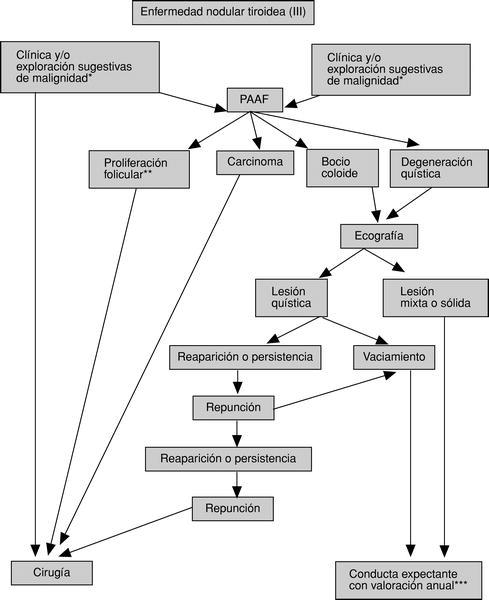
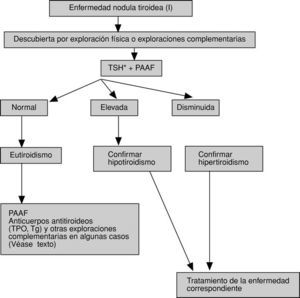
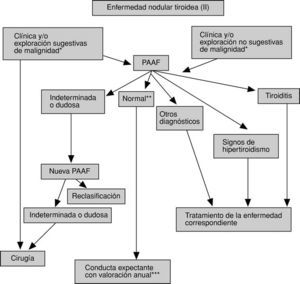
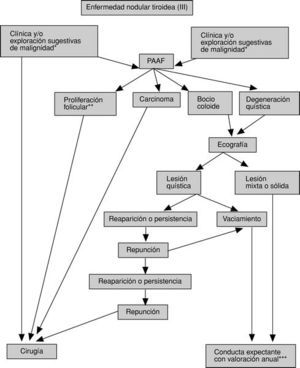
En las figuras 3-5 se detallan las exploraciones que se recomienda realizar en un paciente con ENT.
Fig. 3. Algoritmo diagnóstico y terapéutico de la enfermedad nodular tiroidea (I). TSH: tirotropina; PAAF: punción-aspiración con aguja fina para examen citológico posterior; TPO: tiroperoxidasa; Tg: tiroglobulina. *En casos concretos, de sospecha de carcinoma medular, puede ser útil la determinación de calcitonina basal o estimulada.
Fig. 4. Algoritmo diagnóstico y terapéutico de la enfermedad nodular tiroidea (II). PAAF: punción-aspiración con aguja fina para examen citológico posterior; *Véase tabla 4. **Celularidad benigna y arquitectura normal. ***Si aparecen cambios clínicos, revalorización con repunción. Si aparecen datos sugestivos de malignidad (v. tabla 4), indicar cirugía, previa repunción.
Fig. 5. Algoritmo diagnóstico y terapéutico de la enfermedad nodular tiroidea (III). PAAF: punción-aspiración con aguja fina para examen citológico posterior. *Véase tabla 4. **Celularidad folicular abundante, coloide escaso y, con frecuencia, formación de microfolículos. **Si aparecen cambios clínicos, revalorización con repunción. Si aparecen datos sugestivos de malignidad (v. tabla 4), indicar cirugía, previa repunción
Evolución, pronóstico y tratamiento
El pronóstico del bocio simple es bueno y su evolución desfavorable depende sólo de la posible aparición de fenómenos compresivos. En los estadios iniciales, el proceso puede revertir espontáneamente, especialmente en el varón y después de la pubertad pero, una vez en fase de nodularidad, las alteraciones de la glándula son completamente irreversibles. La evolución del bocio simple hacia el hipotiroidismo es excepcional mientras que el desarrollo de hipertiroidismo es relativamente frecuente (bocio multinodular tóxico).
El tratamiento con levotiroxina sódica puede disminuir de forma transitoria el tamaño del 25% de los bocios simples siempre que se administre en los primeros meses de evolución y a dosis inhibidoras de la TSH.
En general, en el bocio simple se recomienda seguir una actitud expectante con controles periódicos. En algunos casos muy seleccionados, por preferencias del paciente o cuando existen signos y/o síntomas de compresión, debe valorarse la indicación de la tiroidectomía subtotal bilateral.
El tratamiento de las entidades que cursan con bocio y alteraciones de la función tiroidea, como la enfermedad de Graves-Basedow y las tiroiditis, será el específico para cada caso y su desarrollo excede los límites de esta revisión.
El tratamiento de los bocios dishormonogénicos consiste en la administración de levotiroxina sódica a dosis sustitutivas y, cuando aparece hipotiroidismo por invasión de la glándula por enfermedades sistémicas generalizadas, debe instaurarse también tratamiento sustitutivo.
El tratamiento quirúrgico se indicará siempre en los pacientes con ENT y sospecha o diagnóstico de malignidad. Este grupo incluye a todos los enfermos con criterios clínicos de malignidad independientemente del diagnóstico citológico y también a todos los que presentan el diagnóstico citológico de proliferación folicular, aunque únicamente son malignos el 10-20% de los NT con esta citología. La extensión de la cirugía (hemitiroidectomía, tiroidectomía subtotal o total) dependerá del diagnóstico definitivo de la lesión.
Los pacientes con adenoma tóxico o bocio multinodular tóxico son tributarios de tratamiento con fármacos antitiroideos y, una vez conseguida la normofunción, se planteará el tratamiento quirúrgico (hemitiroidectomía o tiroidectomía subtotal) o la administración de radioyodo. En general, la cirugía se indica en los enfermos más jóvenes y con NT de mayor tamaño. El radioyodo controla el hipertiroidismo y también puede disminuir el tamaño de los nódulos; aunque clásicamente se había reservado para los pacientes con riesgo quirúrgico importante, en el momento actual se utiliza de forma más amplia y con buenos resultados iniciales. En los últimos años, se ha introducido la inyección local de etanol o de otras sustancias esclerosantes, guiada o no por ecografía, en el tratamiento de los adenomas tóxicos, con buenos resultados, en pacientes seguidos durante cortos períodos de tiempo. Esta técnica puede ser una alternativa al radioyodo y también se ha utilizado en quistes y en nódulos mixtos, después de su vaciamiento mediante PAAF, con el objetivo de prevenir la recidiva.
Los pacientes con ENT e hipotiroidismo se tratarán con dosis sustitutivas de levotiroxina sódica, siempre que no exista sospecha de enfermedad maligna, en cuyo caso se indicará la intervención quirúrgica.
Ante un paciente con ENT, citología benigna y normofunción tiroidea, existen diferentes opciones de tratamiento. La cirugía es una de ellas, pero en más del 90% de los casos resulta innecesaria. Otra alternativa terapéutica, introducida recientemente en algunos de estos pacientes y con la que se obtienen resultados aceptables, es la administración de radioyodo. La utilidad del tratamiento de los pacientes portadores de una ENT benigna con levotiroxina sódicaa dosis que reducen la producción de TSH es aún un tema de debate. Su hipotética efectividad se basa en la teoría clásica de la influencia de la TSH en el crecimiento del tejido tiroideo y, aunque estudios más recientes demuestran la importancia de otros factores diferentes de la TSH en el desarrollo de los NT, algunos autores continúan utilizando este tratamiento. Así, en los últimos 20 años, se han publicado diferentes trabajos que evalúan la eficacia de la administración de dosis variables de levotiroxinapara conseguir disminuir el tamaño o inducir la desaparición de los NT con resultados contradictorios. Al analizar la relación riesgo/beneficio de este tratamiento no deben olvidarse sus posibles efectos secundarios tanto sobre el metabolismo óseo como sobre la morbilidad cardiovascular. Por ello, en las recomendaciones más recientes sobre el tratamiento que reduce la producción de TSH en la ENT, se consideran de forma separada, por su diferente riesgo, la población masculina y la femenina y, dentro de ésta, las mujeres premenopáusicas de las menopáusicas. En general, se aconseja una actitud más conservadora en los grupos de mayor riesgo y la administración de la dosis mínima posible de levotiroxina y durante menos tiempo en estos grupos de pacientes. Sin embargo, en espera de estudios más amplios y con más tiempo de seguimiento, la mayoría de autores recomienda mantener una conducta expectante con revaloraciones periódicas en los pacientes con ENT benigna. El tratamiento con levotiroxina sódica está contraindicado si la concentración de TSH es inferior a 0,1 mU/l por el riesgo de desarrollar hipertiroidismo.
La actitud terapéutica de nuestro grupo, ante un paciente con ENT, se resume en las figuras 3-5.