Los pacientes oncológicos acuden con cierta frecuencia a los servicios de urgencias de los hospitales donde llevan a cabo un control de su enfermedad de base. Los motivos de consulta urgente están muchas veces relacionados con su neoplasia y las eventuales complicaciones, aunque en otras ocasiones se deben a efectos adversos del tratamiento quimio o radioterápico,
o incluso a afecciones intercurrentes no relacionadas con la enfermedad neoplásica.
Siempre que sea posible debe consultarse la historia clínica y/o los informes previos de asistencia que nos permitirán conocer con detalle la situación clínica del paciente y saber si está recibiendo tratamiento activo con intención curativa o si, por el contrario, se encuentra en situación paliativa. Una anamnesis y una exploración física completas suelen ser suficientes para orientar el origen de la urgencia, aunque habitualmente deberá confirmarse mediante la realización de pruebas complementarias, antes de instaurar el tratamiento adecuado.
En los últimos años el tratamiento del enfermo oncológico ha experimentado cambios significativos. La aparición de fármacos antitumorales cada vez más activos ha permitido disponer de varias líneas de tratamiento y aumentar las expectativas de supervivencia. Así, la supervivencia media actual de las mujeres con cáncer de mama y metástasis óseas supera los 2 años, y los pacientes con carcinoma pulmonar microcítico limitado a tórax tratados con quimioterapia y radioterapia alcanzan supervivencias de un 40% a los 2 años y de un 15 a un 20% a los 5 años.
Los pacientes con procesos neoplásicos acuden con frecuencia a los servicios de urgencias. Los motivos de consulta son diversos, pudiendo clasificarse en 4 grandes grupos recogidos en la tabla 1.
Cuando uno de estos pacientes consulta al servicio de urgencias, es de gran utilidad disponer de su historial clínico. En él podemos consultar datos que nos ayudarán a realizar una correcta orientación diagnóstica del proceso y a la toma posterior de decisiones terapéuticas, entre los que cabe destacar:
1. Localización del tumor primario y estadio de la neoplasia.
2. Tratamiento actual de la enfermedad (¿Está recibiendo tratamiento quimioterápico y/o radioterápico? ¿Qué citostáticos se le han administrado? ¿Es un tratamiento neoadyuvante [previo a la cirugía], adyuvante [después de la cirugía], o instaurado por un proceso metastásico?).
3. Situación actual de la enfermedad. Es importante conocer si el paciente está recibiendo tratamiento paliativo o, por el contrario, tratamiento activo con intención curativa.
Urgencias relacionadas con la neoplasia o sus complicaciones
Tratamiento del dolor en los pacientes con cáncer
El dolor motiva la tercera parte de las consultas a las salas de urgencias. Entre el 10 y el 15% de los pacientes con tumores en estadios iniciales y del 60 al 90% con estadios avanzados van a presentar dolor en algún momento del curso de la enfermedad. Antes de atribuir un cuadro álgico al tumor deberemos descartar otras causas. Para ello, es preciso realizar una anamnesis completa que permita conocer todas las características del dolor, una exploración física, y las pruebas complementarias que consideremos necesarias para filiar su origen.
Elección del analgésico
La OMS propone el uso de «una escalera terapéutica» de fármacos por vía oral en función de la intensidad del dolor (tabla 2).
Dosificación de los analgésicos más habituales. Disponemos de los siguientes fármacos:
Paracetamol. Efecto analgésico y antitérmico, no antiinflamatorio. Dosis: 500-1.000 mg cada 4-6 h por vía oral.
Metamizol magnésico. Efecto analgésico y espasmolítico, especialmente efectivo en el tratamiento del dolor visceral. Cápsula: 500 mg. Supositorio: 1.000 mg. Ampolla: 2.000 mg. Posología: una cápsula cada 6-8 h; en dolores intensos, una ampolla bebida cada 6-8 h. Cuando el dolor no se controla por vía oral recurriremos a la vía intravenosa o intramuscular cada 6-8 h.
Opiáceos menores. Efecto analgésico más potente que los fármacos del primer escalón terapéutico y sinérgico con ellos. Como efectos secundarios ocasionan con frecuencia náuseas y estreñimiento. Los fármacos más utilizados son:
* Sulfato de codeína: comprimidos de 30 mg, a dosis de un comprimido cada 6 h.
* Codeína (30 mg) + paracetamol (500 mg): 1-2 comprimidos o cápsulas cada 6 h.
* Dihidrocodeína: comprimidos de 60, 90 y 120 mg, a dosis de un comprimido cada 12 h.
* Tramadol: cápsulas de 50 mg e inyectables de 100 mg. Dosis: una cápsula cada 6 h o una ampolla intravenosa cada 6 h, en dolores intensos.
Morfina. Debe utilizarse siempre y cuando el dolor no se haya controlado con los fármacos anteriores. La prescripción de morfina depende de la intensidad del dolor y no de la situación del tumor. Es un analgésico de gran utilidad por la falta de techo antiálgico. El efecto secundario más habitual es el estreñimiento, por lo que es aconsejable la asociación de laxantes desde el inicio de su administración. Por vía oral, el riesgo de depresión respiratoria es muy bajo, mientras que por vía parenteral deberemos ser cautos en su manejo, principalmente en pacientes con enfermedades cardiorrespiratorias. En pacientes de edad avanzada puede ocasionar alteraciones de la conducta y períodos de desorientación temporoespacial. Existen unas recomendaciones básicas para la utilización de la morfina, que se resumen en la tabla 3.
Los compuestos de morfina más utilizados son:
* Sulfato de morfina: cápsulas de liberación lenta de 10, 30, 60 o 100 mg. La dosis inicial es de 10 mg cada 12 h. Los incrementos de dosis han de realizarse de forma progresiva, aumentando 10 mg en cada toma hasta que se controle el dolor.
* Solución acuosa de morfina: Suele prepararse a concentraciones de 10 mg por cm3. Es un preparado de absorción rápida y duración corta. Está indicado cuando se pretende conseguir un alivio rápido del dolor o como tratamiento de rescate entre las tomas de morfina de liberación lenta, cuando el dolor no está controlado. Dosis inicial: 1 cm3 cada 4 h. Los incrementos de dosis serán de 10 mg (1 cm3) en cada toma.
* Parche transdérmico de fentanilo. Especialmente útil en pacientes con intolerancia a la morfina oral o con problemas para la ingesta. Son parches de 25, 50 o 100 mgcon una vida media de 72 h. No están indicados en dolores intensos que requieran un alivio inmediato, aunque son útiles como tratamiento de mantenimiento.
* Cloruro mórfico (una ampolla de 1 cm3 [10 mg]). La vía parenteral se reserva para el control de dolores muy intensos. La dosis inicial suele ser un bolo de 5 a 10 mg. Puede proseguirse la administración por vía subcutánea (absorción errática) o vía intravenosa en infusión continua (10 mg diluidos en 500 cm3 de suero glucosado, fisiológico o glucosalino cada 4-6 h).
AINE. Efecto analgésico, antitérmico y antiinflamatorio. Muy útiles en el tratamiento del dolor por metástasis óseas. En este caso se asociarán a cualquiera de los fármacos de los «tres escalones». Los principales componentes de esta familia son:
* Ácido acetilsalicílico: 500-1.000 mg cada 4-6 h.
* Diclofenaco: 50 mg cada 8-12 h. Existen preparados de liberación lenta de 100 mg administrados en una dosis única diaria.
* Aceclofenaco: 100 mg cada 12-24 h.
* Indometacina: 25 mg cada 8-12 h.
* Naproxeno: 500 mg cada 6-8 h.
Fármacos adyuvantes. Se utilizan asociados a cualquiera de los fármacos de los tres «escalones» para potenciar su efecto analgésico:
* Corticoides: Por su acción antiinflamatoria son útiles en el tratamiento de la hepatalgia por metástasis hepáticas, y de la cefalea por hipertensión intracraneal debida a metástasis cerebrales.
* Antidepresivos tricíclicos. Indicados en el tratamiento de los dolores neuropáticos, solos o asociados a otros analgésicos. El más utilizado es la amitriptilina a dosis de 25 mg cada 24 h.
* Benzodiacepinas. Ayudan a aliviar la ansiedad del paciente y también son útiles en el control de los dolores neuropáticos. Uno de los más prescritos es el clonacepam a dosis de 0,3 a 0,5 mg cada 8 h.
El control del dolor requiere de un período de tiempo variable de observación en el que el paciente ha de ser controlado regularmente, y no debe ser dado de alta hasta haber comprobado que el tratamiento analgésico es efectivo. En caso de que persista la sintomatología deberemos plantearnos su ingreso.
Síndrome de vena cava superior
El síndrome de vena cava superior es consecuencia de la obstrucción de esta vena en el mediastino, habitualmente por compresión extrínseca y ocasionalmente por infiltración. La causa más frecuente es la neoplásica, destacando el carcinoma primario de pulmón como principal etiología (70%). La estirpe histológica más habitual es el carcinoma de célula pequeña, seguido del carcinoma escamoso y, con mucha menor frecuencia, tumores como el linfoma, el timoma y el disgerminoma.
Diagnóstico
Anamnesis. El paciente suele referir disnea acompañada de tos irritativa, congestión facial, cefalea y, menos frecuentemente, dolor torácico y disfagia. Estos síntomas suelen empeorar con los cambios posturales, especialmente en decúbito.
Exploración física. Observaremos rubicundez facial, aumento del diámetro cervical con distensión de las venas del cuello y del tórax, aparición de circulación colateral, edema en esclavina y en las extremidades superiores.
Analítica completa.
Radiografía de tórax. Presentará un ensanchamiento mediastínico.
TC torácica. Nos permitirá definir mejor la etiología.
Tratamiento
Medidas generales. Consistirán en: oxigenoterapia; elevación de la cabecera de la cama 45°, para favorecer el retorno venoso; corticoterapia: prednisona 40 mg/8 h, especialmente efectiva en el linfoma, y diuréticos, de eficacia dudosa (furosemida 40 mg/8-12 h).
Tratamiento específico. Dependerá de la etiología del síndrome. Como hemos indicado, la causa más frecuente es la neoplasia de pulmón, siendo el tratamiento citostático, asociado o no a la irradiación torácica, el tratamiento de elección.
Síndrome de compresión medular
El síndrome de compresión medular aparece como complicación evolutiva de la enfermedad neoplásica en el 1-5% de los pacientes con cáncer diseminado. El 95% de los casos son secundarios a metástasis de localización extradural que comprimen el cordón medular. Sólo el 5% son debidos a metástasis intradurales. Las neoplasias que con más frecuencia ocasionan una compresión medular son la de pulmón y la de mama. El nivel de afección más habitual es el torácico (75%), seguido del cervical (12%) y el lumbosacro (10%).
Diagnóstico
El dolor radicular o local constituye el síntoma inicial en el 95% de los casos. Puede preceder semanas al resto de los síntomas. Posteriormente, se instaurará de forma progresiva la sintomatología secundaria al compromiso neurológico, en forma de parestesias y paresias en la localización correspondiente al nivel de la afección. En fases más avanzadas se sumarán alteraciones del control esfinteriano, con retención de orina y estreñimiento pertinaz, por afección del sistema autónomo. Una vez ha aparecido esta sintomatología, la compresión medular progresa rápidamente y puede ser irreversible si el tratamiento no se inicia de forma urgente.
Ante la sospecha clínica de compresión medular se realizarán las siguientes exploraciones:
Radiografía simple de columna. Como signos de sospecha pueden aparecer erosiones de los pedículos, aplastamientos vertebrales o masas paravertebrales. La normalidad de esta prueba no descarta el diagnóstico.
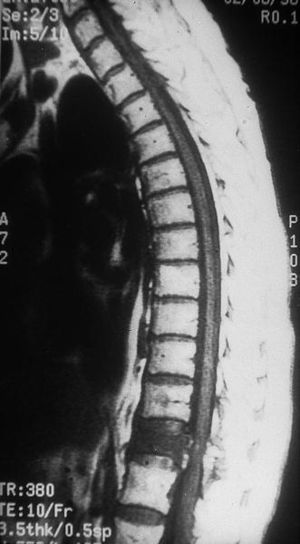
RM de la columna vertebral. Es la exploración básica y debe realizarse con carácter urgente. Se explorará todo el raquis, puesto que con frecuencia las lesiones metastásicas son múltiples. Su realización no debe diferir el inicio del tratamiento, que instauraremos cuando exista una alta sospecha clínica:
* Analítica urgente.
* Radiografía de tórax.
Tratamiento
Medidas generales. Se emplearán:
Corticoides. A partir de una sospecha clínica fundada iniciaremos tratamiento con dexametasona a dosis de 100 mg en bolo de 10 min, seguido de 4 mg cada 6 h intravenoso.
Protección gástrica. Por vía oral con sucralfato 1 g cada 6 h o ranitidina 300 mg cada 24 h. En el caso de que el paciente esté recibiendo también tratamiento con AINE, indicar mejor omeprazol 20 mg al día o misoprostol 200 µg cada 8 h.
Tratamiento específico. La radioterapia es el tratamiento de elección de la compresión medular, aunque la laminectomía descompresiva puede estar indicada en las siguientes circunstancias:
1. Ausencia de diagnóstico histológico.
2. Compresión localizada en una zona irradiada previamente.
3. Irradiación no efectiva.
4. Columnas inestables que requieren de la realización de osteosíntesis (fig. 1).
Figs. 1A y B. RM de columna dorsolumbar que presenta compresión medular por metástasis ósea.
Metástasis cerebrales. Carcinomatosis meníngea
Principales etiologías de los cuadros neurológicos centrales en el paciente con cáncer
Metástasis cerebrales (la causa más frecuente). El cáncer de pulmón (célula pequeña, adenocarcinoma) y el de mama son las neoplasias que con mayor frecuencia metastatizan a este nivel; la carcinomatosis meníngea; accidente cerebrovascular; trastornos hidroelectrolíticos (hiponatremia por secreción inadecuada de ADH [oat-cell], hipercalcemia, hipomagnesemia [en tratamientos con cisplatino], hipoglicemias); fárma cos (principalmente opiáceos) y, por último, sepsis u otras patologías sistémicas graves (sobre todo en ancianos).
Diagnóstico
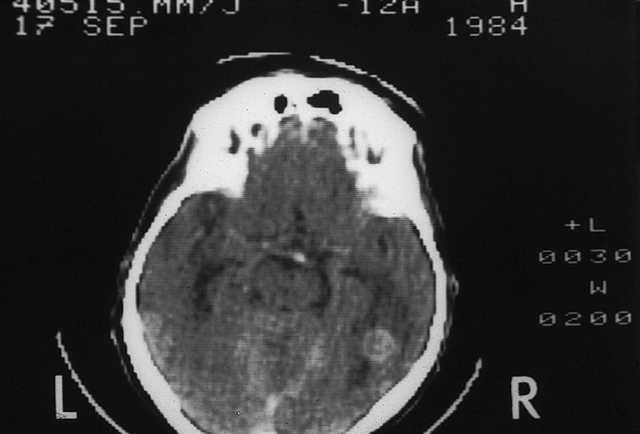
Anamnesis y exploración física. La afección de los pares craneales es típica de la carcinomatosis meníngea. En el caso de metástasis cerebrales, el paciente presentará la clínica correspondiente al déficit de la zona dañada y a la hipertensión intracraneal (cefalea, vómitos «en escopetazo»).
Hemograma, coagulación y bioquímica (incluyendo la calcemia).
Radiografía de tórax.
Electrocardiograma.
TC cerebral. La realizaremos después de haber descartado la presencia de causas metabólicas o farmacológicas. Suele ser la prueba diagnóstica en la mayoría de pacientes.
RM cerebral. Permite detectar lesiones muy pequeñas que pasan desapercibidas a la TC. Su práctica estará indicada cuando exista una alta sospecha clínica y la TC sea normal o cuando nos planteemos la resección de las metástasis o su tratamiento con radiocirugía.
Punción lumbar. Deberá indicarse en los casos en que se sospeche meningit is infecciosa o carcinomatosa, siempre que la TC cerebral sea normal. En la muestra de líquido cefalorraquídeo realizaremos un estudio bioquímico, citológico y microbiológico. En la meningitis carcinomatosa el líquido presentará un aspecto claro, con hiperproteinorraquia (> 0,4 g/l), normo o hipoglucorraquia (60-70% de la glucemia) y leucorraquia de predominiolinfocitario. El estudio citológico del líquido nos proporcionará la confirmación diagnóstica.
Tratamiento de las metástasis cerebrales
Medidas generales. Consisten en los siguientes as-
pectos:
Tratamiento antiedema cerebral. El fármaco principal en el tratamiento del edema cerebral es la dexametasona, a dosis de 4 mg/6 h (i.v.). En caso de edema importante y/o clínica de hipertensión intracraneal, iniciaremos el tratamiento con un bolo de 20 mg. En estos pacientes puede asociarse manitol al 20%, 250 cm3 cada 8-12 h, seguido de furosemida 30 min después del manitol (eficacia dudosa).
Tratamiento anticomicial. No se ha demostrado el beneficio de su administración de forma profiláctica; por tanto, lo prescribiremos únicamente en pacientes que han presentado crisis comiciales. Los anticonvulsionantes no depresores del sistema nervioso central (fenitoína) son los más indicados en esta situación.
Hospitalización. Depende de la clínica del paciente. Es aconsejable un período de observación de 24 h y su revaloración.
Tratamiento específico. La elección del tratamiento específico de las metástasis cerebrales está condicionado por diversos factores:
Situación de la neoplasia. Tumor primario conocido o no (metástasis cerebrales de origen desconocido). Enfermedad neoplásica extracerebral controlada o activa.
Características de la metástasis: número, tamaño y localización.
Características del paciente: edad, estado general, patología concomitante.
La decisión terapéutica requiere una valoración multidisciplinaria. En función de todos estos parámetros optaremos por el tratamiento quirúrgico (exéresis de la lesión/lesiones), la irradiación holocraneal, la radiocirugía (administración de altas dosis de radioterapia en un campo reducido), la quimioterapia, o tratamiento exclusivamente sintomático (situaciones muy avanzadas) (fig. 2).
Fig. 2. Metástasis cerebrales de origen pulmonar con edema cerebral secundario.
Hipercalcemia
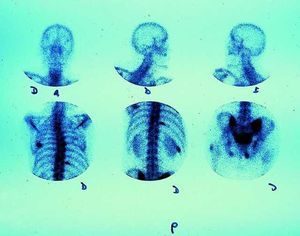
La hipercalcemia tumoral (> 10,4 mg/dl o > 2,6 mmol/l) constituye la complicación metabólica más frecuente en los pacientes con cáncer, seguida con menor frecuencia de la hipoglucemia y de la insuficiencia suprarrenal. Su etiopatogenia no está totalmente esclarecida, y parecen participar distintos mecanismos: incremento de la reabsorción ósea a través de la producción ectópica o hi perproducción de sustancias activas como péptidos PTH-like; afección directa del hueso por el proceso neoplásico; producción de prostaglandinas por las células neoplásicas, etc. Los tumores sólidos más frecuentemente asociados a hipercalcemia son el carcinoma de mama (50%), generalmente con afección metastásica ósea, el carcinoma escamoso de pulmón, el cáncer de riñón y, con menor frecuencia, los tumores de tiroides, ovario, colon, cabeza y cuello y esófago. Las hemopatías malignas también son causa de hipercalcemia, principalmente el mieloma múltiple (fig. 3).
Fig. 3. Gammagrafía ósea con múltiples lesiones hipercaptantes sugestivas de metástasis óseas.
Clínica
Las manifestaciones clínicas más habituales son las alteraciones digestivas (náuseas, vómitos, estreñimiento y dolor abdominal), los síntomas neuromusculares (apatía, laxitud, depresión, fatiga, letargia y coma), los renales (poliuria y nicturia) y los cardiovasculares (arritmias). A medida que el proceso avanza, la función renal puede agravarse, favorecida por los vómitos y la poliuria, y ocasionar acidosis y fallo renal agudo.
Ante la sospecha clínica, la confirmación diagnóstica nos la dará la determinación analítica del calcio iónico en sangre. Normalmente se determina la cifra global (iónico + ligado a proteínas) por lo que deberemos aplicar una corrección para obtener la cifra real:
Ca sérico ajustado = Ca (mg/dl) Alb (g/l) + 4
Ca sérico ajustado = Ca (mmol/l) Alb (g/dl) * 0,25 + 1
Tratamiento
El tratamiento variará en función de la gravedad del cuadro e irá dirigido a la corrección de la hipercalcemia y al control del tumor. Ante cifras superiores a 12,5 mg/dl es aconsejable la hospitalización del paciente.
El tratamiento específico de la hipercalcemia consistirá en lo siguiente:
Dieta pobre en calcio (evitar lácteos y derivados).
Hidratación. Aporte de líquidos para restablecer el volumen intravascular y mejorar la función renal. La hidratación por vía oral e intravenosa con suero fisiológico, ajustada a la situación de cada paciente, constituye una parte fundamental del tratamiento.
Diuréticos. Se emplearán diuréticos del tipo de la furosemida, que aumentan la eliminación renal de calcio, a dosis de 20-60 mg/día. Los diuréticos tiacídicos están contraindicados.
Corticoides. Su eficacia es cuestionable. Puede administrarse prednisona a dosis de 40 mg a 120 mg/día.
Bifosfonatos. Es el tratamiento básico en pacientes sintomáticos y/o con hipercalcemia grave.
Clodronato. La dosis diaria es de 5 mg/kg. Se administra diluido en 500 cm3 de suero fisiológico en infusión de 3 h cada 24 h, durante 5 días, con controles diarios de la calcemia. Tras la corrección de las cifras de calcio se mantendrá una pauta oral de 2 cápsulas cada 12 h.
Pamidronato. Dosis única de una ampolla de 90 mg diluida en 500 cm3 de suero fisiológico, en infusión de 2 h. No se dispone de preparados para su administración por vía oral. El paciente debe ser controlado periódicamente pudiendo requerir nuevas infusiones, habitualmente cada 3-4 semanas.
Urgencias relacionadas con los tratamientos oncológicos
Emesis posquimioterapia
Las principales causas de emesis en el paciente con cáncer son: quimioterapia; radioterapia en campos que engloban estómago y/o intestino delgado; íleo paralítico de origen farmacológico (opiáceos) o metabólico (hipercalcemia); oclusión o suboclusión intestinal (neoplasias del tracto digestivo, bridas); hipertensión intracraneal; gastropatía por AINE, etc.
Diagnóstico
Anamnesis. Valorar si el paciente está recibiendo tratamiento quimioterápico. Los vómitos posquimioterapia aparecen en las primeras 24 h tras el tratamiento y, ocasionalmente, a las 48-72 h, sobre todo en regímenes que incluyen cisplatino. En casos de vómitos persistentes deben descartarse otras causas (bridas, ingesta de AINE y/o opiáceos, causas metabólicas).
Exploración física. Con especial atención a la presencia de signos de deshidratación y a la exploración del abdomen.
Analítica. Hemograma, ionograma, calcemia, urea, creatinina y equilibrio venoso.
Radiografías de tórax y abdomen.
Tratamiento
Medidas generales
Reposo intestinal (dieta absoluta). La dieta se reiniciará de forma progresiva de líquidos a sólidos, según la tolerancia.
Hidratación. Se recomienda un aporte de 2.000 cm3/día, aumentándolo si existen pérdidas adicionales o aparecen signos de deshidratación, y ajustándolo también según la edad, el peso, la diuresis y los resultados del ionograma.
Administración por vía intravenosa del tratamiento habitual del paciente hasta que se observe una buena tolerancia oral, con especial atención en la correcta administración del tratamiento analgésico.
Tratamiento específico de la emesis inducida por quimioterapia y/o radioterapia:
Ondansetrón: 0,15 mg/kg i.v. cada 8 h (12 mg cada 8 h en los individuos de más de 60 kg, y 8 mg cada 8 h en los de menos peso). La principal indicación es el tratamiento de la emesis aguda posquimioterapia (primeras 24 h).
Metoclopramida a dosis de 10-30 mg/6 h i.v., principalmente indicado en el tratamiento de la emesis retardada (24 h después de la administración de la quimio terapia).
Dexametasona 4 mg/8-12 h i.v. (después del antiemético).
Loracepán: medio o un comprimido cada 8-12 h.
Una vez controlado el cuadro agudo se recomienda una pauta oral a las mismas dosis durante 48-72 h. El paciente no debe ser dado de alta hasta que se haya comprobado durante un período adecuado que tolera la ingesta y la medicación por vía oral; en caso contrario, deberá plantearse su hospitalización.
Mucositis oral y esofágica
Etiología
Quimioterapia. Los citostáticos que producen con más frecuencia toxicidad en las mucosas son el 5-fluorouracilo, el metotrexato y la adriamicina, entre otros.
Radioterapia en tumores de cabeza y cuello, pulmón y esófago.
Diagnóstico
Anamnesis y exploración física. Permite establecer los criterios de gravedad (tabla 4).
Analítica: hemograma, pruebas de coagulación, ionograma, proteínas totales, creatinina, equilibrio venoso.
Radiografías de tórax y abdomen.
Tratamiento
Mucositis grado 1-2. No requiere la hospitalización del paciente. Se recomienda la realización de gargarismos con bicarbonato sódico y con agua de tomillo cada
6-8h. En la mucositis grado 2 asociaremos enjuagues con nistatina cada 6 h como profilaxis de la candidiasis oral.
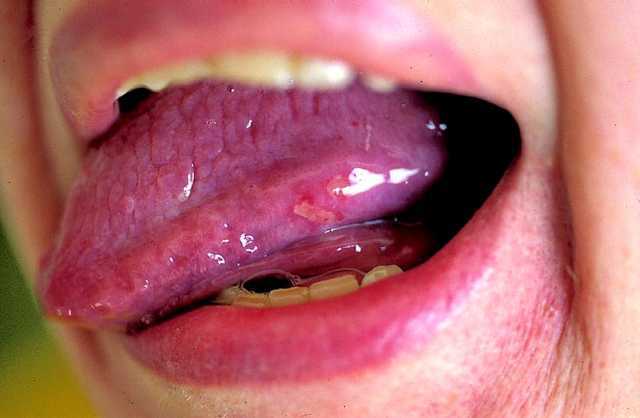
Mucositis grado 3-4. Son cuadros graves que suelen requerir la hospitalización del paciente, principalmente en aquellos casos con imposibilidad absoluta de la in gesta o con signos de deshidratación y/o desnutrición. Durante el ingreso, el tratamiento consistirá en:
Reposo gastrointestinal y posterior introducción de una dieta progresiva.
Hidratación y corrección de las posibles diselectrolitemias (v. pauta de tratamiento de la emesis).
Analgesia. La mucositis oral y la esofagitis son cuadros extremadamente dolorosos, sobre todo durante la ingesta o incluso sólo por el contacto con la saliva. Pueden requerir la prescripción de morfina para su control. La utilización de anestésicos tópicos (enjuagues con lidocaína al 2% cada 4 h) suele aliviar la sintomatología.
Cuidados de la cavidad oral. Enjuagues con bicarbonato, agua de tomillo y nistatina cada 6 h. En pacientes con muguet oral y granulopenia grado 3-4 (< 1.000 neutrófilos), además del tratamiento local, se administrará tratamiento antifúngico parenteral. Si identificamos lesiones herpéticas pautaremos aciclovir por vía oral o intravenosa. En pacientes sin evidencia de muguet oral o candidiasis esofágica, la corticoterapia puede acelerar la resolución del cuadro.
Protección gástrica. Se recomienda la administración de ranitidina u omeprazol i.v. (fig. 4).
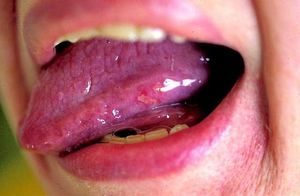
Fig. 4. Mucositis grado 2.
Fiebre neutropénica
Se define por la constatación de una temperatura oral mayor o igual a 38,3°C o por dos determinaciones iguales o superiores a 38°C, separadas entre sí al menos una hora, junto a una neutropenia intensa (recuento de neutrófilos inferior a 500/µl [toxicidad grado 4]) (tabla 5). Es importante tener presente que aunque la infección es la causa principal de fiebre en el paciente con cáncer, en un 30% de los casos la fiebre responderá a otras causas: citostáticos (bleomicina), administración de hemoderivados, antibióticos (anfotericina B), necrosis tumoral, tromboflebitis, etc.
Diagnóstico
Anamnesis. En la neutropenia febril es frecuente la ausencia de signos y síntomas de infección debido a una correcta respuesta inflamatoria inadecuada. El paciente suele presentar únicamente fiebre.
Exploración física. Con especial atención a las mucosas oral y anal.
Hemograma, coagulación y bioquímica.
Sedimento urinario. Urocultivo, aun en presencia de sedimento no patológico.
Hemocultivos. De sangre periférica y de catéter central, si lo hay.
Cultivo de la punta del catéter.
Cultivos de zonas sospechosas.
Radiografías de tórax y abdomen.
Tratamiento
En la elección de la pauta antibiótica debemos valorar aspectos como la situación clínica del paciente (neutropenia febril de alto/bajo riesgo), la existencia de un foco infeccioso, y la prevalencia y susceptibilidad de los gérmenes de cada hospital. Las principales opciones terapéuticas son:
Tratamiento de elección. Asociación de un fármaco betalactámico antiseudomónico y un aminoglicósido. La ventaja de esta combinación es su acción sinérgica frente a los bacilos gramnegativos, disminuyendo el riesgo de resistencias cruzadas. Su principal desventaja es la nefrotoxicidad, a tener en cuenta en pacientes monorrenos, en tratamiento con cisplatino, o con obstrucción de la vía urinaria.
Pacientes con fiebre neutropénica de bajo riesgo. Posibilidad de monoterapia con una cefalosporina de cuarta generación: cefepime 2 g/8 h i.v. Consideramos pacientes de bajo riesgo aquellos que cumplen todos los criterios siguientes: buen estado general; ausencia de una patología de base de riesgo (broncopatía, diabetes mellitus) y, por último, ausencia de un foco clínico aparente de la fiebre.
Pacientes con alta sospecha de infección por organismos grampositivos (mucositis grave, infección de catéter, etc.). Indicaremos de inicio tratamiento combinado con un aminoglicósido, una cefalosporina de tercera generación y teicoplanina.
El seguimiento de estos pacientes requiere la realización diaria de un hemograma con recuento leucocitario y del ajuste de la medicación en función del resultado de los cultivos practicados. La indicación de tratamiento con factores de crecimiento hematopoyético (G-CSF o GM-CSF) debe valorarse individualmente. No se consideran un tratamiento estándar y únicamente están indicados en pacientes con fiebre neutropénicas complicadas (infecciones graves, inestabilidad hemodinámica, neutropenias muy agudas y prolongadas).
Otras urgencias asociadas con frecuencia a las neoplasias
Las infecciones son una complicación frecuente en los pacientes con cáncer. En este tipo de pacientes, además del tratamiento citostático, existen otras causas que predisponen a las infecciones, entre ellas cabe destacar las siguientes:
La alteración de la barrera cutaneomucosa, debida al propio tumor, al empleo de técnicas diagnósticas y terapéuticas invasivas, al uso creciente de catéteres centrales, etc.
La alteración de la producción y la cinética granulocitaria, no s& oacute;lo por la administración de tratamientos
citostáticos sino también por otros, como la corticoterapia prolongada.
Los déficit nutricionales presentes con frecuencia en esta población, que condicionan una alteración en la fagocitosis, en el funcionalismo linfocitario y en la movilidad de los macrófagos, favoreciendo el desarrollo de infecciones.
La neumonía es la complicación infecciosa específica más frecuente y la que conlleva una mayor morbimortalidad. Otros procesos de menor frecuencia son las infecciones asociadas a catéter, la colitis seudomembranosa y las infecciones fúngicas, principalmente por Candida spp.
Desde el siglo pasado es bien conocida la asociación entre trombosis venosa y cáncer (síndrome de Trous-
seau). Los mecanismos etiopatogénicos que intervienen en esta asociación son varios: situación de hipercoagulabilidad favorecida por la presencia de células tumorales en el torrente sanguíneo, la lesión del endotelio vascular por el propio tumor, y la situación de estasis circulatoria, entre otros. El tratamiento de esta complicación comprende, por una parte, el propio de la trombosis y, por otra, el tratamiento específico del tumor.
Urgencias independientes del tumor y del tratamiento oncológico
Es importante recordar que el paciente oncológico, además de estar predispuesto a una patología específica, puede presentar procesos no relacionados con el tumor ni con su tratamiento. Por ello, es fundamental no atribuir directamente cualquier síntoma al proceso tumoral y realizar una amplia y correcta valoración médica.
Bibliografía general
Chanock SJ, Pizzo PA. Fever in the neutropenic host. Infect Dis Clin North Am 1996; 10: 777-796.
Escalante CP. Management of superior vena cava syndrome. Oncology 1993; 7: 61-68.
Hathorn JW, Lyke K. Empirical treatment of febril neutropenia: Evolution of current therapeutic approaches. Clin Infect Dis 1997; 24 (Supl 2): 256-265.
Perrin RG. Metastatic tumors of the axial spine. Curr Opin Oncol 1992; 4: 525-532.
Theriault RL. Hypercalcemia of malignancy: pathophysiology and implications for treatment. Oncology 1993; 7: 47-50.
Wilson JKV, Fidias P, Vaickus L et al. Neurologic emergencies in the cancer patient. Semin Oncol 1989; 16: 490-503.
Yahalom J, Delaney TF, Oldfield EH, Warrel RP. Oncologic emergencies. En: De Vita VT, Hellman S, Rosenberg SA, editores. Cancer: principles and practice of oncology. Filadelfia: Lippincott, 1993; 2111-2141.