Actualmente, son muchas las mujeres que ven reducido su potencial reproductivo. Por un lado, los cambios socioculturales han conducido a postergar la maternidad con los consecuentes efectos negativos que la edad avanzada despliega sobre la reserva ovárica. Por otro, el incremento en la incidencia del cáncer, junto con los numerosos avances conseguidos en las terapias antineoplásicas, han permitido la supervivencia de muchas de las pacientes oncológicas. Como consecuencia de ello, muchas mujeres muestran dificultades a la hora de llevar a cabo sus planes reproductivos. A este porcentaje de la población femenina, se le suman aquellas que, por diversos motivos, experimentan una menopausia precoz. De esta forma, se establece un nuevo foco clínico cuyo punto en común reside en la presencia de una reserva ovárica disminuida que, por lo tanto, no responde de manera adecuada a la estimulación hormonal. Por este motivo, y tras demostrar la existencia de una reserva ovárica residual susceptible de ser recuperada, se están desarrollando nuevos protocolos de rejuvenecimiento ovárico enfocados en la recuperación de aquellos folículos durmientes. Debido a esta alteración de la función ovárica y a la baja reserva folicular de estas pacientes, la aplicación de las actuales estrategias para la preservación de la fertilidad no resulta eficiente. Por ello, se han desarrollado técnicas de activación folicular in vitro e infusión de células madre derivadas de la médula ósea como nuevas alternativas para mejorar el desarrollo folicular en este tipo de pacientes.
Currently, many women see their reproductive potential reduced. On the one hand, socio-cultural changes have led to the postponement of motherhood with the consequent negative effects that advanced age has on the ovarian reserve. On the other hand, the increase in the incidence of cancer together with the numerous advances made in antineoplastic therapies have allowed many of the oncological patients to survive. As a result, many women show difficulties in carrying out their reproductive plans. In addition to this percentage of the female population, there are those who, for various reasons, experience early menopause. In this way, a new clinical focus is established whose common point lies in the presence of a diminished ovarian reserve which, therefore, does not respond adequately to hormonal stimulation. For this reason, and after demonstrating the existence of a residual ovarian reserve that can be recovered, new ovarian rejuvenation protocols are being developed that focus on the recovery of those sleeping follicles. Due to this alteration in ovarian function and the low follicular reserve of these patients, the application of current strategies for the preservation of fertility is not efficient. Therefore, in vitro follicular activation techniques and infusion of bone marrow-derived stem cells have been developed as new alternatives to improve follicular development in this type of patient.
A día de hoy, la incidencia de la infertilidad se ha incrementado respecto a años anteriores. Los cambios socioculturales instaurados en la sociedad actual han conducido a las mujeres a postergar su maternidad, hecho que dificulta la consecución del embarazo debido a los innumerables efectos negativos que la edad avanzada tiene sobre las células germinales y, en especial, sobre los ovocitos (Argyle et al., 2016).
En la pubertad, una vez que la mujer alcanza la madurez sexual, se desencadenan una serie de mecanismos fisiológicos que preparan su organismo para futuras gestaciones, dando así comienzo al periodo de vida fértil (Zhang et al., 2014). A partir de ese momento, los folículos primordiales salen del estado de quiescencia en el que se encontraban hasta entonces, dando lugar al reclutamiento de una cohorte folicular de la cual solamente uno de ellos se hará dominante sobre el resto y proseguirá su desarrollo hasta la ovulación. Esto supone la reducción progresiva de la población folicular, hecho que da lugar al declive de la función ovárica a partir de los 35 años. Por lo tanto, a medida que la edad avanza, el ovario va envejeciendo de forma natural hasta que, finalmente, la población folicular queda reducida a una cifra por debajo de 1.000 desencadenado así, un fallo ovárico total que pone fin a la vida fértil de la mujer, momento conocido como menopausia (Richardson et al., 2014).
Sin embargo, este envejecimiento ovárico no se encuentra asociado exclusivamente a la edad. Existen determinadas situaciones en las que el declive progresivo de la reserva se ve acelerado, como es el caso de las mujeres bajas respondedoras (BR). Estas se caracterizan por presentar una respuesta ovárica inadecuada a la estimulación exógena a consecuencia de presentar una baja reserva independientemente de la edad (Beckers et al., 2002). Por otro lado, la insuficiencia ovárica prematura (POI) es otra de las situaciones que suponen una alteración de la cronología ovárica normal. Las pacientes afectas cursan con amenorrea antes de los 40 años de edad, alcanzando así la menopausia antes de lo esperado. Las causas desencadenantes de esta situación responden a varios motivos, ya sean genéticos, patologías autoinmunes, infecciones, cirugía, y causas idiopáticas sin identificar (Visser et al., 2012). Además, el POI también puede originarse como una consecuencia iatrogénica derivada de diferentes tratamientos, como ocurre en las terapias antineoplásicas utilizadas contra el cáncer. El carácter gonadotóxico de dichos tratamientos repercute negativamente sobre el potencial reproductivo de las mujeres afectas al inducir cambios irreversibles a nivel reproductor. Como consecuencia de ello, una vez superada la enfermedad, y sin el establecimiento previo de un correcto plan de preservación de la fertilidad (PF), las pacientes cursan con ciertas dificultades en la consecución de su plan reproductivo (Blumenfeld, 2012).
Los problemas de fertilidad asociados a estos tratamientos vienen subrayados por el incremento en la incidencia del cáncer de los últimos años. Cada vez son más las mujeres adolescentes y adultas en edad reproductiva que se ven afectadas sin tener cumplidos sus deseos reproductivos (Fidler et al., 2017). A esto se le suma que, gracias a la detección precoz de la enfermedad, así como a las innumerables mejoras en las terapias y tratamientos antitumorales, se ha producido un notable incremento en la supervivencia frente a estas patologías. En referencia a ello, y tomando el cáncer de mama como ejemplo al ser la neoplasia más prevalente entre la población femenina, el Observatorio del Cáncer AEEC indicó que la supervivencia de las mujeres diagnosticadas entre los años 2010-2014 abarcaba el 82,8% en España, el 89,5% en Australia y el 90,2% en Estados Unidos, cifras de las que es posible concluir que cada vez son más las pacientes diagnosticadas con cáncer que están vivas tras 5 años de haber cesado el tratamiento (Siegel et al., 2016).
Por lo tanto, teniendo en cuenta que muchas de las pacientes oncológicas no han llevado a cabo su plan reproductivo cuando tienen que someterse a una terapia que probablemente reduzca su capacidad reproductiva, es necesario el establecimiento de tratamientos seguros y eficaces que les posibiliten la consecución de su descendencia una vez cesado el tratamiento antitumoral (Bermejo et al., 2015).
El principal problema asociado a las situaciones que suponen una reducción de los folículos ováricos radica en el hecho de que, en las mujeres, la reserva ovárica queda determinada desde la vida prenatal. De esta forma, en el momento del nacimiento queda establecida una reserva de carácter limitado y no renovable que suele abarcar una cifra de aproximadamente 400.000 folículos por ovario (Richardson et al., 2014).
Actualmente, la quimioterapia (QT) y la radioterapia (RT) conforman el arsenal terapéutico más extendido contra las enfermedades oncológicas (Larsen et al., 2003). A pesar de las innumerables mejoras de dichos tratamientos que han conducido a un aumento significativo en las tasas de supervivencia, aún no se ha podido optimizar la principal desventaja que supone la utilización de dichas terapias: la gonadotoxicidad. El uso de QT o RT pueden desencadenar un estado de infertilidad transitoria o permanente que dificulta o imposibilita la consecución del embarazo, hecho que supone un grave problema para aquellas pacientes que aún no han visto resuelto su plan reproductivo (Lee et al., 2006).
La fertilidad femenina puede verse comprometida a distintos niveles como consecuencia de las terapias antitumorales, ya sea a nivel folicular, dando lugar a una reducción de la población de folículos primordiales; a nivel hormonal, desencadenando un desequilibrio en el eje hipofisario y/o intraovárico; y a nivel estructural, perjudicando a los principales órganos reproductivos como son ovarios, trompas de Falopio, útero y cérvix (Bermejo et al., 2015). Los efectos secundarios experimentados por el empleo de estas terapias van a depender de diversos aspectos a tener en cuenta, como son el tipo de cáncer, la edad y reserva ovárica de la paciente, así como la dosis, duración y tipo de tratamiento además de la zona irradiada en el caso de la RT (Muñoz et al., 2016).
A diferencia de la RT, la QT despliega sus principales efectos adversos directamente sobre el ovario, dejando en segundo plano tanto al eje hipotálamo-hipófisis como al resto de órganos reproductores. Los fármacos quimioterápicos interfieren en diversas vías intracelulares implicadas en el ciclo celular con el fin de suprimir la proliferación de las células tumorales. Sin embargo, este mecanismo de actuación no presenta especificidad por las células cancerígenas. Como consecuencia, van a verse afectados otros tipos celulares entre los que se encuentran los ovocitos y las células foliculares. Por lo tanto, estos efectos negativos sobre las partes constituyentes de los folículos ováricos se traducen en un declive en la reserva femenina (Lee et al., 2006).
El riesgo de pérdida de la fertilidad se encuentra, como ya se ha mencionado anteriormente, estrechamente relacionado con el tipo de agente utilizado. Así pues, son de mejor pronóstico aquellos que son ciclo específico, los cuales van a afectar exclusivamente a la cohorte de folículos antrales en crecimiento reclutados en cada ciclo, lo que ofrece la posibilidad de reestablecer la fertilidad una vez cesado el tratamiento. Sin embargo, aquellos agentes que actúan independientes del ciclo afectan a la población de folículos durmientes, hecho que compromete la reserva ovárica futura provocando una menopausia precoz (Barton et al., 2013).
Por otro lado, la RT se basa en la destrucción de tejido neoplásico mediante la administración de radiaciones ionizantes. Así pues, la respuesta de los diferentes tejidos a dicho tratamiento depende de la radiosensibilidad del mismo (Meirow et al., 2010). Por este motivo la radiación pélvica, la craneal y la de cuerpo total tienen mal pronóstico sobre la fertilidad, ya que tanto el ovocito humano como el hipotálamo son altamente radiosensibles. A estos efectos se le suma la capacidad de la RT de provocar daño por la dispersión ionizante fuera del campo de tratamiento. Consecuentemente, una vez finalizada la RT es posible distinguir pérdida folicular, atresia ovárica, disfunción del eje hipotalámico y afectación del aparato genital en general, pudiendo provocar fibrosis uterina y reducción de la vascularización del mismo, lo cual supondría complicaciones obstétricas futuras en caso de embarazo (Chueca et al., 2014).
Por lo tanto, las pacientes BR así como las que experimentan POI, ya sea a consecuencia de tratamientos antineoplásicos o como desencadenante de diversas situaciones, constituyen dos poblaciones susceptibles de tratamientos de reproducción asistida al presentar una reserva ovárica reducida, haciendo ineficiente la estimulación ovárica. Por este motivo, este tipo de mujeres podrían verse beneficiadas de las técnicas de rejuvenecimiento ovárico para activar aquellos folículos residuales localizados en el ovario, lo que conduciría a la salida del estado de quiescencia de los mismos permitiendo así, que la paciente se someta a un ciclo de reproducción asistida.
Estrategias actuales frente a la reducción de la fertilidadActualmente existe un amplio abanico de alternativas que permiten a la mujer postergar su maternidad. Así pues, mientras que algunas de ellas ya tienen su uso clínico bien establecido y consolidado, otras siguen considerándose de carácter experimental en vía de estudio y desarrollo. En este sentido, la diversidad de mujeres que pueden ver afectada su reserva ovárica por motivos de diversa índole hace que las estrategias a seguir sean diferentes y personalizadas. Las pacientes con baja reserva ovárica de etiología diversa requieren técnicas que favorezcan el máximo reclutamiento de ovocitos en el menor tiempo posible. Sin embargo, las candidatas a preservar tejido ovárico requieren técnicas que disminuyan la pérdida folicular del mismo y prolonguen en lo posible la vida media del reimplante ovárico. Por tanto, se hace necesaria la cooperación de un equipo multidisciplinar que valore cada caso de forma individualizada (Lee et al., 2006). Así pues, en el caso de las pacientes oncológicas es necesario una consideración especial. En estos casos, la colaboración de oncólogos, especialistas en medicina reproductiva, y el conjunto del equipo médico, permite la recomendación personalizada de diferentes métodos de preservación tras evaluar el riesgo de la fertilidad de cada paciente. Gracias a ello, es posible establecer diferentes estrategias de actuación en función de factores propios de cada mujer, como son la edad, el tipo de cáncer y tratamiento, la presencia de pareja masculina, el tiempo disponible antes de comenzar el tratamiento antineoplásico y la probabilidad de metástasis ovárica (Scarella Chamy et al., 2017).
Alternativas de carácter no experimental como opción de preservación de la fertilidad (PF)Criopreservación de ovocitos y embrionesDurante las últimas décadas, la crioconservación de embriones ha sido el principal método utilizado para solventar los problemas de infertilidad, ya que cursa con altas tasas de supervivencia, implantación y embarazo tras la descongelación de los mismos (Martínez, 2017). Sin embargo, una de las principales desventajas asociadas a dicho método es la necesidad de una pareja masculina. Esto supone un inconveniente para aquellas pacientes jóvenes o sin pareja, que se tendrían que ver obligadas a recurrir a semen de donante, además de no ser una opción viable para las pacientes adolescentes o prepúberes. Por otro lado, el almacenaje de embriones es un tema altamente controvertido. Por ello, es posible distinguir dos grupos de pacientes que se ven afectadas por la polémica asociada a dicho método de preservación: aquellas que por motivos éticos o religiosos no se muestran de acuerdo con la crioconservación de embriones; y aquellas que, a pesar de no presentar inconvenientes al respecto, dicho almacenaje no está permitido en su país de origen, de manera que el acceso a dicha opción está imposibilitado por motivos legales (McLaren y Bates, 2012).
Sin embargo, las innumerables mejoras en el campo de la criopreservación, así como la puesta a punto de la metodología de vitrificación, ha puesto de manifiesto que no existen diferencias significativas entre el uso de ovocitos frescos y vitrificados. Se ha comprobado que, en las mujeres que se someten a un ciclo de FIV, se obtienen resultados comparables en cuanto a tasas de fecundación, formación de embriones de buena calidad y gestación independientemente de la procedencia de los ovocitos (Cobo et al., 2016). Esto ha conducido a tratar la vitrificación del gameto femenino como una técnica estándar desde el año 2013 (Practice Committees of the American Society for Reproductive Medicine and the Society and Technology, 2013). Como consecuencia, esta es considerada como una mejor opción de preservación de la fertilidad frente a la crioconservación de embriones al ofrecer una mayor flexibilidad reproductiva donde no es necesaria la presencia de pareja masculina. De esta forma, se origina una alternativa viable para adolescentes y mujeres jóvenes o sin pareja, que no quieren recurrir a donantes de esperma, así como para aquellas a las que el almacenamiento de embriones les supone un problema, ya sea ético, religioso o legal (McLaren y Bates, 2012).
No obstante, ambas opciones requieren de una estimulación ovárica controlada (EOC) para la obtención de ovocitos maduros (Zafra et al., 2013). Esto genera gran polémica ya que, en los casos en los que las pacientes presentan una reserva ovárica reducida, esta estimulación resulta altamente ineficiente. Por un lado, la estimulación de las BR precisa de adaptaciones de protocolos que frecuentemente no reportan resultados fructíferos. Por otro, en las pacientes oncológicas, la EOC supondría un retraso en el inicio del tratamiento antineoplásico que muchas veces no es posible afrontar debido a la agresividad del tumor. Además, implica un incremento de estrógenos en sangre que resulta contraproducente en muchos casos como, por ejemplo, en los tumores hormonodependientes. Asimismo, otra de las desventajas a tener en cuenta es la exclusión total de las pacientes prepúberes de este plan de fertilidad. En estos casos, la estimulación hormonal resulta moral y éticamente cuestionable debido a que las pacientes no han alcanzado aún la madurez sexual (Tomasi-Cont et al., 2014).
Alternativas de carácter experimental como opción de preservación de la fertilidad (PF)A pesar de que la criopreservación de gametos y embriones sean las únicas técnicas establecidas para la PF, se han modificado diferentes protocolos que amplían el abanico de posibilidades a la hora de valorar cada caso de forma individual. Para ello se han optimizado diversas estrategias que permiten reducir el tiempo necesario para la obtención de ovocitos tras la estimulación (Turan et al., 2013) y evitar los niveles suprafisiológicos de estrógenos en sangre, ampliando así las alternativas a seguir en cada caso individualizado (Rodgers et al., 2017).
Criopreservación de corteza ovárica (CCO)La crioconservación de la corteza ovárica (CCO) y su posterior autotrasplante es, probablemente, la técnica más relevante para aquellas pacientes en las que la vitrificación de ovocitos o embriones no es una opción válida. Este es el caso de las niñas prepúberes, las pacientes en las que la EOC está contraindicada y aquellas en las que el retraso del tratamiento oncológico no es posible (Donnez y Dolmans, 2013).
La base de este procedimiento se sustenta en el hecho de que la población de folículos primordiales se encuentra localizada en la corteza ovárica. Por lo tanto, el protocolo consiste en la obtención de tejido ovárico para su posterior crioconservación mediante congelación lenta de pequeños fragmentos de corteza. A pesar de ser una técnica altamente invasiva, está ofreciendo resultados que podrían resultar óptimos ya que, al no requerir una hiperestimulación ovárica controlada, permite la obtención de un mayor número de folículos en los casos en los que las pacientes no reaccionan de forma correcta a la EOC. Además, la CCO minimiza el intervalo de tiempo necesario entre la ejecución de las técnicas de PF y el comienzo del tratamiento oncológico. Esto posibilita la intervención de forma rápida tanto del equipo médico como de los especialistas en reproducción, hecho que ofrece la posibilidad de preservar la fertilidad a una población de pacientes que anteriormente no tenían ninguna opción para salvaguardar su potencial reproductivo (Herraiz et al., 2014).
Así pues, se ha comprobado que, una vez superada la enfermedad, el reimplante de estos fragmentos permite el restablecimiento de la función ovárica y el patrón hormonal de las mujeres reinjertadas, siendo la vida media del injerto de aproximadamente 5 años en los casos de alta densidad folicular (Wallace et al., 2014). Sin embargo, a pesar de que el primer nacimiento a través de esta técnica consta del año 2004 (Donnez et al., 2004) y que actualmente son más de 86 recién nacidos vivos (RNV) gracias a la misma, aún sigue siendo considerada de carácter experimental (Jensen et al., 2017). Esto se debe a las desventajas asociadas al procedimiento, como son la alta condición invasiva, el daño causado en el tejido por isquemia, los problemas posteriores asociados a la revascularización y la probabilidad teórica de reintroducir células tumorales, condición de importancia subrayada en casos como el linfoma de Burkitt, la leucemia o las enfermedades hematológicas (Meirow et al., 2008; Rodriguez-Wallberg y Oktay, 2012).
Protección de la función ovárica nativa en los tratamientos antineoplásicosLa protección de la función ovárica nativa es una de las estrategias contempladas como método de preservación en los casos en los que la población folicular se ve en riesgo por necesidad de tratamientos anticancerígenos. Esta alternativa abarca diferentes técnicas en función del tratamiento gonadotóxico utilizado. Así pues, se distinguen la transposición ovárica y la quimioprofilaxis con análogos de la GnRH (a-GnRH) como métodos de protección frente a la RT y la QT, respectivamente. Estas presentan una menor efectividad respecto al resto de técnicas, sin embargo, a pesar de reportar resultados comprometidos, pueden ser utilizadas de manera complementaria a las ya desarrolladas (Herraiz et al., 2014).
La transposición ovárica consiste en la movilización de los ovarios fuera del campo de radiación con la intención de reducir al máximo la dosis absorbida. Los resultados obtenidos tras la utilización de dicho método son inconsistentes, a lo que se le suma las complicaciones asociadas a la técnica (Sonmezer y Oktay, 2004). A pesar de ello, se ha propuesto la combinación de la transposición ovárica junto con la CCO en la misma intervención quirúrgica con la intención de mejorar las posibilidades de embarazo (Elgindy et al., 2015).
Por otro lado, se han utilizado los a-GnRH de forma previa o simultánea a la QT, con la intención de bloquear el eje hipogonadal e inducir, así, un estado de latencia responsable de reducir el efecto citotóxico. Sin embargo, a pesar de los óptimos resultados obtenidos en el modelo murino, en humanos son altamente controvertidos. Por lo tanto, el uso de los a-GnRH debe considerarse como una alternativa complementaria a los tratamientos de PF, siendo necesario el desarrollo de estudios que comprueben realmente su eficacia (Loren et al., 2013).
Otras investigaciones han determinado la posibilidad de utilizar la melatonina como coayudante en los procesos de protección ovárica prematura. Esto se debe a que dicha molécula presenta una clara actividad oncoestática, resultado de su implicación en una serie de procesos. Además de sus acciones antiestrogénicas, la melatonina se encuentra estrechamente relacionada con la regulación del ciclo celular al presentar propiedades antiproliferativas y proapoptóticas sobre las células tumorales, a lo que se le suma su capacidad de inducir la diferenciación celular sobre la línea tumoral, dando lugar a una reducción de la agresividad y mejora del pronóstico respecto a los tumores no diferenciados. Por otro lado, tiene efecto antiangiogénico, lo que impide el abastecimiento de oxígeno y nutrientes al tumor; reduce la invasividad de las células tumorales y su adhesión a la membrana basal, lo que supone una inhibición del proceso de metástasis; presenta efectos epigenéticos ya que tiene la capacidad de regular la metilación del ADN de las células tumorales y la remodelación de las histonas; inhibe la acción de la telomerasa procurando así, acortar la vida de las células malignas; y, finalmente, presenta propiedades antioxidantes, lo que le permite actuar como adyudante de la QT y la RT al reducir la toxicidad de dichos tratamientos y sus efectos secundarios (Mediavilla et al., 2010).
Crecimiento y maduración de folículos in vitroLos resultados prometedores obtenidos tras el uso de la CCO han permitido que esta sea considerada como la técnica más relevante en los casos en los que el tiempo es un factor limitante (Donnez y Dolmans, 2013). Sin embargo, como se ha nombrado anteriormente, la posibilidad de reintroducir células cancerígenas es un factor altamente limitante del uso de dicha técnica. Con el fin de solventar estas limitaciones, actualmente existen varios enfoques experimentales que se encuentran en vías de desarrollo. Estos están focalizados en el crecimiento y maduración folicular in vitro (MIV), lo cual permite la obtención de ovocitos maduros sin necesidad de reintroducir el tejido de la paciente y sin requerir un protocolo de EOC completo. Actualmente existen 3 líneas de investigación en dicho campo: el cultivo en placa, el cultivo en corteza ovárica y el cultivo en matrices 3D (De Vos et al., 2014; Chiti et al., 2017; Laronda et al., 2017).
La maduración in vitro de ovocitos tras el cultivo clásico en placa es utilizada como medida alternativa o complementaria a las técnicas de PF comúnmente utilizadas. En estos casos el protocolo de actuación se reduce a un intervalo de 3-5 días. Tras ese periodo de tiempo se obtienen ovocitos inmaduros (MI/VG) para su posterior maduración in vitro antes o después de la vitrificación (De Vos et al., 2014). Sin embargo, a pesar de la existencia de un foco de pacientes que podrían beneficiarse de dicha técnica, tanto la falta de estandarización del protocolo como de ensayos clínicos controlados incentivan el mantenimiento del carácter experimental de la misma (Practice Committees of the American Society for Reproductive Medicine and the Society and Technology, 2013).
Por otro lado, es importante tener en cuenta que la forma tridimensional de un folículo es crítica para su supervivencia (Pangas et al., 2003). Por este motivo, son varios los grupos de investigación que actualmente trabajan en la elaboración de ovarios 3D con el fin de optimizar el cultivo folicular así como de solventar las desventajas subyacentes a la metodología de CCO (Chiti et al., 2017; Laronda et al., 2017). Cada vez son más las aportaciones que la bioingeniería ofrece a la medicina reproductiva, lo cual está ofreciendo nuevos enfoques para tratar de resolver diversas patologías y anomalías implicadas en la infertilidad femenina (Campo et al., 2017).
La elaboración de estos ovarios bioprotésicos está basada en la fabricación de moldes de hidrogel en los que se distinguen poros de diferentes diámetros encargados de formar esquinas de 30° y 60° que rodean los folículos por varios lados. Esta conformación proporciona una estructura tridimensional imprescindible para la supervivencia folicular, la cual se incrementa a medida que se establece un mayor número de contactos con el molde, originando así un nicho óptimo para el desarrollo del folículo (Laronda et al., 2017).
Los ensayos realizados con ratones han puesto de manifiesto la alta vascularización del biomolde tras el trasplante. Esto supone una reducción de los daños ocasionados por la isquemia, principal responsable de la depleción de gran parte de los folículos presentes en la corteza. Por lo tanto, el desarrollo de este tipo de ovarios bioprotésicos aumenta la vida media del implante respecto a la de los injertos tras la CCO. Este hecho podría suponer una solución a largo plazo para aquellas pacientes interesadas en preservar su fertilidad sin poner en riesgo su reserva ovárica futura (Chiti et al., 2017).
Por otro lado, el grupo de Laronda et al. (2017) han llevado a cabo ensayos experimentales con ratones en los que trasplantaban ovarios artificiales, previamente sembrados con folículos murinos aislados, en hembras esterilizadas quirúrgicamente. Tras ello, han comprobado la capacidad del molde para reimplantarse y restaurar completamente la función ovárica sin necesidad de estimulación exógena. Este hecho evidencia el restablecimiento de la regulación del eje hipotálamo-hipófisis-ovario gracias a las secreciones hormonales procedentes de los folículos en crecimiento. Finalmente, dicho grupo de investigación ha testado el correcto funcionamiento de estos órganos artificiales al determinar el nacimiento natural de crías procedentes de hembras trasplantadas sin el requerimiento de factores angiogénicos, estimulación hormonal o transferencia de embriones (Laronda et al., 2017).
Finalmente, a pesar de la falta de ensayos clínicos y las dificultades que ello supone, la bioingeniería podría establecerse como una nueva ventana en el ámbito de la medicina reproductiva. La comparación de resultados, así como la adaptación de procedimientos a la especia humana podría suponer un gran avance para el que, actualmente, aún queda mucho por conocer.
Rejuvenecimiento citoplasmáticoUno de los principales objetivos en el manejo tanto de las pacientes BR como de las pacientes con POI es el incremento de las posibilidades que dichas mujeres tienen para la consecución de un embarazo y, en última estancia, de un RNV.
Por ello, actualmente se encuentran en auge las estrategias focalizadas en la búsqueda de diferentes vías para la mejora de la calidad embrionaria. A día de hoy, son varias las técnicas en vías de desarrollo que buscan el rejuvenecimiento citoplasmático con el fin de ofrecer una correcta estructura de desarrollo. Por un lado, el grupo de Labarta et al. (2019) han realizado ensayos con mujeres diagnosticadas de infertilidad, con el objetivo de probar la efectividad de la transferencia de mitocondrias autólogas (AUGMENT). Para ello, los ovocitos obtenidos de estas pacientes se microinyectaban junto con una solución de mitocondrias de la propia paciente. Sin embargo, el análisis de los resultados durante el trascurso del estudio no elucidó una mejora en el pronóstico de estas pacientes, motivo por el que la investigación fue interrumpida.
En esta misma línea, pero con resultados mucho más alentadores, se han elaborado diferentes estudios con la finalidad de probar la eficacia de la transferencia de huso materno (MST). En los casos de mala calidad ovocitaria se ha comprobado que es posible transferir el huso meiótico de la paciente a un ovocito de donante previamente enucleado para la obtención de resultados beneficiosos. Con esto se consigue una mejora citoplasmática que se traduce en un aumento de las probabilidades de experimentar un desarrollo embrionario óptimo tras la inseminación de dicho ovocito con el esperma de la pareja (Zhang et al., 2017).
Actualmente, investigadores del centro Embryotools del grupo de Costa-Borges et al. (2018) llevan a cabo un ensayo clínico en Grecia centrado en el uso de esta técnica como opción para solucionar problemas de infertilidad y no para sortear enfermedades mitocondriales. Gracias a ello, han registrado el primer embarazo de una paciente BR tras el uso de MST, verificando así un incremento del potencial reproductivo tras la aplicación de la técnica. La ventaja principal de la misma es el mantenimiento del material genético de ambos progenitores, de forma que el 99% del ADN de la descendencia se corresponde con el de los padres biológicos. Esto ofrece la posibilidad de cumplir los planes reproductivos sin necesidad de recurrir a la ovodonación.
A pesar de la existencia de diferentes protocolos de preservación de la fertilidad, muchas de las pacientes no reciben un buen consejo acerca de las distintas opciones a las que pueden acceder, siendo los casos más claros aquellas que tienen que comenzar un tratamiento antineoplásico. Esto es así ya que, en el mecanismo de actuación frente a un caso oncológico, se prioriza la velocidad a la que comenzar el tratamiento. A esto se le suma la falta de conocimiento, tanto por parte de pacientes como del equipo médico, de las recientes y continuas mejoras que están dando lugar a un gran avance en los tratamientos de preservación. Como consecuencia se ha comprobado que, en países desarrollados, un 30-50% de las mujeres en edad reproductiva no reciben información acerca de las posibilidades de minimizar los efectos adversos de la QT y RT (Peccatori et al., 2013). De esta forma, muchas de las mujeres que superan la enfermedad y quieren llevar a cabo un plan reproductivo tienen que rechazar la opción de ser madres biológicas y pasar a un programa de ovodonación como última opción de estrategia reproductiva (Cobo et al., 2016).
Rejuvenecimiento ováricoA pesar de que existan diferentes formas de abordaje dirigidas a incrementar el potencial reproductivo de la paciente, aquellas cuyos problemas de fertilidad se encuentran asociados a una reserva ovárica deficiente siguen representando un reto clínico. Esto se debe a que las estrategias actuales se centran en el proceso de estimulación hormonal. Sin embargo, las mujeres que conforman el foco clínico de baja reserva o POI no presentan folículos susceptibles de ser estimulados (Pandian et al., 2010).
Afortunadamente, estudios recientes han demostrado la existencia de folículos residuales en el ovario de pacientes con POI. En la actualidad, existen dos líneas de investigación implicadas en el desarrollo de técnicas centralizadas en la consecución del rejuvenecimiento ovárico. Por un lado, se ha comprobado que este pool folicular residual puede activarse mediante la combinación de fragmentación del tejido ovárico y activación folicular in vitro, mientras que una segunda línea de investigación se centra en la infusión de células madre derivadas de la médula ósea. Este enfoque es de gran utilidad en mujeres cuya reserva ovárica se ve comprometida, ya que ofrece la posibilidad de rescatar un pequeño grupo de folículos presentes en el ovario de forma residual capaces de dar recién nacidos sanos (Kawamura et al., 2013; Zhai et al., 2016).
Activación folicular in vitroA día de hoy, la activación folicular in vitro es una de las técnicas que se encuentra en auge en el ámbito del rejuvenecimiento ovárico. A pesar de que los mecanismos moleculares exactos responsables de la regulación de la activación y el crecimiento folicular siguen siendo desconocidos, estudios con animales han puesto de manifiesto la participación central de dos vías intracelulares en dichos procesos respectivamente: la vía Hippo y la vía fosfoinositol-3-kinasa (PI3K) (Kawamura et al., 2013). Así pues, esta técnica de rejuvenecimiento ovárico busca interrumpir la señalización de dichas rutas moleculares con la intención de romper el estado de quiescencia de los folículos residuales. Para ello, el tejido se somete a un proceso de fragmentación ovárica que va a alterar la vía de señalización Hippo, seguida de la incubación de dichos fragmentos con inhibidores y/o activadores de los principales reguladores de la ruta PI3K.
Mecanismos moleculares asociados a la activación folicular tras la fragmentación del tejido ovárico (OFFA): vía HippoUna de las estrategias empleadas en la terapia de rejuvenecimiento ovárico se basa en el fraccionamiento de la corteza ovárica con la intención de incentivar el crecimiento folicular mediante la modificación de tensiones mecánicas (Kawamura et al., 2013). Dicho procedimiento toma como punto de referencia el hecho de que técnicas como la resección en cuña y el drilling ovárico han demostrado incrementar el crecimiento folicular en pacientes con síndrome de ovario poliquístico (Farquhar et al., 2012).
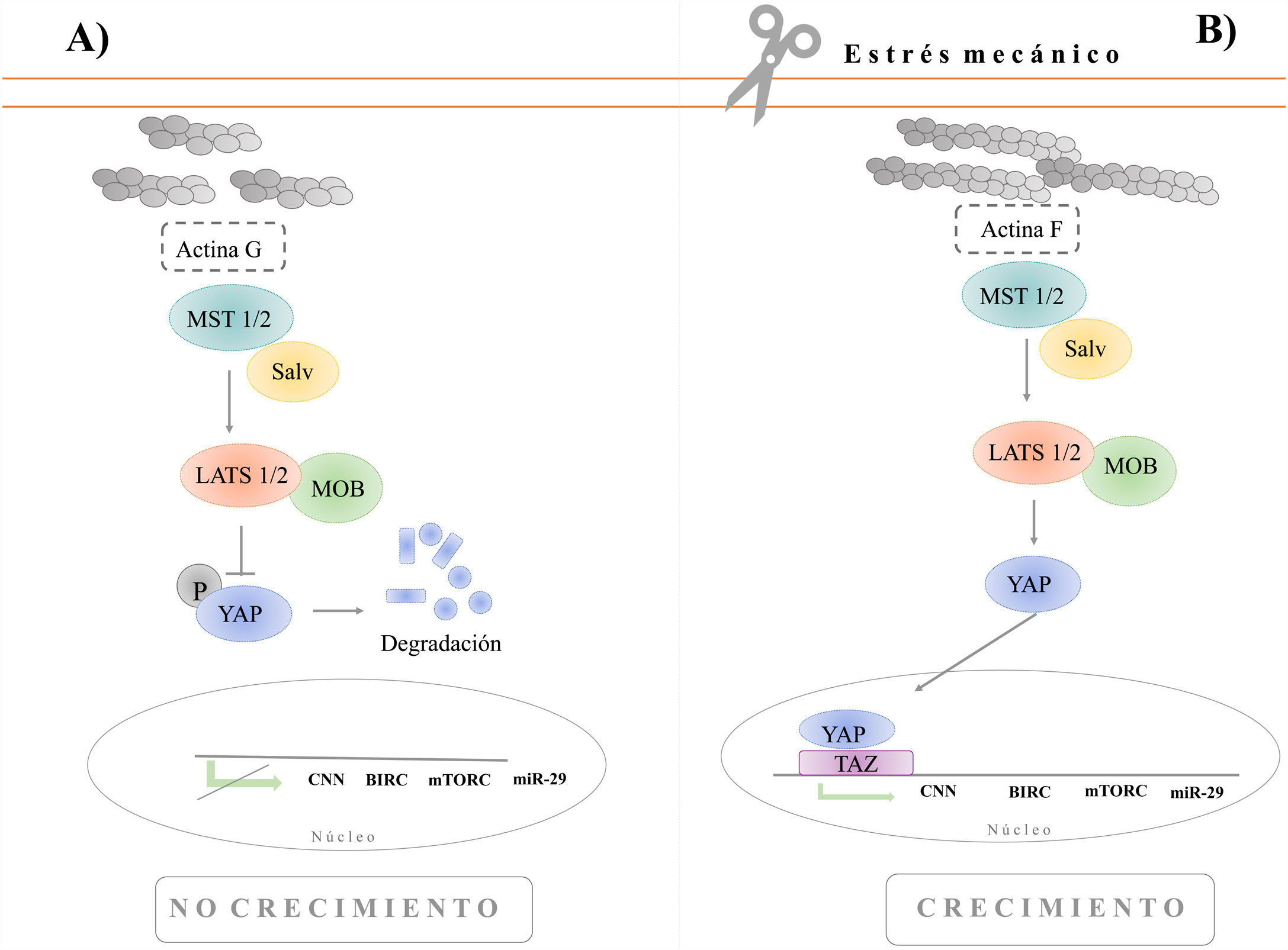
A pesar de que los mecanismos de activación folicular siguen sin estar completamente esclarecidos, se ha observado la participación crucial de determinadas rutas en dicho proceso (Adhikari y Liu, 2009). Una de ellas es la comúnmente conocida como vía Hippo, implicada en la supresión del crecimiento excesivo del tejido al actuar como regulador negativo de los procesos de proliferación y muerte celular (Varelas, 2014). En esta cascada se distingue la actuación de las proteínas quinasa MST 1/2 y LATS 1/2, el adaptador Salvador (Sav) y la proteína aglutinante MOB. La intervención en cadena de dichas moléculas supone la inhibición del coactivador transcripcional YAP como consecuencia de diversas fosforilaciones. De esta forma, YAP fosforilada queda retenida en el citoplasma, impidiendo así su translocación al núcleo. Como consecuencia de ello, se ve impedida la formación del complejo transcripcional con TAZ, su dominio de unión a PDZ, bloqueando así la transcripción de determinados factores necesarios para el crecimiento celular tales como los factores de crecimiento CNN, las proteínas antiapoptótica BIRC y mTORC así como el miR-29, inhibidor de la traducción del gen de supresión tumoral PTEN, principal inhibidor de la vía PI3K (fig. 1A) (Pan, 2007).
Mecanismo molecular de la ruta Hippo (A) y regulación impartida por los cambios en la polimerización de la actina (B). A) La proteína quinasa MST 1/2 se une a la proteína de apoyo Salvador (Sav) provocando su fosforilación. Esto promueve la activación de la siguiente proteína de la cascada de señalización conocida como LATS 1/2. Paralelamente, MST fosforila y activa a MOB, permitiendo que esta forme un complejo con LATS reforzando así su actividad. Como consecuencia de esta cascada de señalización, la proteína YAP es fosforilada, bloqueando así su translocación al núcleo e imposibilitando la transcripción de diferentes factores de crecimiento, el inhibidor de la apoptosis BIRC, el complejo mTORC y el miR-29, entre otros factores, dando lugar a una supresión del crecimiento del tejido. B) La polimerización de la actina G a actina F origina una interrupción de la vía de señalización Hippo. Esto resulta en un incremento de YAP nuclear responsable de la transcripción de diversos factores implicados en el crecimiento celular (Modificada de Richardson, 2011).
Se ha determinado el papel central que esta ruta desempeña en la activación folicular tanto en condiciones normales como en situaciones no fisiológicas. Por este motivo, se han realizado varios estudios con la intención de aclarar la regulación de la misma y poder así buscarle una aplicabilidad clínica (Kawamura et al., 2013). En lo que respecta a la regulación de la vía, esta no se encuentra asociada a la estimulación de ligandos extracelulares, sino que viene determinada por una serie de componentes relacionados con la adhesión, forma y polaridad celular (Johnson y Halder, 2014). Así pues, rápidos cambios en la polimerización de la actina que dan lugar a un decremento de la forma globular (actina G), con el consiguiente incremento de la forma filamentosa (actina F), suponen una interrupción en la señalización de la cascada. Por lo tanto, la fragmentación de la corteza ovárica propicia una alteración de las tensiones mecánicas del tejido responsables de polimerización de la actina. Este hecho promueve una hipofosforilación de YAP, estado que permite su translocación al núcleo. Gracias a ello, se establece el complejo YAP/TAZ desencadenando la transcripción de genes implicados en el desarrollo folicular (fig. 1B) (Novella-Maestre et al., 2015).
Mecanismos moleculares asociados a la activación de folículos in vitro: vía PI3KOtra de las vías vinculadas a la activación folicular es la de PI3K/Akt/FOXO3/mTORC, estrechamente relacionada con el crecimiento y la proliferación celular (Hsueh et al., 2015).
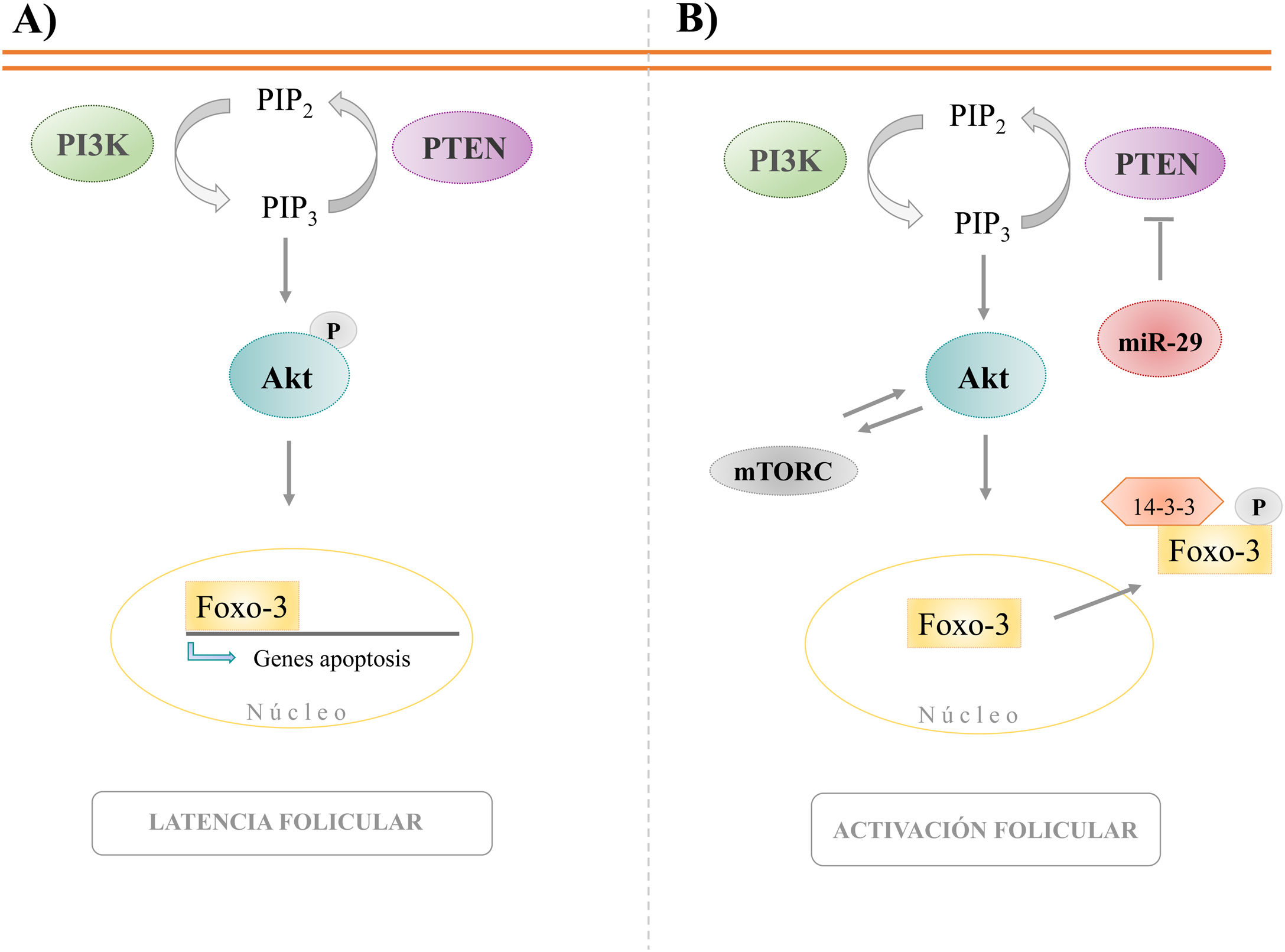
Uno de los principales reguladores de dicha vía es el gen supresor de tumores PTEN. Este codifica una enzima fosfatasa responsable de la catalización del fosfatidilinositol-3,4,5-trifosfato (PIP3) a fosfatidilinositol-4,5-bifosfato (PIP2). A razón de ello, la proteína quinasa Akt queda inactivada y, como consecuencia, FOXO3 no es extruido del núcleo (fig. 2). Por lo tanto, se establece la expresión de una serie de genes apoptóticos que van a modular la actividad de los principales reguladores del ciclo celular: p27, proteína encargada de retener las fases del ciclo celular y CDK, implicada en la transición de fases. Así pues, la expresión de FOXO3 supone un incremento de p27 con la consecuente inhibición de las CDK, dejando al tejido en un estado de latencia. Sin embargo, la inhibición del gen PTEN y, por consiguiente, la activación de AKT supone, por un lado, la inhibición de FOXO3 al promover la retención citoplasmática de dicha proteína, y por otro, la activación de factores como mTORC, implicado en el proceso de crecimiento celular al impulsar la síntesis proteica. Finalmente, este conjunto de procesos da lugar a una respuesta de activación folicular.
Implicación de la ruta PI3K en la activación folicular. A) El gen PTEN codifica una enzima fosfatasa encargada de convertir el sustrato PIP3 en PIP2 provocando así una inhibición de AKT. Esto supone la exclusión nuclear de FOXO3 con la consiguiente retención citoplasmática del mismo. Esta inhibición de FOXO impide la síntesis de diferentes genes implicados en la apoptosis, estableciéndose así una regulación negativa del crecimiento celular. B) La inhibición del gen PTEN produce una sobreactivación de la quinasa Akt, resultando en la translocación nuclear del factor de transcripción FOXO3, dando lugar a la expresión de una serie de genes implicados en la apoptosis, así como a la activación de mTORC, propiciando la activación de la síntesis proteica. La actuación conjunta de dichos procesos moleculares se traduce en la proliferación y crecimiento del tejido implicado (Modificada de Zoncu et al., 2011).
Estudios realizados en ratones knockout han demostrado que la deleción específica del gen PTEN supone la activación masiva de todos los folículos primordiales. Lo mismo ocurre tras la eliminación selectiva tanto del gen FOXO3 como TSC1/2, regulador de la proteína mTORC (Reddy et al., 2008). La eliminación de dichos genes induce la sobreexpresión de Akt y/o mTORC, propiciando así una activación masiva y precoz de los folículos primordiales que simula una situación de POI (Tanaka et al., 2012). Basado en ello, se ha conseguido incentivar la activación de folículos primordiales localizados en la corteza de forma residual, gracias a la utilización de inhibidores de PTEN y/o activadores Akt tanto en ovarios murinos como humanos (Kawamura et al., 2013; Li et al., 2010).
Aprovechando las posibles uniones funcionales establecidas entre la ruta PI3K y la vía Hippo, así como su implicación en el reclutamiento y crecimiento folicular, se ha desarrollado un protocolo de activación in vitro basado en la combinación de la fragmentación ovárica y el tratamiento con activadores PI3K/inhibidores PTEN. Para ello, la corteza previamente fragmentada para la crioconservación es seccionada en pequeños cubos tras la descongelación. Posteriormente, las fracciones del tejido son incubadas con el inhibidor PTEN Bpv (pic) y el activador Akt 740YP durante 48h. Así pues, el estímulo mecánico inducido por la sección de la corteza promueve el crecimiento de los folículos secundarios, mientras que la estimulación química con activadores e inhibidores induce la activación de los primordiales. Finalmente, el sumatorio de los resultados obtenidos debido a la coordinación de dichos procesos posibilita la recuperación de un mayor número de folículos susceptibles de ser estimulados en las pacientes con POI. Esto supondría una mejora en el pronóstico del ciclo de estimulación (Kawamura et al., 2013).
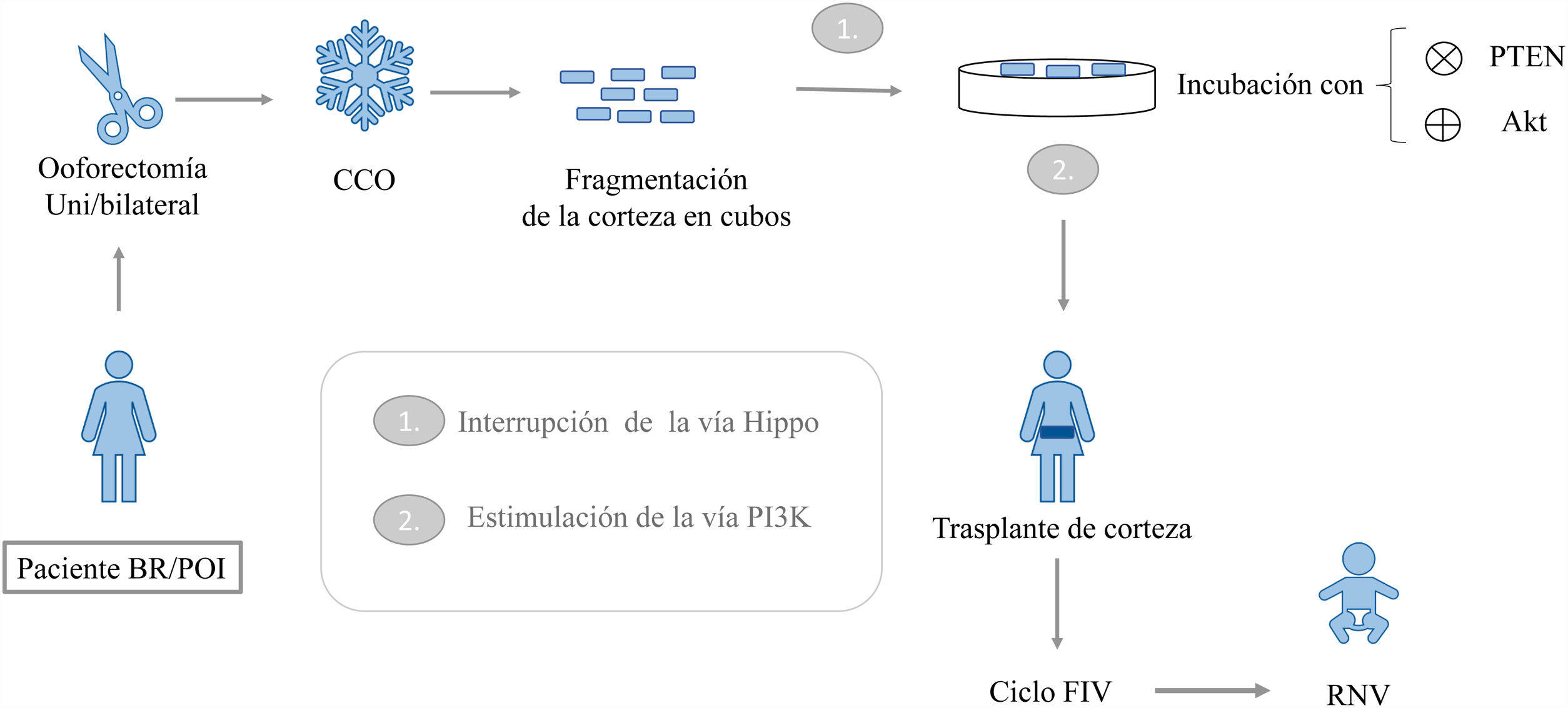
Modelos experimentalesTras evaluar la eficiencia de dicha técnica en modelos animales (Kawamura et al., 2013; Adhikari et al., 2012; Li et al., 2010), se han realizado varios ensayos clínicos dirigidos a comprobar la efectividad del tratamiento en mujeres con POI. El primer estudio que toma a estas pacientes como población de estudio es el de Kawamura et al. (2013). En él se comprobó la capacidad del proceso de activación folicular in vitro como herramienta para la obtención de ovocitos maduros. Para ello, 27 pacientes previamente diagnosticadas se sometieron a una ooforectomía uni- o bilateral con la posterior crioconservación de la corteza ovárica. Una vez descongelado el tejido, se fragmentó y se le aplicó un estímulo químico basado en la incubación de las muestras con un inhibidor de PTEN y un activador de PI3K. Posteriormente, las pacientes se sometieron a una segunda cirugía para el reimplante de los cubos de corteza bajo la serosa de las trompas de Falopio (fig. 3).
Protocolo completo de la activación folicular in vitro (Modificada de Kawamura et al., 2016).
Tras el trasplante, se siguió el crecimiento de los folículos mediante mediciones hormonales y ecografía transvaginal, de manera que se observó crecimiento folicular en 8 pacientes. En el seguimiento del desarrollo folicular, se detectó la presencia de folículos preovulatorios transcurridas unas semanas del injerto. Esto pone en evidencia el crecimiento de los folículos secundarios residuales a raíz de la alteración de la vía Hippo. Por otro lado, se localizaron folículos preovulatorios una vez transcurridos 6 meses tras el reimplante, probablemente relacionados con el tratamiento de activación in vitro. De esta forma, las pacientes a las que se les pudo activar su reserva residual fueron sometidas a un ciclo FIV. Finalmente, una de ellas quedó gestante consiguiendo dar a luz a un RNV. Este mismo grupo actualizó los resultados obtenidos en dicho estudio en el año 2014, incluyendo 10 pacientes más respecto al estudio inicial. Tras el desarrollo del mismo protocolo, reportaron dos nuevas gestaciones de las cuales una terminó en aborto y otra dio lugar a un RNV (Suzuki et al., 2015).
Motivados por los resultados obtenidos en los ensayos anteriormente nombrados, otros grupos han replicado dichos estudios con el fin de contrastar los resultados. De esta forma, Novella-Maestre et al. (2015), investigadores de la Fundación Instituto Valenciano de Infertilidad (FIVI) y el hospital la Fe de Valencia (España), han comprobado la capacidad de rescatar folículos quiescentes en pacientes oncológicas mediante los mecanismos de activación folicular in vitro. Por otro lado, Zhai et al. (2016), grupo vinculado al hospital de Zhengzhou (China), han realizado los mismos estudios con pacientes diagnosticadas con POI.
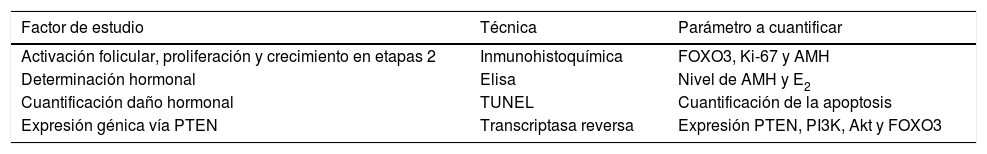
En el primer estudio, se compararon diferentes parámetros relacionados con la activación folicular. Las pruebas realizadas para la identificación del estado de los principales factores implicados en los procesos de maduración y desarrollo folicular de este estudio quedan recogidas en la tabla 1.
Factores de estudio para la valoración de la eficacia del procedimiento de activación folicular in vitro (elaboración propia, Zhai et al., 2016)
| Factor de estudio | Técnica | Parámetro a cuantificar |
|---|---|---|
| Activación folicular, proliferación y crecimiento en etapas 2 | Inmunohistoquímica | FOXO3, Ki-67 y AMH |
| Determinación hormonal | Elisa | Nivel de AMH y E2 |
| Cuantificación daño hormonal | TUNEL | Cuantificación de la apoptosis |
| Expresión génica vía PTEN | Transcriptasa reversa | Expresión PTEN, PI3K, Akt y FOXO3 |
En lo que respecta al análisis de activación y crecimiento folicular tras la aplicación del protocolo de activación folicular in vitro, se determinó un incremento en la extrusión de FOXO3 en los ovocitos activados respecto a los controles. Además, se notificó la expresión de los genes Ki-67 y AMH en las células de la granulosa (CG). Por otro lado, la determinación hormonal mediante ELISA elucidó un incremento de AMH y E2 en los folículos del grupo que había sido tratado, siendo dichos parámetros indicadores principales del desarrollo folicular.
Por otro lado, en la cuantificación del daño celular mediante TUNEL, no se distinguieron diferencias significativas entre los grupos activados y los controles, por lo que el tratamiento con inhibidores de PTEN no inducía alteraciones en el ADN de los folículos de estudio. Por último, el estudio genómico de los principales genes de la vía PI3K puso de manifiesto un incremento en el perfil de expresión de PTEN, PI3K y FOXO3 tras la aplicación de la activación folicular in vitro, siendo únicamente significativo el aumento de PTEN Y FOXO3.
Basados en los resultados obtenidos, el grupo de Novella-Maestre et al. concluyeron que el protocolo de activación folicular in vitro no solo no reduce el conjunto folicular, sino que induce el crecimiento y la activación folicular (Novella-Maestre et al., 2015). En el estudio de Zhai et al. (2016), vinculados al hospital de Zhengzhou (China), se replicó el mismo protocolo a seguir reportando resultados muy similares. Así pues, quedó testada la capacidad de la técnica para rescatar folículos quiescentes presentes en los ovarios de pacientes con POI (Kawamura et al., 2015).
Sin embargo, a pesar de que esta tecnología innovadora parece ir en buena dirección, se necesitan importantes mejoras para poder considerarla como una estrategia clínica segura y eficaz. Una de las principales preocupaciones vinculadas a dicha metodología es la posibilidad de inducir efectos cancerígenos nocivos a largo plazo como consecuencia de los químicos utilizados. Esto se debe a que los fármacos actúan sobre la ruta PI3K/Akt, la cual se encuentra estrechamente relacionada con el proceso tumoral humano (Lee y Chang, 2019). Además, un estudio realizado por McLaughlin et al. (2014) sugiere que la utilización de inhibidores PTEN puede comprometer el desarrollo del folículo en crecimiento. A día de hoy, aún no se han identificado las causas de las discrepancias en los resultados de dicho estudio respecto al resto de ensayos que conseguían reportar folículos óptimos que daban lugar a gestaciones y, finalmente, descendencia sana.
En lo que respecta a la seguridad de la técnica, no se ha informado de ningún caso de desarrollo tumoral tras la aplicación de la activación folicular in vitro. Por otro lado, es necesario destacar que aún no se han confirmado estudios que evalúen la epigenética de los embriones ni la salud de la descendencia nacida tras el desarrollo de este protocolo (Lee y Chang, 2019). Por estos motivos, es necesario ser precavidos ante la utilización de la técnica y profundizar en el desarrollo de método más seguros y eficaces para la estrategia de activación folicular in vitro.
Con base en la relación de la vía PI3K/Akt en el proceso cancerígeno, el grupo de Fabregues et al. (2018) ha sugerido la utilización de un protocolo modificado sin fármacos en los casos de pacientes con POI temprano. Estos se basan en que dichas pacientes experimentan la activación espontánea de folículos primordiales durmientes que alcanzan la fase de folículo secundario, de manera que la primera parte del protocolo correspondiente al estímulo mecánico (interrupción de la vía Hippo) sería suficiente para promover el crecimiento de estos folículos. Así pues, y siguiendo dichas directrices, el grupo llevó a cabo el protocolo en una paciente de 32 años en las condiciones anteriormente mencionadas, monitorizando la existencia de folículos maduros tras la fragmentación ovárica, que pudieron fecundarse y que, finalmente, dieron lugar a una gestación óptima. Este embarazo se encontraba en curso en el momento de publicación del artículo, siendo el primer caso de gestación tras la activación folicular in vitro sin fármacos.
Así pues, es posible concluir que es necesario el análisis individualizado de cada paciente, de manera que sea posible valorar la posibilidad de someterlas a este protocolo modificado sin comprometer los resultados esperados. De esta forma, aquellas mujeres en estadios iniciales de POI que presenten folículos secundarios residuales podrían recurrir a la activación folicular in vitro efectuando únicamente la primera parte del protocolo correspondiente a la fragmentación ovárica, excluyendo así la incubación del tejido con fármacos de los que aún no se conocen con exactitud sus efectos a largo plazo.
Finalmente, tras la realización de los ensayos clínicos citados anteriormente, se ha estimado que, a pesar de las innumerables mejoras requeridas, son más de 10 RNV tras la aplicación de la técnica (Lee y Chang, 2019). Esto sugiere que, aún siendo necesaria la optimización del método, la activación de folículos in vitro puede ser una posibilidad válida para una población de mujeres que, anteriormente, se hubieran visto obligadas a recurrir a la donación de ovocitos rechazando la posibilidad de tener descendencia biológica.
Trasplante autólogo de células madre en el ovarioPor otro lado, se ha puesto de manifiesto que en pacientes con POI inducido a consecuencia de tratamientos oncológicos, el trasplante de médula ósea parece tener un efecto positivo sobre el ovario. Así pues, se ha reportado que mujeres tratadas con QT y RT, a las que posteriormente se les trasplantó células madre derivadas de la médula ósea (BMDSC), conseguían gestaciones espontáneas a pesar de haber cursado con amenorrea tiempo antes del trasplante (Salooja et al., 2001; Veitia et al., 2007). Este hecho parece estar relacionado con la capacidad del nicho ovárico para atraer células indiferenciadas de otros órganos, específicamente de la médula ósea, en un proceso conocido como homing. Gracias al mismo, se hace posible la restauración de la estructura y funcionalidad del ovario (Liu et al., 2014).
La importancia del nicho ovárico queda constatada bajo el estudio realizado por Niikura et al. (2009) en el que comprobaron que, al exponer tejido ovárico viejo en un entorno joven, se incrementaba el número de folículos. Con base en ello, el grupo de investigación de Herraiz et al. (2018a,b) ha desarrollado diversos estudios con el fin de evaluar el efecto regenerativo del trasplante de células madre en ovarios con una reserva ovárica reducida. La intención principal del estudio es la de valorar la eficacia de dicho procedimiento como estrategia terapéutica para regenerar el nicho ovárico en pacientes con POI o BR.
Para ello trabajaron con la subpoblación celular CD133+ de las BMDSC, caracterizadas por ser las más inmaduras dentro de las células madre hematopoyéticas (Peichev et al., 2000), las cuales, además, presentan propiedades regenerativas al promover la proliferación celular y neoangiogénesis (Cervello et al., 2015).
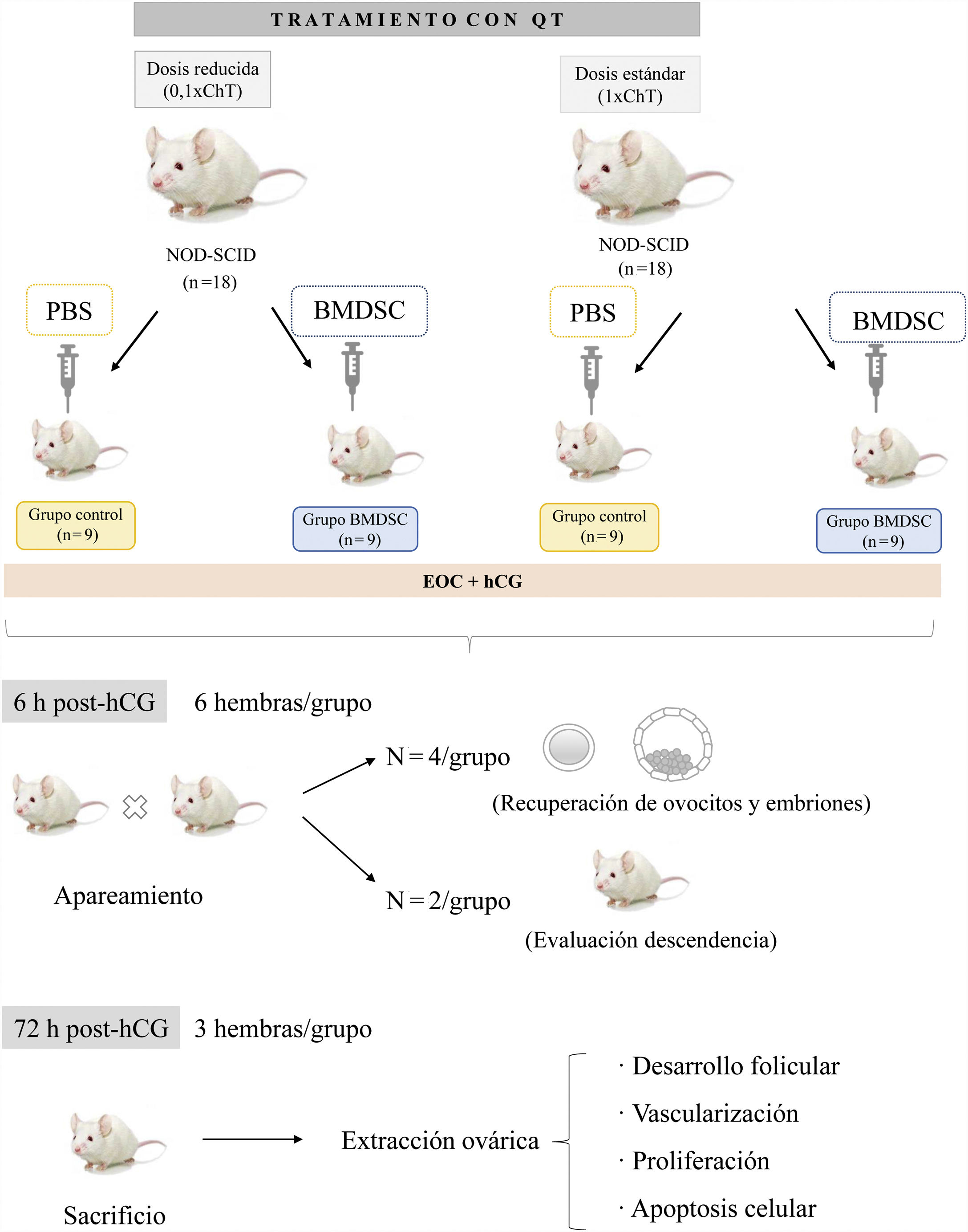
Modelo animalPara el desarrollo del estudio, Herraiz et al. (2018a) tomaron como sujeto de trabajo una población de 36 ratones hembras NOD-SCID a la que indujeron daños en la función ovárica mediante tratamientos quimioterápicos. Para ello se distinguieron dos grupos (fig. 4): uno al que administraron una dosis reducida de QT (0,1×ChT) para simular una situación de BR (N=18), y otro al que trataron con una dosis estándar (1×ChT) responsable de provocar un estado de esterilidad completa similar a la situación de las pacientes con POI (N=18). Posteriormente, cada uno de ellos se subdividió en un grupo control (n=9) al que se le inyectó solución salina (PBS) y un grupo de estudio (n=9) al que se trató con BMDSC obtenidas de pacientes BR mediante aféresis tras su movilización con el factor estimulante de granulocitos (G-CSF). Una vez realizado dicho proceso, se monitorizó el ciclo estral y el peso de los ratones a lo largo de todo el experimento. Seguidamente, los ratones fueron sometidos a EOC. Una vez transcurrido el tiempo necesario tras la administración de la hCG, se permitió el apareamiento de 6 hembras de cada grupo con machos fértiles (fig. 4). Cuatro de esas hembras se sacrificaron 48h después del apareamiento. Tras ello, se recuperaron tanto ovocitos como embriones con la intención de evaluar así la tasa de ovulación y fecundación. Las 2 hembras restantes llegaron a término con las gestaciones, lo cual permitió estudiar las características de la descendencia. Por otro lado, las 3 hembras de cada grupo que no se aparearon se sacrificaron 72h post-hCG para la recuperación de los ovarios. Una vez ovariectomizadas, se analizó el desarrollo folicular, la vascularización, proliferación y apoptosis celular.
Diseño experimental para la evaluación de los efectos regenerativos de BMDSC en un modelo murino al que previamente se le ha inducido daño ovárico mediante QT (Modificada de Herraiz et al., 2018a).
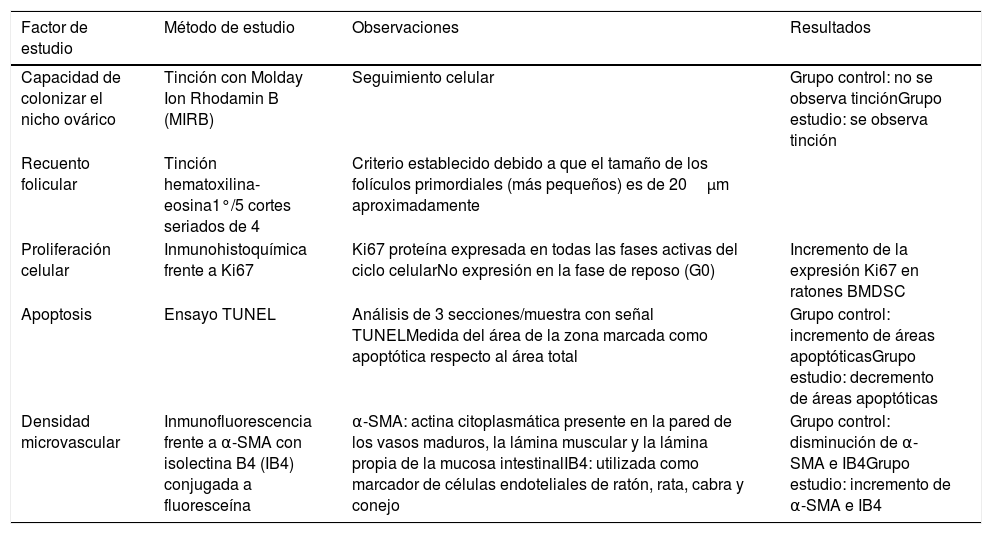
Para el análisis de los parámetros anteriormente citados, se realizaron una batería de pruebas a partir de las cuales se contrastaron los resultados obtenidos de los grupos controles y los grupos BMSDC. En la tabla 2 se recoge la asociación factor-método de estudio, así como los resultados obtenidos en cada uno de ellos.
Pruebas realizadas en las muestras obtenidas en los grupos control y BMDSC tras la administración del tratamiento con células madre (elaboración propia, Herraiz et al., 2018a)
| Factor de estudio | Método de estudio | Observaciones | Resultados |
|---|---|---|---|
| Capacidad de colonizar el nicho ovárico | Tinción con Molday Ion Rhodamin B (MIRB) | Seguimiento celular | Grupo control: no se observa tinciónGrupo estudio: se observa tinción |
| Recuento folicular | Tinción hematoxilina-eosina1°/5 cortes seriados de 4 | Criterio establecido debido a que el tamaño de los folículos primordiales (más pequeños) es de 20μm aproximadamente | |
| Proliferación celular | Inmunohistoquímica frente a Ki67 | Ki67 proteína expresada en todas las fases activas del ciclo celularNo expresión en la fase de reposo (G0) | Incremento de la expresión Ki67 en ratones BMDSC |
| Apoptosis | Ensayo TUNEL | Análisis de 3 secciones/muestra con señal TUNELMedida del área de la zona marcada como apoptótica respecto al área total | Grupo control: incremento de áreas apoptóticasGrupo estudio: decremento de áreas apoptóticas |
| Densidad microvascular | Inmunofluorescencia frente a α-SMA con isolectina B4 (IB4) conjugada a fluoresceína | α-SMA: actina citoplasmática presente en la pared de los vasos maduros, la lámina muscular y la lámina propia de la mucosa intestinalIB4: utilizada como marcador de células endoteliales de ratón, rata, cabra y conejo | Grupo control: disminución de α-SMA e IB4Grupo estudio: incremento de α-SMA e IB4 |
Tras el análisis de los resultados se comprobaron los efectos regenerativos de las BMDSC sobre el nicho ovárico y el crecimiento folicular en los modelos que simulaban las situaciones clínicas de POI y BR. Se comprobó la capacidad de las BMDSC para alcanzar el nicho ovárico mediante una tinción con MIRB. Se observó como dicho marcaje no se distinguió en el grupo control, pero sí en las células de la teca de las zonas próximas a los vasos del grupo sometido al tratamiento. Esta colonización del nicho se relacionó con los cambios experimentados en la densidad de las poblaciones foliculares. En comparación con los controles, los ratones tratados sufrieron un incremento de folículos antrales, preovulatorios y cuerpos lúteos, siendo el estadio preovulatorio el único estadísticamente significativo. La modificación de dichos parámetros se correlacionó con el desarrollo de una red de microvasos al producirse mejoras en la vascularización tras la insuflación de células madre, las cuales fueron altamente significativas en el grupo murino al que se le indujo daño ovárico severo.
Se estableció un nexo entre el aumento de la perfusión sanguínea y los cambios experimentados en las poblaciones foliculares. En comparación con los controles, los ratones tratados sufrieron un incremento en el número de folículos antrales, preovulatorios y cuerpos lúteos, siendo el estadio preovulatorio el único estadísticamente significativo. Esto podría verse relacionado con la mejora de la perfusión sanguínea al producirse una mejora en el intercambio de moléculas necesarias para el crecimiento folicular, tales como factores de crecimiento u hormonas. Esta mejora en el desarrollo folicular se vinculó, además, a la capacidad de las BMDSC para inducir la proliferación celular e inhibir la apoptosis, mejorando así la viabilidad del estroma ovárico. Esta recuperación del tejido se relacionó, en última instancia, con los cambios observados en el peso de los ovarios, distinguiendo un aumento considerable en los ratones tratados respecto a los controles.
En lo que respecta al perfil hormonal, la utilización de agentes quimioterapéuticos supuso una alteración en las fases del ciclo estral. Sin embargo, una vez aplicado el tratamiento se comprobó una recuperación de la ciclicidad en el 75% de los ratones en ambas dosis de QT, recuperación que no se hizo vigente en los casos controles. Esto pone de manifiesto la restauración de la función ovárica y por lo tanto de la secreción hormonal promovida por las BMDSC.
Asimismo, se comprobaron los efectos de las BMDSC sobre la maduración ovocitaria, ovulación y desarrollo embrionario, siendo este uno de los resultados de mayor interés. De forma previa al tratamiento, los ratones de estudio mostraban un grave deterioro del estado reproductivo. Tras el tratamiento, se determinó que la infusión de BMSCD aumentaba el número total de ovocitos MII en todos los grupos, siendo especialmente significativo en el modelo POI. De esta forma fue posible recuperar ovocitos residuales no dañados incluso en la situación altamente gonadotóxica. Esto permitió la recuperación de un mayor número de embriones tras el apareamiento en contraposición con los obtenidos en el modelo control. Una vez realizado el análisis de los mismos se constató que, el grupo control mostraba un mayor índice de fragmentación y una morfología de peor calidad respecto a los grupos tratados.
Como punto final al estudio, se concluyó que el tratamiento mejoró la tasa de fecundación, consiguiendo que el 50% de las hembras quedaran gestantes. Además, el análisis de la descendencia puso de manifiesto una tendencia hacia un mayor tamaño de las camadas, las cuales se mostraban con aspecto y morfología normal. Esta primera parte del estudio de Herraiz et al. (2018a) evidencia la batería de ventajas que el tratamiento con BMDSC despliega sobre los ovarios dañados, concluyendo, por lo tanto, la capacidad de dichas células para mejorar el nicho ovárico. Por este motivo, el grupo de investigación profundizó, en la segunda parte del estudio, en la aplicabilidad de dicha técnica en mujeres BR, posibilitando así, la generación de una nueva alternativa clínica para aquellas mujeres que se ven en una situación de daño ovárico.
A raíz de ahí, elaboraron un segundo experimento basado en el xenotrasplante del tejido ovárico de pacientes BR en ratones NOD/SCID previamente ovariectomizados. Para ello replicaron cada etapa del estudio explicado anteriormente, omitiendo la inducción de daño ovárico por QT. Gracias a dicho experimento, fue posible valorar el efecto de las células BMDSC en los folículos humanos, hecho que suprime las desventajas asociadas a las diferencias interespecíficas del modelo murino. Tras el análisis y procesamiento de las diferentes pruebas, se obtuvieron resultados semejantes al estudio anterior. Consecuentemente se determinó que, en el tejido ovárico humano, la infusión de células madre inducía la vascularización ovárica, la proliferación celular y la secreción de E2. Se comprobó que el cómputo global de dichos resultados se traducía en la promoción del crecimiento de los folículos y, por lo tanto, en la movilización de la reserva ovárica residual.
Ensayo clínico en pacientes con POIAlentados por los resultados obtenidos tras el tratamiento con BMDSC tanto en el modelo animal como en el del xenoinjerto de corteza humana en ratones, Herraiz et al. (2018b) realizaron un estudio piloto de carácter prospectivo observacional, en el Hospital Universitario de la Fe en Valencia (España). Este ensayo tenía como objetivo comprobar el efecto positivo de dicho tratamiento en pacientes BR. Para ello se llevó a cabo el trasplante autólogo de células madre en el ovario (ASCOT) de 17 pacientes BR. Para la obtención de estas células, se realizaron los mismos pasos que en el estudio anterior: movilización con G-CSF y recuperación por aféresis. Posteriormente, se infundieron mediante inyección en la arteria ovárica. La elección del ovario para la administración del tratamiento fue aleatoria en cada paciente, teniendo en cuenta que el ovario contralateral sería utilizado como control.
La respuesta al tratamiento se basó en la medición de dos parámetros: el recuento de folículos antrales (RFA) mediante ecografía transvaginal y los niveles de AMH sérica medidos en Cobas Elecsys 2010 (diagnóstico de Roche). Se consideró que las pacientes manifestaban una respuesta positiva si en el RFA se visualizaban 3 o más folículos respecto a la medida inicial y/o experimentaban un incremento en el nivel de AMH en 2 mediciones consecutivas en comparación con los niveles basales. Con el objetivo de identificar si las pacientes experimentaban una respuesta positiva, se realizó un registro basal antes de la movilización con G-CSF en el que se obtuvieron los valores de referencia a comparar. Una vez realizado el ASCOT, se llevaron a cabo registros en un principio semanales y, posteriormente, mensuales, para valorar los cambios experimentados a consecuencia de la actividad de las BMDSC.
Se observó que tanto la aféresis como el ASCOT resultó con éxito en todos los casos excepto en una paciente. Esta sufrió un espasmo venoso tras la infusión de BMDSC que la condujo a ser retirada del ensayo, dejando la población de estudio en 16 pacientes BR.
En lo que respecta a la reserva ovárica, el RFA se realizó por ecografía en diferentes puntos de tiempo. En cada punto se registró el ovario control, el ovario de estudio y el RFA total (ambos ovarios). El RFA total se incrementó desde el día 2 hasta el día 43, encontrando diferencias significativas en el día 15 de tratamiento. Sin embargo, no se detectó ninguna diferencia cuando el ovario tratado se comparó con el control en cualquier otro punto de tiempo analizado.
Por otro lado, el perfil sérico de AMH mostró variaciones individuales, las cuales no se distinguían al analizarlo de forma global, lo que indica que solo algunas pacientes mostraron un aumento notable de dicha hormona en suero. Tras el análisis de los resultados, se comprobó que 13/16 pacientes (81,3%) manifestaron una respuesta positiva a la administración de células madre. Sin embargo, no todas respondieron de la misma forma: 6 de las pacientes (37,5%) cumplieron con los dos criterios necesarios para determinar una respuesta positiva al tratamiento; 2 de ellas (12,5%) mostraron únicamente un incremento significativo en el RFA y los 5 casos restantes mostraron un incremento en los niveles de AMH séricos (31,3%).
Para evaluar la actuación paracrina de las células madre sobre el tejido ovárico, se midieron los factores de crecimiento solubles producidos y secretados por las BMDSC. Se comprobó que, aquellas pacientes que manifestaban una respuesta positiva al tratamiento para ambos parámetros mostraban valores más altos en las concentraciones del factor de crecimiento de fibroblastos (FGF-2). Asimismo, se determinó una correlación positiva en los niveles del factor de crecimiento insulínico (THSP-1) y los niveles de AMH, siendo significativamente mayor en aquellas pacientes que experimentaron una subida en las concentraciones hormonales séricas.
Por último, el grupo de investigación estudió los distintos resultados reproductivos obtenidos tras el desarrollo de los ciclos FIV. En comparación con los ciclos realizados como controles antes de comenzar el estudio, se distinguió un incremento en la obtención de ovocitos. La recuperación ovocitaria se llevó a cabo de manera satisfactoria en 24/28 EOC, hecho que ofrece una tasa de éxito del 85,7%. De los ciclos iniciados, se obtuvieron ovocitos MII en el 82,1% con una tasa de formación de embriones del 67,8%. Por otro lado, se distinguió un decremento en la tasa de cancelación de las pacientes BR, estableciéndose en un 14,2% tras el tratamiento, parámetro muy similar a la tasa predicha para las pacientes con buen pronóstico (13,3%). Una vez realizado el ICSI a los 51 ovocitos recuperados, se obtuvieron 36 blastocitos. Tras el análisis genético de los mismos, 5 fueron diagnosticados como euploides y llevados a transferencia embrionaria. A raíz de ello, se reportaron 2 embarazos clínicos de los cuales, uno terminó en aborto espontáneo. A continuación, durante el periodo de seguimiento, se lograron otras 3 gestaciones concebidas de forma natural, dando lugar al nacimiento de 3 bebés sanos. Un análisis posterior mostró que solo 4 de los ciclos llevados a cabo de forma posterior al ASCOT se iniciaron en condiciones óptimas. De esta forma, al realizar la comparación de dicho grupo (post-ASCOT óptimo) con el control, el aumento de los folículos antrales fue significativamente mayor.
En correlación con los resultados del estudio, es posible considerar el ASCOT como una técnica semiinvasiva y fácilmente reproducible, capaz de optimizar la movilización y activación de la reserva ovárica residual de las pacientes BR. Gracias a la aplicación de la misma, es posible la obtención de folículos susceptibles de ser estimulados para la realización posterior de ciclos de reproducción asistida, abriéndose así una nueva ventana terapéutica para aquellas pacientes cuya dotación folicular se encuentra afectada.
ConclusionesLos ensayos realizados han puesto de manifiesto la capacidad que muestran tanto la técnica de activación folicular como la de trasplante autólogo de células madre para la inducción de un rejuvenecimiento ovárico. Se ha comprobado la posibilidad de recuperar folículos residuales presentes en el ovario tanto en condiciones de baja respuesta como en aquellas donde se ha ocasionado un daño ovárico severo. Esto supone la apertura de una nueva alternativa clínica para pacientes cuya reserva folicular se ve comprometida, siendo de especial interés en los casos oncológicos y prepúberes. Este nuevo enfoque permite el manejo de la fertilidad de pacientes que precisan de una intervención médica inmediata, lo cual puede arrastrar consecuencias negativas en su reserva ovárica, como son los casos en los que se requieren tratamientos antineoplásicos.
Se han definido ciertas ventajas interesantes asociadas al ASCOT, entre ellas la administración de una serie de componentes no celulares obtenidos gracias a la aféresis, como alguno de los factores de crecimiento relevantes para el desarrollo folicular. Por lo tanto, cabe la posibilidad de utilizar dichos componentes no celulares como herramientas para la predicción de la respuesta ovárica al tratamiento. Una de las principales ventajas de dicha técnica es el incremento inducido en la red microvascular tras la insuflación de células madre. Esta es una de las principales ventajas a sortear en la técnica de activación in vitro, puesto que los problemas asociados a la isquemia tras el reinjerto establecen una media de vida de la corteza trasplantada en unos 5 años aproximadamente.
A pesar de haber demostrado las diversas ventajas que el rejuvenecimiento ovárico puede aportar al manejo de la fertilidad de aquellas pacientes vinculadas a una reserva ovárica disminuida, aún es necesaria la elaboración de más estudios que optimicen el procedimiento. Se ha determinado que la mejora en la cantidad de folículos recuperados no se encuentra asociada a un incremento en la calidad de los mismos. Además, se requieren mejoras futuras que incrementen la eficiencia de los protocolos, incluyendo la selección de lugares óptimos para la colocación de los injertos, la pérdida folicular asociada a la isquemia en el caso de la activación folicular in vitro, así como la reducción de la invasividad de la misma y la posibilidad de predecir la presencia de folículos residuales. Por lo tanto, se hacen necesarios la elaboración de más trabajos que validen los resultados obtenidos en una población más grande y homogénea para determinar la eficacia del rejuvenecimiento ovárico como técnica habitual para la recuperación de la fertilidad, ya que no existen ensayos clínicos aleatorizados que permitan determinar la eficacia de dichas técnicas. Así pues, la profundización en las metodologías expuestas y la optimización de las mismas permitirían el planteamiento de un plan de recuperación de la fertilidad en pacientes que se ven obligadas a recurrir a la ovodonación, ofreciendo así la posibilidad de ser madres biológicas y cumplir sus deseos reproductivos.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.