Comprobar si hay diferencias en el volumen y la vascularización trofoblástica en edades tempranas del embarazo entre gestaciones espontáneas y las conseguidas mediante técnicas de reproducción asistida (TRA).
MétodosSe realizó un estudio observacional prospectivo de embarazos únicos en la semana 9, mediante ecografía transvaginal con tridimensión y power doppler. Los volúmenes adquiridos fueron analizados utilizando el programa de imagen VOCAL –Virtual Organ Computer-Aided Analysis–, para evaluar el volumen de la placenta, el índice de vascularización, el índice de flujo y el índice de vascularización de flujo.
ResultadosDe 59 gestantes incluidas en el estudio, 32 se habían sometido a tratamientos de esterilidad y 27 eran gestaciones espontáneas. En un análisis comparativo todos los factores a estudio mostraron diferencias estadísticamente significativas. Las medias de estos valores para el grupo de técnicas de reproducción asistida fueron significativamente menores.
ConclusionesEl estudio de la volumetría y la vascularización trofoblástica podría ser de utilidad para comprender y prevenir la afección placentaria más habitual en las gestaciones conseguidas tras técnicas de reproducción asistida y que explicarían algunos resultados perinatales adversos en este tipo de gestaciones.
To determine whether there are differences in the volume and trophoblastic vascularisation at early stages of pregnancy between spontaneous pregnancies and those achieved after assisted reproduction techniques.
MethodsA prospective observational study was performed during week 9 of single pregnancies, using a trans-vaginal 3-dimensional ultrasound scan using power Doppler. The acquired volumes were analysed using the image program VOCAL –Virtual Organ Computer-Aided Analysis–, to evaluate the volume of the placenta, the vascularisation index, the flow index, and the vascularisation flow index.
ResultsOf the 59 pregnant women included in the study, 32 had fertility treatments, and 27 were spontaneous pregnancies. In a comparative analysis, all the factors studied showed statistically significant differences. The measurements of these values for the assisted reproduction techniques group were significantly lower.
ConclusionsThe study of the volumetric and trophoblastic vascularisation could be useful for understanding and preventing the most common placenta disorders in the assisted reproduction technique pregnancies, and it would explain some adverse prenatal outcomes in those pregnancies.
Después del primer nacimiento tras fecundación in vitro publicado en 1978, millones de parejas de todo el mundo han conseguido un embarazo con alguna de las técnicas derivadas de la misma.
La mayor parte de la morbilidad neonatal observada en gestaciones conseguidas con tratamientos de reproducción asistida (TRA) se debe a las consecuencias derivadas de los embarazos múltiples (Buitendijk, 1999; Olivennes, 2000; Koudstaal et al., 2000; Pinborg et al., 2004a). Pero también se ha comprobado en revisiones recientes y examinando un elevado número de casos (Wen et al., 2012; Hansen et al., 2004) que los embarazos simples presentan igualmente un mayor riesgo de resultados adversos: partos prematuros, bajo peso, anomalías congénitas y cualquier tipo de complicación perinatal. Queda por dilucidar si el hecho de presentar enfermedad reproductiva hace que estas parejas estén expuestas a mayores riesgos gestacionales que aquellas que gozan de una mayor y normal fertilidad. Asimismo, y dado el gran número de factores que intervienen en los diversos tratamientos, es difícil establecer una relación causa-efecto directa con la estimulación ovárica, la manipulación de gametos y embriones, los cultivos y el entorno hormonal alterado en la implantación, amén de la influencia de factores epigenéticos.
El conocimiento de los mecanismos que regulan el desarrollo de los nuevos vasos es básico para la comprensión del desarrollo del embarazo precoz (Bauer et al., 2005). El principal objetivo del proceso de angiogénesis es asegurar el flujo sanguíneo con la formación y el mantenimiento de la red vascular placentaria, condición de vital importancia. Variaciones agudas en la perfusión producen alteraciones en el flujo y, por consiguiente, en la presión parcial de oxígeno, y como consecuencia, alteraciones en el metabolismo de las células endoteliales y un déficit en el desarrollo del árbol vascular y en la maduración de los vasos (Demir et al., 2004; Kayisli et al., 2006). Esta circunstancia está presente en la preeclampsia y en casos de retardo de crecimiento fetal (Briceño-Pérez et al., 2009; Salafia et al., 1995).
De manera reciente, la introducción del 3D power doppler y el manejo de los datos mediante el sistema Virtual Organ Computer-Aided Analysis (VOCAL) ha permitido la observación, el estudio y la medición de la vascularización, así como el volumen de cualquier órgano. Debemos hacer constar que, en realidad, son estimaciones de estos parámetros, especialmente en lo que respecta a la vascularización, pues la correlación del índice de vascularización (IV), el índice de flujo (IF) y el índice de vascularización de flujo (IVF) con el flujo y la perfusión reales, y sobre todo su reproducibilidad, están siendo cuestionadas en los últimos años, tanto en relación con la metodología semiautomática del VOCAL (con reproducibilidad aceptable solamente en manos experimentadas) como con las de los índices power doppler, con ajustes técnicos variables en cada equipo, como la frecuencia de repetición de pulsos (PRF), la distancia del foco y los filtros de pared (Alcázar, 2008; Raine-Fenning et al., 2008; Schulten-Wijman et al., 2008). Y además, estos índices de vascularización son obtenidos desde un volumen 3D estático, sin tener en cuenta el ciclo cardiaco (tiempo y variación sistodiastólica del flujo sanguíneo, arterial y venoso), hecho que hace que tengamos que ser todavía más cautos a la hora de asimilar los datos obtenidos junto con su reproducibilidad intrapaciente (Miyague et al., 2013; Welsh et al., 2012).
Numerosas publicaciones centradas en la aplicación de esta técnica han mostrado déficit de vascularización placentaria en casos que han evolucionado posteriormente a preeclampsia (Costa et al., 2010; Odibo et al., 2011; Hafner et al., 2010; Mihu et al., 2012; Odeh et al., 2011) y retardos del crecimiento fetal (Pomorski et al., 2012). Todos ellos evalúan la vascularización a partir de la semana 20. Recientemente, han aparecido trabajos con gestaciones más precoces, pero siempre a partir de la semana 12 (Yigiter et al., 2011; Dar et al., 2010; Bozkurt et al., 2010).
Sin embargo, no tenemos constancia de estudios en épocas tan tempranas como en la semana 9 y, por tanto, si realmente es útil aplicar esta técnica en dicho momento. Una gran ventaja del estudio precoz en esta semana es la facilidad en la visualización completa de todo el saco gestacional con todo el trofoblasto en un mismo corte bidimensional y su consiguiente barrido para la toma tridimensional.
Nos proponemos, pues, estudiar el volumen trofoblástico total y su vascularización, comparando las gestaciones espontáneas con las conseguidas tras TRA para, así, intentar añadir más datos sobre la existencia de diferencias anatomofisiológicas en este tipo de gestaciones y la explicación del mayor número de resultados adversos perinatales que llevan asociados.
Material y métodosSe practica ecografía utilizando el ecógrafo Voluson 730 Expert (GE Medical System) equipado con sonda endocavitaria volumétrica multifrecuencia (3 a 9MHz) con un ángulo de insonación de 146°. Todas las exploraciones fueron realizadas por un único observador (FS). Son gestantes cursando la semana 9, siendo excluidas del estudio las pacientes con antecedentes de infertilidad y de fallos de implantación (trombofilias, anomalías uterinas y abortos de repetición), la gestación múltiple, el sangrado activo en el momento de la exploración o la evidencia de despegamientos o hematomas. Igualmente, se considera como criterio de exclusión los embarazos que han concluido en abortos precoces y tardíos. Por tanto, todos los casos corresponden a gestaciones que han llegado a la viabilidad fetal.
Tras comprobar la normalidad de las imágenes de útero con trofoblasto, biometría embrionaria, latido cardiaco y anexos, se realiza una captura en volumen 3D automática en modo power doppler que abarca todo el saco gestacional con su trofoblasto y el tejido subcoriónico adyacente, siempre con los mismos parámetros preseleccionados: armónico alto, potencia 97%, ganancia −3, mapa de grises 5, calidad del power doppler normal, frecuencia baja, filtro de pared Bajo1 y una PRF de 0,9KHz. El ángulo de volumen de captación fue de 85°, el máximo permitido, para así abarcar el tejido trofoblástico al completo.
El tiempo de adquisición de los volúmenes osciló entre 15 y 20s, y durante este periodo se solicitó a la paciente que no realizara ningún movimiento para así evitar la aparición de artefactos de color. Si así ocurre, se descarta el almacenamiento de esa imagen y se procede a una nueva adquisición.
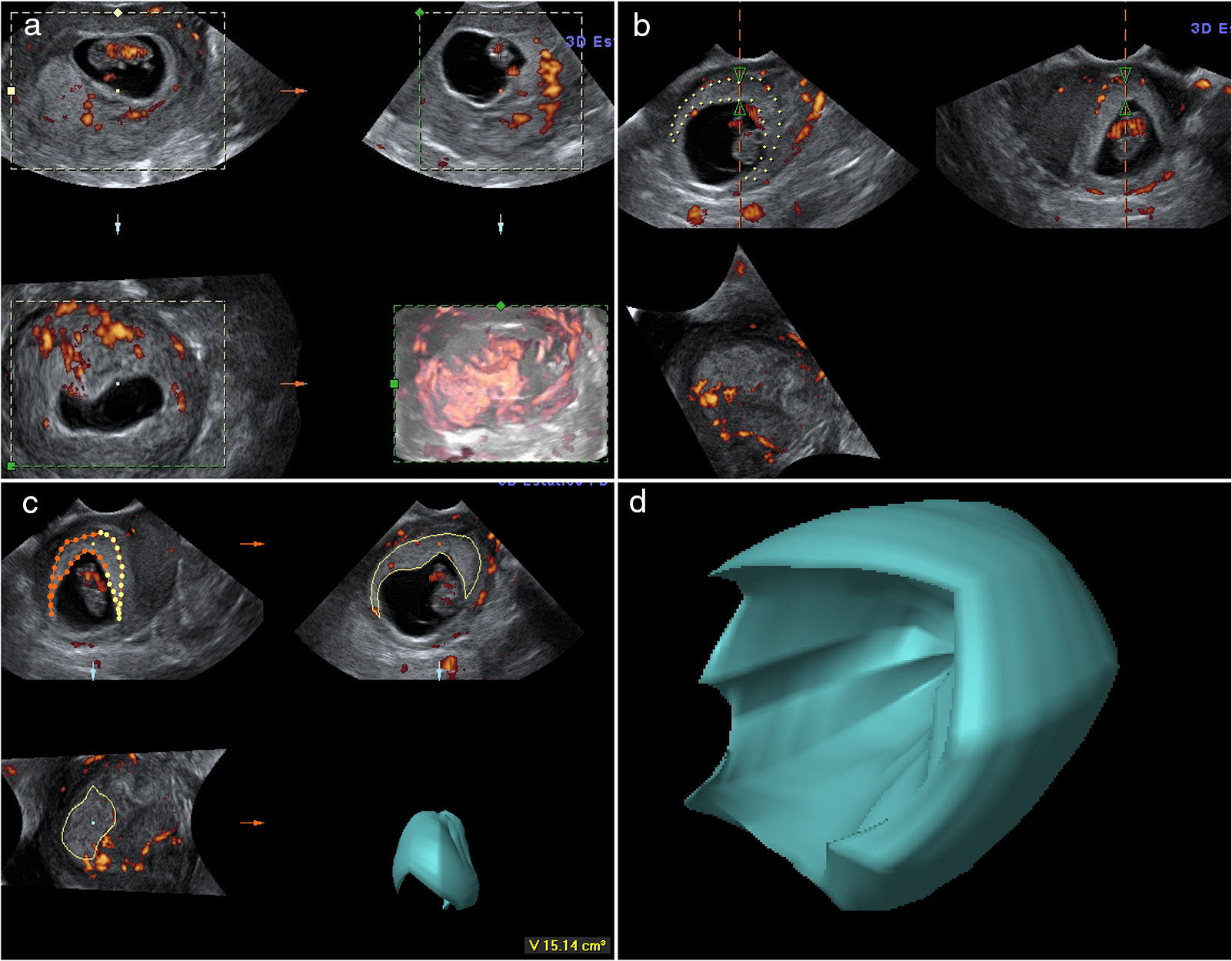
El análisis de manera «off-line» de todas las imágenes captadas se realizó por un único observador, el mismo que realizó la captación del volumen placentario. La medición fue realizada mediante el programa VOCAL incluido en el software del equipo ecográfico, en su modalidad rotacional manual, con un ángulo predeterminado de 30°, de forma que en cada volumen obtenido se realizaban 6 medidas para adquirir el volumen total (fig. 1).
Imágenes en power doppler tridimensional generadas usando el software VOCAL en gestación de 9 semanas. a) Obtención de la imagen tridimensional de la gestación. b) Análisis manual rotacional (30°) del trofoblasto. c) Resultado automático del volumen. d) Representación tridimensional del trofoblasto obtenido.
Mediante este software se calculó de forma automática la volumetría de todo el tejido trofoblástico y los 3 índices vasculares: IV, IF e IVF.
El IV, medido en porcentaje, es una medición de la cantidad de vasos que hay en el interior del área seleccionada. El IF se mide en una escala de 0-100, representa la potencia media de color: es una estimación de la intensidad del flujo en el área seleccionada. El IVF se mide en una escala de 0-100 y se obtiene a partir de una relación matemática de los índices anteriores: estima la perfusión del órgano.
El análisis univariante se realizó mediante la correlación de Spearman para evaluar los factores de confusión. Un valor de p (bilateral)<0,05 fue establecido como una relación estadísticamente significativa. No se han encontrado factores de confusión tras aplicar las medidas de ajuste necesarias, al no hallar factores que se relacionen a la vez con la variable dependiente y con la variable independiente. La t de Student fue el test utilizado para demostrar las diferencias estadísticamente significativas entre grupos independientes. Modelos de regresión logística fueron realizados para considerar la relación entre los grupos y los parámetros de volumen y vascularización trofoblástica.
El proyecto de investigación fue previamente aprobado por el Comité Ético de Investigación Cínica del Hospital Universitario San Juan de Alicante.
ResultadosCincuenta y nueve gestantes en su novena semana de gestación fueron estudiadas en nuestra Unidad de Embarazo. Veintisiete de ellas (45,8%) correspondían a embarazos espontáneos, en mujeres con una edad media de 33,8±3,6 años, y 32 (54,2%) a gestaciones tras diversos TRA, con una edad media de 37,1±4,9 años. En 18 casos la técnica fue fecundación in vitro con ovocito propio y 14 gestantes estaban en nuestro programa de ovodonación. El grupo de gestaciones espontáneas concluyó en 23 partos vaginales y 4 cesáreas, en la semana 38,5±2,4 de media y con un peso fetal de 3.184,7±557,3g de media. El grupo de gestantes tras TRA terminó en 22 partos y 10 cesáreas, en la semana 38,3±2 de media y con un peso fetal de 3.029,1±575,6g de media.
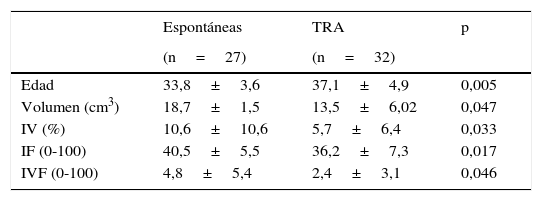
La tabla 1 muestra el análisis descriptivo de las variables estudiadas, donde se observan ya con el análisis univariante diferencias estadísticamente significativas entre las medias de ambos grupos, tanto en el volumen trofoblástico (p=0,047) como en los 3 parámetros de vascularización estudiados: IV (p=0,033), IF (p=0,017) e IVF (p=0,046), siendo menores en las pacientes con embarazos procedentes de tratamientos de esterilidad.
Relación de la edad de los pacientes, el volumen placentario obtenido y los parámetros de vascularización estudiados entre gestaciones espontáneas y tras técnicas de reproducción asistida
| Espontáneas | TRA | p | |
|---|---|---|---|
| (n=27) | (n=32) | ||
| Edad | 33,8±3,6 | 37,1±4,9 | 0,005 |
| Volumen (cm3) | 18,7±1,5 | 13,5±6,02 | 0,047 |
| IV (%) | 10,6±10,6 | 5,7±6,4 | 0,033 |
| IF (0-100) | 40,5±5,5 | 36,2±7,3 | 0,017 |
| IVF (0-100) | 4,8±5,4 | 2,4±3,1 | 0,046 |
IF: índice de flujo; IV: índice de vascularización; IVF: índice de vascularización-flujo; TRA: técnicas de reproducción asistida.
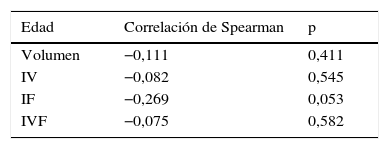
Se observa el desequilibrio entre ambos grupos con respecto a la variable edad, por lo que se incluye en el análisis estadístico, en un análisis multivariante, sin observar cambios clínicamente significativos (>10%) en los factores predictores de la variable a estudio, la esterilidad de las pacientes. La edad no se puede considerar un factor de interacción o de confusión, puesto que no existe correlación con los factores a estudio: volumen, IV, IF e IVF, como se muestra en la tabla 2, al aplicar la correlación de Spearman.
DiscusiónLa placenta es un órgano con unas características genéticas, morfológicas y funcionales únicas y complejas, con rápidos cambios a lo largo del embarazo; sin embargo, su fisiología es pobremente conocida en algunos aspectos.
La placenta separa histológicamente feto y útero, modifica los sistemas endocrino e inmunitario materno y establece las conexiones vasculares entre la madre y el embrión. Sin duda, es la perfusión placentaria la función primordial para comprender la fisiología del desarrollo y nutrición del feto. Muy posiblemente se sustentan en las anomalías del árbol placentario muchas de las enfermedades obstétricas: hipertensión, oligoamnios, retardo del crecimiento, trombosis placentaria, síndrome de perfusión entre gemelos, infarto o desprendimientos de la placenta. Se ha comprobado que la mayor parte del volumen placentario consiste en la circulación de la sangre materna y fetal (Wolf et al., 1989). Algunos autores evidencian que ocurre una reducción de este volumen y, por tanto, de su árbol vascular y un déficit en su función, ya en estadios precoces, en estas situaciones (Pijnenborg et al., 1991; Mercé et al., 2005a). Y precisamente en nuestro trabajo confirmamos la reducción del volumen placentario ya en su estadio precoz de trofoblasto en gestaciones tras TRA como elemento diferenciador respecto a las gestaciones espontáneas. Aunque como limitación, debemos indicar que existe una segunda oleada trofoblástica que igualmente tiene interés en la enfermedad placentaria, pero que no hemos correlacionado oportunamente en los casos estudiados.
La oxigenación placentaria es un agente importante para el control de los factores de crecimiento angiogénico y, por tanto, para la angiogénesis y la vasculogénesis fetoplacentaria y la diferenciación de las vellosidades. En la vasculatura fetoplacentaria, numerosos factores angiogénicos y antiangiogénicos están presentes, pero la forma en la interactúan y las consecuencias moleculares de tales interacciones aún no son comprendidas en su totalidad (Demir et al., 2004; Kayisli et al., 2006).
La preeclampsia es la principal causa de morbimortalidad perinatal. Aunque su etiología es desconocida, sabemos que la regulación del crecimiento vascular en la unidad maternofetal está alterada, llevando a defectos de la placentación. Se ha demostrado que existe una correlación entre la presencia de lesiones vasculares uteroplacentarias y preeclampsia (Costa et al., 2010; Odibo et al., 2011; Hafner et al., 2010; Mihu et al., 2012; Odeh et al., 2011). E igualmente, estudios morfológicos han presentado un pobre desarrollo de la vasculatura en la placenta en asociación con retardos del crecimiento fetal intrauterino (Briceño-Pérez et al., 2009; Salafia et al., 1995; Pomorski et al., 2012).
Hasta ahora, el método disponible para detectar precozmente anomalías de la perfusión placentaria antes de que derivaran en compromiso fetal era tan solo la valoración, muy subjetiva, del aspecto placentario en imágenes bidimensionales o bien doppler convencional y análisis del flujo de una sola arteria, la umbilical. No obstante, las alteraciones detectadas en esta arteria reflejan cambios vasculares ya tardíos del árbol vellositario; además, no se detectan las anomalías en los pequeños vasos, origen probable de la enfermedad anteriormente comentada. La tecnología power doppler combinada con la ecografía tridimensional, con reproducibilidad y aplicación clínica ya validadas tanto en ginecología (Mercé et al., 2005a; Jarvela et al., 2003; Yaman et al., 2002; Raine-Fenning et al., 2003) como en obstetricia (Jauniaux et al., 2003; Dubiel et al., 2005; Yu et al., 2003; Chaoui et al., 2001; Mercé et al., 2005b; Chang et al., 2003; Araujo Júnior et al., 2011; Morel et al., 2011), nos ofrece la posibilidad de conocer de una manera más objetiva toda la red vascular de la placenta. Posee la sensibilidad suficiente para detectar los vasos sanguíneos más pequeños con menor velocidad de flujo y la obtención de mapas de flujo sanguíneo de todo el parénquima placentario, con su posterior análisis mediante el histograma color incluido en el sistema VOCAL, igualmente validado para su aplicación clínica. La técnica power doppler es la más sensible y útil para el estudio vascular en órganos parenquimatosos, pues es capaz de visualizar los vasos sanguíneos de pequeño diámetro con menor velocidad de flujo, característica específica de los vasos placentarios (Welsh et al., 2001; Konje et al., 2003; Schaaps et al., 2005).
Sigue siendo materia controvertida si las TRA aumentan la incidencia de anomalías en los niños nacidos. Encontramos publicaciones que no detectan incrementos (De Mouzon y Lancaster, 1997; Bonduelle et al., 2002; Pinborg et al., 2004b) y otras que sí (Hansen et al., 2004; Buckett et al., 2007; Hansen et al., 2002; McDonald et al., 2005; Ludwig y Katalinic, 2002; Mau et al., 2004), aunque casi siempre se asocian a una edad materna avanzada. Este detalle en concreto de la edad de la gestante lo hemos descartado como elemento de confusión en nuestro estudio, siendo desvinculados, por tanto, los resultados obtenidos de peor vascularización en TRA, independientemente de la edad de la gestante.
Especialmente relevantes y clarificadores resultan los últimos metaanálisis publicados con un alto número de casos y un seguimiento a largo plazo, como el de Davies et al. (2012), confirmando de nuevo que las TRA incrementan el riesgo de malformaciones (6-8% frente al esperado 2-3% de la población general). Aunque este trabajo, junto con otros también recientes, abre una nueva vía de debate, al comprobar que en los niños de parejas con su correspondiente etapa de esterilidad que consiguen gestación espontánea hay un aumento de anomalías similar al de los niños tras TRA (Edwards y Ludwig, 2003; Ludwig, 2005) y, en general, reportan resultados adversos perinatales en estas gestaciones (Masako et al., 2012). Incluso, se comprueba bajo peso en gestaciones espontáneas en las subfértiles (Williams et al., 1991; Jackson et al., 2004) y también la tasa de malformaciones fetales varía según el tiempo de espera hasta conseguir la gestación correspondiente, como ya se había comprobado con anterioridad (Ghazi et al., 1991). Además, y aunque ya sabíamos que los embarazos tras TRA producen cambios en algunos productos específicos del embarazo, como la disminución en las cifras de la proteína plasmática A asociada al embarazo, algunos trabajos asocian una deficiente vascularización trofoblástica en gestaciones con baja tasa de esta proteína (Rizzo et al., 2009).
La discusión sigue abierta y es, por tanto, imprescindible y necesaria la investigación para intentar conocer los posibles factores que influyen y contribuyen al aumento de la morbilidad en niños nacidos tras TRA.
Intentando arrojar luz sobre todas estas cuestiones, diseñamos el presente trabajo, en edades muy tempranas de la gestación, con el fin de demostrar si ya en esos momentos existen diferencias en la placentación entre gestaciones espontáneas y las conseguidas tras los diversos TRA, mediante el estudio del volumen y los 3 parámetros de vascularización. Ambos parámetros, volumen y vascularización, estiman la fisiología de la placenta, origen de diversa enfermedad obstétrica. Y efectivamente, encontramos diferencias significativas en ambos grupos, tanto en volumen trofoblástico como en los 3 índices de vascularización estudiados: IV, IF e IVF. Además, como ya hemos comentado, se comprueba que la edad materna no influye en los resultados obtenidos.
Se han de indicar varias limitaciones del estudio, entre ellas, la no especificación del tratamiento concreto recibido por las pacientes en cuanto a la estimulación ovárica y a la preparación endometrial en los casos de receptoras de óvulos y en los de criotransferencia. E igualmente, los hallazgos en el IV, IF e IVF están influidos por una sola PRF estudiada, sin la toma de volúmenes con diferente PRF para así comprobar su perfecta reproducibilidad con diferentes operadores, lo que hubiera aportado más fiabilidad a los resultados finales (Lai et al., 2010). Todo ello hace que existan limitaciones técnicas y de interpretación de resultados que, de momento, evitan su generalización en la práctica clínica.
Muchos de los resultados obstétricos adversos encontrados en las gestaciones tras TRA, junto con el aumento de anomalías en los niños nacidos tras estos tratamientos, pueden relacionarse con los cambios íntimos y precoces en el trofoblasto temprano y en la placenta definitiva. Y además, independientemente de otros factores ya conocidos, como la edad materna y la multifetalidad. Por ello, deben considerarse ya desde un principio embarazos de alto riesgo, subsidiarios de un control obstétrico más exhaustivo. Estudios posteriores podrían validar esta exploración como un posible elemento diagnóstico de pronóstico de resultados adversos en la gestación estudiada.
Se abre, pues, la posibilidad de intentar resolver las importantes entidades clínicas ya comentadas y originadas muy posiblemente en el seno del tejido placentario. Finalmente, podría contribuir al estudio de los diferentes y complejos mecanismos de la placenta todavía no resueltos: sus características inmunológicas de adaptación, la contribución de los genomas materno y paterno, los intercambios bioquímicos y endocrinos fetomaternos, la placenta como injerto, etc.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.