La morfología del espermatozoide es una característica estrechamente relacionada con la fertilidad del gameto masculino. Diversas patologías causantes de infertilidad llevan asociadas subpoblaciones espermáticas anómalas que, además, pueden verse acompañadas de osmolaridades alteradas. Hemos planteado un estudio experimental para establecer si el aumento o la disminución de la osmolaridad in vitro pueden alterar la morfología espermática original.
Material y métodosSe han escogido aleatoriamente 42 pacientes que presentaban un seminograma normal, según los criterios de la OMS. Las muestras fueron procesadas mediante el analizador SCA 5.4 (Sperm Class Analyzer) (Microptic S.L, Barcelona, España), tipo CASA. La osmolaridad del plasma seminal se ha determinado mediante el osmómetro Advanced 2020 3MO.
ResultadosLos ensayos in vitro realizados en 30 de los 42 pacientes nos muestran que el aumento de la osmolaridad, a un valor el doble del normal (880 mOsm/kg), produce la pérdida progresiva de la viabilidad de los espermatozoides y un aumento significativo de las formas macrocefálicas, incremento del volumen y área del espermatozoide. En los 12 pacientes restantes, la disminución de la osmolaridad a la mitad (228 mOsmol/kg) no afecta a la viabilidad espermática, aunque el estudio de las subpoblaciones espermáticas nos muestra un aumento de las formas microcefálicas, con disminución del volumen y área cefálica.
DiscusiónLa morfología espermática es adquirida de manera definitiva durante la maduración epididimaria. Constatamos que cambios en la osmolaridad del plasma seminal in vitro no parecen afectar a esta. Solo con valores de osmolaridad extremadamente altos se observa que los espermatozoides adquieren formas macrocefálicas, acompañándose con una pérdida progresiva de la viabilidad. Estos ensayos nos pueden ayudar a entender el efecto bioquímico que puede ejercer el plasma seminal en el gameto masculino.
Sperm morphology is a parameter closely related to the fertility of the male gamete. Various infertility-causing disorders have been associated with anomalous sperm sub-populations that may be accompanied by an altered osmolality. A pilot study was conducted to determine whether the increase or decrease in in vitro osmolality can alter the original morphology.
Material and methodsThe study included 42 randomly selected patients who had been classified as normal according to WHO criteria. The samples were processed by a CASA - SCA 5.4 (Sperm Class Analyzer) (Microptic S.L, Barcelona, Spain). Seminal plasma osmolality was measured using an Advanced Osmometer 2020 3MO.
ResultsThe in vitro assays carried out on 30 patients showed that an osmolality increase up two times the reference value (880mOsm/kg), caused a progressive loss of sperm viability and a significant increase in macrocephalic sperm heads, with an increase in sperm volume and area. An osmolality decrease (half of the reference value, 228 mOsmol/kg) in a sample of 12 patients had no effect on sperm viability, although the sperm sub-population study showed increased micro-cephalic sperm with lower volume and cephalic area.
DiscussionSperm morphology is acquired by sperm during the epididymal maturation. It was found that changing in vitro seminal plasma osmolality did not seem to affect it. Only extremely high values of osmolality cause the formation of macrocephalic sperm heads and a progressive loss of viability. These in vitro assays can help us to understand the biochemical seminal plasma effect in the male gamete.
El espermatozoide solo está en contacto con el plasma seminal en el corto espacio de tiempo que el eyaculado se deposita en la vagina, por lo que la posible importancia funcional de este en el proceso de fecundación parece ser, al menos, cuestionable (Sullivan, 1999). El plasma seminal puede no ser esencial para la función fecundante de los espermatozoides, ya que espermatozoides extraídos directamente del conducto deferente pueden fecundar oocitos, e incluso obtener gestaciones en algunas especies con inseminación de espermatozoides del epidídimo (Ketamura et al., 1996). Sin embargo, sí parece ser esencial como transportador y protector de los espermatozoides en la mayoría de los procesos de apareamiento, así como por su contribución de factores nutricionales (Shivaji et al., 1990; Speroff et al., 1999). No obstante, durante el transporte de los espermatozoides en el tracto reproductor femenino, estos van separándose progresivamente del plasma seminal, por lo que su metabolismo se ve influido fuertemente por los fluidos luminares del útero y del oviducto (Suarez, 1999). Esta situación parece tener un efecto directo sobre la actividad metabólica de los espermatozoides eyaculados, así como también puede estar relacionada con el desarrollo de la capacidad fecundante y el incremento de la movilidad de los espermatozoides (Suarez, 2008; Yao y Yeung, 1999). De hecho, los espermatozoides se desprenden de todo el plasma seminal antes de llegar al lugar de fecundación, independientemente de donde se deposite el semen durante el coito, siendo muy improbable que en los momentos próximos a la ovulación, el plasma seminal penetre en los trompas de Falopio. Ciertos componentes del plasma contribuyen positivamente a la fertilidad de los espermatozoides como por ejemplo estimulando la reacción acrosómica (Palmerini et al., 2003). Sin embargo, otros actúan como factores de infertilidad, los cuales serán eliminados durante la capacitación in vivo en el tracto genital femenino. Estos están compuestos principalmente por proteínas que inhiben la motilidad, capacitación y reacción acrosómica de los espermatozoides (Shivaji et al., 1990).
En la bibliografía se ha descrito que la morfología espermática y el estudio de las subpoblaciones de espermatozoides es una variable estrechamente relacionada con la fertilidad del gameto masculino (Auger, 2010; Menkveld, 2010; Menkveld et al., 2011). La zona pelúcida es una matriz de glicoproteínas que sintetiza y segrega el oocito en crecimiento y que juega un papel fundamental en los primeros momentos de la fertilización (Casanovas y Coy, 2008; Bellido, 1997). Está compuesta fundamentalmente por secuencias repetidas formadas por tres unidades glicoproteicas denominadas ZP1, ZP2 y ZP3. Los espermatozoides con el acrosoma intacto pueden unirse a la ZP3 y tras la unión esta glicoproteína inicia la reacción acrosómica. Se ha señalado que las formas anómalas presentan alteración en el mecanismo de unión con el oocito por la llave bioquímica de la glicoproteina ZP3 (Casanovas y Coy, 2008).
Para estudiar y entender el efecto del cambio de la osmolaridad en el plasma seminal es necesario conocer que la membrana espermática es una estructura heterogénea y dinámica que presenta 5 dominios diferentes: acrosoma, segmento ecuatorial, región postacrosomal, pieza intermedia y cola (Manandhar y Sutovsky, 2007). Participa en el reconocimiento y transporte de moléculas con funciones específicas que permiten que el espermatozoide adapte su metabolismo al medio circundante, proporcionándole un sistema molecular para el reconocimiento del oocito (Bellido, 1997; Olivera et al., 2006). De aquí deriva que, la evaluación morfológica o estructural del espermatozoide hace énfasis en la valoración de la integridad de su membrana plasmática y acrosomal. La integridad de la membrana espermática es fundamental para el metabolismo espermático e imprescindible en varios eventos involucrados en la fecundación, como lo son la capacitación, la reacción acrosómica y la fusión con el oocito. La valoración de la integridad funcional de la membrana plasmática y membrana acrosomal puede ser fácilmente analizada usando pruebas sencillas y prácticas que valoran la capacidad funcional de estas membranas a los cambios osmóticos. Se basan en la reacción de estas membranas cuando se exponen a soluciones hipoosmóticas (Jeyendran et al., 1984; Correa y Zavos, 1994; Van Derven et al., 1986) observando una alta correlación entre la respuesta del espermatozoide a un medio hiposmótico y su capacidad de penetración en oocito de hámster libre de zona pelúcida. Dentro de las pruebas desarrolladas a partir de este fenómeno destacan dos: el test de endósmosis o hiposmótico (Hypoosmotic Swelling Test) y el test de resistencia osmótica (ORT), los cuales valoran dos regiones distintas del espermatozoide. El primer caso es una prueba sencilla y rápida denominada Hypoosmotic Swelling Test que se basa en el concepto fisiológico de la semipermeabilidad de las membranas plasmáticas intactas y bioquímicamente activas de los espermatozoides vivos, las cuales absorben agua cuando son expuestas a una solución hiposmótica (Correa y Zavos, 1994; Van Derven et al., 1986; Chan et al., 1991). Para que esta respuesta se produzca, la membrana plasmática del espermatozoide debe estar íntegra y con los mecanismos de intercambio de fluidos funcionando correctamente. Así, en los espermatozoides funcionalmente alterados no se produce la captación selectiva de agua de forma adecuada alcanzándose un equilibrio pasivo entre los medios intra- y extracelular que no provoca cambios morfológicos en la célula. También es utilizado en reproducción asistida para seleccionar los espermatozoides vivos para la ICSI (inyección intracitoplasmática de espermatozoides), cuando presentan movilidad reducida (Speroff et al., 1999).
La sensibilidad del espermatozoide a la osmolaridad también se ve al observar que estos presentaban diferentes magnitudes morfométricas según la osmolaridad del tipo de fijación o tinción utilizada (Maree et al., 2010; Yániz et al., 2015). Respecto el test de resistencia osmótica está dirigido al estudio de la membrana acrosómica, estando actualmente su utilización restringida a trabajos de investigación específicos (Correa y Zavos, 1994; Jeyendran et al., 1984; Van Derven et al., 1986). Por otro lado nuestra experiencia con dos casos clínicos nos ha reforzado en el propósito de este estudio:
Paciente 1: varón de 43 años que acude a nuestro servicio de reproducción asistida tras varios años de infertilidad de la pareja, el paciente presentaba con una severa teratozoospermia (0% de espermatozoides normales) y en el estudio de las subpoblaciones de espermatozoides con tecnología Automated Sperm morphology Analysis (ASMA), nos muestra un 60% de formas alargadas. El estudio de la osmolaridad del plasma seminal nos muestra un valor de 1,64 mOsm/kg/eyaculado (Vn=1,26 1,17-1,36 mOsm/kg/eyaculado), un aumento significativo de la osmolaridad respecto a los valores normales. Se remite al urólogo y este descarta varicocele y el paciente entra en lista de espera de ICSI.
Paciente 2: varón de 35 años remitido también a reproducción asistida por el urólogo con 5 años de infertilidad de la pareja, sin ninguna patología sobreañadida. Presenta un seminograma normal con un 10% de espermatozoides normales pero en el estudio de las subpoblaciones presenta un 50% de formas redondas. El estudio de la osmolaridad del plasma seminal nos muestra un valor de 0,73mOsm/kg/eyaculado (Vn=1,26 1,17-1,36 mOsm/kg/eyaculado), significativamente más bajo respecto a los valores de referencia. El paciente entra en lista de espera para IAC.
Por todo ello postulamos la hipótesis de que la osmolaridad podría estar correlacionada con la morfología del espermatozoide y, por tanto, con la fertilidad. Este efecto quedaría limitado al breve tiempo que el espermatozoide está en contacto con el plasma seminal, cuando es depositado en la vagina, pero el efecto podría ser también relevante en las técnicas de reproducción asistida, puesto que los espermatozoides podrían permanecer en contacto con el plasma seminal y otros medios durante tiempos mayores. Hemos señalado que el espermatozoide es una célula osmóticamente sensible por lo que se plantea si este corto periodo de tiempo podría ser suficiente para modificar la morfología del espermatozoide. En este estudio se presenta una serie de ensayos in vitro en los cuales se ha pretendido forzar las condiciones osmóticas del plasma seminal original, siguiendo el modelo del «Host test», y estudiar el efecto que estas condiciones extremas produce en el espermatozoide mediante el análisis morfológico avanzado con métodos automatizados tipo ASMA de fiabilidad reconocida (Mortimer et al., 2015).
Material y métodosPoblación de estudioSe han estudiado 42 pacientes con una edad media de 36,7 años, con un rango entre 17 y 48 años. De ellos, 6 pacientes procedían del Servicio de Esterilidad, 7 del Servicio de Urología y 29 restantes de consultas externas de centros de Asistencia Primaria. Todos los pacientes fueron escogidos aleatoriamente, estableciendo como requisito que presentaran un seminograma normal según los criterios de la OMS (2010) para entrar en el ensayo (World Health Organization, 2010).
Estudio del semenLa recogida de la muestra de semen se ha realizado siguiendo la normativa de la OMS y de la ESHRE (Monographs, 1999; World Health Organization, 2010). La concentración y la movilidad espermática se han analizado con el analizador automatizado SCA 5.4 (Sperm Class Analyzer) (Microptic S.L, Barcelona, España), tipo Computer Assay Semen Analysis, utilizando cámaras Leja desechables de 10 micras de espesor y efectuando las lecturas de los campos necesarias para 1.000 espermatozoides, siguiendo las indicaciones de Aulesa et al. (2006). El SCA se ha calibrado utilizando una rejilla micrométrica Carl-Zeis, y el factor de conversión hallado fue de 0,083648 pixel/μm. La vitalidad se ha realizado siguiendo el método recomendado por la OMS con la tinción de colorantes supravitales eosina-nigrosina al 10% (World Health Organization, 2010). El estudio de la morfología se ha realizado utilizando el módulo automático de morfología del SCA y empleando el método rápido de tinción Hemacolor (Merck) modificado, siguiendo las indicaciones propuestas por Ramirez et al. (2016), y con una diferenciación de un mínimo de 200 espermatozoides. Los valores de referencia que se han adoptado son los establecidos por la OMS (World Health Organization, 2010). Se clasifica a un semen como normal cuando cumple valores de volumen total de semen recibido superior a 1,5mL, concentración de espermatozoides superior a 39 millones de espermatozoides/eyaculado, movilidad progresiva (a+b) superior a un 32%, vitalidad espermática positiva con un valor superior al 55% y morfología normal superior a un 4% (según el criterio de Kruger). La osmolaridad del plasma seminal ha sido medida con un osmómetro Advanced 2020 modelo 3MO basado en el cálculo de la disminución del punto de congelación (freezing point depression).
El laboratorio de Andrología está acreditado en el Programa Español de Evaluación Externa de la Calidad del Seminograma de Ceifer, lab 08100 registro 5D4704241006, desde hace 5 años. La acreditación Ceifer está certificada a nivel europeo por la ESHRE (Sociedad Europea de Reproducción Humana y Embriología).
Protocolo de estudio de la influencia de la osmolaridad en las subpoblaciones de espermatozoidesProtocolo aumento de la osmolaridad: con 30 muestras de las escogidas aleatoriamente se tomaron dos alícuotas de 0,3mL que se situaron en tubos eppendorf. Uno de los eppendorf se dejó con el semen sin aditivos y al otro se le añadió 0,0150g de KH2PO4 (PM=136,09), equivalente a una osmolaridad de 400-500 mOsm/kg, y se agita la muestra suavemente para disolver el fosfato. El objetivo fue que dicha cantidad de fosfato añadida doblara la osmolaridad normal de la muestra de semen. Ambas muestras se dejaron en estufa a 37°C durante 45 min.
Protocolo de disminución de la osmolaridad: con 12 muestras de las escogidas aleatoriamente se tomaron dos alícuotas de 0,3mL que se situaron en tubos eppendorf. Uno de los eppendorf se dejó con el semen sin aditivos y al otro se le añadió 0,3mL de agua destilada. El objetivo perseguido fue que dicha cantidad de agua añadida redujera a la mitad la osmolaridad normal de la muestra de semen. Ambas alícuotas (una diluida con agua y la otra el semen original sin tratamiento), se situaron en estufa a 37°C durante 45min.
Transcurridos los tiempos de incubación de ambos protocolos, las muestras se centrifugaron suavemente a 200g 5 min y se separó el sobrenadante de cada muestra para la determinación de la osmolaridad. Con el sedimento de espermatozoides se efectuó una extensión mediante extensor semiautomático Hemaprep (CellaVision). El frotis se tiñó con el equipo Hemacolor modificado, siguiendo las indicaciones de modificación de la tinción original propuesta por Ramirez et al. (2016). Se analizan un mínimo de 200 espermatozoides con el analizador de sémenes SCA obteniendo el porcentaje de formas normales de la muestra y el estudio porcentual de las subpoblaciones espermáticas.
Métodos de evaluación y estadísticosLos cálculos de los resultados se efectuaron con los programas estadísticos SPSS 19.0 (SPSS, Chicago, IL EE. UU.) y MedCalc 10.0.2.0 (MedCalc. Software. Mariakerke, Bélgica).
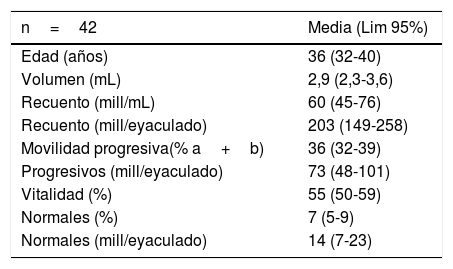
ResultadosLos valores normales de osmolaridad se hallaron en 90 pacientes que presentaron un seminograma normal, que ya fueron descritos anteriormente por Bergamo et al. (2017). La distribución de estos valores es gaussiana, con un valor medio de osmolaridad de 421 mOsm/kg con un intervalo de confianza del 95% de 412-431 mOsm/kg y expresado en mOsm/kg/eyaculado presenta una media de 1,26 (1,17-1,36 mOsm/kg/eyaculado). En la tabla 1 se muestran los resultados de la media de los parámetros del seminograma de los 42 pacientes que han integrado el estudio.
Medias y Lim 95% de los parámetros del seminograma de los pacientes seleccionados como grupo control
| n=42 | Media (Lim 95%) |
|---|---|
| Edad (años) | 36 (32-40) |
| Volumen (mL) | 2,9 (2,3-3,6) |
| Recuento (mill/mL) | 60 (45-76) |
| Recuento (mill/eyaculado) | 203 (149-258) |
| Movilidad progresiva(% a+b) | 36 (32-39) |
| Progresivos (mill/eyaculado) | 73 (48-101) |
| Vitalidad (%) | 55 (50-59) |
| Normales (%) | 7 (5-9) |
| Normales (mill/eyaculado) | 14 (7-23) |
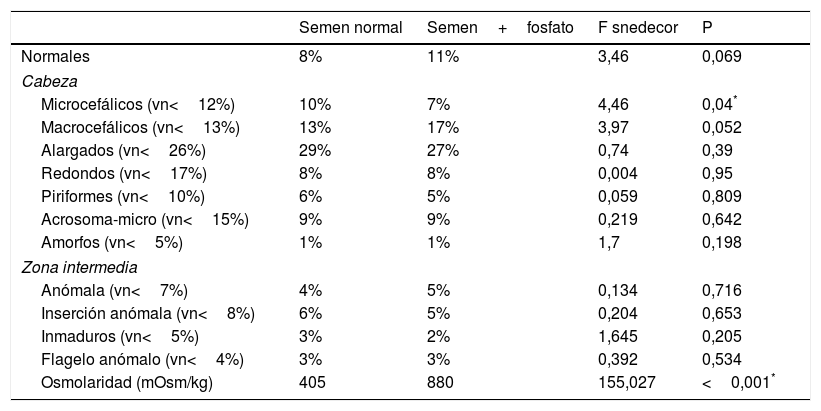
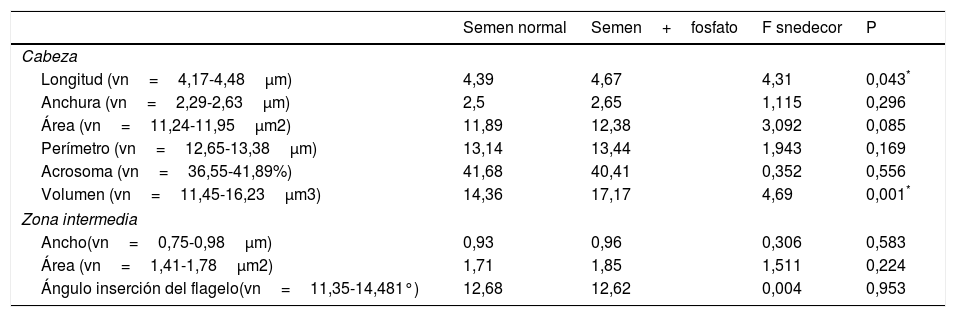
En la tabla 2 se muestran los resultados de las medias de la morfología normal y de las subpoblaciones espermáticas del grupo de 30 pacientes originales y tratadas con el fosfato para duplicar su osmolaridad, junto con las medias de la osmolaridad de cada subgrupo. El análisis estadístico comparativo de los resultados de la tabla 2 se realizó aplicando el test de Anova al estudio de las medias de ambas subpoblaciones, previa comprobación de la homogeneidad de las varianzas con el test de Levene (p>0,05). Estos resultados nos muestran que existen diferencias entre las subpoblaciones de espermatozoides al aumentar la osmolaridad del plasma seminal, con un aumento de las formas macrocefálicas de forma significativa (p<0,05) y disminución de las microcefálicas de forma no significativa (p>0,05), sin que se observe una alteración significativa en el porcentaje normal. En el análisis visual de la morfología realizado por el SCA no se observó ninguna alteración en los espermatozoides que nos indique una desestructuración de la membrana celular. En la tabla 3 se muestran los valores morfométricos de los espermatozoides analizados de ambos subgrupos. En el análisis estadístico de estos resultados solamente la longitud de la cabeza del espermatozoide y el volumen cefálico presentan un aumento significativo (p<0,05). El análisis complementario de viabilidad de las muestras mediante el análisis de la vitalidad con el método eosina/nigrosina nos muestra una total y progresiva pérdida de la viabilidad celular de las muestras en que se aumentó la osmolaridad del plasma. Para descartar una pérdida de viabilidad por motivos no osmóticos, como el consumo de la fructosa durante la incubación a 37°C, se determinó la fructosa y el pH y no se observaron alteraciones significativas en ningún caso.
Medias de la morfología avanzada y la osmolaridad del semen normal y con adición de fosfato (n=30)
| Semen normal | Semen+fosfato | F snedecor | P | |
|---|---|---|---|---|
| Normales | 8% | 11% | 3,46 | 0,069 |
| Cabeza | ||||
| Microcefálicos (vn<12%) | 10% | 7% | 4,46 | 0,04* |
| Macrocefálicos (vn<13%) | 13% | 17% | 3,97 | 0,052 |
| Alargados (vn<26%) | 29% | 27% | 0,74 | 0,39 |
| Redondos (vn<17%) | 8% | 8% | 0,004 | 0,95 |
| Piriformes (vn<10%) | 6% | 5% | 0,059 | 0,809 |
| Acrosoma-micro (vn<15%) | 9% | 9% | 0,219 | 0,642 |
| Amorfos (vn<5%) | 1% | 1% | 1,7 | 0,198 |
| Zona intermedia | ||||
| Anómala (vn<7%) | 4% | 5% | 0,134 | 0,716 |
| Inserción anómala (vn<8%) | 6% | 5% | 0,204 | 0,653 |
| Inmaduros (vn<5%) | 3% | 2% | 1,645 | 0,205 |
| Flagelo anómalo (vn<4%) | 3% | 3% | 0,392 | 0,534 |
| Osmolaridad (mOsm/kg) | 405 | 880 | 155,027 | <0,001* |
Vn:valores normales.
Medias en μm de las magnitudes del espermatozoides normal y con adición de fosfato (n=30)
| Semen normal | Semen+fosfato | F snedecor | P | |
|---|---|---|---|---|
| Cabeza | ||||
| Longitud (vn=4,17-4,48μm) | 4,39 | 4,67 | 4,31 | 0,043* |
| Anchura (vn=2,29-2,63μm) | 2,5 | 2,65 | 1,115 | 0,296 |
| Área (vn=11,24-11,95μm2) | 11,89 | 12,38 | 3,092 | 0,085 |
| Perímetro (vn=12,65-13,38μm) | 13,14 | 13,44 | 1,943 | 0,169 |
| Acrosoma (vn=36,55-41,89%) | 41,68 | 40,41 | 0,352 | 0,556 |
| Volumen (vn=11,45-16,23μm3) | 14,36 | 17,17 | 4,69 | 0,001* |
| Zona intermedia | ||||
| Ancho(vn=0,75-0,98μm) | 0,93 | 0,96 | 0,306 | 0,583 |
| Área (vn=1,41-1,78μm2) | 1,71 | 1,85 | 1,511 | 0,224 |
| Ángulo inserción del flagelo(vn=11,35-14,481°) | 12,68 | 12,62 | 0,004 | 0,953 |
Vn:valores normales. Calibración rejilla micrométrica Carl-Zeis 0,083648 pixel/micrómetro.
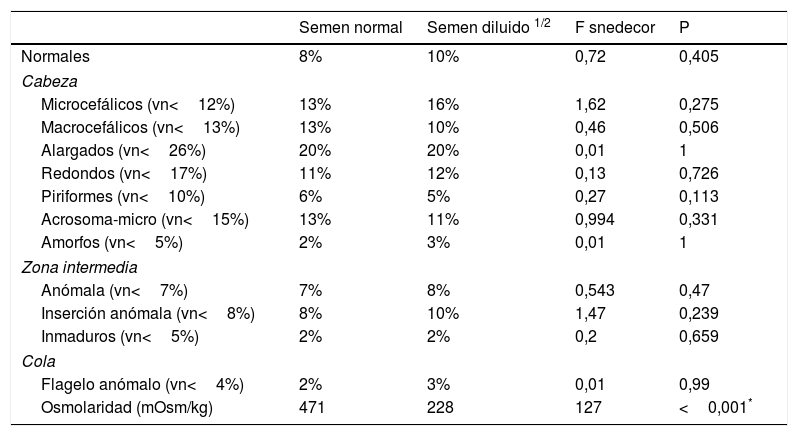
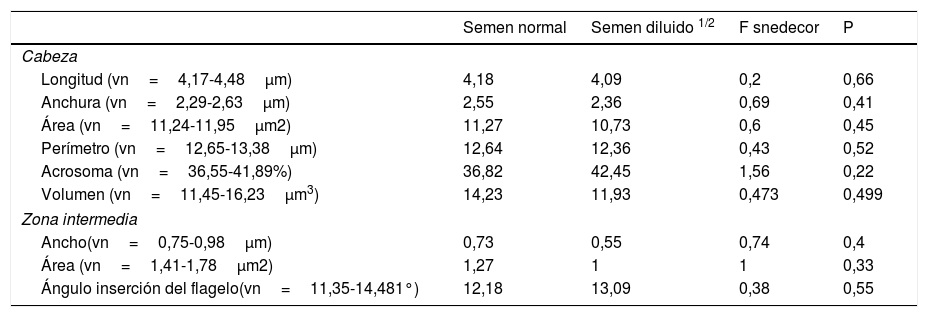
En la tabla 4 se muestran las medias de la morfología normal y de las subpoblaciones espermáticas de las 12 muestras originales y diluidas, junto con las medias de la osmolaridad de cada subgrupo. El análisis estadístico comparativo de los resultados (tabla 4) se realizó aplicando el test de Anova al estudio de las medias de ambas subpoblaciones, previa comprobación de la homogeneidad de las varianzas con el test de Levene (p>0,05). Estos resultados nos señalan que en las muestras con osmolaridad reducida se produce un aumento de las subpoblaciones microcefálicas y una reducción de las formas macrocefálicas, con valores no significativos (p>0,05). En la tabla 5 se muestran los valores morfométricos de los espermatozoides analizados de ambos subgrupos. En el análisis estadístico de estos resultados se observa una disminución de longitud, anchura, área, perímetro y volumen cefálicos del espermatozoide, aunque esta disminución tampoco es significativa (p>0,05). El análisis visual realizado en el SCA para realizar el análisis de la morfología tipo ASMA, nos muestra que en un ambiente hipoosmolar se producen fenómenos de hinchazón de la cola del espermatozoide, similares a los observados en el Host-test, sin que se observe alteración macroscópica de la cabeza del espermatozoide. El análisis complementario de viabilidad de las muestras a las que se les ha disminuido la osmolaridad del plasma nos muestra una conservación de la viabilidad celular después del tratamiento.
Medias de la morfología avanzada y la osmolaridad del semen normal y con adición de agua destilada (n=12)
| Semen normal | Semen diluido 1/2 | F snedecor | P | |
|---|---|---|---|---|
| Normales | 8% | 10% | 0,72 | 0,405 |
| Cabeza | ||||
| Microcefálicos (vn<12%) | 13% | 16% | 1,62 | 0,275 |
| Macrocefálicos (vn<13%) | 13% | 10% | 0,46 | 0,506 |
| Alargados (vn<26%) | 20% | 20% | 0,01 | 1 |
| Redondos (vn<17%) | 11% | 12% | 0,13 | 0,726 |
| Piriformes (vn<10%) | 6% | 5% | 0,27 | 0,113 |
| Acrosoma-micro (vn<15%) | 13% | 11% | 0,994 | 0,331 |
| Amorfos (vn<5%) | 2% | 3% | 0,01 | 1 |
| Zona intermedia | ||||
| Anómala (vn<7%) | 7% | 8% | 0,543 | 0,47 |
| Inserción anómala (vn<8%) | 8% | 10% | 1,47 | 0,239 |
| Inmaduros (vn<5%) | 2% | 2% | 0,2 | 0,659 |
| Cola | ||||
| Flagelo anómalo (vn<4%) | 2% | 3% | 0,01 | 0,99 |
| Osmolaridad (mOsm/kg) | 471 | 228 | 127 | <0,001* |
Vn:valores normales.
Medias en μm de las magnitudes del espermatozoides normal y con adición de agua destilada (n=12)
| Semen normal | Semen diluido 1/2 | F snedecor | P | |
|---|---|---|---|---|
| Cabeza | ||||
| Longitud (vn=4,17-4,48μm) | 4,18 | 4,09 | 0,2 | 0,66 |
| Anchura (vn=2,29-2,63μm) | 2,55 | 2,36 | 0,69 | 0,41 |
| Área (vn=11,24-11,95μm2) | 11,27 | 10,73 | 0,6 | 0,45 |
| Perímetro (vn=12,65-13,38μm) | 12,64 | 12,36 | 0,43 | 0,52 |
| Acrosoma (vn=36,55-41,89%) | 36,82 | 42,45 | 1,56 | 0,22 |
| Volumen (vn=11,45-16,23μm3) | 14,23 | 11,93 | 0,473 | 0,499 |
| Zona intermedia | ||||
| Ancho(vn=0,75-0,98μm) | 0,73 | 0,55 | 0,74 | 0,4 |
| Área (vn=1,41-1,78μm2) | 1,27 | 1 | 1 | 0,33 |
| Ángulo inserción del flagelo(vn=11,35-14,481°) | 12,18 | 13,09 | 0,38 | 0,55 |
Vn:valores normales.
La función del plasma seminal en el proceso de fecundación del óvulo es controvertida (Sullivan, 1999), Ketamura et al. (1996) señalan que espermatozoides extraídos del deferente pueden ser utilizados en reproducción asistida con éxito, por lo que minimiza la importancia del plasma seminal en el proceso de fecundación. En cambio otros autores como Shivaji et al. (1990), Speroff et al. (1999), Suarez et al. (1999) o Yao et al. (1999), describen la importancia del plasma seminal en el aislamiento de proteínas activadoras e inhibidoras de la reacción acrosómica, que precede al desencadenamiento del mecanismo de ZP3 en la dicha reacción. La bibliografía más reciente presenta el estudio proteómico del plasma seminal en individuos normales (Gupta et al., 2015) y con varicoceles (Agarwal et al., 2015), como una línea de investigación que puede establecer una nueva interpretación de los estudios de infertilidad y reproducción asistida de la pareja (Cooper, 1986). Recientemente, Bergamo et al. (2017), ha descrito la actualización de la determinación de los componentes bioquímicos clásicos (proteínas totales, glucosa, fructosa, diversos iones...), con las nuevas metodologías analíticas realizadas con los autoanalizadores actuales. Y también han hallado los valores normales de nuevos parámetros, como la osmolaridad del plasma seminal, que hasta ahora no se habían considerado. Se plantea que el sodio, potasio, fósforo, calcio y glucosa son los principales responsables de la osmolaridad del plasma.
Otro punto controvertido es de cómo y en qué fase de maduración el espermatozoide adquiere la morfología espermática. Varios autores plantean que la maduración del espermatozoide se produce en el epidídimo, y que las glicoproteínas no son los únicos componentes de la membrana que cambian durante la maduración epididimaria (Cooper, 1986; Cooper, 2011; Meniru, 2004). Los lípidos también cambian su composición, así como sus propiedades físicas y químicas (Dhindsa y Bahle, 2012). Yanagimachi et al. (1994) señalan que algunos de estos cambios en la composición y contenido de lípidos podrían causar diferencias en la susceptibilidad al choque térmico, en la fluidez de la membrana o cambios en la permeabilidad de esta.
También se ha planteado como tema de debate la relación entre membrana plasmática y morfología espermática, y su interacción con el sistema ZP. Algunos autores, como Casanovas (2008) señalan que es necesario una forma normal del espermatozoide para desencadenar el mecanismo de reconocimiento entre espermatozoide y capa pelúcida; en cambio otros como Meniru et al. (2004) o Dhindsa et al. (2012) plantean que cuando los espermatozoides han completado la reacción acrosómica pueden unirse a la ZP2 sin importar su morfología. Diversos autores como Jeyendran et al. (1984) o Van Derven et al. (1986) presentan también la importancia de la función de la membrana plasmática y acrosómica en la fecundación, y preconizan pruebas osmóticas como el Host test o ROS para estudiar la viabilidad de los espermatozoides para la reproducción asistida, independientemente de su morfología. La relación de la morfología del espermatozoide y la tasa de fertilidad está bien documentada (Auger, 2010; Menkveld et al., 2011) y nos muestra que la disminución de formas normales reduce significativamente la tasa de fertilidad de las muestras de fecundación in vitro (Meniru, 2004).
En este trabajo se ha estudiado cómo el aumento y disminución de la osmolaridad podría influir en la morfología normal y las subpoblaciones espermáticas, con ensayos in vitro y posterior análisis de su morfología. Gracias a la nueva metodología empleada en el análisis morfológico tipo ASMA, hemos constatado que al disminuir la osmolaridad del medio de los espermatozoides, la membrana celular del flagelo se hincha, adquiriendo el espermatozoide una morfología parecida a la que adquiere en el Host test (Correa y Zavos, 1994), aunque en la cabeza del espermatozoide macroscópicamente no se observa alteración. En el análisis de morfología realizado por el SCA, se observa una disminución de la media de su volumen cefálico, ocasionando el aumento de la subpoblación de espermatozoides microcefálicos, aunque no significativa (p>0,05). La variación es opuesta a la explicable mediante el paso normal de agua en una membrana semipermeable, pudiendo explicarse mediante mecanismos fisiológicos descritos por Yeung et al. (2006). Estos autores describen que el espermatozoide es una célula osmóticamente muy activa, provista de múltiples mecanismos de control homeostásico de su volumen celular, principalmente canales iónicos, que permiten al espermatozoide la regulación de su volumen celular al producirse cambios importantes en la osmolaridad de su entorno. También Yeung et al. (2006), describen receptores de proteínas que tienen su máxima expresión en la zona del cuello y cola del espermatozoide y que se activan en ambientes hipoosmolares con una reducción del volumen de la cabeza del espermatozoide conocida como regulatory volume decrease (RDV), y cambio de la forma del flagelo para evitar un excesivo estrés de la membrana plasmática, con enrolamiento o angulación con una acomodación geométrica para conservar la misma área superficial del espermatozoide, lo que facilitaría el desplazamiento del espermatozoide en el tracto femenino.
En nuestros resultados se detecta esta disminución del volumen de la cabeza, pero no han detectado sin embargo cambios de tamaño ni de angulaciones de la zona intermedia del espermatozoide como describen Yeung et al. (2006). Creemos que en nuestros ensayos, las condiciones osmolares no han sido suficientes o son simplemente diferentes, para activar los mecanismos específicos de regulación, situados en la zona del cuello e intermedia del espermatozoide. El análisis complementario de la viabilidad celular con el test de vitalidad nos muestra que la hipoosmolaridad no parece afectar la membrana celular del espermatozoide al ponerse en marcha los mecanismos homeostásicos descritos por Yeung et al. para neutralizar el cambio osmolar y se conserva la viabilidad celular, pudiéndose emplear estos espermatozoides en reproducción asistida.
El análisis de los resultados al aumentar la osmolaridad del plasma seminal, nos muestran que se produce un aumento del volumen cefálico y un aumento de la longitud del eje transversal del espermatozoide de forma significativa (p<0,05), por lo que crecen las subpoblaciones macrocefálicas aunque de forma no significativa y disminuyen las microcefálicas de forma significativa (p<0,05). Esta variación de tamaño más acusada que en otro experimento y con un mayor número de pacientes, podría explicarse por mecanismos opuestos a los descritos anteriormente, en un proceso conocido como regulatory volume increase. Este proceso, menos estudiado en la bibliografía que el RVD, podría haber sido más fácilmente detectado que el RDV debido a nuestras condiciones experimentales, proponiéndose que podrían haber superado la capacidad del regulatory volume increase conduciendo a una desestructuración de la membrana plasmática debido al shock hiperosmolar que puede producir la alta concentración de fosfato. La hipótesis de la desestructuración de la membrana quedaría reforzada por la pérdida significativa de la viabilidad observada en los espermatozoides, que los inhabilita para su utilización en reproducción asistida.
Con los resultados de estos ensayos podemos concluir que la osmolaridad del plasma seminal no parece estar relacionada con la morfología del espermatozoide, confirmando que esta se establece en el microambiente del epidídimo (Cooper, 1986; Cooper, 2011), en los 10-15 días en que el espermatozoide sufre un proceso de maduración desde la cola del epidídimo hasta su cabeza. La osmolaridad podría no ser uno de los muchos factores determinantes que hace que la cabeza del espermatozoide adquiera una forma alargada o piriforme en los varicoceles (American Urological Association and the practice committee of American Society for Reproductive Medecine, 2004; Jarow et al., 1996; Wein et al., 2008) y redonda en la diabetes. Parámetros como el reactive oxygen substances y antioxidant total capacity pueden ser factores coadyuvantes de la forma que adquiera el espermatozoide y que permanece inalterable hasta su depósito en la vagina (Baker y Aitken, 2005; Homa et al., 2015; Pasqualotto et al., 2008; Plessis et al., 2015). Nuestros estudios in vitro han constatado que la morfología del espermatozoide no es una característica que pueda ser modificada de una manera significativa por los cambios de osmolaridad del plasma seminal. Aunque se evidencian alteraciones por mecanismos compensatorios propios de la célula, la osmolaridad del plasma seminal no es suficiente para modificar la morfología del espermatozoide aun con los valores más extremos en los que se alcanza la pérdida de viabilidad. Sería el periodo de tiempo de maduración del espermatozoide en el epidídimo el que establece la forma del espermatozoide y, por ende, también la disminución en la fertilidad de las formas anómalas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
Conflictos de interesesLos autores declaran no tener ningún conflicto de intereses.