Aplicación de la estandarización de la morfología espermática humana, con la metodología tipo ASMA (assisted sperm morphometry analysis), en el análisis de las subpoblaciones espermáticas para diversas patologías.
Material y métodosSe han estudiado 703 pacientes, clasificados en 7 grupos en función de su diagnóstico, de los que se analizan las subpoblaciones de espermatozoides. Los grupos de patología son: infertilidad, factor masculino en el contexto de estrés (ansiedad, insomnio y/o depresión), diabetes tipo 1 o 2, varicocele, infecciones del sistema urogenital, oncológicos y otras endocrinopatías. La morfología automatizada se ha realizado con el analizador de semen SCA 5.4 (Sperm Class Analyzer) (Microptic S.L., Barcelona, España), tipo ASMA, siguiendo el protocolo de pretratamiento y de tinción descrito anteriormente por nuestro grupo de trabajo.
ResultadosLa realización de la morfología automatizada nos muestra que el estudio de subpoblaciones de espermatozoides presenta utilidad clínica para el diagnóstico de varicocele. En estos pacientes, valores superiores al 30% de espermatozoides alargados presentan una sensibilidad diagnóstica del 37% y una especificidad del 79% (odds ratio de 1,54, con un intervalo de confianza al 95% de 1,05-2,26). En el estudio de infertilidad, las subpoblaciones han mostrado que podrían ser un factor pronóstico y de orientación al tipo de técnica de reproducción asistida más aconsejable. En los grupos de diabetes y de estrés se han identificado nuevas subpoblaciones que podrían ser de utilidad diagnóstica.
DiscusiónLa estandarización y la automatización de la morfología espermática reducen los coeficientes de variación del análisis, permitiendo realizar el estudio de subpoblaciones de espermatozoides en pacientes con diversas patologías, con una mayor fiabilidad analítica. En el caso de pacientes con varicocele, presenta utilidad clínica como ayuda diagnóstica. En el resto de grupos se han identificado nuevas subpoblaciones no descritas anteriormente, pudiendo constituir nuevas herramientas diagnósticas, a pesar de que se requeriría un aumento de la casuística.
Use is made of computer-assisted sperm morphometry analysis (ASMA) in order to analyse sub-populations as a function of several pathologies.
Material and methodsA total of 703 patients were classified into 7 pathology groups, and their sperm sub-populations were analysed. Pathology groups were classified into infertility, male factor stress (anxiety, insomnia and/or depression), diabetes mellitus type 1 or 2, varicocele, urogenital infections, oncological patients, and other endocrine diseases. Morphological analysis was performed using the semen analyser system SCA 5.4 (Sperm Class Analyzer) (Microptic S.L., Barcelona, Spain). Pre-treatment and staining method used has been previously described by this group.
ResultsAutomatic human sperm morphology showed that the study of sperm sub-populations has a clinical usefulness in the diagnosis of varicocele. Higher values of 30% elongated sperms had a sensitivity of 37% and a specificity of 79% (1.54 odds ratio with a 95% confidence interval from 1.05 to 2.26). Furthermore, groups of infertility, stress, and diabetes showed new sperm sub-populations which had not been described previously, so they could become a new diagnostic tool.
DiscussionThe coefficients of variation of sperm morphology were decreased using automation, enabling the study sperm subpopulations in different pathologies. There is a diagnostic usefulness for varicocele. There could be a prediction to choose the best assisted reproductive technique for infertility patients. However, for the rest of groups new sperm subpopulations could be identified that could make it a diagnostic tool, but requires a higher casuistry to conclude the study.
El varón puede producir hasta 300 millones de espermatozoides diarios. El análisis de los espermatozoides muestra una gran heterogeneidad de tamaños y formas (Yániz et al., 2015; Thurston et al., 1999), y se ha señalado que esta se presenta en función de factores intrínsecos como edad, madurez, actividad sexual, período de abstinencia previo al estudio y genética del individuo (Mayorga-Torres et al., 2015; Sharma et al., 2015), o dependiendo de factores extrínsecos como nutrición, hábitos tóxicos, factores ambientales, epigenéticos, etc. (Radwan et al., 2016). Se plantea que dicha heterogeneidad podría estar relacionada fisiológicamente para cubrir la propia diversidad de los receptores de la capa pelúcida del oocito (Yániz et al., 2015; Soler et al., 2014;Soler et al., 2015) o para asegurar un mayor potencial de fertilización del oocito durante el impredecible intervalo de tiempo después de la eyaculación (Maroto-Morales et al., 2012; Saacke et al., 2000).
La estandarización de la morfología espermática, para el estudio de las subpoblaciones espermáticas, con sistemas de análisis de semen automáticos tipo ASMA (assisted sperm morphometry analysis), no ha conseguido la implantación deseada en nuestros laboratorios. Se han señalado varias causas, como las diferentes modalidades de pretratamiento a las que se puede someter el semen y/o los diversos tipos de tinciones, tanto específicas como genéricas (Barroso et al., 1999; Van der Horst y Maree, 2009). A pesar de ello, creemos que además de estas causas también se debe indicar la falta de consenso en la unificación de criterios científicos válidos. Algunos profesionales siguen los criterios de la OMS (WHO, 2010), otros los criterios estrictos de Kruger (Kruger y Coetzee, 1999), y otros siguen los de la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) (Kvist y Bjorndahl, 1999). En Europa se utilizan mayoritariamente otras clasificaciones, como la de Menkveld (Menkveld et al., 1990) o la de Blanchard (Blanchard et al., 2011). Esta diferencia de criterios ha sido propiciada por la falta de un gold standard de la morfología espermática. Sí es cierto que existen trabajos, como por ejemplo el del desarrollo del sistema Truemorph®, que analiza el espermatozoide en fresco sin necesidad de fijar ni teñir, que pueden ayudar a crear un gold standard de la morfología que facilitaría la unificación de criterios (Soler et al., 2014; Soler et al., 2015). Por otro lado, la importancia del parámetro de morfología es una constante que se repite en todos los estudios clínicos de fertilidad, remarcando la importancia de la relación entre la tasa de fertilidad y el porcentaje de morfología normal (Menkveld et al., 2011; Ombelet et al., 2014). También se ha señalado la importancia del estudio morfológico en el caso de globozoospermias y macrozoospermias, donde hay un predominio de formas redondas o macrocefálicas, respectivamente, debido a alteraciones que comprometen seriamente su fertilidad (Achard et al., 2007; De Braekeleer et al., 2015). Finalmente, es importante señalar que la morfología realizada manualmente presenta altos coeficientes de variación (Álvarez et al., 2005) y requiere una prolongada formación. Dada la elevada heterogeneidad que se presenta en el eyaculado, los métodos manuales no permitirían la cuantificación de una manera fiable de las subpoblaciones espermáticas, las cuales solo son identificables con métodos automatizados tipo CASA/ASMA, que incorporan algoritmos matemáticos para la identificación y cuantificación de estas.
Por todo lo expuesto, en una primera etapa de nuestro estudio estandarizamos el proceso de pretratamiento y tinción hallando los valores de referencia para este método (Ramírez et al., 2016). Como segunda etapa, en este trabajo realizado se pretende estudiar las subpoblaciones de espermatozoides en diversas patologías como infertilidad, estrés, diabetes, varicocele y patología urogenital infecciosa.
Material y métodosSe han estudiado 703 pacientes con una media de edad de 36,2 años y un rango de entre 15 y 59 años. La procedencia de estos fue: 202 pacientes del servicio de esterilidad y reproducción asistida de nuestro hospital (29%), 444 de centros de atención primaria externos (63%), solicitados por médicos de familia, urólogos y ginecólogos, y 57 pacientes de otras procedencias (8%). En la entrega de muestra los pacientes firmaron un impreso normalizado por el comité de bioética del hospital, dando su consentimiento para la utilización de los resultados del análisis para estudios epidemiológicos.
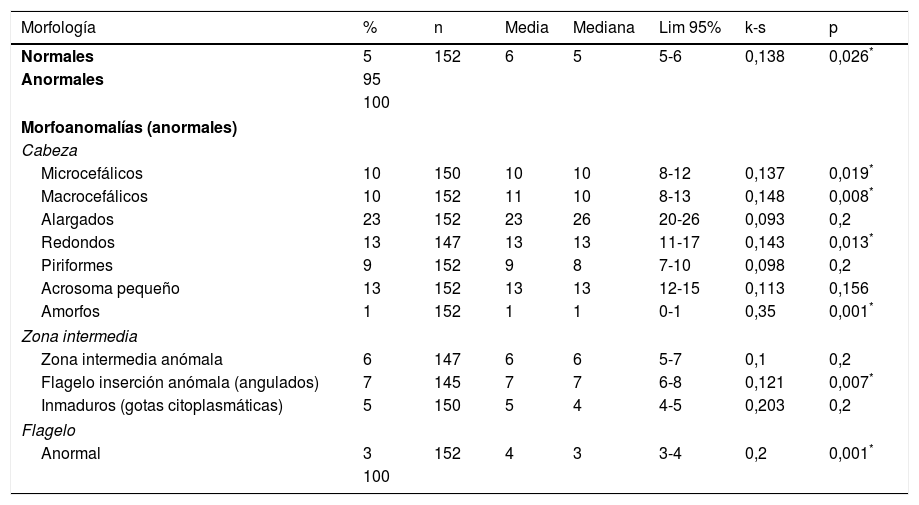
Para la realización de la morfología espermática de una manera automatizada se ha utilizado el analizador de semen SCA 5.4 (Sperm Class Analyzer) (Microptic S.L, Barcelona, España) tipo CASA/ASMA. Se han analizado alrededor de 200 espermatozoides por cada muestra de semen, y con ello se ha obtenido el porcentaje de formas normales como resultado principal del informe. También se ha creado una nueva plantilla adicional subtitulada «Morfoanomalías» o «Morfología avanzada», en la que se muestra el porcentaje para cada una de las alteraciones de la cabeza, la zona intermedia y la cola del espermatozoide (tabla 1), siguiendo el modelo del francés de David modificado (Auger et al., 2000). De nuestro estudio preliminar se ha establecido un protocolo de pretratamiento, para muestras con una concentración inferior a 40×106 espermatozoides/mL. Este consiste en un centrifugado a 300g durante 5min, la separación del plasma y el sobrenadante y, por último, la resuspensión del pellet de espermatozoides en 0,2mL del propio plasma seminal (Ramírez et al., 2016). Para todas las muestras se realiza el frotis con un extensor semiautomático Hemaprep (CellaVision). La tinción se realiza siguiendo el protocolo preestablecido por nuestro grupo mediante el equipo Haemacolor modificado (Merck). Se tampona el reactivo fijador con buffer fosfato al 10% a pH 7,2, que estabiliza la fijación y sube su osmolaridad, y se varían los tiempos a una fijación de 5s, tinción con el primer colorante Eosina de 30s y tinción con el segundo colorante Azur B de 2s. Finalmente, se lava con tampón fosfato pH 7,2 y se deja secar al aire (fig. 1) (Ramírez et al., 2016).
Informe plantilla de configuración del SCA del estudio de la morfología avanzada y valores de referencia actualizados (Ramírez et al., 2016)
| Morfología | % | n | Media | Mediana | Lim 95% | k-s | p |
|---|---|---|---|---|---|---|---|
| Normales | 5 | 152 | 6 | 5 | 5-6 | 0,138 | 0,026* |
| Anormales | 95 | ||||||
| 100 | |||||||
| Morfoanomalías (anormales) | |||||||
| Cabeza | |||||||
| Microcefálicos | 10 | 150 | 10 | 10 | 8-12 | 0,137 | 0,019* |
| Macrocefálicos | 10 | 152 | 11 | 10 | 8-13 | 0,148 | 0,008* |
| Alargados | 23 | 152 | 23 | 26 | 20-26 | 0,093 | 0,2 |
| Redondos | 13 | 147 | 13 | 13 | 11-17 | 0,143 | 0,013* |
| Piriformes | 9 | 152 | 9 | 8 | 7-10 | 0,098 | 0,2 |
| Acrosoma pequeño | 13 | 152 | 13 | 13 | 12-15 | 0,113 | 0,156 |
| Amorfos | 1 | 152 | 1 | 1 | 0-1 | 0,35 | 0,001* |
| Zona intermedia | |||||||
| Zona intermedia anómala | 6 | 147 | 6 | 6 | 5-7 | 0,1 | 0,2 |
| Flagelo inserción anómala (angulados) | 7 | 145 | 7 | 7 | 6-8 | 0,121 | 0,007* |
| Inmaduros (gotas citoplasmáticas) | 5 | 150 | 5 | 4 | 4-5 | 0,203 | 0,2 |
| Flagelo | |||||||
| Anormal | 3 | 152 | 4 | 3 | 3-4 | 0,2 | 0,001* |
| 100 | |||||||
Resultado de las imágenes para el análisis de la morfología de los espermatozoides tras el pretratamiento y la tinción descritos por nuestro grupo (Ramírez et al., 2016), a través de la metodología SCA (Microptic S.L., Barcelona, España).
Como método de evaluación se utiliza un análisis de clústeres, técnica estadística multivariante de clasificación (Vilà-Baños et al., 2014), ya aplicado al estudio del semen por varios autores (Vásquez et al., 2016). Esta técnica nos permite detectar y describir subgrupos de sujetos o variables en función de los valores observados dentro de un conjunto aparentemente homogéneo.
Los cálculos de los resultados se efectuaron con los programas estadísticos SPSS (IBM Corp. Released 2010. IBM SPSS Statistics for Windows, Version 19.0, Armonk, NY) y MedCalc 10.0.2.0 (MedCalc Software, Mariakerkem, Bélgica) y Stat 14.2 (Statacorp, Texas, EE.UU.)
ResultadosBasándonos en nuestra técnica de pretratamiento, tinción y procesado, pudimos obtener los valores de referencia para la morfología espermática (tabla 1). Los 703 seminogramas se analizaron durante un período de 9 meses, en los cuales nos centramos en el estudio morfológico avanzado para cuantificar las subpoblaciones de espermatozoides. En muestras con severa oligozoospermia no fue posible realizar la morfología automatizada y se realizó de forma manual, pero siguiendo los mismos criterios utilizados para la corrección de las imágenes procesadas automáticamente en el SCA. En el análisis preliminar de los resultados de los sémenes estudiados, con respecto al número de espermatozoides normales y patológicos, y siguiendo la normativa de la OMS (WHO, 2010), obtuvimos 322 pacientes con un informe normal (46%) y 381 con un informe patológico (54%). Debido a esta elevada complejidad y elevado porcentaje de patología en nuestra Unidad de Andrología, se ha creído conveniente realizar el estudio estadístico de los resultados de la morfología avanzada clasificando a los pacientes en 7 grupos diagnósticos. El grupo 1 lo han constituido 293 pacientes (41%) procedentes de estudio de infertilidad de la pareja. El grupo 2, 111 pacientes (16%), de estudio del factor masculino con diagnóstico de estrés, en el contexto de ansiedad, insomnio y/o depresión. El grupo 3, 85 pacientes (12%), con diagnóstico de diabetes tipo 1 o 2. El grupo 4, 133 pacientes (19%) con diagnóstico de varicocele, en el cual se engloban pacientes con varicocele unilateral y bilateral, operados y sin operar. El grupo 5, 62 pacientes (9%), diagnosticados de infecciones en el sistema urogenital con cultivos positivos. El grupo 6, 12 pacientes (2%) oncológicos. Y, por último, el grupo 7, formado por 7 pacientes (1%) con diagnóstico de otras endocrinopatías.
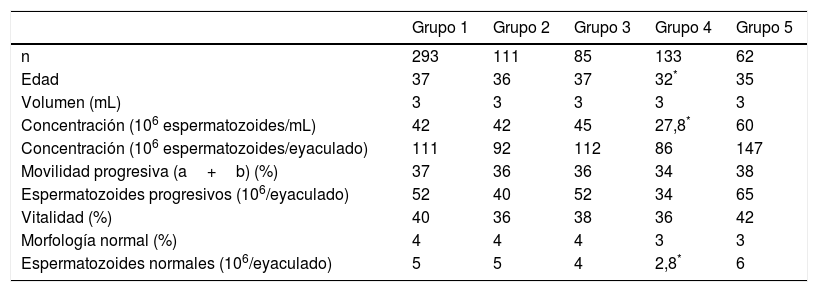
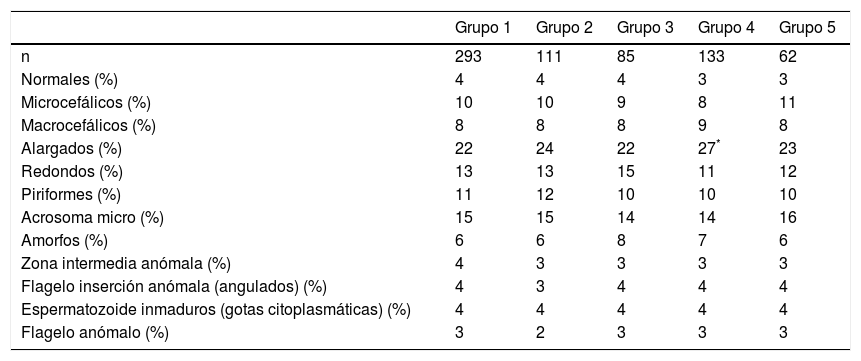
En la tabla 2 se muestran las medias de los resultados de cada parámetro del seminograma en cada uno de los grupos de estudio, exceptuando los grupos 6 y 7 los cuales presentan un número reducido de pacientes y no han sido considerados en el análisis estadístico. El análisis, aplicando el test estadístico de Anova, previa comprobación de homogeneidad de varianzas con el test de Levene, nos muestra que el grupo patológico de varicoceles (grupo 4) presenta un valor de la variable edad media significativamente menor que los demás grupos de estudio, con una concentración de 27,8×106 espermatozoides/mL (2,8×106 espermatozoides normales/eyaculado). Estos resultados, comparados con los otros grupos estudiados, son estadísticamente más bajos (p<0,05). En los demás grupos estudiados no se observa ninguna variable con diferencia significativa. Posteriormente se han calculado los valores de las medias de las subpoblaciones de espermatozoides que constituyen los parámetros de morfología avanzada, para cada uno de los grupos de patología reseñados (tabla 3). El análisis estadístico, aplicando el test estadístico de Anova, nos indica que el grupo de varicoceles (grupo 4) presenta una media de la subpoblación de espermatozoides alargados del 27%, con un intervalo de confianza (IC) al 95% de entre 25-29%, y que es estadísticamente superior respecto a los demás grupos estudiados (p<0,05). Para el resto de grupos no observamos ninguna diferencia significativa. A pesar de ello, sí es cierto que en el grupo de pacientes diabéticos (grupo 3) se observa que la media de la subpoblación de espermatozoides redondos, con un 15%, es superior a la de los otros grupos, a pesar de que no alcanza el carácter de diferencia significativa (p=0,087).
Resultados medios de los parámetros de análisis del semen en cada patología estudiada
| Grupo 1 | Grupo 2 | Grupo 3 | Grupo 4 | Grupo 5 | |
|---|---|---|---|---|---|
| n | 293 | 111 | 85 | 133 | 62 |
| Edad | 37 | 36 | 37 | 32* | 35 |
| Volumen (mL) | 3 | 3 | 3 | 3 | 3 |
| Concentración (106 espermatozoides/mL) | 42 | 42 | 45 | 27,8* | 60 |
| Concentración (106 espermatozoides/eyaculado) | 111 | 92 | 112 | 86 | 147 |
| Movilidad progresiva (a+b) (%) | 37 | 36 | 36 | 34 | 38 |
| Espermatozoides progresivos (106/eyaculado) | 52 | 40 | 52 | 34 | 65 |
| Vitalidad (%) | 40 | 36 | 38 | 36 | 42 |
| Morfología normal (%) | 4 | 4 | 4 | 3 | 3 |
| Espermatozoides normales (106/eyaculado) | 5 | 5 | 4 | 2,8* | 6 |
Grupo 1: pacientes con estudio de infertilidad; grupo 2: pacientes con diagnóstico de estrés; grupo 3: pacientes con diabetes de tipo 1 o 2; grupo 4: pacientes con varicocele; grupo 5: pacientes con infección urogenital.
Estudio de las subpoblaciones de espermatozoides por grupos de patología
| Grupo 1 | Grupo 2 | Grupo 3 | Grupo 4 | Grupo 5 | |
|---|---|---|---|---|---|
| n | 293 | 111 | 85 | 133 | 62 |
| Normales (%) | 4 | 4 | 4 | 3 | 3 |
| Microcefálicos (%) | 10 | 10 | 9 | 8 | 11 |
| Macrocefálicos (%) | 8 | 8 | 8 | 9 | 8 |
| Alargados (%) | 22 | 24 | 22 | 27* | 23 |
| Redondos (%) | 13 | 13 | 15 | 11 | 12 |
| Piriformes (%) | 11 | 12 | 10 | 10 | 10 |
| Acrosoma micro (%) | 15 | 15 | 14 | 14 | 16 |
| Amorfos (%) | 6 | 6 | 8 | 7 | 6 |
| Zona intermedia anómala (%) | 4 | 3 | 3 | 3 | 3 |
| Flagelo inserción anómala (angulados) (%) | 4 | 3 | 4 | 4 | 4 |
| Espermatozoide inmaduros (gotas citoplasmáticas) (%) | 4 | 4 | 4 | 4 | 4 |
| Flagelo anómalo (%) | 3 | 2 | 3 | 3 | 3 |
Grupo 1: pacientes con estudio de infertilidad; grupo 2: pacientes con diagnóstico de estrés; grupo 3: pacientes con diabetes de tipo 1 o 2; grupo 4: pacientes con varicocele; grupo 5: pacientes con infección urogenital.
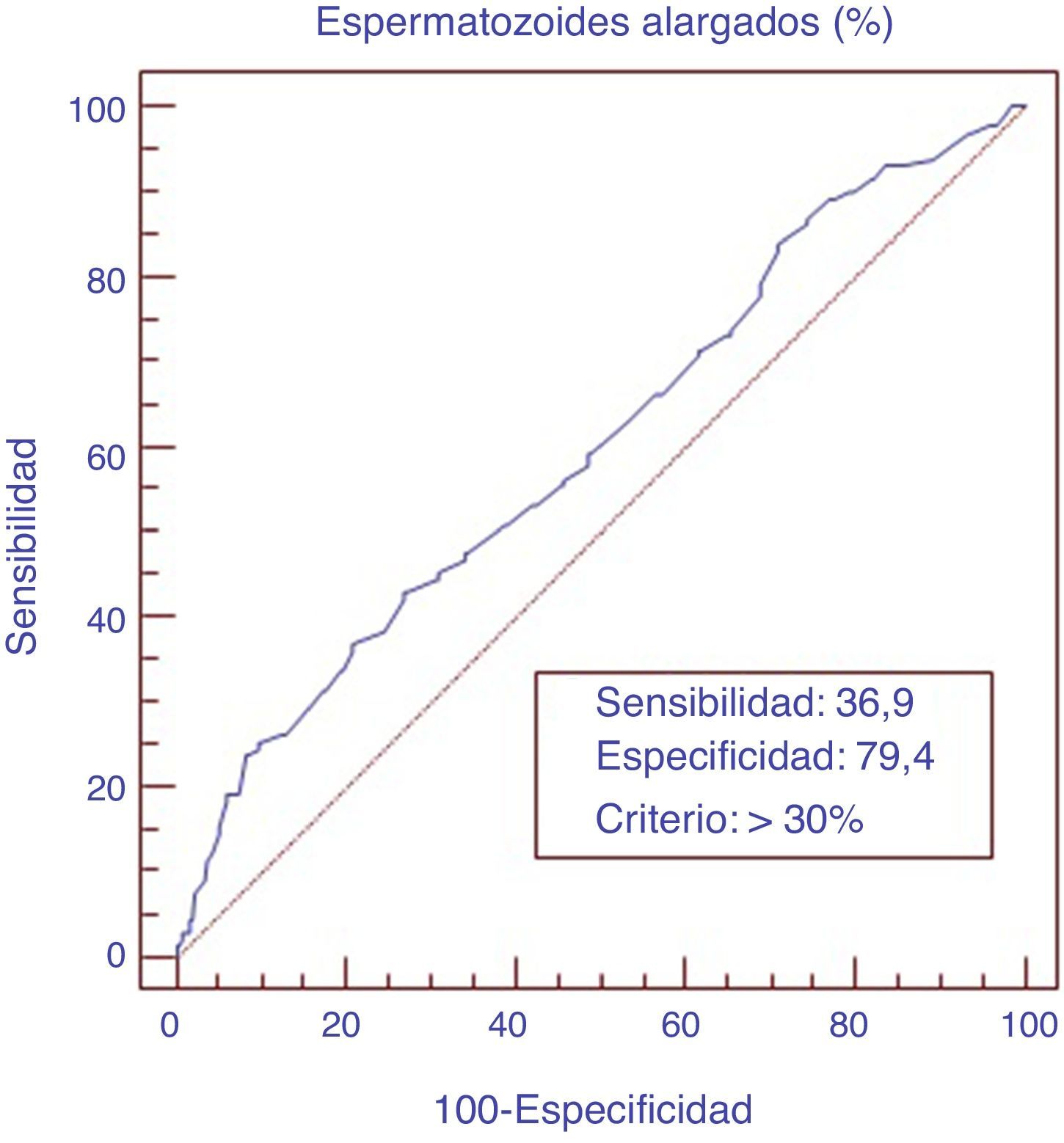
Aplicando las curvas receiver operating characteristic (ROC), para el grupo de pacientes con diagnóstico de varicocele, se observa que valores superiores al 30% de espermatozoides alargados presentan una sensibilidad diagnóstica del 36,9%, con un IC de 28,6-46,8%, una especificidad del 79,4%, con un IC de 75,6-82,8%, y una odds ratio (OR) de 1,51, con un IC de 1,05-2,16. Por otro lado, el área bajo la curva (AUC) obtenida es de 0,603, con un IC del 95% de 0,56-0,64 (fig. 2). Con valores superiores al 40% de espermatozoides alargados, la OR sube progresivamente a 2,47 (IC: 1,23-4,96), y con un 50% de estos se obtiene una OR de 3,91 (IC: 0,79-19,17). Cuando encontramos un 25-30% de espermatozoides alargados, intervalo de ventana gris para el diagnóstico positivo de varicocele, si le sumamos el porcentaje de espermatozoides piriformes la sensibilidad sube a un 45%, la especificidad a un 83,3% y la OR a 2,43 (IC: 1,7-3,4). Este hecho viene explicado porque el analizador SCA tiene dificultades para clasificar entre alargados y piriformes. De esta manera, un valor superior al 12% de morfología piriforme también tendría valor diagnóstico para el varicocele.
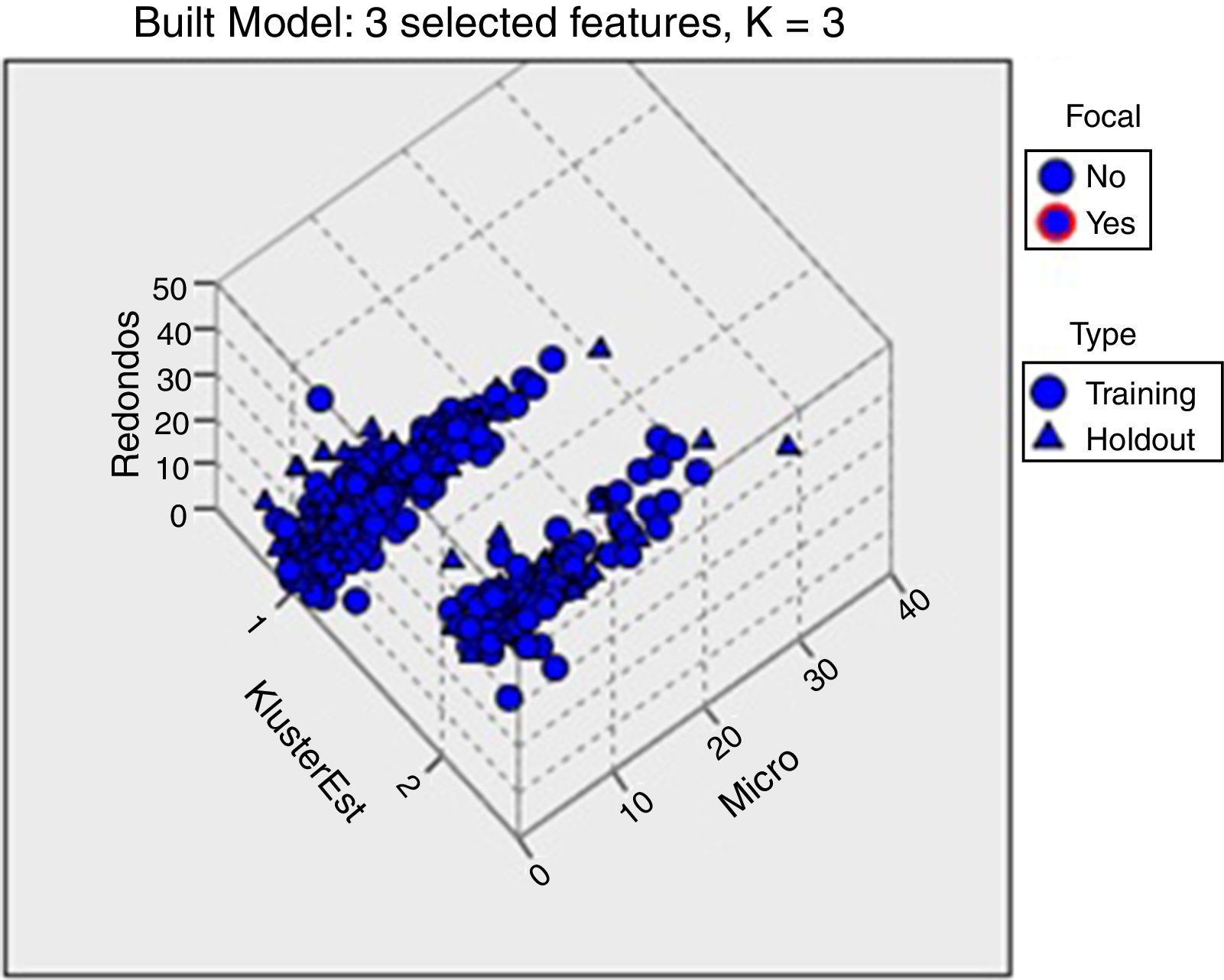
Dado que la clasificación de los pacientes por diagnóstico que se ha utilizado en este trabajo es muy genérica, hemos aplicado el análisis de clúster (Vilà-Baños et al., 2014; Vásquez et al., 2016) para identificar los subgrupos de pacientes que presentan resultados similares de los nuevos parámetros de la morfología avanzada. El análisis de clúster se inicia seleccionando de una base de datos todos los pacientes con diagnóstico común y los resultados de morfología avanzada que presentan, y aplicamos la metodología de clúster jerárquico al estudio de todas las variables de la morfología avanzada. En el caso de pacientes del grupo 1, se identifica un subgrupo de 86 pacientes que presentan el aumento significativo de la subpoblación de espermatozoides microcefálicos (12%) y de forma redondeada (23%). Hemos aplicado el test Anova observándose diferencias significativas respecto al resto del subgrupo, 207 pacientes, con un 9% de microcefalia y un 8% de formas redondeadas (fig. 3). La identificación de este subgrupo significativo dentro del grupo de infertilidad podría tener interés clínico para analizar los resultados de las técnicas de reproducción asistida a las que se someten los pacientes que integran este subgrupo, así como también su tasa de fertilidad.
Análisis de clúster del grupo de pacientes con diagnóstico de infertilidad (grupo 1). Se observa, en el clúster 1, un subgrupo de pacientes con una media del 9% de espermatozoides microcefálicos y del 8% de redondos. En el clúster 2, un subgrupo de pacientes con una media del 12% de espermatozoides microcefálicos y del 23% de redondos.
En los grupos de diagnóstico restante observamos que el grupo 2, 111 pacientes con diagnóstico de estrés, presenta un subgrupo de 33 pacientes con valores superiores de la subpoblación de espermatozoides microcefálicos (16%) y con acrosoma micro (18%). El grupo 3, 85 pacientes con diagnóstico de diabetes, muestra un subgrupo de 43 pacientes que presentan como principal característica un aumento significativo de la subpoblación de espermatozoides redondos (21%). El grupo 4, 133 pacientes con varicocele, muestra un subgrupo de 43 pacientes con una media del 39% de espermatozoides alargados frente a una media del 20% en el resto de pacientes de ese mismo grupo de diagnóstico. Para los grupos 6 y 7 no se ha aplicado el análisis clúster debido al reducido número de pacientes que los integran.
DiscusiónEn este trabajo se presenta la aplicación clínica de la estandarización del análisis de la morfología espermática con sistemas automáticos tipo CASA/ASMA para el estudio de diversas patologías. Esta estandarización nos ha permitido verificar la gran heterogeneidad que presentan los espermatozoides existentes en un eyaculado (Thurston et al., 1999; Yániz et al., 2015) y poder cuantificar de una manera más fiable las subpoblaciones de espermatozoides. Se ha postulado la hipótesis de que las diferentes subpoblaciones en las especies heteromorfas, como la humana, pueden trabajar sinérgicamente para alcanzar el éxito en la fertilización, o para asegurar un mayor potencial de fertilización del oocito en el impredecible intervalo de tiempo después de la eyaculación (Maroto-Morales et al., 2012; Saacke et al., 2000). Esta heterogeneidad se ha constatado al realizar los valores normales en una población de 152 pacientes que presentaron un seminograma normal (tabla 2). A pesar de la gran variación interindividual registrada, hemos establecido unos límites de referencia mínimos en la cuantificación de las subpoblaciones de espermatozoides que nos permiten abordar el estudio de diversas patologías. Sí debemos resaltar que hemos constatado que la presencia de subpoblaciones espermáticas con valores superiores a la normalidad puede cursar de una forma subclínica, por lo que solamente se puede poner de manifiesto ante casos de abortos de repetición o infertilidad en la pareja.
En el análisis de los grupos de patologías que se han estudiado, la cuantificación de las subpoblaciones espermáticas para pacientes con varicocele es el grupo que mayores prestaciones diagnósticas nos ofrece (Vásquez et al., 2016). El aumento del porcentaje de espermatozoides alargados y piriformes en este tipo de pacientes ya ha sido descrito cualitativamente en la bibliografía (Dohle et al., 2010), pero en el presente trabajo hemos establecido los IC y OR diagnósticos para estas. El cálculo de las curvas ROC, que son el máximo exponente de estudio del valor diagnóstico de un test (Zweig y Campbell, 1993), para los resultados de las subpoblaciones espermáticas de los varicoceles, mostraba que valores superiores al 30% de espermatozoides alargados presentaban una sensibilidad en el diagnóstico del varicocele del 36,9%, una especificidad del 79,4% y una OR de 1,51. Por otro lado, se calcula la AUC de la curva ROC obteniendo un valor de 0,603. Diversos autores ya describen que el parámetro de porcentaje de espermatozoides alargados puede emplearse como ayuda en el diagnóstico de varicocele (Swets y Pickett, 1982). También se comprueba que valores superiores al 40% de espermatozoides alargados aumentan la OR a 2,47, y valores superiores al 50%, a 3,91. Además, se ha encontrado que la suma del porcentaje de espermatozoides alargados más piriformes aumenta la sensibilidad de detección del varicocele al 45% y la especificidad al 83,3%, con una OR de 2,43, ya que en los varicoceles también aumenta la presencia de estos últimos (WHO, 2010). Remarcamos que a pesar de que el diagnóstico de varicocele se realiza con la exploración física testicular, complementada con la realización de exploraciones como ecografía doppler o termografía testicular (Dohle et al., 2010; McDougal et al., 2014), es un hecho constatado que en nuestras consultas de esterilidad nos encontremos con un número importante de varicoceles subclínicos. Por ello, el estudio de las subpoblaciones de espermatozoides de estos pacientes podría ser una ayuda sencilla de orientación positiva al diagnóstico. Destacamos que, en el estudio de este grupo, aplicando el análisis clúster, este nos muestra un subgrupo de 43 pacientes con una elevación significativa de espermatozoides alargados, con una media del 39%, frente al resto del subgrupo, cuya elevación media era del 20%. El análisis de las historias clínicas de pacientes, diagnosticados con varicocele, no nos daba ninguna explicación sobre si la diferencia encontrada es referida a que se trate de un varicocele unilateral o bilateral, y/o se trate de un paciente que haya sido intervenido quirúrgicamente o no. Pero no por ello, pensamos que el aumento de la casuística de este grupo podría ayudar a encontrar una explicación clínica a esta subdivisión.
Respecto a los otros grupos estudiados, observamos que en pacientes con diagnóstico de esterilidad no se observa ninguna subpoblación con diferencia significativa. Sí es cierto que, al aplicar la técnica estadística de clúster, se observa un subgrupo de 86 pacientes que presentaban un aumento significativo de espermatozoides microcefálicos y redondos (fig. 3). Con dichos resultados podríamos plantear la hipótesis de que la historia clínica de estos pacientes, junto con los resultados que se obtengan de las técnicas de reproducción asistida a las que se les someta, nos podría orientar sobre escoger la técnica de reproducción asistida más adecuada. Por este mismo planteamiento, en el grupo 2 —pacientes con diagnóstico de estrés— se localiza un subgrupo con elevación significativa de espermatozoides microcefálicos, ya anteriormente descrita (Giblin et al., 1988; Auger et al., 2001), y que puede relacionarse con problemas de fertilidad. En pacientes diabéticos ya se encuentran estudios en los que se observa una variación de la calidad seminal respecto a pacientes no diabéticos (Singh et al., 2014; La Vignera et al., 2015). Nosotros hemos identificado un subgrupo con un aumento de espermatozoides redondos con acrosoma micro, lo que podría explicar la menor tasa de fertilidad espontánea (Dohle et al., 2010), pudiendo relacionarse con los cambios metabólicos bioquímicos descritos en estos pacientes. Independientemente de un diagnóstico de diabetes, sí se ha descrito que el aumento de espermatozoides redondos en pacientes afectos de globozoospermia, parcial o total, presenta severos problemas de fertilidad (Achard et al., 2007; De Braekeleer et al., 2015).
Concluimos que, en las próximas generaciones de analizadores de muestras de semen, la incorporación de un estudio morfológico de las subpoblaciones espermáticas al seminograma de rutina podría ser una nueva herramienta diagnóstica de estudio de la infertilidad de la pareja e incluso de otras patologías urológicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.