En mujeres con una respuesta pobre a la estimulación de la ovulación (1-3 ovocitos) o subóptima (4-9 ovocitos), no es infrecuente obtener ovocitos inmaduros. Cuando este porcentaje es superior al 50% se le denomina asincronía folicular. Nuestro objetivo fue analizar, en mujeres de edad materna avanzada y una respuesta subóptima a la estimulación ovárica, la influencia de presentar asincronía folicular en los resultados del ciclo de ICSI.
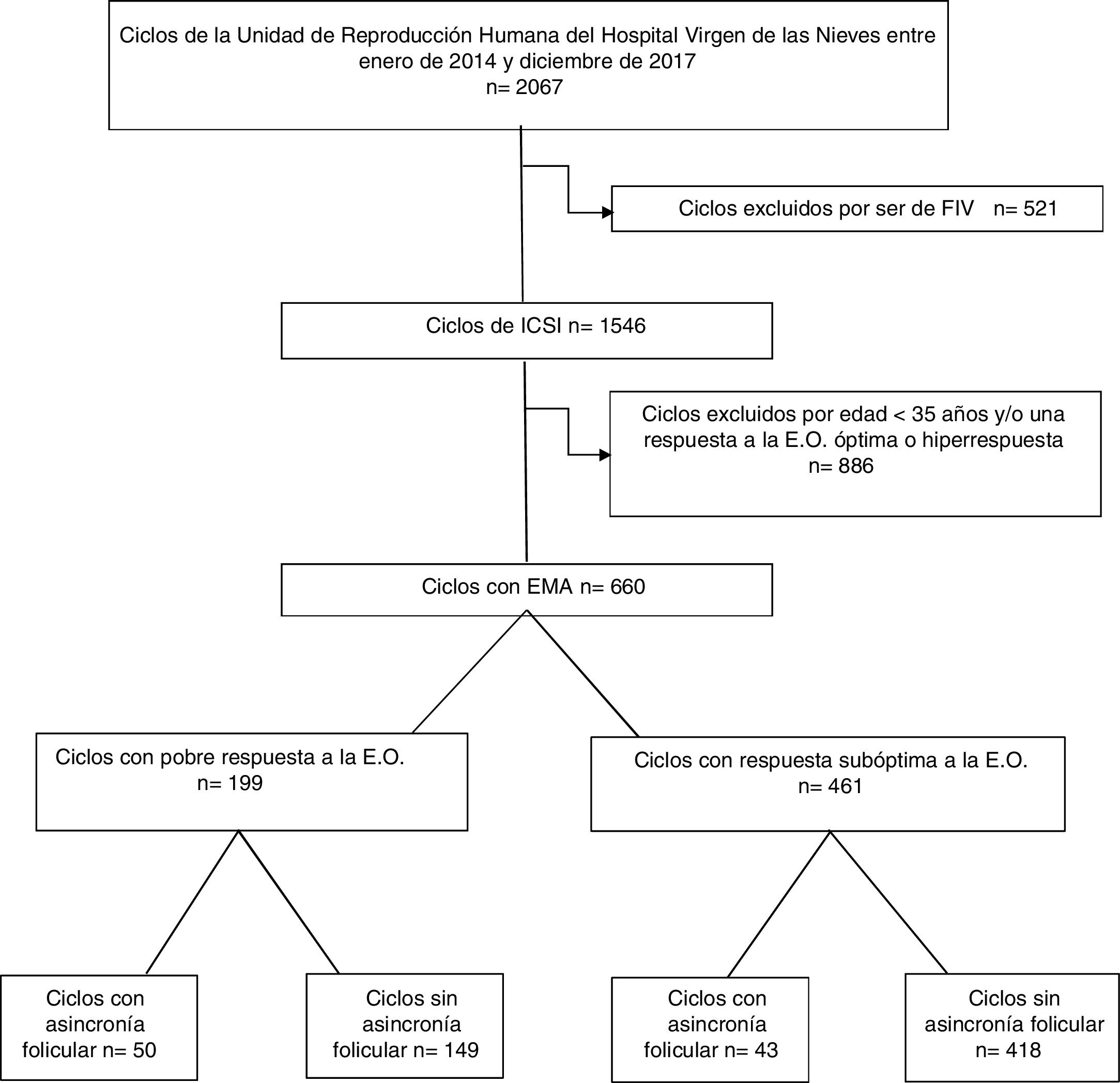
Material y métodosSe ha realizado un estudio retrospectivo de 660 pacientes de edad materna avanzada sometidas a ciclos de ICSI con ovocitos propios y frescos, entre enero de 2014 y diciembre de 2017. De los cuales, 199 ciclos tuvieron una pobre respuesta y 161 una respuesta subóptima. Dentro de este último grupo, 43 presentaban asincronía folicular y 418 no.
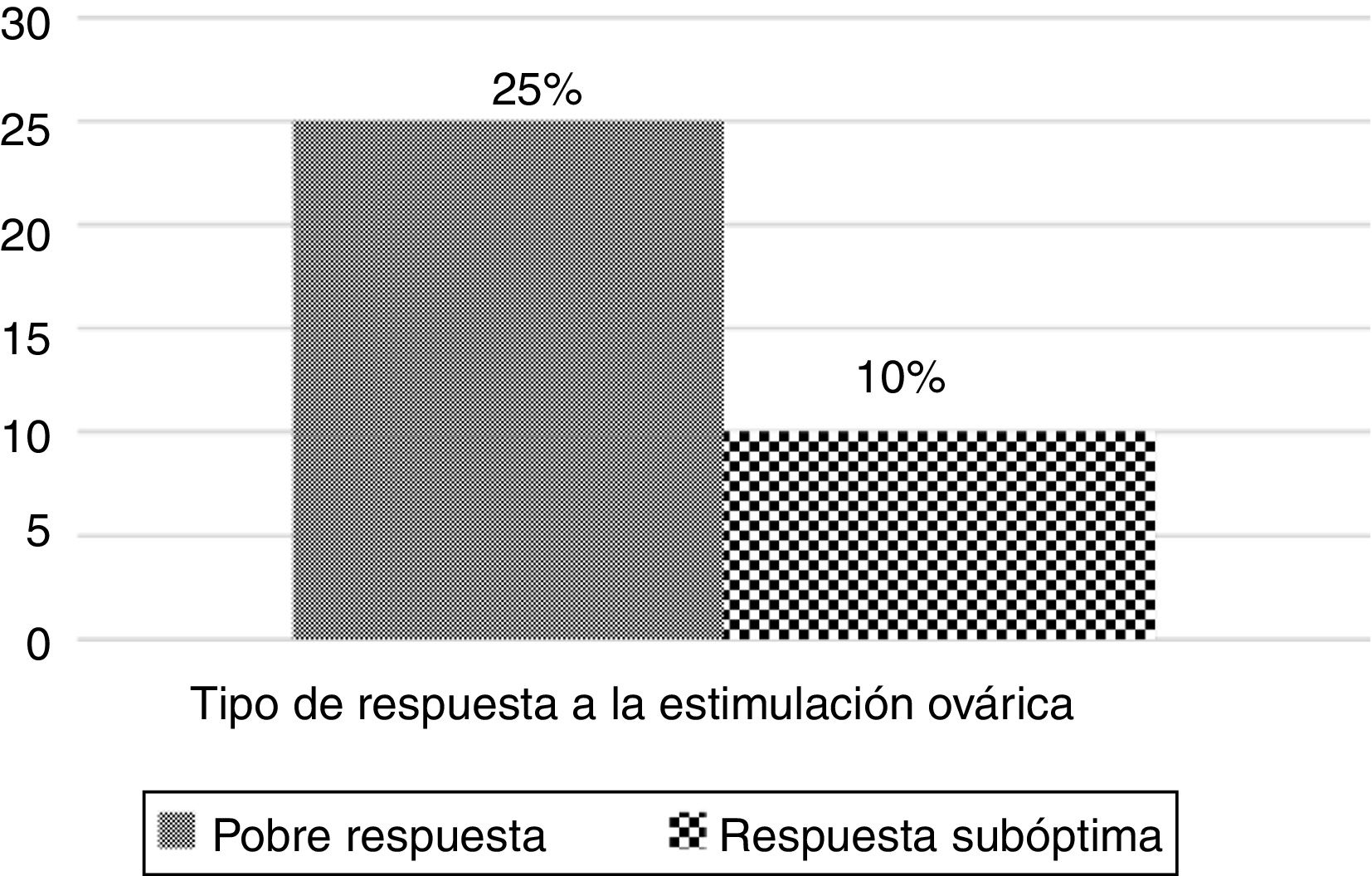
ResultadosDel total de ciclos con respuesta pobre a la estimulación (199), el 25% de ellos presentaban asincronía folicular (50), mientras que en el grupo de pacientes con una respuesta subóptima a la estimulación ovárica (461), solo el 10% presentaron esta característica (43). No se observaron diferencias significativas entre ciclos con y sin asincronía folicular en la tasa de fecundación, ni en el porcentaje de embriones utilizados. Los resultados obstétricos y neonatales son similares entre los grupos, no habiendo diferencias en la tasa de abortos (14,28 vs. 35,24%) y tampoco en la tasa de parto por TE (27,27 vs. 22,44%; N.S.), solamente en el peso de los recién nacidos (3.506±464 vs. 2.906±537; p<0,01), siendo menor en el de mujeres sin asincronía porque fue el grupo donde se dieron casos de gestación múltiple.
ConclusionesSi solo se considera la transferencia en fresco, la asincronía folicular no tiene importancia clínica en mujeres de edad materna avanzada con respuesta subóptima a la estimulación de la ovulación en un programa de ICSI.
Women with poor (1-3 oocytes) or suboptimal response (4-9) to ovarian stimulation usually give immature oocytes. When this percentage is bigger than 50%, this situation is known as follicular asynchronism. We focused on women with advanced maternal age and suboptimal response to ovarian stimulation and the relevance that follicular asynchronism could have in ICSI procedure.
Material and methodsWe have carried out a retrospective project, between January 2014 - December 2017, in which we have analyse 660 patients with advanced maternal age and who have been subjected to ICSI procedure with own and fresh oocytes. In this group, we found 199 patients who had a poor response and 161 patients with suboptimal response to ovarian stimulation. In the last group, 43 had follicular asynchronism and 418 patients had not this characteristic.
ResultsIn the group with poor response to ovarian stimulation (199), follicular asynchronism was showed in 25% of them, whereas patients with suboptimal response (461), only the 10% had this characteristic. We did not find significant differences between patients with follicular asynchronism or without this feature, related to fertilization rate or used embryos percentage. In order to obstetrical and gynaecological results, these are similar between groups. We did not realized differences in miscarriage rate (14,28 vs.35,24%) and it had not dissimilarity in labour rate / TE (27,27 vs. 22,44%; N.S.). We only found deviation in newborńs weight, which was fewer in patients without follicular asynchronism because in this group had more multiple gestation than in the group of patients with follicular asynchronism.
ConclusionTo sum up, the number of immature oocytes does not have effect on the rest of mature oocytes in the same cohort, when the patients are women with advanced maternal age and have a suboptimal response to ovarian stimulation, as long as, we only consider fresh transfer.
La esterilidad se define como la incapacidad de quedar gestante tras 12 meses de relaciones sexuales sin métodos anticonceptivos. Es uno de los principales problemas de salud que afronta la población actual. Gracias a las técnicas de reproducción humana asistida, muchas de estas parejas pueden ver cumplidos sus deseos genésicos.
Entre los factores determinantes en los tratamientos de reproducción asistida, y más concretamente dentro de los programas de fecundación in vitro, ICSI, se encuentra la edad y la reserva ovárica. Respecto a la primera, determina la calidad ovocitaria, ya que existe una relación directa entre la edad y las alteraciones cromosómicas ovocitarias y embrionarias (Munné y Cohen, 2017). La edad materna avanzada (EMA) se define como aquellas mujeres que son madres cuando tienen 35 años o más y se considera que hay un riesgo mayor de abortos y de obtener peores resultados obstétricos y perinatales (Goisis et al., 2017).
Respecto al segundo factor, la respuesta ovárica, nos indica la cantidad de ovocitos que podemos obtener tras la estimulación de la ovulación. Actualmente se considera una pobre respuesta cuando se obtienen 3 o menos ovocitos, una respuesta subóptima entre 4 y 9, óptima de 10 a 15 y una hiperrespuesta por encima de 15 ovocitos (Sunkara et al., 2014). Además de la cantidad, el grado de madurez de los ovocitos es una variable importante para el éxito de la reproducción asistida. En general, cerca del 85% de los ovocitos obtenidos son maduros y reproductivamente útiles, mientras que el 15% restante está todavía en fase de metafase i o estado de vesícula germinal. Los ovocitos inmaduros no son adecuados para los propósitos reproductivos y generalmente se descartan. Esta pérdida de ovocitos inmaduros no suele afectar negativamente a las oportunidades de embarazo cuando la respuesta ovárica es óptima. Sin embargo, en mujeres con baja reserva ovárica, además del bajo número de ovocitos, se añade la baja madurez que tienen los mismos cuando se obtienen después de la estimulación ovárica. Sus ovocitos suelen tener unas etapas madurativas más divergentes que los de las mujeres con buena reserva ovárica (Lee et al., 2016). Se conoce como asincronía folicular a la situación en la cual el porcentaje de ovocitos inmaduros es superior al 50% con respecto al resto de la cohorte.
Una asincronía folicular alta tiene poca relevancia en mujeres jóvenes, puesto que la capacidad implantatoria de los pocos embriones obtenidos a partir de ovocitos de mujeres jóvenes es alta, independientemente de la cohorte de la que vengan. Sin embargo, en el grupo de pacientes subóptimas, este porcentaje es clínicamente muy relevante. Se desconoce si un ciclo con una alta asincronía folicular afecta a los ovocitos maduros dentro de la misma cohorte en ciclos subóptimos. Por ello, nuestro objetivo fue saber si el número de ovocitos inmaduros, en mujeres de EMA con una respuesta subóptima a la estimulación de la ovulación, tenía alguna repercusión sobre el resto de la cohorte ovocitaria, en mujeres de las que se recupera un nivel de ovocitos subóptimo.
Material y métodosSe ha realizado un estudio retrospectivo, basado en los datos del programa de Reproducción Asistida del Hospital Universitario Virgen de las Nieves de Granada. Estos datos corresponden a ciclos realizados entre enero de 2014 y diciembre de 2017. Se analizó un total de 1.546 ciclos del programa de ICSI sometidos a estimulación de la ovulación, punción folicular y transferencia embrionaria (TE). Todas las pacientes tenían edades comprendidas entre los 18 y los 40 años. Los criterios de inclusión fueron: mujeres con EMA y respuesta a la estimulación de la ovulación pobre o subóptima. Las mujeres que cumplían estos criterios se clasificaron según la presencia o no de asincronía folicular (menos del 50% de los ovocitos recuperados en estadio de metafase ii el día de la punción folicular).
Este proyecto ha sido aprobado por el comité de ética de la investigación biomédica de Andalucía el 29 de abril de 2019.
Todas las pacientes de nuestro estudio fueron sometidas a un tratamiento de estimulación ovárica, con el fin de conseguir un desarrollo folicular múltiple. A las 36h del desencadenamiento de la ovulación, se lleva a cabo el proceso de punción folicular. Se incluyeron ciclos con semen de pareja y de donante. Posteriormente se realiza la microinyección intracitoplasmática de espermatozoides (ICSI). Previamente se ha evaluado la madurez de los ovocitos que hemos obtenido en la punción folicular. A primera hora del día siguiente lo que se hace es evaluar los signos de fecundación. Los embriones son evaluados en día 1 (D1), día 2 (D2) y día 3 (D3) de desarrollo embrionario, esto se lleva a cabo siguiendo los criterios de la Asociación Española para el Estudio de la Biología de la Reproducción (ASEBIR). Las TE se realizaron en D2 o D3 de desarrollo embrionario. Los embriones viables sobrantes tras la TE en fresco se vitrifican en D3 o D4.
El análisis estadístico de los datos obtenidos en este estudio se realizó mediante los paquetes estadísticos SSPS y Microsoft Excel. Las variables cualitativas se describen mediante su valor absoluto (n) y valor relativo (%). Se compararon entre grupos mediante el test de Chi-cuadrado, y en caso de no cumplirse los criterios de validez se utilizó el test de Fisher. Las variables cuantitativas se describen mediante media, desviación estándar, y máximo y mínimo. Se compararon entre grupos mediante el test de la t de Student.
ResultadosSe analizaron un total de 2.067 ciclos realizados entre enero de 2014 y diciembre de 2017 en la Unidad de Reproducción del Hospital Universitario Virgen de las Nieves de Granada. De estos, un total de 521 ciclos se descartaron por utilizarse fecundación in vitro convencional como método de inseminación. Para nuestro estudio nos quedamos con un total de 1.546 ciclos en los que la fecundación se realizó mediante ICSI. De estos, 660 cumplieron con nuestros criterios de inclusión de edad y respuesta pobre o subóptima a la estimulación de la ovulación. Con el fin de conocer si la asincronía folicular afecta al resto de la cohorte ovocitaria en pacientes que presentan una respuesta subóptima a la ovulación, se dividieron estas 660 pacientes en función del tipo de respuesta a la ovulación, teniendo así un grupo de 199 pacientes con pobre respuesta y uno de 461 ciclos con respuesta subóptima. Finalmente, dentro de cada tipo de respuesta, también se dividieron en función de si presentaban o no asincronía folicular (fig. 1). Del total de ciclos con respuesta pobre a la estimulación (199), el 25% de ellos presentaban asincronía folicular (50), mientras que en el grupo de pacientes con una respuesta subóptima a la estimulación ovárica (461), solo el 10% presentaron esta característica (43) (fig. 2).
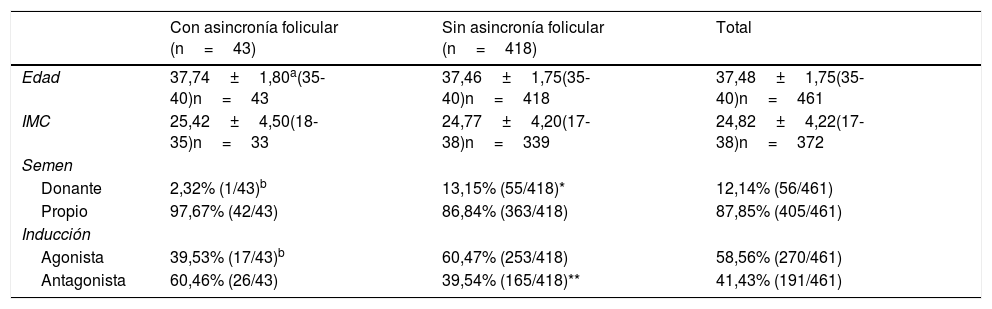
En cuanto a las variables sociodemográficas y clínicas entre mujeres con y sin asincronía folicular, el rango de edad fue similar. Tampoco se apreciaron diferencias significativas en el índice de masa corporal (tabla 1). Con respecto al tipo de semen utilizado en cada ciclo, vemos que la mayoría de los ciclos se llevaron a cabo con semen propio (87,85%) independientemente de la presencia o no de asincronía folicular y solo el 12,14% de los ciclos usaron semen de donante, siendo estos, principalmente, ciclos sin asincronía folicular. Podemos ver que sí se aprecian diferencias significativas en el protocolo de frenación hipofisaria. En el grupo de mujeres con asincronía folicular, el protocolo más utilizado fue el de antagonista frente al de agonista (60,46 vs. 39,53%; p<0,01) (tabla 1).
Resultados del análisis de las variables sociodemográficas y clínicas en el grupo de mujeres de EMA con respuesta subóptima a la estimulación ovárica y con asincronía folicular o sin ella
| Con asincronía folicular (n=43) | Sin asincronía folicular (n=418) | Total | |
|---|---|---|---|
| Edad | 37,74±1,80a(35-40)n=43 | 37,46±1,75(35-40)n=418 | 37,48±1,75(35-40)n=461 |
| IMC | 25,42±4,50(18-35)n=33 | 24,77±4,20(17-38)n=339 | 24,82±4,22(17-38)n=372 |
| Semen | |||
| Donante | 2,32% (1/43)b | 13,15% (55/418)* | 12,14% (56/461) |
| Propio | 97,67% (42/43) | 86,84% (363/418) | 87,85% (405/461) |
| Inducción | |||
| Agonista | 39,53% (17/43)b | 60,47% (253/418) | 58,56% (270/461) |
| Antagonista | 60,46% (26/43) | 39,54% (165/418)** | 41,43% (191/461) |
EMA: edad materna avanzada; IMC: índice de masa corporal.
N.S.
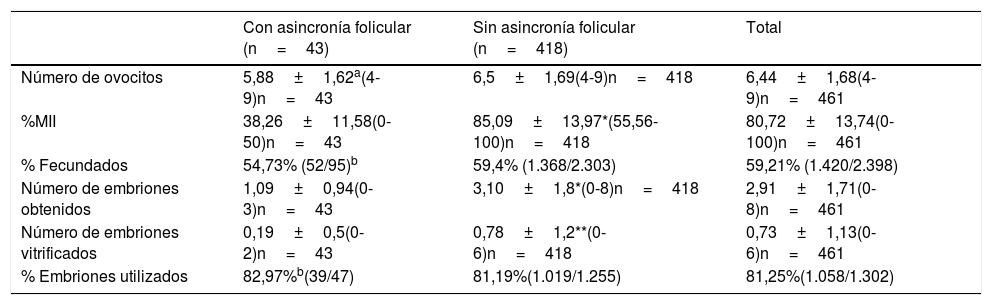
El número de ovocitos obtenidos es similar en ambos grupos (5,88±1,62 ovocitos vs. 6,5±1,69 ovocitos, respectivamente), independientemente de la presencia, o no, de asincronía folicular (tabla 2). Podemos ver cómo existen diferencias significativas en el porcentaje de fase de metafase ii entre el grupo con asincronía folicular (38,26±11,58%), con respecto al grupo sin asincronía folicular (85,09±13,97%; p<0,001) (tabla 2). En el caso del porcentaje de fecundación no se aprecian diferencias significativas entre los grupos (tabla 2). Existen diferencias significativas con respecto al número de embriones obtenidos en el grupo con asincronía folicular (1,09±0,94 embriones) frente al grupo que no presenta este rasgo (3,10±1,8 embriones; p<0,001). Asimismo, las diferencias también son significativas en el número de embriones transferidos (0,72±0,79 embriones vs. 1,43±0,78; p<0,001) (tabla 2). En cuanto al número de embriones vitrificados también existen diferencias significativas entre los grupos, siendo mayor en el de mujeres sin asincronía folicular (p<0,05). Con respecto al porcentaje de embriones utilizados por ambos grupos, no hay diferencias significativas, independientemente del grado de madurez ovocitaria tras la punción folicular (tabla 2).
Resultados del análisis de las variables relacionadas con ovocitos en mujeres de EMA con respuesta subóptima a la estimulación ovárica y con y sin asincronía folicular
| Con asincronía folicular (n=43) | Sin asincronía folicular (n=418) | Total | |
|---|---|---|---|
| Número de ovocitos | 5,88±1,62a(4-9)n=43 | 6,5±1,69(4-9)n=418 | 6,44±1,68(4-9)n=461 |
| %MII | 38,26±11,58(0-50)n=43 | 85,09±13,97*(55,56-100)n=418 | 80,72±13,74(0-100)n=461 |
| % Fecundados | 54,73% (52/95)b | 59,4% (1.368/2.303) | 59,21% (1.420/2.398) |
| Número de embriones obtenidos | 1,09±0,94(0-3)n=43 | 3,10±1,8*(0-8)n=418 | 2,91±1,71(0-8)n=461 |
| Número de embriones vitrificados | 0,19±0,5(0-2)n=43 | 0,78±1,2**(0-6)n=418 | 0,73±1,13(0-6)n=461 |
| % Embriones utilizados | 82,97%b(39/47) | 81,19%(1.019/1.255) | 81,25%(1.058/1.302) |
MII: metafase ii; EMA: edad materna avanzada.
N.S.
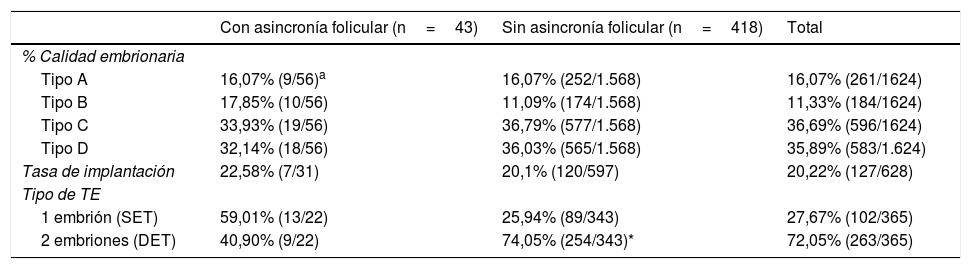
En cuanto a la calidad embrionaria, no vemos diferencias significativas entre los grupos, independientemente de si presentan asincronía folicular o no. Sí hay que destacar que la mayoría de los embriones son de tipo C o D, en ambos grupos (tabla 3). Con respecto a la tasa de implantación, no se aprecian diferencias significativas entre los grupos, independientemente de la presencia, o no, de asincronía folicular (tabla 3). Sí hay diferencias significativas en el tipo de transferencia de 2 embriones (DET, por sus siglas en ingles), siendo esta mayor en el grupo de mujeres sin asincronía folicular (p<0,001) (tabla 3).
Resultados de las variables del laboratorio de reproducción, relacionadas con la calidad embrionaria según la clasificación de ASEBIR, en mujeres de EMA con respuesta subóptima a la estimulación ovárica, y con y sin asincronía folicular
| Con asincronía folicular (n=43) | Sin asincronía folicular (n=418) | Total | |
|---|---|---|---|
| % Calidad embrionaria | |||
| Tipo A | 16,07% (9/56)a | 16,07% (252/1.568) | 16,07% (261/1624) |
| Tipo B | 17,85% (10/56) | 11,09% (174/1.568) | 11,33% (184/1624) |
| Tipo C | 33,93% (19/56) | 36,79% (577/1.568) | 36,69% (596/1624) |
| Tipo D | 32,14% (18/56) | 36,03% (565/1.568) | 35,89% (583/1.624) |
| Tasa de implantación | 22,58% (7/31) | 20,1% (120/597) | 20,22% (127/628) |
| Tipo de TE | |||
| 1 embrión (SET) | 59,01% (13/22) | 25,94% (89/343) | 27,67% (102/365) |
| 2 embriones (DET) | 40,90% (9/22) | 74,05% (254/343)* | 72,05% (263/365) |
ASEBIR: Asociación Española para el Estudio de la Biología de la Reproducción; EMA: edad materna avanzada; TE: transferencia embrionaria.
N.S.
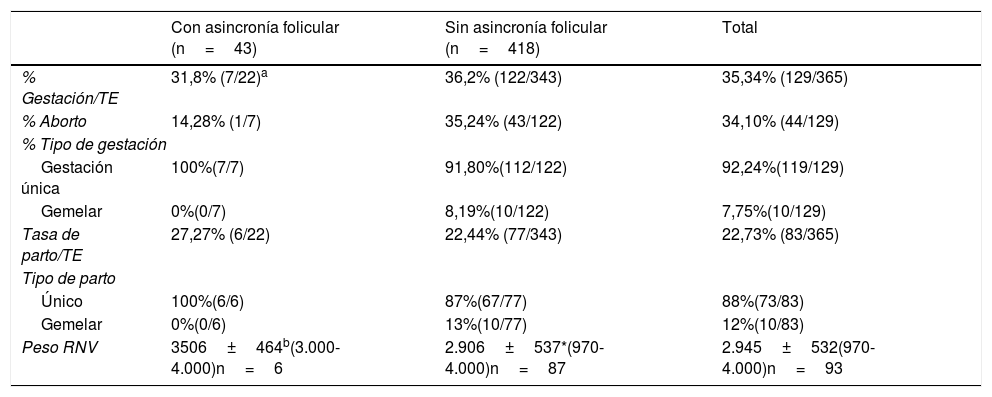
Cuando analizamos la tasa de gestación/TE vemos que no existen diferencias significativas entre los grupos de pacientes, tampoco se aprecian diferencias significativas en la tasa de aborto (tabla 4). En la tasa de parto/TE no se aprecian diferencias significativas entre los grupos (tabla 4), al igual que en el tipo de parto, aunque sí hay que destacar que un 13% de los ciclos de mujeres sin asincronía folicular tuvieron parto gemelar como consecuencia de que se realizaron DET mayoritariamente en este grupo. El peso de los recién nacidos vivos presenta diferencias significativas entre los 2 grupos, siendo menor en el grupo sin asincronía folicular porque hubo más parto gemelar (p<0,01) (tabla 4).
Resultados del análisis de las variables resultados clínicos de gestación y parto, en mujeres de EMA con respuesta subóptima a la estimulación ovárica y con y sin asincronía folicular
| Con asincronía folicular (n=43) | Sin asincronía folicular (n=418) | Total | |
|---|---|---|---|
| % Gestación/TE | 31,8% (7/22)a | 36,2% (122/343) | 35,34% (129/365) |
| % Aborto | 14,28% (1/7) | 35,24% (43/122) | 34,10% (44/129) |
| % Tipo de gestación | |||
| Gestación única | 100%(7/7) | 91,80%(112/122) | 92,24%(119/129) |
| Gemelar | 0%(0/7) | 8,19%(10/122) | 7,75%(10/129) |
| Tasa de parto/TE | 27,27% (6/22) | 22,44% (77/343) | 22,73% (83/365) |
| Tipo de parto | |||
| Único | 100%(6/6) | 87%(67/77) | 88%(73/83) |
| Gemelar | 0%(0/6) | 13%(10/77) | 12%(10/83) |
| Peso RNV | 3506±464b(3.000-4.000)n=6 | 2.906±537*(970- 4.000)n=87 | 2.945±532(970-4.000)n=93 |
EMA: edad materna avanzada; RNV: recién nacido vivo; TE: transferencia embrionaria.
N.S.
La presencia de asincronía folicular en una paciente resulta en una disminución en el número de ovocitos maduros que se obtienen tras la punción folicular, sin que ello, según nuestros resultados, influya en la calidad de los ovocitos maduros dentro de la misma cohorte. En base al análisis de nuestros datos, vemos cómo las mujeres con una respuesta pobre a la estimulación presentan un porcentaje de ciclos con asincronía folicular cercano al 25%, más elevado que el de aquellas mujeres que tienen una respuesta subóptima a la estimulación ovárica (10%). Estos datos coinciden con los que aparecen en la literatura, donde observan un alto porcentaje de ciclos con muchos ovocitos inmaduros en mujeres con baja respuesta, de un 15-25% (Guzman et al., 2019; Lee et al., 2016). El incremento del número de ovocitos inmaduros en las mujeres con baja reserva folicular demuestra una maduración folicular asincrónica y/o la incapacidad de los ovocitos para desarrollar una maduración nuclear y citoplasmática apropiada, en respuesta a la estimulación con gonadotropinas (Lee et al., 2016). Esto nos indica que la pobre respuesta a la estimulación ovárica va a estar relacionada con un mayor número de ovocitos inmaduros y, por tanto, se va a ver reducida la probabilidad de obtener un embrión en este grupo de mujeres, ya que dan pocos ovocitos, y dentro de estos, muchos son inmaduros (fase de metafase i o estado de vesícula germinal).
Las pacientes de EMA con respuesta subóptima a la estimulación de la ovulación que presentan una cohorte de ovocitos maduros elevada, sin asincronía folicular, tienen características clínicas que indican un mejor pronóstico reproductivo. Así, en nuestros resultados observamos un mayor porcentaje de mujeres sin pareja masculina, como lo demuestra el mayor uso de semen de donante en este grupo. Y son varios los autores que refieren mejores resultados de las técnicas de reproducción asistida en estas mujeres sin pareja masculina que en aquellas con parejas heterosexuales (Fiske y Weston, 2014). Por otro lado, la mayor indicación de agonista como protocolo de frenación es resultado de este mejor pronóstico reproductivo. Según las evidencias científicas, el protocolo con agonistas permite obtener un mayor número de ovocitos y más maduros, lo que correspondería con nuestros datos, ya que las pacientes en las que más se usan agonistas son aquellas que no tienen asincronía folicular (Depalo et al., 2009). Las mujeres con asincronía folicular fueron sometidas principalmente a protocolos de frenación hipofisaria con antagonistas de la GnRH. Este tipo de frenación hipofisaria suele utilizarse en mujeres con mal pronóstico reproductivo (Sunkara, 2014). El motivo principal es que los antagonistas permiten un reclutamiento folicular más natural en la fase folicular, ya que se administra después de este reclutamiento, por lo que este ocurre en un ovario que no ha sido suprimido. Esto es debido a que la estimulación comienza en el segundo o tercer día del ciclo menstrual, cuando el reclutamiento folicular ya ha comenzado. Por esto, hay una menor sincronización en la cohorte folicular cuando se usan antagonistas porque la transición lúteofolicular induce unos niveles de hormona folículoestimulante (FSH) 3 veces superiores durante un pequeño periodo de tiempo, hasta que ocurre el feedback hormonal, permitiendo a los folículos que inicien el crecimiento folicular. Como la administración exógena de FSH tiene lugar a los 2-3 días del inicio del ciclo, los niveles incrementan hasta el triple de nuevo y se recupera el crecimiento folicular inicial. Como consecuencia, estas variaciones en los niveles de FSH conducen a una asincronía folicular en los ovocitos recuperados tras la punción folicular.
Sin embargo, con el protocolo de agonistas, el reclutamiento folicular es alto, y tiene lugar tras la supresión hipofisaria, y con la administración exógena de FSH, por lo que los niveles de FSH se mantienen constantemente altos, resultando en una sincronía folicular y buen desarrollo ovocitario (Depalo et al., 2009). En cambio, en otras revisiones y metaanálisis podemos encontrar resultados contradictorios, indicándonos que el número de ovocitos y el grado de madurez de estos no se ven afectados por el protocolo de frenación hipofisaria (Dakhly et al., 2015; Pu et al., 2011; Sunkara, 2014). Esto sugeriría que no es el tratamiento el que determina el tipo de respuesta a la estimulación, sino que las propias características de la paciente son las que determinan qué tipo de protocolo de frenación utilizar.
En los resultados del laboratorio de reproducción asistida vemos cómo el número de ovocitos es prácticamente igual en ambos grupos, estando dentro del rango de respuesta subóptima (4-9 ovocitos tras punción folicular) (Sunkara et al., 2014) y coincidiendo con lo que en la literatura se describe como el número de ovocitos esperados según la edad que tenían nuestras pacientes (Wu et al., 2014). El porcentaje de ovocitos maduros es superior en el grupo sin asincronía folicular, como era de esperar. El porcentaje de ovocitos fecundados no presenta diferencias significativas entre los grupos, lo que nos indica que los ovocitos maduros de ambos grupos eran de igual calidad, coincidiendo con la literatura (Depalo et al., 2009).
Sin embargo, con respecto a los embriones obtenidos, nuestros resultados muestran que las mujeres con sincronía folicular obtienen más embriones. Esto estaría en concordancia con lo anterior, pues a mayor número de ovocitos maduros más probabilidad de tener embriones que puedan transferirse o congelarse. Sin embargo, cuando calculamos el porcentaje de embriones utilizados, no existen diferencias entre los grupos.
Los resultados de calidad embrionaria no muestran diferencias significativas entre los grupos con asincronía folicular y sin ella. Esto concuerda con lo que aparece en la literatura, donde indican que el número de embriones de buena o mala calidad es comparable entre los grupos, independientemente de la presencia o no de asincronía (Depalo et al., 2009). Sí que hay que destacar que la mayoría de los embriones que se obtienen tiene una calidad de grado C o D. Esto se lo podemos atribuir a la edad de nuestra muestra, ya que las mujeres de EMA suelen tener peor calidad ovocitaria y, por ende, embrionaria. Esto aparece reflejado de igual modo en la literatura, donde se describe que, a partir de los 35 años, la calidad embrionaria se ve disminuida como consecuencia de una peor calidad del gameto femenino (Korkmaz et al., 2015). En resumen, la calidad embrionaria no se relaciona con la presencia o no de asincronía folicular.
Con respecto a los resultados que hemos obtenido en función de las variables relacionadas con la TE, vemos que en el grupo sin asincronía folicular principalmente se dieron casos de DET, mientras que, en grupo con asincronía, se transfirió mayoritariamente un embrión. El hecho de que, en este grupo, se transfieran 2 embriones coincide con las guías de buena práctica clínica que marcan que se realice DET cuando la mujer presenta EMA, como en nuestro caso. El principal problema de las reproducción humana asistida es el embarazo múltiple que tiene riesgos tanto para la madre como para el feto (Tannus et al., 2017). Todo lo anterior indica que a las pacientes con maduración sincrónica se les realizó DET por la edad materna y las mujeres con asincronía fueron sometidas principalmente a SET por no tener más embriones para transferir o por la decisión de la paciente.
La tasa de implantación es similar en ambos grupos, lo que confirma que los embriones tienen calidades similares independientemente de la madurez de los ovocitos del resto de su cohorte. Nuestros resultados de gestación y parto por transferencia nos muestran que no existen diferencias entre los grupos, de lo que se puede concluir que no afecta la asincronía folicular al resto de los ovocitos maduros y que, por tanto, la tasa de gestación es similar en los 2 grupos. En cuanto al tipo de parto, mayoritariamente se dieron partos únicos en ambos grupos, pero se obtuvo un 13% de parto gemelar en mujeres sin asincronía folicular. Esto motivó que hubiera diferencias en el peso de los recién nacidos vivos de las mujeres sin asincronía folicular, con respecto a las que sí presentaban esta característica. Esto puede atribuirse a que en este grupo sí se dieron casos de parto gemelar, mientras que en el de mujeres con asincronía no.
Nuestro estudio presenta las siguientes limitaciones. Solo hemos considerado las TE en fresco. Por lo que, aunque nuestros resultados no muestran diferencias significativas en el porcentaje de partos por TE de embriones en fresco producidos en pacientes con y sin asincronía folicular, el menor número de embriones crioconservados que se observa en el grupo con asincronía folicular nos indica que esto sí tendría una repercusión negativa en el porcentaje de gestación acumulada por ciclo, es decir, al tener en cuenta las gestaciones obtenidas tanto tras TE en fresco como de embriones vitrificados. Otra limitación es la falta de validez externa de nuestros resultados, ya que no deben ser generalizados al resto de pacientes más jóvenes, porque la edad influye en la calidad ovocitaria, pudiendo modificar nuestras conclusiones.
En conclusión, en las mujeres con EMA y con una respuesta pobre o subóptima a la estimulación ovárica el número de ovocitos inmaduros se relaciona inversamente con el número de ovocitos totales obtenidos tras la estimulación de la ovulación. Además, la presencia de asincronía folicular en mujeres de EMA con respuesta subóptima a la estimulación ovárica no influye sobre el resto de ovocitos maduros de la misma cohorte, por lo que no tiene relevancia clínica en mujeres que se vayan a realizar TE en fresco.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
Los autores agradecen al informático de la unidad el esfuerzo realizado para recoger todos los datos que nos han servido para la realización del estudio.