La infertilidad es un fenómeno habitual hoy en día, aumentando cada año el número de parejas que no pueden concebir. El factor masculino contribuye en un 40-50% de la infertilidad existente y se ha observado que la calidad seminal ha ido disminuyendo considerablemente en las últimas décadas.
ObjetivoEl principal objetivo de esta revisión se centra en la búsqueda de factores capaces de alterar la fertilidad masculina, determinando qué efectos producen en el organismo.
Material y métodosSe ha realizado una búsqueda bibliográfica en las principales revistas científicas del campo de la reproducción asistida para identificar los factores que perjudican la fertilidad masculina y analizar de qué forma pueden estar afectándola.
ResultadosEn esta revisión han sido analizados 76 artículos. De entre los factores identificados que afectan negativamente a la fertilidad masculina, destacan los compuestos ambientales y los relacionados con el estilo de vida. Todos ellos son capaces de generar alteraciones histomorfológicas, metabólicas, endocrinas, seminales y genéticas, aunque dependiendo del factor pueden incidir más en unas alteraciones que en otras. Los tóxicos de la ingesta y los ambientales, problemas de salud como obesidad o desórdenes emocionales, así como el exceso de ejercicio físico, actúan con mayor frecuencia desregulando el sistema hormonal, reduciendo los niveles de testosterona y los parámetros espermáticos principales (concentración, movilidad y morfología). Por otra parte, la edad paterna, los tóxicos de la ingesta, sobre todo el tabaco, y algunos tóxicos ambientales, como el bisfenol A o los pesticidas, actúan principalmente generando roturas en el ADN, mutaciones, alteraciones cromosómicas o cambios epigenéticos.
ConclusiónLos factores ambientales y del estilo de vida analizados ejercen un efecto negativo sobre la fertilidad masculina, pudiendo esta tratarse mediante la mejora de los hábitos de vida o mediante técnicas de reproducción asistida.
Nowadays, infertility is one of the most common problems in clinical medicine, as the number of couples that cannot conceive is increasing every year. The male factor contributes 40%-50% of the existing infertility and it has been observed that the seminal quality has been decreasing considerably in the last decades.
AimThe main objective of this review focuses on the search for factors capable of affecting male fertility, determining what effects they produce in the body.
Material and methodsa bibliographic research was carried out in the main scientific journals in the field of assisted reproduction to identify the factors that alter male fertility and how they may be affecting it.
ResultsIt has been analysed 76 articles in this review. Among the main features that affect male fertility negatively, environmental compounds and lifestyle factors stand out. All of them can generate histomorphological, metabolic, endocrine, seminal and genetic alterations, although depending on the factor, they can affect more in some alterations than in others. Intake and environmental toxicants, health problems such as obesity or emotional disorders, as well as excessive physical exercise, act more frequently deregulating the hormonal system, decreasing testosterone levels and reducing the main sperm parameters (concentration, mobility and morphology). On the other hand, factors such as paternal age, intake toxicants, especially tobacco, and some environmental toxicants, such as bisphenol A or pesticides, act mainly generating breaks in DNA, mutations, chromosomal alterations or epigenetic changes.
ConclusionAll environmental and lifestyle factors analysed in this literature review have a negative effect on male fertility, which can be treated by improving life habits and/or through assisted reproduction techniques.
En la actualidad, la infertilidad es uno de los temas más estudiados en el campo de la medicina clínica debido al aumento constante de parejas incapaces de concebir, que se sitúan en torno al 15% a nivel mundial (Pan et al., 2018).
La infertilidad está definida por la Organización Mundial de la Salud (OMS) como «una enfermedad del sistema reproductivo caracterizada por la imposibilidad de lograr un embarazo clínico después de 12 meses o más de relaciones sexuales regulares sin protección» (Zegers-Hochschild et al., 2009). Las causas de esta se recogen en 3grandes grupos, el factor femenino y el factor masculino (por separado o de forma combinada), así como las causas desconocidas (Lindsay y Vitrikas, 2015; Tahmasbpour et al., 2014).
El factor masculino es el responsable del 40-50% de la infertilidad existente, afectando a 30 millones de hombres en todo el mundo (Colaco y Modi, 2018; Pan et al., 2018; Tahmasbpour et al., 2014). La evaluación del factor masculino es necesaria para una mejor comprensión de la infertilidad de la pareja, la cual requiere un análisis de la historia clínica, un análisis físico y seminal. Para la historia clínica, se observa si presenta alguna enfermedad o problema testicular, disfunción eréctil, si ha necesitado algún proceso de cirugía o si ha recibido un tratamiento fuerte como quimioterapia, así como también si tiene descendencia y si esta presenta algún problema. En cuanto al análisis físico, es muy importante realizar un examen de los genitales, el epidídimo y del aparato reproductor masculino en sí, pero también es importante una revisión del tórax o de la parte abdominal, puesto que anomalías en estas zonas pueden estar ligadas a problemas con el sistema endocrino (Pan et al., 2018). Por último, en lo referente al análisis seminal, se observan las características macro y microscópicas, las cuales presentan unos parámetros y valores límite de referencia establecidos por la OMS como criterio para determinar la calidad y la normalidad o no de la muestra seminal. Entre estas, se encuentran la concentración espermática total (> 15 millones/ml), movilidad total (> 40%) o morfología (> 4%) (Pan et al., 2018; Esteves, 2016; WHO, 2010).
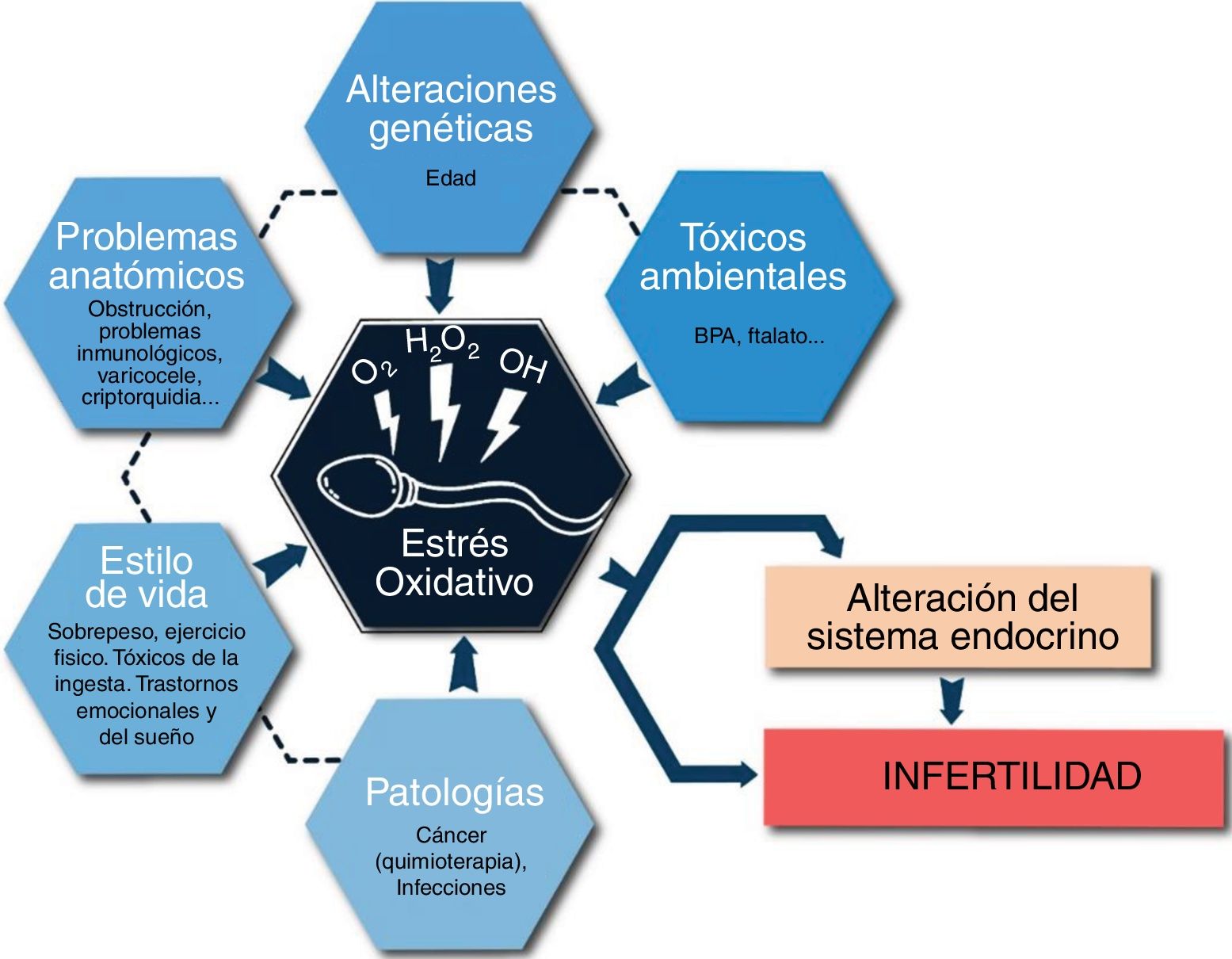
Las causas responsables de la infertilidad masculina son muy variadas, considerándose esta un problema multifactorial, y que, generalmente, dañan la calidad espermática debido a la producción de estrés oxidativo (fig. 1). Dentro de las principales, es importante resaltar un conjunto de problemas físicos, tales como la obstrucción de las vías seminales, dificultades en la eyaculación, así como la presencia de criptorquidia y varicocele (Esteves, 2016; Agarwal y Sekhon, 2010). La criptorquidia puede llegar a afectar hasta un 9% de los recién nacidos, aunque también puede ser adquirida, y consiste en un fallo de al menos uno de los testículos en descender hasta el escroto (Skakkebaek et al., 2016). Por su parte, al varicocele se le conoce como la dilatación de las venas del cordón espermático y se sitúa entre las causas de infertilidad masculina más frecuentes, surgiendo en un 40% de los hombres infértiles (Colaco y Modi, 2018; Esteves, 2016; Tahmasbpour et al., 2014).
Agentes y enfermedades que afectan al factor masculino. El principal daño que generan es el aumento del estrés oxidativo, que desencadenará diversos problemas, como disfunción endocrina o afección de los parámetros seminales, generando infertilidad.
Adaptado de Agarwal y Sekhon, 2010.
Las alteraciones genéticas constituyen, a su vez, un factor muy importante, teniendo una recurrencia de entre el 15 y el 30% de los casos. La mayoría se encuentra en el cromosoma Y, destacando las variaciones en el número de copias génicas, deleciones y alteraciones epigenéticas. Estos daños a nivel de ADN implican problemas en el sistema endocrino, en la espermatogénesis, en la calidad seminal, en el desarrollo de las gónadas masculinas y también en la correcta formación del tracto urogenital. Pueden ser hereditarios o únicos, pero suelen derivarse de la edad del varón, generándose problemas de fertilidad o teniendo consecuencias negativas en su futura descendencia (Colaco y Modi, 2018; Miyamoto et al., 2017; Tahmasbpour et al., 2014).
Si bien es cierto que los factores anteriormente mencionados constituyen un buen porcentaje de las posibles causas de infertilidad masculina, tanto las condiciones de contaminación ambiental como el estilo de vida se están convirtiendo en foco de investigación del factor masculino, consolidándose cada vez más entre las causas más probables del mismo (Durairajanayagam, 2018; Sharpe, 2000).
Desde que comenzó la Revolución Industrial a mediados del siglo xviii, se han conseguido numerosos avances socioeconómicos y tecnológicos con el paso de los años, llevando a crear una sociedad plenamente industrializada y provocando la emisión constante de compuestos tóxicos a la atmósfera, como el bisfenol A (BPA) o el ftalato. Estos tóxicos suponen un riesgo bastante grave para la salud afectando al sistema reproductivo, entre otros, debido a la alteración del sistema endocrino y a la disminución de la calidad seminal (Mínguez-Alarcón et al., 2016; Sharpe, 2000).
No solo existe una exposición a la contaminación ambiental, sino que también entran en escena los tóxicos de la ingesta, donde destacan la cafeína, el tabaco o el consumo de alcohol, factores que parecen afectar al sistema endocrino, aunque existe controversia respecto al efecto que tienen sobre la fertilidad (Colaco y Modi, 2018; Tahmasbpour et al., 2014; Sharpe, 2000); es conocido también que enfermedades como el cáncer, las infecciones graves o las enfermedades cardiovasculares, así como algunos de sus tratamientos, como la quimioterapia, son capaces de alterar la fertilidad. Sin embargo, actualmente muchas investigaciones se centran en la posible generación de infertilidad masculina como consecuencia del insomnio y determinados trastornos emocionales. De hecho, estos suelen aparecer incluso cuando ya existe la propia infertilidad por otros motivos, puesto que esta implica problemas sociales y mentales, pudiendo agravar la situación (Colaco y Modi, 2018; Pan et al., 2018; Shehata, 2017; Alvarenga et al., 2015; Wang et al., 2015).
Por otro lado, el estilo de vida actual dista mucho del que se apreciaba unos años atrás. Esta nueva forma de vida ha potenciado en gran medida el sedentarismo y una alimentación poco equilibrada y basada en productos procesados. De esta forma, se ha llevado a un aumento de la obesidad o el sobrepeso que, en hombres, ha pasado de encontrarse en un 10% en 2008 hasta un 36,9% en 2013 y continúa en aumento (Marco-Jiménez y Vicente, 2017). En contraposición, también ha surgido un estilo de vida enfocado al deporte o a practicar ejercicio de forma rutinaria, un hábito que se recomienda para tener un adecuado estado de salud. Sin embargo, son varios los estudios que señalan tanto el sobrepeso como el exceso de ejercicio físico como posibles responsables de contribuir o provocar esterilidad o alteración de los parámetros espermáticos (Craig et al., 2017; Jóźków et al., 2017; Sharpe, 2000).
La mayoría de los factores responsables de la generación de la infertilidad masculina, principalmente estos últimos relacionados con compuestos tóxicos y el estilo de vida, han ido aumentando en las últimas décadas, del mismo modo que lo ha hecho el factor masculino. No obstante, no son muchos los estudios que han conseguido obtener resultados esclarecedores sobre el efecto adverso que estos factores puedan generar sobre la fertilidad (Craig et al., 2017; Esteves, 2016), por lo que se plantea la hipótesis de si realmente contribuyen a originar el factor masculino o a agravarlo. Por tanto, el objetivo de esta revisión es identificar los factores que verdaderamente se correlacionen con la esterilidad masculina, determinando qué efectos producen sobre el organismo.
Materiales y métodosLos artículos empleados en esta revisión han sido encontrados en la base de datos PubMed, utilizando principalmente para su búsqueda los siguientes filtros o palabras clave: «male fertility», «male infertility», «paternal age and infertility», «lifestyle and male infertility», «toxic diet compounds and male infertility», «caffeine intake and male infertility», «alcohol consumption and male infertility», «tobacco and male infertility», «environmental compounds and male infertility», «BPA and male infertility», «phthalates and male infertility», «pesticides and male infertility», «polychlorinated biphenyls and male infertility», «sleep disturbance and male infertility», «emotional disorders and male infertility», «stress and male infertility», «obesity and male infertility», «overweight and male infertility», «physical activity and male infertility», «exercise and male infertility». Además, se ha añadido a la bibliografía un cuaderno sobre andrología clínica publicado por la Asociación para el Estudio de la Biología de la Reproducción. En total, se han revisado 76 estudios: artículos originales, revisiones bibliográficas, así como capítulos de libro.
Se han incluido investigaciones que aportan información y resultados relevantes para la revisión, tanto si los factores analizados ejercen efectos negativos sobre la fertilidad masculina como si no la alteran. Los estudios realizados en humanos incluyen, dependiendo de la investigación, a varones fértiles, con fertilidad no demostrable, a pacientes con infertilidad idiopática y algunos casos de varones con infertilidad severa, todos ellos importantes a la hora de establecer una comparativa. Estudios con animales de experimentación y cultivos celulares también han sido incorporados, principalmente para obtener información sobre posibles daños histomorfológicos y afección celular. Se han excluido artículos que no contribuyen con datos importantes, que presentan datos pocos precisos o de menor impacto en comparación con otras publicaciones de mayor relevancia. Se han excluido también artículos con información sobre determinados compuestos que no se encuentran entre los principales que pueden alterar la fertilidad masculina y de los cuales hay pocos e inconsistentes estudios al respecto.
Factores que afectan a la fertilidad masculinaEdad paternaSi bien es cierto que en las mujeres el efecto deletéreo de la edad en la reserva ovárica está claro, en el caso de los hombres no existe un cese de la capacidad reproductiva al mismo nivel, por lo que no se había planteado qué puede ocurrir con la fertilidad masculina a edades avanzadas. No obstante, surge el interés en esta debido a que ha aumentado la longevidad de la población, así como la edad media para tener descendencia, concretamente, alrededor de un 60% en varones mayores de 40 años, debido al factor socioeconómico (Eisenberg y Meldrum, 2017; Harris et al., 2011; Kidd et al., 2001; Plas et al., 2000).
Durante el proceso de envejecimiento, el cuerpo experimenta muchos cambios. En el aparato reproductor masculino, principalmente, disminuye el número de células de Leydig, liberadoras de testosterona, y se produce un engrosamiento de la membrana basal de los túbulos seminíferos que conlleva alteraciones de la espermatogénesis en pequeñas áreas. Por otro lado, surgen complicaciones como la disfunción eréctil, consecuencia del incremento en la producción de radicales libres (estrés oxidativo). Surgen también cambios en el sistema endocrino, como el cese del suministro de esteroides mitocondriales que contribuye a disminuir las células de Sertoli, afectando al correcto funcionamiento de las células de Leydig y, con ello, a reducir los niveles de testosterona. Esta hormona es fundamental para el adecuado desarrollo de los espermatozoides, por lo que su disminución supone serios problemas en la espermatogénesis y en la calidad seminal (Eisenberg y Meldrum, 2017; Dakouane-Giudicelli et al., 2006; Plas et al., 2000).
En lo referente a los parámetros seminales, en líneas generales se ha demostrado una disminución en la calidad conforme aumenta la edad del varón, pero existen todavía datos contradictorios. En la mayoría de los estudios, el volumen del eyaculado y la morfología normal de los espermatozoides disminuyen levemente en hombres mayores de 40 años en comparación con menores de 30 años. Por otra parte, la concentración espermática parece no verse afectada por el incremento de la edad, incluso en algunos estudios se ha observado un aumento de la misma, aunque, al igual que con el resto de parámetros mencionados, no hay suficientes datos que permitan confirmar plenamente estos resultados. Sin embargo, sí que existen evidencias de que la movilidad espermática disminuye entre un 3-37% conforme pasan los años. Esto se debe a que, con la edad, las glándulas testiculares pueden sufrir daños o alteraciones, además de producirse fallos mitocondriales (Durairajanayagam, 2018; Harris et al., 2011; Sloter et al., 2006; Kidd et al., 2001).
Otro aspecto relevante a destacar es que la edad disminuye la frecuencia de relaciones sexuales y la tasa de embarazo, aumentando el tiempo necesario para conseguirlo y las pérdidas preimplantacionales o abortos. Esto es consecuencia principalmente de las alteraciones espermáticas y endocrinas, aunque influye en un porcentaje mayor la edad materna (Harris et al., 2011; Plas et al., 2000).
Por último, entre los problemas más frecuentes y generalmente asociados a la edad paterna, destacan el aumento notable de la fragmentación del ADN espermático, las aneuploidías y las alteraciones genéticas. Con el paso de los años, el número de divisiones celulares sigue aumentando, así como la continua exposición a agentes mutagénicos y la replicación y duplicación de ADN, lo que conlleva un incremento de la tasa de error de la replicasa, acumulándose mutaciones que desembocan en desórdenes genéticos. Por tanto, cuanto mayor es el padre, mayor es la probabilidad de transmitir tanto mutaciones genéticas como enfermedades hereditarias a su descendencia. Existe un grupo de trastornos denominados «trastornos de efecto de edad paternal» que implican mutaciones espontáneas durante la espermatogénesis, con una alta tasa de aparición en genes determinados como consecuencia del proceso de envejecimiento y que son transmitidos a la descendencia. Entre estas, las mutaciones más comunes son las que afectan a los genes del receptor del factor de crecimiento fibroblástico FGFR2 y a su parálogo FGFR3, pudiendo dar lugar al síndrome de Apert o generar acondroplasia, respectivamente. Es interesante mencionar que la mayoría de estas mutaciones también son oncogénicas, lo cual supone un doble efecto negativo para el varón y para su descendencia. Además, todas ellas tienen lugar en genes que participan en el proceso de señalización del receptor del factor de crecimiento RAS, la cual es fundamental para la regulación de las células madre espermatogonales y para que tenga lugar la espermatogénesis (Durairajanayagam, 2018; Goriely y Wilkie, 2012; Harris et al., 2011; Plas et al., 2000).
Tóxicos de la ingestaCafeínaLa 1,3,7-trimetilxantina, o más comúnmente conocida como cafeína, es un alcaloide presente en grandes cantidades en bebidas como el café o el té, aunque también se encuentra en menor proporción en refrescos, bebidas energéticas o en el chocolate. El consumo de estos productos es muy abundante hoy en día, debido al actual estilo de vida, por lo que el estudio del efecto que puede causar la cafeína en la capacidad reproductora masculina suscita interés (Ricci et al., 2017; Ramlau-Hansen et al., 2008).
Dentro de los múltiples efectos que ejerce sobre el organismo, se caracteriza por actuar como antagonista de los receptores de adenosina, afectando al sistema nervioso central, y porque prácticamente el 100% de este compuesto es absorbido por el cuerpo. Por otra parte, su ingesta también provoca cambios hormonales, concretamente afectando a la globulina fijadora de hormonas sexuales, del mismo modo que afecta al funcionamiento de las células de Sertoli, reguladoras de las células de Leydig, siendo capaz de promover un aumento de la testosterona, un 14% más de lo normal (Karmon et al., 2017; Lafuente y Jacquemin, 2017; Ricci et al., 2017; Ramlau-Hansen et al., 2008).
Las investigaciones relacionadas con la calidad seminal han mostrado resultados contradictorios sobre el efecto que la cafeína causa en los distintos parámetros espermáticos. Tanto el volumen como la concentración espermática parecen no verse alterados, aunque varios estudios han observado una disminución de los mismos si se toman bebidas energéticas o refrescos con frecuencia. Por otro lado, sí que hay ciertas evidencias que indican que la morfología y la movilidad espermática pueden verse afectadas. Concretamente, la cabeza del espermatozoide cambia ligeramente su morfología y la pieza media se inflama, así como el porcentaje de espermatozoides móviles aumenta. Sin embargo, se trata de un aumento deletéreo consecuencia de la toxicidad de la cafeína, la cual también genera roturas de doble cadena en el ADN y daños en los puntos de control genético. La mayoría de las investigaciones analizadas coinciden en que estas posibles alteraciones, tanto en determinados parámetros espermáticos como en el ADN, suelen detectarse cuando la cantidad de cafeína ingerida supera los 300g al día de café (3 tazas), agravándose si sobrepasan los 800g de café (7 tazas). En el caso de bebidas energéticas o refrescos hay mayor discrepancia, pudiendo ser las afecciones producidas por el estilo de vida en sí del individuo y no solo por la ingesta de este tipo de bebidas (Karmon et al., 2017; Lafuente y Jacquemin, 2017; Ricci et al., 2017; Harrison et al., 1980).
Un último aspecto importante a considerar es que, además de que la capacidad de fecundación disminuye con cantidades elevadas de cafeína, aumenta el riesgo de gestaciones múltiples y la tasa de abortos, los hijos también pueden sufrir las consecuencias de una exposición diaria y elevada de cafeína por parte de los padres. En el caso de los varones, los efectos que pueden provocar en la descendencia son anomalías e inestabilidad cromosómica (Karmon et al., 2017; Harrison et al., 1980).
AlcoholCon el paso de los años, el consumo de alcohol se ha vuelto cada vez más frecuente, principalmente entre los jóvenes. Bebidas como la cerveza o el vino han sido consideradas como beneficiosas para la salud si se ingieren en cantidades moderadas, debido a que contienen compuestos antioxidantes capaces de reducir el estrés oxidativo. No obstante, un consumo elevado y diario de alcohol está relacionado con daños en la salud, como afección del sistema reproductor (Aboulmaouahib et al., 2018; Ricci et al., 2016; Condorelli et al., 2015).
Los efectos adversos que tiene el alcohol sobre la salud se deben principalmente a la toxicidad del etanol y de los radicales hidroxilos. En exceso, estos generan un incremento del estrés oxidativo, afectando a las células de Leydig y de Sertoli, pudiendo causar azoospermia y disminuyendo la cantidad de testosterona. De este modo, se pueden generar daño testicular y fallos en la espermatogénesis, lo cual provoca defectos en la peroxidación lipídica de la membrana espermática y alteraciones en determinados parámetros espermáticos. A pesar de encontrarse resultados contradictorios en muchos aspectos, la mayoría de las investigaciones coinciden en que una ingesta diaria de alcohol conlleva una disminución en el volumen del eyaculado, del porcentaje de espermatozoides con morfología normal y de su concentración (Aboulmaouahib et al., 2018; Karmon et al., 2017; Lafuente y Jacquemin, 2017; Ricci et al., 2016; Condorelli et al., 2015).
En cuanto a la cantidad de alcohol necesaria para causar o no estos efectos, los artículos revisados se centran en las unidades diarias tomadas, donde una unidad de alcohol se corresponde aproximadamente con 12g de etanol en 125ml de vino, 330ml de cerveza y 40ml en whisky o similares. Una ingesta superior a 1/2 unidades diarias se consideraría consumo frecuente, estando relacionada con la posibilidad de afectar negativamente a la fertilidad masculina cuanto mayor sea el número de unidades. Con relación a los beneficios que puede aportar la ingesta moderada, no se menciona una cantidad determinada, pero se establece que un consumo ocasional igual o inferior a una unidad no parece tener un efecto negativo sobre el sistema reproductor masculino. Además, en algunos estudios se ha observado un ligero aumento en la movilidad espermática y una mejora de la fecundación con un consumo ocasional (Aboulmaouahib et al., 2018; Karmon et al., 2017; Lafuente y Jacquemin, 2017; Ricci et al., 2016; Condorelli et al., 2015).
Finalmente, el estrés oxidativo y las desregulaciones hormonales, junto con el incremento de la apoptosis, también provocan daños en el ADN nuclear y mitocondrial espermáticos, así como desnaturalización de la cromatina y mayor riesgo de aneuploidías. Las consecuencias de este daño genético pueden dar lugar a infertilidad o, en el caso de tener descendencia, a la transmisión de alteraciones genéticas no deseables (Aboulmaouahib et al., 2018; Lafuente y Jacquemin, 2017; Anifandis et al., 2014).
TabacoCon el efecto de la crisis económica y el auge de un estilo de vida saludable, la venta de tabaco ha disminuido casi en un 50% con respecto a unos 10 años atrás. No obstante, el consumo de esta planta sigue siendo muy frecuente, de hecho, un 36% de los hombres en edad reproductiva son fumadores, lo cual se debe principalmente a razones sociales y al efecto adictivo que generan la gran cantidad de compuestos que contienen los cigarros. Muchos de ellos son agentes mutágenos y cancerígenos que dañan la salud del consumidor, destacando la nicotina y el monóxido de carbono por su alta concentración y por los efectos adversos que generan. Mientras que el monóxido de carbono es un gas tóxico capaz de causar enfermedades, la nicotina es un alcaloide con un alto efecto estimulante y citotóxico en determinadas cantidades, llegando a los pulmones y al sistema circulatorio rápidamente. En relación con el sistema reproductor masculino, la nicotina es considerada un disruptor hormonal y es capaz de atravesar la barrera testicular (Sapra et al., 2016; La Maestra et al., 2015; Mostafa, 2010; Stillman et al., 1986).
El sistema endocrino se ve afectado con el consumo del tabaco, generalmente apreciándose una desregulación en la hormona del crecimiento, en la hormona estimuladora del tiroides y en las hormonas sexuales como la testosterona. Esto es consecuencia del efecto de la nicotina, pero también del cadmio, metal presente en altas concentraciones en la sangre de los fumadores. Además, el ácido ascórbico (antioxidante principal del plasma seminal) se ve disminuido en aproximadamente un 30%, por lo que todo ello contribuye a la formación de radicales libres de oxígeno y. por tanto, a elevar el estrés oxidativo bloqueando la espermatogénesis y dañando la calidad seminal (Sapra et al., 2016; Mostafa, 2010). En cuanto a los parámetros espermáticos, tanto el volumen como la movilidad pueden disminuir en un 22 y un 20%, respectivamente, mientras que el porcentaje de espermatozoides anormales se ve incrementado, destacando defectos en la cabeza y ausencia de cola. También es importante mencionar que la concentración de acrosina, enzima esencial para que tenga lugar la fecundación del ovocito, se ve disminuida en los fumadores, del mismo modo que también se reduce la reacción acrosómica, por lo que la tasa de embarazo puede disminuir (La Maestra et al., 2015; Mostafa, 2010; Stillman et al., 1986).
Otra de las consecuencias que se deriva del aumento de mutágenos y estrés oxidativo en el plasma seminal es el daño que se produce al ADN espermático. Se altera el patrón de metilación del ADN, las roturas de doble cadena aumentan, al igual que aumentan el riesgo de aneuploidías y las mutaciones del ADN. Todo ello contribuye a la aparición de alteraciones en la calidad seminal y a problemas en la capacidad reproductora y en la descendencia, puesto que aumentan los abortos espontáneos y la posibilidad de transmitir mutaciones espermáticas heredables (Fragou et al., 2019; Lafuente y Jacquemin, 2017; La Maestra et al., 2015; Mostafa, 2010; Stillman et al., 1986).
Es importante mencionar que la mayoría de autores ha mostrado en sus estudios un efecto negativo del tabaco en el sistema reproductor masculino tanto en varones que consumen entre 1 y 20 cigarrillos al día (moderado) y más de 20 al día (elevado). Si bien es cierto que el daño provocado es mucho mayor en los últimos y que en el consumo moderado hay investigaciones que no observan daños, en general, estos resultados muestran lo perjudicial que puede ser para la salud este tipo de productos, de forma que los no fumadores serían los únicos exentos de sufrir efectos adversos en su fertilidad (Aboulmaouahib et al., 2018; Anifandis et al., 2014; Mostafa, 2010; Stillman et al., 1986).
Finalmente, se sabe que el consumo de alcohol, tabaco y cafeína suele ser frecuente en una misma persona. Es por esto que existen varios estudios que se han centrado en el efecto que puede causar el consumo combinado de los mismos. El resultado ha sido un efecto sinérgico, aumentando casi todos los efectos negativos que ejercen sobre la calidad seminal, como el porcentaje de espermatozoides con defectos morfológicos, disminuyendo la movilidad y volumen espermático, así como elevando el riesgo de sufrir mutaciones en el ADN y alteraciones cromosómicas. A pesar de que estas alteraciones pueden ser permanentes si se afectan las células germinales y si el consumo ha sido durante muchos años (especialmente en el caso del tabaco y el alcohol), la mayoría de los efectos son generalmente deletéreos puesto que la privación de estos productos supone una recuperación de las condiciones hormonales y espermáticas normales. El tiempo necesario para dicho restablecimiento no está claro ni se menciona en muchos de los artículos analizados, aunque en el caso del tabaco se han encontrado algunas investigaciones que observan mejoras de la calidad seminal tras llevar 6 meses sin fumar. Por otro lado, sí que se establece como recomendación dejar de consumir estos productos antes de intentar concebir o de iniciar tratamientos de reproducción asistida. Esto puede estar relacionado con el tiempo de renovación espermática, que tiene una duración aproximada de 3 meses, tiempo que podría suponerse suficiente para observar mejoría en los parámetros seminales afectados (Aboulmaouahib et al., 2018; Lafuente y Jacquemin, 2017; Anifandis et al., 2014; Stillman et al., 1986).
Tóxicos ambientalesLos tóxicos ambientales se caracterizan por ser compuestos químicos que provocan alteraciones en el sistema endocrino, por lo que suelen ser comúnmente llamados compuestos disruptores endocrinos (CDE), viéndose la fertilidad masculina claramente comprometida. Los CDE que mayores efectos adversos presentan sobre el sistema reproductor masculino son el BPA, ftalatos, pesticidas organoclorados (POC) y organofosforados (POF), y bifenilos policlorados (BPC) (Hipwell et al., 2019; Mendiola y Lázaro, 2017).
Bisfenol AEl BPA (2,2-bis(4-hidroxifenil)propano) es un compuesto fenólico ampliamente utilizado, puesto que se encuentra en muchos productos manufacturados, como plásticos, recubrimiento de botellas y latas para bebidas y alimentos en conserva, etc. Toda la población se encuentra expuesta a este contaminante químico, principalmente por la ingesta de comida mediante la filtración del BPA que recubre el recipiente, ya que supone el 73% de la contribución total, encontrándose que el 90% de los ciudadanos de Estados Unidos presentan cantidades considerables de BPA en la orina. Se ha observado que una exposición alta a BPA está relacionada con un mayor riesgo de presentar enfermedades cardiovasculares pero, al tratarse de un potente CDE, uno de los problemas con los que más se ha relacionado a este fenol es con el riesgo de padecer infertilidad (Karmakar et al., 2017; Mendiola y Lázaro, 2017; Wang et al., 2010; Li et al., 2009).
Este tóxico es capaz de unirse a los receptores estrogénicos alfa y beta, actuando como agonista o antagonista. Además, también es responsable de causar hipogonadismo hipogonadotrópico (reducción en la concentración de hormonas gonadotrópicas) y tiene efectos antiandrogénicos, puesto que provoca el descenso de los niveles de testosterona en el plasma seminal, inhibiendo la actividad de los transportadores de ATP en la membrana de los tejidos testiculares. De esta forma, se altera la espermatogénesis. En consecuencia, la concentración y la movilidad espermática pueden verse reducidas, pero el BPA también puede provocar cambios histomorfológicos a largo plazo, ya que en estudios con roedores se ha observado una disminución en el peso de los testículos, reducción de los túbulos seminíferos, de las células de Leydig y de Sertoli. Estas últimas son fundamentales para el desarrollo de las células germinales y participan en la formación de la barrera hematotesticular, debido a la unión de las mismas gracias a uniones gap, constituidas principalmente por conexinas. El control de esta barrera es esencial para que lleguen las hormonas necesarias para activar la secreción de testosterona, importante también para la adhesión celular. Debido a la presencia de BPA, varias proteínas y conexinas ven reducida su cantidad, por lo que se altera la barrera, afectando a los receptores androgénicos y evitando que la espermatogénesis se produzca de forma correcta (Hipwell et al., 2019; Karmakar et al., 2017; Kaur et al., 2017; Mendiola y Lázaro, 2017; Mínguez-Alarcón et al., 2016).
Otra de las consecuencias que provoca el BPA sobre la fertilidad masculina es el incremento de la apoptosis de las células germinales. Para mantener el equilibrio testicular, la apoptosis es un proceso muy importante, puesto que elimina las células espermatogénicas de mala calidad. Sin embargo, la falta de determinadas hormonas sexuales, así como el incremento del estrés oxidativo, da lugar a un aumento descontrolado de la apoptosis. Además, la falta de testosterona hace que exista una menor concentración de estradiol, molécula protectora de la apoptosis en las células germinales, por lo que se agrava aún más la situación. Para que tenga lugar la apoptosis, hay varias rutas de señalización que están implicadas y que parecen verse afectadas por el BPA, destacando la ruta Fas/FasL. En las células germinales y en las de Leydig se encuentra una sobreproducción de estos ligandos, así como de la caspasa-9, en presencia de BPA que implica el incremento de las células apoptóticas (Kaur et al., 2017; De Freitas et al., 2016; Li et al., 2009).
Actualmente, no están establecidos los niveles a los que el BPA puede resultar tóxico para el ser humano, aunque en una de las publicaciones analizadas se ha indicado que la concentración espermática en varones con problemas de fertilidad puede verse agravada con concentraciones de 1,55 ng/ml de BPA. La mayoría de las investigaciones al respecto trabaja con roedores o con cultivos de células germinales murinas, estableciendo como tóxicos valores de 480-960mg/kg/día de BPA y 10-100μM de BPA, respectivamente (Karmakar et al., 2017; Mendiola y Lázaro, 2017; De Freitas et al., 2016; Wang et al., 2010; Li et al., 2009).
Finalmente, este fenol es capaz de alterar la actividad meiótica durante la espermatogénesis como consecuencia de la disrupción hormonal y el aumento del estrés oxidativo, como fallos en el intercambio de cromátidas. Conjuntamente, da lugar a daños a nivel de ADN, de entre los cuales destaca la disminución de la metilación. Todos estos efectos adversos desembocan en problemas de fertilidad, viéndose reducida las tasa de fecundación y promovida la transmisión de posibles defectos genéticos a la descendencia (Mendiola y Lázaro, 2017; Wang et al., 2010).
FtalatosComo la mayoría de los tóxicos ambientales, los ftalatos se encuentran ampliamente distribuidos en el mundo debido a la presencia de estos en productos plásticos. Pueden encontrarse en el policloruro de vinilo (PVC), recubriendo envoltorios de alimentos o formando parte de material médico, como ocurre con los ftalatos de alto peso molecular, así como los ftalatos de bajo peso molecular forman parte de productos de cuidado personal o solventes. Son compuestos rápidamente metabolizados por el cuerpo humano, detectándose altas concentraciones en orina y, aunque no todos los ftalatos poseen el mismo efecto ni actúan de la misma forma, son capaces de interaccionar con rutas del sistema endocrino y reproductor. Por todo ello, el Comité Científico de Toxicidad, Ecotoxicidad y Medio Ambiente de la Unión Europea establece un nivel de tolerabilidad de ftalatos de 37μg/kg/día (Liu et al., 2017; Mendiola y Lázaro, 2017; Wu et al., 2017; De Freitas et al., 2016).
Varias investigaciones han confirmado su actividad antiandrogénica, disminuyendo la cantidad de testosterona en los testículos, así como provocando una desregulación en la síntesis de esteroides. Conjuntamente, provocan una reducción en las células de Leydig y generan una disfunción de la citocromo CYP17, lo cual contribuye a disminuir la cantidad de testosterona y también disminuye el número de células de Sertoli y de las proteínas y las uniones gap que las rodean. No obstante, en cuanto a la relación con la calidad seminal, los estudios son bastante contradictorios, principalmente en los parámetros de concentración y movilidad espermáticas. De hecho, estudios sobre cambios a nivel metabólico como consecuencia de estos compuestos, han afirmado que la presencia de bajos niveles de ftalato (10mg/kg en orina) contribuyen a aumentar la cantidad de ácido aspártico (estimulante de la síntesis de testosterona), incrementando la concentración y movilidad espermática, así como son capaces de aumentar la concentración de hidroxiestrona, la cual contribuye a restablecer el equilibrio hormonal. Sin embargo, estas investigaciones no son del todo consistentes y los niveles establecidos varían en las diversas publicaciones analizadas, además de que con niveles elevados de ftalatos (750mg/kg en orina) no se ve reflejada ninguna mejora metabólica, sugiriendo que estas pueden provocar efectos adversos sobre la fertilidad masculina (Hipwell et al., 2019; Liu et al., 2017; Mendiola y Lázaro, 2017; Wu et al., 2017; Yang et al., 2017).
En lo que sí coincide la mayoría de los autores es en que la presencia de ftalatos afecta negativamente a la espermatogénesis mediante el incremento de la apoptosis, el estrés oxidativo y la autofagia de las células germinales, proceso que se activa principalmente en condiciones de estrés para proteger a las células de la muerte celular programada. La apoptosis aumenta debido a la sobreexpresión de los ligandos Fas y FasL, así como de diversas caspasas. Una prueba confirmatoria de esta actividad es el estudio de los polimorfismos genéticos asociados a estos genes que se han encontrado en determinados pacientes, puesto que varios polimorfismos han ocasionado la resistencia de estos al efecto que les causa el ftalato, mientras que otros han agravado el efecto apoptótico (Huffman et al., 2018; Valenzuela-Leon y Dobrinski, 2017; Yang et al., 2017).
Pesticidas organoclorados y organofosforadosLos pesticidas son compuestos sintéticos empleados para eliminar especies de hongos o plantas que tienen un efecto dañino para el cultivo de alimentos. El uso de estos compuestos biológicamente activos ha ido incrementándose a partir de los años 60 y su exposición puede darse en el trabajo o simplemente por contacto con el ambiente. De entre los plaguicidas más relevantes, destacan los POC, como el dicloro difenil tricloroetano (DDT), y los POF, ambos tipos implicados en causar posibles daños en la espermatogénesis (Mendiola y Lázaro, 2017; Perry, 2008).
Debido a la toxicidad de los POC, en la década de los 80 fueron prohibidos en muchos países, aunque el DDT sigue empleándose para tratar la malaria y varios metabolitos son capaces de desprenderse de otros compuestos químicos. Si bien es cierto que algunas investigaciones arrojan resultados contradictorios, a altas concentraciones se ha observado una posible actividad estrogénica y, en ocasiones, una disminución de la concentración de andrógenos en los testículos por fallos en el transporte. Del mismo modo, un descenso en la concentración y movilidad espermática también parecen apreciarse como consecuencia de la presencia de POC. Además, un estudio realizado en jóvenes expuestos a este tipo de pesticidas ha demostrado que los efectos de los organoclorados son más adversos en la pubertad, ya que se han observado cambios físicos y hormonales, retraso de la maduración sexual, el crecimiento y desarrollo genital, así como afección en la producción de andrógenos y retraso en la aparición de vello púbico como consecuencia de niveles de POC elevados en suero (≥ 1.400 pg/g) (Mendiola y Lázaro, 2017; Lam et al., 2015; Perry, 2008).
En cuanto a los POF, su auge comenzó en la industria agroalimentaria cuando se prohibieron los POC, pero también son responsables de dañar la fertilidad masculina debido a su interacción con el eje hipotálamo-hipófisis-gonadal (HHG) y componentes necesarios para la funcionalidad espermática. Son capaces de afectar a los túbulos seminíferos y provocan una disminución de las hormonas LH y FSH (hormonas estimulantes de las células de Leydig y Sertoli, respectivamente), por lo que los niveles de testosterona también descienden, alterando la espermatogénesis y la proliferación de las células germinales. Los parámetros seminales que se ven afectados son la concentración, morfología y movilidad espermática, disminuyendo incluso en un 40-60% en condiciones de alta exposición. Una de las posibles razones por las que la movilidad espermática se vea alterada, se debe a que los POF son capaces de fosforilar residuos de histidina o lisina en proteínas que participan en el proceso de transporte de ATP en la cola y pieza media espermática, por lo que disminuyendo la presencia de ATP, desciende también la movilidad. Además, estos efectos se han visto intensificados en trabajadores que llevan expuestos a estos pesticidas muchos años, del mismo modo que también se han visto agravados durante la época de primavera, justo donde son aplicados con mayor frecuencia estos productos (Mendiola y Lázaro, 2017; Recio-Vega et al., 2008).
Al igual que en el caso del BPA, no está reflejada una concentración determinada de pesticidas a partir de la cual ejerzan los efectos adversos mencionados. En los artículos revisados, la concentración de metabolitos procedentes de los diversos pesticidas varía en función del tipo de metabolito y del tiempo de exposición del individuo. Por ejemplo, para los POC, concentraciones en torno a 9mg/l en orina del ácido 2,4-diclorofenoxiacético puede causar efectos nocivos en la fertilidad masculina. En el caso de los POF, se observan diferencias significativas en varones que llevan más de 10 años trabajando en comparación con los que llevan menos de 5 años y los no expuestos a pesticidas en sus trabajos. Aunque no se mencionan los niveles de POF a los que están expuestos, los resultados de una de las publicaciones han mostrado que concentraciones en orina de entre 2-7mg/l son capaces de afectar a la calidad seminal (Lam et al., 2015; Perry, 2008; Recio-Vega et al., 2008).
Por último, es importante señalar que tanto los POC como los POF son capaces de dañar el ADN espermático y la integridad de la cromatina, consecuencia de afectar a la maduración espermática y al aumento de la apoptosis, así como de provocar alteraciones cromosómicas por fallos durante la meiosis. Por tanto, la descendencia también puede verse afectada como consecuencia de la transmisión de alteraciones genéticas espermáticas (Perry, 2008).
Bifenilos policloradosComo la mayoría de los tóxicos ambientales, los BPC son una serie de compuestos químicos lipofílicos ubicuos ampliamente utilizados en la industria para elaborar transformadores, aislantes eléctricos, solventes, etc., hasta que fueron prohibidos en la época de los 70 debido a su elevada toxicidad y al verse asociados a efectos adversos sobre la salud. A pesar de su prohibición, los BPC son compuestos altamente persistentes, que pueden encontrarse tanto en el aire como en el agua, adquiriéndolos la mayor parte de la población durante la ingesta de alimentos. Además de estar asociados a enfermedades como problemas cardiovasculares, se han visto relacionados con el sistema reproductor masculino como consecuencia de su actividad disruptora endocrina (Chao et al., 2017; Mendiola y Lázaro, 2017; Meeker y Hauser, 2010).
Los niveles de BPC en suero analizados en varones en las distintas investigaciones son muy variados, aunque algunas de ellas coinciden en que a partir de aproximadamente 200 ng/g de lípidos en suero los efectos negativos sobre la fertilidad masculina pueden ser más notables. A concentraciones bajas, los BPC no parecen tener efectos adversos sobre el sistema endocrino o la calidad seminal. Sin embargo, a concentraciones elevadas se han dado alteraciones del eje HHG, provocando en la mayoría de los casos un descenso de la concentración de testosterona. En varios estudios se han observado cambios histomorfológicos, tales como reducción del epidídimo y de las células de Leydig, además apoptosis de las células germinales, de modo que tanto estas alteraciones como las hormonales, dan lugar a variaciones de los parámetros seminales. Concretamente, la morfología y la movilidad espermática son las principales afectadas, aumentando la cantidad de espermatozoides anormales en un 12% y disminuyendo los espermatozoides móviles en un 22% (Mendiola y Lázaro, 2017; Meeker y Hauser, 2010). Esta reducción de la movilidad se debe a que en presencia de BPC se genera una cantidad elevada de especies reactivas de oxígeno, las cuales interactúan con los lípidos poliinsaturados de las membranas espermáticas afectando el transporte de ATP y, por tanto, promoviendo una disminución del movimiento espermático que, en última instancia, puede generar la muerte de los espermatozoides (Chao et al., 2017; Mendiola y Lázaro, 2017).
Desórdenes emocionales y del sueñoEl estilo de vida actual está marcado por una fuerte presión socioeconómica, capaz de provocar cambios en el organismo como consecuencia de la carga de trabajo o estar desempleado. Todo ello ha llevado a aumentar el porcentaje de personas que sufren de algún trastorno emocional, destacando entre estos el estrés, la ansiedad y la depresión, incrementándose a su vez la falta de sueño. Afectan a la salud física y mental de la persona, alterando sistemas como el endocrino y el reproductor, pudiendo generar problemas de infertilidad (Wise et al., 2018; Alvarenga et al., 2015; Jensen et al., 2013; Li et al., 2011).
Una de las consecuencias principales del estrés es la desregulación de las células de Sertoli y de Leydig, dando lugar al descenso de una décima parte de los niveles normales de testosterona en los testículos. Además, teniendo en cuenta que la mayor parte de la testosterona se libera durante el sueño y que los desórdenes emocionales están ligados a la falta de descanso nocturno, es lógico que los niveles de testosterona se vean reducidos. Por otra parte, tanto el eje hipotalámico-hipofisario-adrenal como el HHG son responsables del control de la respuesta inmunitaria, de modo que también aparece una desregulación del sistema inmunitario, aumentando el número de leucocitos en el plasma seminal, afectando a la calidad espermática (Durairajanayagam, 2018; Wise et al., 2018; Nargund, 2015; Collodel et al., 2008; Conrad et al., 2002).
La mayoría de los parámetros seminales se ven afectados, destacando la disminución de la vitalidad, la movilidad progresiva y la concentración, esta última en valores de hasta un tercio del total, y, en menor medida, hay estudios que han encontrado fluctuaciones en cuanto a la morfología y el volumen seminal (Jensen et al., 2013; Li et al., 2011; Collodel et al., 2008). En esta reducción de la calidad seminal también participa el óxido nítrico, cuya síntesis en bajas cantidades es esencial para la espermatogénesis y para el mantenimiento de la función eréctil. La alteración del sistema endocrino supone una desregulación en la producción de óxido nítrico, incrementándose considerablemente en el plasma seminal. En altas concentraciones, este gas es tóxico para las células y da lugar al aumento de los procesos de apoptosis y necrosis, de ahí que la vitalidad, la movilidad y la concentración espermática se vean drásticamente disminuidas. Además, junto con el aumento del estrés oxidativo, el óxido nítrico genera una mayor proporción de ADN espermático fragmentado y afecta a la membrana lipídica de los espermatozoides, generando en ocasiones problemas cromosómicos, como aneuploidías (Alvarenga et al., 2015; Vellani et al., 2013; Collodel et al., 2008).
Así pues, los trastornos emocionales, junto con la consiguiente falta de sueño asociada, puede dañar notablemente la capacidad reproductora masculina. No obstante, no se trata de un factor masculino severo, puesto que con ejercicio o tratamiento médico se pueden disminuir las situaciones de ansiedad y depresión, recuperando horas de sueño y revirtiendo el efecto negativo que ejercían a nivel hormonal y sobre los parámetros espermáticos (Lafuente y Jacquemin, 2017; Alvarenga et al., 2015; Jensen et al., 2013; Li et al., 2011).
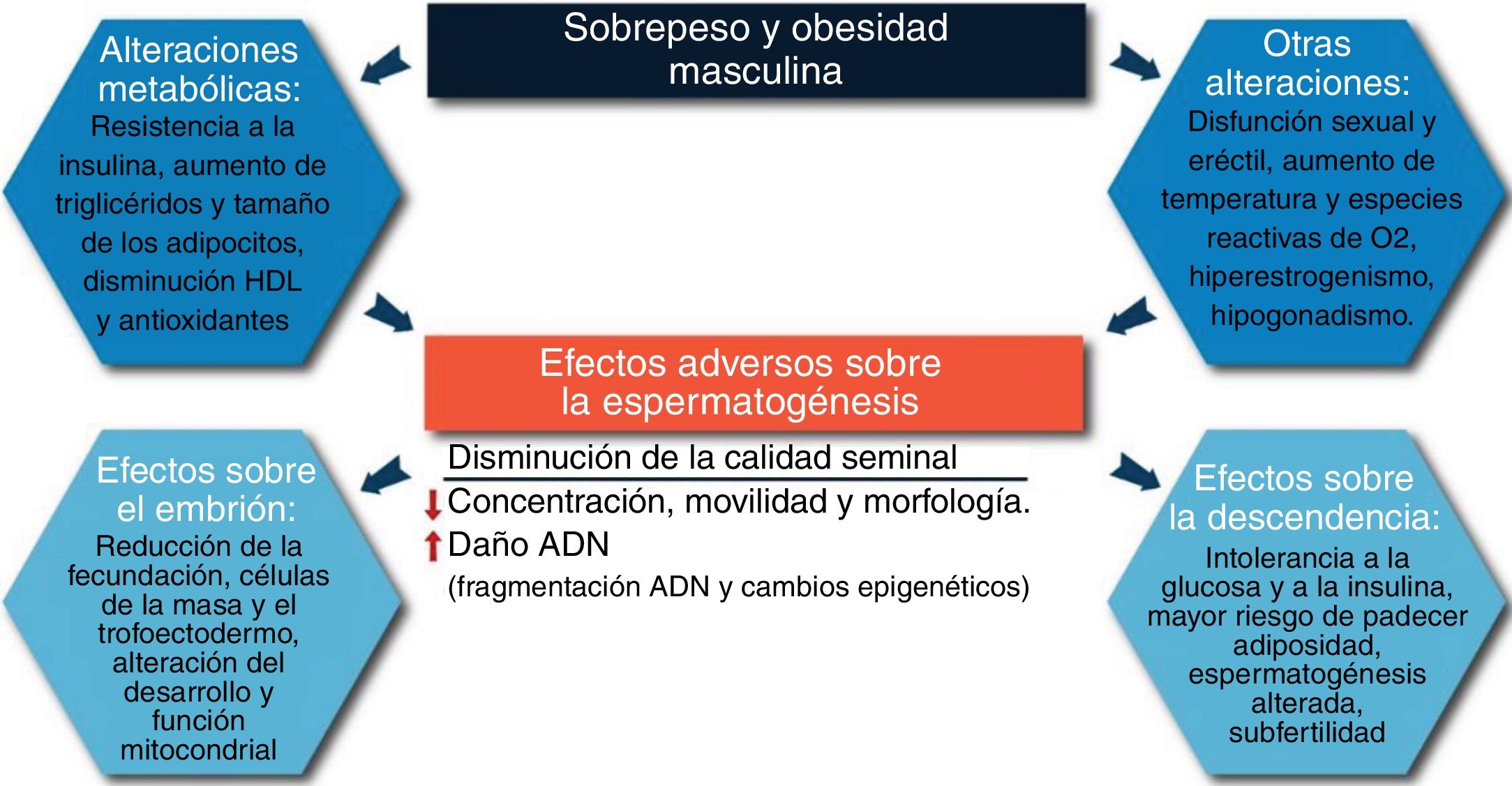
Sobrepeso y obesidadEl sobrepeso, definido como un índice de masa corporal (IMC) superior a 25kg/m2, y la obesidad, IMC mayor de 30kg/m2, llevan en constante auge desde hace varias décadas, encontrándose a día de hoy que entre el 60 y el 70% de los hombres en los países industrializados presentan sobrepeso y obesidad, de los cuales una quinta parte de ellos son niños. Las causas más frecuentes de presentar sobrepeso u obesidad son la ingesta de alimentos ricos en grasas y llevar una vida sedentaria, dando lugar a un desequilibrio energético en el organismo (Fullston et al., 2015; McPherson et al., 2014; Cabler et al., 2010). Esta desregulación genera alteraciones principalmente en el metabolismo de la glucosa, teniendo como consecuencias la resistencia del organismo a la insulina o un incremento del tamaño de los adipocitos, debido a que se acumulan grandes cantidades de grasa en ellos, provocando la adiposidad. Por todo ello, se ha visto relacionada en muchos estudios con la infertilidad masculina (fig. 2) (Craig et al., 2017; Fullston et al., 2015; Meikle et al., 2012; Cabler et al., 2010; Alegría-Ezquerra et al., 2008).
Efectos del sobrepeso y la obesidad sobre el sistema reproductor masculino. La obesidad genera principalmente alteraciones metabólicas y endocrinas, provocando daños a nivel espermático. En última instancia, se verá comprometido el desarrollo embrionario, además de existir la posibilidad de transmisión de enfermedades genéticas.
Adaptado de McPherson et al., 2014.
Con el exceso de grasa corporal, se produce un aumento de los estrógenos que ejercen un efecto adverso sobre el hipotálamo, viéndose alterado y dificultando la liberación en concentraciones normales de la hormona liberadora de gonadotropinas. De esta forma, se produce una menor concentración de LH y de FSH, lo que altera la cascada que provoca la secreción de testosterona por parte de las células de Leydig, disminuyendo así la concentración de la misma, efecto agravado por el incremento de estradiol como consecuencia del aumento de estrógenos. Por otro lado, a las personas que presentan obesidad les cuesta más respirar, principalmente durante las horas de sueño, lo que provoca falta del mismo y también reducción de la producción de testosterona. Por tanto, esta alteración del eje HHG da lugar a fallos en la espermatogénesis, así como a la alteración de la calidad seminal, donde la concentración, la movilidad y la morfología espermática se ven reducidas en más de un 20%. De este modo, las tasas de recién nacido vivo y la probabilidad de embarazo también se ven disminuidas (Craig et al., 2017; Stokes et al., 2014; Meikle et al., 2012; Cabler et al., 2010).
El sobrepeso y la obesidad también son responsables de provocar una disminución de los compuestos antioxidantes en el organismo, además de un incremento de las especies reactivas de oxígeno. Esto provoca un aumento de la fragmentación del ADN y el daño de la actividad mitocondrial espermática, lo cual deriva, a su vez, en alteraciones de la calidad espermática, que más frecuentemente se han visto asociadas a fluctuaciones en la concentración de espermatozoides (Raad et al., 2019; Craig et al., 2017; Meikle et al., 2012; Cabler et al., 2010).
Por otra parte, el epigenoma espermático es otro de los grandes afectados en casos de adiposidad, reduciéndose el número de metilaciones de ADN y alterándose las modificaciones en las histonas y la expresión de ARN no codificante. Estas marcas epigenéticas son esenciales para la correcta realización de la espermatogénesis y para el desarrollo adecuado del embrión, puesto que cambios en el patrón epigenómico causan una reducción en el número de células de la masa y el trofoectodermo del embrión. Así pues, varias investigaciones sobre el efecto de la obesidad en la descendencia han mostrado datos que indican que el metabolismo alterado de la glucosa y la intolerancia a la insulina puede transmitirse a los hijos, del mismo modo que heredan un mayor riesgo de presentar sobrepeso y, además, la mayoría ve reducidas las posibilidades para tener descendencia, ya que se heredan las alteraciones genéticas, pueden llegar a crearse mutaciones nuevas y presentan una espermatogénesis alterada (Raad et al., 2019; Craig et al., 2017; Fullston et al., 2015; McPherson et al., 2014).
Por último, es importante mencionar que los efectos sobre la fertilidad masculina producidos por el sobrepeso y la obesidad son, en su mayoría, reversibles si se lleva a cabo un cambio en el estilo de vida. El tiempo estimado para observar una mejoría en los valores espermáticos o para restablecer los valores hormonales no está definido, ya que dependen en gran medida de cada individuo. Sin embargo, está demostrado que existe una recuperación más rápida y efectiva si se combinan el ejercicio y una dieta baja en grasas y saludable que si solo se lleva a cabo uno de ellos. Por otra parte, hay pacientes que requieren del uso fármacos para controlar los niveles hormonales o incluso hay casos en los que es necesaria una intervención quirúrgica gástrica. Todo depende del grado de obesidad que presente, de variables y características físicas o del tiempo que se lleve en ese estado, entre otros factores (Craig et al., 2017; Stokes et al., 2014; Cabler et al., 2010).
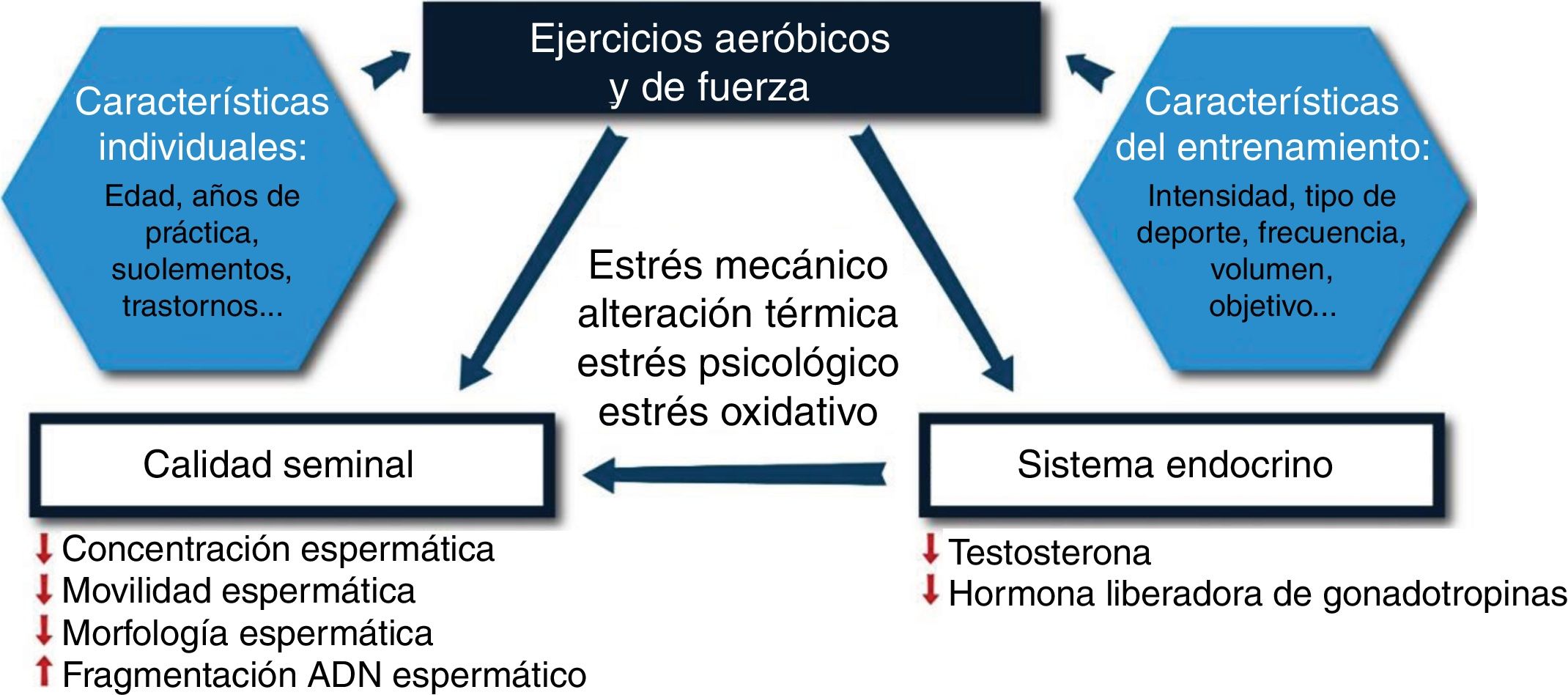
Actividad físicaRealizar un mínimo de ejercicio físico a la semana ya es considerado como óptimo por los especialistas, estableciéndose unos 5.000 pasos al día o 5 h a la semana de ejercicio, aproximadamente, como adecuado y bueno para la salud. Sin embargo, también se han detectado posibles efectos adversos sobre la fertilidad masculina como consecuencia de practicar ejercicio. No se ha llegado a una determinación clara y precisa, pero cada vez son más los estudios realizados que muestran datos relevantes al respecto, concretamente, indicando que pueden existir alteraciones hormonales y espermáticas (fig. 3). Llegados a este punto, es importante hacer distinciones, puesto que no cualquier tipo de deporte o forma de practicarlo va a tener consecuencias sobre la fertilidad. Así pues, dependiendo del tipo de deporte, la intensidad o el objetivo del mismo, así como de las características individuales, los efectos para la salud pueden ser beneficiosos o, por el contrario, la realización de actividad física puede suponer un factor de riesgo para la fertilidad masculina (Ibáñez-Pérez et al., 2019; Jóźków et al., 2017; Jóźków y Rossato, 2017; Vaamonde et al., 2017; Gaskins et al., 2014).
Efectos de la actividad física aeróbica y de fuerza sobre el factor masculino. Las características individuales, así como las características del entrenamiento, influyen en cómo se ve afectado el sistema reproductor masculino, pudiendo provocar desregulación hormonal y disminución de la calidad seminal.
Adaptado de Vaamonde et al., 2017.
En primer lugar, es importante tener en cuenta la medida de intensidad (consumo de oxígeno) o carga de trabajo y el tiempo dedicado al deporte que se emplea en la mayoría de las investigaciones analizadas, que se conoce como «equivalente metabólico total» (MET) por hora a la semana. Una actividad física moderada se considera entre 10-40 METh/semana, elevada entre 40-80 METh/semana y de élite o excesiva a partir de 80 METh/semana. El sistema endocrino es muy susceptible a los cambios en el organismo, por lo que con el deporte también puede verse afectado. Si el ejercicio se realiza a una intensidad moderada, los niveles hormonales suelen mantenerse estables o presentar fluctuaciones leves que no repercuten de forma negativa en el individuo. Cuando se lleva a cabo un entrenamiento de fuerza o aeróbico y, además, de forma excesiva, se produce una desregulación hormonal destacada por el descenso de los niveles de la hormona liberadora de gonadotropinas y de testosterona. Además, los ejercicios de fuerza suelen estar relacionados con la ingesta de compuestos para ganar masa muscular y que los músculos se adapten a estos esfuerzos, como, por ejemplo, los esteroides anabólicos androgénicos. La ingesta de estos fármacos también contribuye a alterar el sistema endocrino, incluso de forma irreversible. Por tanto, los atletas de élite y aquellos que practican ejercicio de alto rendimiento o de forma abusiva presentan niveles hormonales muy distintos de los que practican deporte de forma moderada, lo cual repercute directamente en los parámetros espermáticos, ya que las células de Sertoli y Leydig se verán notablemente afectadas (Ibáñez-Pérez et al., 2019; Jóźków y Rossato, 2017; Vaamonde et al., 2017; Brant et al., 2010).
En cuanto a la calidad seminal, algunos autores han indicado que realizar ejercicio moderado o incluso de intensidad elevada (resultados contradictorios en este caso) puede mantenerla o presentar algunos parámetros espermáticos más elevados, pero se encuentra considerablemente dañada si se practica ejercicio aeróbico o de fuerza a un nivel extremo (≥ 80 METh/semana). Los parámetros principalmente alterados son la concentración, la movilidad y la morfología, todos ellos disminuyendo drásticamente, incluso más que en personas sedentarias. Esta reducción de la calidad seminal se debe al descenso de los niveles de testosterona, a la disfunción de las células de Sertoli y Leydig, a la generación de estrés oxidativo con la consecuente disminución de agentes antioxidantes como el ácido ascórbico, así como al choque térmico generado y a los traumatismos testiculares que pueden tener lugar. El incremento de temperatura promovido por varios deportes (conducción, ciclismo, etc.) en la zona de los testículos tiene un gran número de consecuencias para los mismos, además de la alteración de los parámetros espermáticos, destacando la atrofia testicular, la apoptosis de las células germinales y el aumento de las especies reactivas de oxígeno. Todo ello deriva en última instancia en daños en el ADN, como, por ejemplo, se ha observado un aumento de la fragmentación (Jóźków et al., 2017; Jóźków y Rossato, 2017; Vaamonde et al., 2017; Gaskins et al., 2014; Brant et al., 2010).
A día de hoy, existe una gran variedad de deportes que millones de personas en todo el mundo practican, cuyo entrenamiento exhaustivo de forma constante supone un riesgo para la fertilidad masculina. En el caso del fútbol o el baloncesto, la concentración espermática se ve disminuida conforme avanza la temporada, específicamente, de mitad de temporada en adelante. Esto se debe a que se reducen los niveles de testosterona como consecuencia del doble esfuerzo en los entrenamientos o de entrenamientos más intensos para alcanzar un buen puesto en la clasificación, así como al estrés al que pueden estar sometidos por la situación deportiva en la que se encuentren. Para los corredores de larga distancia, con entrenamientos de más de 5 días a la semana con una duración de 2 h, la concentración, movilidad y, sobre todo, morfología espermática parecen reducirse considerablemente. Estos parámetros también se ven afectados por aquellos que practican alpinismo o algún deporte de montaña, ya que el descenso en los niveles de oxígeno es perjudicial para el proceso de espermatogénesis. La concentración y la movilidad espermática disminuyen casi en un 50 y un 20%, respectivamente, mientras que el porcentaje de espermatozoides con morfología anormal se incrementa en un 10% aproximadamente (Jóźków y Rossato, 2017; Vaamonde et al., 2017).
Finalmente, la mayoría de las investigaciones destacan el ciclismo como el deporte que más afecta a la fertilidad masculina. De hecho, es el único deporte conocido hasta la fecha cuya práctica regular en condiciones normales (≥ 5h/semana) o moderadas supone un riesgo elevado para el factor masculino. Estar sentado durante varias horas en el sillín o el sobrecalentamiento gonadal, junto con el hecho de llevar ropa muy ajustada, genera consecuencias tales como la alteración de las hormonas sexuales, la disminución de la movilidad espermática en un 34%, el incremento de las anomalías morfológicas en los espermatozoides y el aumento del estrés oxidativo que desemboca en un incremento de la fragmentación del ADN espermático (Jóźków y Rossato, 2017; Gaskins et al., 2014; Brant et al., 2010).
Del mismo modo que ocurre con otros factores, los efectos adversos producidos por el exceso de actividad física son generalmente reversibles. La disminución de la intensidad de realización del ejercicio y no exceder el número de entrenamientos adecuados pueden devolver a sus valores normales los parámetros seminales y el sistema endocrino, con el consiguiente mantenimiento de la fertilidad masculina (Ibáñez-Pérez et al., 2019; Jóźków et al., 2017; Vaamonde et al., 2017).
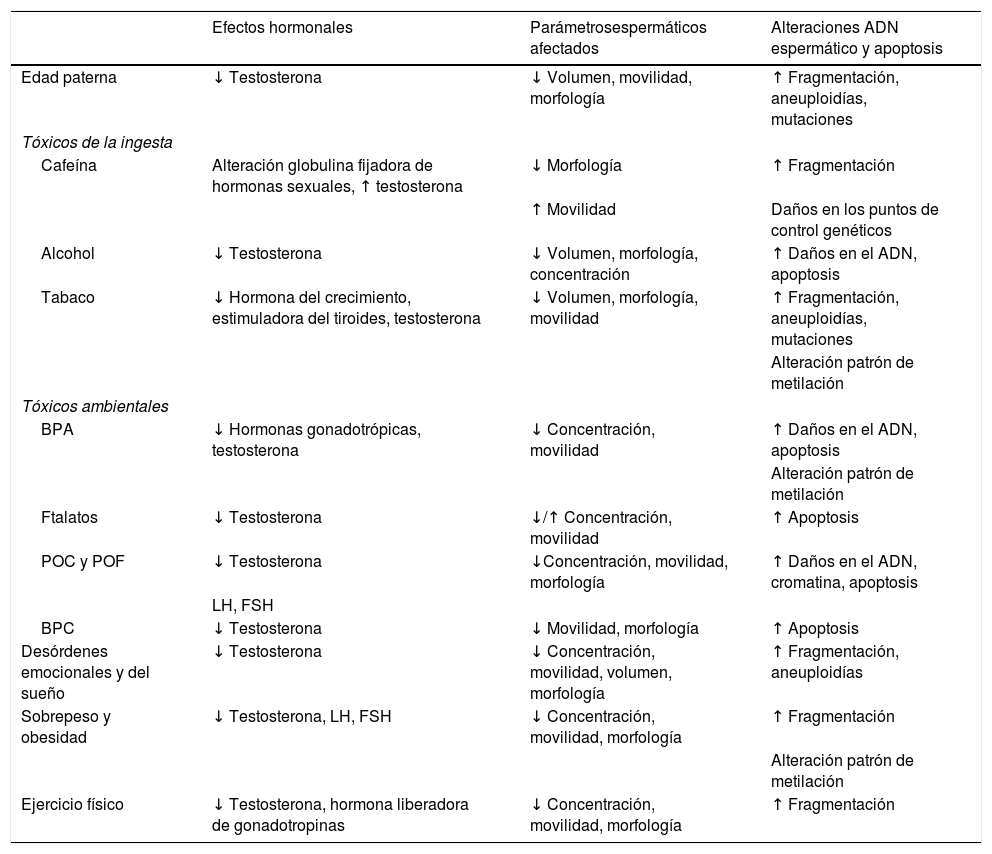
DiscusiónLos factores relacionados con el estilo de vida y determinados compuestos tóxicos pueden tener un impacto negativo sobre la fertilidad masculina. Son capaces de provocar cambios histomorfológicos y de afectar al sistema endocrino, principalmente disminuyendo los niveles de testosterona, y con ello una desregulación del sistema reproductor masculino, dañando en última instancia la calidad seminal. Además, otra de las consecuencias que generan es el daño al ADN espermático, ya sea por roturas de doble cadena, aumento de aneuploidías, mutaciones o cambios epigenéticos (tabla 1). Estos problemas se deben también a que la mayoría de los factores generan un aumento del estrés oxidativo, aumentando la apoptosis.
Resumen de los factores capaces de alterar la fertilidad masculina y sus principales efectos. Se exponen los efectos negativos más importantes ocasionados sobre los niveles hormonales, calidad espermática y sobre el ADN que el estilo de vida actual y ciertos compuestos químicos son capaces de provocar con relación a la fertilidad masculina
| Efectos hormonales | Parámetrosespermáticos afectados | Alteraciones ADN espermático y apoptosis | |
|---|---|---|---|
| Edad paterna | ↓ Testosterona | ↓ Volumen, movilidad, morfología | ↑ Fragmentación, aneuploidías, mutaciones |
| Tóxicos de la ingesta | |||
| Cafeína | Alteración globulina fijadora de hormonas sexuales, ↑ testosterona | ↓ Morfología | ↑ Fragmentación |
| ↑ Movilidad | Daños en los puntos de control genéticos | ||
| Alcohol | ↓ Testosterona | ↓ Volumen, morfología, concentración | ↑ Daños en el ADN, apoptosis |
| Tabaco | ↓ Hormona del crecimiento, estimuladora del tiroides, testosterona | ↓ Volumen, morfología, movilidad | ↑ Fragmentación, aneuploidías, mutaciones |
| Alteración patrón de metilación | |||
| Tóxicos ambientales | |||
| BPA | ↓ Hormonas gonadotrópicas, testosterona | ↓ Concentración, movilidad | ↑ Daños en el ADN, apoptosis |
| Alteración patrón de metilación | |||
| Ftalatos | ↓ Testosterona | ↓/↑ Concentración, movilidad | ↑ Apoptosis |
| POC y POF | ↓ Testosterona | ↓Concentración, movilidad, morfología | ↑ Daños en el ADN, cromatina, apoptosis |
| LH, FSH | |||
| BPC | ↓ Testosterona | ↓ Movilidad, morfología | ↑ Apoptosis |
| Desórdenes emocionales y del sueño | ↓ Testosterona | ↓ Concentración, movilidad, volumen, morfología | ↑ Fragmentación, aneuploidías |
| Sobrepeso y obesidad | ↓ Testosterona, LH, FSH | ↓ Concentración, movilidad, morfología | ↑ Fragmentación |
| Alteración patrón de metilación | |||
| Ejercicio físico | ↓ Testosterona, hormona liberadora de gonadotropinas | ↓ Concentración, movilidad, morfología | ↑ Fragmentación |
De entre todos los factores analizados en esta revisión, la mayoría de los autores coinciden en que el tabaco, el BPA, los POF, la obesidad y el exceso de ejercicio físico destacan como claramente tóxicos para la fertilidad masculina. El tabaco es considerado altamente nocivo debido a su composición química, conteniendo agentes cancerígenos. Componentes como la nicotina y el cadmio son capaces de provocar alteración del eje endocrino y daños en el ADN espermático, aumentado la fragmentación y alterando los patrones de metilación (Fragou et al., 2019; Stillman et al., 1986). Por su parte, el BPA y los POF inducen elevados niveles de apoptosis y, al igual que el tabaco, desregulan el sistema endocrino y generan cambios histomorfológicos en las células de Leydig y en los túbulos seminíferos (Mendiola y Lázaro, 2017). La obesidad y la práctica intensiva de ejercicio físico provocan también un aumento del estrés oxidativo que cursa con un aumento de la fragmentación del ADN (Jóźków y Rossato, 2017; Cabler et al., 2010). Es importante señalar que, además del resto de los efectos notables individualmente, todos estos compuestos coinciden en la disminución drástica de la testosterona, fundamental para una espermatogénesis eficiente, y disminución de la movilidad y concentración espermática (salvo el tabaco), relevante a la hora de determinar la calidad seminal. Es por ello que, con todos estos efectos en conjunto, pueden considerarse como los factores principalmente relacionados con el descenso de la fertilidad masculina.
Si bien es cierto que para todos los factores se han encontrado publicaciones que presentan resultados inconclusos o contradictorios en mayor o menor medida, hay determinados factores que destacan en cuanto a la variabilidad de los mismos. La edad paterna es uno en los que mayor variación se ha encontrado, principalmente en cuanto a su relación con los parámetros espermáticos. Estos apenas se ven influidos y hay casos en los que se ha visto incluso un ligero aumento, mientras que en los escasos artículos en los que se ha visto disminución esta fluctuaba entre porcentajes significativos y no significativos, por lo que se trata de un factor cuyo efecto sobre la fertilidad no está todavía esclarecido. Por su parte, tanto la cafeína como el alcohol comprenden muchos efectos adversos sobre la fertilidad masculina descritos, pero sigue habiendo un gran número de publicaciones que contradicen estos resultados o que no encuentran una relación significativa. Esto puede deberse a que el grado de afección varía considerablemente en función del tiempo de consumo y el tipo de producto (el café contiene más cafeína que los refrescos, por ejemplo), encontrándose muchos trabajos en los que estos difieren y resultando complicado comparar los datos obtenidos. Además, hay que tener en cuenta que el consumo de cafeína, alcohol y tabaco combinados es muy frecuente, observándose una disminución de la calidad espermática y una desregulación hormonal mucho mayor que cando se ingieren por separado. Por ello, también resulta difícil establecer efectos individuales. Algo similar ocurre en el caso de los tóxicos ambientales, más concretamente con los ftalatos, POC y BPC, cuyos resultados no son tan claros como los del BPA o los POF. El tiempo de exposición a estos compuestos es fundamental para que ejerzan sus efectos, siendo este muy variable entre los diferentes artículos revisados. De hecho, en el caso de los pesticidas también varía según la estación del año y es importante considerarlo. Por último, los desórdenes emocionales y del sueño son los factores de estudio más recientes y, aunque parece claro el efecto negativo que el estrés o la depresión pueden tener en el sistema reproductor masculino, están muy influidos por el estilo de vida, ya que, en estas situaciones, el consumo de tabaco, alcohol o café, por ejemplo, es muy frecuente, interfiriendo con los resultados obtenidos.
Por tanto, hay que destacar que la variabilidad de los datos observados se debe en gran parte a la confluencia de los factores analizados, puesto que en muchos de los artículos no se excluían los factores que pueden interferir, y a la imposibilidad de controlar la intervención de estos, como en el caso de los tóxicos ambientales presentes en el día a día. En esta variabilidad también participan las diferencias encontradas en la metodología de los experimentos, así como en la población de estudio, por ejemplo, muchas investigaciones trabajan con roedores o con cultivos celulares, por lo que la extrapolación al ser humano también resulta complicada. Para obtener unos resultados más consistentes y fiables, se requiere una mayor investigación en el campo, llevada a cabo en una población de estudio más o menos similar, con unos criterios de selección bien definidos y que se separen de los resultados la influencia del resto de factores que no se están investigando.
Se ha visto que los efectos generados a nivel hormonal, de la calidad seminal y del ADN afectan, en última instancia, a la capacidad para obtener embarazo y a la posibilidad de transmitir defectos a la descendencia. El aumento de la edad paterna, el consumo de tóxicos de la ingesta y la obesidad muestran un mayor aumento del número de abortos, principalmente ocasionados por el daño al ADN, provocando roturas de doble cadena o aumentando el número de aneuploidías, disminuyendo con ello la tasa de embarazo (Lafuente y Jacquemin, 2017; Cabler et al., 2010; Harrison et al., 1980). Del mismo modo, estos compuestos junto con los tóxicos ambientales se han relacionado con la alta posibilidad de transmitir alteraciones genéticas a la descendencia, dependiendo de la existencia de mutaciones en el ADN, fragmentación o alteración del patrón epigenético en el espermatozoide (Mendiola y Lázaro, 2017; Stillman et al., 1986). Así pues, son muchos los estudios que indican recomendaciones para mejorar la fertilidad masculina, como realizar ejercicio moderado, disminuir la ingesta de productos tóxicos y llevar una dieta más saludable, tratando de aumentar las probabilidades de éxito en el embarazo. Aunque no se ha establecido el tiempo necesario para ver una mejoría de la calidad seminal o restablecimiento hormonal, el periodo de 3 meses podría ser un buen punto de partida, ya que es el tiempo en el que se completa un nuevo ciclo de espermatogénesis. No obstante, la recuperación también depende de factores individuales, el tiempo de consumo o exposición, si están dañadas células germinales o el ADN (en tal caso no sería reversible), etc.
Por otro lado, a la hora de determinar si un paciente presenta infertilidad o no, el primer paso es la realización de un espermiograma, junto con la elaboración de la historia clínica (Pan et al., 2018). Sin embargo, este análisis es insuficiente en muchos casos para determinar la infertilidad masculina, principalmente en los casos de infertilidad idiopática. El problema puede estar asociado a daños en el ADN espermático, como elevada fragmentación o mutaciones en genes esenciales para la fecundación, por lo que el análisis de los parámetros seminales no sería de utilidad. Además, la evaluación de parámetros como la morfología es muy subjetiva, puesto que varía significativamente entre unos expertos y otros. De esta forma, a la hora de evaluar la infertilidad, es muy importante tener en cuenta que no solo influye el estado de la calidad espermática, sino que hay otros factores relevantes cuyo análisis sería de gran ayuda e interés.
En definitiva, el efecto que el estilo de vida actual y la creciente contaminación atmosférica tienen sobre la fertilidad masculina concuerda con el hecho de que la calidad seminal se ha visto reducida en las últimas décadas (Sharpe, 2000). Teniendo en cuenta que la sociedad actual sigue un ritmo de vida acelerado, en el que estrés y los cambios en la dieta son los predominantes, y que cada vez es mayor la exposición a compuestos tóxicos, todos los factores analizados se han visto implicados en la aparición o el agravamiento del factor masculino. Esta situación puede solventarse mejorando los hábitos de vida y, por otra parte, para aquellos que presenten un grado de infertilidad mayor, ya sea por problemas genéticos, por la edad o porque decidieron preservar su fertilidad, la reproducción asistida ofrece un amplio abanico de estrategias que pueden llevarse a cabo para conseguir descendencia, destacando la inseminación artificial, la inyección intracitoplasmática de espermatozoides o la criopreservación.
ConclusionesTanto los factores del estilo de vida como los compuestos tóxicos contribuyen en la aparición y el agravamiento del factor masculino, alterando el sistema endocrino, provocando un aumento del estrés oxidativo, disminuyendo la calidad seminal y dañando el ADN espermático.
La desregulación de la secreción hormonal y la disminución de los parámetros espermáticos se ven más afectadas por los tóxicos de la ingesta y los ambientales, destacando el BPA, así como por problemas de salud como la obesidad.
Factores como la edad paterna, el tabaco y algunos tóxicos ambientales (BPA y ftalatos) actúan principalmente a nivel del ADN, generando roturas o cambios epigenéticos.
Se requieren más investigaciones en el campo, cuyos criterios de selección de la población de estudio sean claros y precisos, y que se excluyan los efectos de otros factores que puedan interferir con los resultados, evitando la obtención de valores inconclusos.
Las soluciones para mejorar la infertilidad o para tener descendencia pasan por cambiar los hábitos de vida hacia unos más saludables, evitar los excesos y, en los casos en los que sea necesario, se pueden emplear técnicas de reproducción asistida.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.