En medicina existe un interés creciente por la predicción del riesgo individual de los pacientes para desarrollar un determinado problema de salud o para predecir su respuesta a un tratamiento. Dado que la fecundación in vitro (FIV) puede ser estresante física y emocionalmente, y que no está exenta de riesgos para la salud, las parejas con esterilidad candidatas a una FIV deben ser bien informadas acerca de las posibilidades de éxito antes de cada ciclo de tratamiento. Presentamos una revisión sistemática y un análisis crítico de los modelos predictivos de respuesta ovárica y de gestación en FIV, demostrando que en muchas ocasiones la calidad de dichos modelos es baja. La metodología inadecuada a la hora de desarrollar un modelo predictivo dificulta su aplicación en la práctica clínica. Es fundamental desarrollar y disponer de modelos predictivos metodológicamente adecuados con la finalidad de optimizar nuestra capacidad predictiva en reproducción asistida y alcanzar una verdadera individualización y personalización de la medicina reproductiva.
In medicine, there is a growing interest in predicting the individual risk of patients to develop a specific health problem or to predict their response to a treatment. Since in vitro fertilisation (IVF) an be physically and emotionally stressful, and as it is not free of health risks, the couples candidates for IVF should be well informed about the chances of success before each treatment cycle. A systematic review and a critical analysis of predictive models of ovarian response to stimulation and pregnancy after IVF is presented, showing, that in many cases the quality of these models is low. The inadequate methodology when developing a predictive model makes it difficult to apply in clinical practice. It is essential to develop, and to have methodologically appropriate predictive models, in order to optimise predictive capacity in assisted reproduction and achieve a true individualisation and personalisation in reproductive medicine.
En los últimos años estamos asistiendo a un cambio de paradigma importante en la forma de tratar a nuestras pacientes que requieren una estimulación ovárica. Hasta hace muy poco, las decisiones las tomábamos basándonos en estudios aleatorizados que comparaban diferentes estrategias y nos aportaban soluciones para las pacientes con el perfil de las incluidas en los ensayos clínicos, que no siempre son un reflejo de la realidad clínica. Pero evidentemente no individualiza la decisión, sino que es la misma para la media de pacientes que son incluidas en el estudio. En cambio, cada vez más las decisiones son tomadas tras el análisis de miles de datos recogidos en las bases de datos que hoy manejamos, y tras un análisis riguroso de estos datos «de la vida real», podemos individualizar —ahora sí— la pauta para esta paciente en concreto. Esto es algo que ya se hace en otras áreas de la medicina, más concretamente en la oncología, donde el empleo de bases de datos y algoritmos estadísticos para identificar la probabilidad de que ocurra un resultado basándonos en datos históricos es más habitual.
La predicción con modelos estadísticos se inició en 1955 para poder saber con antelación el tiempo que iba a hacer y de ahí se ha ido aplicando a muchas otras facetas de la vida, incluida la medicina. Disponemos cada vez de más datos y tenemos más interés en analizarlos; además, los ordenadores son cada vez más rápidos y capaces, con un software más sencillo, lo que facilita el acceso. Estos modelos nos van a permitir no confiar tanto en la intuición o la memoria, poder tener la información siempre a mano, e integrarla con el paciente. Existen ya descritos varios modelos para predecir no solo la respuesta ovárica, sino la probabilidad de éxito tras una fecundación in vitro (FIV) (ivfpredict.com) o de que un embrión sea euploide (Vera-Rodriguez et al., 2015).
La necesidad de disponer de capacidad predictiva en reproducción asistida viene dada por el hecho de que somos variables porque, tal como dijo uno de los padres de la medicina moderna, sir William Osler (1849-1919), «no hay 2caras iguales, no hay 2cuerpos iguales, no hay 2individuos que reaccionen por igual y se comporten de igual modo en condiciones fisiológicas o patológicas». Y este diferente comportamiento individual nos conduce a la necesidad de poder aplicar una verdadera medicina personalizada cuyo objetivo va a ser separar a los pacientes en diferentes grupos, con decisiones médicas, intervenciones o productos adaptados a cada paciente en función de la predicción de su respuesta o su riesgo de enfermedad. Y para poder desarrollar esta medicina personalizada necesitamos poder trabajar con precisión, es decir, conseguir la misma respuesta terapéutica en diferentes ocasiones al aplicar el mismo tratamiento en el mismo individuo, y con exactitud, es decir, aproximarnos al máximo al resultado óptimo de un tratamiento.
Predicción de respuesta ovárica para fecundación in vitroEn los inicios de la estimulación ovárica para FIV y, ante la falta evidente de un marcador de respuesta, todas las pacientes eran estimuladas con el mismo protocolo, el mismo fármaco y a las mismas dosis. Y con frecuencia nos encontrábamos con respuestas ováricas extremas que llevaban a la cancelación del ciclo por una respuesta ovárica insuficiente o a la hiperrespuesta ovárica, con el riesgo de desarrollar una entidad clínica temida, y por entonces desconocida desde el punto de vista fisiopatológico, como es el síndrome de hiperestimulación ovárica (SHO).
En 1989,Scott et al. (1989) describieron el primer marcador hormonal de respuesta ovárica, la hormona foliculoestimulante (FSH) basal, que durante mucho tiempo nos ha sido más o menos útil a la hora de predecir el grado de respuesta a la estimulación en un ciclo de FIV. Pero el valor más importante de la introducción de la FSH basal en la práctica clínica fue que abrió el camino para la investigación en el concepto de reserva ovárica y para el descubrimiento de otros marcadores de respuesta ovárica, como son la hormona antimülleriana (AMH) y el recuento de folículos antrales (AFC), los cuales nos han permitido predecir fundamentalmente las respuestas ováricas extremas, la baja respuesta y la hiperrespuesta (La Marca y Sunkara, 2014). Sin embargo, a pesar de estos grandes avances en el conocimiento de la fisiología ovárica, todavía no tenemos capacidad predictiva de la respuesta ovárica óptima, es decir, la que se asociaría a una mayor probabilidad de gestación y a una reducción de los riesgos de hipo e hiperrespuesta y que, de acuerdo con el estudio clásico deSunkara et al. (2011), sería la recuperación de 10 a 14 ovocitos.
En la actualidad, podemos decir que no controlamos todo el proceso de la FIV. A pesar de nuestro control sobre fases tan importantes como la recuperación de ovocitos, el manejo de gametos y embriones en el laboratorio y la técnica de la transferencia embrionaria, todavía existen 2«cajas negras» en este proceso en las que necesitamos capacidad predictiva: la respuesta a la estimulación ovárica y la implantación embrionaria.
En lo que respecta a la respuesta a la estimulación ovárica no somos precisos ya que, de acuerdo con el estudio deRombauts et al. (2015), realizado en 176 pacientes que fueron estimuladas en 3ciclos con la misma pauta de estimulación, si bien el 75% de las pacientes se mantenía en la misma categoría de respuesta (normal, alta o baja), el 25% restante cambiaba de categoría en los diferentes ciclos. Y tampoco somos exactos, es decir, no conseguimos siempre una respuesta ovárica óptima. Y todo ello sin olvidarnos de un subgrupo importante de pacientes, las denominadas respondedoras subóptimas, que supondrían el 43,3% de los ciclos, en las que se recuperan entre 4-9 ovocitos y que van a presentar un 20-30% menos de probabilidades de gestación que las normorrespondedoras (Sunkara et al., 2011). Este subgrupo de pacientes que presentan una respuesta subóptima tiene por definición unos marcadores de reserva ovárica normales, lo que nos impide su identificación antes del inicio de la estimulación. Así, en un estudio dePeralta et al. (2017) sobre un total de 4.019 ciclos de FIV la respuesta ovárica fue subóptima en el 44,3% de los ciclos y uno de los marcadores con mayor capacidad predictiva de respuesta ovárica, el AFC, no permitió discriminar entre las pacientes con respuesta subóptima y las normorrespondedoras.
Todo lo expuesto nos dificulta el alcanzar una verdadera individualización en la estimulación ovárica y el poder cumplir sus objetivos, que son: 1) la personalización de la estimulación ovárica, en cuanto a protocolo, tipo de gonadotrofina y dosis inicial; 2) la reducción de las respuestas ováricas extremas (tanto la baja como la hiperrespuesta) y la respuesta subóptima; 3) la eliminación de las complicaciones iatrogénicas ligadas a la estimulación, como el SHO; 4) la optimización de las tasas de recién nacido vivo (RNV), y 5) el cumplimiento de las expectativas de la paciente.
Los esfuerzos para desarrollar un modelo predictivo de respuesta ovárica reflejan la necesidad de estos modelos en la práctica clínica. Esta necesidad se explica por la incapacidad de los marcadores de reserva ovárica existentes para predecir el grado de respuesta ovárica con un 100% de certeza. El desarrollo de modelos predictivos de respuesta a una estimulación con gonadotrofinas puede permitir aproximarnos a una medicina personalizada y a la individualización en los protocolos de estimulación. Partiendo del hecho de que ningún modelo predictivo es infalible, nuestro objetivo ha sido revisar los modelos predictivos de respuesta ovárica descritos en la literatura con la finalidad de realizar un análisis crítico de los mismos y aportar objetividad y criterio cuando se analiza la literatura existente sobre el tema.
Predicción de gestación tras fecundación in vitroLa idea de establecer un modelo predictivo para poder tener una estimación lo más real posible en cuanto a la tasa de éxito esperable tras un tratamiento de reproducción asistida (TRA) surge de la necesidad de establecer un correcto asesoramiento a la pareja subfértil antes de iniciar un ciclo de FIV. La carga emocional y física, los potenciales riesgos clínicos y los elevados costes económicos que implican estos tratamientos llevaron a intentar desarrollar estas herramientas de estimación pronóstica y poder ayudar a los pacientes en la toma de decisiones. Por otra parte, contrariamente a la percepción general, la FIV no garantiza la consecución del embarazo ni siquiera acumulando varios ciclos de tratamiento, por ello sería de un gran valor poder asesorar objetiva y eficazmente a los pacientes acerca de sus expectativas reales de éxito en un programa de FIV antes de ser incluidos en él. También debemos tener en cuenta que en la mayoría de los casos se trata realmente de situaciones de subfertilidad y no de esterilidad, por lo que la gestación podría también ocurrir de manera espontánea y sin necesidad de realizar un TRA.
Las predicciones realizadas desde la experiencia clínica o la impresión clínica del médico resultarán probablemente muy imprecisas y empíricas; sin embargo, son las más ampliamente utilizadas por médicos y sistemas públicos de salud, centrándose principalmente en el factor edad femenino.
En este contexto, los modelos predictivos podrían tener un papel importante al intentar calcular las expectativas reales y objetivas de éxito de los pacientes, a priori y de forma individualizada. Aunque planteado así un modelo predictivo puede parecer la panacea en el asesoramiento médico de los pacientes, también tienen sus importantes limitaciones ya que cada modelo predictivo se ha desarrollado en un centro determinado con una población de referencia particular, y en unas circunstancias sociales y demográficas determinadas, pudiendo predecir de manera muy diferente de como lo haría en otro centro y con otras condiciones distintas. Esto sería debido a las diferencias en los resultados clínicos de cada centro de reproducción asistida en particular, a las diferencias demográficas o étnicas de la población de referencia, al desarrollo de la propia tecnología de las TRA o a la aparición de nuevos marcadores con demostrado valor predictivo a través de los continuos estudios y avances científicos que se producen en este campo. Las soluciones que se plantean para solventar estas limitaciones pasan por crear un nuevo modelo predictivo para cada centro y población de referencia o por actualizar el modelo original ajustándolo a las nuevas características poblacionales.
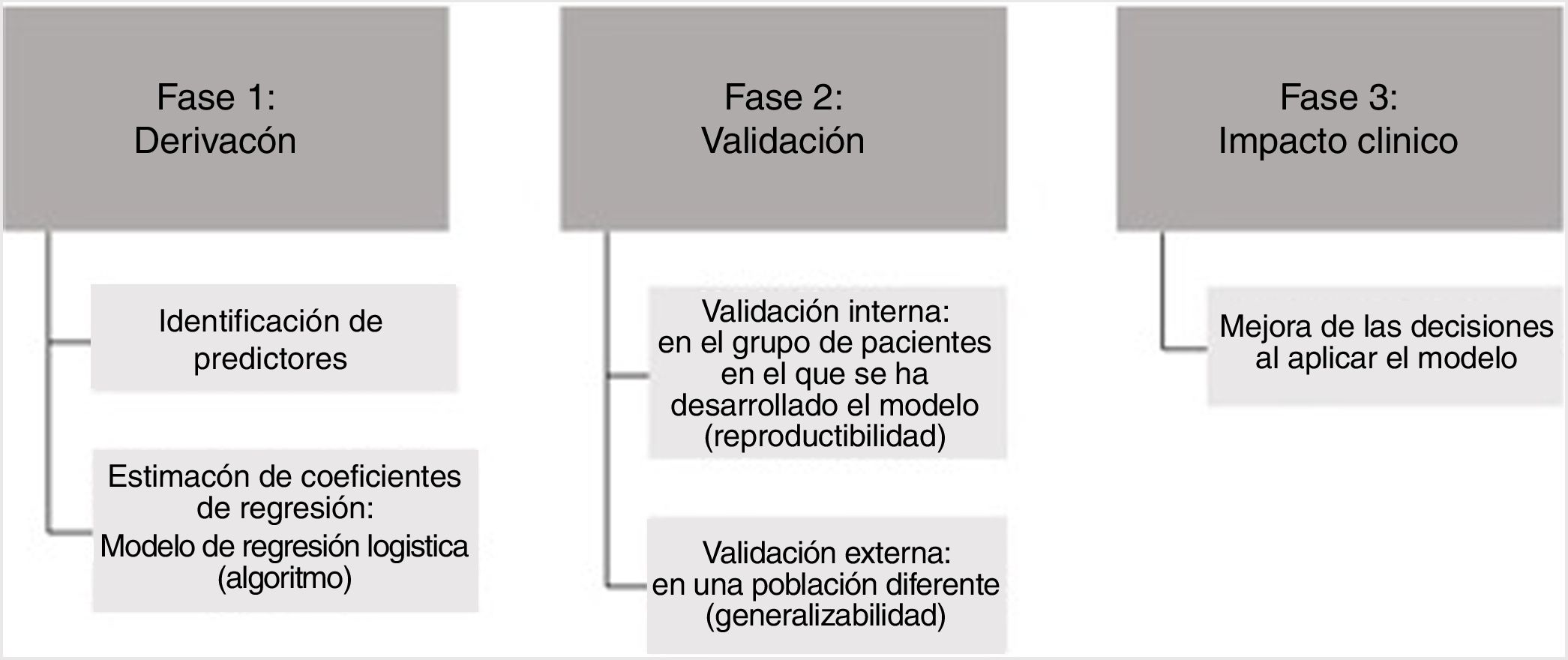
Desarrollo de un modelo predictivoTodo comienza con la pregunta clínica que nos hagamos, la recopilación de los datos y tener un software que nos ayude. El desarrollo de un modelo predictivo en cualquier ámbito se divide en 3 fases (fig. 1):
- 1.
Derivación del modelo: incluye la identificación de las variables predictivas, la estimación de los coeficientes de regresión de cada variable y el desarrollo de un modelo, es decir, un algoritmo matemático, mediante un análisis de regresión logística.
- 2.
Validación del modelo: valorar la capacidad predictiva del modelo. Esta fase incluye la validación interna en el grupo de pacientes en el que se ha desarrollado el modelo, es decir, si el modelo es reproducible, y la validación externa en una población diferente, es decir, si el modelo es generalizable.
- 3.
Análisis del impacto clínico: establecer si la aplicación del modelo en la práctica mejora las decisiones clínicas frente a lo que hubiera hecho el médico.
Desarrollo de un modelo predictivo.
Modificado a partir de Van Loendersloot, 2014.
Los predictores deben ser variables que se han escogido por su potencial capacidad predictiva y pueden incluir características demográficas, datos clínicos o físicos, resultados de laboratorio o respuesta a tratamientos previos. Por otra parte, el número de predictores no debe ser excesivo, ya que se corre el riesgo de sobrestimar la capacidad predictiva del modelo. En cuanto al tamaño de la muestra, este debe ser de al menos de 10individuos por cada variable predictiva.
Las variables más estudiadas en la predicción de la respuesta ovárica han sido la edad de la mujer, el índice de masa corporal (IMC), los niveles de FSH, hormona luteinizante, inhibina B y AMH, datos ecográficos como el AFC y el volumen ovárico y diversos test dinámicos, como el test de clomifeno o el de test de análogos agonistas de la hormona liberadora de gonadotropinas (aGnRH).
Estimación del coeficiente de regresiónUna vez identificados los potenciales predictores, se determina el efecto cuantitativo o peso de cada predictor mediante el cálculo del correspondiente coeficiente de regresión y se desarrolla el modelo mediante un análisis de regresión logística que nos proporcionará una ecuación o algoritmo matemático con la variable o variables con más peso.
Fase 2. Validación del modeloLa segunda fase en el desarrollo de un modelo predictivo es la validación del mismo. La validación de un modelo con el fin de establecer su capacidad predictiva se realiza calculando su capacidad de discriminación para distinguir a pacientes con y sin el evento estudiado, o determinando su grado de calibración, es decir, la concordancia entre la probabilidad observada y la estimada por el modelo. Por ejemplo, si calculamos una probabilidad del 30% de gestación tras un ciclo de FIV, la frecuencia observada de gestación debe ser aproximadamente de 30 por cada 100 mujeres.
La capacidad de discriminación se expresa mediante el área bajo la curva ROC (AUCROC); así, un modelo con una AUCROC de 0,5 no tiene poder de discriminación mientras que una AUCROC de 1,0 reflejaría una discriminación perfecta.
El grado de calibración de un modelo se calcula mediante la prueba de bonanza de ajuste de Hosmer-Lemeshow, de tal modo que si en esta prueba el valor de p es inferior a 0,05, no existe riesgo de un error de calibración. También se puede determinar gráficamente mediante un «plot» de calibración; en caso de una calibración perfecta, todos los puntos de la gráfica se encuentran en la diagonal, lo que indica que las probabilidades se corresponden con las proporciones observadas.
La validación de un modelo predictivo se subdivide en la fase de validación interna y en la de validación externa. Con la validación interna se evalúa la capacidad del modelo para predecir la respuesta a un tratamiento en el grupo de pacientes en el que se desarrolló el modelo (reproducibilidad). Sin embargo, antes de utilizar un modelo predictivo en la toma de decisiones clínicas no es suficiente haber demostrado un rendimiento bueno o razonable después de la validación interna. Muchos modelos predictivos ofrecen unos resultados demasiado optimistas y un aspecto fundamental en la predicción es que el modelo derivado a partir de un grupo de pacientes pueda ser aplicado a otro. Por lo tanto, es necesario que el modelo trabaje satisfactoriamente en una población «similar pero diferente» a la población en la que se desarrolló; es decir, es necesario realizar una validación externa (generalizabilidad). Esta validación externa puede ser temporal, en la que el modelo es validado en un nuevo grupo de pacientes del mismo centro, pero en un diferente periodo, o geográfica, en la que el modelo es validado en nuevos pacientes de un centro diferente.
Es importante tener en cuenta que en medicina reproductiva es frecuente la aparición de nuevos biomarcadores y que, en consecuencia, los modelos predictivos que se desarrollen en este ámbito deben ser regularmente actualizados con la finalidad de adaptarlos a las nuevas herramientas disponibles.
Fase 3. Análisis del impacto clínicoLa última fase en el desarrollo de un modelo predictivo, y probablemente la más importante, es el análisis del impacto clínico, es decir, si la aplicación del modelo mejora las decisiones clínicas en términos de calidad o de coste-efectividad.Idealmente, este análisis debe realizarse mediante la comparación de los resultados entre pacientes asignados aleatoriamente para recibir el tratamiento guiado por el modelo y pacientes tratados sin aplicación del modelo predictivo. Una alternativa menos válida es realizar un documento de manejo de decisiones terapéuticas, es decir, una encuesta a los profesionales, antes (guiados por su experiencia previa o su instinto) y después de ser «expuestos» al modelo predictivo.
MetodologíaModelos predictivos de respuesta ováricaSe realizó una revisión de los estudios publicados desde el año 2000 hasta el 2017 y que hacían referencia a la predicción de la respuesta ovárica en ciclos de FIV. Se efectuó una búsqueda sistemática en PubMed usando como palabras clave: predicción de respuesta ovárica, modelos predictivos de respuesta ovárica, marcadores de reserva ovárica, marcadores de respuesta ovárica, individualización de la estimulación ovárica, FSH, inhibina B, AMH y AFC. Las palabras clave se identificaron en el título o en el resumen de las publicaciones.
La búsqueda generó 140 citaciones. De estas, 74 fueron rechazadas con base en el título, el resumen o la lectura del artículo. Finalmente, se incluyeron 66 estudios que hacían referencia a alguna de las fases del desarrollo de un modelo predictivo expuestas anteriormente (Akande et al., 2004; Al-Azemi et al., 2011; Anckaert et al., 2012; Andersen et al., 2011; Arce et al., 2013; Ashrafi et al., 2017; Bancsi et al., 2002; Bancsi et al., 2004a; Bancsi et al., 2004b; Brodin et al., 2015; Broekmans et al., 2014; Broer et al., 2013a; Broer et al., 2013b; Creus et al., 2000; Dzik et al., 2000; Dzik et al., 2008; ×; Fábregues et al., 2000; Fang et al., 2015; Fawzy et al., 2002; Gingold et al., 2015; Guo et al., 2014; Hamdine et al., 2015; Heidar et al., 2015; Hendricks et al., 2004; Hendricks et al., 2005a; Hendricks et al., 2005b; Howles et al., 2006; Hsu et al., 2011; Ng et al., 2005a; Ng et al., 2005b; Jayaprakasan et al., 2009a; Jayaprakasan et al., 2009b; Khairy et al., 2008; Kunt et al., 2011; Kwee et al., 2006; Kwee et al., 2007; Kwee et al., 2008; La Cour Freiesleben et al., 2011; La Marca et al., 2011; La Marca et al., 2012; La Marca et al., 2013; Lee et al., 2008; Li et al., 2016; Lorusso er al., 2007; Magnusson et al., 2017; Mclleveen et al., 2007; Moon et al., 2016; Mutlu et al., 2013; Muttukrishna et al., 2005; Nelson et al., 2007; Nelson et al., 2015; Oehninger et al., 2015; Olivennes et al., 2009; Peñarrubia et al., 2000; Peñarrubia et al., 2005; Peñarrubia et al., 2010; Polyzos et al., 2013; Popovic-Todorovic ert al., 2003; Pouly et al., 2015; Singh et al., 2013; Van rooj ert al., 2002; Verberg et al., 2007; Vural et al., 2014; Papaleo et al., 2016 y Erdem et al., 2004). Estos modelos predictivos podían ser simples o multivariados con base en la inclusión de uno o varios marcadores de respuesta ovárica.
Modelos predictivos de gestación tras fecundación in vitroEn este caso, se realizó una revisión sistemática de los modelos predictivos de gestación y de RNV tras FIV publicados en la literatura en los últimos años.
ResultadosModelos predictivos de respuesta ováricaLa mayor parte de las publicaciones incluidas corresponden a estudios prospectivos (48/66; 72,7%) realizados con base en un número variable de pacientes, si bien en la mayoría se incluyeron 500 o menos (46/66; 69,7%).
A pesar de que históricamente el régimen más utilizado para conseguir la inhibición hipofisaria en ciclos de FIV ha sido el protocolo largo con aGnRH (Daya, 2000), en los últimos años se ha impuesto el protocolo con antagonistas de la GnRH dada la menor duración del tratamiento y la reducción del riesgo de SHO (Al-Inany et al., 2016). Sin embargo, en la mayoría de los estudios incluidos en esta revisión, incluso en los más recientes, la pauta de inhibición hipofisaria utilizada había sido el protocolo largo con aGnRH (48/66) junto con el empleo de FSH recombinante para la estimulación ovárica (34/66; 51,5%). Este dato es importante ya que puede limitar la aplicabilidad clínica actual de los modelos predictivos de respuesta ovárica descritos.
En cuanto a los eventos relacionados con la respuesta ovárica que pretendían predecir los modelos incluidos, en su mayor parte fueron las respuestas ováricas extremas, es decir, la baja respuesta (40/66; 60,6%) y la hiperrespuesta con o sin desarrollo de un SHO (15/66; 22,7%). En este sentido, es importante tener en cuenta las diferentes definiciones de este tipo de eventos existentes en la literatura incluida, hecho que también va a dificultar la aplicación clínica del modelo predictivo. En solo 11 estudios (16,7%) el objetivo final de la predicción fue el número de ovocitos obtenidos.
Respecto al tipo de modelo predictivo, en 30 estudios el modelo se desarrolló con base en la inclusión de un único marcador de respuesta ovárica (modelo simple) y en 36 se realizó con base en varios de estos marcadores (modelo multivariado).
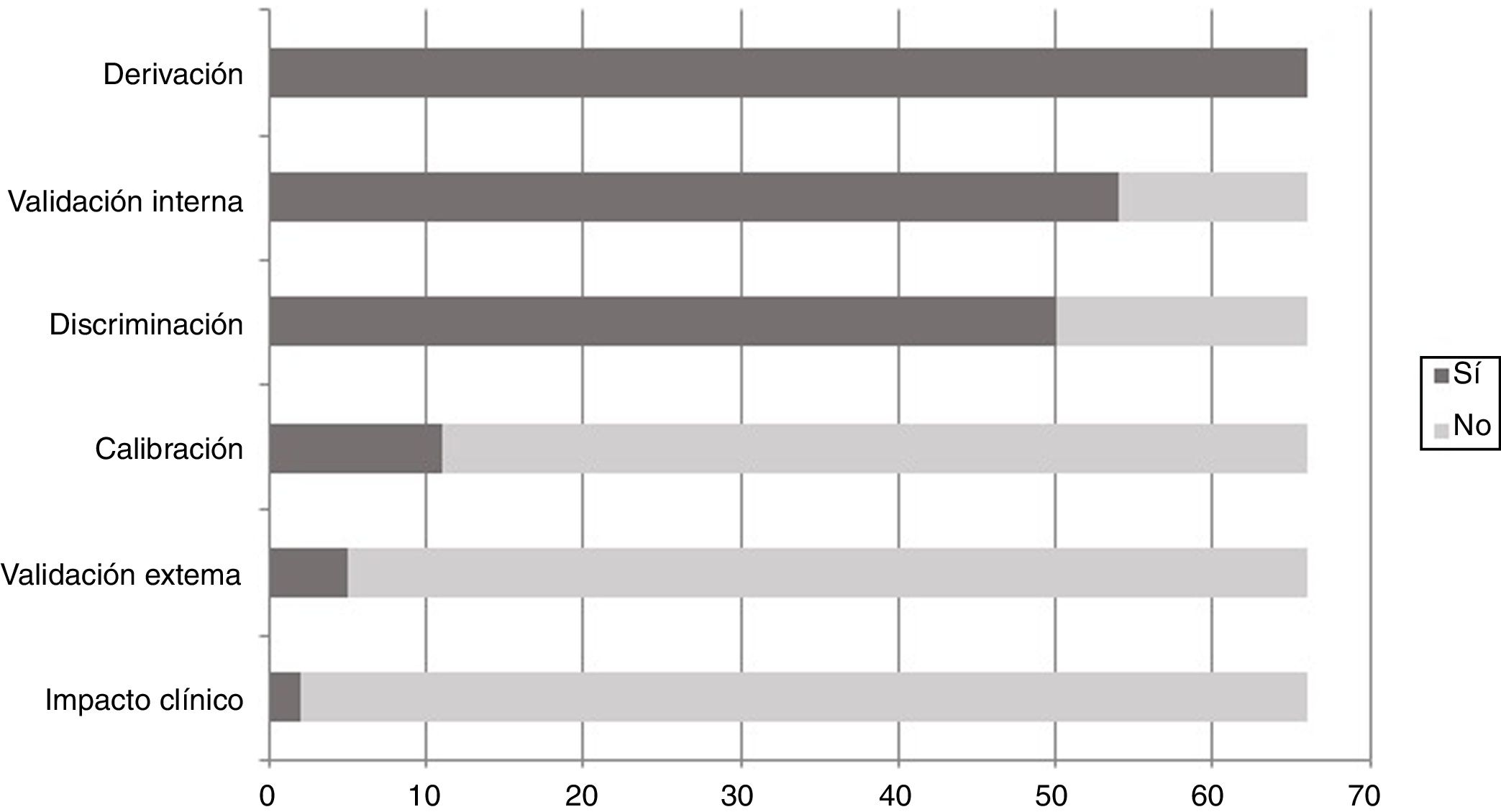
Un aspecto fundamental es valorar la calidad del modelo predictivo desarrollado de acuerdo con las fases expuestas anteriormente (fig. 2). En este sentido, si bien en la mayoría de los estudios revisados se realizó una validación interna del modelo, fundamentalmente a través de la valoración de su capacidad de discriminación mediante el cálculo del AUCROC, solo en 11 estudios (Akande et al., 2004; Bancsi et al., 2002; Broekmans et al., 2014; Howles et al., 2006; Lorusso et al., 2007; Nelson et al., 2015; Andersen et al., 2011; Oehninger et al., 2015; Polyzos et al., 2013; Popovic-Todorovic, 2003; Vural et al., 2014) se realizó la calibración del modelo y únicamente en 5 se validó externamente (Broekmans et al., 2014; la Cour Freiesleben et al., 2011; La Marca et al., 2012; Olivennes et al., 2009; Popovic-Todorovic et al., 2003). Por último, tan solo en 2 estudios (Pouly et al., 2015; Magnusson et al., 2017) se analizó el impacto clínico de la aplicación del modelo.
Modelos predictivos de gestación tras fecundación in vitroLos sistemas de salud británico y holandés han sido los principales responsables del desarrollo de los modelos predictivos al disponer de una gran base de datos por la obligatoriedad del registro de toda la información clínica, de laboratorio y de resultados que emana de cada ciclo de TRA realizado en su territorio. En el caso de Reino Unido, desde 1991 la Autoridad en Fecundación y Embriología Humanas (HFEA) obligaron por ley al registro de todos estos datos y es por ello que el primer modelo predictivo desarrollado fue el «modelo de Templeton» (Templeton et al., 1996) analizando 37.000 ciclos realizados entre 1991 y 1994. El objetivo principal de este primer modelo era predecir la tasa de RNV por ciclo iniciado. Del análisis exhaustivo de estos datos y realizando regresiones univariables, determinaron que los factores que mayor impacto ejercían sobre los resultados clínicos eran: la edad (objetivando una caída aguda a partir de los 35 años), el tiempo de infertilidad (a mayor tiempo de infertilidad, peor pronóstico), la infertilidad primaria, el número de ciclos previos fallidos y en cuanto a la causa primaria de infertilidad, el factor tubárico (sin especificar el grado de afectación ni la presencia-ausencia de hidrosálpinx).
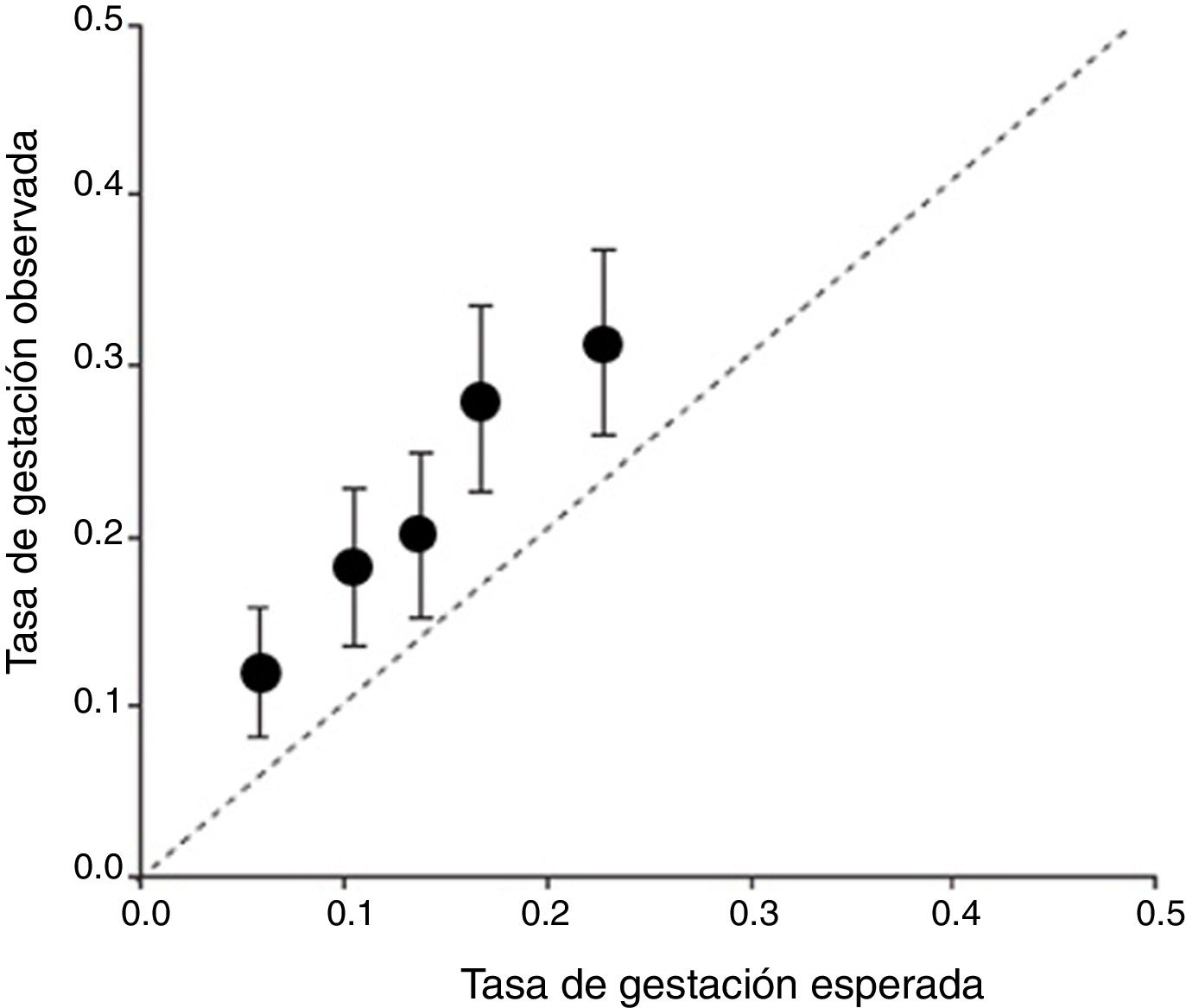
Leushuis et al. (2009) realizan una revisión sistemática en 2009 sobre los modelos predictivos existentes señalando al modelo de Templeton como el único con una buena capacidad predictiva. Basándose en las conclusiones de esta revisión sistemática,van Loendersloot et al. (2011), aprovechando que en Holanda también existe la obligatoriedad por ley de registrar todos los datos de los ciclos in vitro, se plantearon realizar una validación externa del modelo de Templeton con el objeto de valorar si 15 años después de desarrollarse, dados los grandes avances tecnológicos y de conocimiento de la reproducción asistida, y aplicado sobre una población geográficamente diferente, seguía teniendo validez y aplicabilidad. Este grupo estudia 1.537 ciclos de FIV y 1.442 ciclos de ICSI en el Academic Medical Center de Amsterdam. El objetivo principal que se marcan es la tasa de gestación evolutiva y estratifican la población en quintiles de probabilidad de éxito obteniendo una pobre discriminación en la AUCROC (C=0,63), así como una pobre calibración. Ellos justifican esta pobre capacidad predictiva por disponer de una base de datos mucho más reciente, por la existencia de cambios importantes producidos en ese tiempo en la práctica clínica de laboratorio, que condicionaban la consecución de unas tasas de gestación significativamente superiores, y por un menor tiempo medio de infertilidad previa a la primera consulta.
Por todo ello, al encontrar aplicando el modelo de Templeton una gran desviación entre los valores observados y los valores esperados en tasas de gestación concluyen que el modelo ya no era válido ni operativo en la práctica médica en ese momento. Como consecuencia, ellos desarrollarán su propio modelo predictivo que veremos más adelante (fig. 3).
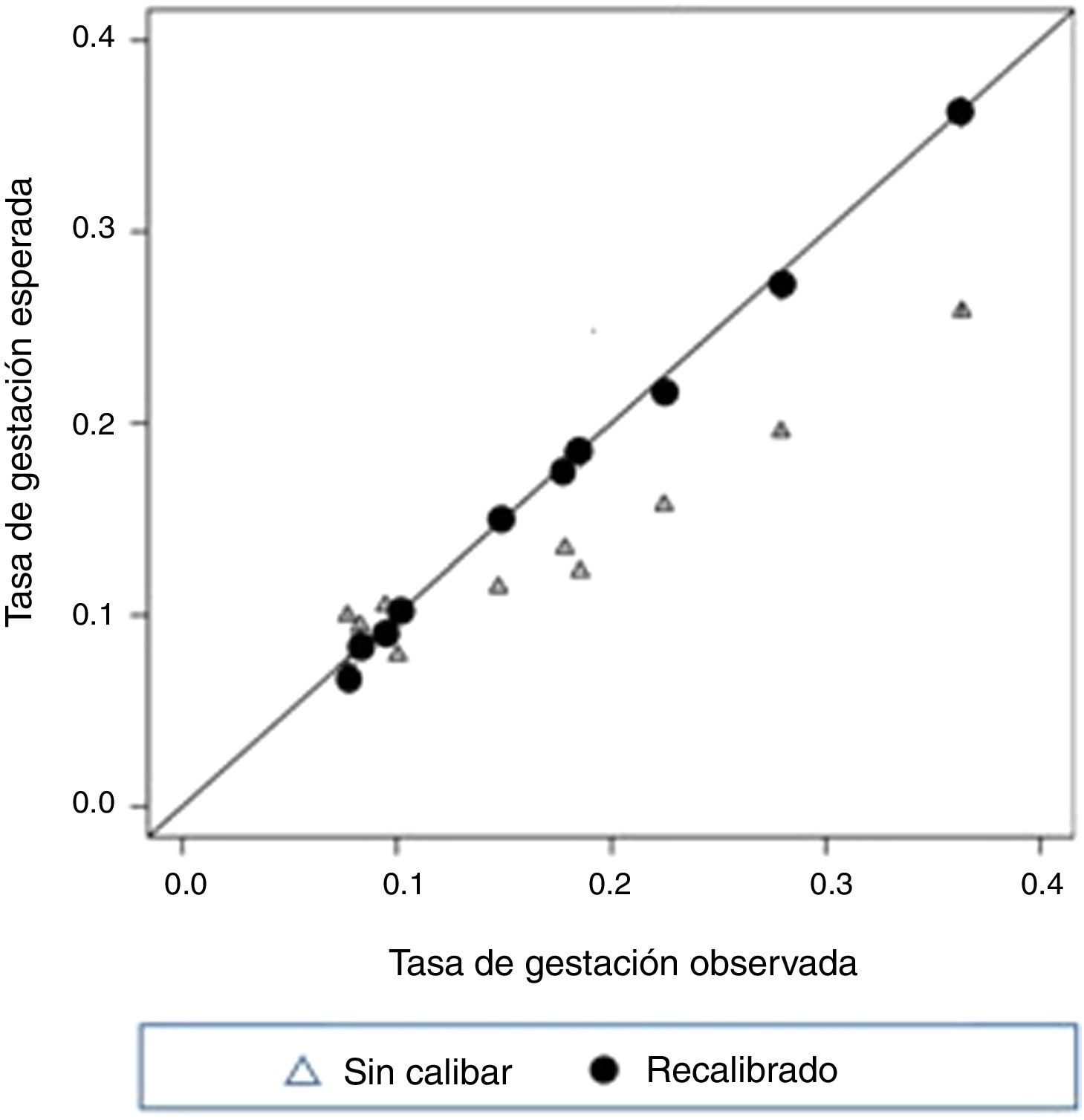
Otro enfoque diferente lo encontramos en la validación externa del modelo de Templeton que realizan Arvis et al. (2012) intentando demostrar que con unos pequeños ajustes podrían validar la aplicación de dicho modelo 2décadas después de haberse descrito, a pesar del gran avance y el desarrollo tecnológico producido. El estudio lo realizan sobre 11.208 de FIV-ICSI llevados a cabo en Rennes (Francia) entre 2002 y 2010, y también establecen como objetivo principal la tasa de RNV. Ellos consiguen finalmente validarlo a través de las siguientes fases: en una primera fase demuestran, al igual que van Loendersloot et al. (2011), que el modelo original subestima sistemáticamente, demostrando tanto la existencia de una pobre discriminación (C=0,64) como de una pobre calibración; en una segunda fase, realizando un reajuste con sus propios datos mejoran la discriminación (C=0,69) y consiguen una calibración casi perfecta; y finalmente, en una tercera fase ajustando la tendencia lineal en el tiempo hacia una mejora de los resultados y añadiendo 3nuevos predictores al modelo a partir del análisis de la literatura científica disponible (el tabaquismo, el IMC y los niveles séricos basales de FSH), consiguen mejorar el nivel de discriminación (0,71) manteniendo una calibración casi perfecta entre el valor observado y el esperado (fig. 4).
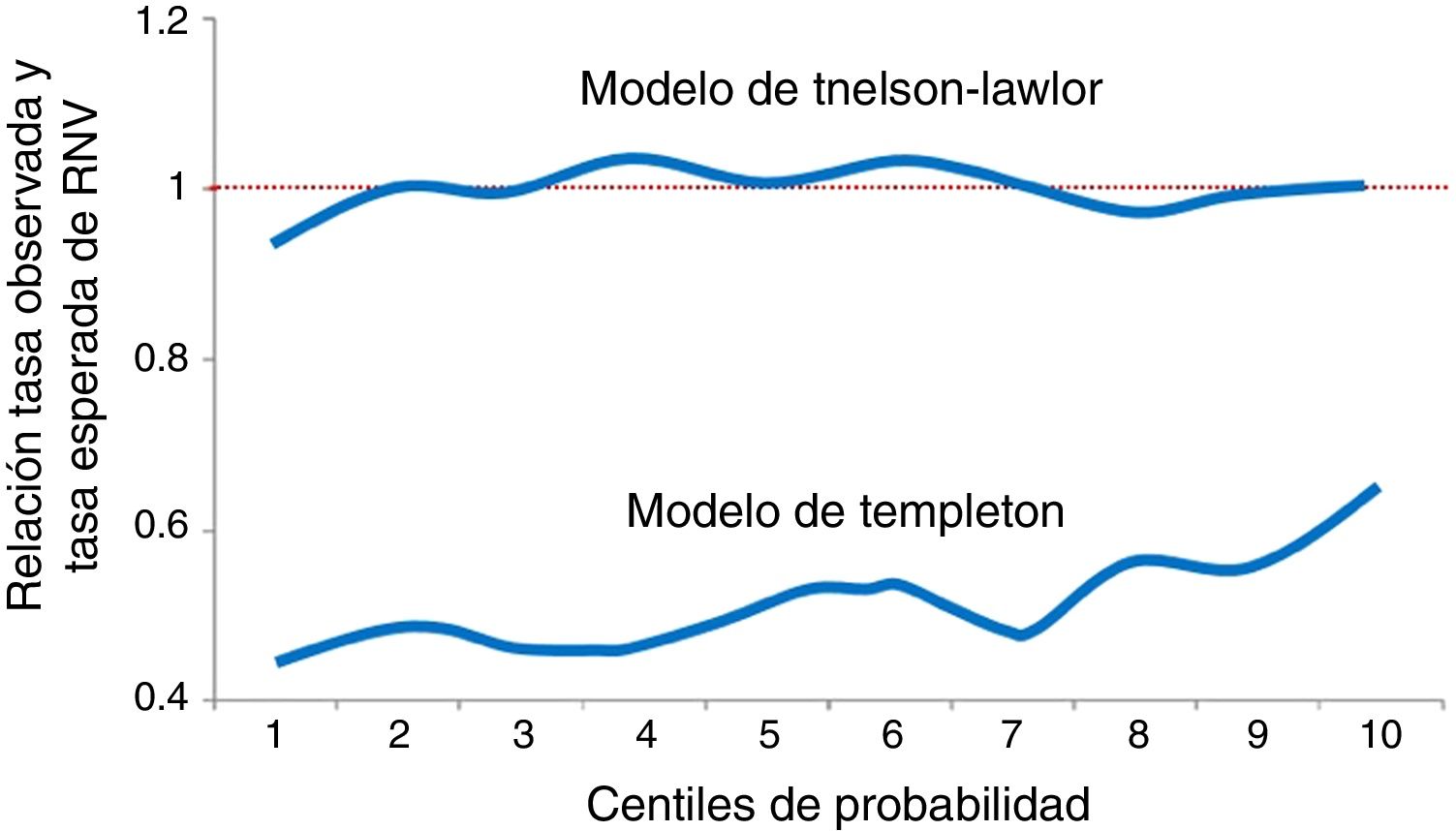
En 2011, de nuevo con casuística del Reino Unido, se publican los resultados de un nuevo modelo predictivo, el modelo de Nelson-Lawlor o IVFpredict (Nelson y Lawlor, 2011). El objetivo principal de este modelo también era la tasa de RNV. Los autores estudian 144.018 casos registrados por la HFEA entre 2003 y 2007, tratándose prácticamente en el 100% de los casos de transferencias de 2embriones (DET). Querían utilizar como predictores los mismos del modelo de Templeton actualizados y compararlo con el original. La actualización del modelo de Templeton la realizan a través de 2mecanismos. En primer lugar, incluyen nuevas variables (todas las causas de esterilidad, gameto propio o donado, tipo de tratamiento hormonal, ciclos FIV e ICSI y número de tratamientos previos) y, en segundo lugar, ajustan la tendencia lineal en el tiempo hacia la mejora en los resultados clínicos tras detectar esa significativa tendencia a la alza desde 2003 hasta 2007 (p<0,001), y lo vuelven a justificar obviamente con el desarrollo tecnológico y con las mejoras en los procedimientos de laboratorio. Después de aplicar estos ajustes al modelo original, constataron que tanto la discriminación como la calibración fueron muy superiores con el nuevo modelo de Nelson-Lawlor que con el original de Templeton en los 10 centiles de probabilidad (fig. 5).
A la vista del alto poder predictivo del nuevo modelo, los autores crean una herramienta novedosa y vanguardista, una página web de uso libre a modo de consulta: www.IVFpredict.com.
En 2015, Smith et al. (2015), estudiando 130.960 casos registrados por la HFEA en el Reino Unido entre 2008 y 2010, comparan los modelos de Templeton y de Nelson-Lawlor actualizados mediante coeficientes de regresión multivariable, entre sí y con un modelo basado sencillamente en la edad de la paciente por ser el predictor más potente y el método más ampliamente usado en la práctica clínica habitual. Demostraron que ambos modelos discriminaban mejor que el factor edad de forma aislada y en cuanto a la calibración, constataron que el modelo de Nelson-Lawlor era mejor predictor especialmente en los extremos de probabilidad; es decir los casos de peor y mejor pronóstico. Dicho de otro modo, los casos que no gestaban tenían peor pronóstico al igual que los casos que sí gestaban tenían mejor pronóstico con el modelo de Nelson-Lawlor que con el modelo de Templeton.
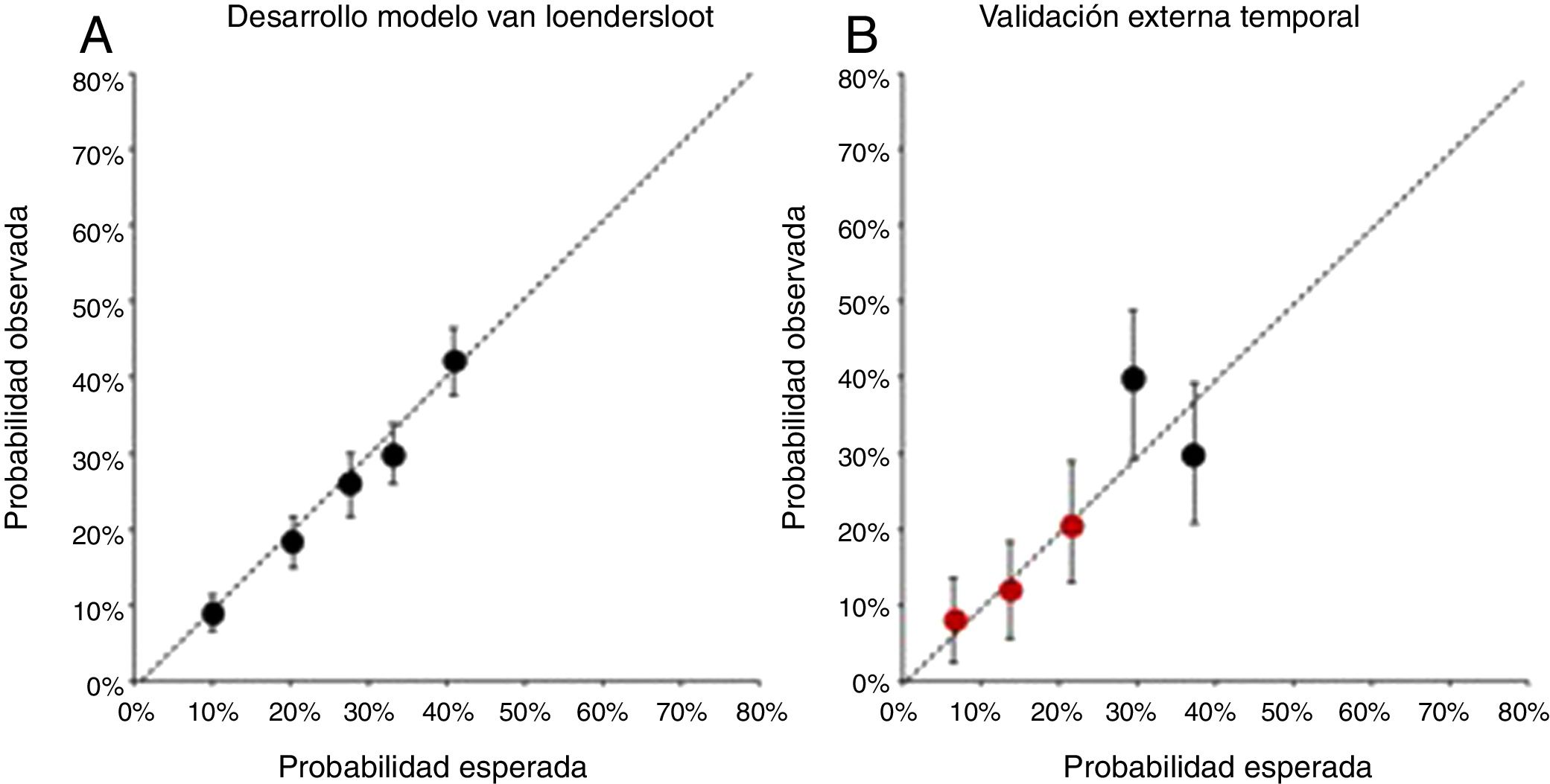
Antes de esto, en 2013, van Loendersloot et al. (2013) publican los resultados de su propio modelo predictivo; una vez habían demostrado la «obsolescencia» del modelo de Templeton basándose en los grandes avances en los protocolos clínicos y de laboratorio producidos en la reproducción asistida moderna. Para ello estudian 2.621 casos FIV-ICSI registrados en el Academic Medical Centre de Amsterdam entre 2001 y 2010, según mandato legal al igual que en el Reino Unido con la HFEA y también realizan una validación interna con 515 ciclos del mismo centro registrados entre 2009 y 2011. Como innovación, el modelo permite predecir los resultados clínicos antes del primer ciclo in vitro y también después de uno o varios ciclos fallidos.
Seleccionan los predictores del metaanálisis realizado por ellos mismos en el que incluyen variables clínicas disponibles antes de iniciar el ciclo e incluyendo eventualmente datos de la estimulación ovárica y del laboratorio FIV de el/los ciclo/s previos fallidos. Tanto en el desarrollo del modelo como en la validación interna posterior, la discriminación expresada en la AUCROC fue moderada (C=0,68), lo que sería claramente insuficiente para una predicción diagnóstica pero no para una predicción pronóstica como es el caso en todos estos modelos predictivos. La calibración también fue buena en ambas series de estudio especialmente en los 3primeros quintiles que son lo de mayor relevancia tanto para la paciente como para el médico y los sistemas públicos de salud, por ser los casos de peor pronóstico y en los que hay que decidir si la relación coste-efectividad es razonable (fig. 6).
Desarrollo y validación interna del modelo de van Loendersloot.
Tomado de van Loendersloot et al., 2013.
Este modelo fue sometido también a una validación externa geográfica con 772 casos registrados entre enero y diciembre del 2013 en el Ospedale Maggiore Policlínico de Milán (Sarais et al., 2016). Al igual que el original, consigue una calibración casi perfecta tras ajuste de regresión logística en los 5quintiles de probabilidad.
Más recientemente, fue publicado en 2016 el modeloDhillon et al. (2016), siendo el primero en incluir predictores como el IMC, la valoración de la reserva ovárica a través del AFC o la etnicidad; teniendo en cuenta, además, factores importantes fruto de los avances tecnológicos y los protocolos de actuación como son la transferencia en estadio de blastocisto o de embrión único (SET). Como buen modelo predictivo solo estudian variables pretratamiento y el desarrollo inicial del modelo se establece analizando 9.915 casos recogidos entre 2008 y 2012 en 12CARE Clinics del Reino Unido. La validación externa temporal la realizan en 2013 sobre 2.723 ciclos. Tras recalibración de la curva, ellos obtienen un poder predictivo excelente en los 10 centiles de la curva.
Buscando simplificar y facilitar el manejo en la práctica clínica habitual,La Marca et al. (2011) desarrollan un modelo predictivo en el Fertility Centre de Módena (Italia), basado exclusivamente en el factor edad y en la AMH como valoración de reserva ovárica, observando que la peor capacidad predictiva se da en los grupos de peor pronóstico, es decir, en los de mayor edad y menor nivel de AMH, lo que resta mucho valor a este modelo predictivo por ser los casos de mayor interés en la práctica clínica.
Desde un punto de vista práctico, se generaron en Estados Unidos 2útiles herramientas. La primera fue el desarrollo en 2011 de una aplicación online para introducir una serie de parámetros predictores, para asesorar al ginecólogo en cuanto a la tasa de embarazo gemelar esperada tras DET, ayudándole de esta manera a decidir el transfer selectivo de un embrión (eSET) en los casos de buen pronóstico (ForMyOdds.com) (Jones et al., 2011); la segunda fue la creación de un modelo en 2014 que se incluye en la web de la SART (www.sart.org) para, introduciendo el propio paciente sus datos clínicos, asesorarse de sus expectativas reales en cuanto a tasas de éxito, embarazo gemelar y tasa acumulada en 3 ciclos in vitro (Luke et al., 2014).
DiscusiónEs evidente que en medicina existe un interés creciente por la predicción del riesgo individual de los pacientes para desarrollar un determinado problema de salud o para predecir su respuesta a un tratamiento. Este interés ha llevado al desarrollo de modelos predictivos basados en características personales, antecedentes, pruebas diagnósticas y respuesta previa a tratamientos con la finalidad, no de sustituir el papel de los profesionales a la hora de dictaminar sobre un pronóstico o un tratamiento, sino de facilitar la toma de decisiones clínicas.
La predicción de la respuesta ovárica a la estimulación y de los resultados de la FIV en términos de gestación y de RNV es todavía un problema no resuelto en medicina reproductiva. La variabilidad individual a la hora de responder a un TRA hace necesario el mejorar nuestra capacidad predictiva con el fin de reducir las respuestas ováricas subóptimas y extremas, que se asocian a peores tasas de embarazo o a un incremento del riesgo para la salud de la mujer, y de optimizar los resultados en términos de gestación y nacido vivo.
La revisión de los modelos predictivos de respuesta ovárica realizada en el presente trabajo demuestra que la calidad de los modelos publicados en la literatura es baja. En pocos casos se ha realizado una validación externa del modelo y en muy pocas ocasiones se ha llegado a analizar el impacto clínico de la aplicación del modelo. Así, una revisión sistemática de los modelos predictivos en reproducción encontró que, de 29 modelos, solo 8 habían sido validados externamente y en tan solo uno se había llegado a aplicar en la práctica clínica (Leushuis et al., 2009).
La metodología inadecuada a la hora de desarrollar un modelo predictivo, es decir, el no realizar todas las fases necesarias (derivación, validación interna y externa y análisis del impacto clínico), dificulta e incluso contraindica la aplicación del modelo en la práctica clínica. Para que un modelo predictivo sea ampliamente aceptado es necesaria una evidencia consistente que demuestre que su aplicación conduce a un incremento en el beneficio que obtenga la paciente.
Dado que la FIV puede ser estresante física y emocionalmente, y que no está exenta de riesgos para la salud, las parejas con esterilidad candidatas a una FIV deben ser bien informadas acerca de las posibilidades de éxito antes de cada ciclo de tratamiento. Desafortunadamente, en este momento, no hay ensayos clínicos controlados aleatorizados que comparen la FIV con la concepción natural. Por lo tanto, la única manera de aconsejar adecuadamente a estas parejas es a través de un pronóstico basado en modelos predictivos.
En conclusión, la calidad de los modelos predictivos de respuesta ovárica publicados hasta el momento es desafortunadamente baja, sobre todo por la falta de una validación externa de los mismos y de un análisis del impacto de su aplicación en la toma de decisiones clínicas. Respecto a los modelos predictivos de gestación tras FIV, existen numerosos trabajos que han informado sobre el desarrollo o la validación de modelos de predicción de gestación tras FIV. Sin embargo, muy pocos han demostrado un buen rendimiento después de su validación externa y aún no se han realizado análisis de impacto para ninguno de estos modelos. En consecuencia, es necesario poder desarrollar y disponer de modelos predictivos realizados con base en una adecuada metodología con la finalidad de optimizar nuestra capacidad de predicción en el campo de la reproducción asistida y alcanzar una verdadera individualización terapéutica y una personalización de la medicina reproductiva. En la actualidad, se está abriendo una puerta que encierra enormes posibilidades predictivas como es el manejo del big data y la inteligencia artificial que será cada vez más capaz de analizar estas enormes cantidades de información obteniendo predicciones de forma cada vez más individualizada y precisa. De esta manera, los modelos de predicción podrán fortalecer la toma de decisiones individualizadas y basadas en la evidencia y contribuir al uso racional de estos costosos tratamientos.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los compañeros del Grupo de Interés de Endocrinología Reproductiva de la Sociedad Española de Fertilidad (Claudio Álvarez, Manuel Álvarez, Elisa Gil, Mónica González, Sonia Lobo, Joaquín Llácer, Elkin Muñoz, Ana Robles, Eric Saucedo).