Las microdeleciones del cromosoma Y se consideran una de las causas más comunes de la infertilidad masculina. La ausencia de algunos genes localizados en ciertas regiones del cromosoma Y, conocidas como «factor de azoospermia», conduce a fallo de la espermatogénesis, aunque en muchos casos se consigue recuperar espermatozoides del eyaculado o del testículo. Su detección puede resultar crucial en el tratamiento clínico de estos pacientes, pues permite predecir, en pacientes azoospérmicos con ciertas microdeleciones, la presencia de espermatozoides en el testículo, además de prevenir el empleo de métodos invasivos de extracción espermática en pacientes oligozoospérmicos que pudieran tener una pérdida progresiva de su producción con el tiempo.
La inyección intracitoplasmática, junto con las técnicas de recuperación espermática, han ofrecido a muchos de estos pacientes la posibilidad de concebir hijos con sus propios gametos, si bien se produce la transmisión de dicho defecto genético a la descendencia masculina. Aunque, hasta hace poco, se asumía la infertilidad como la única consecuencia clínica que heredarían los hijos varones de estos pacientes, diversos estudios han sugerido que existen otros riesgos potenciales que podrían afectar a la descendencia, como disfunciones sexuales asociadas a alteraciones de cromosomas sexuales (síndrome de Turner o Klinefelter) e incluso otros trastornos, con peores consecuencias clínicas, causados por anomalías de los autosomas. No obstante, por el momento no se ha descrito ningún caso claro de hijos de pacientes con microdeleciones con complicaciones mayores de la infertilidad, pero debemos reparar en que la primera generación de esos niños acaba de alcanzar la madurez. Además, dichas anomalías podrían bloquear el desarrollo embrionario o incrementar la incidencia de abortos, reduciendo las posibilidades de éxito en las parejas afectadas que acuden a los centros de reproducción asistida. Resulta imperioso, por tanto, esclarecer los riesgos reales de transmisión de anomalías diferentes a la microdeleción a la descendencia y establecer el tratamiento más adecuado para estos pacientes.
Y-chromosome microdeletions are currently one of the most common causes of male infertility. The absence of some genes located in certain regions in the long arm of the human Y-chromosome, known as azoospermia factor region, causes spermatogenic failure, while spermatozoa has been found in either the ejaculate or the testicle of most patients. Detection of deletions is crucial for the medical treatment of these patients, since it has a prognostic value in predicting potential success of testicular sperm retrieval in azoospermic patients with certain microdeletions, and allows avoiding invasive techniques in oligozoospermia patients whose sperm production could result in progressive worsening.
Intracytoplasmic sperm injection, together with testicular or epididymal sperm retrieval for azoospermic men, has allowed these patients to become fathers using their own gametes, but the ability to vertically transmit that genetic defect, and thus, the infertility, to the offspring has been commonly accepted. Until recently, no clinical consequences other than infertility were supposed in the sons of fathers with deletions. However, different studies in the last few years suggest other potentially risks transmitted to the offspring, such as development of sexual dysfunction due to sex chromosome abnormalities (Turner or Klinefelter syndromes) or other somatic disorders, with worse health consequences, caused by chromosome aberrations in autosomes associated with Y-chromosome microdeletions. To date, no major clinical complications other than infertility have been described in the offspring born from fathers with deletions, but it is important to remember that the first generation of those babies has just reached maturity. Moreover, the aforementioned chromosome anomalies could halt embryo development or increase miscarriage rate, reducing the chances of a successful pregnancy in affected couples attending infertility clinics. Therefore, the actual risk of transmitting different anomalies associated to microdeletions to the offspring should be clarified in order to establish the most appropriate treatment for these patients.
En la actualidad, aproximadamente el 10-15% de las parejas que buscan concebir un hijo sufren infertilidad. Se estima que en la mitad de los casos las causas pueden radicar al menos en parte en el varón (Suganthi et al., 2014; Foresta et al., 2001b). Una gran proporción de los hombres infértiles cursan con una producción espermática muy escasa o nula en el eyaculado (oligozoospermia severa y azoospermia, respectivamente) debido a una alteración en alguno de los estadios de la espermatogénesis. Dichas alteraciones se relacionan con patrones histopatológicos testiculares diferentes, que oscilan desde la ausencia de células germinales (Sertoli Cell Only Syndrome [SCOS]) a la detención del proceso de maduración de los espermatozoides o la hipoespermatogénesis. Entre las causas más comunes de la infertilidad masculina podemos encontrar desde anomalías o infecciones del tracto genital hasta exposición a sustancias tóxicas, alteraciones hormonales o trastornos genéticos, pero en alrededor del 30% de los casos se desconoce el origen de la infertilidad (infertilidad masculina idiopática). En las últimas décadas los grandes avances de la genética y la biología molecular aplicados a la medicina reproductiva han permitido profundizar en los mecanismos de la espermatogénesis, consiguiendo con ello caracterizar muchos trastornos inicialmente considerados como idiopáticos. Es el caso de ciertas anomalías cromosómicas como las mutaciones del gen que codifica la proteína Cystic Fibrosis Transmembrane Conductance Regulator (CFTR), involucradas en la fibrosis quística, o la infertilidad ligada al cromosoma Y (Cr Y) (Dohle et al., 2002; Suganthi et al., 2014).
El desarrollo de las tecnologías de análisis del ADN permitió cambiar en poco más de 3 décadas la percepción del Cr Y en el estudio de la infertilidad masculina. Mientras que inicialmente se pensaba que la función de este pequeño cromosoma se limitaba a la determinación sexual, cada vez son más las evidencias de su implicación en la regulación de la espermatogénesis y, con ello, en la patogenia de ciertos tipos de trastornos de la fertilidad masculina (Foresta et al., 2001b; Martinez-Frias, 2005). De hecho, comparado con otros, se trata del cromosoma con menor número de genes, pero con mayor porcentaje de ellos relacionados con la espermatogénesis (Li et al., 2008). Tan solo se empareja con el cromosoma X a través de 2 pequeñas regiones pseudoatosómicas (Pseudoautosomal Region [PAR]) que ocupan aproximadamente el 5% del cromosoma y se localizan en los extremos del brazo corto (p) y del brazo largo (q) del mismo. El resto del cromosoma lo forman una amplia región de heterocromatina y una región eucromática caracterizada por grandes bloques de secuencias repetitivas, dispuestas en estructuras palindrómicas (que se leen igual en ambas direcciones), y que parecen codificar proteínas necesarias para la fertilidad (fig. 1). Aunque esta región no sufre recombinación homóloga con el cromosoma X, razón por la que han ido acumulando con el tiempo mutaciones, y con ello un elevado polimorfismo, puede sufrir recombinación intracromosómica y conversión de secuencias gracias a la existencia de palíndromos (Suganthi et al., 2014; Li et al., 2008).
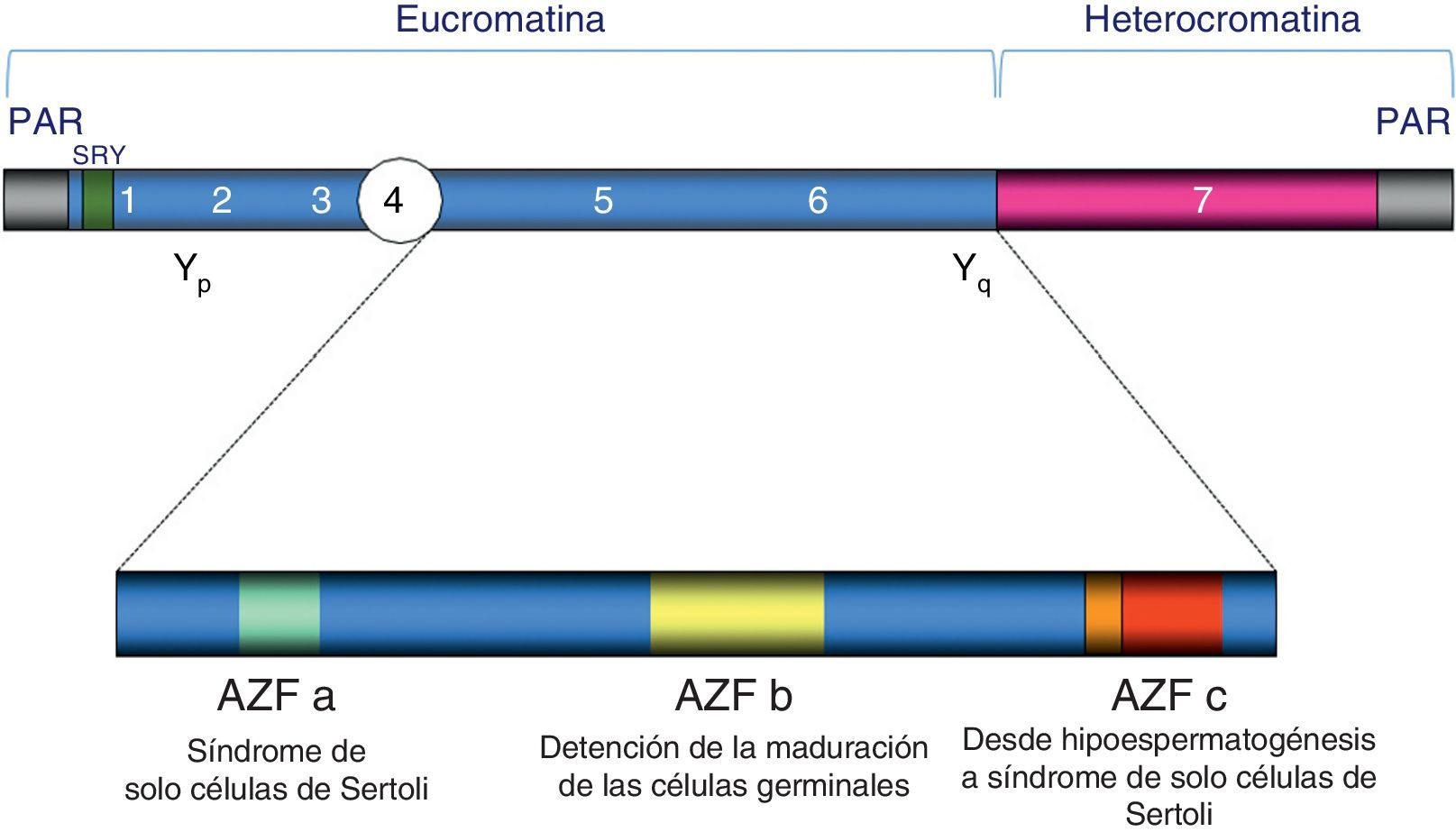
Diagrama del cromosoma Y. Incluye la representación de las regiones Pseudoautosomal Region (PAR) en los brazos corto (Yp) y largo (Yq) del cromosoma, la región Sex-determining Region Y (SRY) y una ampliación con las distintas regiones Azoopermic Factor (AZF). Bajo cada región AZF se indica el fenotipo histológico testicular característico clásico para los casos de deleción completa de dichas regiones, si bien la deleción parcial de las regiones AZFa y AZFb puede ocasionar hipoespermatogénesis.
Los primeros datos sobre la existencia de factores genéticos relacionados con la fertilidad masculina se remontan a mediados de los años 70, cuando Tiepolo y Zuffardi (1976), a través de análisis citogenéticos, detectaron la presencia de deleciones en la región Yq11 de pacientes con azoospermia. Con estos datos postularon la existencia de una zona en el Cr Y que abarcaría un gen relacionado con la fertilidad, y se le denominó factor de azoospermia (Azoospermia Factor [AZF]). Sin embargo, su existencia no se demostró definitivamente hasta que en 1996, Vogt et al., observaron la presencia de microdeleciones en 3 regiones diferentes, con influencia en la esterilidad masculina, a las que denominaron AZFa, AZFb y AZFc (Vogt et al., 1996), conocidas asimismo en la actualidad como AZFa, P5/P1 proximal y b2/b4, respectivamente. Posteriormente se propuso una cuarta región en la que se podían presentar dichas deleciones, denominada AZFd, si bien su existencia ha sido recientemente cuestionada (Sadeghi-Nejad y Farrokhi, 2007; Krausz et al., 2014). Cada una de estas regiones alberga una o más copias de genes de hasta 15 familias diferentes, como el gen Dead Box Y (DBY) localizado en la región AZFa, el RNA Binding Motif Y-Linked (RBMY) en la AZFb, o el Deleted in Azoospermia (DAZ) en la AZFc, entre otros, que resultan ser esenciales para el correcto desarrollo de la espermatogénesis. No obstante, se ha propuesto que el efecto de la microdeleción en la alteración de la espermatogénesis podría depender además de la activación de otros genes o copias del gen no eliminadas, así como del haplotipo de Cr Y del que se trate (Li et al., 2008; Vogt, 2005).
Mecanismos que originan las microdeleciones en el cromosoma YHoy en día se dispone del mapa genético completo del Cr Y, lo que ha permitido proponer que el mecanismo por el que se originan las microdeleciones de novo es por recombinación homóloga entre secuencias muy similares o idénticas dentro del Cr Y. Dicha mutación podría suceder bien durante la meiosis de la línea germinal del padre fértil (sin deleción en las células somáticas), o durante las primeras divisiones poscigóticas del paciente infértil (con deleción), en cuyo caso presentaría mosaicismo para dicha anomalía. Además, gracias a las técnicas de secuenciación se han determinado los puntos de ruptura de las deleciones, logrando identificar y nombrar, además de las microdeleciones «clásicas» o completas de dichas regiones, otras dentro y fuera de los intervalos clásicos de deleción. Es el caso de las microdeleciones parciales, como las de la región AZFc (gr/gr, b2/b3 y b1/b3), o las que comprenden varias de las regiones, como las AZFbc (P5/P1 o P4/P1 distal) (Suganthi et al., 2014; Ferlin et al., 2007). En cualquier caso, todas las deleciones mencionadas suponen la eliminación de una o más copias de genes candidatos de la espermatogénesis, lo que en ciertos casos ha sugerido el análisis de la eficiencia de dicho proceso según la cantidad de genes excluidos por la deleción (Krausz et al., 2009).
Técnicas de análisis de microdeleciones en el cromosoma YPara su detección se emplean técnicas de reacción en cadena de la polimerasa (Polymerase Chain Reaction [PCR]) con ADN genómico procedente de linfocitos y diferentes marcadores frente a secuencias cortas de nucleótidos no repetidos, conocidas en inglés como Sequence-Tagged Site (STS), que pueden ser específicas para un gen o familia de genes, o simplemente detectar secuencias «anónimas» (Suganthi et al., 2014; Foresta et al., 2001b). Aunque los análisis iniciales se realizaban con un número reducido de marcadores anónimos, la obtención del mapa preciso del Cr Y permitió seleccionar marcadores más específicos y desarrollar unas directrices para su diagnóstico molecular, que han permitido conseguir pruebas más fiables y homogéneas entre los diferentes laboratorios (Foresta et al., 2001b; Krausz et al., 2014). En los últimos años diversos autores han sugerido el empleo de nuevos protocolos de PCR múltiplex (Guo et al., 2012; Vogt y Bender, 2013), e incluso de nuevas técnicas diagnósticas más específicas y sensibles basadas en la PCR cuantitativa o la tecnología de arrays que podrían sustituir la empleada de rutina (Suganthi et al., 2014; Guo et al., 2012; Song et al., 2012).
Prevalencia de las microdeleciones del cromosoma YDesde su detección molecular, en los años 90, numerosos autores han profundizado en el estudio de las microdeleciones, considerándose en la actualidad la anomalía cromosómica más frecuente asociada al fallo en la producción espermática, y una de las causas más comunes de la infertilidad masculina. Sin embargo, al revisar la bibliografía, la frecuencia con la que se encuentran estas microdeleciones en pacientes infértiles varía tremendamente entre los diferentes estudios, oscilando entre el 1% y el 55% (Suganthi et al., 2014; van der Ven et al., 1997; Oliva et al., 1998; McElreavey y Krausz, 1999; Foresta et al., 2001a; Martinez et al., 2000; Pryor et al., 1997), probablemente debido a variaciones en el diseño de los mismos, como el número de pacientes analizados o su criterio de selección (McElreavey y Krausz, 1999). Así, aunque la mayoría de los estudios se centra en pacientes con azoospermia y oligozoospermia severa (con <5×106 espermatozoides/ml) otros incluyen todos los pacientes infértiles con causa conocida o desconocida de infertilidad. Tras una profunda revisión de 4.800 casos, Foresta et al. (2001b) demostraron que la incidencia de las deleciones aumenta cuando el criterio de selección de la población es más estricto, encontrando los mayores porcentajes en pacientes con azoospermia no obstructiva y oligozoospermia idiopáticas con recuento <5×106 espermatozoides/ml (18% y 14%, respectivamente) mientras que si se trata de infertilidad de origen desconocido con >5×106 espermatozoides/ml la frecuencia cae al 0,7% (Foresta et al., 2001b). Otra variable que parece afectar a la diferencia entre las frecuencias observadas en los distintos estudios es el empleo de diferentes marcadores STS para la determinación de las microdeleciones (Suganthi et al., 2014; Martinez-Frias, 2005; McElreavey y Krausz, 1999). No obstante, también se ha sugerido que dichas diferencias podrían deberse a otros factores no relacionados con el diseño del estudio, como diferencias estrictamente étnicas o geográficas, relacionadas con un haplotipo particular del Cr Y, el factor genético o la influencia ambiental (McElreavey y Krausz, 1999). En particular, los estudios realizados con la población que acude a clínicas de fertilidad en España muestran una prevalencia que oscila entre el 3,3% y el 7% (Oliva et al., 1998; Martinez et al., 2000; Lo Giacco et al., 2014), lo que supone una incidencia ligeramente mayor a la encontrada en población alemana, con valores seminales análogos, y casi idéntica, al menos para pacientes con azoospermia, a la de la población italiana, reforzando el posible efecto de la composición étnica sobre la prevalencia de la deleción (Lo Giacco et al., 2014). Quizá por ello en los últimos años han surgido numerosos estudios sobre la incidencia de estas anomalías en poblaciones de diferentes zonas geográficas aún no analizadas, como en el Oriente Medio o en países de Asia (Alhalabi et al., 2013; Khabour et al., 2014; Zhang et al., 2013; Suganthi et al., 2014; Sadeghi-Nejad y Farrokhi, 2007).
En cualquier caso, los autores coinciden en que las deleciones se dan con más frecuencia en los casos de azoospermia no obstructiva (en el 8-20% de dichos pacientes) que en los de oligozoospermia severa (en el 4-14%) o moderada (Foresta et al., 2001a; Suganthi et al., 2014), lo que sugiere que las deleciones ocasionan mayoritariamente daños severos de la producción espermática, si bien se pueden encontrar con cierta asiduidad espermatozoides, al menos en los testículos. Otro patrón común en toda la bibliografía es que las microdeleciones más frecuentes afectan a la región AZFc (54-72%), siendo especialmente significativa la deleción parcial gr/gr en la población española (Lo Giacco et al., 2014; De Llanos et al., 2005), mientras que son poco comunes las que afectan a la región AZFa y AZFb, o comprenden a varias (AZFbc) o todas las regiones AZF (AZFabc) (Hopps et al., 2003; Foresta et al., 2001b; Sadeghi-Nejad y Farrokhi, 2007; Ferlin et al., 2007; Patrat et al., 2010; Krausz et al., 2014).
Correlación entre genotipo y fenotipo del paciente con microdelecionesAunque toda la comunidad científica considera que las deleciones más largas se asocian generalmente con defectos más graves de la espermatogénesis, no existe un acuerdo sobre la asociación entre la región afectada por una microdeleción, bien sea completa o parcial, y los parámetros seminales o el fenotipo testicular del paciente infértil, y por tanto, sobre el valor pronóstico de su determinación. Así, mientras que, en un principio, las deleciones de las regiones AZFa, AZFb y AZFc se asociaron a pacientes con SCOS, detención de la espermatogénesis o fenotipo variable, respectivamente (Vogt et al., 1996), pronto se observó la necesidad de precisar la extensión y posición de las deleciones, e incluso de caracterizar los genes eliminados y usar STS específicos para dichos genes, con el fin de poder pronosticar la presencia o no de espermatozoides en los testículos o el eyaculado (Foresta et al., 2001a; Krausz et al., 2000; Liow et al., 2001). En general, los estudios que relacionan fenotipo con genotipo muestran que las deleciones de las regiones AZFa y AZFb causan azoospermia sin posibilidad de recuperar espermatozoides en la biopsia, siempre que se trate de la deleción completa de las mismas, y se asocian fundamentalmente a SCOS y detención de la maduración, respectivamente (Suganthi et al., 2014; Ferlin et al., 2007; Patrat et al., 2010; Choi et al., 2004). Sin embargo, si la deleción en esas regiones es parcial puede ocasionar una escasa producción de espermatozoides (hipoespermatogénesis), tal como demuestran la presencia de dichas deleciones parciales en pacientes con oligozoospermia (Suganthi et al., 2014; McElreavey y Krausz, 1999; Ferlin et al., 2007; Krausz et al., 2000) o los casos de transmisión natural de las mismas a la descendencia (Sadeghi-Nejad y Farrokhi, 2007). Por su parte, los pacientes con deleciones AZFbc o AZFabc presentan un daño severo en la espermatogénesis y ausencia de espermatozoides en eyaculado o testículos (Foresta et al., 2001a; Patrat et al., 2010; Choi et al., 2004). En contra, un par de estudios recientes muestran 2 casos excepcionales de pacientes con oligozoospermia severa y deleción completa de AZFb o AZFbc en la que se completó la espermatogénesis, si bien en el primer caso se requirió la extracción de múltiples biopsias testiculares para conseguir algún espermatozoide móvil, mientras que un posterior seminograma del segundo caso revelaba azoospermia (Soares et al., 2012; Longepied et al., 2010). La deleción completa o parcial de AZFc se asocia, por el contrario, a una variedad de parámetros seminales (aproximadamente 50% de azoospermia y 50% de oligozoospermia severa) e histologías testiculares (desde hipoespermatogénesis a SCOS), pero en la mayoría de los casos disponen de espermatozoides maduros en el eyaculado o en los testículos (Suganthi et al., 2014; Sadeghi-Nejad y Farrokhi, 2007; McElreavey y Krausz, 1999; Foresta et al., 2001a; Ferlin et al., 2007; Patrat et al., 2010). Un caso de especial interés clínico lo constituye la deleción gr/gr, en la que se elimina la mitad de los genes de la región AZFc (Repping et al., 2003). Aunque está igualmente asociada a un fenotipo heterogéneo, este oscila entre en varones fértiles con normozoospermia e infértiles con azoospermia, pero solo predispone a fallo de la espermatogénesis en algunas poblaciones como la española o la italiana, sin encontrar dicho efecto negativo en otras, como la japonesa o la china (Krausz et al., 2014; Krausz et al., 2009; Krausz, 2005; Repping et al., 2003). En la actualidad aún se debate sobre el origen de las diferencias encontradas entre portadores de la deleción gr/gr pero, a pesar de que no parece afectar a los resultados reproductivos tras ICSI (De Llanos et al., 2005), las últimas recomendaciones internacionales aconsejan su análisis rutinario en las poblaciones en las que, como la española, se considera un importante factor de riesgo para la deficiente producción espermática (Krausz et al., 2014; Lo Giacco et al., 2014).
Además de la distinta región o extensión de la deleción, se ha sugerido que la variabilidad en el fenotipo de los pacientes que presentan las AZFc, y en particular las gr/gr, bien podría deberse a factores genéticos, como los diferentes haplotipos del Cr Y, la presencia en ese u otros cromosomas de genes iguales u homólogos a los eliminados, e incluso a la pérdida progresiva de la producción espermática con el tiempo, detectada en ciertos pacientes (Foresta et al., 2001b; Longepied et al., 2010; Liu et al., 2013; Simoni et al., 1997; Krausz et al., 2014). La detección precoz de la microdeleción en estos casos puede resultar crucial en el tratamiento clínico de dichos pacientes, ya que la criopreservación seminal mientras dispongan de espermatozoides en el eyaculado puede evitar el empleo de métodos más invasivos con posterioridad (Sadeghi-Nejad y Farrokhi, 2007).
Aunque la presencia de microdeleciones se ha relacionado con una reducción en el tamaño testicular, o con variaciones en los niveles de algunas hormonas (en concreto de la FSH), por el momento ningún dato obtenido a través de la historia clínica, examen físico o analítico permite identificar a priori a los pacientes que presentan microdeleciones (Foresta et al., 2001a, 2001b; Ferlin et al., 2007; Patrat et al., 2010). Por ello, la mayoría de los autores sostienen la necesidad de analizar las microdeleciones en pacientes infértiles con escaso número de espermatozoides, independientemente de la presencia simultánea de otras causas de daño testicular, con el objetivo de realizar el tratamiento más adecuado en cada caso.
Opciones reproductivas en pacientes con microdelecionesHasta hace unas décadas las parejas infértiles cuyo varón presentaba un fallo acusado de la espermatogénesis, que cursaba con azoospermia u oligozoospermia severa, no tenían otra opción que recurrir a la donación de semen para ser padres, ya que no existe ninguna terapia clínica que permita corregir dichas anomalías (Silber, 2011). La introducción de la inyección intracitoplasmática de espermatozoides (Intracytoplasmic Sperm Injection [ICSI]) entre las técnicas de reproducción asistida (TRA) combinado, en el caso de pacientes azoospérmicos, con las técnicas de recuperación espermática de testículo (Testicular Sperm Extraction [TESE]) o epidídimo (Microsurgical Epididymal Sperm Aspiration [MESA]), ofreció a esos pacientes nuevas posibilidades para concebir hijos con sus propios gametos, pues para ello tan solo se requiere un pequeño número de espermatozoides móviles. Puesto que, como ya hemos mencionado, en un gran número de pacientes con microdeleciones es posible recuperar espermatozoides de semen o testículo, la ICSI o TESE+ICSI suelen ser tratamientos habituales para estos casos. Sin embargo, dado que dichas técnicas evitan la selección natural del espermatozoide, cabe la posibilidad de que los espermatozoides empleados en el proceso sean de peor calidad y, por ello, menos competentes para el desarrollo de sus funciones durante la fecundación o en los primeros estadios del desarrollo embrionario, conduciendo a peores resultados clínicos.
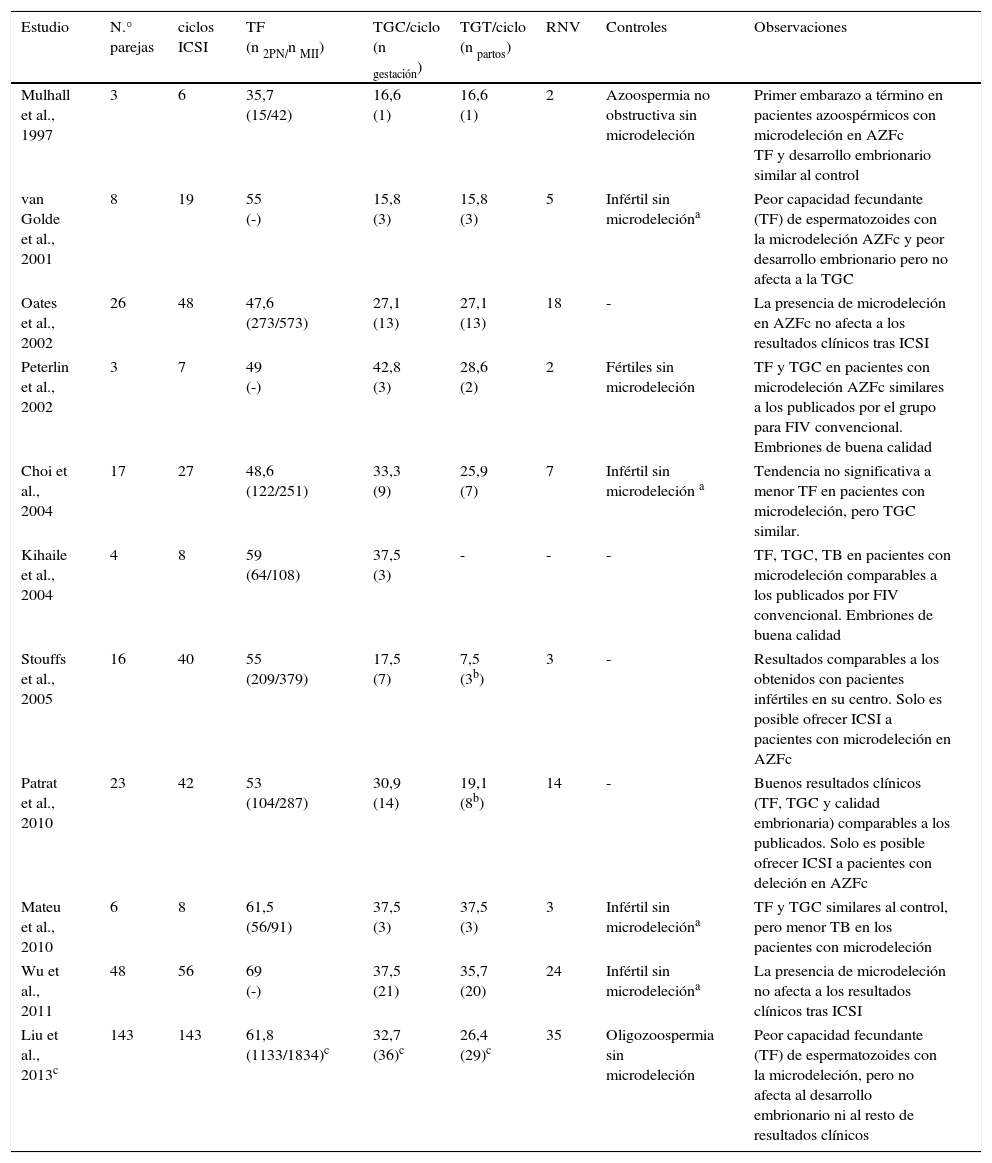
Desde que, a finales de los 90, Mulhall et al. (1997) lograron mediante TESE+ICSI el primer embarazo y posterior nacimiento de un hijo de un paciente azoospérmico con deleción en la región AZFc (Mulhall et al., 1997), tan solo unos pocos estudios han analizado cómo la microdeleción puede afectar a los resultados clínicos tras ICSI, publicando conclusiones controvertidas (tabla 1). Mientras algunos autores observaron similares resultados en pacientes con microdeleciones que en aquellos con el Cr Y intacto (Choi et al., 2004; Mulhall et al., 1997; Wu et al., 2011; Peterlin et al., 2002; Oates et al., 2002), otros encontraron diferencias significativas entre ellos. En concreto, cuando la ICSI se realizaba con espermatozoides con la mutación, las tasas de fecundación resultaron ser inferiores y obtuvieron embriones de peor calidad (Liu et al., 2013; van Golde et al., 2001). Este último dato no fue confirmado por otros autores que consideran que, una vez fecundado, la presencia de la microdeleción en el espermatozoide no afecta al desarrollo embrionario (Liu et al., 2013; Wu et al., 2011) aunque, en nuestra experiencia, la tasa de llegada a blastocisto sí resulta inferior (Mateu et al., 2010). Por lo demás, los estudios realizados hasta la fecha muestran tasas de gestación clínica, de implantación y de recién nacidos vivos similares cuando se comparan los resultados clínicos de pacientes infértiles con microdeleciones respecto de los controles sin ellas (Choi et al., 2004; Liu et al., 2013; Mulhall et al., 1997; Wu et al., 2011; van Golde et al., 2001), o a los obtenidos habitualmente en pacientes fértiles o infértiles en cada centro (Patrat et al., 2010; Oates et al., 2002; Kihaile et al., 2004; Stouffs et al., 2005), si bien en muchos casos no comparan las tasas de aborto o el número de embriones transferidos. Tan solo un estudio prospectivo evalúa la eficacia de la ICSI en pacientes con microdeleciones, pero emplean para ello un número muy reducido de pacientes y no muestran datos de pacientes control sin microdeleciones (Kihaile et al., 2004). Se requieren, por tanto, más estudios para llegar a resultados concluyentes a este respecto.
Resultados clínicos tras ciclos de ICSI en parejas con microdeleciones del cromosoma Y
| Estudio | N.° parejas | ciclos ICSI | TF (n 2PN/n MII) | TGC/ciclo (n gestación) | TGT/ciclo (n partos) | RNV | Controles | Observaciones |
|---|---|---|---|---|---|---|---|---|
| Mulhall et al., 1997 | 3 | 6 | 35,7 (15/42) | 16,6 (1) | 16,6 (1) | 2 | Azoospermia no obstructiva sin microdeleción | Primer embarazo a término en pacientes azoospérmicos con microdeleción en AZFc TF y desarrollo embrionario similar al control |
| van Golde et al., 2001 | 8 | 19 | 55 (-) | 15,8 (3) | 15,8 (3) | 5 | Infértil sin microdelecióna | Peor capacidad fecundante (TF) de espermatozoides con la microdeleción AZFc y peor desarrollo embrionario pero no afecta a la TGC |
| Oates et al., 2002 | 26 | 48 | 47,6 (273/573) | 27,1 (13) | 27,1 (13) | 18 | - | La presencia de microdeleción en AZFc no afecta a los resultados clínicos tras ICSI |
| Peterlin et al., 2002 | 3 | 7 | 49 (-) | 42,8 (3) | 28,6 (2) | 2 | Fértiles sin microdeleción | TF y TGC en pacientes con microdeleción AZFc similares a los publicados por el grupo para FIV convencional. Embriones de buena calidad |
| Choi et al., 2004 | 17 | 27 | 48,6 (122/251) | 33,3 (9) | 25,9 (7) | 7 | Infértil sin microdeleción a | Tendencia no significativa a menor TF en pacientes con microdeleción, pero TGC similar. |
| Kihaile et al., 2004 | 4 | 8 | 59 (64/108) | 37,5 (3) | - | - | - | TF, TGC, TB en pacientes con microdeleción comparables a los publicados por FIV convencional. Embriones de buena calidad |
| Stouffs et al., 2005 | 16 | 40 | 55 (209/379) | 17,5 (7) | 7,5 (3b) | 3 | - | Resultados comparables a los obtenidos con pacientes infértiles en su centro. Solo es posible ofrecer ICSI a pacientes con microdeleción en AZFc |
| Patrat et al., 2010 | 23 | 42 | 53 (104/287) | 30,9 (14) | 19,1 (8b) | 14 | - | Buenos resultados clínicos (TF, TGC y calidad embrionaria) comparables a los publicados. Solo es posible ofrecer ICSI a pacientes con deleción en AZFc |
| Mateu et al., 2010 | 6 | 8 | 61,5 (56/91) | 37,5 (3) | 37,5 (3) | 3 | Infértil sin microdelecióna | TF y TGC similares al control, pero menor TB en los pacientes con microdeleción |
| Wu et al., 2011 | 48 | 56 | 69 (-) | 37,5 (21) | 35,7 (20) | 24 | Infértil sin microdelecióna | La presencia de microdeleción no afecta a los resultados clínicos tras ICSI |
| Liu et al., 2013c | 143 | 143 | 61,8 (1133/1834)c | 32,7 (36)c | 26,4 (29)c | 35 | Oligozoospermia sin microdeleción | Peor capacidad fecundante (TF) de espermatozoides con la microdeleción, pero no afecta al desarrollo embrionario ni al resto de resultados clínicos |
RNV: recién nacidos vivos; TB: tasa de blastocistos; TF: tasa de fecundación (%); TGC: tasa de gestación clínica (%); TGT: tasas de gestación a término (%).
Independientemente de su eficiencia, una de las cuestiones que más preocupa a la comunidad científica respecto del empleo de ICSI para el tratamiento de la infertilidad de estos pacientes es si su descendencia puede tener mayor riesgo de transmisión de alguna anomalía genética. En este sentido, ya es un hecho probado en la bibliografía que, si bien la mayoría de las deleciones son de novo (Foresta et al., 2001b; Sadeghi-Nejad y Farrokhi, 2007), dichas deleciones se transmiten tanto de manera natural, cuando ello es posible, como a través de ICSI a la descendencia masculina, heredando con ello los problemas de fertilidad (Oates et al., 2002; Cram et al., 2000; Lee et al., 2006). En este último caso es importante precisar que la técnica de ICSI en sí misma no induce la aparición de novo de microdeleciones, como se deduce de la nula presencia de las mismas en niños de varones sin microdeleción concebidos mediante dicha técnica en centros españoles o extranjeros (Cram et al., 2000; Buch et al., 2004). Con respecto a la transmisión de la alteración y la infertilidad asociada, aunque en raras ocasiones, se han detectado algunos casos en los que se produce una expansión de la microdeleción en la descendencia (Foresta et al., 2001b; Sadeghi-Nejad y Farrokhi, 2007; Lee et al., 2006), con el consiguiente posible empeoramiento de sus efectos. De cualquier modo, aunque padre e hijo portaran una deleción de igual tamaño, tan solo podremos asumir que ambos presentarán una alteración de la espermatogénesis, pero nunca podremos predecir la severidad de la infertilidad en los varones de la descendencia, dado que, como ya hemos mencionado, existen otros factores que pueden conducir a un fenotipo distinto (Foresta et al., 2001b; Oates et al., 2002). En el mejor de los casos, aunque los hijos pudieran acudir igualmente a las TRA para solventar su infertilidad, lo cierto es que podría provocar un aumento significativo de varones infértiles en generaciones futuras (Silber, 2011; Foresta et al., 2001b).
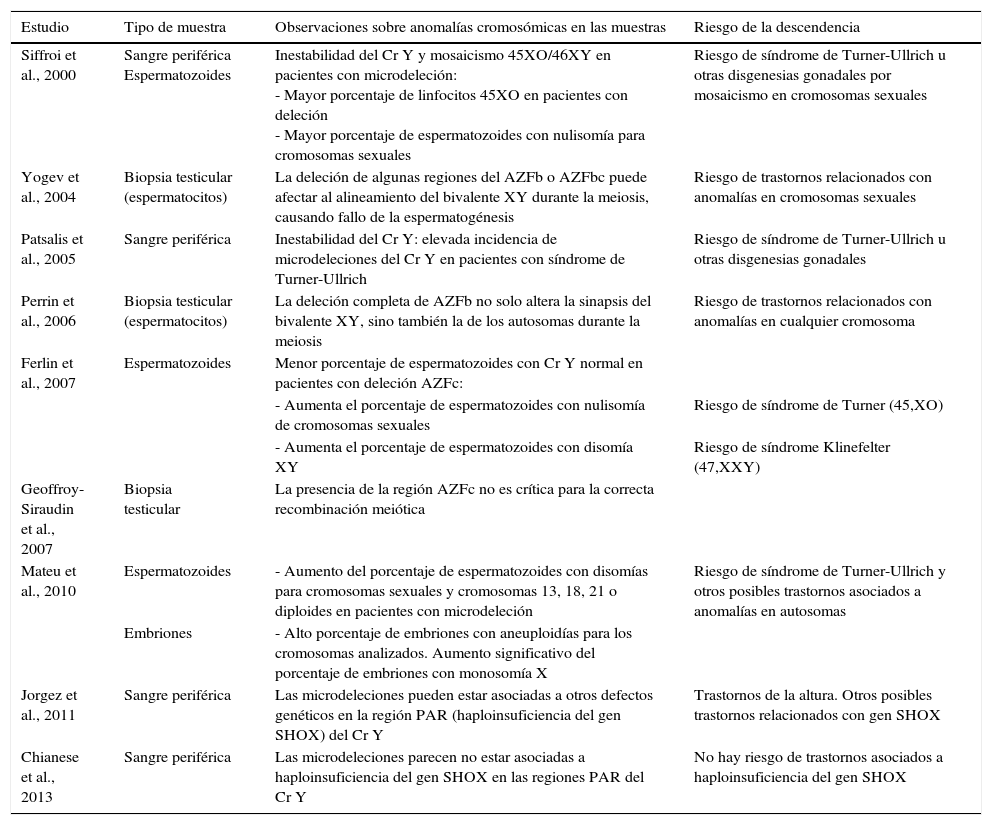
Relación entre las microdeleciones del cromosoma Y y otras anomalías cromosómicasUn hecho aún más inquietante es la posibilidad de transmitir a la descendencia otro tipo de anomalías cromosómicas que podrían estar asociadas a las microdeleciones, ocasionando daños más severos a los recién nacidos vivos (tabla 2). Con respecto a las anomalías cromosómicas podemos diferenciar entre las que implican a los cromosomas sexuales (Ferlin et al., 2007; Patrat et al., 2010; Stouffs et al., 2005; Siffroi et al., 2000; Patsalis et al., 2005; Patsalis et al., 2002; Mitra et al., 2006, Dos Santos et al., 2013) y las que implican a otros cromosomas (Perrin et al., 2006; Yogev et al., 2004).
Estudios de anomalías cromosómicas asociadas a las microdeleciones del cromosoma Y. Riesgo de la descendencia
| Estudio | Tipo de muestra | Observaciones sobre anomalías cromosómicas en las muestras | Riesgo de la descendencia |
|---|---|---|---|
| Siffroi et al., 2000 | Sangre periférica Espermatozoides | Inestabilidad del Cr Y y mosaicismo 45XO/46XY en pacientes con microdeleción: - Mayor porcentaje de linfocitos 45XO en pacientes con deleción - Mayor porcentaje de espermatozoides con nulisomía para cromosomas sexuales | Riesgo de síndrome de Turner-Ullrich u otras disgenesias gonadales por mosaicismo en cromosomas sexuales |
| Yogev et al., 2004 | Biopsia testicular (espermatocitos) | La deleción de algunas regiones del AZFb o AZFbc puede afectar al alineamiento del bivalente XY durante la meiosis, causando fallo de la espermatogénesis | Riesgo de trastornos relacionados con anomalías en cromosomas sexuales |
| Patsalis et al., 2005 | Sangre periférica | Inestabilidad del Cr Y: elevada incidencia de microdeleciones del Cr Y en pacientes con síndrome de Turner-Ullrich | Riesgo de síndrome de Turner-Ullrich u otras disgenesias gonadales |
| Perrin et al., 2006 | Biopsia testicular (espermatocitos) | La deleción completa de AZFb no solo altera la sinapsis del bivalente XY, sino también la de los autosomas durante la meiosis | Riesgo de trastornos relacionados con anomalías en cualquier cromosoma |
| Ferlin et al., 2007 | Espermatozoides | Menor porcentaje de espermatozoides con Cr Y normal en pacientes con deleción AZFc: | |
| - Aumenta el porcentaje de espermatozoides con nulisomía de cromosomas sexuales | Riesgo de síndrome de Turner (45,XO) | ||
| - Aumenta el porcentaje de espermatozoides con disomía XY | Riesgo de síndrome Klinefelter (47,XXY) | ||
| Geoffroy-Siraudin et al., 2007 | Biopsia testicular | La presencia de la región AZFc no es crítica para la correcta recombinación meiótica | |
| Mateu et al., 2010 | Espermatozoides | - Aumento del porcentaje de espermatozoides con disomías para cromosomas sexuales y cromosomas 13, 18, 21 o diploides en pacientes con microdeleción | Riesgo de síndrome de Turner-Ullrich y otros posibles trastornos asociados a anomalías en autosomas |
| Embriones | - Alto porcentaje de embriones con aneuploidías para los cromosomas analizados. Aumento significativo del porcentaje de embriones con monosomía X | ||
| Jorgez et al., 2011 | Sangre periférica | Las microdeleciones pueden estar asociadas a otros defectos genéticos en la región PAR (haploinsuficiencia del gen SHOX) del Cr Y | Trastornos de la altura. Otros posibles trastornos relacionados con gen SHOX |
| Chianese et al., 2013 | Sangre periférica | Las microdeleciones parecen no estar asociadas a haploinsuficiencia del gen SHOX en las regiones PAR del Cr Y | No hay riesgo de trastornos asociados a haploinsuficiencia del gen SHOX |
Cr Y: cromosoma Y; gen SHOX: del inglés short-stature-homeobox gene; PAR: del inglés pseudoautosomal region.
Por lo que concierne a las primeras, esto es, a las de cromosomas sexuales, son varios los indicios que sugieren su relación con la presencia de microdeleciones en el Cr Y. Así, algunos autores han descrito una mayor incidencia de cariotipos anormales que involucran a los cromosomas sexuales en los pacientes infértiles con deleciones que en la población general (Patrat et al., 2010; Stouffs et al., 2005; Siffroi et al., 2000). Por su parte, Siffroi et al. (2000) propusieron que ciertas microdeleciones del Cr Y podrían provocar una inestabilidad general de dicho cromosoma que conduciría a la pérdida del mismo, contribuyendo así a la formación de algunas líneas celulares 45XO, detectadas especialmente en células germinales de dichos pacientes (Siffroi et al., 2000; Patsalis et al., 2005). De acuerdo con su hipótesis, diversos autores han encontrado una reducción significativa en el número de espermatozoides con Cr Y normal en pacientes con deleción respecto de los controles infértiles sin deleción o de los fértiles, así como un incremento en el porcentaje de espermatozoides nulisómicos para cromosomas sexuales (Ferlin et al., 2007; Siffroi et al., 2000) o con disomías XY (Ferlin et al., 2007; Mateu et al., 2010). Mientras que el aumento de espermatozoides nulisómicos, probablemente debido a la inestabilidad del Cr Y, incrementa el riesgo de que la descendencia de dichos pacientes presente además síndrome de Turner (45XO), la disomía XY en los espermatozoides indica que la microdeleción podría interferir en el proceso de disyunción meiótica de los cromosomas sexuales, elevando el riesgo de que los pacientes que la poseen engendren hijos con síndrome de Klinefelter (47XXY) (Ferlin et al., 2007).
Además, recientemente se ha insinuado que los mecanismos responsables de la aparición de microdeleciones podrían ser más complejos de lo esperado y asociarse a otras aberraciones del Cr Y fuera de las regiones AZF (Jorgez et al., 2011). Así, Jorgez et al. observaron que, a diferencia de los varones fértiles o infértiles con Cr Y normal, el 10% de pacientes con alguna deleción presenta además anomalías génicas de las regiones teloméricas PAR, y con ello la posibilidad de transmitir a la descendencia otros defectos relacionados con los genes afectados en dichas regiones, como trastornos de la altura o ciertos trastornos mentales (Jorgez et al., 2011). En contra, en un estudio multicéntrico reciente no encontraron ninguna asociación con relevancia clínica entre las microdeleciones y dichos genes (Chianese et al., 2013).
Por otra parte, ciertos estudios sugieren que la presencia de microdeleciones podría afectar asimismo a la presencia de anomalías en cromosomas no sexuales. En concreto, mediante estudios de meiosis en espermatocitos se ha comprobado que ciertas microdeleciones (en la región AZFb) parecen afectar a la sinapsis no solo del bivalente XY, sino también de los autosomas (Perrin et al., 2006; Yogev et al., 2004), aunque los genes de otras regiones (AZFc) no parecen ser críticos para la recombinación meiótica (Geoffroy-Siraudin et al., 2007). Ello reitera la posibilidad de que la descendencia herede, junto con la deleción causante de su infertilidad, otras anomalías con peores consecuencias clínicas.
Por último, la presencia de otras anomalías cromosómicas asociadas a la microdeleción en el Cr Y también podría implicar un bloqueo del desarrollo embrionario o mayor número de abortos. De acuerdo con esta teoría, estudios recientes de nuestro laboratorio demostraron una tasa de llegada a blastocisto significativamente menor en los embriones de estos pacientes (Mateu et al., 2010). De igual modo, 2 grupos de investigación diferentes revelaron recientemente una mayor frecuencia de microdeleciones en AZFc en parejas con aborto de repetición, sugiriendo que dicha región podría ser importante para el mantenimiento de la gestación (Dewan et al., 2006; Karaer et al., 2008), si bien estos resultados no se confirmaron en estudios posteriores, en los que se empleaban un mayor número de STS más adecuadas para la detección de la mayoría de las deleciones conocidas clínicamente relevantes (Kaare et al., 2008, Bellver et al., 2010).
Es importante señalar que, a pesar de todos estos datos, por el momento no se ha publicado ningún caso de descendencia con malformaciones de los genitales y, excepto un caso con síndrome de corazón izquierdo hipoplásico y atresia pulmonar, de etiología probablemente independiente a la microdeleción (Page et al., 1999), todos los niños nacidos de pacientes con alguna microdeleción son clínicamente sanos. No obstante, debemos reparar en que gran parte de esos niños, mayoritariamente obtenidos por ICSI, todavía no han alcanzado la pubertad. Igualmente, no se dispone de suficiente información sobre la incidencia de abortos espontáneos en las parejas de dichos pacientes.
Por todo ello, de acuerdo con las últimas directrices de la European Academy of Andrology (EAA) y de la European Molecular Genetics Quality Network (EMQN) se está insistiendo en recomendar el cribado de las microdeleciones a los pacientes con azoospermia no obstructiva u oligozoospermia severa (<5×106 espermatozoides/ml) y ofrecer asesoramiento genético, antes de realizar FIV o ICSI, a aquellas parejas cuyo varón las presente (Krausz et al., 2014). Sin embargo, por el momento, no es una recomendación aplicada en la práctica clínica en muchos centros de reproducción asistida de España.
A pesar de los riesgos ya descritos, hoy día la ICSI sigue siendo la estrategia terapéutica elegida por la mayoría de las parejas que presentan estas anomalías y no consiguen embarazo de manera natural, siempre que se logre recuperar espermatozoides (Patrat et al., 2010; Oates et al., 2002), lo que sucede aproximadamente en la mitad de los casos que acuden a dicha técnica de fecundación, aunque se trata mayoritariamente de pacientes con microdeleciones en AZFc (Stouffs et al., 2005).
En esos casos, con el objetivo de evitar la posible aparición de otras anomalías potenciales en la descendencia, tales como las aneuploidías, sería preciso realizar un estudio genético preimplantacional (Preimplantation Genetic Screening [PGS]) para seleccionar embriones sin aneuploidías para la transferencia, consiguiendo asimismo reducir las tasas de aborto y mejorar los resultados reproductivos. Las nuevas aproximaciones al PGS desarrolladas en los últimos años, como los arrays basados en la hibridación genómica comparada (Comparative Genomic Hybridization), permiten evaluar todos los cromosomas del embrión, y ha permitido detectar alteraciones numéricas en otros cromosomas no observados previamente por hibridación fluorescente in situ (Fluorescent In Situ Hybridization [FISH]). De este modo, recientemente hemos ratificado la necesidad de realizar PGS en embriones de parejas con factor masculino severo (<2×106 espermatozoides/ml), dado que con ello se descartan embriones anómalos y se incrementan las tasas de gestación evolutiva, reduciendo al mínimo la incidencia de abortos (Rubio et al., 2014). Queda pendiente, sin embargo, comprobar los riesgos reales de transmisión de anomalías diferentes a la microdeleción en la descendencia de aquellos que la poseen, y verificar si el PGS debería ser aconsejado a parejas cuyo varón presente microdeleciones, que acuden a ICSI para ser padres, empleando sus propios gametos.
En este sentido, estudios retrospectivos de nuestro laboratorio han demostrado que, a diferencia de los controles sin microdeleción, los pacientes que las presentan no solo poseen mayor porcentaje de espermatozoides con disomías sexuales, sino también de los cromosomas 13, 18 y 21 o de espermatozoides diploides (Mateu et al., 2010). Es posible que dichas disomías también se presentaran en otros cromosomas no analizados mediante FISH. Paralelamente, el PGS evidenció una alta incidencia de embriones cromosómicamente anormales (monosomía X) procedentes de pacientes con la deleción y FISH de espermatozoides anormal (Mateu et al., 2010), que resultó ser significativa respecto a la de los controles sin deleción, a pesar de no contar con un número muy amplio de muestras ni analizar los 23 pares cromosómicos.
Hasta el momento son pocos los pacientes con microdeleciones cuyos embriones se hayan sometido a PGS. En muchos casos, a pesar de las recomendaciones, ni siquiera se ha analizado la presencia de dicha anomalía en el varón. Sin embargo, si se confirman los riesgos genéticos de la descendencia de estos pacientes, sería particularmente necesario incluir como rutina clínica la evaluación de microdeleciones en varones infértiles que acuden a las TRA para solventar sus problemas de fertilidad, y recomendar PGS como una alternativa terapéutica adecuada para aquellos que las presenten. No obstante, teniendo en cuenta que los hijos varones sufrirían el mismo problema de infertilidad que sus padres y que la selección de sexo está prohibida en muchos países como España, la inseminación con semen de donante resulta también una alternativa reproductiva para estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.