La técnica inyección intracitoplasmática de espermatozoides (ICSI) lleva aplicándose con relativo éxito durante cerca de 25 años. A pesar de los resultados obtenidos, esta está lejos de ser totalmente infalible: se acumulan constantemente pacientes que sufren fallos de fertilización o sucesivos fallos de implantación tras varios ciclos de ICSI. Por ello, en el mercado han aparecido diferentes sistemas de imagen que permiten perfeccionar estas técnicas.
Sin embargo, hasta el momento, estas nuevas tecnologías no han gozado de demasiado éxito. El sistema PolScope (también denominado oosight) permite observar las estructuras internas del ovocito durante los procesos de microinyección. Su aplicación permitiría observar el huso meiótico, evitando que sea dañado durante el progreso de la técnica, pero tiene escaso sentido a la hora de evaluar el gameto. Por otro lado, el sistema intracytoplasmic morphologically selected sperm injection (IMSI) está bastante más desarrollado, pero el tiempo que requiere su manejo, unido a los escasos éxitos obtenidos en su aplicación sobre la población general, ha supuesto un evidente desinterés por parte de los laboratorios de reproducción.
En el presente trabajo se ha realizado un análisis exhaustivo de estas técnicas de imagen y de los resultados obtenidos en los diferentes artículos publicados. El resultado de dicha búsqueda ha revelado que, si bien el uso del sistema motile-sperm organelle morphology examination (MSOME) durante los procesos de microinyección no supone una mejora clara de los resultados en la población general, determinados grupos de pacientes con alteraciones espermáticas (teratozoospermia) o con sucesivos fallos de ICSI previos, sí que pueden verse altamente beneficiados de su aplicación. Según las conclusiones desprendidas del presente trabajo, a estos pacientes se les puede, por tanto, ofrecer estas técnicas como alternativa a otros métodos menos accesibles, como por ejemplo la donación de gametos, con cierta garantía de éxito.
The intracytoplasmic sperm injection (ICSI) technique has being implemented with relative success for almost 25 years. Despite the results, it is far from being completely infallible, with an increasing number of patients suffering successive fertilisation or implantation failures after several cycles of ICSI. For this reason, different imaging systems have appeared in the last few years that may help to improve these techniques.
However, these new technologies have not been very successful. The PolScope system (also called oosight) enables most of the internal structures of the egg to be observed during the process of microinjection. Also, with this system the meiotic spindle can be observed, preventing it from being damaged during the progress, although it is not of much use when assessing the gamete. On the other hand, the intracytoplasmic morphologically selected sperm injection (IMSI) system is perhaps much more developed, but the time required to manage this technique, together with the few number of successful cycles obtained in its application in the general population, has led to an apparent lack of interest by reproduction laboratories.
In this paper, a thorough analysis has been made of these imaging techniques and the results obtained in various published articles. The result of this search has revealed that, although the use of the motile-sperm organelle morphology examination (MSOME) system during the process of microinjection does not show a clear improvement in results when applied in the general population, certain groups of patients with sperm abnormalities (teratozoospermia), or with successive previous failures of ICSI may benefit highly from its application. According to the findings observed in this study, it is possible to offer to these patients some of the techniques described as an alternative to other less accessible methods, such as gamete donation, with some guarantee of success.
El desarrollo de la inyección intracitoplasmática de espermatozoides (ICSI) en los años 90 del pasado siglo (Palermo et al., 1992) supuso una revolución en las técnicas de reproducción asistida. Gracias a ella, con tan solo un único espermatozoide podemos proceder a fecundar un ovocito, con grandes posibilidades de obtener un embrión, que finalmente curse en embarazo. Sin embargo, el uso de estas técnicas también implica una reducción en la capacidad natural de los gametos de autoseleccionarse, con lo que la responsabilidad de dicho acto pasa al embriólogo. En este punto, es crítico realizar correctamente dicha discriminación, de forma que una mala selección puede echar por tierra la mayoría de las opciones de obtener un embrión evolutivo. A pesar de ello, en la práctica habitual suele trabajarse a relativamente pocos aumentos (apenas 400x), concediendo, tal vez, mayor importancia a realizar el proceso en el menor tiempo posible que a efectuar una selección de los gametos altamente minuciosa. No obstante, aún se considera que hay margen de mejora, y, por ello, en los últimos años se han desarrollado nuevos sistemas de imagen con el objetivo de mejorar la calidad de nuestros embriones, y, con ello, perfeccionar estos procesos. Algunos de los sistemas desarrollados incluirían: el sistema PolScope (también denominado oosight), centrado en la evaluación del gameto femenino; el Zech-selector, con el que se pretende seleccionar espermatozoides con mayor movilidad y menor grado de fragmentación en su ADN; o el motile sperm organelle morphology examination (MSOME), diseñado en principio para la evaluación del gameto masculino y que ha derivado, posteriormente, hacia su aplicación dentro de la técnica de inyección intracitoplasmática (ICSI), tomando el nombre de Intracytoplasmic Morphologically-selected Sperm Injection (IMSI).
El objetivo del presente trabajo es evaluar la conveniencia de la aplicación de las nuevas tecnologías de imagen, sobre todo, en los momentos previos y durante la aplicación de la técnica de ICSI. Tomando como base una exhaustiva búsqueda bibliográfica, baremaremos los pros y los contras del empleo de estas técnicas, con el ánimo de establecer, en primer lugar, si es posible estandarizar su uso a todos los pacientes. Si el resultado no fuera positivo, es decir, si los estudios realizados no consideraran que puede haber una mejora sustancial en su uso generalizado, pasaremos a valorar si algún grupo de pacientes particular podría beneficiarse preferentemente de su aplicación.
Material y métodosPara el presente trabajo se ha realizado una revisión de la bibliografía más relevante acerca del estudio y desarrollo, así como de los resultados obtenidos durante la aplicación de las técnicas de imagen durante la ICSI. Principalmente se ha estudiado el sistema MSOME, la técnica IMSI y el PolScope. La base de datos utilizada ha sido el PubMed. La búsqueda de bibliografía se ha acotado al periodo comprendido entre 2006 y 2015 con los términos «MSOME», «IMSI», «Zech-selector», «Oosight», «Polscope», «human sperm vacuoles» y «high magnification, sperm», así como un estudio de los trabajos previos referidos por estos. Todos los artículos consultados están reflejados en el apartado de bibliografía. Solo se consideraron los trabajos publicados en inglés, los cuales fueron seleccionados, analizados y relacionados con la intención de obtener una visión global de las posibilidades de las técnicas consultadas. Además, se examinan, comparan y discuten las metodologías de estudio y los resultados.
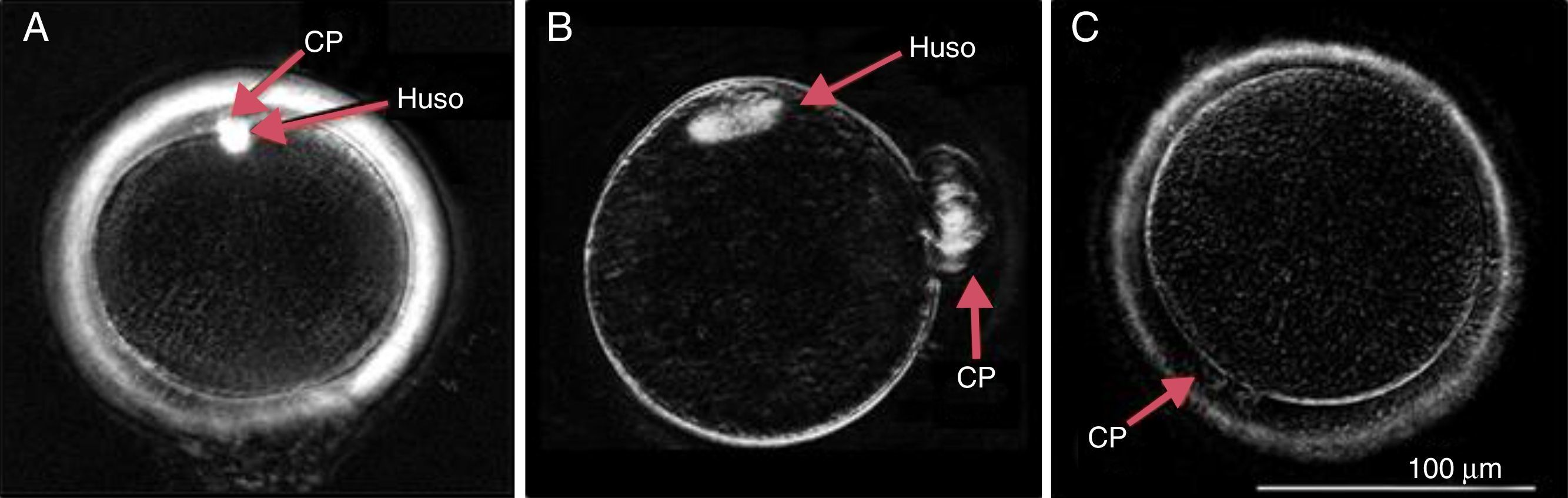
ResultadosTécnicas para la evaluación ovocitariaEmpezaremos hablando de los sistemas de imagen diseñados específicamente para evaluar la calidad ovocitaria. El sistema denominado PolScope (o microscopio de polarización, también conocido comercialmente como oosight) permite evaluar el estado del propio gameto, incluyendo la presencia (o no) de un huso meiótico intacto y en su posición apropiada, o de una zona pelúcida del grosor adecuado (fig. 1); factores que, si se tienen en cuenta durante el proceso de ICSI, podrían aumentar enormemente el número de embriones con aspecto favorable e, incluso, mejorar hasta 8 veces las tasas de embarazo (Cohen et al., 2004; Shen et al., 2005; Son y Tan, 2010; Wang et al., 2001; Zeng et al., 2007).
Imágenes obtenidas mediante el sistema PolScope (oosight), en las que es posible observar la disposición del corpúsculo polar (CP), el huso meiótico y el grosor de la zona pelúcida. A) Ovocito normal maduro (Son y Tan, 2010). B) Ovocito que presenta el huso meiótico desplazado (Cheng Hong ©). C) Ovocito sin huso meiótico (Zeng et al., 2007).
El oosight permite observar mediante luz polarizada las estructuras internas del ovocito. Si bien las posibilidades de elección del ovocito adecuado son mucho más limitadas que en la selección espermática, en determinados casos sí es posible evaluar la conveniencia del uso de un determinado ovocito o no. Muchos trabajos publicados hacen uso de esta técnica para evaluar diferentes procesos considerados agresivos, pero realizados con frecuencia durante la práctica clínica. Por ejemplo, en ovocitos que habían sufrido un proceso previo de congelación lenta se observó cómo, muchos de ellos, presentaban alteraciones en la forma y disposición del huso meiótico, si bien en el mismo estudio se constató como la mayoría recuperaba su estado normal en apenas una hora de cultivo tras la descongelación (Sereni et al., 2009); de este modo, según los autores, y en lo que respectaba al huso, no sería necesario el cultivo de las 3 h que marca la bibliografía (Bianchi et al., 2005; Rienzi et al., 2004). También se pudo evaluar como ovocitos de ratón procedentes de una estimulación ovárica más suave, producida por el letrozol, un inhibidor de la aromatasa, presentaban un mejor aspecto interno que aquellos procedentes de estimulaciones con FSH (Ganesh et al., 2010).
Sin embargo, la aplicación más útil de estos sistemas, esto es, su uso durante la fecundación ovocitaria, quedaría limitado a la realización de lo que se denomina ICSI de rescate («rescued ICSI»), o a la realización de una ICSI en ovocitos que no fecundaron tras un intento previo de fecundación in vitro (FIV). Estos gametos tienen, al menos, un día de retraso (asincronía en madurez ovocitaria), debido al intento de FIV realizado previamente. Debido a esto, el intento de realizar un ICSI con ellos implicaría la generación de embriones con alto grado de anomalías cromosómicas, baja tasa de embarazo o alta probabilidad de formación de 3 o más pronúcleos, principalmente por la rotura del huso, que se encuentra deslocalizado, durante la inyección (fig. 1). En un reciente estudio comprobaron como la aplicación del oosight permitía reducir el daño al ovocito en este punto y mejorar significativamente las tasas de fertilización respecto al grupo control (69 vs. 44%), reduciendo la formación de embriones con número anormal de pronúcleos (Moon et al., 2013).
Técnicas para evaluar el grado de integridad de ADN espermáticoEn cuanto al espermatozoide, una de las características que se ha demostrado más crítica a la hora de seleccionar el gameto adecuado durante el proceso de ICSI es poder medir la integridad de su ADN. Sin embargo, las técnicas más usadas en la actualidad para evaluar el nivel de fragmentación en el ADN espermático implican la destrucción del propio espermatozoide (sistemas basados en la sperm chromatin dispersion); con lo que la única alternativa que podemos ofrecer en el laboratorio es la obtención de un capacitado enriquecido con espermatozoides con el ADN intacto, sin poder asegurar que el gameto que finalmente seleccionemos sea el adecuado o no. En este punto entra en juego una novedosa técnica denominada «Zech-selector», una cámara que permite la selección espermática sin aplicar estrés por centrifugación, simplemente con su desplazamiento por una superficie durante un corto espacio de tiempo.
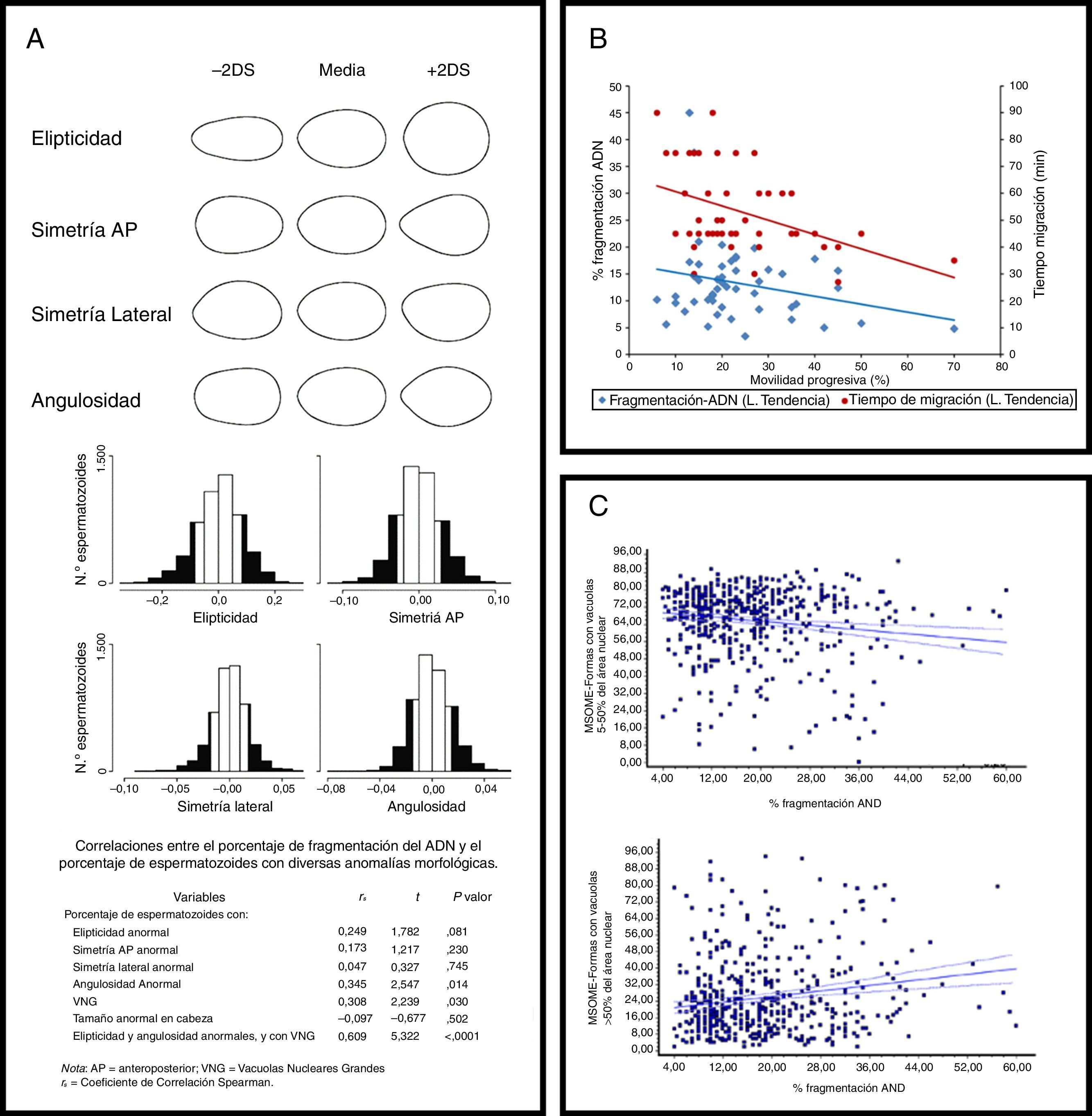
Un reciente estudio en el que analizaban un subgrupo de espermatozoides seleccionados mediante esta técnica llegó a la conclusión de que aquellos espermatozoides con peor movilidad eran portadores de anomalías en sus cromosomas, tanto numéricas como estructurales (principalmente en el X, Y y 18). Dicha técnica, además, es eficaz para separar espermatozoides con mayor número de vacuolas o con condensación anómala en su cromatina. De este modo, los espermatozoides que dispongan de una mejor movilidad progresiva serán los que, en definitiva, tengan su ADN intacto y los que finalmente utilicemos a la hora de microinyectar (Ebner et al., 2003; Seiringer et al., 2013) (fig. 2B).
A) Resultados del análisis Fourier realizado sobre las cabezas de los espermatozoides en Utsuno et al. (2013). Muestra la media de cada parámetro analizado, junto con la desviación típica (DE). Los histogramas muestran la distribución de la población respecto a cada parámetro, las desviaciones mostradas en negro serían consideradas formas anormales. B) Correlación entre el porcentaje de espermatozoides que muestran movilidad normal, con su fragmentación en el ADN, y el tiempo de migración en el Zech-selector (Seiringer et al., 2013). C) Relación entre la fragmentación del ADN y la presencia de vacuolas de pequeño y gran tamaño (Oliveira et al., 2010).
A día de hoy, la mejor alternativa para aumentar las posibilidades de elegir correctamente el espermatozoide para inyectar es el uso de otro sistema denominado MSOME (Bartoov et al., 2002), cuya aplicación dentro de las técnicas de microinyección se denomina IMSI (Bartoov et al., 2003). Esta técnica se basa en la observación de los gametos mediante un microscopio invertido equipado con un sistema de micromanipulación, en el cual se ha acoplado un novedoso sistema óptico conectado, a su vez, a una cámara y a un sistema digital de imagen. Este sistema permite, en conjunto, un campo de observación de 6.600 aumentos.
Sin embargo, el principal problema al obtener tal nivel de magnificación es decidir qué debemos evaluar. Ante esto, en la bibliografía se presentan diferentes criterios morfológicos para evaluar al espermatozoide en cabeza, acrosoma, pieza intermedia o cola, y para, de algún modo, intentar correlacionar los dismorfismos de estas estructuras con una peor integridad en su ADN (de Almeida Ferreira Braga et al., 2011; Garolla et al., 2008; Oliveira et al., 2010; Utsuno et al., 2013). Una dificultad añadida es la gran cantidad de formas y tamaños que puede adoptar el esperma humano. Esto complica la definición de criterios de normalidad, así como el establecimiento de categorías bien definidas. Criterios morfométricos que relacionan largo, ancho o circunferencia se pueden aplicar, pero muchas veces no resultan demasiado adecuados, ya que las proporciones no suelen coincidir entre diferentes muestras (Oliveira et al., 2010; Utsuno et al., 2013) (fig. 2A).
En uno de sus trabajos, Oliveira nos demuestra cómo durante las técnicas convencionales de selección en ICSI, y usando criterios morfológicos Tygenberg, se produce una elección ficticia de espermatozoides calificados como de buena calidad (falsos positivos). El uso del MSOME es mucho más restrictivo y permite identificar vacuolas y evaluar anormalidades en la cromatina que, de otro modo, quedarían ocultas (Oliveira et al., 2009). Por otro lado, el estudio de Knez et al. (2012) va un paso más allá y nos muestra como la inyección de espermatozoides con menos de 2 vacuolas pequeñas implica la obtención de embriones de mejor calidad y con mayores posibilidades de desarrollarse a blastocisto. En cambio, los propios autores ya nos advierten de que esta selección tan exhaustiva solo puede realizarse con la capacidad de aumentos ofrecida por el MSOME.
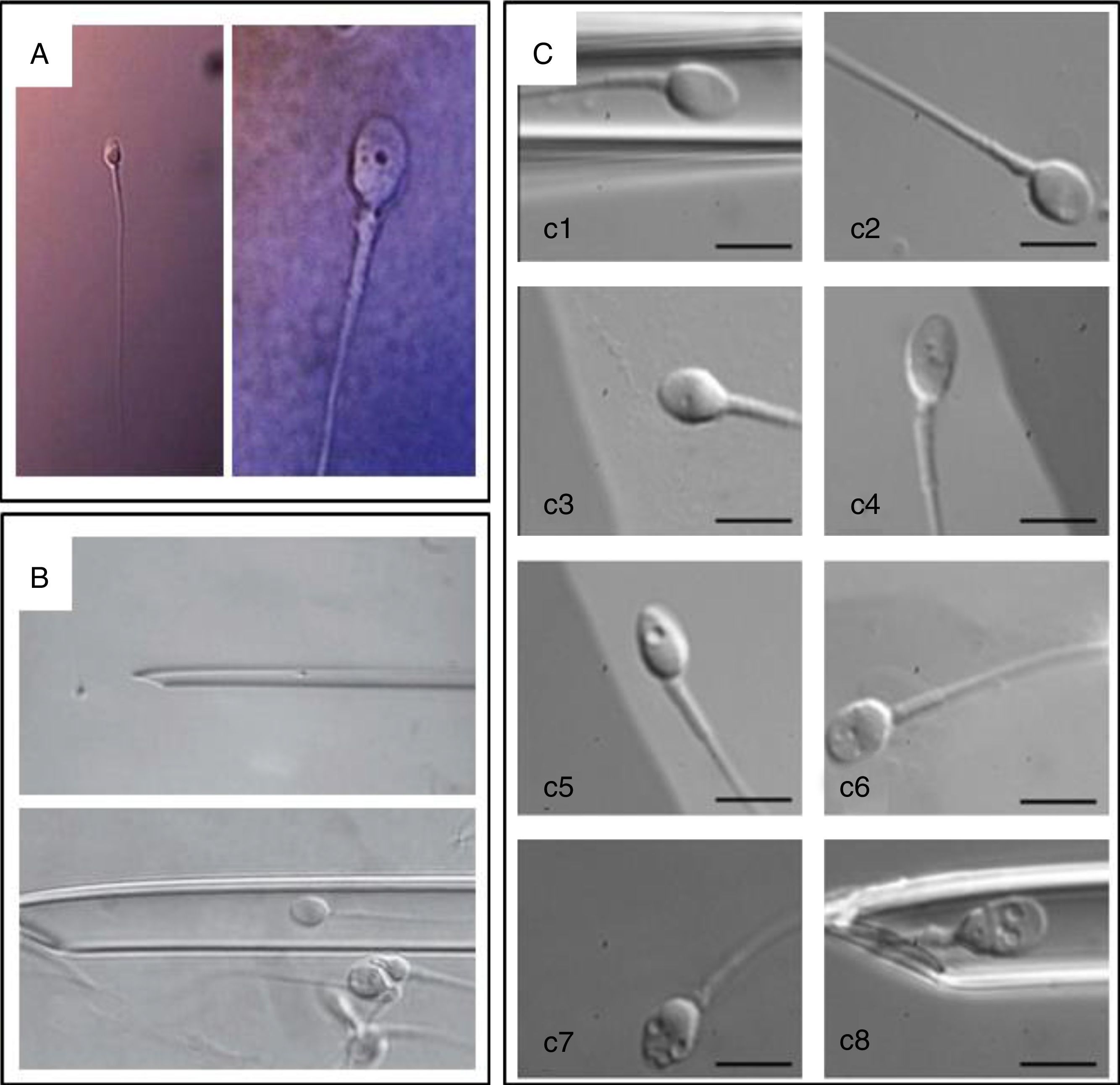
Significado biológico de las vacuolasComo vemos, el uso de la técnica MSOME nos abre un nuevo mundo en el análisis del gameto masculino. Sin embargo, en la comunidad científica todavía existe cierto desconocimiento sobre algunas de las estructuras que encontramos en los gametos humanos. Una de estas estructuras, cuya presencia produce cierta controversia, son las vacuolas (Bartoov et al., 2003, 2001; Berkovitz et al., 2006b; Berkovitz et al., 2005; Vanderzwalmen et al., 2008) (fig. 3). Tras la introducción de las técnicas de microscopia electrónica en los años 50 del pasado siglo, se pudo comprobar como la presencia de vacuolas estaba ampliamente extendida en las muestras de semen analizadas, y eso llevó a la conclusión de que su existencia podría ser una característica inherente en el esperma tanto humano como de otros mamíferos (Chrzanowski, 1966; Fawcett, 1958; Pedersen, 1969), y que estaban, de algún modo, relacionadas con los procesos de descondensación de la cromatina (Czaker, 1985). Actualmente, sin embargo, diferentes autores comienzan a considerar que la presencia de estas estructuras puede ser síntoma de una baja calidad espermática (Bartoov et al., 2003, 2002, 2001; Berkovitz et al., 2006b; Berkovitz et al., 2005; Janett et al., 2001; Mundy et al., 1994): son de peor pronóstico aquellos espermatozoides con un gran número de ellas o que presentan, al menos, una de gran tamaño (Knez et al., 2012; Oliveira et al., 2010; Toshimori, 2009; Vanderzwalmen et al., 2008) (fig. 3C).
A y B) Muestra la visión de un espermatozoide mediante el sistema óptico convencional (x400) y mediante el sistema MSOME (x6.000) (Antinori et al., 2008). C) Muestra diferentes espermatozoides analizados mediante el sistema MSOME: (c1-c2) sin vacuolas (clase i); (c3-c4) máximo 2 vacuolas pequeñas (clase ii); (c5-c6) más de 2 vacuolas pequeñas o una grande (clase iii); (c7-c8) varias vacuolas junto anormalidades de forma (clase iv). Escala: 5μm (Knez et al., 2012).
Algunos primeros estudios ya confirmaban la presencia de una mayor concentración de espermatozoides con vacuolas de gran tamaño en individuos subfértiles (Mundy et al., 1994) o relacionaban la presencia de estas estructuras con una baja fertilidad, incluso en sementales equinos (Janett et al., 2001). Más recientemente, se ha comenzado a relacionar una menor tasa de embarazo en aquellos pacientes que, tras ser tratados mediante ciclos de ICSI, presentaban un semen con mayor número de espermatozoides afectos con vacuolas (Bartoov et al., 2003, 2001; Berkovitz et al., 2006b; Berkovitz et al., 2005; Vanderzwalmen et al., 2008).
Sin embargo, a pesar de estos estudios, la significación de estas vacuolas aún no está del todo clara. En otro estudio que comparaba la fecundidad de espermatozoides con vacuolas grandes frente a espermatozoides sin ellas o con vacuolas pequeñas, no fue posible establecer diferencias en las tasas de fecundidad o desarrollo a blastocisto entre los grupos analizados, así como tampoco determinar que dichas cifras fueran diferentes respecto a las obtenidas mediante una menos exhaustiva selección espermática por ICSI convencional (Tanaka et al., 2012). Sin embargo, muy posiblemente, el resultado de este estudio puede haberse visto afectado por el limitado número de muestras analizadas. Además, otro reciente estudio nos indica que la presencia de vacuolas no reduce las posibilidades de fecundidad, considerando esta como la tasa de recién nacido vivo, y que, en definitiva, su presencia no altera la calidad del esperma (Fortunato et al., 2015).
Una buena parte de la gran discrepancia existente podría venir del desconocimiento respecto a estas estructuras. Algunos autores consideran que las vacuolas son un indicio de la presencia de daño en el ADN espermático, lo cual influiría claramente en su capacidad fecundante (Bartoov et al., 2002). Estos argumentan dicho origen en que la inducción artificial de la reacción acrosómica no altera la presencia de estas vacuolas, las cuales continúan visibles en el núcleo. Además, con la observación de espermatozoides en diferentes estadios madurativos, llegan a la conclusión de que estas tienen su origen durante el proceso de maduración de los espermatozoides (Tanaka et al., 2012). Recientemente, una extensa revisión bibliográfica, ofrecida por Boitrelle y otros autores, concluye que estas vacuolas son de origen nuclear y que están conectadas con la presencia de fallos en la condensación de la cromatina, y correlacionadas, en algunos casos, con daños en el ADN presente en el esperma (Boitrelle et al., 2013).
Sin embargo, otros autores argumentan firmemente que el origen de las vacuolas es acrosomal. Entre este último grupo se encuentran Kacem et al. (2010), los cuales cuestionan que la posición de dichas vacuolas pueda ser establecida simplemente con el uso de un sistema MSOME de «tan solo» 6.600 aumentos. Entre los argumentos que exponen se encuentra el hecho de que, ya en estudios previos, se estableció que era necesario el uso de microscopia electrónica para la correcta identificación de estas estructuras, unos 20.000 aumentos (Zamboni, 1987), además de que la microscopia de óptica presenta limitaciones a la hora de observar estructuras intracitoplasmáticas. Estos autores consideran que las vacuolas se localizan mayoritariamente en la región anterior de la cabeza, relacionadas posicionalmente con el acrosoma, y que es poco probable que no exista relación entre ambas estructuras (Kacem et al., 2010). Además, establecen un sistema para detectar mediante fluorescencia aquellos espermatozoides que han concluido su reacción acrosómica, y comparan espermatozoides entre MSOME y microscopia electrónica. Con estos instrumentos lanzan la idea de que aquellos espermatozoides considerados en la bibliografía como «sin vacuolas» mediante el MSOME son en realidad espermatozoides que han concluido su reacción acrosómica y que están mejor preparados para llevar a cabo la fecundación, y su uso es la razón de que se mejoren las tasas de fecundación en estos trabajos (Kacem et al., 2010).
Finalmente, todos estos experimentos no están libres de críticas. Neyer et al. consideran que mediante métodos convencionales no es posible observar exactamente el mismo espermatozoide y que, por tanto, no se puede determinar si sus vacuolas desaparecen en realidad tras la inducción de la reacción acrosómica. Para solventar esto desarrollan un sistema de microcanales, los cuales permiten observar los mismos espermatozoides antes y después de ser sometidos a diferentes tratamientos (Neyer et al., 2013). Este novedoso sistema les permite aseverar que el origen de las vacuolas no puede achacarse a la manipulación en el laboratorio (por temperatura o por estrés oxidativo), ni que una completa reacción acrosómica genere la desaparición de las vacuolas. Su conclusión final es que, muy probablemente, el origen de las vacuolas pueda establecerse durante la espermiogénesis, al igual que indica el anterior grupo de autores (Tanaka et al., 2012); aunque dejan la puerta abierta a la de tesis de Toshimori, quien considera que no todas las vacuolas son iguales, y que las vacuolas de mayor tamaño son especialmente negativas para la viabilidad del embrión. Según este grupo, es necesario abrir, en primer término, el debate para definir claramente qué consideramos vacuolas «negativas», para, posteriormente, establecer las implicaciones en la capacidad fecundante de los espermatozoides que las poseen (Toshimori, 2009). En la misma línea encontramos el trabajo de Oliveira et al. (2010), quienes lograron correlacionar la existencia de grandes vacuolas con una mayor fragmentación en el ADN espermático, correlación esta que es menos clara con las vacuolas de tamaño reducido (fig. 2C).
Aplicación práctica de los nuevos sistemas de imagenExiste escasa discusión sobre el hecho de que una correcta selección del espermatozoide mejora los resultados durante los procesos de microinyección convencionales (de Vos et al., 2003; Kahraman et al., 1999; Miller y Smith, 2001); sin embargo, existe alta controversia sobre el uso de nuevas tecnologías que permitan la observación más minuciosa del gameto, lo que, a priori, debería mejorar dicha selección.
La principal desventaja que alegan los autores para la aplicación de estas técnicas en general, y de la técnica de IMSI en particular, es la gran cantidad de tiempo que implica su uso (Antinori et al., 2008). Durante el IMSI, por ejemplo, en primer lugar es necesario aislar el espermatozoide en una zona alejada del resto, para evaluar después su morfología y decidir si es válido o no. Además, en el punto de la evaluación encontramos un escollo que durante las técnicas de ICSI no nos planteamos, y que consiste en elegir qué debemos evaluar. Como indicamos antes, existe un amplio debate sobre qué elementos se deben evaluar durante las técnicas de microinyección con microscopios de gran aumento, y, aun con los avances logrados, no estamos seguros de qué estructuras debemos considerar anómalas y cuáles no. Como hemos destacado anteriormente, algunos estudios han pretendido introducir algunas bases para la evaluación rutinaria de la forma de la cabeza durante los procesos de IMSI (Oliveira et al., 2010; Utsuno et al., 2013).
En cualquier caso, a pesar de las evidentes desventajas, en la bibliografía encontramos diferentes estudios que intentan evaluar la conveniencia del uso de estas nuevas técnicas, principalmente durante la selección espermática (pueden consultarse algunas revisiones al respecto (Ebner et al., 2014; Boitrelle et al., 2014; Setti et al., 2013; Souza Setti et al., 2010). Estos estudios se centran, sobre todo, en aquellos casos en los que existen sucesivos fallos de ICSI previos, o bien alteraciones severas en los recuentos espermáticos (oligoastenoteratozoospermia). También hay estudios que intentan evaluar la utilidad de estas técnicas en parejas que no han entrado en ciclos de FIV previos, como una alternativa en aquellos países con limitaciones legales en la generación de embriones para transferir.
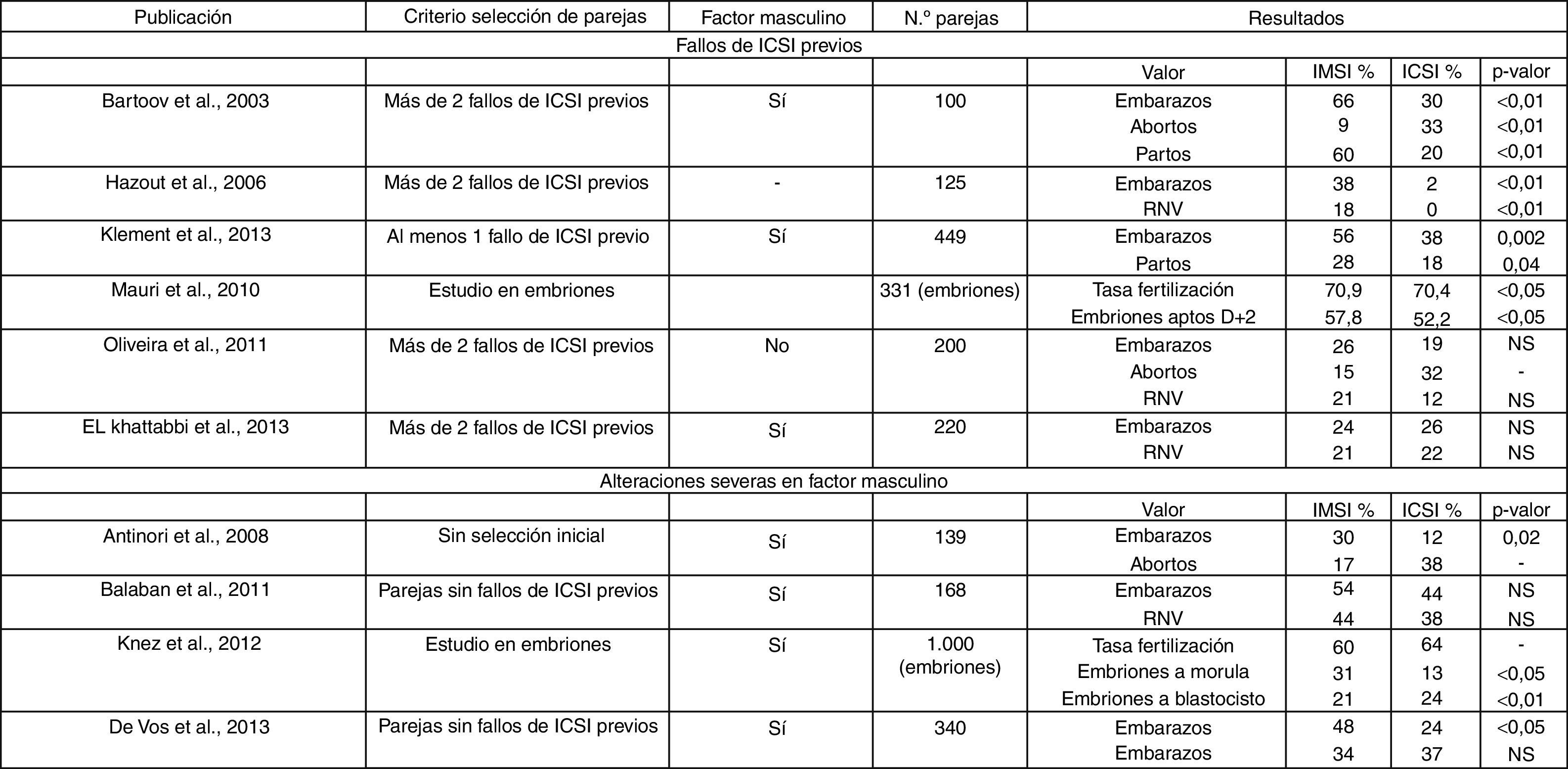
Sin embargo, el uso de IMSI frente a las técnicas ICSI convencionales resulta para algunos autores beneficiosa, mientras que para otros no supone una ventaja clara (El Khattabi et al., 2013; Mauri et al., 2010; Oliveira et al., 2010), aunque estos trabajos presentan algunas discrepancias estadísticas (Tabla 1). Por ejemplo, El Khattabi considera que se mejoran algo los resultados sobre pacientes afectados por teratozoospermia, pero no en la población general (El Khattabi et al., 2013). Mauri, en cambio, solo considera que existe un similar desarrollo de embriones obtenidos mediante ambas técnicas hasta día +2, sin analizar los desarrollos posteriores (Mauri et al., 2010). Esto supone una clara limitación para el trabajo, ya que actualmente se considera que el desarrollo embrionario durante los primeros días se encuentra guiado principalmente por el material genético contenido en el ovocito, sin que afecte el supuesto ADN dañado del espermatozoide (Berger et al., 2011; de Almeida Ferreira Braga et al., 2011; Tesarik, 2005), lo que explica que embriones de estadio de 4–8 células afectados con graves alteraciones cromosómicas tengan un aspecto morfológico normal.
Los primeros estudios en los que se planteaba el uso de la tecnología MSOME durante los procesos de microinyección (IMSI), se centraban en su aplicación en parejas que habían sufrido más de 2 fallos de ICSI (Bartoov et al., 2003; Hazout et al., 2006). Estas parejas son consideradas como de muy mal pronóstico, ya que tras 2 fallos de ICSI las posibilidades de que logren concebir en un siguiente intento son extremadamente bajas (Stolwijk et al., 2000) y son, en muchos casos, derivadas a ciclos de ovodonación. Sin embargo, en ambos estudios, los resultados fueron altamente satisfactorios, con duplicación de las tasas de embarazo frente a la técnica de ICSI convencional (30 vs. 66%) (Bartoov et al., 2003), o con mejora clara del pronóstico de estas parejas con unas tasas de recién nacidos vivos de alrededor del 18% (vs. 0% en el fallo de ICSI previo) (Hazout et al., 2006) (Tabla 1). Ambos estudios son bastantes concluyentes, si bien estábamos ante parejas con escasas posibilidades de éxito a priori, ante lo cual cualquier ayuda en sus ciclos, aunque tan solo fuera un aumento en los tiempos de selección del gameto adecuado, podría resultar positivo. De hecho, en el primer trabajo nos encontramos con que el grupo al que se le aplicó ICSI convencional logró un sorprendente 30% en la tasa de embarazo (Bartoov et al., 2003), un porcentaje bastante alto para ser parejas con más de 2 fallos de ICSI previos. Los autores achacan este resultado a un diagnóstico incompleto, y tal vez pesimista, de las parejas masculinas introducidas en el estudio; aunque también podría ser achacable a un mayor cuidado en la selección espermática al estar siendo esta evaluada a través de un estudio científico. Adicionalmente, Oliveira presentó un estudio en el que detectó que la aplicación de IMSI en este tipo de parejas permitía obtener unas tasas de embarazo mayores y unas tasas de abortos menores (Oliveira et al., 2011); sin embargo, debido al bajo número de parejas analizadas, los resultados no pudieron considerarse significativos (Tabla 1).
A estos estudios podemos sumar el trabajo más reciente de Klement et al., en el que observan claramente una mejora en las tasas de embarazos mediante el uso del IMSI en parejas incluso con tan solo un fallo de ICSI previo; sin embargo, en sus estudios también observan que el pronóstico para aquellas parejas que no consiguen embarazo tras aplicarles IMSI resulta extremadamente negativo (Klement et al., 2013) (Tabla 1).
No obstante, las parejas que más se podrían beneficiar de estas técnicas son aquellas afectadas por alteraciones severas en el factor masculino. En una situación con un limitado número de espermatozoides, o con una alta incidencia de malformaciones en estos, una mejor selección espermática puede suponer una evidente ventaja y, a priori, una mejora en los resultados. Antinori et al. realizaron un amplio estudio en el que compararon los resultados de aplicar estas técnicas en grupos de pacientes afectados por oligoastenoteratozoospermia, en un principio sin tener en cuenta el número de fallos de ICSI previos y posteriormente considerando tan solo aquellos que habían presentado más de 2 fallos previos de ICSI (Antinori et al., 2008). En primer lugar, realizaron un estudio piloto para evaluar cuál era el número mínimo de parejas que debían analizar para obtener unas cifras estadísticamente significativas.
Realizaron, por tanto, el estudio con un total de 446 parejas, afectadas por factor masculino (oligoastenoteratozoospermia) exclusivamente, con al menos 3 años de esterilidad y con parejas femeninas de menos de 35 años. Posteriormente, dividieron las parejas en 2 grupos, y aplicaron a uno de ellos ICSI y al otro IMSI. De este modo, observaron un ligero aumento en las tasas de embarazo en aquellas parejas a las que se aplicó la técnica IMSI frente a las que se realizó ICSI convencional. Además, constataron un incremento en las tasas de embarazo e implantación en todos los subgrupos de IMSI, pero especialmente en aquellas parejas que habían tenido 2 o más fallos de ICSI, en concordancia con otros estudios anteriores (Bartoov et al., 2003; Berkovitz et al., 2006a; Berkovitz et al., 2006b; Berkovitz et al., 2005; Hazout et al., 2006) (Tabla 1). Sin embargo, en este trabajo tan solo se microinyectan 3 ovocitos por pareja, debido a que el número de embriones máximo que se pueden obtener en cada ciclo se encontraba restringido por la ley italiana. Si bien es cierto que en todo estudio científico se deben instaurar unas reglas previas, que incluyen el establecer un mismo número de ovocitos fecundados para cada una de las parejas del estudio, el limitado número de embriones obtenidos por dicha restricción pudo reducir claramente las posibilidades de transferencia de embriones de buen aspecto y, con ello, generar un sesgo negativo en los resultados de ICSI mostrados. Esto que, en definitiva, podría ser un lastre para el estudio, no le resta utilidad en escenarios legales restrictivos similares a los planteados, pero resulta incierto en situaciones como la española donde la obtención de embriones no se encuentra limitada. En nuestro país, la posibilidad de seleccionar entre mayor número de embriones tal vez podría haber mejorado las tasas de embarazo-implantación de las parejas tratadas mediante ICSI convencional, igualándolas, al menos en parte, a las obtenidas por las parejas sometidas al IMSI.
Por otro lado, los mismos autores plantean que las diferencias entre la aplicación de ambas técnicas no fueron estadísticamente significativas teniendo en cuenta tan solo a las parejas sin fallos previos de ICSI, posiblemente por el bajo número de casos analizados. En este sentido, puede ser útil el estudio planteado por Balaban et al. (2011), en el que intentan analizar si el uso de IMSI puede ayudar a pacientes que generalmente acuden a técnicas de FIV, es decir, si resultaría útil la aplicación de esta técnica en sustitución directa de la ICSI convencional, un escenario similar al planteado con las parejas sin fallos previos de ICSI del estudio de Antinori. Comenzaron el estudio con 181 pacientes, divididos directamente en 2 grupos (uno para ICSI y otro para IMSI), sin plantearse si habían sufrido fallos previos ni el tipo de dolencias que padecían (factor femenino, masculino o mixto). Posteriormente, durante el análisis estadístico, sí consideraron que aproximadamente la mitad de las parejas a las que se les aplicó cada técnica sufrían alteraciones del factor masculino y que, en definitiva, eran estas las más beneficiadas por el uso de IMSI. Respecto a las parejas con otras dolencias, las tasas de implantación-embarazo fueron algo mayores en el grupo de IMSI, si bien las diferencias no pudieron considerarse estadísticamente significativas (Tabla 1); un resultado similar al obtenido más recientemente por de Vos et al. (2013), que aseveran que el IMSI no debería aplicarse de rutina en parejas sin fallos previos. Todas estas conclusiones hacen plantearnos la conveniencia de emplear IMSI como técnica de rutina, si bien, sí que podría ser de utilidad en casos de alteraciones severas del factor masculino. En estos casos la inyección de ovocitos con espermatozoides alterados puede llevarnos a obtener un número bastante alto de embriones, pero estos, muy probablemente, tendrán una escasa calidad y, al final, no serán transferidos; sin embargo, la aplicación de una selección más exhaustiva con IMSI, aunque más lenta, podría generarnos menos embriones, pero de una mayor calidad y con más posibilidades de éxito.
Knez et al. (2012) nos plantean un escenario similar, tomando en cuenta parejas con teratozoospermia y centrándose exclusivamente en la evaluación de un gran número de embriones, alrededor de 1.000. Su estudio fue doble. Por un lado, compararon las tasas de embriones que llegaban a estadio de mórula entre 2 grupos estadísticamente similares, pero a los que se les aplicaba ICSI o IMSI, respectivamente. En este caso, aunque no observaron diferencias apreciables en las tasas de fecundación, sí que comprobaron como aquellos embriones obtenidos por IMSI tenían menores tasas de detención, sobre todo en estadios tempranos (Tabla 1). Por otro lado, comprobaron como la selección y posterior inyección de espermatozoides de peor calidad (con más de 2 pequeñas vacuolas o, al menos, una de gran tamaño, ambas con una supuesta peor integridad en el ADN, fig. 3C) suponía defectos en el desarrollo embrionario, en estadios muy tempranos (a nivel de pronúcleos) y en el desarrollo de blastocisto. Estos embriones sufrían, además, cierto retraso madurativo y mayores tasas de bloqueo embrionario, lo que podría considerarse una evidencia práctica de que la presencia de grandes vacuolas puede correlacionarse con mayor fragmentación en el ADN. A pesar de que de Vos et al. (2013) cuantifican la prevalencia de espermatozoides con vacuolas en apenas el 27,5% en muestras seminales normales, lo que, según estos mismos autores, supone una baja probabilidad de elegir un espermatozoide afectado durante una técnica de ICSI convencional, no es posible negar que una mejor selección espermática en las técnicas de microinyección es una garantía de éxito y, en este caso, el uso de una mayor magnificación permite observar la presencia de anomalías, principalmente vacuolas, que en técnicas de ICSI convencionales son imposibles de detectar.
DiscusiónLas técnicas de inyección citoplasmática de espermatozoides hicieron su aparición hace apenas 25 años: fueron desde un principio una revolución en los tratamientos de reproducción asistida (Palermo et al., 1992). Desarrolladas en sus inicios como una técnica para tratar problemas de obstrucción en las trompas, actualmente se consideran la primera opción cuando una pareja es derivada hacia un ciclo de FIV, gracias a sus altas posibilidades de éxito (Palermo et al., 2000). Sin embargo, estas técnicas se encuentran lejos de ser infalibles, lo que deja margen para el estudio y aplicación de nuevas tecnologías de imagen en su despliegue.
En el presente trabajo hemos realizado una exhaustiva recopilación bibliográfica que nos permite evaluar las posibilidades que nos brindan estas nuevas tecnologías. Evidentemente, como toda nueva técnica tiene sus pros y sus contras, y difícilmente se puede encontrar una tecnología que sea aplicable por igual a todas las parejas.
El sistema oosight podría tener un gran potencial durante el desarrollo del ICSI. Tener la capacidad de observar el estado madurativo del ovocito y localizar perfectamente sus estructuras internas (sobre todo el huso meiótico) puede suponer una ventaja a la hora de obtener un embrión viable (fig. 1). Sin embargo, su aplicación práctica estaría limitada a evitar dañar el ovocito durante el desarrollo de la técnica, en aquellos casos en los que el huso puede encontrarse desplazado de su posición normal (junto al primer corpúsculo polar), como puede ser en ovocitos procedentes de ciclos de congelación-descongelación, en determinados protocolos de estimulación o en mujeres de edad avanzada (Ganesh et al., 2010; Sereni et al., 2009). Esto es así ya que la selección de ovocitos no tiene demasiado sentido, dado que su número durante los ciclos de TRA suele ser bastante limitado.
Por otro lado, el desarrollo del IMSI supone, a priori, un buen avance dentro de la FIV. Con la técnica ICSI se trabaja a una magnificación relativamente baja, la cual es muy práctica para la manipulación de los gametos, pero que resulta claramente insuficiente a la hora de realizar una selección exhaustiva de los espermatozoides válidos para la inyección. A estos aumentos, la mayoría de las estructuras subcelulares permanecen ocultas (fig. 3), realizándose, la mayoría de veces, una selección mínima, basada exclusivamente en que el espermatozoide conserva una movilidad correcta o en que tiene un aspecto relativamente normal. Sin embargo, con la capacidad de aumento del sistema MSOME (Bartoov et al., 2003), sí que es posible observar las estructuras celulares, principalmente vacuolas, lo que a priori debería mejorar la capacidad de selección, e incluso detectar anormalidades que de otro modo quedarían ocultas (Oliveira et al., 2009).
Pero tanta capacidad de aumentos ¿resulta práctica? En principio parece que no: el trabajo con estos aumentos supone una minuciosa selección de los espermatozoides y su aislamiento individual, lo que implica consumir demasiado tiempo en el proceso. A continuación, se microinyectan de un modo similar a la técnica de ICSI convencional, pero, en cualquier caso, la aplicación del IMSI puede retrasar el trabajo rutinario del laboratorio y, con ello, puede surgir la necesidad de adquirir un segundo equipo de microinyección o un mayor gasto en personal.
Esta inversión deshabilita el uso del IMSI de manera rutinaria, y limita su aplicación a algunas parejas concretas, como aquellas afectadas por deficiencias severas en el factor masculino (Balaban et al., 2011). En estos casos, se podrían estar seleccionando espermatozoides con anormalidades ocultas, y esta elección deficiente de gametos para la inyección podría llevarnos a obtener una cohorte de embriones de baja calidad, lo que en definitiva podría generar un fallo de implantación. Tal vez, en estos casos, sería preferible alargar sensiblemente el proceso, con la obtención de un número algo más limitado de embriones, pero de visiblemente mejor calidad (Knez et al., 2012).
Por otro lado, podríamos considerar que el mantenimiento de embriones no supone gasto, pero esto no es del todo cierto. Mantener embriones que finalmente no van a prosperar o que tienen pocas posibilidades de hacerlo puede suponer bastantes miles de euros de pérdidas a lo largo del año, en incubadores, medios de cultivo, etc. Debemos, por tanto, poner en una balanza si queremos invertir más tiempo en la selección espermática y en personal, o si elegimos obtener y cuidar el máximo de embriones posible para posteriormente seleccionarlos. Esto solo podemos planteárnoslo en países donde la ley de reproducción asistida es suficientemente permisiva. En países donde el número máximo de embriones que se pueden obtener por ciclo y paciente está estrictamente limitado, la nueva tecnología de IMSI cobra más sentido.
En otro escenario se encuentran parejas que ya han sufrido sucesivos fallos de ICSI. Las razones de estos fallos pueden ser varias, aunque un gran número de ellos se debe a la presencia de una baja calidad espermática (una combinación de espermatozoides con formas anómalas o alto grado de fragmentación en su ADN, con la presencia de vacuolas), unido muchas veces a la obtención de un bajo número de ovocitos en estado madurativo óptimo. A priori, muchos de estos problemas podrían solucionarse con el uso del oosight, o con una selección de espermatozoides más exhaustiva, con detección de la presencia de vacuolas o formas sutilmente anómalas, sobre todo en la cabeza (Bartoov et al., 2003; Berkovitz et al., 2006a; Berkovitz et al., 2006b; Berkovitz et al., 2005; Hazout et al., 2006; Klement et al., 2013).
En conclusión, las nuevas tecnologías aplicadas a las TRA deben ser evaluadas con cautela. Los escasos trabajos clínicos encontrados en los que aplican el PolScope sobre grupos de pacientes hacen pensar que el principal sentido práctico del oosight se limita a evitar el daño al ovocito. Por otro lado, según los estudios realizados, el avance de la técnica de IMSI es capaz de mejorar los resultados en TRA, si bien, su mayor potencial se alcanza únicamente en algunos casos en los que una mejor selección espermática resulta crucial. Y es en estas situaciones, que se escapan de la norma, en las que cualquier ayuda extra puede ser positiva. Así, estamos de acuerdo con otros autores que abogan por presentar el IMSI a pacientes que ya hayan sufrido al menos 2 fallos de ICSI, o que posean un alto porcentaje de fragmentación de ADN espermático, pero nunca establecerlo como rutina (Ebner et al., 2014).
Otro asunto es el hecho de si estamos seleccionando correctamente los gametos durante estos procesos. A pesar de todos nuestros esfuerzos, aún nos queda muchísimo por aprender acerca de nuestro proceso reproductivo: no sabemos a ciencia cierta qué significación biológica tiene la presencia de vacuolas en nuestro esperma, o cuál es el límite funcional en una forma anómala de un espermatozoide, o por qué se producen desplazamientos del huso meiótico en el ovocito frente a determinados procesos. El despejar estos interrogantes puede resultar secundario en la aplicación diaria de la técnica ICSI, cuando simplemente priorizamos los resultados, pero puede ser crucial en determinados casos aislados, como en parejas con fallos recurrentes de ICSI, en los que existe cierto grado de teratozoospermia oculta bajo la escasa magnificación de nuestros instrumentos rutinarios. Y, por supuesto, el desconocimiento de estos interrogantes limita enormemente las capacidades de unas técnicas cuyo éxito se basa justamente en tener estos conceptos totalmente claros.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl siguiente artículo no ha recibido financiación específica de ninguna institución y se ha realizado dentro de las actividades académicas establecidas en el Máster Universitario en Medicina y Genética Reproductivas a través de la Facultad de Medicina de la Universidad Miguel Hernández de Elche.
Los autores quieren agradecer la colaboración en la revisión del siguiente artículo a los Dres. José Jesús López Gálvez y Joaquín Rueda Puente, directores de la Cátedra de Biomedicina Reproductiva Clínica Vistahermosa-Universidad Miguel Hernández.