La azoospermia y la criptozoospermia son enfermedades relativamente comunes entre los varones, teniendo que recurrir a tratamientos de reproducción asistida (TRA) si desean tener descendencia. En este trabajo se valoró el comportamiento cinético y la morfología embrionaria en los primeros días de desarrollo en función de si la muestra seminal empleada era normal o procedente de varones azoospérmicos y criptozoospérmicos.
Material y métodosSe analizaron retrospectivamente 396 TRA, 40 procedentes de varones criptozoospérmicos, 17 de varones con azoospermia obstructiva y, el resto, de normozoospérmicos (según los criterios de la OMS, 2010). Las pacientes presentaron una respuesta ovárica normal y, para evitar el efecto de la edad materna, se incluyeron solo menores de 38 años. En todos los casos los ovocitos fueron fecundados mediante microinyección intracitoplasmática de espermatozoides (ICSI) y la calidad embrionaria establecida según los criterios de ASEBIR (The Istanbul consensus workshop on embryo assessment, 2011).
ResultadosLa tasa de fecundación fue inferior cuando empleamos espermatozoides testiculares (aunque no significativa) y no hubo diferencias con espermatozoides de varones criptozoospérmicos. No se observaron variaciones significativas en la velocidad de división embrionaria. Respecto a la calidad embrionaria en el día 2, encontramos resultados comparables entre varones azoospérmicos y normozoospérmicos, mientras que esta disminuyó en el grupo de criptozoospérmicos (mayor porcentaje de embriones tipo C). Sin embargo, los resultados encontrados en el día 3 fueron similares entre los distintos grupos. Respecto a los datos clínicos, no se encontraron diferencias significativas en cuanto a las tasas de embarazo clínico y aborto del primer trimestre.
DiscusiónEl empleo de muestras seminales criptozoospérmicas, afectó a la calidad embrionaria tras ICSI. Por el contrario, los resultados fueron comparables entre los grupos de varones normozoospérmicos y con azoospermia obstructiva.
Azoospermia and cryptozoospermia are relatively common diseases among men, who may have to resort to assisted reproduction if they wish to have children. In this work, an assessment is made of the kinetic behavior and morphology in the early days of embryo development as regards whether the semen sample is normal, azoospermic or cryptozoospermic.
Material and methodsA retrospective analysis was performed on 396 treatments, which included 40 cryptozoospermic males, 17 obstructive azoospermic males, and the remainder normozoospermic (according to the criteria of the WHO, 2010). Patients had normal ovarian response and to avoid the effect of maternal age, only women under 38 years old were included. In all cases, the oocytes were fertilized by intracytoplasmic sperm injection (ICSI) and embryo quality as defined by the ASEBIR criteria (The Istanbul consensus workshop on embryo assessment, 2011).
ResultsFertilization rate was lower when testicular sperm was used (although not significant) and there were no differences in cryptozoospermic males. No significant changes were observed in the rate of embryo cleavage. As regards embryo quality in day 2, results are comparable between normozoospermic and azoospermic group, while it decreased in the cryptozoospermic group (the percentage of embryos type C was higher). However, the results found in day 3 were similar between groups. Clinically, there were no significant differences in pregnancy rates or miscarriage.
DiscussionThe use of cryptozoospermic seminal samples affects the embryo quality after ICSI. On the other hand, the results were comparable between the groups of normozoospermic males and obstructive azoospermia.
Comprender el desarrollo embrionario previo al proceso de implantación tiene importantes implicaciones para la evolución y mejora de las técnicas de reproducción asistida (TRA). A pesar de los estudios publicados, los mecanismos celulares y moleculares que gobiernan durante este estadio precoz del desarrollo humano apenas se conocen.
Tras la interacción de ambos gametos se suceden una serie de complejos y dinámicos eventos que llevan a la fecundación y formación del cigoto. Cuando el espermatozoide penetra, el centrosoma de uno de los 2 gametos sufre una reducción de su expresión génica para evitar las divisiones anormales del embrión. En la mayoría de las especies el gameto masculino es el que tiene el centrosoma funcional (Manandhar et al., 2005, Palermo et al., 1997, Schatten y Sun, 2009).
Transcurridas 16-20h desde la microinyección intracitoplasmática de espermatozoides (ICSI), la fecundación se valora mediante la observación del número de pronúcleos (PN) y corpúsculos polares (CP). La presencia de 2 PN y 2 CP es considerada como una fecundación normal, fundamental a la hora de determinar la ploidía en conjunto (Papale et al., 2012, Rienzi et al., 2005). Los embriones de gran calidad deben tener una sincronía, simetría y cinética apropiadas en la división. Por el contrario, los que se dividen demasiado lento o demasiado rápido pueden presentar defectos cromosómicos y/o metabólicos que pueden comprometer el desarrollo del embrión (Prados et al., 2012, Rienzi et al., 2005).
En estos estadios tempranos los criterios empleados para valorar la calidad embrionaria están establecidos y ampliamente descritos en los criterios ASEBIR (The Istanbul consensus workshop on embryo assessment, 2011). En líneas generales, el embrión tiene que tener una fragmentación menor al 10% del volumen total, un citoplasma homogéneo, las divisiones han de ser simétricas para que las blastómeras hereden el mismo material genético y tienen que tener un solo núcleo cada una de ellas (Borini et al., 2005, Prados et al., 2012, Rienzi et al., 2005). Recientemente, el empleo de time-lapse en los laboratorios de FIV nos permite estudiar otros parámetros cinéticos que determinan la calidad embrionaria (Armstrong et al., 2015, Herrero et al., 2013), aunque su utilidad clínica está lejos de haberse demostrado (Armstrong et al., 2015).
Se estima que el 15% de las parejas sufren problemas de infertilidad (American Society for Reproductive Medicine, 2015, Jungwirth et al., 2012, Ray et al., 2012). Una de las causas por factor masculino es la azoospermia que, en algunos casos, no implica necesariamente la esterilidad, porque muchos hombres pueden mantener la producción de espermatozoides a diferentes niveles dentro de los testículos sin que se emitan en el eyaculado (Esteves et al., 2011, Esteves y Agarwal, 2013, Hourvitz et al., 1998, Van Wely et al., 2015). Otra de las causas son las muestras seminales criptozoospérmicas (<100.000spz/ml), ya que la probabilidad de alcanzar el gameto femenino de forma natural disminuye. Los espermatozoides procedentes de este tipo de muestras se encuentran estructuralmente dañados y, por ello, pueden dar lugar a desarrollos embrionarios no óptimos (American Society for Reproductive Medicine, 2015, Verza y Esteves, 2008).
Los pacientes con factor masculino severo deben someterse a TRA para poder tener descendencia (Van Wely et al., 2015). La obtención de espermatozoides en casos de varones azoospérmicos se realiza directamente del testículo, empleando la punción aspiración con aguja fina (PAAF) o la biopsia; mientras que la de varones criptozoospérmicos se realiza a partir del eyaculado (Esteves y Agarwal, 2013, Esteves et al., 2013, Van Wely et al., 2015). Los espermatozoides procedentes de estas muestras seminales pueden encontrarse estructuralmente dañados y, por lo tanto, tener una repercusión negativa en el desarrollo morfológico del embrión (Aboulghar et al., 1997, Tavmergen et al., 2002, Van Wely et al., 2015, Verza y Esteves, 2008).
El objetivo de este trabajo es valorar el comportamiento cinético y la morfología embrionaria en los 3 primeros días de desarrollo en embriones generados a partir de espermatozoides de varones criptozoospérmicos y azoospérmicos obstructivos frente a los de varones normozoospérmicos, Para ello nos basamos en la hipótesis de que los embriones fruto de la fecundación de un ovocito por un espermatozoide procedente de una muestra seminal de concentración muy disminuida y/o testicular, no evolucionarán de forma óptima debido a alteraciones estructurales del gameto masculino no necesariamente detectables en la morfología de los mismos.
Material y métodosPoblación de estudioEstudio retrospectivo basado en 2 grupos de estudio, el primero constituido por 40 parejas con dificultades reproductivas asociadas a factor masculino por criptozoospermia que realizaron 40 ciclos ICSI (34 de ellas con ovocito propio y 6 con ovocito procedente de ovodonación) y el segundo que incluyó 17 ciclos realizados empleando espermatozoides de varones con azoospermia obstructiva tras PAAF. El periodo de estudio fue desde enero de 2012 a diciembre de 2013. El trabajo se realizó en el Instituto Bernabeu de Alicante, España.
Para la clasificación de las muestras seminales criptozoospérmicas se siguieron los criterios establecidos por la OMS en 2010, es decir, una concentración espermática inferior a 100.000 espermatozoides/ml. Con ovocitos propios se excluyeron pacientes de 38 años en adelante con el fin de evitar la influencia del factor edad. Por su parte, en los ciclos de ovocito donado las donantes fueron seleccionadas según los criterios de nuestro programa de ovodonación. Las receptoras presentaron endometrios adecuados en el momento de la transferencia embrionaria. Las transferencias fueron realizadas en el tercer día de desarrollo embrionario.
Así mismo, se realizaron 2 controles positivos: uno para el grupo de criptozoospermia que agrupó 299 tratamientos de reproducción asistida (89 de ellos procedentes de ovocito propio y 210 procedentes de ovodonación) y otro para el grupo de azoospermia constituido por 40 ciclos. En ambos grupos el factor femenino mantuvo las mismas condiciones que su respectivo grupo de estudio y los varones presentaron normozoospermia según los criterios de la OMS (2010).
Estimulación ovárica y recogida ovocitariaLas pacientes fueron estimuladas mediante 2 protocolos convencionales: protocolo largo o protocolo corto con antagonistas.
La estimulación ovárica de las pacientes con ovocito propio se realizó de una forma individualizada y atendiendo a las características fisiológicas de cada una de ellas. De forma predominante llevaron un protocolo largo con agonistas de la GnRH. Esta estimulación se inicia en la fase lútea del ciclo previo (día 21 del ciclo) con la administración del agonista acetato de leuprolide (Procrin; Abbott, Madrid, España). A los 10 días se evalúa la supresión ovárica por medio de ecografía. Una vez que se confirma la supresión hipofisaria se comienza con la aplicación de las gonadotropinas (FSH urinaria y/o recombinante y/o HMG) hasta alcanzar los criterios de administración de la hCG recombinante (Ovitrelle, Merck-Serono, Madrid).
Por otra parte, el protocolo empleado en donantes de ovocitos es el realizado con antagonistas, el cual comienza alrededor del día 2-3 del ciclo con FSH urinaria (150-225UI/d, Fostipur, Angelini, Barcelona), tras ecografía basal de control para confirmar idoneidad de los ovarios e individualizando dosis, en función de las características clínicas y la respuesta a la medicación. El antagonista de la GnRH, cetrorelix 0,25mg/día (Cetrotide, Merck-Serono, Madrid), es aportado en dosis múltiples según un protocolo flexible hasta el día de administración de agonistas de la GnRH (0,4mg de Decapeptyl, Ipsen Pharma, Barcelona).
Los ovocitos fueron aspirados 36h tras la administración de hCG/agonistas por medio de punción folicular transvaginal con guía ecográfica bajo sedación. Tras la obtención, todos los complejos ovocito-corona-cúmulo fueron lavados empleando un tampón (G-Mops plus; Vitrolife) y posteriormente incubados en Fertilization Medium (FM, Cook Medical, Irlanda) al menos durante 1h a 37°C en atmósfera con un 6% de CO2. La eliminación del cúmulo y la corona radiata que rodean al ovocito se realizó mediante una breve exposición a 80UI/ml de hialuronidasa (Hyase; SAGE) seguida de una suave aspiración mediante pipeta para eliminar los posibles restos.
Recogida y procesamiento de las muestras seminalesLas muestras seminales fueron capacitadas atendiendo a la calidad, volumen y concentración de las mismas según diferentes técnicas que permiten posteriormente una manipulación correcta y resultados más satisfactorios.
Aquellas muestras con una concentración de espermatozoides por mililitro elevada y una motilidad normal fueron sometidas a la técnica de gradientes de densidad. Dichas muestras fueron procesadas empleando un gradiente discontinuo generado usando PureSperm (Nidacom International AB; Goteborg, Suecia). Después se centrifugó a 1.300rpm durante 15-20min, el pellet fue lavado con medio tamponado (Gamete buffer; Cook Medical, Irlanda) y resuspendido en Fertilization Medium (FM, Cook Medical, Irlanda). Con las muestras seminales de peor calidad se realizó la técnica de swim-up para obtener espermatozoides móviles. Las muestras se suspendieron en el medio espermático Gamete (Cook Medical) y se centrifugó a 1.600rpm durante 10min, se retiró el sobrenadante y se añadió al pellet Fertilization Medium (FM; Cook Medical, Irlanda).
Las muestras del grupo de estudio de azoospermia fueron extraídas directamente de testículo mediante PAAF el mismo día de la recogida ovocitaria. Esta técnica consiste en la inserción de una aguja fina a través del escroto para extraer los túbulos seminíferos; el parénquima testicular es aspirado por la creación de presión negativa al tirar del émbolo mientras la punta de la aguja se mueve dentro y fuera. La muestra se procesa en el laboratorio de FIV (Esteves et al., 2011, Esteves y Agarwal, 2013) usando agujas hipodérmicas unidas a jeringas de insulina. El contenido de la placa fue transferido a un tubo cónico (Nunc, Dinamarca) y centrifugado a 1.100rpm durante 5min. El pellet fue diluido y diseminado en una placa para ICSI (Falcon).
Por su parte, las muestras del grupo de criptozoospermia fueron procesadas empleando el método de concentrado en el cual la muestra se suspende en 3ml de Gamete Buffer (Cook Medical) y es centrifugada a 1.100rpm durante 5min. Posteriormente, el sobrenadante es retirado y se adiciona al pellet Fertilization Medium (FM; Cook Medical, Irlanda).
Procedimiento de microinyección intracitoplasmática de espermatozoidesLa ICSI fue llevada a cabo entre 4 y 5h después de la recogida ovocitaria en una superficie calefactada a 37°C, en un microscopio invertido (Nikon Eclipse TE2000S, Japón) equipado con modulación óptica Hoffman y sistema de micromanipulación Narishige (Narishige, Japón). La ICSI se llevó a cabo mediante protocolo convencional (Palermo et al., 1994, Van Steirteghem et al., 1993).
Evaluación de la fecundación y desarrollo embrionarioLa fecundación fue evaluada después de 16-18h tras ICSI. Los ovocitos que presentaron 2 pronúcleos y 2 corpúsculos polares fueron considerados como fecundados y se cultivaron en gotas de 30μl de Cleavage Medium (CM, Cook Medical, Irlanda) cubiertas con aceite mineral estéril (SAGE; EE. UU.) e incubados a 37°C en atmósfera con un 6% de CO2.
Pasadas 40-44h desde la fecundación, los embriones fueron evaluados a través de su visualización en microscopio invertido sobre placa calefactora. De nuevo tras 67-71h, los embriones son visualizados con el fin de realizar un control del desarrollo de los mismos. Toda la información que se extrae de estas observaciones: número de células, porcentaje de fragmentación, asimetría de las células, presencia de vacuolas, multinucleación y posible bloqueo de los embriones se registra rigurosamente para establecer, posteriormente, la clasificación de dichos embriones siguiendo los criterios de ASEBIR (The Istanbul consensus workshop on embryo assessment, 2011) donde se agrupa a los embriones en 4 categorías: A, B, C y D siendo A la mejor categoría y D la de peor pronóstico.
Transferencia y criopreservación embrionariasTras la evaluación de la calidad de los embriones existentes, aquel o aquellos con una morfología adecuada son transferidos al útero materno. Una ecografía abdominal permite conocer la posición del útero, la angulación del canal cervical, la longitud de la cavidad endometrial y las características del endometrio. El/los embriones son cargados en un catéter flexible (Rocket Medical, UK) y transferidos al útero materno, todo bajo control ecográfico.
Los embriones de buena calidad que no han sido transferidos son criopreservados mediante la técnica de vitrificación empleando el protocolo Irvine Scientific (EE. UU.) y dispositivos cerrados (HSS, CBS, Francia).
Parámetros de estudioA continuación se detallan los parámetros que han sido evaluados en este estudio:
- -
Edad materna.
- -
Edad paterna.
- -
Porcentaje de fecundación.
- -
Número de cigotos que se dividen.
- -
Número de embriones evolutivos hasta el día 3.
- -
Número de embriones transferidos y criopreservados.
- -
Número medio de células en el día 2.
- -
Calidad embrionaria en los días 2 y 3 de desarrollo (según criterios ASEBIR, 2011).
- -
Número medio de embriones criopreservados.
- -
Porcentaje de embarazo clínico (considerado tras visualización ecográfica de saco tras 6 semanas de gestación).
- -
Aborto clínico (pérdida de la gestación tras visualización ecográfica de saco).
La descripción de las variables cuantitativas se realizó mediante la media y la desviación estándar. El análisis univariante entre grupos se realizó mediante análisis Chi-cuadrado (para variables categóricas) o test de Kruskal-Wallis cuando no estaba asegurada la normalidad y «t» de Student para grupos independientes, cuando estaba asegurada la normalidad en variables cuantitativas.
La valoración de la relación de los grupos con la variable dependiente se realizó gracias a una regresión lineal para variables cuantitativas y una regresión logística binaria para variables categóricas ajustando a posibles variables de confusión.
El estudio fue realizado considerando el nivel estadístico como p< 0,05. Se ha usado el programa Statistical Product and Service Solutions (SPSS 20.1) para todo el análisis de los datos.
ResultadosLos descriptivos analizados y sus medias en función de los grupos estudiados dependiendo del origen de la muestra seminal no mostró diferencias estadísticamente significativas en ninguno de ellos, si comparamos el grupo de normozoospérmicos y de azoospérmicos, con excepción de la edad paterna (p=0,000) y la media de embriones transferidos (p=0,000). El número de ovocitos extraídos, aunque no alcanzó diferencias significativas (p=0,070), fue mayor en el grupo de azoospérmicos que en el control (11,9 vs 8,7, respectivamente). Debido a ello, la edad paterna, la media de embriones transferidos y el número de ovocitos extraídos se tuvieron en cuenta en el análisis multivariante como factores de confusión para el grupo de azoospérmicos.
Por su parte, en la comparación del conjunto de normozoospérmicos con criptozoospérmicos se observó una mayor cantidad de cigotos que se dividieron empleando muestras normozoospérmicas (6,6±2,9) frente a las muestras criptozoospérmicas (6,0±3,4). Así mismo, también se pudieron establecer diferencias estadísticamente significativas entre algunas de las variables, las cuales fueron consideradas como factores de confusión en el análisis multivariante. Dichas variables fueron el origen de los ovocitos (propio y donado), la causa de esterilidad femenina y el porcentaje de fecundación.
Tasa de fecundaciónLa tasa de fecundación fue del 70% al emplear espermatozoides procedentes de muestras normozoospérmicas, frente al 60% en los ciclos con PAAF. Dicha diferencia no fue estadísticamente significativa. La realización de la ICSI con muestras seminales criptozoospérmicas no generó diferencias en la tasa de fecundación frente al grupo control.
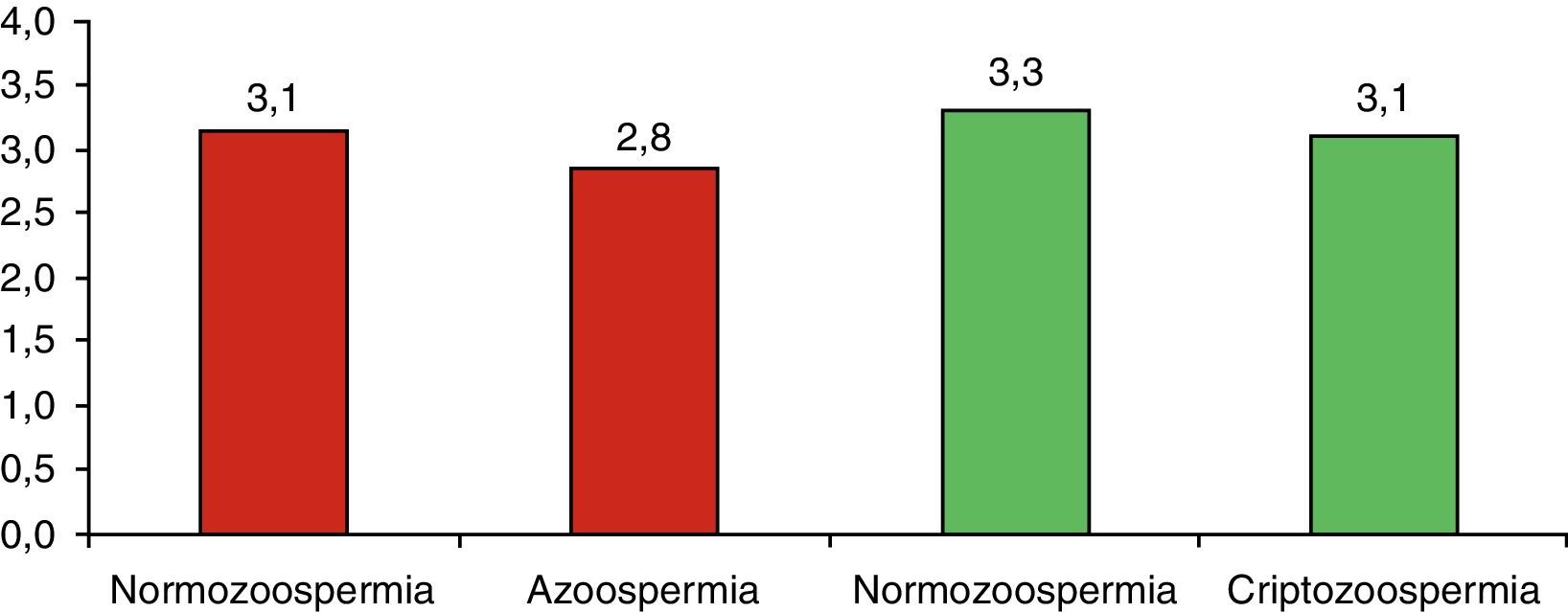
Velocidad de división en el día 2En la figura 1 se observa una mayor velocidad de división (número medio de células en el día 2 de toda la cohorte embrionaria) en los embriones procedentes de ciclos con espermatozoides de varones normozoospérmicos en comparación con los procedentes de muestras azoospérmicas y criptozoospérmicas, aunque para ninguno de los casos alcanzó valores significativos.
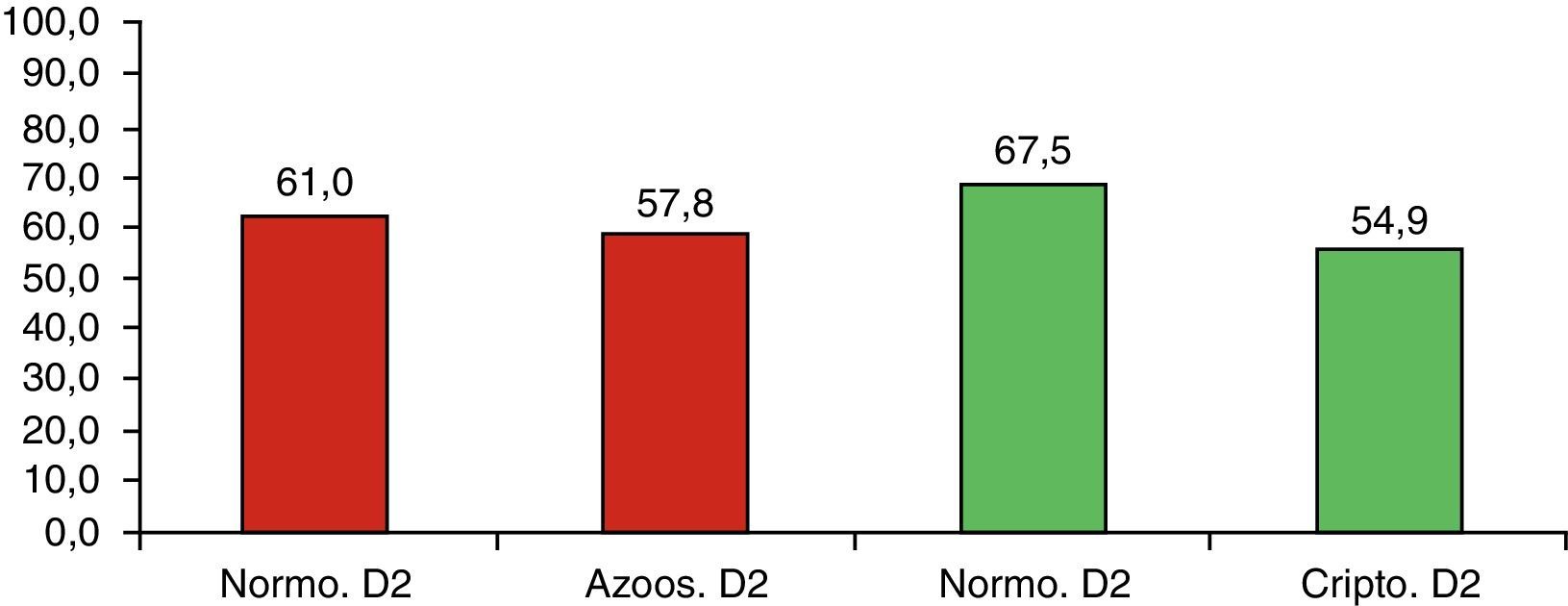
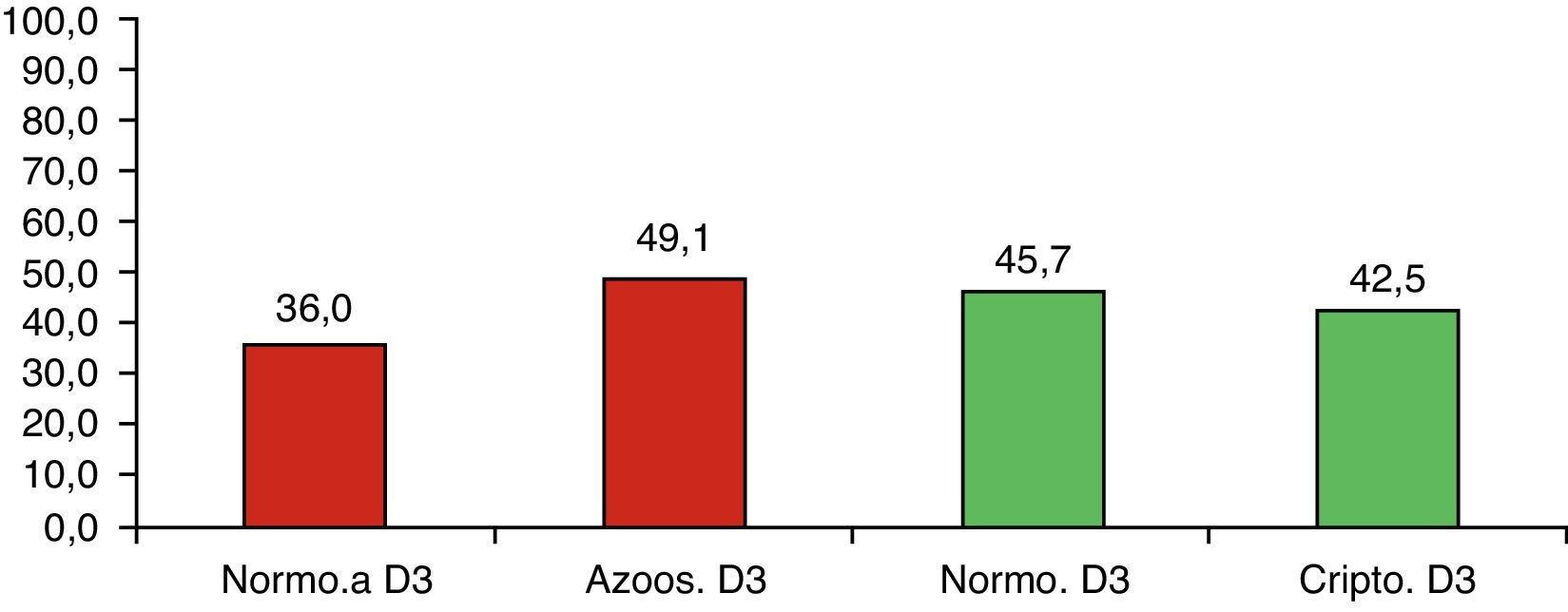
Calidad embrionaria en los días 2 y 3Los embriones de buena calidad fueron considerados la suma de los tipos A y B de la clasificación ASEBIR, tanto para el día 2 como para el día 3 de desarrollo. No se observaron variaciones en los embriones procedentes del grupo de azoospérmicos, donde la calidad embrionaria disminuyó ligeramente durante su desarrollo (57,8% de embriones de buena calidad en el día 2 y 49,1% de embriones de buena calidad en el día 3). Esta disminución de la calidad embrionaria en el transcurso del día 2 al día 3 también se observó en el grupo control, el cual presentó un 61% de embriones de buena calidad en el día 2 y un 36% de embriones con dicha calidad en el día 3 de desarrollo embrionario. Estas diferencias no fueron estadísticamente significativas, siendo el valor de p=0,709 para el día 2 y p=0,207 para el día 3.
En cambio, sí que se observaron diferencias estadísticamente significativas (p=0,015) al comparar los porcentajes de calidad embrionaria en el día 2 entre el grupo de normozoospérmicos (67,5% embriones de buena calidad) y de criptozoospérmicos (54,9% embriones de buena calidad). En el día 3 esta diferencia no fue estadísticamente significativa (p=0,557), aunque se mantuvo la tendencia hacia la obtención de embriones de peor calidad al emplear muestras seminales criptozoospérmicas. Las figuras 2 y 3 muestran las calidades embrionarias en los días 2 y 3 de desarrollo embrionario para todos los grupos de estudio.
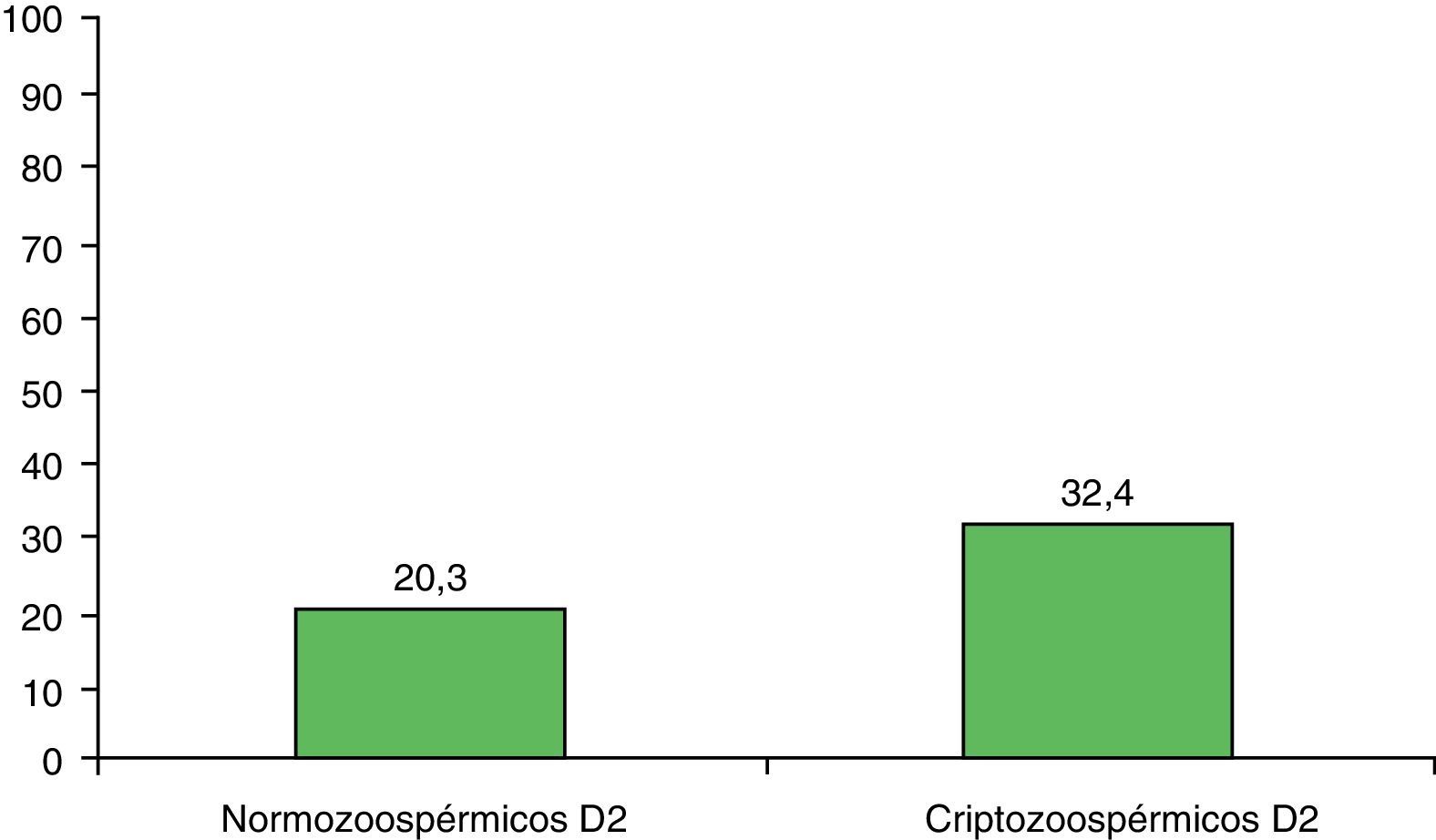
Con respecto a la calidad de los embriones entre los grupos de normozoospérmicos y criptozoospérmicos también se observaron diferencias significativas en el porcentaje de embriones tipo C en el día 2, siendo mayor en el grupo de estudio que en el control (p=0,004) (fig. 4).
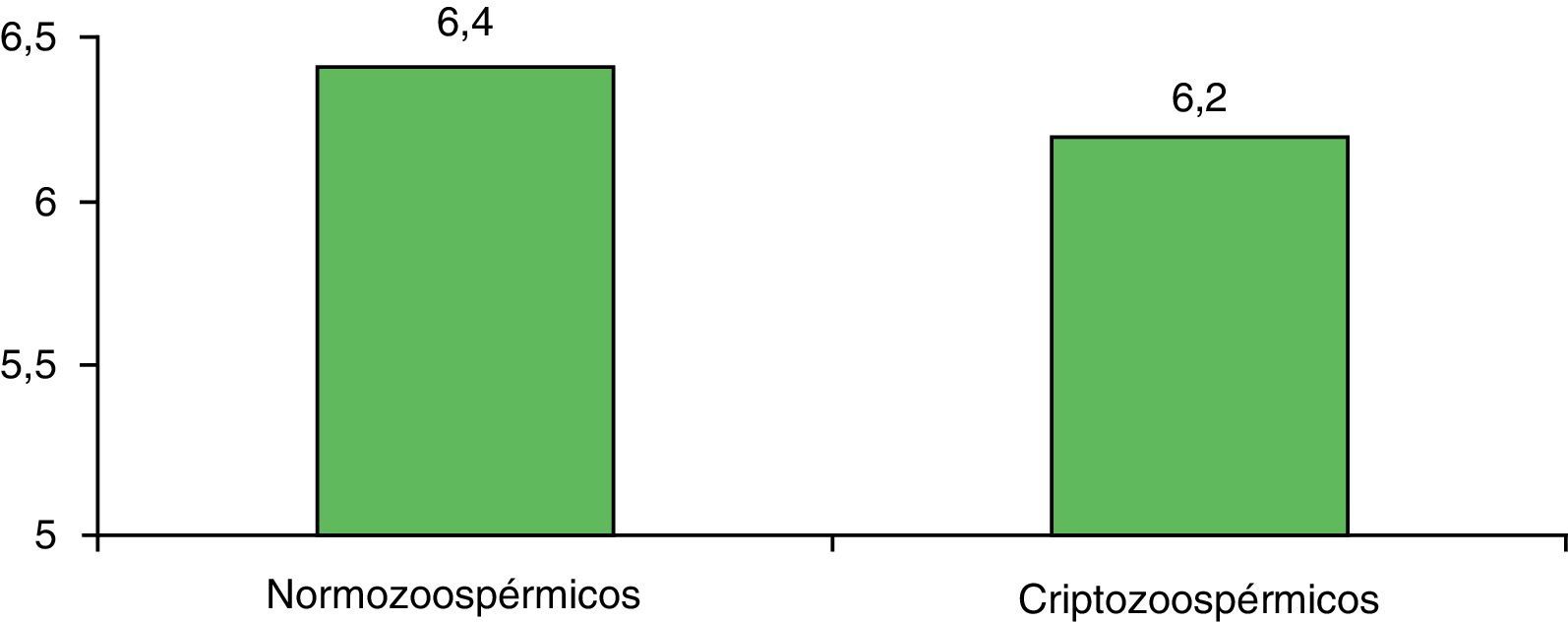
Así mismo, el número de embriones evolutivos hasta el día 3 de desarrollo entre los grupos de normozoospérmicos y criptozoospérmicos muestra ciertas diferencias que no son significativas (p=0,609), tomando un valor de 6,4 en el caso de los controles y de 6,2 en el grupo de estudio (fig. 5), lo que se traduce en una media de 1,7 embriones transferidos en normozoospérmicos frente a una media de 1,8 en el caso de criptozoospérmicos (p=0,068).
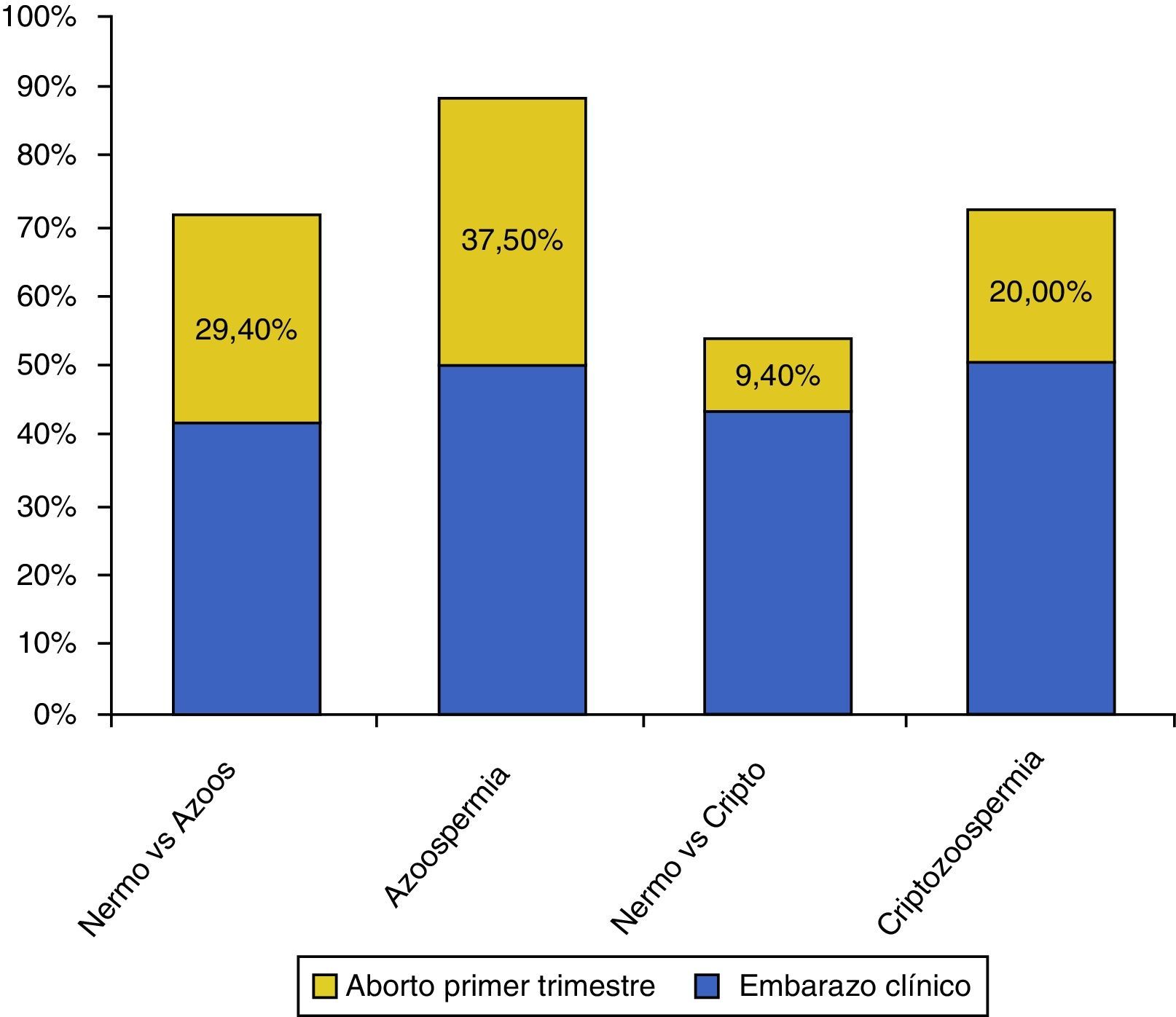
Tasa de embarazo clínico y aborto en el primer trimestreLas tasas de embarazo clínico y de aborto en el primer trimestre tampoco fueron estadísticamente significativas para ninguno de los grupos, aunque se advierte una tendencia a una mayor tasa de embarazo en embriones procedentes de varones azoospérmicos y criptozoospérmicos, que posteriormente se tradujo en una tasa de aborto superior en ambos grupos durante el primer trimestre (fig. 6).
DiscusiónLa ICSI permite la fecundación empleando muestras seminales de calidad reducida según los parámetros espermáticos convencionales, ya que el único prerrequisito absoluto para llevar a cabo una ICSI de forma satisfactoria es la presencia de un espermatozoide para un ovocito (Nagy et al., 1995, Van Steirteghem et al., 1993, Van Wely et al., 2015). La influencia y relevancia que una oligozoospermia severa o una azoospermia pueden tener sobre el éxito de la técnica es un aspecto que ha suscitado opiniones y resultados muy diversos y que, a día de hoy, no se encuentra clarificado. Nagy et al. (1995) y Van Wely et al. (2015) obtienen diferentes rangos de fecundación partiendo de muestras seminales con baja concentración; sin embargo, concluyen que los resultados de la ICSI no se ven influenciados por la concentración espermática. Por su parte, Strassburger et al. (2000) llegan a resultados significativos cuando la oligozoospermia es extrema (concentración espermática<10.000/ml). Cuando se trata de muestras azoospérmicas Verza y Esteves (2008) afirman que las muestras obtenidas directamente del testículo son de peor calidad, pero concretan que son las de azoospermias no obstructivas las que tienen mayores alteraciones en factores espermáticos citosólicos y en el centriolo, lo que produce una mala división en las primeras etapas del desarrollo embrionario. Esto hace que sea más importante el tipo de azoospermia que sufre el paciente que la procedencia de la muestra seminal.
En este estudio se ha analizado el resultado de 57 ciclos ICSI llevados a cabo por 40 parejas con problemas reproductivos asociados a concentración espermática extremadamente reducida y 17 parejas en las cuales la muestra seminal fue obtenida mediante PAAF por azoospermia obstructiva. No hemos encontrado una relación estadísticamente significativa entre la realización de la ICSI con muestras criptozoospérmicas o azoospérmicas y una mala calidad embrionaria. Sin embargo, algunos datos obtenidos muestran alguna tendencia que llevaría a pensar que sí puede haber dicha correlación que no hemos sido capaces de vislumbrar con el método empleado.
En el caso del análisis de las muestras criptozoospérmicas dichas tendencias llevan hacia un número medio de células en el día 2 menor, número de cigotos que se dividen menor, número de embriones evolutivos en el día 3 menor y mayores tasas de aborto. Además, es importante señalar que la calidad de los embriones en el día 2 se vio significativamente reducida en las muestras criptozoospérmicas, y además la cantidad de embriones tipo C en este tipo de muestras fue sensiblemente superior tanto en el día 2 como en el día 3 en comparación con las muestras normozoospérmicas. Esta relación de los embriones tipo C en el día 2, con la pertenencia al grupo de criptozoospermia fue estadísticamente significativa. Estas diferencias pueden tener diversas explicaciones. Primero, en los casos en los que la presencia de espermatozoides es muy esporádica, la evaluación morfológica que se puede realizar del mismo es prácticamente nula. Patologías morfológicas que pueden ser visibles en condiciones normales pueden hacerse irreconocibles en muestras de este tipo. Otra explicación puede ser la incidencia de la fragmentación del ADN en muestras seminales de mala calidad, que se correlacionaría con una disminución de los porcentajes de fecundación y calidad embrionaria. Por otro lado, los espermatozoides de varones con problemas reproductivos poseen alteraciones en la función del centrosoma y en la posterior formación del áster, que es fundamental para la fecundación y las sucesivas divisiones mitóticas.
Por su parte, en el caso del análisis de las muestras azoospérmicas, la tasa de fecundación no mostró diferencias entre los 2 grupos. Estos resultados están en consonancia con los encontrados por Balaban et al. (2001), Esteves et al. (2011), Gil-Sallom et al. (1995) y Hourvitz et al. (1998). No obstante, la disminución de un 10% en la tasa de fecundación encontrada en nuestro estudio empleando espermatozoides testiculares, aunque no significativa, estaría también de acuerdo con los trabajos de Aboulghar et al. (1997), Tavmergen et al. (2002) y Verza y Esteves (2008), donde demuestran la existencia de unas menores tasas de fecundación cuando se emplean muestras de pacientes azoospérmicos no obstructivos debido a una mala calidad espermática.
Respecto a la velocidad de división, establecida como la media de células de toda la cohorte embrionaria en el segundo día de desarrollo, tampoco observamos diferencias significativas. Los embriones se dividieron a igual velocidad independientemente de si procedían de espermatozoides de eyaculado o de PAAF, lo que insinúa que la calidad espermática es similar, aunque no se produzca una selección natural por movilidad, contradiciendo el trabajo clásico de Sathananthan (1998). La calidad embrionaria, tanto en el día 2 como en el día 3, presentó diferencias significativas. Esta afirmación está en consonancia con los resultados obtenidos por Gil-Sallom et al. (1995); en cambio, Aboulghar et al. (1997) y Verza y Esteves (2008) encontraron una disminución de la calidad en aquellos embriones procedentes de muestras de semen alterado, bien fuese de testículo o de eyaculado. Los resultados clínicos, medidos mediante la tasa de embarazo, no mostraron diferencias significativas, acorde con lo publicado por Balaban et al. (2001), Esteves et al. (2011), Gil-Sallom et al. (1995) y Hourvitz et al. (1998). Tampoco fueron significativas las diferencias entre grupos en la tasa de aborto en el primer trimestre, a pesar de lo cual, es algo mayor en el grupo de pacientes azoospérmicos (Balaban et al., 2001). Los datos obtenidos marcan una tendencia de incremento del embarazo en el grupo de estudio (PAAF) pero, posteriormente, ambos conjuntos se igualan y el embarazo clínico evolutivo resulta ser muy similar en ambos.
Teóricamente, los espermatozoides procedentes de testículo deberían presentar una peor calidad, puesto que no se someten a la selección natural ni a las técnicas de capacitación (Sathananthan, 1998, Schatten y Sun, 2009). Además, muchos de estos espermatozoides son inmóviles por ser inmaduros (Van Wely et al., 2015, Verza y Esteves, 2008).
El comportamiento de los espermatozoides testiculares de varones con azoospermia obstructiva sobre la tasa de fecundación y, fundamentalmente, sobre la calidad embrionaria (disminución de embriones de buena calidad) y sobre los resultados clínicos es similar al encontrado empleando espermatozoides de varones normozoospérmicos.
Cabe destacar que este estudio es de tipo retrospectivo, con las limitaciones que ello supone para la obtención de datos fiables, y que el número de casos problema que se ha podido estudiar no es lo suficientemente consistente para obtener una significación en todas las variables estudiadas que apoye nuestra hipótesis por completo. Sin embargo, existen aspectos que sí reflejan de forma significativa la relación entre las muestras seminales de concentración extremadamente reducida y la mala calidad embrionaria, como son el porcentaje de embriones de buena calidad en el día 2 y el porcentaje de embriones tipo C en el día 2. Sería oportuno realizar un estudio prospectivo ampliando el tamaño de la población de estudio con el fin de confirmar que esta significación se mantiene, y observar si estas tendencias obtenidas pueden ser diferencias significativas y, por lo tanto, que arrojen luz en la controversia que existe sobre este tipo de muestras seminales. Por otra parte, no hemos obtenido diferencias significativas entre la realización de la ICSI con muestras azoospérmicas y una mala calidad embrionaria, lo que radicaría en el hecho de haber empleado muestras de varones con azoospermia obstructiva. Esta cuestión sería posible aclararla introduciendo casos de azoospermia secretora, lo que nos permitiría realizar un análisis estadístico preciso y representativo de toda la población.
En conclusión, una azoospermia obstructiva o una criptozoospermia en las muestras seminales a partir de las que se va a realizar la ICSI no presenta una influencia notablemente negativa en el desarrollo posterior de los embriones, aunque parece que existe cierta tendencia hacia la generación de embriones de calidades reducidas a partir de muestras criptozoospérmicas, probablemente debido a algunas alteraciones espermáticas, imperceptibles morfológicamente (como la fragmentación del ADN o la alteración de los centriolos paternos), que serían heredadas por el embrión.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.