Se estima que un 3% del total de parejas en edad reproductiva serán estériles debido a un factor masculino severo. En estos casos, se ha sugerido la existencia de un daño en el ADN espermático debido al efecto deletéreo que ejerce el estrés oxidativo sobre los espermatozoides a su paso por el tracto genital postesticular masculino. Esto ha llevado a proponer el uso generalizado de espermatozoides procedentes de biopsia testicular a pesar del riesgo quirúrgico que ello supone.
ObjetivosAnalizar la influencia de la procedencia de los espermatozoides en parejas estériles por factor masculino severo en los resultados de los ciclos de microinyección intracitoplasmática (ICSI), cuando no se analiza previamente el nivel de fragmentación del ADN espermático en el eyaculado.
Material y métodosSe realizó un estudio retrospectivo a partir de ciclos de ICSI de parejas estériles por factor masculino severo (oligozoospérmicos severos, criptozoospérmicos y azoospérmicos no obstructivos), divididas según la procedencia de los espermatozoides (testículo o eyaculado).
ResultadosEn total se analizaron 152 ciclos de ICSI, 107 realizados con espermatozoides en fresco procedentes de eyaculado y 45 con espermatozoides crioconservados de biopsia testicular. No se observaron diferencias significativas en las variables socio-demográficas ni en las variables de estimulación ovárica. Tampoco los resultados de la ICSI presentaron diferencias, siendo los porcentajes de fecundación (54,3 vs. 48,6%), implantación (23,1 vs. 22,8%) y de gestación por transferencia (35,5 vs. 37,1%) similares. Se observó un mayor porcentaje de abortos (18,5 vs. 46,1%), así como un menor porcentaje de nacidos vivos (28,9 vs. 20,0%) en el grupo de biopsia, aunque no resultaron diferencias estadísticamente significativas.
ConclusiónEn parejas estériles por factor masculino severo, no se encontraron evidencias a favor del uso generalizado de espermatozoides de testículo frente a eyaculado, cuando el nivel de fragmentación del ADN espermático en el eyaculado no se analiza previamente.
It is estimated that around a 3% of the couples are affected by severe male factor infertility -oligozoospermia, cryptozoospermia and non-obstructive azoospermia-. It is suggested the existence of postesticular sperm damage due to the oxidative stress that sperm suffers through the male genital tract. Base on this, different authors have propose the generalised use of testicular sperm, surgically retrieved (TESE), instead of ejaculated sperm.
ObjectivesAnalysing the influence of the sperm source in couples affected by severe male factor infertility in the ICSI results, when DNA ejaculated sperm fragmentation has not been tested before.
Material and methodsA retrospective study was conducted based on a specific severe male factor ICSI cycle database, according to the selected sperm source -testicle or ejaculate-.
ResultsWe analysed a total amount of 152 ICSI cycles which were divided into two groups, 107 cycles conducted with fresh ejaculated spermatozoa and 45 cycles conducted with criopreserved testicular biopsy spermatozoa. The results showed no significant differences in social-demographical or ovarian stimulation variables. ICSI cycles results were not different either; we obtained similar fertilization rates (54.3% vs. 48.6%), implantation rates (23.1% vs. 22.8%) and pregnancy per embryo transfer rates (35.5% vs. 37.1%). We observed a trend towards greater miscarriage rate between the testicular sperm cycles (18.5% vs. 46.1%), as well as a reduced live birth rate (28.9% vs. 20.0%) in this group. However, no significance differences were found after the analyses.
ConclusionNo evidences were found in favour of mass testicular spermatozoa vs. ejaculated spermatozoa use in ICSI cycles, when DNA ejaculated sperm fragmentation has not been tested before.
Un 3% del total de parejas en edad reproductiva son estériles debido a un factor masculino severo (Vander-Borght y Wyns, 2018; Aragón et al., 2016). En estos pacientes, se ha sugerido la existencia de un daño en la integridad del ADN espermático debido al efecto deletéreo que ejerce el estrés oxidativo sobre los espermatozoides en su trayecto a través del tracto genital postesticular masculino (Sakkas et al., 2010; Suganuma et al., 2005; Aitken, 1999). Esto podría ser debido al aumento del estrés oxidativo existente en el tracto genital de estos pacientes o a la alteración de los mecanismos protectores frente a las especies reactivas del oxígeno que poseen de manera fisiológica los espermatozoides. El estrés oxidativo se ha visto repetidamente asociado en diferentes estudios a un aumento en la fragmentación del ADN espermático (Greco et al., 2005; Aitken y Krausz, 2001). Además, se ha observado en algunos trabajos, como la fragmentación del ADN de los espermatozoides tendría un efecto negativo sobre la calidad seminal (Moskovtsev et al., 2009). En el caso de los factores masculinos severos, esto se vería agravado por la mayor exposición a especies reactivas del oxígeno que se produce durante la preparación y, especialmente, el centrifugado de estas muestras (Matás et al., 2011).
Estos motivos han llevado a diferentes autores a proponer el uso generalizado de espermatozoides procedentes de testículo, en lugar de eyaculado, en las parejas estériles por factor masculino severo (Arafa et al., 2017; Cui et al., 2017). Sin embargo, el uso de espermatozoides de origen testicular también tiene sus desventajas, ya que debido a la ausencia de recorrido del semen a través del epidídimo en estos pacientes, este adquiriría una menor maduración (Gervasi y Visconti, 2017; Dacheux J. y Dacheux F., 2014; Ariel et al., 1994) relacionada específicamente con la capacidad de los espermatozoides para penetrar en el ovocito y la adquisición de movilidad, así como la producción de cambios epigenéticos en el espermatozoide, que también han sido asociados con esta estructura. La movilidad espermática es utilizada como criterio de vitalidad y calidad seminal durante el estudio previo a la realización de la microinyección intracitoplasmática ICSI. Por ello, cuando se utilizan espermatozoides testiculares para la ICSI, los cuales son habitualmente inmóviles, se añade pentoxifilina al medio que los contiene, a fin de aumentar su movilidad. Recientemente, nuestro grupo ha demostrado la seguridad del uso de pentoxifilina en estos pacientes (Navas et al., 2017). Por otra parte, la gran problemática de la obtención de espermatozoides de testículo en reproducción asistida, radica en el riesgo quirúrgico asumido en el procedimiento (Esteves et al., 2013; Schlegel y Su, 1997), así como la aparición de posibles efectos a largo plazo en el perfil androgénico del paciente (Everaert et al., 2006).
Existen resultados contradictorios en los diferentes estudios realizados sobre el tema (Herrero et al., 2019; Miller et al., 2017; Mehta et al., 2015; Hameed y Ozturk, 2010; Aboulghar et al., 1997; Mansour et al., 1997), y aunque en ciertos supuestos se están observando mejores resultados reproductivos con la utilización de espermatozoides testiculares, aún los grandes metaanálisis y revisiones sistemáticas, llevados a cabo en los últimos años, son muy limitados al respecto (Kang et al., 2018; Ku et al., 2018; Awaga et al., 2018; Esteves et al., 2017; Abhyankar et al., 2016). De aquí parte este estudio, con el objetivo principal de analizar la influencia de la procedencia de los espermatozoides en los ciclos de ICSI de parejas estériles por factor masculino severo, en las que se desconoce la integridad de su ADN espermático previamente.
Material y métodosSe realizó un estudio retrospectivo a partir de los ciclos de ICSI de parejas estériles por factor masculino severo, que fueron atendidas en la Unidad de Reproducción Asistida del Hospital Universitario Virgen de las Nieves (HUVN), entre enero de 2014 y diciembre de 2017.
Se incluyeron para su comparación en este estudio, los ciclos realizados con espermatozoides procedentes del eyaculado de pacientes oligozoospérmicos severos (<1 millón de espermatozoides/ mL), frente a los ciclos realizados con espermatozoides procedentes de biopsia testicular de pacientes criptozoospérmicos (no se observan espermatozoides en la muestra en fresco pero sí tras el centrifugado) o azoospérmicos no obstructivos (no se observan espermatozoides ni en el examen en fresco ni tras el centrifugado de la muestra). El diagnóstico de azoospermia no obstructiva se basó en la anamnesis y exploración física complementada por estudios andrológicos, hormonales y anatomopatológicos de la muestra de tejido testicular tomada el día de la biopsia para crioconservación de espermatozoides testiculares. En ninguno de los grupos anteriores, se realizaron estudios previos para determinar la integridad del ADN espermático.
Este estudio fue aprobado por el Comité de Ética e Investigación (CEI/ CEIM) provincial de Granada, el 27 de marzo de 2019.
Recogida y preparación de espermatozoidesLa recogida y preparación de los espermatozoides siguió un proceso diferente según su distinta procedencia, eyaculado o biopsia testicular.
En el grupo de eyaculado, la selección de espermatozoides se llevó a cabo mediante la técnica Swim-up. En el caso de la obtención de espermatozoides testiculares, la biopsia se realizó entre dos y seis meses antes de la fecha de inicio del ciclo de estimulación ovárica, por ello, los espermatozoides obtenidos de este modo fueron crioconservados. Para la criopreservación se emplearon pajuelas de alta seguridad de 0,5 mL en las que se conservó el material diluido en medio crioprotector utilizando el congelador semiautomático LM10. Llegado el día de la ICSI se procedió a su descongelación, sometiendo el preparado a un ambiente a 37°C durante cinco minutos. Tras ello, se transfirió la muestra contenida en la pajuela a un medio de cultivo de fertilización in vitro (IVF), procediendo posteriormente al centrifugado, decantación del sobrenadante y resuspensión del pellet celular en medio IVF. Dado el caso de no encontrarse un número suficiente de espermatozoides móviles, se añadieron 5 nM de pentoxifilina a la microgota de espermatozoides en la placa de ICSI.
Estimulación y punción ováricaEl protocolo de estimulación empleado fue, indistintamente en ambos grupos, antagonista o agonista largo de la GnRH; descrito previamente (Rodríguez et al., 2019). La dosis de FSHr utilizada fue de 300 UI los días 1 y 2, reduciéndose posteriormente a 150 UI del día tres al siete. Se procedió a desencadenar la ovulación, una vez se comprobó el desarrollo de al menos tres folículos ováricos mayores de 18 mm de diámetro, mediante la administración de un bolo único de 6.500 UI de hCG. Pasadas 36 horas, se realizó la punción folicular.
Laboratorio de ICSIEn el laboratorio se examinaron los líquidos foliculares, se recuperaron los complejos cúmulo-corona-ovocito y se depositaron en medio de cultivo hasta la realización de la ICSI. Una vez realizada esta, se seleccionaron los embriones obtenidos siguiendo los criterios de la Asociación Española para el Estudio de la Biología de la Reproducción (ASEBIR) en su revisión de 2016 (Castilla et al., 2016), clasificándose así los embriones en cuatro categorías: A, B, C y D. Los embriones de mayor calidad (A y B) fueron, en ambos grupos, bien transferidos en fresco el segundo o tercer día tras la punción folicular, o bien vitrificados.
En el caso de aquellos ciclos realizados con espermatozoides de eyaculado que sufrieron cancelación de la transferencia por fracaso en la fecundación en el primer ciclo de estimulación realizado (13 pacientes), se repitió ciclo en todos los pacientes a excepción de tres, que optaron por semen de donante. En tres de los 10 pacientes restantes se repitió el fracaso en la fecundación en algún otro ciclo posterior. En el caso de espermatozoides de testículo y fracaso de fecundación en el primer ciclo (cinco pacientes), cuatro repitieron ciclo con espermatozoides procedentes de biopsia, volviendo a obtener un fracaso de fecundación en uno de estos pacientes.
Análisis estadístico de los datosEn la comparación de variables cualitativas se aplicó el estadístico χ2; de no cumplirse las condiciones de validez, se recurrió al Test exacto de Fisher. En el caso de las variables cuantitativas se empleó el estadístico t de Student, bajo la condición previa de homogeneidad de varianzas determinada mediante el Test de Levenne; de no cumplirse, se recurrió al Test de Welch. Debido al alto número de variables contempladas en el estudio, se decidió aplicar el Método Bonferroni como corrección del error tipo I o alfa (asumido al 0,05) en la valoración de la homogeneidad entre ambos grupos.
El programa informático con el que se llevó a cabo el análisis estadístico de los datos fue IBM® SPSS Statistics versión 24.
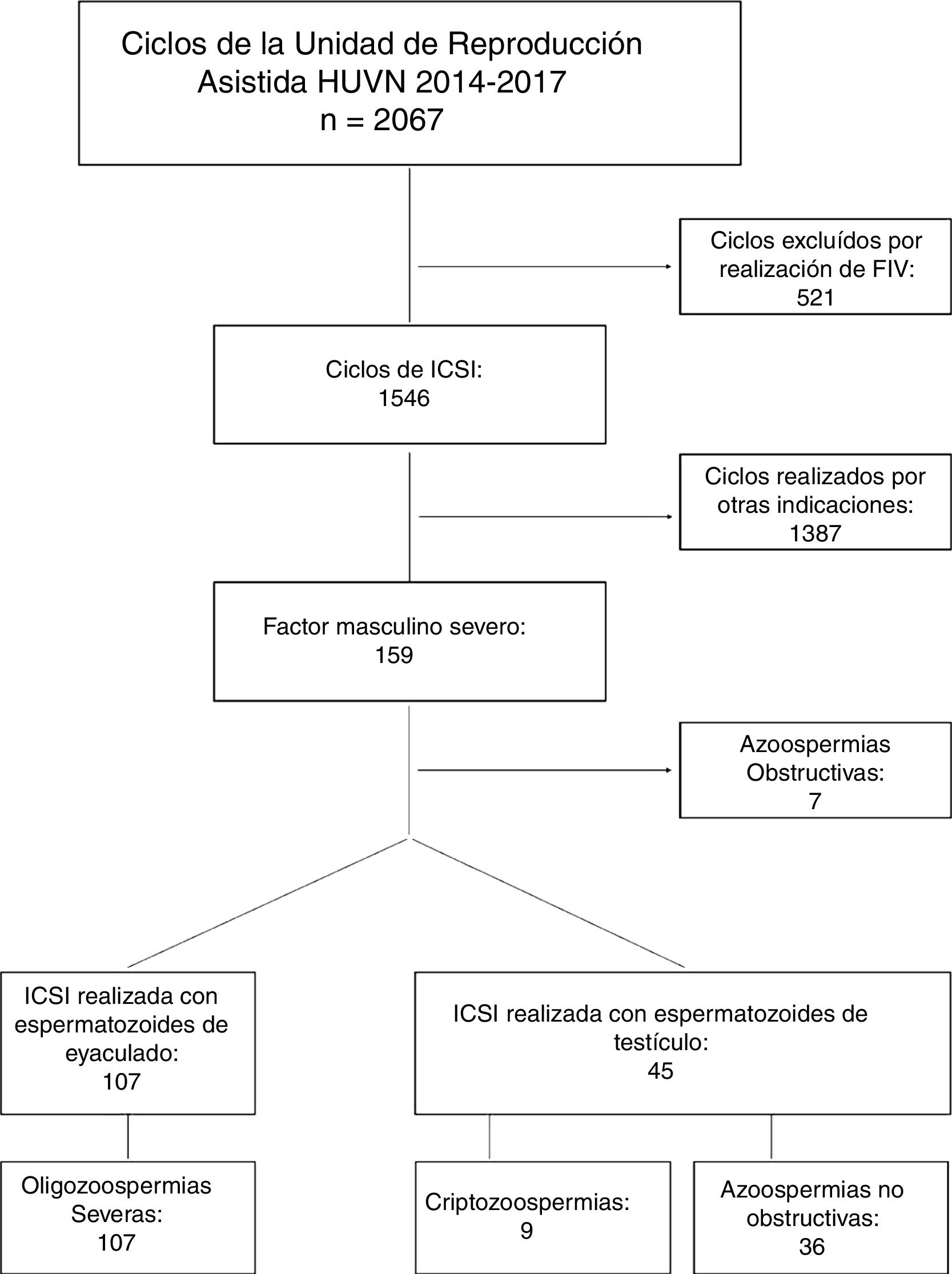
ResultadosSe analizaron un total de 152 ciclos de ICSI que posteriormente se dividieron en dos grupos según la procedencia de los espermatozoides. De ello se obtuvieron 107 ciclos realizados con espermatozoides procedentes de eyaculado y 45 con espermatozoides procedentes de biopsia testicular (fig. 1).
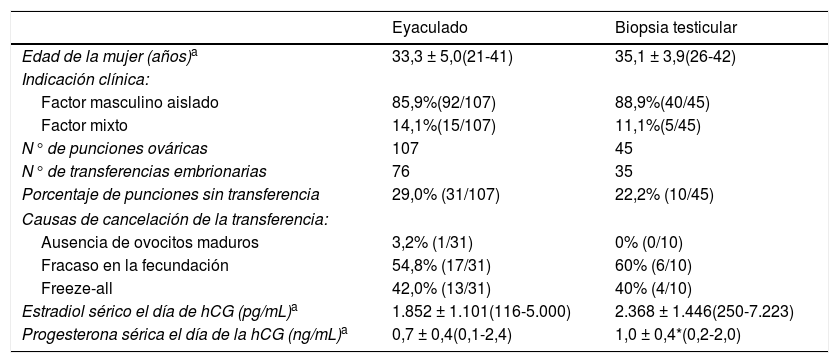
Al analizar dichas variables no se observaron diferencias estadísticamente significativas entre los grupos de estudio, siendo la edad media de la mujer de 33,3 ± 5,0 años en el grupo de eyaculado y 35,1 ± 3,9 en el de biopsia testicular. Tampoco obtuvimos resultados significativos respecto a la indicación clínica de los ciclos de ICSI, siendo mayoritario en ambos grupos el factor masculino aislado.
El protocolo de estimulación empleado fue mayoritariamente antagonista (60,7%, [65/107]) en el grupo de eyaculado, y agonista en protocolo largo (51,1%, [23/45]) en el grupo de biopsia testicular, sin observarse diferencias estadísticamente significativas. Así mismo, las unidades de FSH (UI) administradas en cada grupo de pacientes fueron similares, 2.333 ± 784 en el grupo de eyaculado y 2.339 ± 694 en el de biopsia testicular. Tampoco se observaron diferencias en la variable «días de estimulación» (11,4 ± 2,0 vs. 11,8 ± 1,4). Atendiendo a las variables hormonales séricas, sí que se obtuvieron diferencias estadísticamente significativas en los valores de progesterona en el día de la hCG, con una concentración de 0,7 ± 0,4 ng/mL en el grupo de ciclos realizados con espermatozoides procedentes de eyaculado y 1,0 ± 0,4 ng/mL en el de biopsia testicular. Sin embargo, no se observaron diferencias significativas en la concentración sérica de estradiol en el día de la hCG.
Todos los ciclos incluidos en nuestro estudio llegaron a punción ovárica, quedando posteriormente sin transferencia un 29,0% de los ciclos en el grupo de eyaculado y un 22,2% en el de biopsia testicular. Las causas de cancelación de la transferencia fueron mayoritariamente el fracaso en la fecundación, seguido de la ausencia de ovocitos maduros y el llamado Freeze-all, la vitrificación de todos los embriones obtenidos (tabla 1).
Edad de la mujer, indicación clínica y variables relativas a estimulación ovárica en ciclos de ICSI de parejas estériles por factor masculino severo según la procedencia de los espermatozoides
| Eyaculado | Biopsia testicular | |
|---|---|---|
| Edad de la mujer (años)a | 33,3 ± 5,0(21-41) | 35,1 ± 3,9(26-42) |
| Indicación clínica: | ||
| Factor masculino aislado | 85,9%(92/107) | 88,9%(40/45) |
| Factor mixto | 14,1%(15/107) | 11,1%(5/45) |
| N° de punciones ováricas | 107 | 45 |
| N° de transferencias embrionarias | 76 | 35 |
| Porcentaje de punciones sin transferencia | 29,0% (31/107) | 22,2% (10/45) |
| Causas de cancelación de la transferencia: | ||
| Ausencia de ovocitos maduros | 3,2% (1/31) | 0% (0/10) |
| Fracaso en la fecundación | 54,8% (17/31) | 60% (6/10) |
| Freeze-all | 42,0% (13/31) | 40% (4/10) |
| Estradiol sérico el día de hCG (pg/mL)a | 1.852 ± 1.101(116-5.000) | 2.368 ± 1.446(250-7.223) |
| Progesterona sérica el día de la hCG (ng/mL)a | 0,7 ± 0,4(0,1-2,4) | 1,0 ± 0,4*(0,2-2,0) |
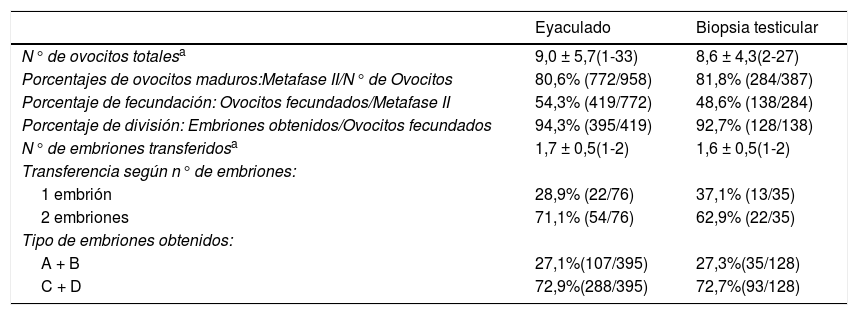
Se observó un mayor porcentaje de fecundación en el grupo de ciclos realizados con espermatozoides procedentes de eyaculado, resultando fecundados el 54,3% de los ovocitos en el grupo de eyaculado y el 48,6% en el grupo de biopsia testicular. Los embriones obtenidos fueron mayoritariamente clasificados de categoría C-D (72,9% en el grupo de eyaculado vs. 72,7% en el grupo de biopsia testicular). Complementariamente a estos datos, el 27,1% de los embriones en el grupo de eyaculado y el 27,3% en el de biopsia testicular, fueron determinados de categoría A-B. En ninguna de las variables relativas a este apartado se observaron diferencias estadísticamente significativas entre ambos grupos (tabla 2).
Resultados de la punción ovárica, fecundación y calidad de los embriones obtenidos en ciclos de ICSI de parejas estériles por factor masculino severo según la procedencia de los espermatozoides
| Eyaculado | Biopsia testicular | |
|---|---|---|
| N° de ovocitos totalesa | 9,0 ± 5,7(1-33) | 8,6 ± 4,3(2-27) |
| Porcentajes de ovocitos maduros:Metafase II/N° de Ovocitos | 80,6% (772/958) | 81,8% (284/387) |
| Porcentaje de fecundación: Ovocitos fecundados/Metafase II | 54,3% (419/772) | 48,6% (138/284) |
| Porcentaje de división: Embriones obtenidos/Ovocitos fecundados | 94,3% (395/419) | 92,7% (128/138) |
| N° de embriones transferidosa | 1,7 ± 0,5(1-2) | 1,6 ± 0,5(1-2) |
| Transferencia según n° de embriones: | ||
| 1 embrión | 28,9% (22/76) | 37,1% (13/35) |
| 2 embriones | 71,1% (54/76) | 62,9% (22/35) |
| Tipo de embriones obtenidos: | ||
| A + B | 27,1%(107/395) | 27,3%(35/128) |
| C + D | 72,9%(288/395) | 72,7%(93/128) |
N.S.
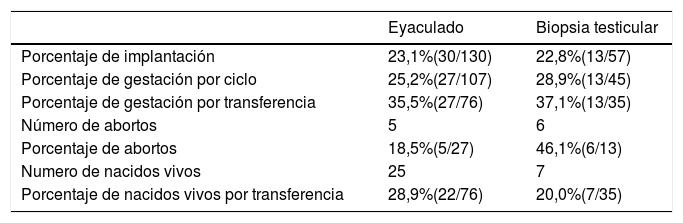
En primer lugar, el porcentaje de implantación embrionaria fue similar en ambos grupos, el 23,1% en el grupo de eyaculado y el 22,8% en el de biopsia testicular. Al analizar los porcentajes de gestación por ciclo y por transferencia, se obtuvieron como resultado el 25,2% y 35,5% respectivamente en el grupo de eyaculado y el 28,9% y 37,1% en el grupo de biopsia testicular. El porcentaje de gestación única fue el 88,9% para los ciclos de eyaculado y el total (100%) de los ciclos de biopsia. Se observaron un total de cinco abortos en el grupo de eyaculado y seis en el grupo de biopsia testicular, siendo el porcentaje de abortos el 18,5% y el 46,1% respectivamente. Por último, se registró el nacimiento de un total de 25 neonatos entre los 107 ciclos de ICSI realizados con espermatozoides procedentes de eyaculado, y siete en los 45 ciclos realizados con espermatozoides procedentes de biopsia testicular. Esto supone un porcentaje de nacidos vivos por transferencia del 28,9% y el 20,0% en los grupos de eyaculado y biopsia testicular, respectivamente.
No se observaron diferencias estadísticamente significativas en ninguna de las variables analizadas en este apartado (tabla 3).
Resultados obstétricos y neonatales en ciclos de ICSI de parejas estériles por factor masculino severo según la procedencia de los espermatozoides
| Eyaculado | Biopsia testicular | |
|---|---|---|
| Porcentaje de implantación | 23,1%(30/130) | 22,8%(13/57) |
| Porcentaje de gestación por ciclo | 25,2%(27/107) | 28,9%(13/45) |
| Porcentaje de gestación por transferencia | 35,5%(27/76) | 37,1%(13/35) |
| Número de abortos | 5 | 6 |
| Porcentaje de abortos | 18,5%(5/27) | 46,1%(6/13) |
| Numero de nacidos vivos | 25 | 7 |
| Porcentaje de nacidos vivos por transferencia | 28,9%(22/76) | 20,0%(7/35) |
N.S.
Tras el análisis de los datos, no hemos observado diferencias que indiquen el uso generalizado de espermatozoides obtenidos por biopsia testicular, en las parejas estériles por factor masculino severo.
En primer lugar, pensamos que la validez interna de nuestro estudio es adecuada, por resultar ambos grupos comparables. Las variables sociodemográficas y de estimulación ovárica, ambas independientes del factor masculino severo analizado en el estudio, mostraron valores homogéneos en ambos grupos, encontrándose únicamente diferencias estadísticamente significativas en los niveles de progesterona sérica el día de la hCG, siendo estos superiores en el grupo de biopsia testicular. Pensamos que esta observación carece de repercusión clínica, ya que la diferencia absoluta entre ambas medias (0,3 ng/mL) es irrelevante. Además, en ambos grupos el valor medio de progesterona sérica es inferior al considerado deletéreo (≥ 1,5 ng/mL) (Bosch et al., 2010). En cualquier caso, los resultados obtenidos concordarían con lo observado por Bosch et al., que asocia niveles más elevados de progesterona sérica al uso de agonistas de la GnRH para la frenación hipofisaria frente al uso de antagonistas. En nuestro estudio el uso de protocolo agonista fue superior en el grupo de biopsia testicular (51,1 vs. 39,3%), tendencia que podría justificar las diferencias observadas en los valores de progesterona sérica, y concordaría con lo observado previamente por este autor.
Al analizar las variables sociodemográficas y, de manera particular, la edad de la mujer, vemos que en ningún caso fue superior a 42 años, dado que esta es la edad máxima aceptada para la participación en el programa de reproducción asistida en nuestro centro (Aragón et al., 2016). Debemos comentar, además, la tendencia observada a una mayor edad de la mujer en los ciclos realizados con espermatozoides de testículo (33,3 ± 5,0 vs. 35,1 ± 3,9), observación también realizada por Kang et al. en su metaanálisis (Kang et al., 2018). Lo cual, pensamos, podría estar en relación con una acumulación de ciclos fallidos de FIV/ICSI en estas mujeres, hasta recurrir finalmente a la obtención de espermatozoides a través de biopsia testicular, siendo dicha repetición de ciclos de reproducción asistida el factor causante de la realización de esta técnica a una mayor edad. También podría parecer llamativo el elevado porcentaje de indicación clínica de ICSI por factor masculino aislado, pero resulta lógico, dados los criterios de inclusión de nuestro estudio. Ello influyó en el buen desarrollo de la estimulación ovárica, la cual se produjo sin incidencias reseñables, dado que en la mayoría de los casos se trató de mujeres con un estudio básico de esterilidad normal y sin trastornos reproductivos diagnosticados.
A la hora de evaluar los resultados de la ICSI, debemos tener en cuenta que debido a la imposibilidad de poder realizar biopsias testiculares no programadas en nuestro centro (Aragón et al., 2016), a los pacientes criptozoospérmicos y azoospérmicos -no obstructivos- se les realizó la biopsia testicular entre dos y seis meses antes del ciclo de ICSI, y por ello se procedió a la estimulación ovárica sólo en aquellas parejas en las que la biopsia resultó satisfactoria. Por esta causa, el grupo de ciclos realizados con espermatozoides testiculares, fue conformado íntegramente por espermatozoides crioconservados, mientras que el grupo de eyaculado se compuso de muestras en fresco. La relación entre crioconservación y pérdida de calidad espermática ya ha sido tratada anteriormente por diferentes autores, arrojando resultados no significativos en el caso del semen testicular. Es decir, no ha sido demostrada la peor condición de los espermatozoides testiculares crioconservados, frente a los espermatozoides testiculares en fresco, en los resultados de la ICSI (Schachter-Safrai et al., 2017; Karacan et al., 2013).
La capacidad fecundante in vitro de los espermatozoides afectados por un factor masculino severo es baja, y así lo demuestra el hecho de que el porcentaje de fecundación encontrado en ambos grupos, aunque sin diferencias significativas, sea inferior a la especificación deseable por el indicador de calidad establecido por ASEBIR (63,2%; IC 95%: 62,3-65,2) (Castilla et al., 2016). Estos resultados son similares a los obtenidos en el metaanálisis de Kang et al. (2018), quienes encontraron un porcentaje de fecundación media global de aproximadamente el 55%, en los ciclos realizados con espermatozoides afectos por un factor masculino severo. Además, observamos una tendencia a menor capacidad fecundante en los espermatozoides de testículo frente a eyaculado (48,6 vs. 54,3%), coincidiendo con lo observado en el metaanálisis de Esteves et al. (2017) en pacientes oligozoospérmicos. El hecho de que estos autores no observen diferencias entre la capacidad fecundante de los espermatozoides de eyaculado y de testículo, cuando analizan los resultados en pacientes normozoospérmicos con fallos recurrentes en ICSI, sugiere una asociación entre el mayor grado de alteraciones en la espermatogénesis y la menor capacidad fecundante de los espermatozoides testiculares.
En lo referente a la calidad embrionaria, el porcentaje de embriones de buena calidad (A y B) en ambos grupos (27,1 vs. 27,3%) se encuentra alejado del obtenido por otros autores en ciclos realizados en varones sin factor masculino; el 52% aproximadamente (Meseguer et al., 2011). Hecho que estaría en consonancia con lo anteriormente comentado acerca de la asociación entre la alteración de la espermatogénesis en varones afectos por factor masculino severo y una menor capacidad fecundante, pues la calidad espermática juega un papel clave en las primeras divisiones embrionarias (Colaco y Sakkas, 2018), y por tanto, en la calidad de los embriones obtenidos.
Aunque no significativo, hemos observado un considerable aumento en el porcentaje de abortos en los ciclos realizados con espermatozoides testiculares (18,5 vs. 46,1%). La principal causa de aborto son las alteraciones cromosómicas, y más concretamente las aneuploidías embrionarias. Esta mayor tasa de aborto observada en los ciclos realizados con espermatozoides testiculares podría ir en relación al mayor número de aneuploidías observado en los espermatozoides testiculares respecto a los de eyaculado (Moskovtsev et al., 2009), dado que una de las funciones principales de los radicales libres contenidos en el tracto genital postesticular es la eliminación de aquellos espermatozoides afectados por alteraciones en su material genético.
Puesto que no se determinó previamente la integridad del ADN espermático en el eyaculado de ninguno de los pacientes incluidos en el estudio, nuestros resultados sugieren que, de no analizar el grado de fragmentación del ADN espermático, no se obtendrían beneficios de la realización de biopsia testicular de manera generalizada para la obtención de espermatozoides, frente a su obtención directa del eyaculado, en los varones afectos por un factor masculino severo. Esto podría deberse a que el porcentaje de estos varones que asocia daños en la integridad de su ADN espermático es relativamente bajo, como ya se ha visto en diferentes trabajos publicados (Esteves et al., 2017; Feijó y Esteves, 2014), los cuales, encontraron una alta fragmentación del ADN espermático en torno al 30% de los pacientes candidatos a ICSI. Esta conclusión se complementa con la ya formulada por Esteves et al. (2017) o Arafa et al. (2017), quienes observaron que, cuando en pacientes con espermatozoides de eyaculado con una alta fragmentación del ADN, se utilizan espermatozoides obtenidos directamente de testículo, se observan mejores resultados en los porcentajes de gestación y nacidos vivos, así como un menor porcentaje de abortos.
ConclusionesNo hemos encontrado evidencias a favor del uso generalizado de espermatozoides de testículo frente a eyaculado, en los ciclos de ICSI de parejas estériles por factor masculino severo, cuando no se analiza previamente el nivel de fragmentación del ADN de los espermatozoides en el eyaculado.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al informático de la Unidad de Reproducción del Hospital Universitario Virgen de las Nieves, Matías Quero, el esfuerzo realizado para recoger todos los datos utilizados en este estudio, así como al resto del personal técnico y sanitario las facilidades prestadas.